Эпигенетика [Чарльз Дэвид Эллис] (fb2) читать онлайн
[Настройки текста] [Cбросить фильтры]
[Оглавление]
ЭПИГЕНЕТИКА под редакцией С. Д. Эллиса, Т. Дженювейна, Д. Рейнберга
Предисловие к русскому изданию
Глубокоуважаемый читатель! Перед Вами русскоязычное издание первой в мире обстоятельной научной книги об эпигенетике. Под эпигенетикой обычно понимают область знаний о совокупности свойств организма, которые не прямо, а опосредованно закодированы в геноме и, по определению, должны передаваться по наследству. По сути дела в первую очередь эта наука имеет дело с механизмами, контролирующими экспрессию генов и клеточную дифференцировку. У организмов существуют мощные регуляторные элементы (в самом геноме и даже целые системы в клетках), которые контролируют работу генов, в том числе и в зависимости от разных внутренних и внешних сигналов биологической и абиотической природы. Эти сигналы накладываются на генетику и часто по-своему решают коренной вопрос — быть или не быть? Действительно, даже самая отличная генетика может вовсе и не реализоваться, если эпигенетика неблагополучна. По образному выражению Нобелевского лауреата П. Медавара «генетика полагает, а эпигенетика располагает». Долгое время эпигенетику многие не признавали совсем, а часто стыдливо или даже намеренно умалчивали о ней. В основном, это происходило потому, что знания о природе эпигенетических сигналов и путях их реализации в организме были очень расплывчатыми. Сегодня стало ясно, что одним из таких эпигенетических сигналов в клетке является энзиматическая модификация (метилирование) самой генетической матрицы, то есть метилирование ДНК. С раскрытием и описанием исключительной роли метилирования ДНК в жизни организмов, по сути дела, впервые по-настоящему произошли становление и материализация эпигенетики как науки. Именно в России были открыты тканевая и возрастная специфичность метилирования ДНК у эукариотических организмов, в том числе у животных и высших растений, и было впервые обоснованно заявлено, что эта энзиматическая модификация генома может быть одним из механизмов регуляции экспрессии генов и клеточной дифференцировки. Здесь же были получены первые данные о том, что метилирование ДНК контролируется гормонально, а искажение метилирования ДНК — путь к раку. Набор и природа эпигенетических сигналов в клетке весьма разнообразны, таких сигналов много и сегодня они разделяются, по крайней мере, на несколько групп — метилирование и деметилирование ДНК, «гистоновый код» (энзиматическая модификация гистонов — ацетилирование, метилирование, убиквитинирование, фосфорилирование и другие), транскрипционное и трансляционное замалчивание генов малыми РНК, позиционирование элементов хроматина. Любопытно, что многие из этих процессов переплетены между собой и взаимозависимы. Это во многом обеспечивает и гарантирует надежность эпигенетического контроля за избирательным функционированием генов. Детальное описание разных эпигенетических сигналов и механизмов их реализации можно найти в соответствующих главах этой любопытной книги. В ней детально описаны собственно феномен, история и концепции эпигенетики, ее отдельные механизмы и пути реализации эпигенетических сигналов в клетке Особое место занимают главы, описывающие роль малых РНК в замалчивании генов, ремоделирование хроматина, его разные энзиматические модификации, транскрипционное замалчивание генов белками групп поликомб и триторакс, инактивацию X хромосом и половую дифференцировку у нематод и млекопитающих, механизмы дозовой компенсации генов у дрозофилы и млекопитающих, метилирование ДНК и механизмы геномного импринтинга у млекопитающих, эпигенетические механизмы дифференцировки стволовых клеток, эпигенетический контроль за лимфопоэзом, пересадку ядер и репрограммирование ядра, эпигенетику рака, эпигенетические болезни человека. По отдельности в соответствующих главах довольно детально рассматривается так называемая частная эпигенетика разных групп организмов: дрожжей и других грибов, насекомых (дрозофила), реснитчатых простейших (Ciliata), высших растений. Каждая из глав этой книги написана крупными, ведущими в мире специалистами в эпигенетике, которые, как правило, являются и основоположниками ее отдельных областей К сожалению, работы наших соотечественников, внесших достойный вклад в становление и развитие эпигенетики, остались практически без внимания. Жаль также, что в этой книге не приняли участие и такие всемирно известные родоначальники эпигенетики, как Робин Холлидей, Артур Риггс, Вальтер Дерфлер и другие. Эта многообещающая область знаний развивается очень быстро и бурно, и уже сегодня эта книга могла бы быть изрядно дополнена принципиально новыми и важными научными сведениями. Книга дает очень хорошее и обширное представление об эпигенетике в целом, ее отдельных областях и молекулярных механизмах. Наука эпигенетика уже успела основательно прорасти в технологии. В одном из последних бюллетеней (Technology Review) Массачуссетского технологического института (США) эпигенетика названа среди десяти важнейших технологий, которые в ближайшее время могут изменить мир и оказать наибольшее влияние на человечество. И это действительно так. С ней безусловно связан прогресс биологии, медицины, сельского хозяйства и разных биотехнологий. Разумеется, эта книга, ярко и наглядно повествующая о новой науке нашего века общебиологического значения — эпигенетике, очень полезна для широкого круга читателей, интересующихся коренными и острыми современными проблемами живого, сущности жизни и молекулярных механизмов ее проявлений. Поэтому появление этой книги в России следует всячески приветствовать, она не только пробудит интерес к эпигенетике, расширит и углубит наши знания, но и послужит развитию этой важной научной дисциплины в стране. Книга переведена на русский язык и издана по инициативе известного российского ученого — Николая Викторовича Томилина. Перевод сделан к.б.н. В. В. Ашапкиным (глава 4), чл. — кор. РАН Б. Ф. Ванюшиным (глава 9), к.б.н. Ю. И. Подлипаевой (главы 21, 23 и 24), к.б.н. И. И. Фридлянской (глава 20) и д.б.н. А. Л. Юдиным.Член-корреспондент РАН Б. Ф. Ванюшин
Глава I. Эпигенетика: от явления к области науки
Daniel Е. Gottschling Fred Hutchinson Cancer Research Center, Seattle, Washington 981091. Введение
Состоявшийся летом 2004 года 69-й симпозиум (Cold Spring Harbor Symposium on Quantitative Biology) был посвящен теме «Эпигенетика» и многие авторы этой книги были в числе его участников. Как наблюдатель на этом симпозиуме я знал, что это должна была быть интересная встреча. Совещание началось достаточно просто — с попыток определения эпигенетики. После недельных распросов участников на эту тему стало ясно, что задавать такой вопрос — все равно что просить кого-то определить, что такое «семейные ценности»: каждый знает, что это такое, но для каждого это имеет разный смысл. Как объяснил Дэвид Хейг [David Haig], отчасти причину такого широкого спектра мнений можно понять исходя из этимологии слова «эпигенетика»: это слово имеет двойное происхождение в биологической литературе прошлого века, и значение этого термина продолжает эволюционировать. Уоддингтон [Waddington] первым изобрел этот термин для обозначения исследований «каузальных механизмов», посредством которых «гены генотипа осуществляют фенотипические эффекты» (см. Haig, 2004). Позже Нэнни [Nanney] использовал этот термин для объяснения своих представлений о том, как клетки с одним и тем же генотипом могут иметь разные фенотипы, сохраняющиеся на протяжении многих поколений. Я определяю эпигенетическое явление как изменение в фенотипе, которое является наследуемым, но не связано с мутацией в ДНК. Более того, это изменение в фенотипе должно быть похожим на переключение типа «ВКЛЮЧЕНО» или «ВЫКЛЮЧЕНО», а не градуальной реакцией, и оно должно наследоваться даже если первоначальные условия, вызвавшие это переключение, исчезают. Таким образом, в число эпигенетических явлений я включаю переключение между лизисом и лизогенией у бактериофага лямбда (Ptashne. 2004), переключение пилей у уропатогенной Escherichia coli (Hemday et al., 2003), эффект положения нестабильного типа у Drosophila (Henikoff, 1990), наследуемые изменения в кортикальном паттерне у Tetrahymena (Frankel 1990), прионные болезни (Wickner et al., 2004) и инактивацию Х-хромосомы (Lyon, 1993). 69-й симпозиум состоялся в 100-ю годовщину генетики как области исследований в Лаборатории Колд Спринг Харбор, что делает очень своевременным рассмотрение эпигенетики. Учитывая этот исторический контекст, я счел уместным рассмотреть изучение эпигенетики в свете предыдущих симпозиумов Колд Спринг Харбор Хотя 69-й симпозиум был первым, посвященными специально этой теме, эпигенетические явления и их изучение оказались представленными на протяжении всей истории этой выдающейся серии симпозиумов. Предлагаемая мною история сужается далее моими собственными ограничениями и предпочтениями. Для более полной и академической картины я могу порекомендовать свыше 1000 обзоров по эпигенетике, написанных за последние пять лет. Представляя этот хронологический отчет, я надеюсь передать свое ощущение от того, как коллекция внешне несопоставимых явлений слилась воедино в область исследований, затрагивающую все разделы биологии, а также показать, что изучение эпигенетики основывается на стремлении объяснить неожиданное — возможно, в большей степени, чем любая другая область биологических исследований.2. История эпигенетики на симпозиумах Колд Спринг Харбор
В 1941 году, во время 9-го симпозиума, великий генетик-дрозофилист Герман Меллер (H.J. Muller) описал результаты дальнейшей разработки явления, первоначально названного им «eversporting displacement», — явления, когда крупные хромосомные перестройки приводили к мутантной мозаичной экспрессии генов вблизи точки разрыва (Muller, 1941). Ко времени симпозиума он называл это «мозаицизмом, обусловленным эффектом положения» («position effect variegation»). Было надежно установлено, что затрагиваемые гены были перенесены «в соседство с гетерохроматиновым районом», что перенесенные эухроматиновые участки «были частично, но в разной степени, трансформированы в состояние гетерохроматина — ‘гетерохроматинизированы’» и что добавление экстракопий гетерохроматиновых хромосом «позволяло затронутому гену становиться более нормальным в своем функционировании». В то время это последнее наблюдение вызывало недоумение и было неожиданным, хотя теперь мы знаем, что это результат титрования лимитирующих компонентов гетерохроматина. На 16-м симпозиуме (1951) высший приоритет имело детальное понимание гена. Этим можно объяснить, почему в понимании мозаицизма, обусловленного эффектом положения (PEV), имел место незначительный прогресс, хотя и были открыты новые примеры этого явления. Однако первый докладчик отметил, что PEV станет захватывающей областью будущих исследований (Goldschmidt, 1951). Барбара МакКлинток отметила, что хромосомные эффекты положения являются основой различий в «мутабильных локусах» кукурузы, и высказала предположение, что наблюдавшаяся ею изменчивость мутабильности, возможно, коренится в тех же механизмах, что лежат в основе PEV у Drosophila (McClintock. 1951). Ко времени 21-го симпозиума идеи МакКлинток о «контролирующих элементах» получили дальнейшее развитие (McClintock, 1956). Две из них имели особо близкое отношение к эпигенетике. В системе контролирующего элемента Spm она обнаружила варианты, позволившие ей различать trans-действующие факторы, которые могут «подавлять» ген (уменьшать или устранять его фенотипическое выражение), а не заставлять его мутировать. Она также отметила, что некоторые контролирующие элементы могли подавлять действие гена не только в том локусе, куда они вставлены, но и в локусах, которые расположены на некотором расстоянии с той или другой стороны от него. Другие исследователи также обнаруживали этот «эффект распространения». Шульц представил биохимические и физические характеристики целых Drosophila, содержащих разные количества гетерохроматина (Schultz, 1956) Хотя эта работа была весьма примитивной, а сделанные на ее основе выводы имели ограниченное значение, она явилась примером первых попыток расчленить структуру гетерохроматина и продемонстрировала, насколько трудной окажется эта проблема. Два сообщения на 23-м симпозиуме явились вехами в свете нашего сегодняшнего симпозиума. Во-первых, Бринк описал свои ошеломляющие наблюдения «парамутаций» в локусе R у кукурузы. Если две аллели (Rst и Rr) с разными фенотипами в гомозиготном состоянии комбинируются и образуют гетерозиготу, и это растение Rst/Rr, в свою очередь, снова скрещивается, получающееся в результате потомство, которое содержит аллель Rr, всегда будет иметь фенотип Rst, хотя аллель Rst больше не присутствует (Brink, 1958). Однако этот фенотип является метастабильным — в последующих скрещиваниях он ревертирует к нормальному фенотипу Rr. Бринк предполагал, что слово «парамутация» «должно использоваться в этом контексте в своем буквальном смысле, как указывающее на явление, отличное от мутации, но и не полностью непохожее на нее». Во-вторых, Нэнни пошел очень далеко в попытках сформулировать «концептуальные и операциональные различия между генетическими и эпигенетическими системами» (Nanney, 1958). По существу он определил эпигенетику иначе, чем первоначально предполагалось Уодцингтоном (Waddington) (детали см. Haig, 2004). Он счел необходимым поступить таким образом, для того чтобы описать явления, наблюдавшиеся им у Tetrahymena. Он получил данные о том, что происхождение цитоплазмы конъюгирующих родительских клеток влияет на детерминацию типа спаривания получающегося потомства. Данное им определение охватывало и наблюдения, сделанные другими исследователями, включая работу Бринка по локусу R и работу МакКлинток, отмеченную на 21-м симпозиуме. На 29-м симпозиуме значительный интерес вызвала гипотеза инактивации Х-хромосомы у самок млекопитающих, незадолго до этого предложенная Мэри Лайон (Lyon, 1961). Еартлер, Бойтлер и Нанс представили новые данные в ее поддержку (Beutler, 1964; Gartler and Linder, 1964; Nance, 1964). Бойтлер дал обзор многочисленных примеров мозаичной экспрессии сцепленных с X генов у женщин, которые свидетельствовали в пользу случайной природы Х-инактивации. Основываясь на тщательном количественном анализе продукта гена, сцепленного с X, Нанс заключил, что инактивация Х-хромосомы происходит до наступления 32-клеточной стадии эмбриона. 38-й симпозиум на тему «Структура и функция хромосом» явился возвратом к изучению эукариотических хромосом — к этому времени значительный прогресс был достигнут в изучении прокариотических и фаговых систем, и, как следствие, в расцветающей области молекулярной биологии в мышлении в основном доминировала экспрессия бактериальных генов. Однако росло и понимание роли хроматина (ДНК с гистонами и негистоновыми белками) у эукариот, но было неясно, связана ли его роль со структурой хромосомы, с ее функциями или же и с тем, и другим (Swift, 1974). Тем не менее, несколько групп начали высказывать предположения, что с транскрипцией генов или с общей структурой хромосом связана посттрансляционная модификация белков хроматина, в том числе гистонов (Allfrey et al., 1974; Louie et al., 1974; Weintraub, 1974). В воздухе витал лишь намек на эпигенетические явления. Высказывались гипотезы о том, что у эукариот большинство генов регулируются повторяющейся ДНК — отчасти исходя из того факта, что открытые МакКлинток контролирующие элементы повторены в геноме. Сообщалось, однако, что большая часть повторяющихся нуклеотидных последовательностей ДНК не сцеплена с генами (Peacock et al., 1974; Rudkin and Tartof, 1974). С учетом этих наблюдений идея о том, что повторяющиеся элементы регулируют экспрессию генов, в значительной мере утратила поддержку со стороны присутствовавших. Что, однако, более важно, в этих же самых исследованиях обнаружилось, что большая часть повторяющейся ДНК локализована в гетерохроматине. 42-к симпозиум продемонстрировал, что за четыре года разительное количество технических и интеллектуальных достижений полностью преобразили изучение эукариотических хромосом (Chambon 1978). К их числу относились использование ферментов рестрикции ДНК, разработка технологии рекомбинантных ДНК, рутинное разделение белков и нуклеиновых кислот, возможность проведения Саузерн- и Норзерн-анализа, быстрое секвенирование ДНК и РНК и иммунофлуоресценция на хромосомах. Была представлена нуклеосомная гипотеза и был открыт сплайсинг и РНК. Основной интерес на этом симпозиуме привлекли биохимические и цитологические различия в структуре хроматина, особенно между активно транскрибируемыми и неактивными генами. Если, однако, говорить о том, что имело наиболее близкое отношение к эпигенетике, то Вайнтрауб с сотрудниками представил свои соображения относительно того, каким образом хроматин может обусловливать мозаичную экспрессию генов у организма (Weintraub et al., 1978). 45-й симпозиум явился торжеством открытий Барбары МакКлинток — подвижных генетических элементов (Yarmolinsky, 1981). Выполненные в механистическом плане исследования бактериальной транспозиции продемонстрировали чрезвычайный прогресс и вполне оправданно составили около половины всех представленных сообщений, в то время как другие доклады содержали данные о том, что транспозиция и регулируемая реорганизация генома происходят не только у кукурузы, но и у других эукариот, в том числе у мух, львиного зева, трипаносом, гриба Ascobolus и почкующихся дрожжей. В контексте этого совещания все наблюдавшиеся случаи мозаичной экспрессии были отнесены на счет транспозиций. Более того, имела место скрытая тенденция всерьез считать, что контролирующие элементы ответственны за большую часть регуляции генов (Campbell, 1981), что привело некоторых участников к предположению, что «единственной функцией этих элементов является стимулирование генетической изменчивости». В сущности, идея о том, что за регулируемую экспрессию в мозаицизме, обусловленном эффектом положения, ответствен гетерохроматин, была поставлена под сомнение. По отношению к будущим эпигенетическим исследованиям, вероятно, наибольшее внимание заслуживало твердое обоснование наличия «молчащих» кассет типов спаривания («silent mating cassetttes») у Saccharomyces cerevisiae (Haber et al., 1981; Klar et al., 1981; Nasmyth et al. 1981; Rine et al., 1981). В порядке подготовки к 47-му симпозиуму у позвоночных была установлена общая корреляция, согласно которой общий уровень метилирования цитозинов в ДНК-последовательностях CpG ниже для генов, которые транскрибируются, чем для тех, которые не транскрибируются. Однако имелись исключения из этого общего правила, и более детальный анализ показал, что наиболее важным является метилирование специфических участков промотора гена (Cedar et al., 1983; Doerfler et al., 1983; La Volpe et al., 1983). Базируясь на системах рестрикции-модификации у бактерий, полагали, что метилирование ДНК предотвращает связывание ключевых регуляторных белков. К тому же было показано, что паттерны метилирования ДНК у позвоночных могут наследоваться через митоз, что приводило к гипотезе о том, что метилирование ДНК может служить средством транскрипционной «памяти» в процессе деления клеток в ходе развития (Shapiro and Mohandas, 1983). Еще одним главным открытием, имеющим отношение к эпигенетике, была идентификация нуклеотидных последовательностей ДНК по ту или другую сторону от «молчащих кассет типов спаривания» у почкующихся дрожжей, которые отвечают за транскрипционную репрессию генов, находящихся внутри этих кассет; они, таким образом, оказались первыми нуклеотидными последовательностями ДНК, необходимыми для хромосомных эффектов положения (Abraham et al., 1983). «Молекулярная биология развития» была темой 50-го симпозиума, и на нем тоже был представлен ряд важных достижений. Возможно, одним из самых волнующих успехов было осознание всеми того факта, что фундаментальные молекулярные свойства являются консервативными в ходе эволюции — например, RAS человека функционирует в почкующихся дрожжах, гомеобоксные белки консервативны у мух и человека (Rubin et al., 1985). Новые попытки понять хромосомный импринтинг начались с разработки техники ядерных пересадок у мышей (Solter et al., 1985). Эти исследования показали, что в отцовском и материнском геномах новой зиготы хранится информация о происхождении от того или другого родителя; важна не просто ДНК сама по себе; хромосомы содержат дополнительную информацию, через кого из родителей они прошли, и эта информация необходима для успешного развития эмбриона. Полагали, что частично ответ лежит в том факте, что от происхождения хромосомы от того или другого родителя зависит дифференциальная экспрессия генов (Cattanach and Kirk, 1985). Имелся ряд исследований, направленных на понимание сложной регуляции комплекса bithorax; особенно следует отметить сообщение Льюиса, который специально остановился на странной природе известных trans-регуляторов этого локуса; почти все они являются репрессорами данного локуса (Lewis, 1985). Таким образом, поддержание гена в «молчащем» состоянии на протяжении многих клеточных удвоений является обязательным для нормального развития. Это противоречило весьма распространенному в то время мнению, согласно которому там, где будут приниматься критические регуляторные рещения, касающиеся развития, имеет место активация/индукция гена. К тому времени для ряда организмов была разработана техника ДНК-трансформации и инсерционного мутагенеза. Один из примеров особенно продуктивного и имеющего отношение к эпигенетике использования этой технологии был получен на Drosophila. Был создан транспозон P-элемент с геном white (цвет глаз) на нем и он «прыгал» по всему геному (Rubin et al., 1985). Это дало возможнсть картировать во всем геноме Drosophila сайты, где мог происходить PEV. Этот симпозиум высветил также первые генетические подходы к расчленению (dissection) явлений детерминации пола и компенсации дозы половых хромосом у Drosophila (Belote et al., 1985; Maine et al., 1985) и Caenorhabditis elegans (Hodgkin et al., 1985; Wood et al., 1985). 58-й симпозиум отвел главное место празднованию 40-й годовщины открытия, сделанного Уотсоном и Криком. Частью этого торжества была выездная «тусовка», посвященная эпигенетическим явлениям: говорилось об идентификации новых явлений, начале молекулярного анализа других явлений, на ряде систем был достигнут существенный прогресс, позволяющий предлагать гипотезы и тестировать их. У трипаносом гены семейства Генов Вариабельных Поверхностных антигенов (VSG — Variable Surface antigene Genes), локализованных возле теломер, в основном «молчат», и в каждый данный момент экспрессируется только один VSG. Хотя этот организм, по-видимому, не содержит метилированной ДНК, сообщалось, что «молчащие» гены VSG содержат новое минорное основание, 0-D-глюкозилгидроксиметилурапил (Borst et al., 1993). Это основание, по-видимому, занимает в ДНК место тимидина. Нетрудно провести параллели между этим основанием и метилированием цитозина у других организмов — эти модификации важны для поддержания «молчащего» гена. Но как это основание вводится в ДНК или как оно осуществляет такую функцию, было неясно. Прогресс был также достигнут в изучении эпигенетических явлений у позвоночных, в том числе хромосомного импринтинга и инактивации Х-хромосомы (Ariel et al., 1993; Li et al., 1993; Tilghman et al., 1993; Willard et al., 1993). К этому времени стало ясно, что у млекопитающих многие локусы подвержены импринтингу; в диплоидных клетках экспрессируется лишь одна аллель, и экспрессия зависит от ее происхождения от того или другого родителя. Особый интерес представлял локус Igf2-H19, главным образом потому, что он содержал два соседних гена, которые регулировались противоположным образом. Igf2 экспрессируется в отцовской хромосоме, тогда как материнская копия репрессирована; в то же время отцовская аллель Н19 репрессирована, а материнская аллель этого гена экспрессируется. Интересно, что метилированные CpG наблюдались на отцовской хромосоме непосредственно «вверх по течению» от обоих генов Предположили, что дифференциальное метилирование регулирует доступ этих двух генов к близлежащему энхансерному элементу — этот энхансер расположен ближе к Н19 и непосредственно «вниз по течению» от него (Tilghman et al., 1993). Можно было представить себе взаимоисключающую конкуренцию между этими двумя генами за энхансер; когда ген HJ9 метилирован, энхансер свободен и активирует более удаленный ген Igf2. В пользу идеи, что метилирование ДНК играет регуляторную роль в этом процессе, свидетельствовали эксперименты с мышами. Мутация первого гена позвоночных, кодирующего 5-метилцитозин-ДНК-метилтрансферазу в ES-клетках, показала, что по мере развития эмбрионов отцовская копия Н19 становилась гипометилированной, и этот ген становился транскрипционно активным (Li et al., 1993). Важным шагом в расшифровке того, как 5MeCpG опосредует свои эффекты, явилась очистка первого комплекса, связывающегося с 5MeCpG в ДНК (MeCPl — 5MeCpG DNА-binding complex) (Bird 1993). MeCPl не только связывается с ДНК, но и, связавшись «вверх по течению» от репортерного гена, вызывает репрессию этого гена. Хотя это и не объясняло регуляцию в локусе Igf2-H19, но давало возможный механизм для объяснения общей корреляции между метилированием ДНК и репрессией гена. Генетическое картирование на протяжении ряда лет позволило идентифицировать ту часть Х-хромосомы человека, которая является критичной для инактивации Х-хромосомы. Исследования этого центра X-инактивации с использованием молекулярного клонирования привели к открытию гена Xist (Willard et al., 1993), некодирующей РНК размером ― 17 т. о., который экспрессируется только на неактивной Х-хромосоме. Мышиная версия Xist оказалась на удивление гомологичной по структуре и нуклеотидной последовательности и обещала стать прекрасной модельной системой для «расчленения» того пути, на котором эта РНК функционирует и репрессирует большую часть Х-хромосомы. Два заслуживающих внимания открытия были описаны у Neurospora (Selker et al., 1993). Во-первых, было показано, что метилирование цитозинов в ДНК не ограничено динуклеотидами CpG, а может происходить как будто бы в любом ДНК-контексте. Вторым открытием стало описание удивительного явления индуцируемых повторами точечных мутаций (RIP — repeat-induced point mutation). Когда в гаплоидном геноме имеется дупликация некой последовательности (сцепленная или несцепленная), и этот геном посредством конъюгации проводится через половой цикл, нуклеотидные последовательности становятся «RIPованными». Происходят два события: обе копии дуплицированной ДНК приобретают мутации типа G: C → А: Т, а ДНК в пределах нескольких сотен пар оснований «RIPованных» последовательностей становится метилированной. Эта двойная атака на геном весьма эффективна — 50 % неспепленных локусов подвержены RIP, тогда как тесно сцепленные локусы достигают 100 % — и легко подавляет функцию генов. Ген brown у Drosophila, будучи транслоцирован в соседство с гетерохроматином, демонстрирует доминантный PEV; транслоцированная копия может вызвать репрессию копии дикого типа. В ходе поисков энхансеров и супрессоров этого явления trans-инактивации Хеникоф (Henikoff) открыл, что дупликация гена, локализованного вблизи гетерохроматина, повышает уровень репрессии на нормальной копии (Martin-Morris et al., 1993). Хотя механизм, лежащий в основе этого события, оставался загадочным, постулировали, что это явление могло бы быть аналогичным RIP у Neurospora, хотя оно должно происходить в отсутствии метилирования ДНК, которое у Drosophila не происходит. Пол Шедл (Paul Schedl) изложил концепцию хромосомных «граничных элементов» (Vazquez et al., 1993). Первые такие элементы были локализованы с той или другой стороны района «пуфа» в локусе теплового шока у Drosophila и определены по необычной структуре их хроматина — устойчивому к нуклеазе кору величиной ~300 п.н., ограниченному гиперчувствительными к нуклеазе сайтами. Постулировали, что такие элементы разделяют домены хроматина вдоль по длине хромосомы. Два теста in vivo свидетельствовали в пользу этой гипотезы: (1) Ограничивая ту или другую сторону репортерного гена, граничные элементы эффективно устраняли хромосомные эффекты положения, когда этот конструкт случайным образом вставлялся в геном. (2) Граничный элемент определялся также по его способности блокировать функцию энхансера. Будучи вставлен между промотором гена и его энхансером, граничный элемент блокировал экспрессию данного гена. Хотя и не в столь определенном виде, эта концепция граничных элементов была разработана и для других организмов, особенно на глобиновом локусе у млекопитающих (Clark et al., 1993). Исследования на почкующихся дрожжах высветили развивающийся механистический подход [a mechanistic inroad] к связанным с хроматином эпигенетическим явлениям. Было уже установлено, что сайленсеры в «молчащих» локусах типа спаривания являются сайтами для нескольких связывающихся с ДНК белков. Их связывание оказалось зависимым от контекста, примером чего может быть белок Rap1, который не только играет важную роль в сайленсинге, но и связывается «вверх по течению» от ряда генов, активируя транскрипцию (обзор см. Laurenson and Rine, 1992). На протяжении ряда лет были установлены многочисленные связи между репликацией ДНК и транскрипционно «молчащими» районами генома. Неактивная Х-хромосома, гетерохроматин и «молчащие» импринтированные локусы — все они, как сообщалось, поздно реплицируются в фазе S по сравнению с транскрипционно активными районами генома. Кроме того, было показано, что установление сайленсинга в «молчащих» локусах типа спаривания требует прохождения через фазу S, что заставляет предполагать, что «молчащий» хроматин должен быть построен на недавно реплицированной ДНК. Так, огромный интерес вызывал тот факт, что один из сайленсеров оказался точкой начала репликации ДНК («ориджином»), а его активность в этом качестве нельзя было отделить от функции сайленсинга (Fox et al., 1993). Более того, мутанты в недавно идентифицированном комплексе распознавания «ориджина» (ORC — origin recognition complex) «портили» сайленсинг (Bell et al., 1993; Fox et al., 1993). Еще один подход к «расчленению» структуры гетерохроматина и ее влияние на экспрессию генов обусловило открытие, показавшее, что теломеры у Saccharomyces cerevisiae приводят в действие PEV, аналогичный наблюдаемому у Drosophila. Репортерные гены, вставленные около теломер, обнаруживают мозаичную экспрессию в колонии дрожжей. Репрессированное состояние зависит от многих генов (SIR2, SIR3, SIR4) из тех, что необходимы для сайленсинга в «молчащих» локусах типа спаривания. Были описаны несколько ключевых аспектов, касающихся структуры «молчащего» хроматина и регуляции мозаичной экспрессии. Заслуживает упоминания тот факт, что цитологически гетерохроматин определяется как конденсированный хроматин, но «молчащий» хроматин у S. cerevisiae никогда не удавалось визуализировать таким образом. Тем не менее, из-за сходства с PEVу Drosophila «молчащий» хроматин у дрожжей всегда были склонны рассматривать как функциональный эквивалент гетерохроматина (описано в Weintraub, 1993). На основе исследований на дрожжах начал формироваться ряд фундаментальных концепций. Во-первых, стало очевидным важное значение гистонов H3 и Н4. В частности, аминотерминальный «хвост» гистонов H3 и Н4 оказался непосредственным участником формирования «молчащего» гетерохроматина (Thompson et al., 1993). Специфические мутации в «хвостах» этих гистонов облегчали или портили сайленсинг и позволяли думать, что и общий заряд остатков на «хвостах», и специфические остатки в составе «хвостов» вносят вклад в сайленсинг. Кроме того, на заре использования иммунопреципитации хроматина (ChIP) было продемонстрировано, что лизины в аминотерминальном «хвосте» гистона Н4 гипоацетилированы в районах «молчащего» хроматина по сравнению с остальной частью генома. Более того, одна из гистоновых мутаций позволила идентифицировать H4K16 гистонов (который может быть ацетилирован) как критичный для формирования «молчащего» хроматина Теломеры оказались простейшей системой для более глубокого понимания того, каким образом белки Sir опосредуют сайленсинг. Была разработана концепция рекрутирования белков сайленсинга. Говоря коротко, оказалось, что белок Rap1, связывающийся с теломерной ДНК, взаимодействует с Sir3 и Sir4 двугибридным способом (by two-hybrid methods — описано в Palladino et al. 1993). Таким образом, Rap1 может «рекрутировать» эти белки Sir к теломерному району генома. Имелись данные о том, что Sir3 и Sir4 могут связываться друг с другом и что (и это особенно важно) Sir3 и, возможно, Sir4 взаимодействуют с «хвостами» гстонов H3 и Н4 (Thompson et al., 1993). Более того, сверхэкспрессия Sir3 заставляет его «распространяться» по хроматиновой фибрилле внутрь от теломеры, позволяя предполагать, что он является лимитирующим компонентом «молчащего» хроматина и может «полимеризоваться» вдоль хроматина (Renauld et al., 1993). Все вместе показывало, что существует, оказывается, обширная сеть взаимодействий, важная для сайленсинга, — белки Sir инициируют сборку на теломерной ДНК, благодаря их взаимодействию с Rap1, а затем полимеризуются от теломеры вдоль хроматинового волокна, предположительно связываясь с «хвостами» гистонов H3 и Н4. Переключение между транскрипционными состояниями при мозаичной теломерной экспрессии оказалось результатом конкуренции в отношении экспрессии между «молчащими» и активными генами (Aparicio and Gottschling, 1994; описано в Weintraub, 1993). Если транскрипционный активатор для теломерного гена делегирован, базовый механизм транскрипции этого гена оказывается недостаточным для экспрессии, и этот ген оказывается конститутивно сайленсированным Наоборот, сверхэкспрессия активатора заставляла теломерный ген экспрессироваться постоянно — это ген никогда не был сайленсирован. В отсутствие SIR3 (или SIR2 или SIR4) базальная экспрессия гена была достаточной, тогда как увеличенная доза SIR3 повышала долю клеток, которые были сайленсированы. Хотя транскрипционный активатор мог преодолеть сайленсинг на протяжении всего клеточного цикла, он был наиболее эффективным, когда клетки были остановлены в фазе S — предположительно, когда хроматин реплицируется и, отсюда, оказывается наиболее чувствительным к конкуренции. Несколько удивляет, что клетки, остановленные на G2/M, также можно было легко переключить, что заставляло предполагать, что «молчащий» хроматин еще не был полностью собран к этому времени. Было показано, что «молчащий» хроматин у дрожжей не поддается действию нуклеаз и ферментов модификации ДНК; это позволяет предположить, что лежащая в его основе ДНК гораздо менее доступна, чем большая часть генома (описано в Thompson et al. 1993). Оказалось также, что имеет место иерархия сайленсинга в геноме дрожжей: наиболее чувствителны к пертурбациям теломеры, затем идет HML, а наименее чувствителен HMR. Действительно, когда ген SIR1 мутировал, локусы НМ, в норме полностью сайленсированные, обнаруживали мозаичную экспрессию (Pillus and Rine, 1989). Наконец, Sir3 и Sir4 были локализованы на периферии ядра, как и теломеры. Предположили, что ядро организовано таким образом, что ядерная оболочка обеспечивает специальную среду для сайленсинга (Раlladinoetal., 1993). Schizosaccharomyces pombe тоже имеют «молчащие» кассеты типов спаривания, которые, как подозревают, ведут себя аналогично кассетам типов спаривания у S cerevisiae. Однако у S. pombe в истории с переключением типов спаривания был дополнительный поворот. В элегантной серии экспериментов Эймар Клар (Amar Klar) выдвинул предположение о том, каким образом в клетке «метка» импринтируется на одной нити ДНК (Klar and Bonaduce, 1993). Эта метка проявляется, после двух клеточных делений, в одной из четырех «внучатых» клеток как двунитевой разрыв, облегчающий переключение типа спаривания У этих дрожжей отсутствуют какие-либо известные модификации ДНК (метилирование и т. п.); отсюда постулируется, что на нити ДНК оставляется метка какого-то иного типа. Темой 59-го симпозиума была «Молекулярная генетика рака». Концепция эпигенетической регуляции в онкогенезе начала развиваться после того, как утвердилась идея генов-супрессоров опухолей. Была опубликована пара исследований в пользу таких представлений, но интересный поворот в этой истории возник в исследованиях пациентов с синдромом Бэквита-Видеманна и опухолями Уилмса. Мутации у пациентов обоих типов были картированы в локусе, включавшем импринтированные гены H19-IGF2 Фейнберг с соавторами (Feinberg et al., 1994) открыл у таких больных «утрату импринтинга» (LOI — loss of imprinting) для этих генов — материнский локус утрачивал свой импринт, Н19 был репрессирован, a IGF2 — экспрессирован. Таким образом, LOI, которая в принципе могла бы происходить в других местах генома, могла вызывать либо биаллельную экспрессию, либо исчезновение генов, критичных для онкогенеза, либо и то и, другое. Через пару лет на пути к 63-му симпозиуму на тему «Механизмы транскрипции» произошли важные события, которые впоследствии повлияют на понимание молекулярных механизмов нескольких эпигенетических феноменов. Были идентифицированы ферменты, модифицирующие гистоны, а именно, ацетилазы и деацетилазы гистонов Некоторые из этих энзимов играли критическую роль в регулировании экспрессии генов и позволили подойти к генным продуктам, непосредственно влияющим на PEVи сайленсинг. На симпозиуме была представлена верхушка этого айсберга (см. Losick, 1998). Молекулярное «расчленение» сайленсирующих белков Sir3 и Sir4 у дрожжей выявило поливалентную природу их взаимодействий и показало, каким образом сеть взаимодействий между всеми белками Sir, гистонами и разнообразными факторами, связывающимися с ДНК, формирует «молчащий» хроматин. Кроме того, были показаны молекулярные детали того, как разнообразные локусы (теломеры, рДНК, локусы НМ и двунитевые разрывы) могут конкурировать за ограниченные ресурсы белков Sir. При нарушении способности специфического локуса рекрутировать факторы сайленсинга уровни содержания белков Sir в других локусах повышались (Cockell et al., 1998). Это прямо доказывало, что работает принцип действия масс и что сайленсинг в одном локусе может влиять на эпигенетический сайленсинг в других локусах (идея, первоначально выдвинутая в исследованиях PEV у Drosophila, но все еще не проверенная) (Locke et al., 1988). Еще одно открытие позволило объяснить, каким образом метилирование ДНК может регулировать экспрессию генов через хроматин. Были идентифицированы белковые комплексы, состоящие из МеСР2, которые связываются и с метилированной ДНК, и с деацетилазой гистонов (Wade et al., 1998). Метилированная ДНК могла служить точкой рекрутирования деапетилаз к локусу и таким образом облегчать сайленсинг близлежащих генов. Концепция граничных элементов была распространена с Drosophila на млекопитающих (четкие данные были получены на локусе Р-глобина), показывая таким образом, что границы хроматина, вероятно, действительно консервативны у многоклеточных и. возможно, у всех эукариот (Bell et al., 1998). На 64-м симпозиуме, темой которого был «Сигналинг и экспрессия в иммунной системе», были приведены данные о том, как возникает моноаллельная экспрессия, и о том, что она может быть распространена более широко, чем думали раньше. Моноаллельная экспрессия в локусах иммуноглобулинов на протяжении некоторого времени была очевидна для лимфоцитов — она гарантировала продукцию единственного типа рецепторов в каждой лимфоидной клетке (Mostoslavsky et al., 1999). Аллель, которая будет экспрессироваться, выбирается на ранних стадиях развития, очевидно, случайным образом: обе аллели вначале находятся в репрессированном состоянии, но через некоторое время одна из них деметилируется. Было неясно, как происходит выбор одной из аллелей, но это явление обнаруживается и в других локусах, где необходимость моноаллелизма была не столь очевидна. Например, экспрессируется только одна аллель генов, кодирующих цитокины IL-2 и IL-4 (Pannetieret al., 1999). Наиболее значительное сообщение на 65-м симпозиуме, имеющее отношение к эпигенетике, касалось открытия того, что белок Sir2 является деацетилазой гистонов (Imai et al., 2000). Это был единственный белок Sir, у которого были очевидные гомологи у всех других эукариот и который регулировал PEV. Создавалось впечатление, что этот фермент в основном отвечает за удаление ацетильных компонентов гистонов в «молчащем» хроматине. Кроме того, поскольку это был фермент, зависимый от NAD, он связывал регуляцию сайленсинга (гетерохроматина) с клеточной физиологией. 68-й симпозиум на тему «Геном Homo sapiens» явился важной вехой в генетике, и хотя все еще остается проделать большую генетическую работу, полное секвенирование этого и других геномов означало, что пришло время переходить на «надгенетический» уровень — в буквальном значении слова «эпигенетика». Этот исторический отчет высвечивает несколько тем, общих со многими другими областями исследования. Во-первых, он демонстрирует эпизодическую природу достижений в эпигенетике. Во-вторых, по мере постижения молекулярных механизмов, лежащих в основе эпигенетических явлений, стало легче связывать эпигенетику с биологической регуляцией в целом. В-третьих, он показал, что исследователи, которых мы в настоящее время считаем корифеями науки, установили эти связи очень рано — потребовалось лишь некоторое время, чтобы большинство остальных «увидели» очевидное.3. 69-й симпозиум
С годами выявилось несколько универсальных принципов, общих для всех эпигенетических явлений, и эти принципы определяют экспериментальные подходы в наших попытках понять детали. Во-первых, различия между двумя фенотипическими состояниями («ВКЛЮЧЕНО» и «ВЫКЛЮЧЕНО») всегда коррелируют с соответствующим различием структуры в ключевой регуляторной точке — форма транслируется в функцию. Отсюда, основная задача заключается в идентификации этих двух различных структур, компонентов, из которых эти структуры состоят, и композиционных различий между ними Во-вторых, эти различающиеся структуры должны обладать способностью поддерживать и воспроизводить себя в окружении конкурирующих факторов и сил энтропии. Таким образом, каждая структура нуждается в самоусилении, или в контурах положительной обратной связи, обеспечивающих ее поддержание и воспроизведение на протяжении многих клеточных делений; в некоторых случаях, таких как инактивация Х-хромосомы, это время оказывается сравнимым со временем жизни На 69-м симпозиуме продолжалось уточнение многих механистических принципов, установленных напредыдущих симпозиумах, но были и новые разработки. Чтобы поместить эти новые разработки в наш контекст, важно отметить, что важное влияние на эпигенетику оказали еще два открытия. Одним было открытие РНК-интерференции и родственных, базирующихся на РНК, механизмах регуляции. Другим было открытие механизмов, лежащих в основе гипотезы прионов. За последнее десятилетие обе эти области быстро развивались, и некоторые из этих исследований внесли вклад в наши знания об эпигенетике, базирующейся на хроматине, тогда как другие наметили новые перспективы в проблеме наследственной передачи фенотипов. Многие достижения, представленные на этом симпозиуме, детально описываются в разных главах этой книги, поэтому я воздержусь здесь от обсуждения этих тем Однако я затрону несколько успешных и перспективных исследований, которые привлекли мое воображение и которые не освещаются на этих страницах В конце я попытаюсь сформулировать наиболее важные концепции, вынесенные мною из этого симпозиума.3.1. Гипотеза гистонового кода
В ходе рассмотрения модификаций гистонов и их потенциального информационного содержания состоялось много дискуссий относительно «гипотезы гистонового кода» (Jenuwein and Allis 2001). Большинство этих споров, в которых я принимал участие или о которых мне рассказывали, были неформальными и довольно оживленными. Сторонники «кода» приводили такие примеры, как триметилирование гистона H3 по К9 и его повышенное сродство к классу НР1 белков гетерохроматина (Jenuwein and Allis, 2001). Их противники приводили биохимические и генетические данные о том, что на связывание с ДНК или на фенотип существенно влияет суммарный заряд на аминотерминальном «хвосте» гистона Н4, независимо от того, где этот заряд расположен (Megee et al., 1995; Zheng and Hayes, 2003) Грюнштейн (Grunstein) представил данные, включавшие анализ модификаций (ацетилирования) гистонов и связанных с хроматином белков во всем геноме S. cerevisiae с использованием специфических антител и метода ChlP-Chip (Millar et al., 2004). Он сделал акцент на ассоциированном с ацетилированием H4K16 эпигенетическом переключении к связыванию или несвязыванию определенных белков хроматина, поддерживая таким образом гипотезу гистонового кода. Некоторые из его данных, хотя они и не обсуждались, по-видимому, свидетельствуют в пользу сообщений других исследователей о том, что для большой части генома нет корреляции между специфичесикми модификациями гистонов и экспрессией генов (т. е. все активные гены имеют одинаковые метки, и эти метки отсутствуют на неактивных генах) (Schubert et al., 2004; Dion et al., 2005). Учитывая всю совокупность этих результатов, я подозреваю, что в качестве механизмов регулирования структуры хроматина и экспрессии генов обычно используются и специфические модификации, и влияние общего заряда3.2. Динамический «молчащий» хроматин
Я должен признаться, что, основываясь на статических изображениях гетерохроматина и на рефрактерной природе «молчащего» хроматина, я был убежден, что, однажды установившись, гетерохроматиновое состояние остается прочным, как гранит. Только когда наступает время репликации ДНК, эта непробиваемая структура становится релаксированной. Думая таким образом, я неразумно игнорировал принципы равновесной динамики, с которыми познакомился в курсе химии. Однако к этим урокам заставили возвратиться исследования «молчащего» хроматина и гетерохроматина, где было показано, что белки сайленсинга у дрожжей (Sir3) и белки гетерохроматина в клетках млекопитающих (НР1) находятся в состоянии динамического равновесия — эти белки быстро обмениваются между гетерохроматином и растворимым компартментом — даже когда хроматин находится в своем наиболее непроницаемом состоянии (Cheng and Gartenberg, 2000; Cheutin et al., 2003). Осознание динамических качеств хроматина вынудило меня иначе взглянуть на то, каким образом поддерживается и воспроизводится его эпигенетическое состояние. Этот взгляд предполагает, что в некоторых системах эпигенетическое состояние может быть ревертировано в любое время, а не только в ходе репликации ДНК. Отсюда мы можем заключить, что для «молчащего» хроматина механизмы усиления и воспроизведения должны функционировать постоянно. Широко распространено мнение, что метилирование гистонов является модификацией, накладывающей на хроматин «перманентную» метку (обзор см. Kubicek and Jenuwein, 2004). В противоположность всем другим модификациям гистонов (например, фосфорилированию, ацетилированию, убиквитинированию) нет известных ферментов, которые могли бы обратимо удалять метальную группу с аминогруппы лизина или аргинина. Более того, считается, что удаление метальной группы простым гидролизом в физиологических условиях невыгодно и, таким образом, вряд ли происходит спонтанно. Несколько сообщений слегка поколебали систему верований тех, кто думал, что метки метилирования являются перманентными. Во-первых, было показано, что ядерная пептидиларгининдеиминаза (PAD4) может удалять монометилирование с остатков аргинина (R) гистона H3 (Cuthbert et al., 2004; Wang et al., 2004). Хотя результатом этого процесса удаления метального компонента является конвертация остатка аргинина в цитруллин, и, следовательно, это не является истинной реверсией данной модификации, он, тем не менее, представляет собой механизм элиминации перманентной метильной метки. Робин Олшайр (Robin Allshire) привел провоцирующий генетический аргумент, согласно которому ген tis2 из S. pombe ревертирует диметилирование по К9 в гистоне H3 (R. Allshire, личное сообoщение). Возможно, он был на верном пути, поскольку через несколько месяцев после симпозиума было показано, что неродственный фермент LSD1 из млекопитающих специфически деметилирует ди- и монометилы на гистоне H3 по K4 (Shi et al., 2004), ревертируя «активную» метку хроматина. Весьма интересно, что LSD1 не работает на триметилированном H3K4 — таким образом, метилирование может быть ревертировано в ходе процесса маркировки, но реверсия невозможна, коль скоро метка полностью созрела. Однако Стив Хеникоф (Steve Henikoff) описал способ, которым могла бы элиминироваться перманентная триметиллизиновая метка Он показал, что вариантный гистон H3.3 может замещать канонический гистон H3 независимым от репликации и сопряженным с транскрипцией образом (Henikoff et al., 2004). По существу гистон, содержащий метильные метки для сайленсинга, мог бы быть удален и заменен гистоном, более подходящим для транскрипции. Когда был изолирован суммарный хроматин, оказалось, что гистон H3.3 имел на себе намного больше меток метилирования хроматина (например, K79me), чем канонический гистон H3. При рассмотрении всех этих результатов создается впечатление, что может и не быть простой молекулярной модификации гистонов, которая служит как метка памяти для воспроизведения состояния «молчащего» хроматина в холе клеточного деления. Скорее, должен иметь место тонкий набор взаимодействий, увеличивающих вероятность того, что «молчащее» состояние будет поддерживаться, хотя и не гарантирующих это.3.3. Ядерная организация
Корреляции между ядерной локализацией и экспрессией генов были установлены уже много лет назад (Mirkovitch et al., 1987). На основе этих наблюдений начало формироваться мнение, что в клетке имеются специальные компартменты, которыми ограничены экспрессия генов или сайленсинг. Приводили доводы в пользу того, что такая организация необходима для поддержания сложности генома и его регуляции в работоспособном состоянии. Эта идея была поддержана исследованиями на S. cerevisiae, где теломеры преимущественно локализовались на периферии ядра, как и ключевые компоненты комплекса сайленсинга, такие как Sir4 (Palladino et al., 1993). Результатом мутаций, высвобождающих теломеры или Sir4 с ядерной периферии, является утрата теломерного сайленсинга (Laroche et al., 1998; Andrulis et al., 2002). Более того, искусственная привязка частично сайленсированного гена к этой периферии делала его полностью сайленсированным (Andrulis et al.. 1998). В очень информативном эксперименте Гассер показал, что если теломеры и сайленсирующий комплекс высвобождаются с периферии и могут свободно перемещаться по всему ядру, легко устанавливается теломерный сайленсинг (Gasser et al., 2004). Таким образом, по-видимому, нет особой нужды локализовать локусы в компартменте. Это в большей мере согласуется с данными о том, что быстрое перемещение белков хроматина на хромосомы и с хромосом может, кроме того, опосредовать такую эффективную регуляцию, как сайленсинг. Возможно, чтобы поддерживать высокие локальные концентрации связанных с этим факторов в специальных (стрессовых?) условиях, какая-то локализация и необходима. Или же это может быть комбинацией доменов, собранных вместе в ходе эволюции, которая давно работает без всякой конечной цели.3.4. Прионы
Викнер дал обзор прионов и критерии для их определения, и из его описания становится ясным, что они (прионы) — это часть эпигенетического ландшафта (Wickner et al., 2004a,b). В простейшем молекулярном смысле прионы — это белки, которые могут вызывать наследуемые фенотипические изменения, действуя на родственный этим белкам генный продукт и изменяя его. Никаких изменений нуклеотидной последовательности ДНК не происходит; скорее, прион, в общем случае, навязывает своему субстрату некое структурное изменение. Прионы, относящиеся к лучше всего изученному и понятому классу, заставляют растворимые формы белка преобразовываться в амилоидные волокна. Во многих случаях эта амилоидная форма снижает или вовсе устраняет нормальную активность данного белка, вызывая таким образом изменение в фенотипе. Викнер определил еще один класс прионов, которые не формируют амилоидных нитей. Это ферменты, для активации которых требуется своя же ферментативная активность. Если клетка обладает лишь неактивными формами этого энзима, тогда необходим внешний источник активного энзима, чтобы положить начало тому, что затем станет самовоспроизводящимся признаком, пока по крайней мере одна активная молекула передается каждой клетке. Он привел два примера и выразил уверенность в том, что этот класс белков составит новую группу эпигенетических механизмов для исследования. Ши представил предварительные данные о том, прионная модель может объяснить научение и память у Aplysia (Si et al., 2004). В нейрональных клетках этого моллюска трансляция ряда запасенных и PH К в белки важна для поддержания кратковременной памяти. Он обнаружил, что регулятор белковой трансляции, СРЕВ, может существовать в двух формах и что активированная форма СРЕВ действует доминантно, воспроизводя себя. Проверка этой идеи все еще находится в самом начале, но обещает фантастические новые подходы на тему о том, каким образом мы помним.3.5 Новое явление
Описание нового и неожиданного феномена всегда поражает наше воображение. Одно сообщение в особенности занимало мои мысли на протяжении нескольких недель после симпозиума Стандартный генетический анализ мутантных аллелей гена HOTHEAD, регулирующего слияние органов у Arabidopsis, показал, что обычные правила менделевской генетики здесь не выполняются (Lolle et al., 2005). Оказалось, что если гетерозиготные (HOTHEAD/hothead) растения самоопыляются и производят гомозиготное растение hothead/hothead, а затем этому гомозиготному растению hothead/hothead дают самоопылиться, потомство от этого гомозиготного родителя ревертирует к генотипу HOTHEAD/hothead с частотой до 15 %. Этот потрясающе высокий уровень реверсии к дикому типу давал, на нуклеотидном уровне, точный дубликат гена дикого типа, наблюдавшегося в предшествующих поколениях. Эта реверсия не ограничивалась локусом HOTHEAD — несколько других локусов обнаруживали сходные частоты реверсии к аллелям дикого типа. Однако для всех этих реверсий требовалось, чтобы родитель был гомозиготным hothead/hothead. Продукт гена HOTHEAD не дает никакого очевидного объяснения, как такое может происходить, но прошедшие обсуждения определенно заставляют предполагать, что некая архивная копия гена дикого типа передавалась в ряду последовательных поколений, возможно через РНК. Хотя можно возразить, что это явление лежит вне сферы «эпигенетики», — поскольку связано с изменениями в нуклеотидной последовательности ДНК, — наследственная передача этой предполагаемой архивной копии не подчиняется нормальным генетическим правилам. Так или иначе, этот феномен чреват огромными последствиями для генетики, особенно в области эволюционного мышления.4. Заключительные соображения
Итак, что еще нужно сделать, чтобы понять эпигенетические механизмы? По большей части мы все еще собираем (открываем) их отдельные компоненты. Точно так же, как полная последовательность генома чрезвычайно облегчила прогресс в области генетики, так и более ясное понимание эпигенетики придет, вероятно, тогда, когда станут известными все составные части. Успехи, достигнутые за последнее десятилетие, очень вдохновляют. Признаюсь, я не в состоянии различить, близки ли мы или далеки от точного, в механистическом плане, понимания того, каким образом поддерживаются и воспроизводятся эпигенетические состояния. Первым, возможно, придет понимание феноменов, базирующихся на прионах; те же явления, которые базируются на хроматине, по-видимому, наиболее далеки от этого. Поливалентная природа взаимодействий, которые, по-видимому, необходимы для установления сайленсированного состояния на хромосоме, увеличивает сложность проблемы. Последняя еще более усложняется динамической природой «молчащего» хроматина. Возможность узнать больше о движении компонентов в хроматиновые структуры и из них требует для окончательного понимания применения усовершенствованных или совсем новых методов. Иммунопреципитация хроматина, оказавшаяся важной в установлении того, какие компоненты находятся в составе структуры, временно заслонила от нас динамику. Я подозреваю, что, учитывая эту сложность, простое измерение констант связывания и равновесия для всех компонентов и попытки получить систему дифференциальных уравнений для имитации эпигенетических переключателей могут оказаться неэффективной тратой ресурсов и не обязательно приведут к лучшему пониманию. Скорее, я предполагаю, что потребуется разработка математического подхода нового типа в комбинации с новыми экспериментальными методами измерения для окончательного понимания эпигенетических событий. В частности может потребоваться разработка систем in vitro, надежно воспроизводящих эпигенетическое переключение между состояниями. Идея конкуренции между двумя состояниями в большинстве эпигенетических явлений, вероятно, отражает «гонку вооружений», происходящую на многих уровнях клетки, за которой следуют попытки исправить «сопутствующий ущерб». Например, белки сайленсинга возникли, возможно, для зашиты генома от транепозонов Однако, поскольку белки сайленсинга работают через посредство вездесущих нуклеосом, становятся репрессированными некоторые критичные гены. Чтобы преодолеть это, возникли модификации гистонов (например, метилирование H3K4 и H3K79) и замещение вариантными гистонами, чтобы предотвращать связывание белков сайленсинга с критичными генами. В зависимости от последующих событий эти изменения могут быть кооптированы для других процессов — например, может стать полезной репрессия некоторых генов белками сайленсинга («молчащие» локусы типа спаривания). Механизмы сайленсинга могут кооптироваться и для других функций, таких как стимуляция расхождения хромосом. И так далее… Я жду секвенирования геномов новых организмов, поскольку это может привести нас к пониманию последовательности эволюционных событий, приведших к возникновению эпигенетических процессов, которые мы наблюдаем сегодня. Например, у S. cerevisiae отсутствует аппарат RNAi, но у многих других грибов он есть. Заполняя некоторые филогенетические пробелы между видами, мы можем выяснить, какие события привели к тому, что S. cerevisiae больше не «нуждаются» в этой системе. Изучение эпигенетики, возможно, более, чем какая-либо другая область биологических исследований, основывается на стремлении понять неожиданные наблюдения, начиная с мозаицизма, обусловленного эффектом положения, до полярной сверхдоминантности в фенотипе callipyge (Georges et al., 2004). Надежда понять что-то необычное служит для нас приманкой, но скоро мы приходим в восторг при виде разумности используемых механизмов. Этим можно объяснить, почему эта область привлекла непропорционально много веселых и светлых умов Я подозреваю, что так и будет продолжаться по мере достижения нами более высокого уровня мастерства и открытия новых и неожиданных эпигенетических явлений.Благодарности
Я благодарю моих коллег в Университете Чикаго и Раковом исследовательском центре Фреда Хатчинсона, которые сделали мои собственные исследования по эпигенетике столь приятными; я благодарен также Национальным институтам здоровья за финансовую поддержку.Литература
Abraham J., Feldman J., Nasmyth K.A., Strathem J.N., Klar A.J., Broach J.R., and Hicks J.B. 1983. Sites required for position-effect regulation of mating-type information in yeast. Cold Spring Harbor Symp. Quant. Biol. 47: 989–998. Allfrey V.G., Inoue A., Karn J., Johnson E.M., and Vidali G. 1974. Phosphorylation of DNA-binding nuclear acidic proteins and gene activation in the HeLa cell cycle. Cold Spring Harbor Symp. Quant. Biol. 38: 785–801. Andrulis E.D., Neiman A.M., Zappulla D.C., and Ster-nglanz R. 1998. Perinuclear localization of chromatin facilitates transcriptional silencing. Nature 394: 592–595. Andrulis E.D., Zappulla D.C., Ansari A., Perrod S., Laiosa C.V., Gartenberg M.R., and Stemglanz R. 2002. Esc1, a nuclear periphery protein required for Sir4-based plasmid anchoring and partitioning. Mol. Cell. Biol. 22: 8292–8301. Aparicio O.M. and Gottschling D.E. 1994. Overcoming telomeric silencing: A trans-activator competes to establish gene expression in a cell cycle-dependent way. Genes Dev. 8: 1133–1146. Ariel M., Selig S., Brandeis M., Kitsberg D., Kafri T., Weiss A., Keshet I., Razin A., and Cedar H. 1993. Allele-specific structures in the mouse Igf2-H19 domain. Cold Spring Harbor Symp. Quant. Biol. 58: 307–313. Bell A., Boyes J., Chung J., Pikaart M., Prioleau M.N., Recillas F., Saitoh N., and Felsenfeld G. 1998. The establishment of active chromatin domains. Cold Spring Harbor Symp. Quant. Biol 63: 509–514. Bell S.P., Marahrens Y., Rao H., and Stillman B. 1993. The replicon model and eukaryotic chromosomes. Cold Spring Harbor Symp. Quant. Biol. 58: 435–442. Belote J.M., McKeown M.B., Andrew D.J., Scott T.N., Wolfner M.F., and Baker B.S. 1985. Control of sexual differentiation in Drosophila melanogaster. Cold Spring Harbor Symp. Quant Biol. 50: 605–614. Beutler E. 1964. Gene inactivation: The distribution of gene products among populations of cells in heterozygous humans. Cold Spring Harbor Symp. Quant. Biol. 29: 261–271. Bird A.P. 1993. Functions for DNA methylation in vertebrates. Cold Spring Harbor Symp. Quant. Biol. 58: 281–285. Borst P., Gommers-Ampt J.H., Ligtenberg M.J., RudenkoG., Kieft R., Taylor M.C., Blundell P.A., and van Leeuwen F. 1993. Control of antigenic variation in African trypanosomes. Cold Spring Harbor Symp. Quant. Biol. 58: 105–114. Brink R.A. 1958. Paramutation at the R locus in maize. Cold Spring Harbor Symp. Quant. Biol. 23: 379–391. Campbell A. 1981. Some general questions about movable elements and their implications. Cold Spring Harbor Symp. Quant. Biol. 45: 1–9. Cattanach B.M. and Kirk M. 1985. Differential activity of maternally and paternally derived chromosome regions in mice. Nature 315: 496–498. Cedar H., Stein R., Gruenbaum Y., Naveh-Many T., Sciaky-Gallili N., and Razin A. 1983. Effect of DNA methylation on gene expression. Cold Spring Harbor Symp. Quant. Biol. 47: 605–609. Chambon P. 1978. Summary: The molecular biology of the eukaryotic genome is coming of age. Cold Spring Harbor Symp. Quant. Biol. 42: 1209–1234. Cheng T.H. and Gartenberg M.R. 2000. Yeast heterochromatin is a dynamic structure that requires silencers continuously. Genes Dev. 14: 452–463. CheutinT, McNaim A.J., Jenuwein T, Gilbert D.M., Singh P.B., and Misteli T. 2003. Maintenance of stable heterochromatin domains by dynamic HP1 binding. Science 299: 721–725. Clark D., Reitman M., Studitsky V., Chung J., Westphal H., Lee E., and Felsenfeld G. 1993. Chromatin structure of transcriptionally active genes. Cold Spring Harbor Symp. Quant. Biol. 58: 1–6. Cockell M., Gotta M., Palladino P., Martin S.G., and Gasser S.M. 1998. Targeting Sir proteins to sites of action: A general mechanism for regulated repression. Cold Spring Harbor Symp. Quant. Biol. 63: 401-412 CuthbertG.L., Daujat S., Snowden A. W.. Erdjument-Bromage H., Hagiwara T, Yamada M., Schneider R., Gregory P.D., Tempst P., Bannister A.J., and Kouzarides T. 2004. Histone deimination antagonizes arginine methylation. Cell 118: 545–553. Dion M.F., Altschuler S.J., Wu L.F., and Rando O.J. 2005. Genomic characterization reveals a simple histone H4 acetylation code. Proc. Natl. Acad. Sci. 102: 5308–5309. Doerfler W., Kruczek I., Eick D., Vardimon L, and Kron B. 1983. DNA methylation and gene activity: The adenovirus system as a model. Cold Spring Harbor Symp. Quant. Biol. 47: 593–603. Feinberg A.P., Kalikin L.M., Johnson L.A., and Thompson J.S. 1994. Loss of imprinting in human cancer. Cold Spring Harbor Symp. Quant. Biol. 59: 357–364. Fox C.A., Loo S., Rivier D.H., Foss M.A., and Rine J. 1993. A transcriptional silencer as a specialized origin of replication that establishes functional domains of chromatin. Cold Spring Harbor Symp. Quant. Biol. 58: 443–455. Frankel J 1990. Positional order and cellular handedness. J. Cell Sci. 97: 205–211. Gartler S.M., and Linder D. 1964. Selection In mammalian mosaic cell populations. Cold Spring Harbor Symp. Quant. Biol. 29: 253–260. Gasser S.M., Hediger R., Taddei A., Neumann F.R., and Gartenberg M.R. 2004. The function of telomere clustering in yeast: The circe effect. Cold Spring Harbor Symp. Quant. Biol. 69: 327–337. Georges M., Charlier C, Smit M., Davis E., Shay T., Tordoir X., Takeda H., Caiment R, and Cockett N. 2004. Toward molecular understanding of polar overdominance at the ovine callipyge locus. Cold Spring Harbor Symp. Quant. Biol. 69: 477–483. Goldschmidt R.B. 1951. The theory of the gene: Chromosomes and genes. Cold Spring Harbor Symp. Quant. Biol. 16: 1-11. Haber J.E., Weiffenbach B., Rogers D.T., McCusker J., and Rowe L.B. 1981. Chromosomal rearrangements accompanying yeast mating-type switching: Evidence for a gene-conversion model. Cold Spring Harbor Symp. Quant. Biol. 45: 991-1002. Haig D. 2004. The (dual) origin of epigenetics. Cold Spring Harbor Symp. Quant. Biol. 69: 67. HenikoffS. 1990. Position-effect variegation after 60 years. Trends Genet. 6: 422–426. HenikoffS., McKittrick E., and Ahmad K. 2004. Epigenetics, histone H3 variants, and the inheritance of chromatin states. Cold Spring Harbor Symp. Quant. Biol. 69: 235–243. Hemday A.D.. Braaten B.A., and Low D.A. 2003. The mechanism by which DNA adenine methylase and PapI activate the pap epigenetic switch. Mol. Cell 12: 947–957. Hodgkin J., Doniach T., and Shen M. 1985. The sex determination pathway in the nematode Caenorhabditis elegans: Variations on a theme. Cold Spring Harbor Symp. Quant. Biol. 50: 585–593. Imai S., Johnson F.B., Marciniak R.A., McVey M., Park P.U., and Guarente L. 2000. Sir2: An NAD-dependent histone deacetylase that connects chromatin silencing, metabolism, and aging. Cold Spring Harbor Symp. Quant. Biol. 65: 297–302. Jenuwein T. and Allis CD. 2001. Translating the histone code. Science 293: 1074–1080. Klar A.J., and Bonaduce M.J. 1993. The mechanism of fission yeast mating-type interconversion: Evidence for two types of epigenet-ically inherited chromosomal imprinted events. Cold Spring Harbor Symp. Quant. Biol. 58: 457–465. Klar A.J., Hicks J.B., and Strathem J.N. 1981. Irregular transpositions of mating-type genes in yeast. Cold Spring Harbor Symp. Quant. Biol. 45: 983–990. Kubicek S. and Jenuwein T. 2004. A crack in histone lysine methylation. Cell 119: 903–906. La Volpe A., Taggart ML, Macleod D., and Bird A. 1983. Coupled demethylation of sites in a conserved sequence of Xenopus ribosomal DNA. Cold Spring Harbor Symp. Quant. Biol. 47: 585–592. Laroche X., Martin S.G., Gotta M., Gorham H.C., Pryde F.E., Louis E.J., and Gasser S.M. 1998. Mutation of yeast Ku genes disrupts the subnuclear organization of telomeres. Curr. Biol. 8: 653–656. Laurenson P. and Rine J. 1992. Silencers, silencing, and heritable transcriptional states. Microbiol. Rev. 56: 543–560. Lewis E.B. 1985. Regulation of the genes of the bithorax complex in Drosophila. Cold Spring Harbor Symp. Quant. Biol. 50: 155–164. Li E., Beard C, Forster A.C., BestorT.H., and Jaenisch R. 1993. DNA methylation, genomic imprinting, and mammalian development. Cold Spring Harbor Symp. Quant. Biol. 58: 297–305. Locke J., Kotarski M.A., and Tartof K.D. 1988. Dosage-dependent modifiers of position effect variegation in Drosophila and a mass action model that explains their effect. Genetics 120: 181–198. Lolle S.J., Victor J.L., Young J.M., and Pruitt R.E. 2005. Genome-wide non-mendelian inheritance of extra-genomic information in Arabidopsis. Nature 434: 505–509. Losick R. 1998. Summary: Three decades after sigma. Cold Spring Harbor Symp. Quant. Biol. 63: 653–666. Louie A.J., Candido E.P., and Dixon G.H. 1974. Enzymatic modifications and their possible roles in regulating the binding of basic proteins to DNA and in controlling chromosomal structure. Cold Spring Harbor Symp. Quant. Biol. 38: 803–819. Lyon M.R. 1961. Gene action in the X-chromosome of the mouse (Mus musculus L.). Nature 190: 372–373. Lyon M.R. 1961. Epigenetic inheritance in mammals. Trends Genet. 9: 123–128. Maine E.M., Salz H.K., Schedl P., and Cline T.W. 1985. Sex-lethal, a link between sex determination and sexual differentiation in Drosophila melanogaster. Cold Spring Harbor Symp. Quant. Biol. 50: 595–604. Martin-Morris L.E., Loughney K., Kershisnik E.O., Poortinga G., and HenikoffS. 1993. Characterization of sequences responsible for trans-inactivation of the Drosophila brown gene. Cold Spring Harbor Symp. Quant. Biol. 58: 577–584. McClintock B. 1951. Chromosome organization and genic expression. Cold Spring Harbor Symp. Quant. Biol. 16: 13–47. McClintock B. 1956. Controlling elements and the gene Cold Spring Harbor Symp. Quant. Biol. 21: 197–216. Megee P.C., Morgan B.A., and Smith M.M. 1995. Histone H4 and the maintenance of genome integrity. Genes Dev. 9: 1716–1727. Millar C.B., Kurdistani S.K., and Grunstein M. 2004. Acetylation of yeast histone H4 lysine 16: A switch for protein interactions in heterochromatin and euchromatin. Cold Spring Harbor Symp. Quant. Biol. 69: 193–200. Mirkovitch J., Gasser S.M., and Laemmli U.K. 1987. Relation of chromosome structure and gene expression. Philos. Trans. R. Soc. Lond. B Biol. Sci. 317: 563–574. Mostoslavsky R., Kirillov A., Ji Y.H., Goldmit M., Holzmann M., Wirth T., Cedar H., and Bergman Y. 1999. Demethylation and the establishment of k allelic exclusion Cold Spring Harbor Symp. Quant. Biol. 64: 197–206. Muller H.J. 1941. Induced mutations in Drosophila. Cold Spring Harbor Symp. Quant. Biol. 9: 151–167. Nance W.E. 1964. Genetic tests with a sex-linked marker: Glucose 6-phosphate dehydrogenase. Cold Spring Harbor Symp. Quant. Biol. 29: 415–425. Nanney D.L. 1958. Epigenetic factors affecting mating type expression in certain ciliates. Cold Spring Harbor Symp. Quant. Biol. 23: 327–335. Nasmyth K.A., Tatchell K., Hall B.D., Astell C., and Smith M. 1981. Physical analysis of mating-type loci in Saccharomyces cerevisiae. Cold Spring Harbor Symp. Quant. Biol. 45: 961–981. Palladino E., Laroche T., Gilson E., Pillus L., and Gasser S.M. 1993. The positioning of yeast telomeres depends on SIR3, SIR4, and the integrity of the nuclear membrane. Cold Spring Harbor Symp. Quant. Biol. 58: 733–746. Pannetier C., Hu-Li J., and Paul W.E. 1999. Bias in the expression of IL-4 alleles: The use of T cells from a GFP knock-in mouse. Cold Spring Harbor Symp. Quant. Biol. 64: 599–602. Peacock W.J., Brutlag D., Goldring E., Appels R., Hinton C.W., and Lindsley D.L. 1974. The organization of highly repeated DNA sequences in Drosophila melanogaster chromosomes. Cold Spring Harbor Symp. Quant. Biol. 38: 405–416. Pillus L. and Rine J. 1989. Epigenetic inheritance of transcriptional states in S. cerevisiae. Cell 59: 637–647. Ptashne M. 2004. A genetic switch: Phage lambda revisited, 3rd edition. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York. Renauld H., Aparicio O.M., Zierath P.D., Billington B.L., Chhablani S.K., and Gottschling D.E. 1993. Silent domains are assembled continuously from the telomere and are defined by promoter distance and strength, and by SIR3 dosage. Genes Dev. 7: 1133–1145. Rine J., Jensen R., Hagen D., Blair L., and Herskowitz I. 1981. Pattern of switching and fate of the replaced cassette in yeast mating-type interconversion. Cold Spring Harbor Symp. Quant. Biol. 45: 951–960. Rubin G.M. 1985. Summary. Cold Spring Harbor Symp. Quant. Biol. 50: 905–908. Rubin G.M., HazelriggT., Karess R.E., Laski F.A., Laverty T., Levis R., Rio D.C., Spencer F.A., and Zuker C.S. 1985. Germ line specificity of P-element transposition and some novel patterns of expression of transduced copies of the white gene. Cold Spring Harbor Symp. Quant. Biol. 50: 329–335. Rudkin G.T. and Tartof K.D. 1974. Repetitive DNA in polytene chromosomes of Drosophila melanogaster Cold Spring Harbor Symp. Quant. Biol. 38: 397–403. Schubeler D., MacAlpine D.M., Scalzo D., Wirbelauer C., Kooper-berg C, van Leeuwen R, Gottschling D.E., O’Neill L.P., Turner B.M., Delrow J., et al. 2004. The histone modification pattern of active genes revealed through genome-wide chromatin analysis of a higher eukaryote. Genes Dev. 18: 1263–1271. Schultz J. 1956. The relation of the heterochromatic chromosome regions to the nucleic acids of the cell. Cold Spring Harbor Symp. Quant. Biol. 21: 307-328 Selker E.U., Richardson G.A., Garrett-Engele P.W., Singer M.J., and Miao V. 1993. Dissection of the signal for DNA methylation in the ζ-η) region of Neurospora. Cold Spring Harbor Symp. Quant. Biol. 58: 323–329. Shapiro L.J. and Mohandas T. 1983. DNA methylation and the control of gene expression on the human X chromosome Cold Spring Harbor Symp. Quant. Biol. 47: 631–637. Shi Y., Lan E., Matson C., Mulligan P., Whetstine J.R., Cole P.A., and Casero R.A. 2004. Histone demethylation mediated by the nuclear amine oxidase homolog LSD1. Cell 119: 941–953. Si K., Lindquist S., and Kandel E. 2004. A possible epigenetic mechanism for the persistence of memory. Cold Spring Harbor Symp. Quant. Biol. 69: 497–498. Solter D., Aronson J., Gilbert S.F, and McGrath J. 1985. Nuclear transfer in mouse embryos: Activation of the embryonic genome. Cold Spring Harbor Symp. Quant. Biol. 50: 45–50. Swift H. 1974. The organization of genetic material in eukaryotes: Progress and prospects. Cold Spring Harbor Symp. Quant. Biol. 38: 963–979. Thompson J.S., Hecht A., and Grunstein M. 1993. Histones and the regulation of heterochromatin in yeast. Cold Spring Harbor Symp. Quant. Biol. 58: 247–256. Tilghman S.M., Bartolomei M.S., Webber A.L., Brunkow M.E., Saam J., Leighton P.A., Pfeifer K., and Zemel S. 1993. Parental imprinting of the H19 and Igf2 genes in the mouse. Cold Spring Harbor Symp. Quant. Biol. 58: 287–295. Vazquez J., Farkas G., Gaszner M., Udvardy A., Muller M., Hag-strom K., Gyurkovics H., Sipos L., Gausz J., Galloni M., et al. 1993. Genetic and molecular analysis of chromatin domains. Cold Spring Harbor Symp. Quant. Biol. 58: 45–54. Wade P.A., Jones P.L., Vermaak D., Veenstra G.J., Imhof A., Sera T., Tse C., Ge H., Shi Y.B., Hansen J.C., and Wolffe A.P. 1998. Histone deacetylase directs the dominant silencing of transcription in chromatin: Association with MeCP2 and the Mi-2 chromodomain SWI/SNF ATPase. Cold Spring Harbor Symp. Quant Biol. 63: 435–445. Wang Y., Wysocka J., Perlin J.R., Leonelli L., Allis C.D., and Coonrod S.A. 2004. Linking covalent histone modifications to epigenetics: The rigidity and plasticity of the marks. Cold Spring Harbor Symp. Quant. Biol. 69: 161–169. Weintraub H. 1974. The assembly of newly replicated DNA into chromatin. Cold Spring Harbor Symp. Quant. Biol. 38: 247–256. Weintraub H. 1993. Summary: Genetic tinkering local problems, local solutions. Cold Spring Harbor Symp. Quant. Biol. 58: 819–836. Weintraub H., Flint S.J., Leffak I.M., Groudine M., and Grainger R.M. 1978. The generation and propagation of variegated chromosome structures. Cold Spring Harbor Symp. Quant. Biol. 42: 401–407. Wickner R.B., Edskes H.K., Rosj> E.D., Pierce M.M., Baxa U., Brachmann A., and Shewmaker F. 2004a. Prion genetics: New rules for a new kind of gene. Annu. Rev. Genet. 38: 681–707. Wickner R.B., Edskes H.K., Ross E.D., Pierce M.M., Shewmaker P., Baxa U., and Brachmann A. 2004b. Prions of yeast are genes made of protein: Amyloids and enzymes Cold Spring Harbor Symp. Quant. Biol. 69: 489–496. Willard H.F., Brown C.J., Carrel L., Hendrich B., and Miller A. P. 1993. Epigenetic and chromosomal control of gene expression: Molecular and genetic analysis of X chromosome inactivation. Cold Spring Harbor Symp. Quant. Biol. 58: 315–322. Wood W.B., Meneely P., Schedin P., and Donahue L. 1985. Aspects of dosage compensation and sex determination in Caenorhabditis elegans. Cold Spring Harbor Symp. Quant. Biol. 50: 575–583. Yarmolinsky M.B. 1981. Summary. Cold Spring Harbor Symp. Quant. Biol. 45: 1009–1015. Zheng C., and Hayes J.J. 2003. Structures and interactions of the core histone tail domains. Biopolymers 68: 539–546.Глава 2. Краткая история эпигенетики
Gary Felsenfeld National Institute of Diabets and Digestive and Kidney, National Institute of Heath, Bethesda, Maryland 20892-0541. Введение
История эпигенетики связана с исследованиями эволюции и развития. Но за последние 50 лет значение самого термина «эпигенетика» претерпело эволюцию, сопоставимую с резко возросшим пониманием молекулярных механизмов, лежащих в основе регуляции экспрессии генов у эукариот. Наше современное рабочее определение выглядит следующим образом: «Изучение митотически и (или) мейотически наследуемых изменений в генной функции, которые нельзя объяснить изменениями в нуклеотидной последовательности ДНК» (Riggs et al., 1996). Однако до 1950-х годов слово «эпигенетика» использовали в совершенно другом смысле — для обозначения всех событий развития, ведущих от оплодотворенной зиготы к зрелому организму, то есть всех регуляторных процессов, которые, начиная с генетического материала, формируют конечный продукт (Waddington 1953). Эта концепция берет свое начало в гораздо более ранних исследованиях в области клеточной биологии и эмбриологии, начиная с конца XIX столетия, которые заложили фундамент нашего сегодняшнего понимания взаимоотношений между генами и развитием. Долгое время среди эмбриологов шли горячие споры о природе и локализации компонентов, ответственных за реализацию плана развития организма. В своих попытках осмыслить большое число остроумных, но в конечном счете противоречивых экспериментов по манипулированию с клетками и зародышами эмбриологи разделились на две школы: на тех, кто думал, что каждая клетка содержит преформированные элементы, которые в ходе развития лишь увеличиваются в размерах, и тех, кто полагал, что этот процесс включает химические реакции между растворимыми компонентами, которые и реализуют сложный план развития. Эти воззрения сфокусировались на относительном значении ядра и цитоплазмы в процессе развития. Вслед за открытием существования хромосом, сделанным Флемингом в 1879 году, опыты, проведенные многими исследователями, в том числе Вильсоном и Бовери, дали надежное доказательство того, что программа развития находится в хромосомах. В конечном счете, Томас Гент Морган (Morgan, 1911) привел наиболее убедительные доказательства этой идеи, продемонстрировав генетическое сцепление нескольких генов Drosophila с Х-хромосомой. Начиная с этого момента, был достигнут быстрый прогресс в создании линейных карт хромосом, в которых отдельные гены были локализованы в специфических сайтах на хромосомах Drosophila (Sturtevant, 1913). Конечно, оставались без ответа классические вопросы «эпигенеза»: какие молекулы внутри хромосом несут генетическую информацию, каким образом они направляют программу развития и как эта информация передается при клеточном делении. Было известно, что в хромосомах присутствуют и нуклеиновая кислота, и белки, но их относительный вклад не был очевиден; конечно, никто не верил, что нуклеиновая кислота одна может нести всю информацию о развитии. Более того, оставались более старые вопросы о возможном вкладе цитоплазмы в процессы развития. Данные генетики Drosophila (см. ниже) заставляли считать, что наследуемые изменения в фенотипе могут происходить без соответствующих изменений в «генах». Характер этих дискуссий резко изменился, когда ДНК была идентифицирована как основной носитель генетической информации. В конечном счете оказалось полезным переопределить эпигенетику таким образом, чтобы различать те наследуемые изменения, которые возникают в результате изменений в нуклеотидной последовательности ДНК, и те, которые с ними не связаны.2. Ключи от генетики и биологии развития
Что бы ни происходило с этим определением, с начала 20-го столетия неуклонно накапливались идеи и научные данные, лежащие в основе современного понятия «эпигенетика». В 1930 году Герман Меллер (Muller, 1930) описал у Drosophila класс мутаций, которые он назвал «eversporting displacements» («eversporting» в данном случае обозначает высокую частоту фенотипического изменения). Эти мутанты были связаны с хромосомными транслокациями (displacements), но «даже тогда, когда все части хроматина, по всей видимости, были представлены в нормальной дозе, — хотя и были ненормально расположены относительно друг друга, — фенотипический результат не всегда был нормальным». В некоторых из этих случаев Меллер наблюдал мух, у которых были пятнистые глаза. Он думал, что это, вероятно, обусловлено «генетическим разнообразием различных клеток, формирующих глаз», но дальнейший генетический анализ привел его к тому, чтобы связать необычные свойства с хромосомной перестройкой; он сделал вывод, что «с этим как-то связаны, скорее, хромосомные участки, влияющие одновременно на различные признаки, чем отдельные гены или гипотетические ”генные элементы”». На протяжении последующи× 10–20 лет убедительные данные, полученные во многих лабораториях (см. Hannah, 1951), подтвердили, что эта пятнистость, мозаичность возникает тогда, когда перестройки ставят рядом ген белых глаз и гетерохроматиновые районы. В течение этого периода хромосомные перестройки всех типов были объектом огромного внимания. Было очевидно, что гены не являются полностью независимыми сущностями; на их функционирование может влиять их локализация в геноме — как было многократно продемонстрировано на многих мутантах Drosophila, которые приводили к мозаицизму, а также на других мутантах, связанных с транслокациями в эухроматиновые районы, у которых можно было наблюдать эффекты положения более общего типа (не мозаичного). Стала также ясной — главным образом благодаря работам МакКлинток (McClintock, 1965) — роль перемещаемых элементов в генетике растений. Вторая линия доказательств берет свое начало в исследованиях процессов развития. Было очевидно, что во время развития имеет место дивергенция фенотипов среди дифференцирующихся клеток и тканей, и оказалось, что такие различные особенности фенотипа, однажды установившись, могут клонально наследоваться делящимися клетками. Хотя на этом этапе стало понятно, что существует клеточноспецифичное программирование и что оно может быть передано дочерним клеткам, было не столь очевидно, каким образом это происходит. Был придуман и рассмотрен целый ряд механизмов В частности, для исследователей-биохимиков клетка характеризовалась многочисленными взаимозависимыми биохимическими реакциями, которые поддерживают ее идентичность. Например, в 1949 году Макс Дельбрюк (Delbrbck, цит. в Jablonka and Lamb, 1995) предположил, что простая пара биохимических цепей реакций, каждая из которых продуцирует в качестве промежуточного вещества ингибитор другого пути, могла бы в результате давать систему, способную переключаться между двумя устойчивыми состояниями. Несколько позже были обнаружены реальные примеры таких систем — в Lac-опероне Escherichia coli (Novick and Wemer, 1957) и в переключении фага между лизогенным и литическим состояниями (Ptashne, 1992). Функционально эквивалентные модели можно придумать и для эукариот. Предметом живого интереса и дискуссий был, конечно, сравнительный вклад ядра и цитоплазмы в передачу дифференцированного состояния в развивающемся эмбрионе; самостабилизирующаяся цепь биохимических реакций предположительно должна была поддерживаться при делении клетки. Второй тип эпигенетической передачи был четко продемонстрирован у Paramecium и других инфузорий, у которых картина расположения ресничек могла варьировать у отдельных особей и наследоваться клонально (Beisson and Sonnebom, 1965). Результатом изменения этого кортикального паттерна с помощью микрохирургии была передача нового паттерна последующим поколениям. Было высказано предположение, что сходные механизмы работают и у многоклеточных организмов, у которых локальные цитоплазматические детерминанты влияют на организацию клеточных компонентов таким образом, что эта организация может передаваться при клеточном делении (Grimes and Aufderheide, 1991).3. Во всех соматических клетках организма ДНК одинакова
Хотя морфология хромосом показывала, что все соматические клетки обладают полным набором хромосом, было далеко не очевидно, что все соматические клетки сохраняют полный набор ДНК, присутствующий в оплодотворенном яйце. Не было даже ясно, вплоть до работ Эвери, МакЛеода и МакКарти в 1944 году (Avery et al., 1944) и Херши и Чейза (Hershey and Chase, 1952), что свободная от белков молекула ДНК может нести генетическую информацию; последний вывод получил очень сильную поддержку, когда в 1953 году Уотсон и Крик (Watson and Crick, 1953) расшифровали структуру ДНК. Работы Бриггса и Кинга (Briggs and King, 1952) на Rana pipiens и Ласки и Гердона (Laskey and Gurdon, 1970) на Xenopus продемонстрировали, что результатом введения ядра из ранних эмбриональных клеток в денуклеированные ооциты может быть развитие эмбриона. Но даже в 1970 году Ласки и Гердон могли говорить, что «предстоит еще доказать, что соматические клетки взрослого животного имеют гены помимо тех, которые необходимы для их собственного роста и дифференцировки». В статье, содержавшей это утверждение, они продолжали показывать, что в первом приближении ДНК ядра соматической клетки при введении в денуклеированную яйцеклетку способна направлять эмбриогенез. Теперь было ясно, что программа развития и специализация репертуара экспрессии, наблюдаемая в соматических клетках, должны включать сигналы, которые не являются результатом какой-то делеции или мутации в нуклеотидной последовательности ДНК зародышевого пути, когда эта ДНК передается соматическим клеткам. Конечно, существуют способы, посредством которых ДНК соматических клеток может стать отличающейся от ДНК зародышевого пути с соответствующими последствиями для фенотипа клетки: например, как показали работы Барбары МакКлинток и других генетиков растений, мобильные элементы могут изменять картину экспрессии в соматических клетках. Аналогичным образом, генерация разнообразия антител связана с перестройками ДНК в линии соматических клеток. Эта перестройка (или, точнее, ее последствия) может рассматриваться как своего рода эпигенетическое событие, сопоставимое с ранними наблюдениями эффекта положения мозаичного типа, описанного Меллером. Однако значительная часть работ по эпигенетике в последние годы была сосредоточена на системах, в которых не происходило никаких перестроек ДНК, и, следовательно, акцент делался на модификациях оснований и на белках, образующих комплексы с ДНК в ядре.4. Роль метилирования ДНК
Инактивация Х-хромосомы явилась одной из первых моделей эпигенетического механизма этого рода (Ohno et al., 1959; Lyon, 1961); в соматических клетках «молчащая» Х-хромосома явно выбиралась случайным образом, и не было никаких данных об изменениях в самой нуклеотидной последовательности ДНК. Отчасти для объяснения этого типа инактивации Риггс (Riggs, 1975) и Холлидей и Пью (Holliday and Pugh, 1975) предположили, что в качестве эпигенетической метки могло бы выступать метилирование ДНК. Ключевыми моментами этой модели были представления о том, что сайты метилирования являются палиндромными и что за метилирование немодифицированной ДНК и ДНК, уже метилированной по одной нити, отвечают разные ферменты. Постулировали, что первое событие метилирования происходит значительно труднее, чем второе; однако, коль скоро первая нить модифицирована, комплементарная нить будет быстро модифицирована в том же палиндромном сайте. Метальная метка, имевшаяся на родительской нити, после репликации могла бы копироваться на дочернюю нить, и в результате происходила бы надежная передача метилированного состояния следующему поколению. Вскоре после этого Берд воспользовался тем, что главной мишенью метилирования у животных является последовательность CpG (Doskocil and Sorm, 1962), для того чтобы предложить использовать чувствительные к метилированию ферменты рестрикции как способ выявления метилированного состояния. Последующие исследования (Bird, 1978; Bird and Southern, 1978) показали затем, что эндогенные сайты CpG были либо полностью неметилированы, либо полностью метилированы. Предсказания, сделанные на основе этой модели, были, таким образом, подтверждены: тем самым был установлен механизм эпигенетической передачи метальной метки посредством полуконсервативного воспроизведения картины метилирования. В годы, последовавшие за этими открытиями, огромное внимание было уделено эндогенным паттернам метилирования ДНК, возможной передаче этих паттернов через зародышевый путь, роли метилирования ДНК в сайленсинге генной экспрессии, возможным механизмам инициации или ингибирования метилирования в полностью неметилированном сайте и идентификации энзимов, ответственных за метилирование de novo и за поддержание метилирования на уже метилированных сайтах. Хотя значительный объем метилирования ДНК, наблюдаемый у позвоночных, связан с повторяющимися и ретровирусными последовательностями и может служить для поддержания этих последовательностей в перманентно «молчащем» состоянии, не может быть никаких сомнений в том, что во многих случаях эта модификация обеспечивает основу для эпигенетической передачи состояния генной активности. Наиболее четко это продемонстрировано на таких импринтированных локусах (Cattanach and Kirk, 1985), как локус Igf2/H19 мыши или человека, где одна аллель маркирована метилированием ДНК, которое в свою очередь контролирует экспрессию с обоих генов (Bell and Felsenfeld, 2000; Hark et al., 2000). В то же самое время было ясно, что это не может быть единственным механизмом для эпигенетической передачи информации. Например, как отмечено выше, эффект положения мозаичного типа наблюдали за много лет до этого у Drosophila — организма, который обладает крайне низким уровнем метилирования ДНК. Более того, в последующие годы генетики, работавшие с Drosophila, идентифицировали группы генов Polycomb и Trithorax, которые, по-видимому, участвуют в постоянном «запирании» («locking in») состояния активности кластеров генов в ходе развития (либо «выключеного», либо «включенного», соответственно). Тот факт, что эти состояния стабильно передавались в ходе клеточного деления, позволял предполагать, что в основе этого лежит эпигенетический механизм.5. Роль хроматина
Многие годы признавалось, что белки, связанные с ДНК в эукариотном ядре, особенно гистоны, могут участвовать в модификации свойств ДНК Задолго до начала работ по метилированию ДНК Стедман и Стедман (Stedman and Stedman, 1950) предположили, что гистоны могут действовать как общие репрессоры экспрессии генов. Они писали, что поскольку все соматические клетки организма имеют одно и то же число хромосом, они имеют одинаковыйгенетический набор (хотя, как отмечается выше, это оставалось не доказанным еще несколько лет). Понимание тонкой природы модификаций гистонов было в далекой перспективе, так что Стедманы оперировали предположением, что разные типы клеток в организме, чтобы генерировать наблюдаемые различия в фенотипе, должны обладать различными типами гистонов. Гистоны действительно могут снижать содержание транскриптов до уровней гораздо ниже тех, что наблюдаются для неактивных генов у прокариот. Последующая работа была направлена на способность хроматина служить матрицей для транскрипции и на решение вопроса о том, ограничена ли эта способность специфичным для клеточного типа образом. В работе 1963 года Боннер (Bonner et al, 1963) приготовил хроматин из продуцирующей глобулин ткани растения гороха и показал, что, когда добавляли PH К-полимеразу из Е. coli и получающийся в результате транскрипт транслировали в системе in vitro, можно было выявить глобулин Такой результат был специфичен для данной ткани. С пришествием методов гибридизации в таких экспериментах in vitro можно было исследовать популяции транскриптов (Paul and Gilmour, 1968); они оказались специфичными для той конкретной ткани, из которой был получен хроматин. Другие результаты позволяли предполагать, что эта специфичность отражает ограничения в доступе к сайтам инициации транскрипции (Cedar and Felsenfeld, 1973). Тем не менее, был период, когда все полагали, что гистоны являются супрессорными белками, которые пассивно подавляют экспрессию генов. С этой точки зрения, активация гена означает просто «сдирание» с него гистонов; считалось, что коль скоро это сделано, транскрипция будет осуществляться почти как у прокариот. Имелись, однако, некоторые данные о том, что в эукариотических клетках нет более или менее протяженных районов открытой ДНК (Clark and Fesenfeld, 1971). Более того, даже если модель «голой» ДНК является правильной, было неясно, каким образом принимается решение о том, какие из покрытых гистонами участков должны быть очищены. Решение этой проблемы началось еще в 1964 году, когда Олфри (Allfrey et al., 1964) высказал спекулятивное соображение, что с активацией генов могло бы коррелировать ацетилирование гистонов и что «активный» хроматин не обязательно должен быть лишен гистонов. В последующее за этим десятилетие наблюдался огромный интерес к изучению взаимоотношений между модификациями гистонов и экспрессией генов. Были идентифицированы иные, чем ацетилирование, модификации (метилирование и фосфорилирование), но их функциональное значение оставалось неясным. Исследовать эту проблему стало гораздо легче после открытия Корнбергом и Томасом (Kornberg and Thomas, 1974) структуры нуклеосомы, фундаментальной субъединицы хроматина. Определение кристаллической структуры нуклеосомы, сначала с разрешением 7 Е, а потом с разрешением 2.8 Е также дало важную структурную информацию, в частности данные о вытягивании аминотерминальных «хвостов» гистонов за пределы кора «ДНК — белковый октамер», что делало очевидной их доступность для модификаций (Richmond et al., 1984; Luger et al., 1997). Начав в 1980 году и продолжив свои исследования на протяжении еще нескольких лет, Грунштейн (Grunstein) и его сотрудники (Wallis et al., 1980; Durrin et al., 1991), применив генетический анализ на дрожжах, смогли показать, что аминотерминальные «хвосты» гистонов имеют важное значение для регуляции экспрессии генов и для формирования «молчащих» доменов хроматина. Окончательная привязка к детальным механизмам началась с того, что Эллис (Allis) (Brownell et al., 1996) показал, что ацетилтрансфераза гистонов из Tetrahymena гомологична регулятору транскрипции у дрожжей, белку Gcn5; это явилось прямым доказательством того, что ацетилирование гистонов связано с контролем экспрессии генов. С тех пор, конечно, произошел буквально взрыв открытий модификаций гистонов, а также переоценка роли тех из них, которые уже были известны прежде. Все это еще не было ответом на вопрос о том, каким образом сайты для модификации выбираются in vivo. Было показано, например (Pazin et al., 1994), что Gal4-VP16 может активировать транскрипцию с реконструированной хроматиновой матрицы зависимым от АТФ образом. Активация сопровождалась репозиционированием нуклеосом, и было высказано предположение, что это является критическим событием в обеспечении доступности промотора. Для более полного понимания значения этих открытий потребовалась идентификация АТФ-зависимых комплексов ремоделинга нуклеосом, таких как SW1/SNF и NURF (Peterson and Herskowitz, 1992; Tsuiyama and Wu, 1995), и понимание того, что в подготовке хроматиновой матрицы к транскрипции участвуют и модификации гистонов, и ремоделинг нуклеосом. Оставалось неясным, каким образом, с использованием этих механизмов, информация о состоянии активности могла бы передаваться при клеточном делении; была, таким образом, неясна их роль в эпигенетической передаче информации. Следующим важным шагом стало понимание того, что модифицированные гистоны рекрутируют специфичным в отношении данной модификации образом белки, которые могут влиять на локальные структурные и функциональные состояния хроматина. Было, например, обнаружено, что метилирование лизина 9 в гистоне H3 приводит к рекрутированию белка НР1 гетерохроматина (Bannister et al., 2001; Lachner et al., 2001; Nakayama et al., 2001). Более того, HP1 мог рекрутировать энзим (Suv39hl), отвечающий за метилирование. Это привело к созданию модели воспроизведения сайленсированного состояния хроматина по всему данному участку посредством процессивного [processive] механизма (рис. 2.1а). В равной степени важно, что это обеспечило разумное объяснение того, каким образом это состояние может быть передано и сохранено в цикле репликации (рис. 2.16). Были предложены аналогичные механизмы для воспроизведения активного состояния, включающие метилирование лизина 4 в гистоне H3 и рекрутирование белков группы Trithorax (Wysocka et al., 2005). Были предложены различные типы механизмов воспроизведения, которые зависели не от модифицированных, а от вариантных гистонов (Ahmad and Henikoff, 2002; McKittrick et al., 2004). Гистон H3 включается в хроматин только во время репликации ДНК. Напротив, вариант этого гистона, H3.3, отличающийся от H3 четырьмя аминокислотами, включается в нуклеосомы не зависящим от репликации образом и имеет тенденцию накапливаться в активном хроматине, где он обогащается «активными» модификациями гистонов (McKittrick et al., 2004). Предположили, что для поддержания активного состояния достаточно присутствия H3.3 и что после репликации остается достаточно H3.3 для поддержания активного состояния, хотя он и разбавляется вдвое. Последующая транскрипция приводила бы к замещению нуклеосом, содержащих H3, вариантом H3.3, воспроизводя таким образом это активное состояние в следующем поколении.6. Все механизмы взаимосвязаны
В этих моделях в конечном счете начала замыкаться связь между модифицированными или вариантными гистонами, активацией специфических генов и эпигенетикой, хотя, конечно, многое еще остается сделать. В то время как эти механизмы дают нам какие-то представления о том, как состояние гетерохроматина может поддерживаться, они не объясняют, каким образом структуры «молчащего» хроматина устанавливаются впервые. Лишь недавно стало ясно, что это связано с продукцией РНК-транскриптов, особенно с повторяющихся последовательностей, которые подвергаются процессингу в малые РНК благодаря действию таких белков, как Dicer, Argonaute и РНК-зависимая РНК-полимераза. Впоследствии эти РНК рекрутируются в гомологичные сайты ДНК как часть комплексов, включающих компоненты группы белков Polycomb, инициируя таким образом формирование гетерохроматина. Сейчас имеются также данные о том, что для поддержания по крайней мере некоторых гетерохроматиновых районов требуются те же механизмы. В известном смысле эти устойчивые циклические цепи реакций напоминают предложенную Дельбрюком модель 50-летней давности — модель устойчивого биохимического цикла, поддерживающего данное состояние организма. Рис. 2.1. Механизмы поддержания паттерна метилирования ДНК и модификаций гистонов в ходе репликации ДНК
(а) механизм поддержания паттерна метилирования ДНК в ходе репликации ДНК. Во время репликации отдельные нити ДНК, со специфическим паттерном метилирования в остатках CpG или CpXpG, спариваются с нитью вновь синтезированной, неметилированной ДНК. CpG на одной нити имеет соответствующий CpG на другой. Поддерживающая ДНК-метилтрансфераза распознает полуметилированный сайт и метилирует цитозин на новой нити, так что паттерн метилирования не нарушается; (б) общий механизм для поддержания модификаций гистонов в ходе репликации. Модифицированный гистоновый «хвост» (m) взаимодействует с белком-связкой (pb — a protein binder), имеющим сайт связывания, специфичный для данной модификации, pb. в свою очередь, имеет специфический сайт для энзима (е), который выполняет эту модификацию гистона, т. е. в свою очередь, может затем модифицировать соседнюю нуклеосому. Во время репликации вновь откладывающиеся гистоны, которые перемежаются с родительскими гистонами, могут таким образом приобретать данную родительскую модификацию. Сходный механизм мог бы обеспечить воспроизведение, распространение модификаций гистонов с модифицированного на немодифицированный участок на любой стадии клеточного цикла
Рис. 2.1. Механизмы поддержания паттерна метилирования ДНК и модификаций гистонов в ходе репликации ДНК
(а) механизм поддержания паттерна метилирования ДНК в ходе репликации ДНК. Во время репликации отдельные нити ДНК, со специфическим паттерном метилирования в остатках CpG или CpXpG, спариваются с нитью вновь синтезированной, неметилированной ДНК. CpG на одной нити имеет соответствующий CpG на другой. Поддерживающая ДНК-метилтрансфераза распознает полуметилированный сайт и метилирует цитозин на новой нити, так что паттерн метилирования не нарушается; (б) общий механизм для поддержания модификаций гистонов в ходе репликации. Модифицированный гистоновый «хвост» (m) взаимодействует с белком-связкой (pb — a protein binder), имеющим сайт связывания, специфичный для данной модификации, pb. в свою очередь, имеет специфический сайт для энзима (е), который выполняет эту модификацию гистона, т. е. в свою очередь, может затем модифицировать соседнюю нуклеосому. Во время репликации вновь откладывающиеся гистоны, которые перемежаются с родительскими гистонами, могут таким образом приобретать данную родительскую модификацию. Сходный механизм мог бы обеспечить воспроизведение, распространение модификаций гистонов с модифицированного на немодифицированный участок на любой стадии клеточного цикла
Мы знаем теперь бесчисленные примеры эпигенетических механизмов, работающих в организме. Кроме импринтинга во многих локусах и описанной выше аллель-специфичной и случайной инактивации Х-хромосомы существуют эпигенетические явления, связанные с экспрессией антител, где селективно подавляется перестройка генов иммуноглобулина в одной хромосоме, и с выбором для экспрессии генов рецепторов индивидуальных одорантов в обонятельных нейронах (Chess et al., 1994; Shykind et al., 2004). У Drosophila гены группы Polycomb ответственны за установление домена «молчащего» хроматина, который поддерживается на протяжении всех последующих клеточных делений. Эпигенетические изменения отвечают также за парамутации у растений, при которых одна аллель может вызывать наследуемое изменение в экспрессии гомологичной аллели (Stam et al., 2002). Это пример эпигенетического состояния, которое наследуется как митотически, так и мейотически — феномен, хорошо документированный у растений, но лишь изредка встречающийся у животных (Jorgensen, 1993). Значительная часть доказательств существования описанных выше механизмов получена в работах по сайленсированию локуса типа спаривания и центромерных последовательностей у Schizosaccharomyces pombe (Hall et al., 2002). Кроме того, было показано, что структура конденсированного хроматина, характерная для центромер у таких разных организмов, как мухи и люди, может быть передана через ассоциированные с центромерой белки, а не через нуклеотидную последовательность ДНК. Во всех этих случаях нуклеотидная последовательность ДНК остается интактной, но ее способность к экспрессии подавляется. Весьма вероятно, что во всех случаях это опосредуется метилированием ДНК, модификациями гистонов или обоими этими механизмами; в некоторых случаях мы уже знаем, что это действительно так. Наконец, представление об эпигенетической передаче кортикальных «паттернов», описанных выше для парамеций, распространилось теперь на прионные белки, которые поддерживают и воспроизводят свое альтернативное состояние фолдинга в дочерних клетках Хотя все это было представлено в виде последовательного рассказа, более правильным был бы взгляд на эти события, как на ряд параллельных и перекрывающихся попыток определить и объяснить эпигенетические явления. Определение термина «эпигенетика» изменилось, но вопросы относительно механизмов развития, поставленные более ранними поколениями ученых, остались прежними. Современная эпигенетика все еще обращается к этим центральным вопросам. Семьдесят лет прошло с тех пор, как Меллер описал явление, называемое сейчас эффектом положения мозаичного типа. Доставляет удовольствие проследить этот медленный прогресс от наблюдения фенотипов, через элегантные генетические исследования, к современному анализу и решению проблем на молекулярном уровне. Вместе с этими знаниями пришло понимание того, что в действительности эпигенетические механизмы могут отвечать за значительную часть фенотипа сложных организмов. Как нередко случается, наблюдение, показавшееся вначале хотя и интересным, но, возможно, маргинальным по отношению к главным проблемам, оказывается центральным, хотя для осознания этого может понадобиться много времени.
Литература
Ahmad K. and HenikoffS. 2002. The histone variant H3. 3 marks active chromatin by replication-independent nucleosome assembly. Mol. Cell. 9: 1191–1200. Allfrey V. G., Faulkner R., and Mirsky A. E. 1964. Acetylation and methylation of histones and their possible role in the regulation of RNA synthesis. Proc. Natl. Acad. Sci. 51: 786–794. Avery O. T., MacLeod CM., and McCarty M. 1944. Studies on the chemical nature of the substance inducing transformation of pneumococcal types. J. Exp. Med. 79: 137–158. Bannister A., Zegerman P., Partridge J., Miska E., Thomas J., Allshire R., and Kouzarides T. 2001. Selective recognition of methylated lysine 9 on histone H3 by the HP1 chromo domain. Nature 410: 120–124. Beisson J. and Sonnebom T. M. 1965. Cytoplasmic inheritance of the organization of the cell cortex in Paramecium aurelia. Proc. Natl. Acad. Sci. 53: 275–282. Bell A. C. and Felsenfeld G. 2000. Methylation of a CTCF-dependent boundary controls imprinted expression of the lgf2 gene. Nature 405: 482–485. Bird A. P. 1978. Use of restriction enzymes to study eukaryotic DNA methylation. II. The symmetry of methylated sites supports semi-conservative copying of the methylation pattern. J. Mol. Biol. 118: 49–60. Bird A. P. and Southern E. M. 1978. Use of restriction enzymes to study eukaryotic DNA methylation. I. The methylation pattern in nbosomal DNA from Xenopus laevis. J. Mol. Biol. 118: 27–47. Bonner J., Huang R. C., and Gilden R. V. 1963. Chromosomally directed protein synthesis. Proc. Natl. Acad. Sci. 50: 893–900. Briggs R. and King T. J. 1952. Transplantation of living nuclei from blastula cells into enucleated frogs’ eggs. Proc. Natl. Acad. Sci. 38: 455–463. Brownell J. E., Zhou J., Ranalli T, Kobayashi R., Edmondson D. G., Roth S. Y., and Allis C. D. 1996. Tetrahymena histone acetyltransferase A: A homolog to yeast Gcn5p linking histone acetylation to gene activation. Cell 84: 843–851. Cattanach B. M. and Kirk M. 1985. Differential activity ol maternally and paternally derived chromosome regions in mice. Nature 315: 496–498. Cedar H. and Felsenfeld G. 1973. Transcription of chromatin in vitro J. Mol. Biol. 77: 237–254. Chess A., Simon I., Cedar H., and Axel R. 1994. Allelic inactivation regulates olfactory receptor gene expression. Cell 78: 823–834. Clark R. J. and Felsenfeld G. 1971. Structure of chromatin. Nat. New Biol. 229: 101–106. Doskocil J. and Sorm F. 1962. Distribution of 5-methylcytosine in pyrimidine sequences of deoxyribonucleic acids. Biochim. Biophys. Acta 55: 953–959. Durrin L. K., Mann R. K., Kayne P. S., and Grunstein M. 1991. Yeast histone H4 N-terminal sequence is required for promoter activation in vivo. Cell 65: 1023–1031. Grimes G. W. and Aufderheide K. J. 1991. Cellular aspects of pattern formation: The problem of assembly. Monogr. Dev. Biol. 22: 1-94. Hall I. M., Shankaranarayana C. D., Noma K., Ayoub N., Cohen A., and Grewal S. I. 2002. Establishment and maintenance of a heterochromatin domain. Science 297: 2215–2218. Hannah A. 1951 Localization and function of heterochromatin in Drosophila melanogaster. Adv. Genet. 4: 87-125. Hark A. T., Schoenherr C. J., Katz D. J., Ingram R. S., Levorse J. M., andTilghman S. M. 2000. CTCF mediates methylation-sensitive enhancer-blocking activity at the H19/Igf2 locus. Nature 405: 486–489. Hershey A. D. and Chase M. 1952. Independent functions of viral protein and nucleic acid in growth of bacteriophage. J. Gen. Physiol. 36: 39–56. Holliday R. and Pugh J. E. 1975. DNA modification mechanisms and gene activity during development. Science 187: 226–232. Jablonka E. and Lamb M. J. 1995. Epigenetic inheritance and evolution: The Lamarckian dimension Oxford University Press, New York, p. 82. Jorgensen R. 1993. The germinal inheritance of epigenetic information in plants. Philos. Trans. R. Soc. Lond. B Biol. Sci. 339: 173–181. Komberg R. D. and Thomas J. 0. 1974. Chromatin structure; oligomers of the histones. Science 184: 865–868. Lachner M., O’Carroll D., Rea S., Mechtler K., and Jenuwein T. 2001. Methylation of histone H3 lysine 9 creates a binding site for HP1 proteins. Nature 410: 116–120. Laskey R. A. and Gurdon J. B. 1970. Genetic content of adult somatic cells tested by nuclear transplantation from cultured cells. Nature 228: 1332–1334. Luger K., Mader A. W., Richmond R. K., Sargent D. F., and Richmond T. J. 1997. Crystal structure of the nucleosome core particle at 2. 8 E resolution. Nature 389: 251–260. Lyon M. F. 1961. Gene action in the X-chromosome of the mouse. Nature 190: 372–373. McClintock B. 1965. The control of gene action in maize. Brookhaven Symp. Biol. 18: 162–184. McKittnck E., Gafken P. R., Ahmad K., and HenikoffS. 2004. Histone H3. 3 is enriched in covalent modifications associated with active chromatin. Proc. Natl. Acad. Sci. 101: 1525–1530. Morgan T. 1911. An attempt to analyze the constitution of the chromosomes on the basis of sex-linked inheritance in Drosophila. J. Exp. Zool. 11: 365–414. Muller H. J. 1930. Types of visible variations induced by X-rays in Drosophila. J. Genet. 22: 299–334. Nakayama J., Rice J. C., Strahl B. D., Allis C. D., and Grewal S. I. 2001. Role of histone H3 lysine 9 methylation in epigenetic control of heterochromatin assembly. Science 292: 110–113. Novick A. and Weiner M. 1957. Enzyme induction as an all-or-none phenomenon. Proc. Natl. Acad. Sci. 43: 553–566. Ohno S., Kaplan W. D., and Kinosita R. 1959. Formatipn of the sex chromatin by a single X-chromosome in liver cells of Rattus norvegicus. Exp. Cell Res. 18: 415–418. Paul J. and Gilmour R. S. 1968. Organ-specific restriction of transcription in mammalian chromatin. J. Mol. Biol. 34: 305–316. Pazin M. J., Kamakaka R. T., and Kadonaga J. T. 1994. ATP-dependent nucleosome reconfiguration and transcriptional activation from preassembled chromatin templates. Science 266: 2007–2011. Peterson C. L. and Herskowitz 1. 1992. Characterization of the yeast SWI1, SWI2, and SWI3 genes, which encode a global activator of transcription. Cell 68: 573–583. Ptashne M. 1992. A genetic switch: Phage X and higher organisms, 2nd edition. Blackwell Science, Maiden, Massachusetts and Cell Press, Cambridge, Massachusetts. Richmond T. J. Finch J. T., Rushton B., Rhodes D., and Klug A. 1984. Structure of the nucleosome core particle at 7 E resolution. Nature 311: 532–537. Riggs A. D. 1975. X inactivation, differentiation, and DNA methylation. Cytogenet. Cell Genet. 14: 9-25. Riggs A. D. and Porter T. N. 1996. Overview of epigenetic mechanisms. In Epigenetic mechanisms of gene regulation (ed. V. E. A. Russo et al.), pp. 29–45. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York. Riggs A. D., Martienssen R. A., and Russo V. E. A. 1996. Introduction. In Epigenetic mechanisms of gene regulation (ed. V. E. A. Russo et al.), pp. 1–4. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York. Shykind B. M., Rohani S. C., O’Donnell S., Nemes A., Mendelsohn M., Sun Y., Axel R., and Bamea G. 2004. Gene switching and the stability of odorant receptor gene choice. Cell 117: 801-815. Stam M., Belele C, Dorweiler J., and Chandler V. 2002. Differential chromatin structure with a tandem array 100 kb upstream of the maize bl locus is associated with paramutation. Genes Dev. 16: 1906–1918. Stedman E. and Stedman E. 1950. Cell specificity of histones Nature 166: 780–781. Sturtevant A. 1913. The linear arrangement of six sex-linked factors in Drosophila, as shown by their mode of association. J. Exp. Zool. 14: 43–59. Tsukiyama T. and Wu C. 1995. Purification and properties of an ATP-dependent nucleosome remodeling factor. Cell 83: 1011–1020. Waddington C. H. 1953. Epigenetics and evolution. Symp. Soc. Exp. Biol. 7: 186–199. Wallis J. W., Hereford L., and Grunstein M. 1980. Histone H2B genes of yeast encode two different proteins. Cell 22: 799–805. Wysocka J., Swigut T., Milne T. Dou Y., Zhang X., Burlingame A., Roeder R., Brivanlou A., and Allis CD. 2005. WDR5 associates with histone H3 methylated at K4 and is essential for H3 K4 methylation and vertebrate development. Cell 121: 859–872.Глава 3. Общий обзор и основные понятия
С. David Allis, Thomas Jenuwein, and Danny Reinberg The Rockefeller University, New York; ‘Research Institute of Molecular Pathology, Vienna, Austria; UMDNJ-Robert Wood Johnson Medical School, Piscataway, New JerseyОбщее резюме
Секвенирование ДНК генома человека и геномов многих модельных организмов вызвало в последние несколько лет значительное возбуждение в биомедицинском сообществе и среди обычной публики. Эти генетические «синьки», демонстрирующие общепринятые правила менделевской наследственности, оказываются теперь легко доступными для тщательного анализа, открывая дверь для более глубокого понимания биологии человека и его болезней. Эти знания порождают также новые надежды на новые лечебные стратегии. Тем не менее, многие фундаментальные вопросы остаются без ответа. Например, как осуществляется нормальное развитие, при том что каждая клетка обладает одной и той же генетической информацией и все же следует своим особым путем развития с высокой временной и пространственной точностью? Каким образом клетка решает, когда ей делиться и дифференцироваться, а когда сохранять неизменной клеточную идентичность, реагируя и проявляя себя согласно своей нормальной программе развития? Ошибки, случающиеся в вышеупомянутых процессах, могут вести к возникновению таких болезненных состояний, как рак. Закодированы ли эти ошибки в ошибочных «синьках», которые мы унаследовали от одного или обоих родителей, или же имеются какие-то другие слои регуляторной информации, которые не были правильно считаны и декодированы? У человека генетическая информация (ДНК) организована в 23 пары хромосом, состоящих из примерно 25 000 генов. Эти хромосомы можно сравнить с библиотеками, содержащими разные наборы книг, которые в совокупности обеспечивают инструкции для развития целого человеческого организма. Нуклеотидная последовательность ДНК нашего генома состоит из примерно 3 × 109 оснований, сокращенно обозначаемых в этой последовательности четырьмя буквами А, С, G и Т, которые образуют определенные слова (гены), предложения, главы и книги. Однако чем же диктуется, когда именно и в каком порядке эти разные книги нужно читать, остается далеко не ясным. Ответ на этот экстраординарный вызов заключается, вероятно, в том, чтобы выяснить, каким образом клеточные события скоординированы в процессе нормального и ненормального развития. Если просуммировать все хромосомы, молекула ДНК у высших эукариот имеет длину около 2 метров и, следовательно, должна быть максимально сконденсирована — примерно в 10 000 раз, — чтобы поместиться в клеточном ядре — том компартменте клетки, в котором хранится наш генетический материал Накручивание ДНК на «шпульки» из белков, так называемых гистоновых белков, обеспечивает элегантное решение этой проблемы упаковки и дает начало полимеру, в котором повторяются комплексы белок: ДНК и который известен как хроматин. Однако в процессе упаковки ДНК для лучшего соответствия ограниченному пространству задача усложняется — во многом так же, как при расстановке слишком большого числа книг на библиотечных полках: становится все труднее и труднее найти и прочесть книгу по выбору, и, таким образом, становится необходимой система индексирования. Такое индексирование обеспечивается хроматином как платформой для организации генома. Хроматин не однороден по своей структуре; он выступает в различных формах упаковки — от фибриллы высококонденсированного хроматина (известного как гетерохроматин) до менее компактизированной формы, где гены обычно экспрессируются (известной как эухроматин). В основной полимер хроматина могут вводиться изменения путем включения необычных гистоновых белков (известных как варианты гистонов), измененных структур хроматина (известных как ремоделинг хроматина) и добавления химических «флажков», меток к самим гистоновым белкам (известного как ковалентные модификации). Более того, добавление метальной группы непосредственно к цитозиновому основанию (С) в матрице ДНК (известное как метилирование ДНК) может создавать сайты для присоединения белков, чтобы изменить состояние хроматина или повлиять на ковалентную модификацию резидентных гистонов. Полученные в последнее время данные позволяют предполагать, что некодирующие РНК могут «направлять» переход специализированных участков генома в более компактные состояния хроматина. Таким образом, на хроматин следует смотреть как на динамический полимер, который может индексировать геном и усиливать сигналы, поступающие из внешней среды, определяя в конечном счете, какие гены должны экспрессироваться, а какие нет. В совокупности эти регуляторные возможности наделяют хроматин неким организующим геномы началом, которое известно как «эпигенетика» и которое является предметом этой книги. В некоторых случаях паттерны эпигенетического индексирования оказываются наследующимися в ходе клеточных делений, обеспечивая тем самым клеточную «память», которая может расширять потенциал наследуемой информации, заключенный в генетическом (ДНК) коде. Таким образом, в узком смысле слова эпигенетику можно определять как изменения в транскрипции генов, обусловленные модуляциями хроматина, которые не являются результатом изменений в нуклеотидной последовательности ДНК. В этом обзоре мы объясняем основные концепции, связанные с хроматином и эпигенетикой, и обсуждаем, каким образом эпигенетический контроль может дать нам ключ для решения некоторых давнишних тайн — таких как клеточная идентичность, опухолевый рост, пластичность стволовых клеток, регенерация и старение. По мере того, как читатели будут «продираться» через последующие главы, мы советуем им обратить внимание на широкий спектр экспериментальных моделей, которые, по-видимому, имеют эпигенетическую (неДНКовую) основу. Выраженное в механистических терминах понимание того, как функционирует эпигенетика, будет, вероятно, иметь важные и далеко идущие последствия для биологии и болезней человека в эту «постгеномную» эру.1. Генетика vs. эпигенетика
Определение структурных деталей двойной спирали ДНК явилось одним из ключевых открытий всей биологии. ДНК является главной макромолекулой, хранящей генетическую информацию (Avery et al. 1944), и она передает эту запасенную информацию следующему поколению через зародышевый путь. На базе этого и других открытий возникла «центральная догма» современной биологии. Эта догма в краткой форме выражает процессы, связанные с поддержанием и транслированием генетической матрицы и необходимые для жизни. Существенными этапами являются (1) самовоспроизведение ДНК путем полуконсервативной репликации; (2) однонаправленная (от 5’ — к 3’-концу) транскрипция — матричный процесс, определяемый генетическим кодом (ДНК); образование промежуточного соединения — информационной РНК (иРНК); (3) трансляция иРНК и образование полипептидов, состоящих из линейных (от амино- к карбоксильной группе) цепочек аминокислот, колинеарных с 5’—3’-последовательностью ДНК. Говоря простыми словами: ДНК → РНК → белок. Центральная догма обеспечивает обратную связь от РНК к ДНК на основе процесса обратной транскрипции, сопровождающейся интеграцией в существующую ДНК (что демонстрируется ретровирусами и ретротранспозонами). Однако эта догма не признает наличие обратной связи от белка к ДНК, хотя новым поворотом в судьбе генетической догмы явился тот факт, что редкие белки, известные как прионы, могут наследоваться в отсутствие матриц ДНК или РНК. Таким образом, эти специализированные самоаггрегирующиеся белки обладают свойствами самой ДНК, в том числе механизмом репликации и хранения информации (Cohen and Prusiner, 1998; Shorter and Lundquist, 2005). Кроме того, новые данные заставляют предполагать, что очень большая часть нашего генома транскрибируется в «некодирующие» РНК. Функция этих некодирующих РНК (т. е. не кодирующих белки, не считая tRNAs, rRNAs, snoRNAs) интенсивно исследуется и лишь начинает проясняться в ограниченном числе случаев. Происхождение эпигенетики берет свое начало в давнишних исследованиях внешне аномальных (т. е. неменделевских) и ни с чем не сравнимых паттернов наследования у многих организмов (см. исторический обзор в главах 1 и 2). Классическое менделевское наследование фенотипических признаков (например, окраски горошин, числа пальцев или недостаточности гемоглобина) является результатом аллельных различий, вызываемых мутациями в нуклеотидной последовательности ДНК. В совокупности мутации лежат в основе определения фенотипических признаков, которые вносят вклад в детерминацию видовых границ. Эти границы затем формируются давлением естественного отбора, как объясняет дарвинова теория эволюции. Подобные концепции помещают мутации в самую сердцевину классической генетики. Напротив, неменделевское наследование (например, изменчивость эмбрионального роста, мозаичная окраска меха, случайная инактивация Х-хромосомы, парамутация у растений) (рис. 3.1) может быть, например, проявлением экспрессии только одной (из двух) аллелей в одном и том же ядерном окружении. Важно, что в этих обстоятельствах нуклеотидная последовательность ДНК не изменяется. Это отличается от другого паттерна, также относимого к неменделевской наследственности, который является результатом материнского наследования митохондрий (Birky, 2001). Потребность в эпигенетическом исследовании возникает в связи с избирательной регуляцией одной аллели внутри ядра. Чем различаются две идентичные аллели и каков механизм, посредством которого это различие устанавливается и поддерживается в последовательных клеточных поколениях? Что лежит в основе различий, наблюдаемых у монозиготных («идентичных») близнецов и делающих их не полностью идентичными? На эпигенетику иногда ссылаются как на одно из возможных объяснений различий во внешних признаках за счет перевода влияния внешней среды, диеты и других внешних источников влияния в экспрессию генома (Юаг, 2004; см. главы 23 и 24). Выяснение того, какие компоненты затрагиваются на молекулярном уровне и как изменения в этих компонентах влияют на биологию и заболевания человека — главный вызов для будущих исследований. Другой ключевой вопрос в этой области заключается в следующем: насколько эпигенетическая информация важна для нормального развития? Каким образом нарушается функционирование нормальных путей развития, приводя к аномальному развитию и неопластической трансформации (т. е. раку)? Как упоминалось выше, «идентичные» близнецы обладают одинаковой нуклеотидной последовательностью ДНК, и их фенотипическая идентичность как таковая часто используется для того, чтобы подчеркнуть определяющую силу генетики. Однако даже такие близнецы могут обнаруживать внешние фенотипические различия, вероятно обусловленные теми эпигенетическими модификациями, которые имели место на протяжении жизни этих индивидуумов (Fraga et al., 2005). Таким образом, нам еще предстоит понять всю степень важности эпигенетики в определении судьбы, идентичности и фенотипа клеток. В случае регенерации тканей и старения остается неясным, диктуются ли эти процессы изменениями в генетической программе клеток или же эпигенетическими модификациями. Интенсивность исследований, ведущихся в мировом масштабе, подтверждает мнение, что в эту постгеномную эру эпигенетика представляет собой новый важный рубеж. Говоря словами других исследователей, «мы — нечто большее, чем просто сумма наших генов» (Юаг, 1998); или: «вы можете наследовать нечто помимо нуклеотидных последовательностей ДНК. Вот где сейчас действительно волнующая проблема в генетике» (Watson, 2003). Важнейшим мотивом для решения издавать эту книгу была общая вера в то, что мы (редакторы) и все авторы этого тома могли бы передать это волнение будущим поколениям студентов, ученых и врачей, большинство из которых обучалось в свое время генетическим, но не эпигенетическим, принципам, управляющим наследственностью и расхождением хромосом. Рис. 3.1. Биологические примеры эпигенетических фенотипов
Эпигенетические фенотипы у широкого круга организмов и типов клеток; все они могут быть связаны с негенетическими различиями. Близнецы, легкие изменения, которые частично можно связать с эпигенетикой (©Randy Harris, New York). Тельце Бара: Эпигенетически сайленсированная, «заглушенная» Х-хромосома в клетках самок млекопитающих, видимая цитологически как конденсированный гетерохроматин. Политенные хромосомы: гигантские хромосомы в слюнных железах Drosophila, идеально подходящие для установления корреляции генов с эпигенетическими метками (воспроизведено из: Schotta et al. 2003 [©Springer]). Тип спаривания у дрожжей: пол определяется активным локусом МАТ, в то время как копии обоих генов, кодирующих типы спаривания, эпигенетически сайленсированы, «заглушены» (©Alan Wheals, University of Bath). Мазок крови: гетерогенные клетки одного и того же генотипа, но эпигенетически детерминированные для выполнения разных функций (с любезного разрешения проф. Christian Sillaber). Опухолевая ткань: клетки метастазов (слева), демонстрирующие повышенные уровни эпигенетических меток на срезе ткани (воспроизведено, с любезного разрешения, из Seligson etal. 2005 [©Macmillan]). Мутантное растение: эпифенотипы цветков Arabidopsis, генетически идентичные, с эпигенетически индуцированными мутациями (воспроиведено, с любезного разрешения, из Jackson etal. 2002 [©Macmillan]). Клонированная кошка: генетически идентичная, но с варьирующим фенотипом по окраске меха (воспроизведено, с любезного разрешения, из Shin et al. 2002 [©Macmillan])
Рис. 3.1. Биологические примеры эпигенетических фенотипов
Эпигенетические фенотипы у широкого круга организмов и типов клеток; все они могут быть связаны с негенетическими различиями. Близнецы, легкие изменения, которые частично можно связать с эпигенетикой (©Randy Harris, New York). Тельце Бара: Эпигенетически сайленсированная, «заглушенная» Х-хромосома в клетках самок млекопитающих, видимая цитологически как конденсированный гетерохроматин. Политенные хромосомы: гигантские хромосомы в слюнных железах Drosophila, идеально подходящие для установления корреляции генов с эпигенетическими метками (воспроизведено из: Schotta et al. 2003 [©Springer]). Тип спаривания у дрожжей: пол определяется активным локусом МАТ, в то время как копии обоих генов, кодирующих типы спаривания, эпигенетически сайленсированы, «заглушены» (©Alan Wheals, University of Bath). Мазок крови: гетерогенные клетки одного и того же генотипа, но эпигенетически детерминированные для выполнения разных функций (с любезного разрешения проф. Christian Sillaber). Опухолевая ткань: клетки метастазов (слева), демонстрирующие повышенные уровни эпигенетических меток на срезе ткани (воспроизведено, с любезного разрешения, из Seligson etal. 2005 [©Macmillan]). Мутантное растение: эпифенотипы цветков Arabidopsis, генетически идентичные, с эпигенетически индуцированными мутациями (воспроиведено, с любезного разрешения, из Jackson etal. 2002 [©Macmillan]). Клонированная кошка: генетически идентичная, но с варьирующим фенотипом по окраске меха (воспроизведено, с любезного разрешения, из Shin et al. 2002 [©Macmillan])
2. Модельные системы для изучения эпигенетики
Изучение эпигенетики обязательно требует наличия хороших экспериментальных моделей, и, как часто случается, эти модели, на первый взгляд, кажутся очень далекими от исследований, проводимых на клетках человека (или других млекопитающих). В совокупности, однако, результаты, полученные на многих системах, дали богатые знания. Авторы исторических обзоров (главы 1 и 2) ссылаются на несколько важных, ключевых открытий, которые явились плодом ранней цитологии, роста генетики, появления молекулярной биологии и сравнительно новых успехов в изучении регуляции генов, опосредованной хроматином. Различные модельные организмы (рис. 3.2) сыграли решающую роль в постановке и решении разнообразных вопросов, выдвигаемых эпигенетическими исследованиями. В самом деле, сделанные на различных модельных организмах и как будто бы несопоставимые эпигенетические открытия сыграли важную роль в объединении исследовательского сообщества Задача данного раздела — осветить некоторые из этих главных открытий, которые более детально обсуждаются в последующих главах этой книги. По мере знакомства с этими открытиями читателям следует сосредоточиться на фундаментальных принципах, выявленных в исследованиях с использованием этих модельных систем; в совокупности они чаще указывают на общие концепции, чем на разобщающие их детали. Одноклеточные и «низшие» эукариотические организмы — Saccharomyces cerevisiae, Schizosaccharomyces pombe и Neurospora crassa — позволяют проводить детальный генетический анализ, отчасти облегчаемый их коротким жизненным циклом. Переключение типов спаривания (МАТ), случающееся у S. cerevisiae (глава 3) и S. pombe (глава 6), дало весьма демонстративные примеры, показывающие значение контроля генов, опосредованного хроматином. У почкующихся дрожжей S. cerevisiae было показано, как уникальные белки — регуляторы «молчашей» информации (SIR — silent information regulator) привлекают специфические модифицированные гистоны. Этому предшествовали элегантные эксперименты с использованием генетики для обоснования активного участия гистоновых белков в регуляции генов (Clark-Adams et al., 1988; Kayne et al., 1988). У дробянковых дрожжей S. pombe паттерны модификаций гистонов, действующие как активирующие и репрессирующие сигналы, замечательным образом сходны с таковыми у многоклеточных организмов. Это открыло путь для использования мощных генетических фильтров в поисках генных продуктов, которые супрессируют или усиливают сайленсинг генов. Совсем недавно для дробянковых дрожжей был предложен целый ряд механистических моделей, связывающих механизм PH К-интерференции (RNAi) с индукцией модификаций гистонов, репрессирующих экспрессию генов (Hall et al., 2002; Volpe et al., 2002). Вскоре после этого был сделан вывод об участии механизма RNAi и в транскрипционном сайленсинге генов у растения Arabidopsis thaliana. что подчеркнуло потенциальное значение регуляции этого типа у широкого круга организмов (см. раздел 10). Другие нетрадиционные организмы также внесли несоразмерно большой вклад, вначале казавшийся необычным, в расшифровку эпигенетических путей. Гриб N. crassa продемонстрировал необычный неменделевский феномен индуцируемых повторами точечных мутаций (RIP — repeat-induced point mutations) как модель для изучения эпигенетического контроля (глава 6). Позже этот организм был использован для демонстрации первой функциональной связи между модификациями гистонов и метилированием ДНК (Tamaru and Selker 2001); это открытие впоследствии было распространено на «высшие» организмы (Jackson et al. 2002). Такие ресничные простейшие, как Tetrahymena и Paramecium, обычно используемые в биологических лабораториях в качестве удобных объектов для микроскопирования, весьма способствовали важным эпигенетическим открытиям благодаря своему уникальному ядерному диморфизму. Каждая клетка несет два ядра: транскрипционно активный соматический макронуклеус и ядро зародышевого пути — микронуклеус, который является транскрипционно неактивным. Используя макронуклеусы в качестве источника, богатого «активным» хроматином, исследователи смогли выполнить биохимическую очистку первого гистон-модифицирующего фермента— ацетилтрансферазы гистонов или HAT (Brownell et al., 1996). Инфузории хорошо известны также благодаря характерному для них особому явлению запрограммированной элиминации ДНК в ходе их полового жизненного цикла, включаемой малыми некодируюшими РНК и модификациями гистонов (глава 7). У многоклеточных организмов размер генома и сложность организма в целом возрастают в ряду от беспозвоночных (Caenorhabditis elegans, Drosophila melanogaster) или растений (A. thaliana) до «высших» и, так сказать, «имеющих к нам более прямое отношение» позвоночных организмов (млекопитающих). Растения, однако, сыграли более важную роль для всей эпигенетики, оказавшись богатейшим источником эпигенетических открытий (глава 9) от перемещающихся элементов и парамутаций (McClintock, 1951) до первого описания некодирующих РНК, участвующих в транскрипционном сайленсинге (Ratcliff et al., 1997). Исследования, выполненные на растениях, обнаружили важные связи между метилированием ДН К, модификациями гистонов и компонентами механизма RNAi. Открытие эпиаллелей растений, получивших такие комические названия как SUPERMAN и KRYPTONITE (например, Jackson et al., 2002), и нескольких генов яровизации (Bastow et al., 2004; Sung and Amasino, 2004) создало далее целую область исследований по выяснению роли эпигенетики в развитии и клеточной памяти. Меристемные клетки растений обусловили также возможность изучать такие ключевые вопросы, как соматическая регенерация и пластичность стволовых клеток (главы 9 и 11). Рис. 3.2. Модельные организмы, используемые в эпигенетических исследованиях
Схематическое изображение модельных организмов, используемых в эпигенетических исследованиях. S. cerevisiae: переключение типов спаривания для изучения эпигенетического контроля на уровне хроматина. S. pombe: мозаичный сайленсинг генов, проявляющийся как секторирование колонии. Neurospora crassa: эпигенетические системы защиты генома связаны с точечными мутациями, индуцированными повторами, подавлением [quelling] и мейотическим сайленсингом неспаренных нитей ДНК; все это выявляет взаимодействие между путями РНК-интерферениии, ДНК и метилированием гистонов. Tetrahymena: Хроматин в соматических ядрах и ядрах зародышевого пути различается эпигенетически регулируемыми механизмами. Arabidopsis: модель для репрессии с помощью механизмов сайленсинга ДНК. гистонов и сайленсинга, направляемого РНК. Кукуруза: модель для импринтинга. парамутации и сайленсинга, индуцируемого транспозонами. С. elegans: эпигенетическая регуляция в зародышевом пути. Drosophila: обусловленный эффектом положения мозаицизм проявляется в виде клональных пятен экспрессии и сайленсинга гена белой окраски глаз (white). Млекопитающие: инактивация Х-хромосомы.
Рис. 3.2. Модельные организмы, используемые в эпигенетических исследованиях
Схематическое изображение модельных организмов, используемых в эпигенетических исследованиях. S. cerevisiae: переключение типов спаривания для изучения эпигенетического контроля на уровне хроматина. S. pombe: мозаичный сайленсинг генов, проявляющийся как секторирование колонии. Neurospora crassa: эпигенетические системы защиты генома связаны с точечными мутациями, индуцированными повторами, подавлением [quelling] и мейотическим сайленсингом неспаренных нитей ДНК; все это выявляет взаимодействие между путями РНК-интерферениии, ДНК и метилированием гистонов. Tetrahymena: Хроматин в соматических ядрах и ядрах зародышевого пути различается эпигенетически регулируемыми механизмами. Arabidopsis: модель для репрессии с помощью механизмов сайленсинга ДНК. гистонов и сайленсинга, направляемого РНК. Кукуруза: модель для импринтинга. парамутации и сайленсинга, индуцируемого транспозонами. С. elegans: эпигенетическая регуляция в зародышевом пути. Drosophila: обусловленный эффектом положения мозаицизм проявляется в виде клональных пятен экспрессии и сайленсинга гена белой окраски глаз (white). Млекопитающие: инактивация Х-хромосомы.
Что касается понимания развития у животных. Drosophila с давних пор была и остается постоянным генератором генетической энергии Основываясь на пионерской работе Меллера (Muller, 1930), было получено множество мутаций, влияющих на развитие, в том числе мутации, вызывающие гомеотические трансформации и эффект положения мозаичного типа; эти мутации описываются ниже (глава 5). Мутации, вызывающие гомеотические трансформации, привели к мысли, что могли бы существовать регуляторные механизмы для установления и поддержания клеточной идентичности/памяти; позже было показано, что они регулируются системами Polycomb и tnthorax (главы 11 и 12). Что касается эффекта положения мозаичного типа (PEV), то активность гена диктуется структурой окружающего хроматина, а не нуклеотидной последовательностью ДНК. Эта система оказалась особенно информативной для выявления факторов, участвующих в эпигенетическом контроле (глава 5). Полагают, что свыше 100 супрессоров мозаичности [Su(var)] кодируют компоненты гетерохроматина. Без фундамента, созданного этими имеющими важное значение исследованиями, были бы невозможны открытие первых метилтрансфераз лизинов в гистонах (HKMTs) (Rea et al. 2000) и вытекающие из него достижения в области метилирования лизина гистонов. Как нередко случается в биологии, у дробянковых дрожжей и у растений был проведен сравнительный скрининг, выявивший мутанты по сайленсингу, которые оказались функционально консервативными с генами Su(var) у Drosophila. Применение методов обратной генетики с использованием библиотек RNAi у червя-нематоды С. elegans внесло существенный вклад в наше понимание эпигенетического регулирования в ходе развития многоклеточных. Здесь исследования, в которых тщательно прослеживалась судьба клеток и которые позволили детализировать все пути развития для каждой клетки, позволили высветить тот факт, что системы Polycomb и tritorax, вероятно, возникли одновременно с появлением многоклеточности (см. разделы 12 и 13). В частности, эти механизмы эпигенетического контроля имеют существенное значение для регуляции генов в зародышевом пути (глава 15). Роль эпигенетики в развитии млекопитающих в основном была выяснена на мышах, хотя ряд исследований был распространен на разнообразные линии клеток человека и первичные клеточные культуры. Технологии нокаута и направленных вставок («knock-out» и «knock-in») оказались мощным инструментом для функционального расчленения ключевых эпигенетических регуляторов. Например, мыши, мутантные по метилтрансферазе ДНК, Dnmt1, позволили выяснить функциональную роль метилирования ДНК у млекопитающих (Li et al., 1992). Эта мутация является эмбриональной леталью и демонстрирует нарушение импринтинга (глава 18). Было также показано, что нарушение метилирования ДНК вызывает нестабильность генома и возобновление активности транспозонов, в частности в зародышевых клетках (Walsh et al., 1998; Bourc’his and Bestor, 2004). Охарактеризовано приблизительно 100 факторов, регулирующих хроматин (т. е. ферменты, модифицирующие гистоны и ДНК, компоненты комплексов ремоделинга нуклеосом и механизма РНКи), которые повреждены у этих мышей. Мутантные фенотипы затрагивают пролиферацию клеток, коммитирование клеточных линий, пластичность стволовых клеток, стабильность генома, репарацию ДНК и процессы сегрегации хромосом, как в соматических клетках, так и в зародышевом пути. Неудивительно, что большинство этих мутаций связаны также с развитием заболеваний и рака. Таким образом, многие из этих ключевых успехов в изучении эпигенетического контроля были достигнуты с использованием тех преимуществ, которые обеспечивались уникальными биологическими особенностями, свойственными многим, если не всем, вышеупомянутым модельным организмам. Без этих биологических процессов и их тщательного функционального анализа (генетического и биохимического) многие из недавних успехов в области эпигенетического контроля оставались бы труднодостижимыми.
3. Определение эпигенетики
Из вышеприведенного обсуждения вытекает один острый вопрос: какова та обшая нить, которая связывает разнообразные эукариотические организмы с фундаментальными эпигенетическими принципами? Различные эпигенетические явления объединены, главнымобразом, тем обстоятельством, что у всех организмов, обладающих настоящим ядром (эукариоты), ДНК не является «голой». Напротив, эта ДНК существует в виде тесного комплекса со специализированными белками, и вместе они составляют хроматин. В своей простейшей форме хроматин — т. е. ДНК, накрученная вокруг нуклеосомных единиц, состоящих из небольших гистоновых белков (Kornberg, 1974), — первоначально рассматривался как пассивная упаковочная структура, служащая для сворачивания и организации ДНК. Однако с помощью разнообразных ковалентных и нековалентных механизмов, выявляемых в настоящее время с большой быстротой, возникают разные формы хроматина (см. раздел 6). В число этих механизмов входит множество посттрансляпионных модификаций гистонов, энергозависимые процессы ремоделинга хроматина, мобилизующие или изменяющие структуру нуклеосом, динамические вставка новых гистонов (вариантов) в нуклеосомы и выход из них, а также направляющая роль малых некодирующих РНК. Сама ДНК у многих высших эукариот также может ковалентно модифицироваться путем метилирования цитозиновых остатков (обычно, но не всегда в динуклеотидах CpG). В совокупности эти механизмы создают набор взаимосвязанных метаболических путей, которые все вместе порождают вариации в полимере хроматина (рис. 3.3). Многие, хотя и не все из этих модификаций и изменений хроматина, являются обратимыми и, следовательно, вряд ли воспроизводятся в зародышевом пути. Временные метки привлекательны потому, что они вызывают изменения в хроматиновой матрице в ответ на внутренние и внешние стимулы (Jaenisch and Bird. 2003) и тем самым регулируют доступность для транскрипционной машины и (или) возможность ее работы, необходимые для того, чтобы «прочесть» лежащую в основе хроматина матрицу ДНК (Sims et al., 2004; Глава 10). Некоторые модификации гистонов (такие как метилирование лизинов), участки метилированной ДНК и измененные нуклеосомные структуры могут, тем не менее, оставаться стабильными на протяжении нескольких клеточных делений. Благодаря этому возникают «эпигенетические состояния», обеспечивающие клеточную память, которые до сих пор остаются недооцененными и малопонятными. С этой точки зрения, «сигнатуры» хроматина могут рассматриваться как высокоорганизованные системы хранения информации, которые могут индексировать отдельные участки генома и обеспечивать ответ на сигналы, поступающие из внешней среды и диктующие программы экспрессии генов. Рис. 3.3. Генетика vs. эпигенетика
ГЕНЕТИКА: мутации (красные звездочки) в матрице ДНК (зеленая спираль) наследуются соматически и через зародышевый путь. ЭПИГЕНЕТИКА: изменения в структуре хроматина модулируют использование генома с помощью (1) модификаций гистонов (mod), (2) ремоделинга хроматина (remodeler). (3) вариантного состава гистонов (желтая нуклеосома), (4) метилирования ДНК (Me) и (5) некодирующих РНК. Метки на хроматиновой матрице могут наследоваться при клеточных делениях и в совокупности вносят вклад в детерминацию клеточного фенотипа
Рис. 3.3. Генетика vs. эпигенетика
ГЕНЕТИКА: мутации (красные звездочки) в матрице ДНК (зеленая спираль) наследуются соматически и через зародышевый путь. ЭПИГЕНЕТИКА: изменения в структуре хроматина модулируют использование генома с помощью (1) модификаций гистонов (mod), (2) ремоделинга хроматина (remodeler). (3) вариантного состава гистонов (желтая нуклеосома), (4) метилирования ДНК (Me) и (5) некодирующих РНК. Метки на хроматиновой матрице могут наследоваться при клеточных делениях и в совокупности вносят вклад в детерминацию клеточного фенотипа
Значение хроматиновой матрицы, способной реализовать генетическую информацию, заключается в том, что она обеспечивает многомерность уровней считывания информации с ДНК. Возможно, это действительно необходимо, учитывая огромные размеры и сложность эукариотического генома, особенно у многоклеточных организмов (см. детали в разделе 11). У таких организмов оплодотворенное яйцо претерпевает развитие, начиная с единичного генома, который становится эпигенетически запрограммированным на образование множества различных «эпигеномов» в более чем 200 разных типов клеток (рис. 3.4). Было высказано предположение, что эта запрограммированная изменчивость составляет некий «эпигенетический код», существенно расширяющий информационный потенциал генетического кода (Strahl and Allis, 2000; Turner, 2000; Jenuwein and Allis, 2001). Несмотря на всю привлекательность этой гипотезы, мы подчеркиваем, что для ее проверки и проверки других соблазнительных теорий требуется еще поработать. Выдвигаются и альтернативные точки зрения, согласно которым в гистонах чисто комбинаторные «коды», подобные триплетному генетическому коду, мало вероятны или, во всяком случае, далеко еще не установлены (Schreiber and Bernstein, 2002; Henikoff, 2005). Несмотря на такую неопределенность, мы склоняемся к общему мнению, что комбинация ковалентных и нековалентных механизмов действует таким образом, что создаются состояния хроматина, которые могут матрицироваться [be templated] при клеточных делениях и в процессе развития с помощью механизмов, которые только еще начинают выясняться. Вопрос о том, каким именно образом эти измененные состояния хроматина надежно воспроизводятся при репликации ДНК и в митозе, остается одной из фундаментальных проблем для будущих исследований.
 Рис. 3.4. ДНК vs. хроматин
Геном: инвариантная нуклеотидная последовательность ДНК (зеленая двойная спираль) особи. Эпигеном: общий состав хроматина, индексирующий весь геном в любой данной клетке. Он варьирует в зависимости от типа клетки и реакции на внутренние и внешние сигналы, которые он получает. (Нижняя часть рисунка) эпигеномная диверсификация у многоклеточных организмов происходит в ходе развития по мере того, как дифференцировка прогрессирует от единичной стволовой клетки (оплодотворенный эмбрион) к более коммитированным клеткам. Реверсия дифференцировки или трансдифференцировка (голубые линии) требует репрограммирования эпигенома клетки
Рис. 3.4. ДНК vs. хроматин
Геном: инвариантная нуклеотидная последовательность ДНК (зеленая двойная спираль) особи. Эпигеном: общий состав хроматина, индексирующий весь геном в любой данной клетке. Он варьирует в зависимости от типа клетки и реакции на внутренние и внешние сигналы, которые он получает. (Нижняя часть рисунка) эпигеномная диверсификация у многоклеточных организмов происходит в ходе развития по мере того, как дифференцировка прогрессирует от единичной стволовой клетки (оплодотворенный эмбрион) к более коммитированным клеткам. Реверсия дифференцировки или трансдифференцировка (голубые линии) требует репрограммирования эпигенома клетки
Фенотипические изменения, происходящие в ряду клеточных поколений в ходе развития многоклеточного организма, были описаны Уодцингтоном как «эпигенетический ландшафт» (Waddington, 1957). Тем не менее, весь спектр клеток, от стволовых до полностью дифференцированных, обладает идентичными нуклеотидными последовательностями ДНК, но заметно различается по профилю генов, которые реально экспрессируются этими клетками. Исходя из этого, позднее пришли к определению эпигенетики как «ядерной наследственности, которая не основывается на различиях в нуклеотидной последовательности ДНК» (Holliday, 1994). Со времени открытия двойной спирали ДНК и ранних трактовок эпигенетики наши знания об эпигенетическом контроле и лежащих в его основе механизмах существенно возросли, заставляя некоторых описывать эти знания в таких более «возвышенных» терминах, как «область науки», а не просто «феномены» (см Wolfe and Matzke, 1999; Roloff and Nuber, 2005; глава 1). За последнее десятилетие значительный прогресс был достигнут в отношении многих семейств энзимов, активно модифицирующих хроматин (см. ниже). Таким образом, используя современную терминологию, эпигенетику можно в молекулярном (механистическом) плане определить как «сумму изменений в хроматиновой матрице, которые в совокупности устанавливают и воспроизводят различные паттерны экспрессии генов (транскрипции) и сайленсинга на основе одного и того же генома».
4. Хроматиновая матрица
Нуклеосома является фундаментальной повторяющейся единицей хроматина (Komberg, 1974). С одной стороны, эта базовая единица хроматина состоит из белкового октамера, содержащего по две молекулы каждого канонического (или корового) гистона (Н2А, Н2В, H3 и Н4), вокруг которого накручены 147 п.н. ДНК. Детальные межмолекулярные взаимодействия между коровыми гистонами и ДНК были определены в выдающихся исследованиях, приведших к получению рентгеновской картины (с атомным, 2.8 Е, разрешением) нуклеосомы, собранной из рекомбинантных частей (рис. 3.5) (Lugeret al., 1997). Картины мононуклеосом, а также возникающих структур более высокого порядка (тетрануклеосом), имеющие более высокое разрешение (Schalch et al., 2005), продолжают привлекать наше внимание, обещая помочь в объяснении физиологически важного субстрата, на котором развертывается действие если не всего, то большей части ремоделинга хроматина и механизма транскрипции Коровые гистоновые белки, составляющие нуклеосому, являются очень небольшими и сильно основными. Они состоят из глобулярного домена и гибких (относительно неструктурированных) «гистоновых хвостов», торчащих с поверхности нуклеосомы (рис. 3.5). Судя по аминокислотной последовательности, гистоновые белки крайне консервативны в диапазоне от дрожжей до человека. Такая высокая степень консервативности подкрепляет общий взгляд, согласно которому эти белки, даже неструктурированные хвостовые домены, вероятно выполняют критичные функции. Хвосты, особенно хвосты гистонов H3 и Н4, в действительности содержат важный ключ к изменчивости нуклеосом (и, отсюда, хроматина), поскольку многие из остатков являются объектами экстенсивных посттрансляционных модификаций (см. стандартную номенклатуру, используемую в этом руководстве, на обратной стороне задней части переплета и список известных модификаций гистонов в Приложении 2). Ацетилирование и метилирование коровых гистонов, особенно H3 и Н4, были одними из первых описанных ковалентных модификаций, и долгое время предполагалось, что они коррелируют с положительными и отрицательными изменениями в транскрипционной активности. Со времени пионерских работ Олфри и сотрудников (Allfrey et al., 1964) были идентифицированы и охарактеризованы многие типы ковалентных модификаций гистонов; в их числе — фосфорилирование, убиквитинирование, сумоилирование, АДФ-рибозилирование, биотинилирование гистонов, изомеризация пролина и другие вероятные типы, ожидающие своего описания (Vaquero et al., 2003). Эти модификации происходят в специфических сайтах и остатках, некоторые из них изображены на рис. 3.6 и перечислены в Приложении 2. Эту ковалентную маркировку катализируют специфические ферменты и ферментные комплексы, часть которых описывается далее в этом обзоре и в отдельных главах. Поскольку в ближайшие годы эти перечни будут продолжать расти, нашим намерением было упомянуть лишь отдельные метки и энзимы, которые могли бы проиллюстрировать то, что, как нам кажется, является общими понятиями и принципами. Рис. 3.5. Структура нуклеосомы
(Слева) Модель нуклеосомы с разрешением 2.8 Е. (Справа) Схематическое представление организации гистонов внутри октамерного кора, вокруг которого обернута ДНК (черная линия). Образование нуклеосомы происходит сперва через откладку на ДНК тетрамера H3/Н4. а затем двух наборов димеров Н2А/Н2В. Неструктурированные аминотерминальные гистоновые хвосты выпячиваются из нуклеосомного кора, состоящего из структурированных глобулярных доменов восьми гистоновых белков
Рис. 3.5. Структура нуклеосомы
(Слева) Модель нуклеосомы с разрешением 2.8 Е. (Справа) Схематическое представление организации гистонов внутри октамерного кора, вокруг которого обернута ДНК (черная линия). Образование нуклеосомы происходит сперва через откладку на ДНК тетрамера H3/Н4. а затем двух наборов димеров Н2А/Н2В. Неструктурированные аминотерминальные гистоновые хвосты выпячиваются из нуклеосомного кора, состоящего из структурированных глобулярных доменов восьми гистоновых белков
В определенных районах хроматина нуклеосомы могут содержать вариантные гистоновые белки вместо какого-нибудь корового (канонического) гистона. Текущие исследования показывают, что это различие в составе способствует выполнению специализированных функций этими маркированными районами хромосом. В настоящее время известны вариантные белки для коровых гистонов Н2А и H3, но не известно ни одного для гистонов Н2В и Н4. Мы подозреваем, что варианты гистонов, хотя они нередко являются минорными в смысле их количества и потому более трудными для исследования, весьма богаты в отношении содержащейся в них информации и играют весьма существенную роль в отношении их вклада в эпигенетическое регулирование (детали см в разделе 8 и главе 13).
5. Более высокие уровни организации хроматина
Хроматин, этот состоящий из ДНК и нуклеосом полимер, является динамической молекулой, существующей во многих различных конфигурациях. Ранее в течение длительного времени хроматин разделяли на эухроматин и гетерохроматин, исходя из картины окрашивания ядра красителями, которые цитологи использовали для визуализации ДНК. Эухроматин представляет собой деконденсированный хроматин, хотя он может быть активным или неактивным в отношении транскрипции. Гетерохроматин можно определить в широком смысле как высококомпактизированный и «молчащий» хроматин. Он может существовать как постоянно «молчащий» хроматин (конститутивный гетерохроматин), где гены организма лишь изредка экспрессируются в клетках любого типа, или как хроматин, репрессированный в некоторых клетках в ходе специфического клеточного цикла или на специфической стадии развития (факультативный гетерохроматин) Таким образом, имеется спектр состояний хроматина, и накопленная за многие годы литература позволяет предполагать, что хроматин является высоко динамичной структурой, склонной к ремоделингу и реструктурированию по мере получения физиологически релевантных сигналов, поступающих по «идущим вверх» (upstream) сигнальным путям. Однако лишь недавно достигнут значительный прогресс в раскрытии молекулярных механизмов, управляющих этими процессами ремоделинга. Рис. 3.6. Сайты, по которым происходят модификации гистоновых «хвостов»
Аминотерминальные «хвосты» гистонов составляют четверть массы нуклеосомы. На них находится огромное большинство известных сайтов, по которым происходит ковалентная модификация и которые изображены на рисунке. Модификации происходят также и в глобулярном домене (заключено в прямоугольник) некоторые из них указаны на рисунке. В целом в число активных меток входят ацетилирование (бирюзовый флажок Ас), метилирование аргинина (желтый шестиугольник Ме) и метилирование некоторых лизинов, таких как H3К4 и H3K36 (зеленый шестиугольник Ме). Функция H3К79 в глобулярном домене — антисайленсинг. В число репрессивных меток входят H3К9, H3К27 и H4K20 (красный шестиугольник Ме). Зеленый цвет — активная метка, красный — репрессивная метка
Рис. 3.6. Сайты, по которым происходят модификации гистоновых «хвостов»
Аминотерминальные «хвосты» гистонов составляют четверть массы нуклеосомы. На них находится огромное большинство известных сайтов, по которым происходит ковалентная модификация и которые изображены на рисунке. Модификации происходят также и в глобулярном домене (заключено в прямоугольник) некоторые из них указаны на рисунке. В целом в число активных меток входят ацетилирование (бирюзовый флажок Ас), метилирование аргинина (желтый шестиугольник Ме) и метилирование некоторых лизинов, таких как H3К4 и H3K36 (зеленый шестиугольник Ме). Функция H3К79 в глобулярном домене — антисайленсинг. В число репрессивных меток входят H3К9, H3К27 и H4K20 (красный шестиугольник Ме). Зеленый цвет — активная метка, красный — репрессивная метка
Фигурирующая в учебниках 11-нанометровая матрица типа «бусинок на нити» представляет собой активную и в основном «развернутую» интерфазную конфигурацию, в которой ДНК периодически оборачивается вокруг повторяющихся единиц — нуклеосом (рис. 3.7). Однако эта хроматиновая фибрилла не всегда составлена из нуклеосом, расположенных на регулярном расстоянии друг от друга. Нуклеосомы могут быть упакованы нерегулярно и могут сворачиваться в структуры более высокого порядка, анализ которых при атомном разрешении еще только начинается (Khorasanizadeh, 2004). Характерные конформации хроматина более высокого порядка возникают в разных районах генома во время спецификации судьбы клеток или на разных стадиях клеточного цикла (интерфазный vs. митотический хроматин). Расположение нуклеосом на 11-нанометровой матрице может быть изменено в результате cis-эффектов и trans-эффектов ковалентно модифицированных «хвостов» гистонов (рис. 3.8). Cis-эффекты возникают в результате изменений в физических свойствах модифицированных хвостов гистонов, таких как модуляции в электростатическом заряде или в структуре «хвостов», которые, в свою очередь, изменяют межнуклеосомные контакты. Хорошо известным примером может служить ацетилирование гистонов, которое, как давно подозревали, нейтрализует положительные заряды сильно основных гистоновых «хвостов», порождая в результате локальное растяжение хроматиновой фибриллы и тем самым обеспечивая лучший доступ транскрипционной машины к двойной спирали ДНК. Фосфорилирование, благодаря добавлению суммарного отрицательного заряда, может создавать «очажки зарядов» [charge patches] (Dou and Gorovsky, 2000), которые, как полагают, изменяют упаковку нуклеосом или экспонируют аминоконцы гистонов, изменяя у хроматинового полимера состояние сворачивания более высокого порядка (Wei et al., 1999; Nowak and Corces, 2004). Считается, что во многом таким же образом линкерные гистоны (Н1) стимулируют упаковку фибрилл более высокого порядка, экранируя отрицательный заряд линкерной ДНК между соседними нуклеосомами (Thomas, 1999; Khochbin, 2001; Harvey and Downs, 2004; Kimmins and Sassone-Corsi, 2005). Добавление таких объемистых аддуктов, как убиквитин и АДФ-рибоза, также может индуцировать разное расположение гистоновых «хвостов» и открывать группы нуклеосом. В какой мере гистоновые «хвосты» могут индуцировать компактизацию хроматина посредством механизмов, зависящих от модификаций и не зависящих от них, — еще не ясно.
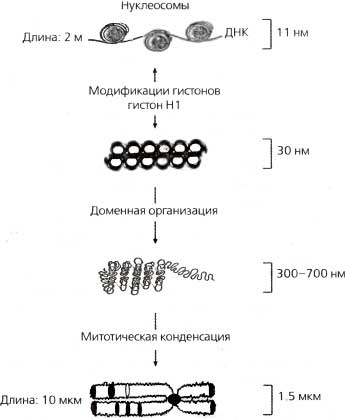 Рис. 3.7. Структурирование хроматина более высоких порядков
11-нанометровая фибрилла представляет собой ДНК, накрученную вокруг нуклеосом 30-нанометровая фибрилла компактизирован а далее во все еще неподтвержденную структуру (изображена здесь как соленоидная конформация), включающую линкерный гистон Н1. 300—700-нанометровое волокно представляет собой динамическое «выпетливание» более высокого порядка, которое обнаруживается как в интерфазном, так и в метафазном хроматине. 1,5-микрометровая конденсированная хромосома представляет собой наиболее компакгизированную форму хроматина, которая обнаруживается только во время ядерного деления (митоза или мейоза). Еще не ясно, каким образом картины бэндинга (т. е. G- или R-бэндинга) митотической хромосомы коррелируют с конкретными структурами хроматина
Рис. 3.7. Структурирование хроматина более высоких порядков
11-нанометровая фибрилла представляет собой ДНК, накрученную вокруг нуклеосом 30-нанометровая фибрилла компактизирован а далее во все еще неподтвержденную структуру (изображена здесь как соленоидная конформация), включающую линкерный гистон Н1. 300—700-нанометровое волокно представляет собой динамическое «выпетливание» более высокого порядка, которое обнаруживается как в интерфазном, так и в метафазном хроматине. 1,5-микрометровая конденсированная хромосома представляет собой наиболее компакгизированную форму хроматина, которая обнаруживается только во время ядерного деления (митоза или мейоза). Еще не ясно, каким образом картины бэндинга (т. е. G- или R-бэндинга) митотической хромосомы коррелируют с конкретными структурами хроматина
 Рис. 3.8. Переходы в хроматиновой матрице (cis/trans)
cis-эффекты: ковалентная модификация остатка гистонового «хвоста» приводит к изменению структуры или заряда, проявляющемуся как изменение в организации хроматина, trans-эффекты: ферментативная модификация остатка гистонового «хвоста» (напр., метилирование H3К9) приводит к возникновению сродства к ассоциированному с хроматином белку (modbinder, напр., НР1). Ассоциация mod binder (или комплексов ассоциированных белков) вызывает изменения в структуре хроматина «вниз по течению». Замещение гистонов: ковалентная модификация гистонов (или другой стимул) может послужить сигналом для замещения какого-то корового гистона вариантным гистоном с помощью комплекса-обменника, осуществляющего ремоделинг нуклеосом
Рис. 3.8. Переходы в хроматиновой матрице (cis/trans)
cis-эффекты: ковалентная модификация остатка гистонового «хвоста» приводит к изменению структуры или заряда, проявляющемуся как изменение в организации хроматина, trans-эффекты: ферментативная модификация остатка гистонового «хвоста» (напр., метилирование H3К9) приводит к возникновению сродства к ассоциированному с хроматином белку (modbinder, напр., НР1). Ассоциация mod binder (или комплексов ассоциированных белков) вызывает изменения в структуре хроматина «вниз по течению». Замещение гистонов: ковалентная модификация гистонов (или другой стимул) может послужить сигналом для замещения какого-то корового гистона вариантным гистоном с помощью комплекса-обменника, осуществляющего ремоделинг нуклеосом
Модификации гистонов могут также вызывать то, что мы обозначаем как trans-эффекты, рекрутируя в хроматин связанные с модификацией молекулы-партнеры. Это может рассматриваться как «считывание» конкретной ковалентной метки гистона зависимым от контекста образом. Некоторые партнеры по связыванию обладают особым сродством и поэтому говорят, что они «помещаются как в док» («dock») на специфические «хвосты» гистона и нередко делают это, играя роль хроматиновой «застежки-липучки» («Velcro») для одного полипептида в составе значительно более крупного ферментативного комплекса, которому нужно связаться с хроматиновым полимером. Например, бромодомен — мотив, распознающий ацетилированные остатки гистона — часто, хотя и не всегда, является частью фермента ацетилтрансферазы гистонов (HAT), функция которого — ацетилирование гистонов-мишеней (см. рис. 3.10 в разделе 7) и который существует как часть более крупного комплекса, осуществляющего ремоделинг хроматина (Dhalluin et al. 1999; Jacobson et al. 2000). Аналогичным образом метилированные остатки лизина, встроенные в гистоновые «хвосты», могут считываться хромодоменами (Bannister et al., 2001; Lachner et al., 2001; Nakayama et al., 2001) или сходными доменами (например, МВТ, tudor) (Maurer-Stroh et al., 2003; Kim et al., 2006) и облегчать модуляции хроматина, происходящие «ниже по течению». В некоторых случаях, например, ассоциация хромодоменных белков ускоряет распространение гетерохроматина путем катализируемого гистоновой метилтрансферазой (HKMT) метилирования соседних гистонов, которые затем считываются хромодоменными белками (глава 5). Модификации как «хвостовых» участков, так и глобулярного корового участка гистонов (Cosgrove et al., 2004) могут также «нацеливать» зависимые от АТФ ремоделирующие комплексы на 11-нанометровую фибриллу, необходимую для перехода от готового к действию эухроматина к транскрипционно активному состоянию. Эта мобилизация нуклеосом может происходить путем скольжения октамера, изменения структуры нуклеосомы в результате выпетливания ДНК (детали см. в главе 12) или замещения специфических коровых гистонов гистоновыми вариантами (глава 13). Зависимые от АТФ ремоделеры хроматина (такие как SWI/SNE — исторически важный пример!) путем гидролиза высвобождают энергию для того, чтобы осуществить значительные изменения в контактах гистон: ДНК, приводящие к выпетливанию, скручиванию и скольжению нуклеосом. Как было показано, эти нековалентные механизмы имеют критически важное значение для событий регуляции генов (Narlikar et al., 2002) в такой же мере, как и механизмы, связанные с ковалентной модификацией гистонов (глава 10). Тот факт, что специфические зависимые от АТФ ремоделеры могут перетасовывать варианты гистонов, включая их в хроматин и выводя их из него, дает возможность связать вместе с is-, trans-механизмы и механизмы ремоделинга. В свою очередь, понимание того, как эти взаимосвязанные механизмы действуют согласованным образом, варьируя эпигенетические состояния в хроматине все еще остается далеко не полным. Более компактные и репрессивные хроматиновые структуры более высокого порядка (30-нанометровые) могут быть также получены в результате рекрутирования линкерного гистона Н1 и (или) зависящих от модификации, или «архитектурных», факторов, связанных с хроматином, — таких, как белок 1 гетерохроматина (НР1) или Polycomb (PC). Хотя обычно считают, что компактизация нуклеосомного хроматина (11-нанометрового) в 30-нанометровую транскрипционно некомпетентную конформацию осуществляется путем включения линкерного гистона Н1 в интерфазе, функциональное и структурное расчленение этого гистона до недавнего времени было затруднено (Fan et al., 2005). Одна вероятная проблема, связанная с этими исследованиями, заключается в том, что гистон Н1 существует в виде разных изоформ (около 8 у млекопитающих), затрудняя проведение детального генетического анализа. Таким образом, имеет место дублирование между некоторыми изоформами Н1, тогда как другие изоформы могут выполнять тканеспецифичные функции (Kimmins and Sassone-Corsi, 2005). Интересно, что сам Н1 может быть ковалентно модифицирован (фосфорилирован, метилирован, поли(АТФ)рибозилирован и т. д.), создавая возможность того, что cis- и trans-механизмы, проанализированные в настоящее время на коровых гистонах, вполне могут быть распространены и на этот важный класс линкерного гистона, а также на негистоновые белки (Sterner and Berger, 2000). Значительные споры имели место по вопросу о деталях того, каким образом организована 30-нанометровая фибрилла хроматина. В целом были описаны либо «соленоидные» (одностартовая спираль) модели, в которых нуклеосомы постепенно сворачиваются вокруг центральной оси (6–8 нуклеосом на один оборот), либо более открытые модели типа «зигзага», предполагающие самосборку более высокого порядка (двухстартовая спираль). Новые данные, в том числе данные рентгеноструктурного анализа с использованием модельной системы, содержащей четыре нуклеосомы, позволяют предполагать такую организацию фибриллы, которая в большей мере согласуется с двухстартовой, зигзагообразной конформацией линкерной ДНК, соединяющей две стопки нуклеосомных частиц (Khorasanizadeh, 2004; Schalch et al., 2005). Несмотря на этот прогресс, мы отмечаем, что линкерный гистон не присутствует в действительно существующих [current] структурах и даже если бы он там присутствовал, 30-нанометровая хроматиновая фибрилла компактизирует ДНК всего лишь примерно в 50 раз. Таким образом, в организации хроматина существует значительно больше уровней более высокого порядка, которые еще предстоит различить за рамками свето- и электронно-микроскопического исследования и которые обусловливают либо интерфазное, либо митотическое состояния хроматина. Недавние результаты, полученные на живых клетках, несмотря на некоторую структурную неопределенность, уже выявили в интерфазных хромосомах существование множественных уровней сворачивания хроматина выше уровня 30-нанометровой фибриллы. Заслуживающим внимания достижением было развитие новых подходов, позволяющих метить специфические нуклеотидные последовательности ДНК в живых клетках, что создает возможность изучать динамику «открытия» и «закрытия» хроматина in vivo в реальном времени. Интересно, что эти результаты выявляют динамическое взаимодействие позитивных и негативных факторов ремоделинга хроматина в установлении хроматиновых структур более высокого порядка для состояний, в большей или меньшей мере совместимых с экспрессией генов (Fisher and Merkenschlager, 2002; Felsenfeld and Groudin, 2003; Misteli, 2004). Имеет место организация в более крупные петлевидные хроматиновые домены (300–700 нм), возможно путем заякоривания хроматиновой фибриллы на периферии ядра или на других ядерных скаффолдах (остовах) с помощью таких ассоциированных с хроматином белков, как ядерные ламины Остается неясным, в какой степени эти ассоциации дают начало значимым [meaningful] «хромосомным территориям», но многочисленные сообщения показывают, что эта концепция заслуживает серьезного внимания. Например, наблюдали образование кластеров множественных сайтов активного хроматина с транскрипционными факторами РНК-полимеразы II (RNA pol II); аналогичные концепции, по-видимому, приложимы к образованию кластеров вокруг реплицирующейся ДНК и ДНК-полимеразы. Напротив, образование кластеров «молчащего» гетерохроматина (в особенности перицентромерных фокусов) и генов, локализованных в trans-положении, также было документировано (главы 4 и 21). Каким образом эти ассоциации контролируются и насколько ядерная локализация хроматиновых доменов затрагивает регуляцию генома — еще не ясно. Тем не менее, все большее количество данных показывает наличие корреляций активной или «молчащей» конфигурации хроматина с определенной ядерной территорией (Cremer and Cremer, 2001; Gilbert et al., 2004; Janicki et al., 2004; Chakalova et al., 2005). Наиболее конденсированная структура ДНК наблюдается на стадии метафазы митоза или мейоза. Это делает возможным надежное расхождение, с помощью хромосом, точных копий нашего генома (одной или двух копий каждой хромосомы, в зависимости от наблюдаемого типа деления) в каждую дочернюю клетку. Эта конденсация связана с серьезным реструктурированием ДНК из состояния двухметровой, полностью растянутой молекулы в состояние дискретных хромосом размером в среднем 1,5 мкм в диаметре (рис. 3.7). Это не меньше, чем 10 000-кратная компактизация и она достигается путем гиперфосфорилирования линкерного (Н1) и корового гистона H3 и зависящего от АТФ действия конденсиновых и когезиновых комплексов и топоизомеразы II. Остается еще определить, как конкретно негистоновые комплексы затрагивают митотический хроматин (или модификации хроматина фазы М) и по каким правилам происходит (зависимым от клеточного цикла образом) их ассоциация с хроматином и высвобождение из него (Bernard et al., 2001; Watanabe et al., 2001). Здесь может оказаться важным хорошо известное митотическое фосфорилирование гистона H3 (т. е. серинов 10 и 28) и членов семейства Н1, но полного понимания того, в чем заключается функция этих митотических меток, предстоит еще достичь в генетических и биохимических экспериментах. Интересно, что была предложена формальная теория, согласно которой специфические метки, обусловленные метилированием, при сочетании с более динамичными и обратимыми метками, обусловленными фосфорилированием, могут действовать в гистоновых белках как «двоичный переключатель», управляя связыванием и высвобождением эффекторов, находящихся «вниз по течению» и затрагивающих хроматиновую матрицу (Fischle et al., 2003а). Используя связывание НР1 с метилированным по лизину 9 гистоном H3 (H3К9ше) и митотическое фосфорилирование серина 10 (H3S10ph), недавно получили данные в поддержку митотического «метил/фос-переключателя» (Daujat et al., 2005; Fischle et al., 2005; Hirota et al., 2005). Такие специализированные хромосомные домены, как теломеры и центромеры, выполняют другие функции, направленные на динамику хромосом как таковую. Теломеры действуют как хромосомные концы, обеспечивая защиту и уникальное решение проблемы репликации самых кончиков молекул ДНК. Центромеры обеспечивают места прикрепления для микротрубочек веретена во время деления ядра. Оба этих специализированных домена играют фундаментальную роль в событиях, приводящих к надежному расхождению хромосом. Интересно, что и теломерный, и центромерный гетерохроматин отличается от эухроматина и даже других гетерохроматиновых районов (см. ниже) присутствием уникальных хроматиновых структур, которые в основном оказывают репрессивное действие на активность генов и рекомбинацию. Перемещение экспрессируемых генов из их нормального положения в эухроматине в новое положение в центромерном и теломерном гетерохроматине или поблизости от него (главы 4–6) может заставить эти гены «замолчать», создавая возможность описанного ранее скрининга для поиска и идентификации супрессоров или энхансеров эффекта положения мозаичного типа (PEV) или эффектов прителомерного положения (ТРЕ, telomere-position effects; Gottschling et al., 1990; Aparicio et al., 1991). Центромеры и теломеры имеют молекулярные сигнатуры, в том числе, например, гипоацетилированные гистоны. Интересно, что центромеры «маркированы» также присутствием гистонового варианта CENP-A, играющего активную роль в сегрегации хромосом (глава 14). Таким образом, правильная сборка и поддержание различающихся центромерного и перицентромерного гетерохроматина являются критичными для завершения митоза или мейоза и, отсюда, для жизнеспособности клеток. В дополнение к хорошо изученным центромерной и перицентромерной формам конститутивного гетерохроматина успешно исследуются механизмы эпигенетического контроля центромерной (и теломерной) «идентичности». Остроумными экспериментами удалось показать, что вместо нормальных центромер могут функционировать «неоцентромеры», демонстрируя тем самым, что идентичность центромер не диктуется нуклеотидными последовательностями ДНК (главы 13 и 14). Вместо этого данный специализированный хромосомный домен маркируют эпигенетические особенности [hallmarks], в том числе паттерны специфичных для центромер модификаций и варианты гистонов. В вопросе о том, каким образом другие кодирующие, не кодирующие и повторяющиеся участки хроматина вносят свой вклад в эти эпигенетические сигнатуры, достигнут значительный прогресс. Как те или иные из этих механизмов соотносятся (если соотносятся вообще) с паттернами бэндинга хромосом — неизвестно, но остается интригующей возможностью. Необходимо достичь понимания того, как эпигенетически регулируются эти части уникальных хромосомных районов, особенно в свете того, что многочисленные виды рака у человека характеризуются геномной нестабильностью, которая является маркером прогрессии некоторых заболеваний и неоплазии.
6. Различие между эухроматином и гетерохроматином
В этом обзоре эухроматин и гетерохроматин обсуждались раздельно, хотя мы признаем, что существуют множественные формы хроматинов обоих классов. Эухроматин, или «активный» хроматин, состоит в основном из кодирующих последовательностей, составляющих лишь небольшую долю (менее 4 %) генома млекопитающих Какие же молекулярные сигналы маркируют тогда кодирующие последовательности, обладающие потенциалом для продуктивной транскрипции, и каким образом структура хроматина вносит свой вклад в этот процесс? Обширная литература позволяет предполагать, что эухроматин существует в «открытой» (декомпактизированной), более чувствительной к нуклеазам конфигурации, делающей его «готовым» к экспрессии генов, хотя и не обязатаельно транскрипционно активным. Некоторые из этих генов экспрессируются повсеместно (гены «домашнего хозяйства»); другие регулируются ходом развития или индуцируются в ответ на внешние стрессорные факторы. Транскрипцию генов включает совместное действие избранных сА-действующих нуклеотидных последовательностей ДНК (промоторов, энхансеров и участков контроля локусов), связанных с комбинациями trans-действующих факторов, вместе с РНК-полимеразой и ассоциированными факторами (Sims et al., 2004). В совокупности эти факторы подверглись жесткому отбору в ходе эволюции, чтобы инструментовать сложные ряды биохимических реакций, которые должны происходить в «правильной» пространственной и временной последовательности. Обеспечивает ли хроматин «систему индексирования», гарантирующую, что вышеописанная машинерия сможет получить доступ к своим целевым последовательностям в клетках соответствующего типа? На уровне ДНК соседние с промоторами области, богатые АТ, часто лишены нуклеосом и могут существовать в жесткой, неканонической конфигурации ДНК (В-форма), способствующей размещению транскрипционного фактора (TF) (Mito et al., 2005; Sekinger et al., 2005). Однако размещения TF недостаточно для обеспечения транскрипции. Рекрутирование механизмов [machines] ремоделинга нуклеосом посредством индукции активирующих модификаций гистонов (например, ацетилирование и метилирование H3К4) облегчает взаимодействие с механизмами транскрипции; в настоящее время определяют, каким образом это происходит (рис. 3.9 и глава 10). Замена вытесненных гистонов гистоновыми вариантами, после того как механизм транскрипции распутал и транскрибировал хроматиновую фибриллу, обеспечивает целостность хроматиновой матрицы (Ahmad and Henikoff, 2002). Однако образование полностью созревших иРНК также требует протекания посттранскрипционных процессов, в том числе сплайсинга, полиаденилирования и экспорта из ядра. Таким образом, собирательный термин «эухроматин» скорее всего обозначает сложное состояние (состояния) хроматина, охватывающее динамичную и сложную смесь механизмов [machines], тесно взаимодействующих друг с другом и с хроматиновой фибриллой и предназначенных для осуществления транскрипции функциональных РНК. Выяснение «правил», определяющих, каким образом, в самом общем смысле, эти «активирующие механизмы» [«activating machinery»] взаимодействуют с аппаратом транскрипции, а также с хроматиновой матрицей — волнующая область современных исследований, хотя в силу динамичной природы матрицы эту область, строго говоря, можно относить не к эпигенетике, а, скорее, к исследованиям динамики транскрипции и хроматина. Что же тогда обозначает термин «гетерохроматин»? Хотя в исторической ретроспективе он изучен хуже, чем эухроматин, новые открытия заставляют считать, что гетерохроматин играет критически важную роль в организации и правильном функционировании геномов, начиная с дрожжей и кончая человеком (хотя у S. cerevisiae особая форма гетерохроматина). Его потенциальное значение подчеркивается тем фактом, что 96 % генома млекопитающих состоит из некодирующих и повторяющихся последовательностей. Новые открытия, касающиеся механизмов формирования гетерохроматина, выявили неожиданные вещи. Например, транскрипция, неспецифичная по отношению к последовательности и дающая двуспиральную РНК (dsRNA), подвержена сайленсингу по механизму, подобному РНК-интерференции (RNAi) (см. раздел 10). Образование таких dsRNAs действует как «сигнал тревоги», отражая тот факт, что соответствующая нуклеотидная последовательность ДНК не может генерировать функциональный продукт или инвазирвана РНК-транспозонами или вирусами. Эта dsRNA подвергается затем процессингу с помощью Dicer и нацеливается на хроматин комплексами, предназначенными для инициации каскада событий, ведущих к формированию гетерохроматина. В результате использования ряда модельных систем был достигнут заметный прогресс в анализе того, что, по-видимому, является высококонсервативным метаболическим путем, ведущим к «запертому» [«locked-down»] состоянию гетерохроматина. Хотя точная последовательность и детали событий могут варьировать, этот общий путь включает деацетилирование гистоновых «хвостов», метилирование специфических остатков лизина (например, H3К9), рекрутирование ассоциированных с гетерохроматином белков (например, НР1) и метилирование ДНК (рис. 3.9). Вполне вероятно, что секвестрирование отдельных участков генома в репрессивных ядерных доменах или территориях может усилить формирование гетерохроматина. Интересно, что все большее количество данных позволяет предполагать, что гетерохроматин может быть «состоянием по умолчанию», по крайней мере у высших организмов, и что присутствие сильного промотора или энхансера, продуцирующего эффективный транскрипт, может «пересилить» гетерохроматин Общие концепции сборки гетерохроматина приложимы, по-видимому, даже к низшим эукариотам. В число основных особенностей входят гипоацетилированные «хвосты» гистонов, что сопровождается связыванием чувствительных к ацетилированию белков гетерохроматина (например, белки SIR; детали см. в главе 4). В зависимости от вида грибов (например, почкующиеся vs. дробянковые дрожжи) наблюдаются различные объемы метилирования гистонов и HP 1-подобных белков. Даже при том, что эти геномы в большей степени настроены на общее, «по умолчанию», состояние готовности к транскрипции, имеются некоторые гетерохроматин-подобные районы генома (локусы спаривания, теломеры, центромеры и т. д.), которые способны супрессировать транскрипцию генов и генетическую рекомбинацию, когда тестируемые гены оказываются в этом новом соседстве. Какие полезные функции мог бы обслуживать гетерохроматин? Определение центромер, участка конститутивного гетерохроматина, хорошо коррелирует с неким наследуемым эпигенетическим состоянием и, как полагают, эволюционно направляется самым крупным объединением в кластеры повторов и повторяющихся элементов на хромосоме. Это разбиение [partitioning] обеспечивает крупные и относительно стабильные гетерохроматиновые домены, маркированные репрессивными «эпигенетическими сигнатурами», облегчающими сегрегацию хромосом в митозе и мейозе (глава 14). Здесь стоит заметить, что центромерные повторы и соответствующие эпигенетические метки, ассоциирующиеся с ними, дуплицировались и переместились на другие хромосомные плечи для создания «молчащих доменов» у таких организмов, как дробянковые дрожжи. Конститутивный гетерохроматин в теломерах (защитных концах хромосом) аналогичным образом обеспечивает стабильность генома, выступая в роли хромосомных «кэпов». Наконец, известно, что формирование гетерохроматина является механизмом защиты от инвазивной ДНК В совокупности эти открытия подчеркивают тот общий взгляд, что гетерохроматин обслуживает важные функции по поддержанию генома, которые могут соперничать даже с функциями самого эухроматина. Подводя итог, можно сказать, что широкие функциональные различия между эухроматином и гетерохроматином в настоящее время можно приписать трем известным характеристикам хроматина. Во-первых, это природа нуклеотидной последовательности ДНК — например, содержит ли она обогащенную АТ «жесткую» ДНК поблизости от промоторов, повторяющиеся последовательности и (или) последовательности, связывающие репрессоры, которые сигнализируют об ассоциации фактора. Во-вторых, качество РНК, продуцируемой в ходе транскрипции, определяет, будет ли она полностью подвергнута процессингу в иРНК, которая может быть транслирована, или же эта РНК будет деградирована или помечена для использования механизмом RNAi в целях гетерохроматинизации. В-третьих, пространственная организация в ядре может играть существенную секвестрирующую роль в поддержании локальных конфигураций хроматина. Рис. 3.9. Различие между эухроматиновыми и гетерохроматиновыми доменами
Рисунок, суммирующий различия между эухроматином и конститутивным гетерохроматином. В их числе — различия в типе продуцируемых транскриптов, в рекрутировании связывающихся с ДНК белков (т. е. транскрипционного фактора [TF]), в ассоциированных с хроматином белках и комплексах, в ковалентных модификациях гистонов и в составе вариантных гистонов
Рис. 3.9. Различие между эухроматиновыми и гетерохроматиновыми доменами
Рисунок, суммирующий различия между эухроматином и конститутивным гетерохроматином. В их числе — различия в типе продуцируемых транскриптов, в рекрутировании связывающихся с ДНК белков (т. е. транскрипционного фактора [TF]), в ассоциированных с хроматином белках и комплексах, в ковалентных модификациях гистонов и в составе вариантных гистонов
7. Модификации гистонов и гистоновый код
Мы рассмотрели, каким образом модификации гистонов могут изменять хроматиновую матрицу посредством cis-эффектов, изменяющих межнуклеосомные контакты и промежуточные расстояния, или же trans-эффектов, вызываемых ассоциациями гистоновых и негистоновых белков с матрицей. Каков же вклад и биологический результат модификаций гистонов? Типы структуры хроматина, коррелирующие с модификациями гистоновых «хвостов», выявились в результате исследований, в которых использовалась основная масса гистонов и которые позволили предположить, что эпигенетические метки могут обеспечить сигнатуры «ВКЛЮЧЕНО» (т. е. активно) или «ВЫКЛЮЧЕНО» (т. е. неактивно). Это выяснилось в результате длительных исследований большей частью коррелятивного характера, которые показали, что определенные модификации гистонов, в особенности их ацетилирование, связаны с доменами активного хроматина или с участками, в целом пермиссивными для транскрипции В противоположность этому другие метки, такие как некоторые фосфорилированные остатки гистонов, давно ассоциировались с конденсированным хроматином, который, в целом, не поддерживает транскрипционную активность. Модификации гистонов, приведенные в Приложении 2, суммируют известные в настоящее время сайты модификаций. Здесь мы подчеркиваем, что приведенный материал отражает модификации и сайты, которые не обязательно характерны для любого организма. Прежде всего, обсудим, каким образом производятся или удаляются модификации гистонов. Большая работа, проведенная в области исследования хроматина, позволила предположить, что модификации «хвостов» гистонов образуются («записываются») или удаляются («стираются») в результате каталитического действия ассоциированных с хроматином ферментативных систем. Однако исследователям годами не удавалось идентифицировать эти ферменты. За последнее десятилетие было идентифицировано очень большое число модифицирующих хроматин энзимов из различных источников; большая часть этих данных собрана в Приложении 2. Этот успех был достигнут в результате многочисленных биохимических и генетических исследований. Эти ферменты часто входят в состав крупных, состоящих из многих субъединиц комплексов, которые могут катализировать включение или удаление ковалентных модификаций как в гистоновых, так и в негистоновых мишенях. Более того, многие из этих энзимов катализируют свои реакции с замечательной специфичностью по отношению к остатку-мишени и к клеточному контексту (т. е. в зависимости от внешних или внутренних сигналов). Для ясности, а также в качестве примера, мы кратко обсудим четыре главные ферментативные системы, которые катализируют модификации гистонов, вместе с ферментативными системамипротивоположного действия, обеспечивающими реверсию этих модификаций (рис. 3.10) (Vaquero et al., 2003; Holbert and Marmorstein, 2005). В совокупности эти антагонистические активности управляют устойчивым балансом каждой рассматриваемой модификации. Ацетилазы гистонов (HATs) ацетилируют остатки специфических лизинов в гистоновых субстратах (Roth et al., 2001); реверсия обеспечивается действием деацетилаз гистонов (HDACs) (Grozinger and Schreiber, 2002). Ферменты семейства гистоновых киназ фосфорилируют остатки специфических серинов или треонинов. а фосфатазы (РРТазы) удаляют метки, созданные фосфорилированием. Особенно хорошо известны митотические киназы, такие как циклин-зависимая киназа или киназа «aurora», катализирующая фосфорилирование корового (H3) и линкерного (Н1) гистонов. Менее очевидны в каждом из этих случаев противостоящие РРТазы, действие которых ревертирует результат этого фосфорилирования, когда клетки выходят из митоза. Были описаны два общих класса метилирующих ферментов: PRMTs (protein arginine methyltransferases — метилтрансферазы аргининов белка), субстратом которых является аргинин (Lee et al., 2005), и HKMTs (histone lysine methyltransferases — метилтрансферазы лизинов гистонов), действующие на остатки лизина (Lachner et al., 2003). Метилирование аргининов косвенным образом ревертируется действием дезиминаз, которые конвертируют метиларгинин (или аргинин) в остаток цитруллина (Bannister and Kouzarides, 2005). Метилированные остатки лизина оказываются химически более стабильными. Было показано, что метилированный лизин существует в моно-, ди- и триметилированном состояниях. Несколько триметилированных остатков на аминоконцах H3 и Н4, по-видимому, обладают возможностью стабильно воспроизводиться в ходе клеточных делений (Lachner et al., 2004), как и метка H4K20mel в имагинальных дисках Drosophila (Reinberg et al., 2004). Недавно была описана лизин-специфичная «деметилаза» (LSD1) как аминооксидаза, способная удалять метилирование H3К4 (Shi et al., 2004). Этот энзим действует путем FSD-зависимой окислительной дестабилизации аминометильной связи, что приводит к образованию немодифипированного лизина и формальдегида. Было показано, что LSD1 действует избирательно в отношении активирующей H3К4 метки, созданной метилированием, и может дестабилизировать только моно- и ди-, но не триметилирование. Эта деметилаза является частью большого репрессивного белкового комплекса, который содержит также HDACs и другие энзимы Другие данные позволяют предполагать, что LSD1 может соединяться в комплекс вместе с рецептором андрогена в локусах-мишенях и деметилирует репрессивную гистоновую метку H3K9me2, внося вклад в транскрипционную активацию (Metzger et al., 2005). Другой класс гистоновых деметилаз, согласно данной ему храктеристике. работает с помощью более мощного механизма, механизма радикальной атаки, известного как гидроксилазы или диоксигеназы (Tsukada et al., 2006). Одна из них дестабилизирует только H3K36me2 (активная метка), но не триметилированное состояние. Эта новая гистоновая деметилаза jumonji (JHDM1) содержит консервативный домен jumonji, которых в геноме млекопитающих известно около 30; это позволяет предполагать, что некоторые из этих энзимов, может быть, могут атаковать и другие остатки, так же как триметильное состояние (Fodor et al., 2006; Whetstine et al., 2006). Значительный прогресс был достигнут в анализе систем ферментов, управляющих устойчивым балансом этих модификаций, и мы подозреваем, что в этой увлекательной области будут достигнуты гораздо большие успехи. Остается понять, как регулируются эти ферментативные комплексы и как становятся мишенями их физиологически релевантные субстраты и сайты. Кроме того остается неясным, как ковалентные механизмы влияют на эпигенетические явления. Рис. 3.10. энзимы, модифицирующие гистоны
Ковалентные модификации гистонов трансдуцируются ферментами, модифицирующими гистоны («писателями»), и удаляются активностями противоположного действия. Они делятся на классы в соответствии с типом ферментативного действия (например. ацетилирование или фосфорилирование). Белковые домены со специфическим сродством к модификации гистонового «хвоста» называются «читателями» (HAT) ацетилтрансфераза гистона; (PRMT) протеин-аргинин-метилтрансфераза; (HKMT) метилтрансфераза лизина гистонов; (HDAC) деацетилаза гистонов; (РРТаза) протеинфосфатазы; (Ас) ацетилирование; (Р) фосфорилирование; (Ме) метилирование
Рис. 3.10. энзимы, модифицирующие гистоны
Ковалентные модификации гистонов трансдуцируются ферментами, модифицирующими гистоны («писателями»), и удаляются активностями противоположного действия. Они делятся на классы в соответствии с типом ферментативного действия (например. ацетилирование или фосфорилирование). Белковые домены со специфическим сродством к модификации гистонового «хвоста» называются «читателями» (HAT) ацетилтрансфераза гистона; (PRMT) протеин-аргинин-метилтрансфераза; (HKMT) метилтрансфераза лизина гистонов; (HDAC) деацетилаза гистонов; (РРТаза) протеинфосфатазы; (Ас) ацетилирование; (Р) фосфорилирование; (Ме) метилирование
Модификации гистонов происходят не изолированно, а на основе комбинирования, как это предполагается — для модификационных кассет (т. е. ковалентных модификаций в соседних остатках определенного гистонового «хвоста», например H3К9те и H3S10ph или H4Slph, H4R3me и H4K4ас) и trans-гистоновых путей (ковалентных модификаций между разными «хвостами» гистонов или нуклеосомами; рис. 3.11). Интригует тот факт что почти все известные модификации гистонов коррелируют с активирующей или репрессивной функциями, в зависимости от того, какой аминокислотный остаток (остатки) в аминоконце гистона модифицирован Описаны как синергистические, так и антагонистические пути (Zhang and Reinberg, 2001; Berger, 2002; Fischle et al., 2003b), которые могут постепенно индуцировать комбинации активных меток, одновременно противодействуя репрессивным модификациям. Неизвестно, однако, сколько разных комбинаций модификаций по различным аминотерминальным позициям гистонов существует для любой данной нуклеосомы, потому что большинство исследований было выполнено на препаратах суммарных гистонов. Недавно было показано, что на структуру и сборку хроматина влияют, кроме аминоконцов, модификации в глобулярных доменах гистонов (Cosgrove et al., 2004), регулируя тем самым экспрессию генов и репарацию повреждений ДНК (van Attikum and Gasser, 2005; Vidanes et al., 2005). Стоит также упомянуть, что несколько модифицирующих гистоны энзимов избирают своей мишенью и негистоновые субстраты (Sterner and Berger, 2000; Chuikov et al., 2004). Рисунок 11 иллюстрирует два примера установленных иерархий гистоновых модификаций, которые, по-видимому, индексируют транскрипцию активного хроматина или, напротив, определяют рисунок гетерохроматиновых доменов. Эти исследования ставят вопрос о том, существует ли «гистоновый код» или даже «эпигенетический код». Хотя эта теоретическая концепция оказалась весьма стимулирующей, и было показано, что в некоторых своих предсказаниях она правильна, вопрос 6 том, действительно ли существует некий код, остается в значительной степени открытым. Для сравнения скажем, что генетический код оказался крайне полезным ввиду возможности делать предсказания на его основе и благодаря его почти полной универсальности Он использует в основном «алфавит» из четырех оснований в ДНК (т. е. нуклеотидов), образуя в целом инвариантный и почти универсальный язык. В противоположность этому современные данные заставляют считать, что картины гистоновых модификаций значительно варьируют от организма к организму, особенно между низшими и высшими эукариотами, например дрожжами и человеком. Таким образом, даже если гистоновый код и существует, он, вероятно, не универсален. Эта ситуация становится еще более сложной, когда учитывается динамическая природа гистоновых модификаций, варьирующих в пространстве и во времени. Более того, хроматиновая матрица вовлекает в процесс ошеломляющее количество факторов ремоделинга (Vignali et al., 2000; Narlikar et al., 2002; Langst and Becker, 2004; Smith and Peterson, 2005). Однако анализ с использованием иммунопреципитации хроматина (ChIP) в масштабах целого генома (ChIP on chip) начал выявлять неслучайные и в какой-то мере предсказуемые паттерны в нескольких геномах (например, S. pombe, A. thaliana, клетки млекопитающих) — такие как сильные корреляции H3К4me3 с активированными участками промотора (Strahl et al. 1999; Santos-Rosa et al., 2002; Bernstein et al., 2005), a также метилирования H3K9 (Hall et al. 2002; Lippman et al., 2004; Martens et al., 2005) и H3K27 (Litt et al., 2001; Ringrose et al., 2004) с «молчащим» гетерохроматином. Возможно, ограничением гистонового кода является то обстоятельство, что одна модификация не транслируется неизменно в один биологический выходной сигнал. Однако действуя в комбинации или кумулятивным образом, модификации, по-видимому, действительно определяют биологические функции и вносят свой вклад в них (Henikoff, 2005).
 Рис. 3.11. Координированная модификация хроматина
Переход не подвергавшейся воздействию хроматиновой матрицы в активный эухроматин (слева) или образование репрессивного гетерохроматина (справа), включающие ряд скоординированных модификаций хроматина. В случае активации транскрипции это сопровождается действием комплексов ремоделинга нуклеосом и замещением коровых гистонов гистоновыми вариантами (желтый цвет, а именно H3.3)
Рис. 3.11. Координированная модификация хроматина
Переход не подвергавшейся воздействию хроматиновой матрицы в активный эухроматин (слева) или образование репрессивного гетерохроматина (справа), включающие ряд скоординированных модификаций хроматина. В случае активации транскрипции это сопровождается действием комплексов ремоделинга нуклеосом и замещением коровых гистонов гистоновыми вариантами (желтый цвет, а именно H3.3)
8. Комплексы, осуществляющие ремоделинг хроматина, и варианты гистонов
Другим важным механизмом, посредством которого индуцируются переходы в хроматиновой матрице, является выработка сигналов [signaling] для рекрутирования комплексов «ремоделинга» хроматина, использующих энергию (гидролиз АТФ) для изменения хроматина и состава нуклеосом нековалентным образом. Нуклеосомы, особенно когда они связаны репрессивными факторами, ассоциированными с хроматином, нередко «навязывают» транскрипционной машине состояние значительного подавления. Отсюда лишь некоторые транскрипционные факторы и регуляторы, специфичные к определенным последовательностям (хотя и не базовая транскрипционная машина), способны получать доступ к сайту (сайтам) своего связывания. Эта проблема доступа решается, хотя бы отчасти, белковыми комплексами, которые мобилизуют нуклеосомы и (или) изменяют нуклеосомную структуру. Ремоделинг хроматина часто функционирует совместно с ферментами, активирующими модификации хроматина, и связанные с ним активности в целом можно разделить на два семейства: семейство SNF2H, или ISWI, и семейство Brahma, или SWI/SNF. Семейство SNF2H/ ISWI мобилизует нуклеосомы вдоль ДНК (Tsukiyama et al., 1995: Varga-Weisz et al., 1997), тогда как Brahma/SWI/ SNF на время изменяет структуру нуклеосомы, экспонируя контакты ДНК: гистон с использованием механизмов, которые только сейчас начинают раскрываться (глава 12). Кроме того, некоторые из гидролизующих АТФ активностей схожи с «обменными комплексами», которые сами предназначены для замещения обычных коровых гистонов специализированными «вариантными» гистоновыми белками. Эта осуществляемая с затратами АТФ перетасовка в действительности может быть средством замещения существующих модифицированных гистоновых «хвостов» новым, свободным от старого, набором вариантных гистонов (Schwartz and Ahmad, 2005). Альтернативная возможность заключается в том, что рекрутирование таких комплексов ремоделинга хроматина, как SAGA (Spt-Ada-Gcn5-aцeтилтpaнcфepaзa), может быть также усилено пред существующими модификациями гистонов, чтобы обеспечить транскрипционную компетентность промоторов-мишеней (Grant et al., 1997; Hassan et al., 2002). В дополнение к инициации транскрипции и установлению первичного контакта с промоторным районом прохождению РНК-полимеразы II (или РНК-полимеразы 1) во время происходящей в ходе транскрипции элонгации препятствует, сверх того, присутствие нуклеосом Поэтому требуются механизмы для обеспечения завершения образующихся транскриптов (особенно с длинных генов). В частности, ряд гистоновых модификаций и докинг-эффекторов действуют совместно с такими комплексами ремоделинга хроматина, как SAGA и FACT (для облегчения транскрипции хроматина) (Orphanides et al., 1998), обеспечивая прохождение РНК-полимеразы II через нуклеосомные порядки. Эта совместная активность обычно индуцирует, например, увеличенную мобильность нуклеосом, смещает димеры Н2А/Н2В и стимулирует обмен коровых гистонов на гистоновые варианты. Как таковая, она дает прекрасный пример тесного взаимодействия между модификациями гистонов, ремоделингом хроматина и обменом на гистоновые варианты для облегчения инициации транскрипции и последующей элонгации (Sims et al., 2004). Были охарактеризованы и другие комплексы ремоделинга, такие как Mi-2 (Zhang et al., 1998; Wade et al., 1999) и INO-80 (Shen et al., 2000), участвующие в стабилизации репрессированного, а не активного хроматина. Композиционные различия хроматиновой фибриллы, которые возникают благодаря присутствию гистоновых вариантов, вносят вклад в индексирование участков хромосом для специальных функций Каждый гистоновый вариант представляет собой замену для конкретного корового гистона (рис. 3.12), хотя гистоновые варианты часто составляют малую долю от всей массы гистонов, в силу чего их труднее исследовать, чем регулярные гистоны. Возрастающий объем литературы (обзор см.: Henikoff and Ahmad, 2005; Sarma and Reinberg, 2005) свидетельствует, что гистоновые варианты обладают своей собственной характеристикой восприимчивости к модификациям, вероятно определяемой небольшим числом аминокислотных замен, отличающих их от членов их семейства. С другой стороны, некоторые варианты гистонов имеют отличающиеся амино- и карбокситерминальные домены с уникальной, в отношении регуляции хроматина, активностью и различным сродством к связывающимся факторам. В качестве примера можно привести транскрипционно активные гены, у которых гистон H3 заменен вариантом H3.3, в связанном с транскрипцией механизме, который не требует репликации ДНК (Ahmad and Henikoff, 2002). Замещение корового гистона Н2А вариантом H2A.Z коррелирует с транскрипционной активностью и может индексировать 5 — конец свободных от нуклеосом промоторов. Однако H2A.Z был ассоциирован также и с репрессированным хроматином. CENP-A, специфичный для центромеры вариант гистона H3, существен для центромерной функции и, отсюда, для сегрегации хромосом. Н2А.Х, вместе с другими гистоновыми метками, ассоциируется с выявлением повреждений ДНК и, по-видимому, индексирует повреждение в ДНК для рекрутирования комплексов репарации повреждений ДНК. МакроН2А — вариант гистона, специфически ассоциирующийся с неактивной Х-хромосомой (Xi) у млекопитающих (дальнейшие детали по вариантам гистонов см. в главе 13). Рис. 3.12. Варианты гистонов
Доменная структура белка для коровых гистонов (H3, Н4, Н2А, Н2В), линкерного гистона Н1 и вариантов гистонов H3 и Н2А. Показаны свернутый домен гистона (HFD — histone fold domain), где происходит димеризация гистона, и участки белка, отличающиеся у гистоновых вариантов (показаны красным цветом)
Рис. 3.12. Варианты гистонов
Доменная структура белка для коровых гистонов (H3, Н4, Н2А, Н2В), линкерного гистона Н1 и вариантов гистонов H3 и Н2А. Показаны свернутый домен гистона (HFD — histone fold domain), где происходит димеризация гистона, и участки белка, отличающиеся у гистоновых вариантов (показаны красным цветом)
Важно отметить (и это противоречит обычно встречающемуся в учебниках утверждению, что гистоны синтезируются и занимают свое место только во время S-фазы), что синтез и замещение многих из этих гистоновых вариантов происходят независимо от репликации ДНК. Следовательно, замещение коровых гистонов гистоновыми вариантами не ограничено стадиями клеточного цикла (т. е. S-фазой), но может немедленно вступать в силу в ответ на действующие в данный момент механизмы (например, транскрипционную активность или напряжение кинетохора во время клеточного деления) или стрессовые сигналы (например, повреждение ДНК или голодание). Элегантные биохимические исследования позволили документировать ремоделинг хроматина или обменные комплексы, специфичные для замещения отдельных гистоновых вариантов, таких как H3.3, H2A.Z или Н2А.Х (Cairns, 2005; Henikoff and Ahmad, 2005; Sarnia and Reinberg, 2005). Например, замещение H3 вариантом H3.3 опосредуется действием обменного комплекса HIRA (регулятор гистона A) (Tagani et al., 2004), а Н2А замещается H2A.Z благодаря активности обменного комплекса SWR1 (связанная с Swi2/ Snf2 АТФаза I) (Mizuguchi et al., 2004). В совокупности эти замещения позволяют вариантным нуклеосомам строить особенно активный хроматин. Для некоторых других гистоновых вариантов механизм «нацеливания» и обмена еще остается определить; они осуществляются либо через зависимый от АТФ комплекс обмена гистонов, либо через шаперонный белок гистонов Сейчас даже постулировали, что обменные комплексы могут существовать для замещения модифицированных гистонов их модифицированными партнерами как механизм для стирания более прочных эпигенетических меток, размещенных в аминоконцах гистонов. Метилирование ДНК — эпигенетический механизм, о котором раньше других стало известно, что он коррелирует с репрессией генов (Razin and Riggs, 1980). В той
9. Метилирование ДНК
или иной степени оно имеет место у всех эукариот за исключением дрожжей. Эта модификация заключается в добавлении метальной группы к цитозиновым остаткам матрицы ДНК. У млекопитающих она происходит по динуклеотидам, тогда как у N. crassa и растений известны другие паттерны метилирования, симметричные, асимметричные и не по CpG. Распределение метилированной ДНК по геному показывает ее повышенное содержание в некодирующих районах (например, центромерном гетерохроматине) и в рассеянных (interspersed) повторяющихся элементах (транспозонах), но не в островках CpG активных генов (Bird, 1986). Действительно, повышенные уровни метилирования ДНК коррелируют с относительным увеличением содержания некодирующей и повторяющейся ДНК в геномах высших эукариот (рис. 3.15 в разделе 11). Экспериментальные данные показывают, что это происходит потому, что метилирование ДНК служит главным образом как защитный механизм, чтобы подавлять значительную часть генома чужеродного происхождения (т. е. реплицированные перемещающиеся элементы, вирусные последовательности и другие повторяющиеся последовательности). ДНК-метилтрансферазы (DNMTs) являются «эффекторами» метилирования ДНК и катализируют либо метилирование de novo (т. е. в новых сайтах), либо поддерживающее метилирование полуметилированной ДНК после репликации ДНК (глава 18). Утрата способности поддерживать метилирование ДНК может приводить к некоторым заболеваниям, таким как ICF (Immunodeficiency, Centromeric instability, and Facial abnormalities — иммунодефицит, центромерная нестабильность и лицевые аномалии) (главы 18 и 23) Дерегуляция в уровнях метилирования ДНК вносит вклад и в прогрессию рака (глава 24). Что представляют собой сигналы, направляющие DNMTs для метилирования определенных участков ДНК? В настоящее время известно, что для того, чтобы «направить» метилирование ДНК de novo, высокоповторяющиеся тандемные последовательности в геноме (например, перицентромерный хроматин) «опираются» на репрессивные метки метилирования по H3К9, как это показано у N. crassa и растений (главы 6 и 9). Рассеянные (interspersed) повторы также могут сигнализировать о метилировании ДНК de novo, как это описано в контексте RIP у N. crassa (Tamaru and Selker, 2001) и сайленсинга ретротранспозонов в зародышевом пути у самцов млекопитающих. Отвечающий за это белок идентифицирован (Dnmt3L) и мог бы функционировать путем сканирования генома для отыскания высоких уровней границ «гомология — гетерология», служащих сигналом о необходимости метилирования ДНК (Bourc’his and Bestor, 2004). У растений сигнал для метилирования ДНК de novo обеспечивают РНК посредством уникального механизма, названного РНК-зависимым метилированием ДНК (RdDM; глава 9). Имеются данные о том, что для глобальных паттернов метилирования ДНК почему-то необходимы комплексы, осуществляющие ремоделинг хроматина и относящиеся к семейству SWI/SNF, как это показано на растениях (Jeddeloh et al., 1999) для белка DDM1 и на млекопитающих с помощью гомолога Lshl (Yan et al. 2003). Наконец, белок EZH2 (относящийся к HKMT-PcG) тоже может участвовать в «направлении» метилирования ДНК в некоторых промоторах у млекопитающих (Vire et al., 2005). Способ, посредством которого установившееся метилирование ДНК может обусловливать сайленсинг хроматина, выяснен еще не полностью, хотя данные указывают на trans-регуляцию. Белки, связывающиеся с метилированными цитозинами и названные доменными белками, связывающимися с метил-CpG (MBD), могут рассматриваться как основанный на метилировании ДНК эквивалент элементов связывания [binders] (или «считывателей») модифицированных гистоновых мотивов (рис. 3.13). Например, белок, связывающийся с метил цитозином (МеСР2), связывается с метилированными CpG и рекрутирует HDACs, служа связующим звеном для репрессивных гистоновых меток (глава 18) Известно также, что метилирование ДНК нарушает сайты распознавания регуляторов транскрипции (например, СЕСА), участвующих в геномном импринтинге (глава 19). Наличие метилированной ДНК в импринтированных локусах, обусловливающей сайленсинг либо материнской, либо отцовской аллели у растений и плацентарных млекопитающих, позволяет предположить, что в ходе эволюции эти организмы уникальным образом приспособили этот эпигенетический механизм для стабилизации репрессии генов. Интересно отметить, что у сумчатых метилирования ДНК в импринтированных локусах нет, что указывает на то, что вовлечение этого механизма в импринтинг у млекопитающих является относительно недавним эволюционным событием (главы 17 и 19). Напротив, у таких двукрылых насекомых, как Drosophila, метилирование ДНК как функциональный эпигенетический механизм в основном утрачено (Lyko, 2001). Высокоповторяющиеся участки генома млекопитающих, обычно метилированные, становятся все более мутагенными, когда они не метилированы, — до такой степени, что вызывают глобальную геномную нестабильность (Chen et al., 1998). В результате возникают хромосомные аномалии, являющиеся главной причиной многих болезней и прогрессии рака (см. раздел 15). Это подчеркивает решающую роль метилирования ДНК в обеспечении целостности генома. С другой стороны, отдельные метилированные остатки цитозинов весьма предрасположены к спонтанному мутированию. Таким образом, со временем в результате реакции дезаминирования возникают транзиции С-Т (рис. 3.13), но полагают, что эта характеристика благоприятна для защиты хозяйского генома, потому что она постоянно дезактивирует такие паразитические нуклеотидные последовательности ДНК, как транспозоны. В ином контексте эта же самая химическая реакция активно катализируется дезаминазой, индуцируемой активацией, или AID (activation-induced deaminase). Экспрессия этого энзима в В- и Т-клетках вызывает «соматические гипермутации» в иммуноглобулиновом локусе (lg). Это важный механизм расширения репертуара рецепторов антигенов и, отсюда, усиления иммунитета у млекопитающих (Petersen-Mahrt, 2005; Глава 21). Экспрессия AID, наблюдаемая в раннем развитии млекопитающих, привела к предположению, что она может обеспечивать альтернативный путь к деметилированию ДНК, хотя это происходило бы на фоне риска повышенной частоты точечных мутаций.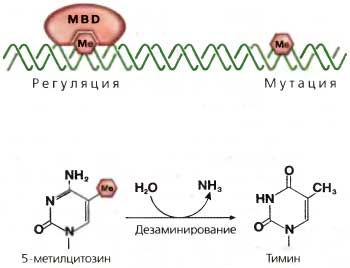 Рис. 3.13. Метилирование и дезаминирование ДНК
Метилированные (Ме) цитозиновые нуклеотиды могут быть связаны с метилДНК-связывающимися белками (MBD) Несвязанный 5-метилцитозин склонен спонтанно мутировать в результате дезаминирования (реакция, изображенная в нижней части рисунка); в результате в нуклеотидной последовательности ДНК происходит траH3иция 5-метил-СрС в ТрА
Рис. 3.13. Метилирование и дезаминирование ДНК
Метилированные (Ме) цитозиновые нуклеотиды могут быть связаны с метилДНК-связывающимися белками (MBD) Несвязанный 5-метилцитозин склонен спонтанно мутировать в результате дезаминирования (реакция, изображенная в нижней части рисунка); в результате в нуклеотидной последовательности ДНК происходит траH3иция 5-метил-СрС в ТрА
Метилирование ДНК и метилирование гистонов являются известными механизмами эпигенетической регуляции генома Некодирующие РНК, как описано в следующем разделе, являются важными первичными триггерами для индукции «молчащего» хроматина. Известно также, что молекулы РНК могут быть интенсивно метилированы по сахарному или нуклеозидному скелету. Более того, показано, что метилирование малых некодирующих РНК на З’-конце стабилизирует эти молекулы (Yu et al., 2005). Любопытно, что Dnmt2 недавно была идентифицирована как метилтрансфераза тРНК (Goll et al., 2006). Поэтому похоже, что РНК-метилтрансферазы, подобные DNMTs и HKMTs, могут существовать как «считыватели» эпигенетической информации, хотя прямых данных, подтверждающих это, нет. Однако метилирование РНК, по-видимому, «чувствуется» определенными Toll-подобными рецепторами (трансмембранными рецепторами, которые распознают молекулярные мотивы обычных патогенов), чтобы опосредовать врожденный иммунитет (Ishii and Akira, 2005), что говорит в пользу такой гипотезы. Возникает интересная возможность, что метилирование РНК может все же быть эпигенетической модуляцией на основе третьей формы метилирования.
10. РНКи и сайленсинг генов, направляемый РНК
Сведения о том, что конститутивный гетерохроматин в центромерах и теломерах играет инструктивную роль в обеспечении целостности генома, способствовали сдвигу парадигмы во взглядах на повторяющуюся некодирующую «мусорную» ДНК. Возможно ли, что эти повторяющиеся последовательности служат каким-то «незряшным» целям, которые еще только начинают проясняться? Не может ли даже быть так, что эти нуклеотидные последовательности ДНК не являются полностью «молчащими»? Такая возможность вытекает из фундаментальной серии открытий, связывающих РНКи с образованием «молчащего» хроматина (гетерохроматина). РНКи является защитным механизмом организма-хозяина, который разбивает dsRNA на мелкие молекулы РНК (известные как короткие интерферирующие РНК или siRNA). Этот процесс в конечном счете приводит к деградации РНК или к использованию этих малых РНК для подавления трансляции, известного как посттранскрипционный сайленсинг (PTGS). Открытый позже механизм транскрипционного сайленсинга генов (TGS), ведущего к образованию гетерохроматина, был обнаружен в результате конвергенции независимых линий исследования хроматина и механизма РНК-интерференции. С одной стороны, многое известно о репрессивном метилировании ДНК (у грибов, растений и млекопитающих), модификациях хроматина (например, H3К9me3) и ассоциированных с хроматином факторах (НР1), характерных для доменов гетерохроматина. С другой стороны, исследователи преуспели в идентификации факторов механизма РНКи (например, Dicer, Argonaute, РНК-зависимой РНК-полимеразы, или RdRP). Наиболее убедительный прогресс, связавший вместе эти вроде бы разные области, был достигнут в элегантных исследованиях на S. pombe, в которых мутации любого компонента механизма РНКи приводили к дефектам в расхождении хромосом (Hall et al., 2002; Reinhart and Bartel, 2002; Volpe et al., 2002). Это было вызвано неспособностью стабилизировать центромерный гетерохроматин и подчеркивало, по-видимому, широко распространенную роль механизмов, опосредованных РНКи, в образовании доменов «молчащего» гетерохроматина. Это также высветило значение гетерохроматина помимо транскрипционного сайленсинга генов — его роль в поддержании целостности генома и, отсюда, жизнеспособности, как показывает необходимость центромерного гетерохроматина для процесса расхождения хромосом. Появляющиеся данные позволяют также предполагать, что siRNAs требуются для определения других специализированных районов функционального гетерохроматина, таких как теломеры. Транскрипция с обеих нитей ДНК прицентромерных районов у S. pombe и выявление прошедших процессинг дериватов siRNAs явились сильным доказательством того, что дериват dsRNA был важнейшим субстратом для «нацеливания» комплекса RITS на центромеры для сайленсинга (рис. 3.14) (Verdel et al., 2004). Более того, мутанты clr4 (имеющийся у S. pombe ортолог Suv39h HKMT млекопитающих) были не способны процессировать dsRNA до siRNAs, усиливая тем самым доводы в пользу взаимосвязи между механизмом РНКи и сборкой гетерохроматина (Motamedi et al., 2004). Каким именно образом siRNAs, генерируемые механизмом RNAi (т. е. Dicer, Argonaute, RdRP), инициируют сборку гетерохроматина или направляют ее на соответствующие локусы в геноме, все еще неизвестно Была предложена модель, в которой сложное взаимодействие между входящим в состав механизма RNAi комплексом RITS и центромерными повторами ведет к самоусиливающемуся циклу формирования гетерохроматина, включающему Clr4, HDACs, Swi6 (ортолог НР1 млекопитающих) и когезин, вероятно через направляемый Ago отжиг гибридов РНК: РНК до образующегося транскрипта (рис. 3.14) (главы 6 и 8). У Tetrahymena аналогичный механизм «нацеливания», опосредованного РНК, направляет уникальный процесс элиминации ДНК в соматическом ядре. В этом случае на соответствующей стадии полового процесса происходит, с обеих нитей, транскрипция внутреннего элиминируемого сегмента (IES — internal eliminated segment) в «молчащем» геноме зародышевого пути (микронуклеарном геноме) (Chalker and Yao, 2001; Mochizuki et al., 2002). Аналогично модели TGS, зависимого от RNAi, была предложена модель сканирующей РНК (scnRNA) для объяснения того, как нуклеотидные последовательности ДНК в родительском макронуклеусе могут эпигенетически контролировать геномные изменения в новом макронуклеусе с участием малых РНК (детали см. в главе 7). Эти волнующие результаты впервые демонстрируют RNAi-подобный процесс, непосредственно изменяющий соматический геном. Возникает любопытная возможность, что межгенные РНК, продуцируемые в локусе V-DJ (Bolland et al., 2004), потенциально могут направлять элиминацию нуклеотидной последовательности ДНК в ходе V-DJ-рекомбинации локуса тяжелой цепи иммуноглобулина (IgH) в В-клетках и локусов Т-клеточного рецептора (TCR) в Т-клетках. Рис. 3.14. Направляемое РНК формирование гетерохроматина
Комплементарные транскрипты dsRNA, получающиеся путем транскрипции обеих нитей ДНК или складывания на себя транскриптов с инвертированных повторов, приводят к образованию siRNAs благодаря действию Dicer (верхняя часть рисунка). Включение этих siRNAs в комплекс RITS посредством связывания с белком Argonaute (Ago) активирует этот комплекс к «нацеливанию» его на комплементарную ДНК или вновь образующуюся РНК. Этот комплекс привлекает Clr4. который трансдуцирует гистон H3K9me2. Специфичный для этой модификации «связыватель», Swi6, связывается с этими модифицированными гистонами, облегчая распространение репрессивного хроматинового домена. Действие RdRP амплифицирует уровни содержания siRNAs, используя существующие siRNAs в качестве праймеров и усиливая тем самым способность комплекса RITS «нацеливаться» на специфические участки ДНК
Рис. 3.14. Направляемое РНК формирование гетерохроматина
Комплементарные транскрипты dsRNA, получающиеся путем транскрипции обеих нитей ДНК или складывания на себя транскриптов с инвертированных повторов, приводят к образованию siRNAs благодаря действию Dicer (верхняя часть рисунка). Включение этих siRNAs в комплекс RITS посредством связывания с белком Argonaute (Ago) активирует этот комплекс к «нацеливанию» его на комплементарную ДНК или вновь образующуюся РНК. Этот комплекс привлекает Clr4. который трансдуцирует гистон H3K9me2. Специфичный для этой модификации «связыватель», Swi6, связывается с этими модифицированными гистонами, облегчая распространение репрессивного хроматинового домена. Действие RdRP амплифицирует уровни содержания siRNAs, используя существующие siRNAs в качестве праймеров и усиливая тем самым способность комплекса RITS «нацеливаться» на специфические участки ДНК
У растений имеется ряд ортологов для многих компонентов RNAi, обусловливающих разнообразие путей РНК-сайленсинга, которые могут действовать с большей специфичностью по отношению к конкретным нуклеотидным последовательностям ДНК, хотя имеет место некоторая избыточность между факторами. Исследования TGS, опосредованного RNAi, выявили новый класс РНК-полимераз — РНК-полимеразу IV (или RNA pol IV), — которые могут транскрибировать ДНК исключительно в гетерохроматиновых районах (Herr et al., 2005; Pontier et al., 2005). Опять-таки только для растений характерно, что пути RNAi непосредственно влияют на метилирование ДНК (Chan et al., 2004) (детальные объяснения в главе 9). RNAi-подобные хроматиновые эффекты были также обнаружены у Drosophila и млекопитающих. Например, обработка пермеабилизированных клеток млекопитающих РНКазой А быстро удаляет гетерохроматиновые метки H3К9me3, что позволяет предполагать, что часть молекул РНК могут быть структурным компонентом околоцентромерного гетерохроматина (Maison et al., 2002). У позвоночных удаление факторов, процессирующих siRNA, нарушает метилирование H3К9 и связывание НР1 в перицентромерном гетерохроматине (Fukugawa et al., 2004). Любопытно, что у мутантов, лишенных Dicer, эмбриональные стволовые (ES) клетки все еще пролиферируют, но не могут дифференцироваться (Kanellopoulou et al., 2005), что заставляет предположить существование сегодня еще непонятной связи между механизмом RNAi и развитием млекопитающих. У Drosophila сайленсинг тандемных наборов гена mini-white, подверженных PEV, также оказывается зависимым от механизма RNAi (Pal-Bhadra et al., 2004). В совокупности эти исследования указывают на ключевую и, вероятно, первичную роль некодирующих РНК в переключении эпигенетических переходов и наследственно поддерживаемых специфических состояний хроматина хроматиновой матрицы. В самом деле, эти некодирующие РНК дали ответ на вопрос о том, как различные повторяющиеся последовательности у разных организмов достигают состояния гетерохроматинизации посредством механизма, «нацеливаемого» с помощью РНК. Стремясь идентифицировать новые мишени для RNAi, обнаружили, путем секвенирования малых РНК, что у растений, Drosophila, млекопитающих и других организмов они в основном транскрибируются с эндогенных транспозонов и других повторяющихся последовательностей (Almeida and Allshire, 2005; Bernstein and Allis, 2005). В совокупности эти результаты показывают, что RNAi эволюировала, отчасти, в целях поддержания стабильности геномов посредством сайленсирующих мобильных элементов ДНК и вирусов и у большинства эукариотических видов представляет собою консервативный механизм. Сейчас, однако, оказывается, что не только РНК-сайленсинг репрессирует инвазивные последовательности, но что, кроме того, этот базовый механизм был использован клеткой для гетерохроматинизации центромер, обеспечивая тем самым корректное расхождение хромосом и целостность генома. Все приведенные выше примеры показывают удивительное изменение центральной догмы контроля генов, формулировка которого начинает выглядеть следующим образом: ДНК → некодирующие РНК → хроматин → функция гена. Никто не предвидел появление представлений о том, что некодирующие РНК активно участвуют в работе RNAi-подобных механизмов, которые также «нацеливают» локус-специфичные домены на ремоделинг хроматина и сайленсинг генов.
11. От одноклеточных систем к многоклеточным
5000–6000 генов, содержащихся в геномах почкующихся и дробянковых дрожжей, достаточны для регуляции основных метаболических процессов и процессов клеточного деления. Здесь, однако, нет потребности в клеточной дифференпировке, поскольку эти одноклеточные организмы в основе своей являются клональными и, как таковые, многократно повторяющимися «бессмертными» существами. В противоположность им млекопитающие кодируются приблизительно 25000 генами, требующимися в клетках примерно 200 разных типов. Понимание того, каким образом с одной и той же генетической матрицы генерируется и координируется связанная с многоклеточностью сложность организма, является ключевым вопросом в эпигенетических исследованиях. Сравнение размеров генома у дрожжей, мух, растений и млекопитающих показывает, что размер генома существенно растет с увеличением сложности соответствующего организма. Имеет место более чем 300-кратное различие между размерами геномов у дрожжей и у млекопитающих, при том что общее число генов возрастает всего в какие-нибудь 4–5 раз (рис. 3.15). Однако показателем сложности генома может служить отношение кодирующих последовательностей к некодирующим и повторяющимся: в основном «открытые» геномы одноклеточных грибов имеют сравнительно мало некодирующей ДНК по сравнению с высоко гетерохроматинизированными геномами многоклеточных организмов. В частности, млекопитающие накопили значительное количество повторяющихся элементов и некодирующих участков, которые составляют большую часть их нуклеотидных последовательностей ДНК (52 % некодирующей и 44 % повторяющейся ДНК). Таким образом, лишь 4 % генома млекопитающих кодируют белковые функции (включая интронные последовательности) Эта массивная экспансия повторяющихся и некодирующих последовательностей у многоклеточных организмов, вероятнее всего, обусловлена включением инвазивных элементов, таких как ДНК-транспозоны, ретротранспозоны и другие повторяющиеся элементы. Хотя эти последние и представляют собою нагрузку для программ координированной экспрессии генов, они в то же время делают возможной эволюцию генома и обусловливают его пластичность, а также некоторую степень стохастической регуляции генов. Экспансия повторяющихся элементов инфильтрировала даже транскрипционные единицы генома млекопитающих. Результатом явились транскрипционные единицы, нередко гораздо более крупные (30—200 т. н.) и обычно содержащие множественные промоторы и повторы ДНК внутри нетранслируемых интронов. В противоположность этому растения, обладающие такими же большими геномами, обычно обладают меньшими транскрипционными единицами с меньшими интронами, потому что у них развились защитные механизмы, не позволяющие «терпеть» вставку транспозона в пределах транскрипционной единицы. Рис. 3.15. Круговые диаграммы, характеризующие организацию генома у разных организмов
Над каждой диаграммой указаны размеры генома для основных модельных организмов, используемых в эпигенетических исследованиях. Увеличение размеров генома у более сложных многоклеточных организмов коррелирует со значительной экспансией некодирующих (т. е. интронных, межгенных и рассеянных повторяющихся последовательностей) и повторяющихся (например, сателлитной. LINE, SINE ДНК) нуклеотидных последовательностей ДНК Эта экспансия сопровождается увеличением числа эпигенетических механизмов (в особенности репрессивных), регулирующих геном Расширение генома коррелирует также с увеличением размеров и сложности единиц транскрипции, за исключением растений; эти последние выработали механизмы, не допускающие вставок или дупликаций в транскрипционной единице. Р — промоторный элемент ДНК
Рис. 3.15. Круговые диаграммы, характеризующие организацию генома у разных организмов
Над каждой диаграммой указаны размеры генома для основных модельных организмов, используемых в эпигенетических исследованиях. Увеличение размеров генома у более сложных многоклеточных организмов коррелирует со значительной экспансией некодирующих (т. е. интронных, межгенных и рассеянных повторяющихся последовательностей) и повторяющихся (например, сателлитной. LINE, SINE ДНК) нуклеотидных последовательностей ДНК Эта экспансия сопровождается увеличением числа эпигенетических механизмов (в особенности репрессивных), регулирующих геном Расширение генома коррелирует также с увеличением размеров и сложности единиц транскрипции, за исключением растений; эти последние выработали механизмы, не допускающие вставок или дупликаций в транскрипционной единице. Р — промоторный элемент ДНК
Существуют важные различия между организмами, проявляющиеся в типах эпигенетических путей, используемых, несмотря на высокую степень функционального консерватизма, во многих механизмах у разных видов. Полагают, что эти различия отчасти имеют отношение к величине генома. Широкая экспансия в геном некодирующих и повторяющихся ДНК у высших эукариот требует наличия более экстенсивных эпигенетических механизмов сайленсинга. Это коррелирует с тем фактом, что млекопитающие и растения используют весь диапазон репрессивного метилирования лизина гистонов, метилирования ДНК и механизмов сайленсинга посредством RNAi. Другим вопросом, связанным с многоклеточностью, является вопрос о том, каким образом могут координироваться и поддерживаться множественные клеточные типы (клеточная идентичность) Для регуляции генома имеет место тонкое равновесие с участием групп белковых комплексов Polycomb (PcG) и Trithorax (trxG). С появлением многоклеточности в особенности коррелируют белки PcG (см. раздел 12). Клетки в многоклеточном организме по своим функциям могут быть разделены на два основных компартмента: зародышевые клетки (тотипотентные и требующиеся для передачи генетической информации следующему поколению) и соматические клетки (дифференцированная «силовая станция» организма). Существуют важные вопросы относительно того, как компартмент зародышевых клеток поддерживает тотипотентность своего эпигенома и какие механизмы вовлечены в стирание, установление и поддержание клеточной судьбы (клеточная память). Поскольку одна зародышевая клетка дает начало другой зародышевой клетке, она в сущности обладает неограниченным пролиферативным потенциалом, подобно одноклеточным «бессмертным» организмам. Однако для того чтобы выполнять эту роль, зародышевые клетки находятся по большей части «в покое» и не реагируют на внешние стимулы, так что целостность их эпигенома может быть защищена. Действительно, ооциты млекопитающих могут сохраняться в покоящемся состоянии более 40 лет. Аналогичным образом, взрослые стволовые клетки (мультипотентные) представляют собой в основном популяцию «спящих» клеток, пролиферирующую (и самовозобновляющуюся) только тогда, когда они. эти клетки, активируются митогенными стимулами и проходят ограниченное число клеточных делений. Таким образом, на состав и структуру эпигенома влияют многие внутренние (например, транскрипция, репликация ДНК, расхождение хромосом) и внешние (например, цитокины, гормоны, повреждение ДНК или общая реакция на стресс) сигналы, в особенности если соматическая дифференцировка вынудила клетки покинуть среду, защищающую зародышевые и стволовые клетки.
12. Polycomb и Trithorax
К числу основных эффекторов, способных передавать сигналы к хроматиновой матрице и участвовать в поддержании клеточной идентичности (т. е. обеспечивать клеточную память), относятся члены групп генов PcG и trxG (Ringrose and Раго 2004). Эти гены были открыты у Drosophila благодаря их роли в регуляции кластера генов Нох в ходе развития и регуляции гомейотических генов. С тех пор было показано, что PcG и trxG являются ключевыми регуляторами пролиферации клеток и клеточной идентичности у многоклеточных эукариот. Кроме того, эти группы генов участвуют в нескольких сигнальных каскадах, которые реагируют на митогены и морфогены; регулируют идентичность и пролиферацию стволовых клеток, яровизацию у растений, гомеотические трансформации и трансдетерминацию, коммитирование линий в ходе дифференцировки В- и Т-клеток и многие другие аспекты развития Metazoa (главы 11 и 12). Теперь мы обратимся вкратце к тому, что известно о том, как семейства PcG и trxG превращают связанные с развитием сигналы в «эпигенетическую память» через посредство структуры хроматина. Группы белков PcG и trxG функционируют по большей части антагонистически: семейство белков PcG устанавливает «молчащее» состояние хроматина, а семейство белков обычно способствует генной активности. Молекулярная идентификация гена Рс, о котором известно, что он стабилизирует паттерны репрессии генов на протяжении нескольких клеточных генераций, обеспечила первые данные о молекулярном механизме клеточной или эпигенетической памяти Равным образом РС явился примером белка, содержащего хромодомен с высокой степенью сходства с хромодоменом ассоциированного с гетерохроматином белка НР1 (Раго and Hogness, 1991). Как упоминалось выше, хорошо доказано, что хромодомены являются специфическими модулями, связывающимися с метиллизином гистона (изображено на рис. 3.10). У Drosophila идентифицированы 20 генов PcG и, по меньшей мере, 15 разных генов trxG. Функциональные анализы показали, что эти группы генов составляют спектр разных белков, но, тем не менее, они высококонсервативны у эукариот. Гены PcG кодируют продукты, в число которых входят белки, связывающиеся с ДНК (например, YY1), энзимы, модифицирующие гистоны (например. EZH2), и другие репрессивные ассоциированные с хроматином факторы, которые содержат хромодомен, обладающий сродством к H3K27me3 (например, РС). Гены группы trxG кодируют транскрипционные факторы (например, GAGA, или Zeste), энзимы АТФ-зависимого ремоделинга хроматина (например, Brahma) и HKMTs, такие как Ash 1 и Trx (или его гомологи у млекопитающих, MLL, Setl и семейство MLL). В большинстве случаев семейства белков PcG и trxG функционируют как компоненты разнообразных комплексов, устанавливая стабильные хроматиновые структуры, которые облегчают экспрессию или сайленсинг генов, регулируемых в развитии (главы 11 и 12). Несмотря на успехи последнего времени механизм, посредством которого комплексы, содержащие PcG или trxG, «нацеливаются» на регулируемые в развитии районы хроматина, еще не вполне выяснен У Drosophila наследуемая репрессия гена требует рекрутирования белковых комплексов PcG к элементам ДНК, называемым «элементы ответа polycomb» (PREs, polycomb response elements). Эквивалентные последовательности умлекопитающих установить не удалось. Неясно, каким образом белковые комплексы PcG вызывают протяженный сайленсинг зависимым от PRE образом, потому что PREs обычно локализованы на расстоянии килобаз от сайта старта транскрипции генов-мишеней. Можно постулировать, что отталкивание или, наоборот, рекрутирование комплексов PcG могут дискриминироваться изменениями в транскрипционной активности или различиями в продуктивном versus непродуктивном процессинге иРНК (Pirrotta, 1998; Dellino et al., 2004; Schmitt et al., 2005). В современных моделях поддерживается представление о связывании PcG через взаимодействие с белками, связывающимися с ДНК, и сродство хромодомена в белке PcG к модифицированным гистонам (H3K27me3) (Cao et al., 2002). Однако комплексы PcG могут также ассоциироваться in vitro с нуклеосомами, лишенными гистоновых хвостов (Francis et al., 2004) и, более того, элементы PRE имеют сниженную плотность нуклеосом (Schwartz et al., 2005). Наиболее логичное объяснение некоторых из этих не согласующихся друг с другом наблюдений заключается в том, что обычно связывание PcG in vivo первоначально нуждается во взаимодействии с факторами, связанными с ДНК, которое затем стабилизируется ассоциацией — с нуклеосомами и модифицированными H3K27me3 в прилегающем участке хроматина. Очевидно, необходимы дальнейшие исследования для того, чтобы связать существующие данные о том, как комплексы PcG «нацеливаются» на участки хроматина, и о том, каким образом они опосредуют репрессию. Вполне вероятно, что Это зависит от организма, поскольку имеет место большая гетерогенность комплексов PcG (глава 11). Белки группы Trithorax поддерживают обычно активное состояние генной экспрессии в генах-мишенях и преодолевают сайленсинг, опосредованный PcG (или предотвращают его). Этот переход еще менее понятен, но последние данные позволяют предполагать, что некий, базирующийся на РНК, механизм мог бы служить триггером для рекрутирования Ashl к промоторам-мишеням (Sanchez-Eisner et al., 2006). Полагают, что в результате может происходить ряд временных и стабильных изменений в структуре хроматина, которые могут облегчаться межгенной транскрипцией, способной устанавливать открытый хроматиновый домен и опосредовать активное замещение гистонов В число документированных изменений хроматина входят вставка «активных» метальных меток по лизинам гистонов с помощью таких trxG HKMTs, как Trx и Ashl, и считывание этих меток (например, распознавание H3К4те с помощью WDR5; Wysocka et al., 2005). Требуется также действие зависимых от АТФ факторов ремоделинга хроматина, таких как Brahma, хотя еще предстоит определить, каким именно образом взаимосвязаны эти механизмы (детали см. в главе 12). Многие белки PcG и trxG действуют кооперативно, поддерживая в нормальной клетке жестко контролируемый уровень репрессированного гетерохроматина по отношению к активному эухроматину. У млекопитающих в соматических интерфазных ядрах морфология ядер показывает, что конститутивные домены околоцентромерного гетерохроматина сгруппированы в 15–20 фокусов (рис 3.16). Дерегуляция клеточной судьбы и контроля пролиферации, приводящая к аномалиям развития и раку, нередко проявляется в аномальной морфологии ядер. Например, ядерная организация в клетках больных PML-лейкемией (родственной смешанной лимфоцитарной лейкемии [MLL]) демонстрирует отсутствие перицентромерных фокусов (Di Сгосе, 2005). В противоположность этому стареющие (непролиферирующие) клетки обнаруживают ядерную морфологию с крупными эктопическими кластерами гетерохроматина (Narita et al., 2003; Scaffidi et al., 2005). Таким образом, морфология ядер оказывается хорошим маркером, позволяющим различать нормальные и аберрантные клеточные состояния; это показывает, что архитектура ядра может, помимо всего прочего, играть регуляторную роль в поддержании специализированных доменов хроматина. Изучение уровней модификации гистонов является еще одним индикатором нормальности или ненормальности клеток. Многие из этих изменений приписываются дерегуляции HKMTs группы PcG (например, Ezh2) или trxG (например, MLL), что вносит вклад в прогрессию и даже метастатический потенциал опухолей (см. раздел 15). Действительно, увеличение общих уровней содержания любого из вышеупомянутых белков связано с повышенным риском возникновения рака простаты, рака груди, множественной миеломы или лейкемии (Lund and van Lohuizen, 2004; Valk-Lingbeek et al., 2004). В других случаях неопластической трансформации имеют место явное снижение уровня репрессивных гистоновых меток и увеличение общего ацетилирования (Seligson et al., 2005), вызывающие повышение уровня транскрипции генов и нестабильности генома. Очевидно, что изменения в глобальном контроле хроматина, может быть через нарушение работы энзимов, модифицирующих гистоны, влияют на функциональность генома и нарушают специфический профиль экспрессии генов в нормальной клетке. Рис. 3.16. Клеточная идентичность, определяемая белками PcG u trxG
В ходе эмбриогенеза устанавливаются два клеточных компартмента, различающихся по своему дифференцировочному потенциалу: это зародышевые клетки (тотипотентные) и соматические клетки (включая стволовые клетки) с ограниченными дифференцировочными потенциями. Пластичность потенциала экспрессии генома зародышевых или стволовых клеток отражается в сниженных уровнях репрессивных гистоновых меток, которые больше не видны в околоцентромерных фокусах. Нормальные пролиферирующие клетки обычно обладают ядерной морфологией с 15–20 гетерохроматиновыми фокусами. Комплексы, содержащие Polycomb и Trithorax, действуют, определяя эпигенетическую и, отсюда, клеточную идентичность разных линий. Они функционируют также в ответ на внешние «стрессорные» воздействия, стимулируя клеточную пролиферацию и соответствующую экспрессию генов. В стареющих клетках происходит утрата пластичности генома и пролиферационного потенциала, что находит свое отражение в аномально крупных гетерохроматиновых фокусах и в общем повышенном уровне репрессивных гистоновых меток. Однако интенсивно пролиферирующие опухолевые клетки обнаруживают изменения в балансе репрессивных и активирующих гистоновых меток через дерегуляцию модифицирующих гистоны энзимов PcG и trxG. Это сопровождается нарушениями ядерной морфологии
Рис. 3.16. Клеточная идентичность, определяемая белками PcG u trxG
В ходе эмбриогенеза устанавливаются два клеточных компартмента, различающихся по своему дифференцировочному потенциалу: это зародышевые клетки (тотипотентные) и соматические клетки (включая стволовые клетки) с ограниченными дифференцировочными потенциями. Пластичность потенциала экспрессии генома зародышевых или стволовых клеток отражается в сниженных уровнях репрессивных гистоновых меток, которые больше не видны в околоцентромерных фокусах. Нормальные пролиферирующие клетки обычно обладают ядерной морфологией с 15–20 гетерохроматиновыми фокусами. Комплексы, содержащие Polycomb и Trithorax, действуют, определяя эпигенетическую и, отсюда, клеточную идентичность разных линий. Они функционируют также в ответ на внешние «стрессорные» воздействия, стимулируя клеточную пролиферацию и соответствующую экспрессию генов. В стареющих клетках происходит утрата пластичности генома и пролиферационного потенциала, что находит свое отражение в аномально крупных гетерохроматиновых фокусах и в общем повышенном уровне репрессивных гистоновых меток. Однако интенсивно пролиферирующие опухолевые клетки обнаруживают изменения в балансе репрессивных и активирующих гистоновых меток через дерегуляцию модифицирующих гистоны энзимов PcG и trxG. Это сопровождается нарушениями ядерной морфологии
В случае клеточного старения увеличение уровня реперессивных меток гистонов также является индикатором клеточной дисфункции. Такое увеличение, сопровождаемое сниженным выявлением ацетилирования гистонов, может укрепить и даже повысить уровни «молчащего» хроматина, блокируя клеточную пластичность и направляя клетки в антипролиферативное состояние (Scaffidi et al., 2005). Это в значительной мере связанный с возрастом эффект, хотя особое болезненное состояние, прогерия, может преждевременно ускорять старение. Напротив, когда у мутантов, не имеющих трансдуцирующего энзима (Suv39h), снижается уровень репрессивных перицентромерных метальных меток, клетки обнаруживают повышенные скорости иммортализации, отсутствие старения и повышенную нестабильность генома (Braig et al., 2005). Эти примеры являются иллюстрацией того, что дерегуляция хроматина, которая проявляется в уровнях характерных гистоновых меток, часто трансдуцируемых энзимами PcG и trxG, и ядерная морфология оказываются важным индикатором прогрессии болезни.
13. Инактивация Х-хромосомы и факультативный гетерохроматин
Сайленсинг генов, опосредованный PcG, и инактивация Х-хромосомы являются лучшими примерами регулируемых в развитии переходов между активным и неактивным состояниями хроматина (рис. 3.17), часто называемого факультативным гетерохроматином. Он назван так в противоположность конститутивному гетерохроматину (например, в околоцентромерных доменах), который, по умолчанию, может быть индуцирован в некодирующих и высокоповторяющихся районах. Факультативный гетерохроматин встречается в кодирующих районах генома, где сайленсинг генов зависит от принимаемых в ходе развития решений, определяющих различные клеточные судьбы (а иногда и ревертируется этими решениями). Один из лучше всего изученных примеров образования факультативного гетерохроматина — инактивация одной из двух Х-хромосом у самок млекопитающих для выравнивания дозы экспрессии сцепленных с Х-хромосомой генов с самцами, обладающими только одной Х-хромосомой (и гетероморфной У-хромосомой) (глава 17). Здесь сайленсинг генов по всей неактивной Х-хромосоме (Xi) индуцирует высокую степень компактизации Xi, которая видна как тельце Бара, локализованное на периферии ядра клеток у самок млекопитающих. Как подсчитываются две аллели Х-хромосом и каким образом одна определенная Х-хромосома выбирается для инактивации — эти вопросы стоят на повестке дня сегодняшних эпигенетических исследований. Инактивация Х-хромосомы происходит с участием большой (~17 т. н.) РНК, Xist, которая, по-видимому, действует как первичный триггер ремоделинга хроматина в Xi. Хотя существует возможность образования dsRNA между Xist и антисмысловым транскриптом Tsix (экспрессируемым лишь до начала инактивации X), нет никаких сколько-нибудь убедительных доказательств участия зависящих от РНКи механизмов в инициации инактивации X. Центр инактивации X (XIC, X inactivation center) и вероятные сайты «вхождения» или «докинга» в ДНК (постулируется, что это специализированные повторяющиеся элементы ДНК, которыми обогащены Х-хромосомы) играют роль в ассоциации A7tf-PHK и функционирования ее в качестве молекулы-скаффолда, декорируюшей Xi в cis. Xist стимулирует рекрутирование, а также действие и комплекса PRC 1 (репрессивный комплекс polycomb), и комплекса PRC2, участвующих в образовании стабильной неактивной Х-хромосомы. В число компонентов PRC2 входит, например, модифицирующий хроматин фермент EZH2 из группы HKMT, который катализирует H3K27me3. Связыванию комплекса PRC1 могут способствовать и H3K27me3, и механизмы, не зависящие от модификации гистонов, тогда как другие компоненты этого комплекса, такие как белки Ringl, убиквитинируют Н2А. Гетерогенность комплексов PcG такова, что различные его компоненты могут действовать независимо от других компонентов комплекса. Модификации хроматина, связывание комплекса PcG, последующее включение гистонового варианта макроН2А вдоль Xi и экстенсивное метилирование ДНК — все эти процессы вносят вклад в образование структуры факультативного гетерохроматина во всей хромосоме Xi. Коль скоро стабильная гетерохроматиновая структура установлена, для ее поддержания Xist-РНК больше не нужна (Avner and Heard, 2001; Heard, 2005). Аналогичной формой моноаллельного сайленсинга является геномный импринтинг, также использующий некодирующую или антисмысловую РНК для сайленсирования одной аллельной копии в зависимости от того, от кого из родителей эта копия происходит (глава 19). В настоящее время неясно, влияют ли ES-клетки от мутантных по Dicer мышей на процессы инактивации X или на геномный импринтинг и, если влияют, то каким образом. Рис. 3.17. Индукция репрессированных состояний хроматина, направляемая РНК
Разные формы «молчащего» хроматина имеют различные первичные сигналы, но многие из них, вероятно, связаны с РНК-транскриптами (от аберрантных транскриптов к Xist-PHK и, далее, к dsRNAs), в зависимости от природы соответствующей нуклеотидной последовательности ДНК. Это включает установление набора изменений хроматина, в том числе комбинации модификаций гистонов (метилирование H3К9, H3К27 и H4K20), связывание репрессивных белков или комплексов (например, РС или НР1) с хроматином, метилирование ДНК и присутствие вариантов гистонов (например, макроH2A на неактивной Х-хромосоме) Факультативный или конститутивный гетерохроматины образуют видимые кластеры в ядре Эухроматиновую репрессию по картинам ядерной морфологии определить нельзя
Рис. 3.17. Индукция репрессированных состояний хроматина, направляемая РНК
Разные формы «молчащего» хроматина имеют различные первичные сигналы, но многие из них, вероятно, связаны с РНК-транскриптами (от аберрантных транскриптов к Xist-PHK и, далее, к dsRNAs), в зависимости от природы соответствующей нуклеотидной последовательности ДНК. Это включает установление набора изменений хроматина, в том числе комбинации модификаций гистонов (метилирование H3К9, H3К27 и H4K20), связывание репрессивных белков или комплексов (например, РС или НР1) с хроматином, метилирование ДНК и присутствие вариантов гистонов (например, макроH2A на неактивной Х-хромосоме) Факультативный или конститутивный гетерохроматины образуют видимые кластеры в ядре Эухроматиновую репрессию по картинам ядерной морфологии определить нельзя
Общая парадигма компенсации дозы — классического эпигенетически контролируемого процесса — была также исследована у других модельных организмов, в особенности у С. elegans (Meyer et al., 2004; глава 15) и Drosophila (Gilflllan et al., 2004; глава 16). Пока что неясно, происходит ли компенсация дозы у птиц, несмотря на тот факт, что они являются гетеросаметными организмами. У Drosophila компенсация дозы между полами происходит не за счет инактивации Х-хромосомы у самки, а путем двукратного усиления [up-regulation] работы единственной Х-хромосомы самца. Любопытно, что существенными компонентами являются, как известно, две некодирующие РНК, roX1 и rоХ2, и их экспрессия специфична для самцов. Хотя и существуют, вероятно, аналогичные механистические различия в каких-то деталях между мухами и млекопитающими, ясно, что активирование ремоделинга хроматина и модификаций гистонов, в особенности зависящее от MOF ацетилирование H4K16 на Х-хромосоме самца, играет ключевую роль в компенсации дозы у Drosophila. Каким именно образом энзимы, модифицирующие гистоны, такие как MOF-ацетилтрансфераза гистонов, «нацеливаются» на Х-хромосому самца, остается предметом будущих исследований. Более того, полагают, что такие зависящие от АТФ энзимы ремоделинга хроматина, как фактор ремоделинга нуклеосом (NURF, nucleosome-remodeling factor), являются антагонистами активностей комплекса компенсации дозы (DCC, dosage compensation complex). В совокупности в этом разделе и в разделах 10 и 11 дано описание механизмов для модификаций хроматина, направляемых РНК, в том виде, как это происходит с конститутивным гетерохроматином, хромосомой Xi и, возможно, также и сайленсингом генов, опосредованным PcG. Исходя из этих любопытных параллелей, можно постулировать, что часть РНК или неспаренных ДНК могли бы обеспечить привлекательный первичный триггер для стабилизации комплексов PcG в PREs или «компрометированной» промоторной функции, где они могли бы «чувствовать» качество транскрипционного процессинга. Аберрантная или блокированная элонгация и (или) ошибки в сплайсинге могли бы стимулировать взаимодействие между PcG, связанным с PRE, и промотором, приводя к выключению транскрипции. Таким образом, инициация PcG-сайленсинга индуцировалась бы переходом от продуктивной транскрипции к непродуктивной. Сейчас только лишь начинает проясняться, в какой мере комплексы trxG могут использовать контроль качества РНК и (или) процессинг первичных РНК-транскриптов как часть поддержания «включенных» транскрипционных состояний (Sanchez-Elsner et al., 2006).
14. Репрограммирование клеточной судьбы
Вопрос о том, каким образом можно изменить или ревертировать судьбу клетки, давно интересовал ученых. Зардышевая клетка и ранние эмбриональные клетки отличаются от других клеточных компартментов как «конечные» [«ultimate»] стволовые клетки свойственной им тотипотентностью. Хотя спецификация клеточной судьбы у млекопитающих допускает около 200 разных клеточных типов, в принципе существуют два главных дифференцировочных перехода: от стволовой (тотипотентной) клетки к полностью дифференцированной клетке и между покоящейся (quiescent, или G0) и пролиферирующей клеткой. Эти типы представляют собой крайние конечные точки среди множества промежуточных состояний, согласующихся с множеством различных компоновок эпигенома в развитии млекопитающих. В ходе эмбриогенеза динамическое увеличение эпигенетических модификаций проявляется в переходе от оплодотворенного ооцита к стадии бластоцисты и затем в имплантации, гаструляции, развитии органов и росте плода. Большинство этих модификаций или импринтов может быть стерто путем переноса ядра дифференцированной клетки в цитоплазму денуклеированного ооцита. Однако некоторые метки могут сохраняться, ограничивая тем самым нормальное развитие клонированных эмбрионов, а некоторые из них могут даже наследоваться как модификации зародышевого пути (g-mod) (рис. 3.18), которые у млекопитающих, вероятно, включают метилирование ДНК. Регенерация печени и репарация мышечной клетки представляют собою исключения среди тканей млекопитающих, поскольку эти органы могут регенерировать в ответ на повреждение, хотя большинство других тканей не способны к репрограммированию. У других организмов, таких как растения и Axolotl, некоторые соматические клетки могут действительно репрограммировать свой эпигеном и вновь вступать в клеточный цикл, чтобы регенерировать утраченную или поврежденную ткань (Tanaka, 2003). В целом, однако, репрограммирование соматических клеток невозможно, если они не подвергаются клеточно-инженерным манипуляциям с целью рекапитулировать раннее развитие после пересадки ядра (NT, nuclear transfer) в денуклеированный ооцит. Впервые это было продемонстрировано клонированием лягушек (Xenopus), а в более недавнее время — созданием Долли, первого клонированного млекопитающего (Campbell et al., 1996; глава 22). Рис. 3.18. Репрограммирование путем пересадки ядра
В течение жизни особи в разных клеточных линиях приобретаются эпигенетические модификации (mod) (левая часть рисунка). Пересадка ядра (NT) соматической клетки приводит к реверсии процесса терминальной дифференцировки, уничтожая большинство эпигенетических меток (mod); однако некоторые модификации, которые обычно присутствуют и в зародышевом пути (g-mod), не могут быть удалены. В ходе неопластической трансформации (из нормальной клетки в опухолевую), вызываемой серией генетических мутаций (красные звезды), накапливаются эпигенетические нарушения. Эти эпигенетические нарушения (mod), но не мутации, могут быть стерты в процессе репрограммирования после NT. Этот подход позволяет оценивать взаимодействие между генетическим и эпигенетическим вкладами в генез опухоли (из R. Jaenisch, с изменениями)
Рис. 3.18. Репрограммирование путем пересадки ядра
В течение жизни особи в разных клеточных линиях приобретаются эпигенетические модификации (mod) (левая часть рисунка). Пересадка ядра (NT) соматической клетки приводит к реверсии процесса терминальной дифференцировки, уничтожая большинство эпигенетических меток (mod); однако некоторые модификации, которые обычно присутствуют и в зародышевом пути (g-mod), не могут быть удалены. В ходе неопластической трансформации (из нормальной клетки в опухолевую), вызываемой серией генетических мутаций (красные звезды), накапливаются эпигенетические нарушения. Эти эпигенетические нарушения (mod), но не мутации, могут быть стерты в процессе репрограммирования после NT. Этот подход позволяет оценивать взаимодействие между генетическим и эпигенетическим вкладами в генез опухоли (из R. Jaenisch, с изменениями)
У млекопитающих были идентифицированы три основных препятствия для эффективного соматического репрограммирования. Во-первых, некоторые соматические эпигенетические метки (например, репрессивные H3К9me3) стабильно передаются в ряду делений соматических клеток и устойчивы к репрограммированию в ооците. Во-вторых, ядро соматической клетки не способно рекапитулировать асимметрию репрограммирования. возникающую в оплодотворенном эмбрионе как следствие дифференциальных эпигенетических меток, унаследованных мужским и женским гаплоидными геномами (см. Mayer et al., 2000; van der Heiden et al., 2005; глава 20). В-третьих, передача импринтированных локусов, которые особенно важны на стадии фетального и плацентарного развития, недостаточно надежно поддерживается после NT (Morgan et al., 2005). Большинство клонированных эмбрионов абортируют, и это заставляет предполагать, что нарушение эпигенетических импринтов является основным узким местом для нормального развития и может быть причиной низкой эффективности вспомогательных репродуктивных технологий (ART, assisted reproductive technologies) и ухудшенного физического состояния клонированных животных. Использование эмбриональных стволовых клеток вместо соматических демонстрирует значительно увеличенные возможности репрограммирования. Демонстрация того, что покоящиеся клетки (частая характеристика стволовых клеток) обнаруживают снижение уровня состояний H3К9me3 и H4K20 me3, могла бы указывать на увеличенную пластичность эпигенома (Baxter et al., 2004). Это согласуется также с тем фактом, что у «бессмертных» одноклеточных организмов (например, дрожжей) с их открытым, в значительной степени, и активным геномом отсутствуют несколько репрессивных эпигенетических механизмов Другой особенностью нормального эпигенетического репрограммирования у млекопитающих после оплодотворения является его отчетливая асимметрия. Это можно приписать прежде всего различным программам эпигенетической спецификации в мужских и женских зародышевых клетках (главы 19 и 20). Геном спермия в основном составлен из протаминов, хотя имеется и остаточный, но достоверный уровень CENP-А (вариант гистона H3) и другие предполагаемые эпигенетические импринты (Kimmins and Sassone-Corsi, 2005), тогда как ооцит состоит из регулярного хроматина, содержащего нуклеосомы. После оплодотворения гаплоидные геномы спермия и ооцита проделывают еще один цикл репрограммирования, включающий деметилирование ДНК и обмен гистоновых вариантов. В первом клеточном цикле эти модификации могут либо усиливать, либо уравновешивать эпигенетические различия двух родительских геномов перед слиянием ядер. В ходе дифференцировки эмбриональной (внутренняя клеточная масса [ICM, inner cell mass]) и экстраэмбриональной (трофэктодерма [ТЕ] и плацента) тканей между линями устанавливаются различные профили метилирования ДНК и модификации гистонов (Morgan et al., 2005). Соматическое клонирование не может надежно рекапитулировать эти паттерны репрограммирования, демонстрируя быстрое, но менее экстенсивное деметилирование в первом клеточном цикле и нарушенное метилирование ДНК и метилирование лизинов гистонов при сравнении клеток ICM и ТЕ. С проблемой репрограммирования соматических клеток тесно связана судьба импринтированных генных локусов. Для нормального эмбрионального развития требуется правильная аллельная экспрессия в импринтированных локусах (глава 19). Это было продемонстрировано оригинальными экспериментами по получению однородительских эмбрионов (Barton et al., 1984; McGrath and Solter, 1984; Surani et al., 1984). Ah-дрогенетические эмбрионы (оба генома которых имеют отцовское происхождение) обнаружили замедленное эмбриональное развитие, но гиперпролиферацию экстраэмбриональных тканей (например, плаценты). У гино- или партеногенетических эмбрионов (оба генома которых имеют материнское происхождение) плацента недоразвита. Следовательно, после стирания предсуществовавших меток в зародышевой клетке должен быть установлен специфичный по отношению к родителю импринт (глава 20). Полагают, что это происходит приблизительно для 100 или даже большего числа импринтированных генов, в основном участвующих в системах обеспечения ресурсами эмбрионального и плацентарного развития (например, ростовой фактор Igf2). Любопытно отметить данные о том, что импринтинг может быть нарушен во время культивирования in vitro эмбрионов, полученных с помощью ART или пересадки ядра (Maher, 2005).
15. Рак
Существует тонкое равновесие между самообновлением и дифференцировкой. Неопластическая трансформация (называемая также туморогенезом) рассматривается как процесс, посредством которого клетки претерпевают изменения, включающие бесконтрольную клеточную пролиферацию, утрату checkpoint-контроля, делающую возможными накопление хромосомных аберраций и геномную анеуплоидию, и неправильно регулируемую дифференцировку (Lengauer et al., 1998). Обычно полагают, что эти изменения вызываются по крайней мере одним генетическим повреждением — точечной мутацией, делепией или транслокацией, разрушающими либо ген-супрессор опухоли, либо онкоген (Hanahan and Weinberg, 2000). В опухолевых клетках гены, супрессирующие опухоль, становятся «молчащими». Онкогены активируются посредством доминантных мутаций или сверхэкспрессии нормального гена (протоонкогена). Важно, что с опухолевыми клетками связано также накопление аберрантных эпигенетических модификаций (глава 24) Эти эпигенетические изменения включают измененные паттерны метилирования ДНК, модификации гистонов и структуру хроматина (рис. 3.19). Таким образом, неопластическая трансформация — это сложный, многоэтапный процесс, включающий случайную активацию онкогенов и (или) сайленсинг генов-супрессоров опухоли и осуществляемый посредством генетических или эпигенетических событий Все это называют «двухударной теорией Кнудсона» (Feinberg, 2004; Feinberg and Tyko, 2004). Проиллюстрируем это следующим образом Сайленсинг гена ретинобластомы (Rb) — гена-супрессора опухоли — вызывает утрату checkpoint-контроля, что не только обеспечивает пролиферативное преимущество, но и стимулирует «второй удар», влияя на функции «ниже по течению», связанные со структурой хроматина, поддерживающие целостность генома (Gonzalo and Blasco, 2005). Сходный эффект может давать несвоевременная активация онкогенного продукта, такого как ген туе, (Knoepfler et al., 2006). Один из вопросов, порождаемых современными исследованиями, заключается в следующем: до какой степени аберрантные эпигенетические изменения способствуют возникновению опухоли и определяют ее общее поведение? Этот вопрос был исследован в опытах по пересадке ядер с использованием клеток меланомы в качестве донора ядер (Hochedlinger et al., 2004). Любые генетические повреждения донорской клетки сохраняются; однако NT стирает эпигенетический «грим». Затем исследовали возникновение опухолей у клонированных зародышей мышей; выяснилось, что спектр опухолей, возникших de novo, сильно варьировал в соответствии с различным вкладом эпигенетических модификаций в разных тканях, в которых включалась неопластическая прогрессия. Гипометилирование ДНК (в противоположность гиперметилированию) может происходить в отдельных локусах или на протяженных участках хромосомы, /ияометилирование ДНК было, по сути, первым типом эпигенетического перехода, который удалось связать с раком (Feinberg and Vogelstein, 1983). Оно оказалось широко распространенным фенотипом раковых клеток На уровне индивидуальных генов гипометилирование ДНК может быть неопластическим благодаря активации протоонкогенов, дерепрессии генов, вызывающих аберрантные функции клеток, или биаллельной экспрессии импринтированных генов (что также называется утратой импринтинга, или LOI — loss of imprinting) (главы 23 и 24). В более глобальных масштабах, масштабах всего генома обширное гипометилирование ДНК, особенно в участках конститутивного гетерохроматина, обусловливает предрасположение клеток к хромосомным транслокациям и анеуплоидии, способствующим раковой прогрессии. Этот эффект рекапитулируется у мутантов по Dnmt1 (Chen et al., 1998). Геномная нестабильность, возникающая в условиях гипометилирования ДНК, обусловлена, вероятно, мутагенным эффектом реактивации транспозонов. Когда обратили внимание на существенную роль репрессивных модификаций гистонов в поддержании гетерохроматина в центромерах и теломерах, появились данные о том, что если эти метки утрачиваются, возникает также нестабильность генома, вносящая свой вклад в раковую прогрессию (Gonzalo and Blasco, 2005). Рис. 3.19. Эпигенетические модификации при раке
(а) аберрантные эпигенетические метки в локусах, вызывающих рак, как правило, вызывают дерепрессию онкогенов или сайленсинг генов-супрессоров опухоли В число эпигенетических меток, о которых известно, что они изменяют нормальную клетку, входят метилирование ДНК, репрессивное метилирование гистонов и деацетилирование гистонов; (б) использование эпигенетических терапевтических агентов для лечения рака имеет свои последствия на уровне хроматиновой матрицы, показанной на примере локуса-супрессора опухоли. Воздействие ингибиторами Dnmt приводит к потере метилирования ДНК, а воздействие ингибиторами HDAC — к приобретению ацетильных гистоновых меток и последующим модификациям «вниз по течению», включая активные метильные метки гистонов и включение гистоновых вариантов. Эти кумулятивные изменения хроматина приводят к возобновлению экспрессии гена
Рис. 3.19. Эпигенетические модификации при раке
(а) аберрантные эпигенетические метки в локусах, вызывающих рак, как правило, вызывают дерепрессию онкогенов или сайленсинг генов-супрессоров опухоли В число эпигенетических меток, о которых известно, что они изменяют нормальную клетку, входят метилирование ДНК, репрессивное метилирование гистонов и деацетилирование гистонов; (б) использование эпигенетических терапевтических агентов для лечения рака имеет свои последствия на уровне хроматиновой матрицы, показанной на примере локуса-супрессора опухоли. Воздействие ингибиторами Dnmt приводит к потере метилирования ДНК, а воздействие ингибиторами HDAC — к приобретению ацетильных гистоновых меток и последующим модификациям «вниз по течению», включая активные метильные метки гистонов и включение гистоновых вариантов. Эти кумулятивные изменения хроматина приводят к возобновлению экспрессии гена
Напротив, гиперметилирование ДНК при многих раковых заболеваниях сконцентрировано в промоторных участках CpG-островков. Сайленсинг генов-супрессоров опухолей посредством такого аберрантного гиперметилирования ДНК имеет особо важное значение в раковой прогрессии. Недавние исследования показали, что имеет место существенное взаимовлияние [cross-talk] между модификациями хроматина и метилированием ДНК, показывающее, что в сайленсинг гена-супрессора опухоли может быть вовлечен не один эпигенетический механизм. Приведем пример: известно, что гены-супрессоры опухолей, р16 и hMLHl, сайленсируются при раке как метилированием ДНК, так и репрессивным метилированием лизинов гистона (МсGarveyet al., 2006). Предполагается, что при многих формах рака имеет место дерегуляция модификаторов хроматина. Некоторые энзимы, модифицирующие гистоны, — например, белок EZH2 группы PcG и белок MLL группы trxG — становятся онкогенными и действуют, нарушая эпигенетическую идентичность клетки, вследствие чего возникает либо транскрипционный сайленсинг, либо активация «несоответствующих», «не тех» генов (Schneider et al., 2002; Valk-Lingbeek et al., 2004). Ясно, что эпигенетическая идентичность является ключевым фактором для клеточной функции. Действительно, рисунок глобальных ацетильных и метильных меток гистонов оказывается признаком, имеющим важное значение для прогрессии некоторых раковых заболеваний, как показывают исследования прогрессии опухоли простаты (Seligson et al., 2005). Разработка мишеней для лекарственных агентов с целью подавления функции эффекторных энзимов, модифицирующих хроматин, открыла новые горизонты для лечения рака (рис. 3.19). Использование ингибиторов DNMT и HDAC находится на наиболее продвинутой стадии клинических испытаний этого нового поколения противораковых терапевтических средств. Двумя такими ингибиторами являются, соответственно, Зебуларин и SAHA. Они особенно эффективны по отношению к раковым клетам, у которых имеются репрессированные гены-супрессоры опухолей (J.C. Cheng et al., 2004; Garcia-Manero and Issa, 2005; Marks and Jiang. 2005), потому что воздействие ими приводит к стимуляции транскрипции. Основная доля репрессивного метилирования лизинов гистонов утрачивается в ходе воздействия, скорее всего благодаря сочетанному с транскрипцией обмену гистонов и замещению нуклеосом; однако эти ингибиторы не изменяют сколько-нибудь существенно H3К9me3 в промоторных участках, являющихся мишенями (McGarvey et al., 2006). Остается выяснить, могут ли сохраняющиеся репрессивные метки индуцировать последующий ресайленсинг генов-супрессоров опухоли, когда воздействие временно прерывается, противодействуя тем самым пользе «эпигенетической терапии». Возможно, что стратегия двойной эпигенетической терапии, использующая ингибиторы DNMT и HDAC, может обеспечить более благоприятный прогноз в клинических испытаниях. Идентификация ингибиторов для других классов модификаторов гистонов, а именно HKMTs и PRMTs, находится в настоящее время на стадии разработки. В геноме млекопитающих имеются приблизительно 50 одних только HKMTs с доменом SET. Большинство хорошо охарактеризованных энзимов, таких как SUV39H, EZH2, MLL и RIZ, уже связывали с развитием опухолей (Schneider et al., 2002). Так, используются методы высокопроизводительного скрининга (HTS) в надежде идентифицировать низкомолекулярные ингибиторы, которые можно было бы использовать в исследовательской работе и, в конечном счете, в противораковой терапии. Для такого подхода годятся все классы энзимов, модифицирующих гистоны, поскольку их специфические сайты связывания с субстратом (т. е. гистоновыми пептидами), в противоположность сайтам связывания общего кофактора (например, СоАи SAM), позволяют разрабатывать лекарственные препараты более селективного действия. HTS оказался успешным в случае HDACs (Su et al., 2000), PRMTs (D. Cheng et al., 2004) и HKMTs (Greiner et al., 2005). Для того чтобы произошел переход знаний из фундаментальных исследований в прикладные, требуются как основанные на гипотезах, так и эмпирические подходы, чтобы окончательно определить эффективность и полезность какого-нибудь ингибитора энзима, модифицирующего гистоны. Например, селективные ингибиторы HKMT против MLL или EZH2 могут быть ценными терапевтическими агентами против лейкемии или рака простаты. В качестве альтернативы использование HKMT-ингибитора SUV39H (что интуитивно кажется неправильным из-за потребности в этом энзиме для поддержания конститутивного гетерохроматина и стабильности генома) могло бы все же избирательно сенсибилизировать опухолевые клетки. Кроме того, анализ HDAC-ингибитора SAHA показал, что он может действовать через дополнительные пути, не связанные с реактивацией транскрипции (Marks and Jiang, 2005). Например, HDAC-ингибиторы могут также сенсибилизировать повреждения хроматина, подавляя эффективную репарацию ДНК и делая возможным возникновение геномной нестабильности, которая может включить апоптоз в опухолевых клетках. Эти наблюдения необходимо будет проконтролировать при оценке эффективности двойной комбинационной терапии. Однако, судя по результатам, имеющимся на сегодняшний день, можно себе представить, что комбинационная терапия с использованием HDAC- и HKMT-ингибиторов может быть более избирательной в уничтожении пронеопластических клеток, переводя их в состояние информационной избыточности и катастрофы с хроматином. Можно надеяться, что продолжение исследований позволит идентифицировать жизнеспособные кандидатуры для эффективной эпигенетической противораковой терапии.
16. В чем же в действительности заключается эпигенетический контроль?
В транскрипции или регуляции хроматина играют роль приблизительно 10 % пула белков, закодированных в геноме млекопитающих (база данных Swiss-Prot). Исходя из того, что геном млекопитающих состоит из 3 × 109 п.н., он должен вмещать ~ 1 × 107 нуклеосом. Это дает начало огромному разнообразию возможных регуляторных сигналов, включая взаимодействия при связывании с ДНК, модификации гистонов, варианты гистонов, ремоделинг нуклеосом, метилирование ДНК и некодирующие РНК. Один только процесс регуляции транскрипции весьма сложен и часто требует сборки крупных мультипротеиновых комплексов (>100 белков), чтобы обеспечить инициацию, элонгацию и правильный процессинг информационной РНК с одиночного выбранного промотора. Если уж регуляция, специфическая по отношению к нуклеотидной последовательности ДНК, столь сложна, можно ожидать, что еще сложнее окажутся характеризующиеся низким сродством ассоциации вдоль динамического полимера, состоящего из ДНК и гистонов. Исходя из этих соображений, можно ожидать, что лишь изредка какая-то одна модификация будет коррелировать с одним каким-то эпигенетическим состоянием. Более вероятно (и в пользу этого говорят экспериментальные данные), что эпигенетические состояния стабилизируются и воспроизводятся определенной комбинацией или кумулятивным влиянием нескольких (возможно, многих) сигналов на протяженном участке хроматина (Fischle et al., 2003b; Lachner et al., 2003; Henikoff, 2005). По большей части, связывание транскрипционного фактора является временным и утрачивается в последующих клеточных делениях. Для сохраняющихся паттернов генной экспрессии транскрипционные факторы нужны при каждом последующем клеточном делении. Как таковой, эпигенетический контроль может усиливать первичный сигнал (например, стимуляцию промотора, сайленсинг генов, определение центромеры) в последовательных клеточных генерациях (но не бесконечного их числа) путем наследственной передачи информации через хроматиновую матрицу (рис. 3.20). Интересно отметить, что у S. pombe эпигенетический мозаицизм, зависящий от Swi6, можно репрессировать на много клеточных делений во время как митоза, так и мейоза (Grewal and Klar, 1996) модификациями гистонов (вероятнее всего, H3K9me2). Аналогичные исследования были выполнены на Drosophila с использованием импульса некоего активирующего транскрипционного фактора для передачи клеточной памяти об экспрессии гена Нох в зародышевом пути самок (Cavalli and Раго, 1999). В обоих этих примерах эпигенетическая память опосредуется изменениями хроматина, в том числе отдельными модификациями гистонов и, вероятнее всего, включением гистоновых вариантов. Если модификации гистонов функционируют совместно, импринт может остаться на хроматиновой матрице, что поможет маркировать нуклеосомы, в особенности если сигнал восстанавливается после репликации ДНК (рис. 3.20). Для еще более стабильного наследования сотрудничество между модификациями гистонов, включением гистоновых вариантов и ремоделингом хроматина может превратить протяженный участок хроматина в устойчиво измененные структуры, которые затем будут воспроизводиться на протяжении многих клеточных делений. Хотя это объяснение относится к наследованию состояний «включения» транскрипции, аналогичный синергизм между репрессивными эпигенетическими механизмами будет более устойчиво закреплять «молчащие» участки хроматина, и это далее будет усилено дополнительным метилированием ДНК. Двойная спираль ДНК может тогда рассматриваться как самоорганизующийся полимер, который, через его упорядочивание в хроматин, может реагировать на эпигенетический контроль и усиливать первичный сигнал, превращая его в более долговременную «память». Кроме того, многие модификации гистонов, вероятно, развились в ответ на внутренние и внешние стимулы. В соответствии с этим энзимы, модифицирующие хроматин, нуждаются в кофакторах, таких как АТФ (киназы), ацетил-СоА (HATs) и SAM (HKMTs), уровни которых диктуются изменениями внешних условий (например, диетой). Таким образом, измененные условия могут транслироваться в более динамичный или более стабильный полимер из ДНК и гистонов. Прекрасным примером этого является зависящий от NAD Sir2 (группа HDAC), который действует как «сенсор» для пищевых веществ и веществ и клеток на протяжении их жизни или уже стареющих (life-span/aged клеток) (Guarente and Picard, 2005; Rine, 2005). Понимание того, как эти сигналы из внешней среды превращаются в биологически значимые эпигенетические сигнатуры и каким образом они прочитываются, транслируются и наследуются, находится в центре современных эпигенетических исследований. Важно, однако, подчеркнуть, что эпигенетический контроль требует сложного равновесия между многими факторами и что функциональное взаимодействие не всегда надежно восстанавливается после каждого клеточного деления. В этом состоит функциональный контраст с генетикой, которая имеет дело с изменениями нуклеотидной последовательности ДНК, всегда стабильно воспроизводящимися в митозе и мейозе, если эти мутации происходят в зародышевом пути. Важным вопросом, вытекающим из рассмотренного выше материала, является вопрос о том, каким образом информация, содержащаяся в хроматине, поддерживается при передаче от материнской клетки дочерним клеткам. Если клетка утрачивает свою идентичность в силу заболевания, неправильной регуляции или репрограммирования, сопровождается ли эта потеря идентичности изменениями в структуре хроматина? Основной синтез большинства коровых гистонов очень сильно регулируется на протяжении клеточного цикла. Транскрипция генов коровых гистонов происходит обычно в S-фазе, на стадии, когда реплицируется ДНК (т. е. связана с репликацией). Эта «координация» гарантирует что с удвоением количества ДНК в клетке имеется достаточное количество коровых гистонов для связывания со вновь реплицированной ДНК; таким образом, упаковка ДНК происходит одновременно с ее репликацией. Как показано выше, различные участки хроматина могут иметь отчетливые различия по гистоновым модификациям, программирующим данный участок в отношении того, будет ли он транскрибироваться или нет. Каким образом домены вновь синтезированного дочернего хроматина сохраняют эту информацию, ключевую для экспрессии соответствующих генов? Каким образом эта программа надежно реплицируется от одного клеточного поколения к следующему или же проходит через мейоз и формирование зародышевой клетки (спермия или яйца)? Эти центральные вопросы ожидают будущих исследований. Рис. 3.20. Эпигенетическое усиление первичного сигнала (память/наследование)
Классическая генетика предсказывает, что экспрессия гена зависит от наличия и связывания соответствующего набора транскрипционных факторов (TF). Удаление таких факторов (т. е. первичный сигнал) приводит к утрате экспрессии гена и, таким образом, составляет преходящий активирующий сигнал (<верхняя часть рисунка). Структура хроматина вносит свой вклад в экспрессию гена: здесь некоторые конформации являются репрессивными, а другие активными. Активация локуса может поэтому происходить посредством первичного сигнала и приводить к изменению в структуре хроматина «вниз по течению», включающему активные ковалентные гистоновые метки (mod) и замещение коровых гистонов их вариантами (например, H3.3). При клеточном делении эта структура хроматина может быть восстановлена в присутствии активирующего сигнала (обозначается как «повторяющийся сигнал»). Результатом эпигенетической памяти оказывается поддержание состояния хроматина при клеточном делении, даже в отсутствие первичного активирующего сигнала. Такая система памяти не является абсолютной, но включает множественные уровни эпигенетического регулирования для ремоделинга структуры хроматина. Динамическая природа хроматина означает, что хотя состояние хроматина может быть митотически стабильным, — оно тем не менее склонно к изменению, влияя тем самым на продолжительность эпигенетической памяти
Рис. 3.20. Эпигенетическое усиление первичного сигнала (память/наследование)
Классическая генетика предсказывает, что экспрессия гена зависит от наличия и связывания соответствующего набора транскрипционных факторов (TF). Удаление таких факторов (т. е. первичный сигнал) приводит к утрате экспрессии гена и, таким образом, составляет преходящий активирующий сигнал (<верхняя часть рисунка). Структура хроматина вносит свой вклад в экспрессию гена: здесь некоторые конформации являются репрессивными, а другие активными. Активация локуса может поэтому происходить посредством первичного сигнала и приводить к изменению в структуре хроматина «вниз по течению», включающему активные ковалентные гистоновые метки (mod) и замещение коровых гистонов их вариантами (например, H3.3). При клеточном делении эта структура хроматина может быть восстановлена в присутствии активирующего сигнала (обозначается как «повторяющийся сигнал»). Результатом эпигенетической памяти оказывается поддержание состояния хроматина при клеточном делении, даже в отсутствие первичного активирующего сигнала. Такая система памяти не является абсолютной, но включает множественные уровни эпигенетического регулирования для ремоделинга структуры хроматина. Динамическая природа хроматина означает, что хотя состояние хроматина может быть митотически стабильным, — оно тем не менее склонно к изменению, влияя тем самым на продолжительность эпигенетической памяти
Хотя первоначальные исследования указывали на полуконсервативный процесс, в ходе которого откладывается новый тетрамер H3/Н4, вслед за чем инкорпорируются два новых димера Н2А/Н2В, данные последнего времени подвергли эту гипотезу сомнению. В этой недавней модели «новые» полипептиды H3 и Н4, которые уже могут нести несколько посттрансляционных модифкаций, включаются как вновь синтезированные гистоновые димеры H3/Н4 вместе со «старыми» димерами H3/Н4, расходящимися между материнской и дочерней ДНК. Если это так. тогда эти модифицированные, родительские димеры H3/Н4 также присутствуют теперь вместе с вновь синтезированными димерами на одной и той же ДНК. Их совместное присутствие могло бы тогда диктовать, какие «правильные» модификации должны размещаться на вновь добавленных димерах (Tagami et al., 2004). Эта модель выглядит привлекательной и может помочь объяснить наследование гистоновых модификаций и, таким образом, воспроизведение эпигенетической информации в ходе репликации ДНК и при клеточном делении. Однако необходимы новые данные в поддержку этой или других моделей, предназначенных для объяснения передачи хроматиновых меток в ходе клеточного деления. Заканчивая эту главу, мы задаем вопрос: отличается ли эпигенетический контроль сколько-нибудь фундаментальным образом от основных генетических принципов? Хотя мы можем захотеть рассматривать «эпигенетический ландшафт» Уодцингтона как разграниченные участки активирующих и репрессивных гистоновых модификаций на континууме хроматинового полимера, этот взгляд легко может оказаться чрезмерной детализацией. Ведь только в последние годы мы узнали об основных ферментных системах, посредством которых могли воспроизводиться модификации гистонов. Это оформило наши современные представления о стабильности и, отсюда, наследовании некоторых гистоновых меток. Кроме того, это подчеркиваетсянедавними исследованиями, которые показывают, что мутации по активностям, модифицирующим хроматин, таким как ремоделеры нуклеосом (Cho et al., 2004; Mohrmann and Verrijzer, 2005), DNMTs (Robertson, 2005), HDACs или HMKTs (Schneider et al., 2002), поскольку они часто обнаруживаются при ненормальном развитии и неоплазиях, являются красноречивыми примерами конечного могущества генетического контроля. Как таковое, возникновение опухоли у этих мутантных мышей обычно рассматривается как генетическое заболевание. В противоположность этому изменения в структуре хромосом, метилировании ДНК и профилях модификаций гистонов — которые не вызываются мутировавшим геном — обычно классифицируются как «истинные» эпигенетические аберрации. Превосходными примерами этих более пластичных систем являются стохастические «выборы» в раннем эмбриональном развитии, репрограммируемые пересадкой ядра, транскрипционная память, геномный импринтинг, мозаичная инактивация Х-хромосомы, центромерная идентичность и прогрессия опухоли. Генетика и эпигенетика, таким образом, оказываются тесно связанными явлениями, и обеим им присуще их воспроизведение в ходе клеточных делений, которое, в том что касается генетического контроля, охватывает также и зародышевый путь, если мутации возникают в зародышевых клетках В случае других — часто слишком легко классифицируемых — эпигенетических модификаций мы не знаем, являются ли они лишь отражением мелких и преходящих реакций на изменения во внешней среде или же вносят существенный вклад в фенотипические различия, которые затем могут поддерживаться на протяжении многих делений соматических клеток, хотя и не бесконечного их числа, и иногда могут затрагивать зародышевый путь. Даже при наших весьма продвинутых сегодня знаниях об эпигенетических механизмах какие-либо новые доводы в пользу ламаркизма отсутствуют или почти отсутствуют.
17. Основные вопросы в эпигенетических исследованиях
В этой книге обсуждаются фундаментальные концепции и общие принципы, объясняющие, как происходят эпигенетические явления, какими бы загадочными они не казались. Наша конечная цель — представить читателю современные представления о механизмах, направляющих и формирующих эти концепции, на фоне разнообразных биологических данных, из которых они возникли. Всего лишь за несколько лет эпигенетические исследования дали интригующие и замечательные сведения и революционные открытия; тем не менее, многие давно поставленные вопросы остаются без ответа (рис. 3.21). Хотя и соблазнительно набросать широкими мазками выводы и предложить на обсуждение общие правила, основывающиеся на этом прогрессе, мы предостерегаем от этой тенденции, подозревая, что будут обнаружены многочисленные исключения из этих правил. Например, ясно, что имеют место значительные различия между организмами. В особенности степень и тип гистоновых модификаций, варианты гистонов, метилирование ДНК и использование механизма РНКи существенно варьируют от одноклеточных до многоклеточных организмов. Имеются, однако, множество оснований с новой энергией взяться за исследовательские программы, нацеленные на молекулярный анализ эпигенетических явлений. Элегантные биохимические и генетические исследования уже позволили успешно и беспрецедентным образом проанализировать многие функциональные аспекты этих путей. Поэтому можно было бы предсказать, что тщательный анализ эпигенетических переходов в разных типах клеток (например, стволовые versus дифференцированные; покоящиеся versus пролиферирующие) выявит ключевые признаки плюрипотентности (Bernstein et al., 2006; Boyer et al., 2006; Lee et al., 2006). Весьма вероятно, что это окажется ценным в определении того, какие изменения хроматина существенны во время нормальной дифференцировки в сравнении с болезненными состояниями и туморогенезом. Например, ожидается, что использование таких подходов, как крупномасштабное картирование на нормальных, опухолевых или ES-клетках — получение «эпигенетического ландшафта» вдоль по длине целых хромосом (Brachen et al., 2006b; Squazzo et al., 2006; Epigenomics AG, ENCODE, GEN-AU, EPIGENOME NoE) — позволит получить сведения, которые могли бы быть использованы для новых подходов в области терапевтического вмешательства и способствовали бы созданию всемирного консорциума для картирования всего эпигенома человека (Jones and Martienssen, 2005). Можно себе представить, что различия в относительных количествах разных гистоновых модификаций, такие например, как явно слабая представленность репрессивного триметилирования лизинов в гистонах у S. pombe и A. thaliana, могут отражать больший пролиферативный и регенераторный потенциал у этих организмов по сравнению с более ограниченными программами развития многоклеточных систем. Кроме того, функциональные связи между механизмом РНКи, метилированием лизинов гистонов и метилированием ДНК по-прежнему будут дарить нам интригующие сюрпризы относительно сложных механизмов, необходимых для детерминации клеточной судьбы в ходе развития. Аналогично этому многое в этом отношении даст углубленное понимание динамики и специфичности механизмов ремоделинга нуклеосом. Мы предсказываем, что будут открыты новые «экзотические» энзиматические активности, катализирующие эпигенетические переходы посредством модификаций гистонов и негистоновых субстратов. Может оказаться, что изменения хроматина, индуцируемые вышеперечисленными механизмами, действуют в значительной степени как фильтр реакций на внешние воздействия. Таким образом, есть надежда, что эти знания в конечном счете можно будет применить к стратегиям интенсивной терапии с целью «перенастройки» некоторых эпигенетических реакций индивидуума, связанных со старением, заболеваниями и раком Сюда входят регенерация тканей, терапевтическое клонирование (использование ES-клеток и их дериватов) и терапевтические стратегии с использованием стволовых клеток взрослых организмов. Предполагается, что такие стратегии увеличат продолжительность жизни клеток, позволят модулировать стрессовый ответ на внешние стимулы, вызывать реверсию прогрессии заболевания и улучшить вспомогательные репродуктивные технологии. Мы предсказываем, что понимание «хроматиновой основы» плюрипотентности и тотипотентности окажется в центре понимания биологии стволовых клеток и ее возможностей для терапевтического вмешательства. Рис. 3.21. Основные вопросы в эпигенетических исследованиях
Многие экспериментальные системы, используемые в эпигенетических исследованиях, вскрыли многочисленные пути и новые механизмы эпигенетического контроля Однако многие вопросы, как показано на этом рисунке, все еще остаются без ответа и нуждаются в дальнейшем выяснении или в подтверждении с использованием новых и уже существующих систем и методов
Рис. 3.21. Основные вопросы в эпигенетических исследованиях
Многие экспериментальные системы, используемые в эпигенетических исследованиях, вскрыли многочисленные пути и новые механизмы эпигенетического контроля Однако многие вопросы, как показано на этом рисунке, все еще остаются без ответа и нуждаются в дальнейшем выяснении или в подтверждении с использованием новых и уже существующих систем и методов
Остается еще много фундаментальных эпигенетических вопросов. Например, что отличает одну нить хроматина от другой, аллельной, хотя обе содержат одинаковые нуклеотидные последовательности ДНК в одном и том же ядерном окружении? Что определяет механизмы, обеспечивающие наследование и воспроизведение эпигенетической информации? Какова молекулярная природа клеточной памяти? Существуют ли эпигенетические импринты в зародышевом пути, которые служат для удержания этого генома в тотипотентном состоянии? Если да, то как эти метки стираются в ходе развития? Добавляются ли в ходе развития новые метки, которые служат для «запирания», фиксации дифференцированных состояний? Мы предвкушаем появление следующего поколения исследований (и исследователей), достаточно смелых, чтобы попытаться ответить на эти вопросы со всей страстностью, свойственной предшествующему поколению исследователей-генетиков и эпигенетиков. Подводя итог, можно утверждать, что генетические принципы, описанные Менделем управляют, вероятно, огромным большинством характеристик нашего развития и нашего внешнего фенотипа Однако исключения из этого правила могут иногда обнаружить новые принципы и новые механизмы, обеспечивающие наследование, которые ранее недооценивались и в некоторых случаях были малопонятными. Цель этой книги — представить читателю новую оценку основ фенотипической изменчивости, лежащих за пределами изменений в ДНК. Мы надеемся, что системы и концепции, описанные в этой книге, заложат полезный фундамент для будущих поколений студентов и исследователей, таких же, как те, кого увлекли странности эпигенетических явлений.
Литература
Ahmad K. and Henikoff S. 2002. The histone variant H3.3 marks active chromatin by replication-independent nucleosome assembly. Mol. Cell 9: 1191-1200. Allfrey V.G., Faulkner R., and Mirsky A.E. 1964. Acetylation and methylation of histones and their possible role in the regulation of RNA synthesis. Proc. Natl Acad. Sci. 51: 786-794. Almeida R. and Allshire R.C. 2005. RNA silencing and genome regulation. Trends Cell Biol. 15: 251-258. Aparicio O.M., Billington B.L., and Gottschling D.E. 1991. Modifiers of position effect are shared between telomeric and silent mating-type loci in S cerevisiae. Cell 66: 1279-1287. Avery O.T., Macleod C.M., and McCarty M. 1944. Studies on the chemical nature of the substance inducing transformation of pneumococcal types. Induction of transformation by a desoxyribonucleic acid fraction isolated from pneumococcus Type III. J. Exp. Med. 79: 137-158. Avner R and Heard E. 2001. X-chromosome inactivation: Counting, choice and initiation. Nat. Rev. Genet. 2: 59-67. Bannister A.J. and Kouzarides T. 2005. Reversing histone methylation. Nature 436: 1103-1106. Bannister A. J., Zegerman R, Partridge J.E, Miska E.A., Thomas J.O., Allshire R.C, and Kouzarides T. 2001. Selective recognition of methylated lysine 9 on histone H3 by the HP1 chromo domain. Nature 410: 120-124. Barton S.C., Surani M.A., and Norris M.L. 1984. Role of paternal and maternal genomes in mouse development. Nature 311: 374-376. Bastow R., Mylne J.S., Lister C, Lippman Z., Martienssen R.A., and Dean C. 2004. Vernalization requires epigenetic silencing of FLC by histone methylation. Nature 427: 164-167. Baxter J., Sauer S., Peters A., John R., Williams R., Caparros M.L., Amey K., Otte A., Jenuwein T, Merkenschlager M., and Fisher A. G. 2004. Histone hypomethylation is an indicator of epigenetic plasticity in quiescent lymphocytes. EMBO J. 23: 4462-4472. Berger S.L. 2002. Histone modifications in transcriptional regulation. Curr. Opin. Genet. Dev. 12: 142-148. Bernard P., Maure J.E, Partridge J.F., Genier S., Javerzat J.P., and Allshire R.C. 2001. Requirement of heterochromatin for cohesion at centromeres. Science 294: 2539-2542. Bernstein B.E., Kamal M., Lindblad-Toh K., Bekiranov S., Bailey D. K., Huebert D.J., McMahon S., Karlsson E.K., Kulbokas E. J., III, Gitigeras T.R., et al. 2005. Genomic maps and comparative analysis of histone modifications in human and mouse. Cell 120: 169-181. Bernstein B.E., Mikkelsen T.S., Xie X., Kamal M., Huebert D.J., Cuff J., Fry B., Meissner A., Wemig M., Plath K., et al. 2006. A bivalent chromatin structure marks key developmental genes in embryonic stem cells. Cell 125: 315-326. Bernstein E. and Allis C.D. 2005. RNA meets chromatin. Genes Dev. 19: 1635-1655. Bird A.P. 1986. CpG-rich islands and the function of DNA methylation. Nature 321: 209-213. Birky C.W., Jr. 2001. The inheritance of genes in mitochondria and chloroplasts: Laws, mechanisms, and models. Annu. Rev. Genet. 35: 125-148. Bolland D.J., Wood A.L., Johnston CM., Bunting S.F., Morgan G., Chakalova L., Fraser P.J., and Corcoran A.E. 2004. Antisense inter-genic transcription in V(D)J recombination. Nat. Immunol. 5: 630-637. Bourc’his D. and Bestor T.H. 2004. Meiotic catastrophe and ret- rotransposon reactivation in male germ cells lacking Dnmt3L. Nature 431: 96-99. Boyer L.A., Plath K., Zeitlinger J., Brambrink T., Medeiros L.A., Lee T.I., Levine S.S., Wemig M., Tajonar A., Ray M.K., et al. 2006 Polycomb complexes repress developmental regulators in murine embryonic stem cells. Nature 441: 349-353. Bracken A.P, Dietrich N., Pasini D., Hansen K.H., and Helin K. 2006. Genome-wide mapping of Polycomb target genes unravels their roles in cell fate transitions. Genes Dev. 20: 1123-1136. Braig M., Lee S.. Loddenkemper C, Rudolph C, Peters A.H., Schlegelberger B., Stein H., Dorken B., Jenuwein T., and Schmitt C. A. 2005. Oncogene-induced senescence as an initial barrier in lymphoma development. Nature 436: 660-665. Brownell J.E., Zhou J., Ranalli T., Kobayashi R., Edmondson D. G., Roth S.Y., and Allis C.D. 1996. Tetrahymena histone acetyltrans-ferase A: A homolog to yeast Gcn5p linking histone acetylation to gene activation. Cell 84: 843-851. Caims B.R. 2005. Chromatin remodeling complexes: Strength in diversity, precision through specialization. Curr. Opin. Genet. Dev. 15: 185-190. Campbell K.H., McWhir J., Ritchie W.A., and Wilmut 1.1996. Sheep cloned by nuclear transfer from a cultured cell line. Nature 380: 64-66. Cao R., Wang L., Wang H., Xia L., Erdjument-Bromage H., Tempst P., Jones R.S.,and Zhang Y. 2002. Role ofhistone H3 lysine 27 methylation in Polycomb-group silencing. Science 298: 1039-1043. Cavalli G. and Paro R. 1999. Epigenetic inheritance of active chromatin after removal of the main transactivator. Science 286: 955-958. Chakalova L., Debrand E., Mitchell J.A., Osbome C.S., and Fraser P. 2005. Replication and transcription: Shaping the landscape of the genome. Nat. Rev. Genet. 6: 669-677. Chalker D.L. and Yao M.C. 2001. Nongenic, bidirectional transcription precedes and may promote developmental DNA deletion in Tetrahymena thermophila. Genes Dev. 15: 1287-1298. Chan S.W., Zilberman D., Xie Z., Johansen L.K., Carrington J.C., and Jacobsen S.E.2004. RNA silencing genes control de novo DNA methylation. Science 303: 1336. Chen R.Z., Pettersson U., Beard C., Jackson-Grusby L., and Jaenisch R. 1998. DNA hypomethylation leads to elevated mutation rates. Nature 395: 89-93. Cheng D., Yadav N., King R.W., Swanson M.S., Weinstein E.J., and Bedford M.T. 2004. Small molecule regulators of protein arginine methyltransferases. J. Biol. Chem. 279: 23892-23899. Cheng J.C., Yoo C.B., Weisenberger D.J., Chuang J., Wozniak C., Liang G., Marquez V.E., Greer S., Omtoft T.F., Thykjaer T., and Jones P.A. 2004. Preferential response of cancer cells to zebularine. Cancer Cell 6: 151-158. Cho K.S., Elizondo L.I., and Boerkoel C.F. 2004. Advances in chromatin remodeling and human disease. Curr. Opin. Genet. Dev. 14: 308-315. Chuikov S., Kurash J.K., Wilson J.R., Xiao B., Justin N., Ivanov G.S., McKinney K., Tempst P., Prives C., Gamblin S.J.. et al. Regulation of p53 activity through lysine methylation. Nature 432: 353-360. Clark-Adams C.D., Noms D., Osley M.A., Fassler J.S., and Winston F. 1988. Changes in histone gene dosage alter transcription in yeast. Genes Dev. 2: 150-159. Cohen F.E. and Prusiner S.B. 1998. Pathologic conformations of prion proteins. Annu. Rev. Biochem. 67: 793-819. Cosgrove M.S., Boeke J.D., and Wolberger C. 2004. Regulated nu- cleosome mobility and the histone code. Nat. Struct. Mol. Biol. 11: 1037-1043. Cremer T. and Cremer C. 2001. Chromosome territories, nuclear architecture and gene regulation in mammalian cells. Nat. Rev. Genet. 2: 292-301. Daujat S., Zeissler U., Waldmann T., Happel N., and Schneider R. 2005. HP1 binds specifically to Lys26-methylated histone H1.4, whereas simultaneous Ser27 phosphorylation blocks HPl binding. /. Biol. Chem. 280: 38090-38095. Dellino G.I., Schwartz Y.B., Farkas G., McCabe D.. Elgin S.C.. and Pirrotta V. 2004. Polycomb silencing blocks transcription initiation. Mol. Cell 13: 887-893. Dhalluin C, Carlson J.E., Zeng L., He C., Aggarwal A.K., and Zhou M.M. 1999. Structure and ligand of a histone acetyltransferase bromodomain. Nature 399: 491-496. Di Croce L. 2005. Chromatin modifying activity of leukaemia associated fusion proteins. Hum. Mol. Genet. 14 Spec. No. 1: R77-R84. Dou Y. and Gorovsky M.A. 2000. Phosphorylation of linker histone HI regulates gene expression in vivo by creating a charge patch. Mol. Cell 6: 225-231. Fan Y, Nikitina T., Zhao J., Fleury T.J., Bhattacharyya R., Bouhas- sira E.E., Stein A., Woodcock C.L., and Skoultchi A.I. 2005. Histone HI depletion in mammals alters global chromatin structure but causes specific changes in gene regulation. Cell 123: 1199-1212. Feinberg A.P. 2004. The epigenetics of cancer etiology. Semin. Cancer Biol 14: 427-432. Feinberg A. P. and Tycko B. 2004. The history of cancer epigenetics Nat. Rev. Cancer 4: 143-153. Feinberg A.P. and Vogelstein B. 1983. Hypomethylation distinguishes genes of some human cancers from their normal counterparts. Nature 301: 89-92. Felsenfeld G. and Groudine M. 2003. Controlling the double helix. Nature 421: 448-453. Fischle W., Wang Y., and Allis C.D. 2003a. Binary switches and modification cassettes in histone biology and beyond. Nature 425: 475-479. Fischle W., Wang Y., and Allis C.D. 2003b Histone and chromatin cross-talk. Curr. Opin. Cell Biol. 15: 172-183. Fischle W., Tseng B.S., Dormann H.L., Ueberheide B.M., Garcia B. A., Shabanowitz J., Hunt D.F., Funabiki H., and Allis C.D. 2005. Regulation of HP 1-chromatin binding by histone H3 methylation and phosphorylation. Nature 438: 1116-1122. Fisher A.G. and Merkenschlager M. 2002. Gene silencing, cell fate and nuclear organisation. Curr. Opin. Genet. Dev. 12: 193-197. Fodor B.D., Kubicek S., Yonezawa M., O’Sullivan R.J., Sengupta R., Perez-Burgos L., Opravil S., Mechtler K., Schotta G., and Jenuwein T. 2006. Jmjd2b antagonizes H3K9 trimethylation at pericentric heterochromatin in mammalian cells. Genes Dev. 20: 1557-1562. Fraga M.F., Ballestar E., Paz M.E., Ropero S., Setien F. Ballestar M.L., Heine-Suner D., Cigudosa J.C., Urioste M., Benitez J., et al. 2005. Epigenetic differences arise during the lifetime of monozygotic twins. Proc. Natl. Acad. Sci. 102: 10604-10609. Francis N.J., Kingston R.E., and Woodcock C.L. 2004. Chromatin compaction by a polycomb group protein complex. Science 306: 1574-1577. Fukagawa T, Nogami M., Yoshikawa M., Ikeno M., Okazaki T., Takami Y., Nakayama T., and Oshimura M. 2004. Dicer is essential for formation of the heterochromatin structure in vertebrate cells. Nat. Cell Biol. 6: 784-791. Garcia-Manero G. and Issa J.P. 2005. Histone deacetylase inhibitors: A review of their clinical status as antineoplastic agents. Cancer Invest. 23: 635-642. Gilbert N., Boyle S., Fiegler H., Woodfine K., Carter N.P., and Bickmore W.A. 2004 Chromatin architecture of the human genome: Generich domains are enriched in open chromatin fibers. Cell 118: 555-566. Gilfillan G.D., Dahlsveen I.K., and Becker P.B. 2004. Lifting a chromosome: Dosage compensation in Drosophila melanogaster. FEBSLett. 567: 8-14. Goll M.G., Kirpekar E., Maggert K.A., Yoder J.A., Hsieh C.L., Zhang X., Golic K.G., Jacobsen S.E., and Bestor T.H. 2006. Methylation of tRNAAsp by the DNA methyltransferase homolog Dnmt2. Science 311: 395-398. Gonzalo S. and Blasco M.A. 2005. Role of Rb family in the epigenetic definition of chromatin Cell Cycle 4: 752-755. Gottschling D.E., Aparicio O.M., Billington B.L., and Zakian V.A. 1990. Position effect at S. cerevisiae telomeres: Reversible repression of Pol II transcription. Cell 63: 751-762. Grant P.A., Duggan L., Cote J., Roberts S.M., Brownell I.E., Candau R., Ohba R., Owen-Hughes T., Allis CD., Winston E, et al. 1997. Yeast Gcn5 functions in two multisubunit complexes to acetylate nucleosomal histones: Characterization of an Ada complex and the SAGA (Spt/Ada) complex. Genes Dev. 11: 1640-1650. Greiner D., BonaldiT., Eskeland R., RoemerE., and ImhofA. 2005. Identification of a specific inhibitor of the histone methyltransferase SU(VAR)3-9. Nat. Chem. Biol. 1: 143-145. Grewal S.I. and Klar A.J. 1996. Chromosomal inheritance of epigenetic states in fission yeast during mitosis and meiosis. Cell 86: 95-101. Grozinger C.M. and Schreiber S.L. 2002. Deacetylase enzymes: Biological functions and the use of small molecule inhibitors. Chem. Biol. 9: 3-16. Guarente L. and Picard E 2005. Calorie restriction — The SIR2 connection. Cell 120: 473-482. Hall I.M., Shankaranarayana G.D., Noma K., Ayoub N., Cohen A., and Grewal S.L. 2002. Establishment and maintenance of a heterochromatin domain. Science 297: 2232-2237. Hanahan D. and Weinberg R.A. 2000. The hallmarks of cancer. Cell 100: 57-70. Harvey A.C. and Downs J .A. 2004. What functions do linker histones provide? Mol. Microbiol. 53: 771-775. Hassan A.H., Prochasson P., Neely K.E., Galasinski S.C., Chandy M., Carrozza M.J., and Workman J.L. 2002. Function and selectivity of bromodomains in anchoring chromatin-modifying complexes to promoter nucleosomes. Cell 111: 369-379. Heard E. 2005. Delving into the diversity of facultative heterochromatin: The epigenetics of the inactive X chromosome. Curr. Opin. Genet. Dev. 15: 482-489. Henikoff S. 2005. Histone modifications: Combinatorial complexity or cumulative simplicity? Proc. Natl. Acad. Sci. 102: 5308- , 5309. Henikoff S. and Ahmad K. 2005. Assembly of vanant histones into chromatin. Annu Rev. Cell Dev. Biol. 21: 133-153. Herr A.J., Jensen M.B., DalmayT., and Baulcombe D.C. 2005. RNA polymerase IV directs silencing of endogenous DNA. Science 308: 118-120. Hirota T., Lipp J.J., Toh B.H., and Peters J.M. 2005. Histone H3 serine 10 phosphorylation by Aurora B causes HP1 dissociation from heterochromatin. Nature 438: 1176-1180. Hochedlinger K., Blelloch R., Brennan C, Yamada Y, Kim M., Chin L., and Jaenisch R. 2004. Reprogramming of a melanoma genome by nuclear transplantation. Genes Dev. 18: 1875-1885. Holbert M.A. and Marmorstein R. 2005. Structure and activity of enzymes that remove histone modifications. Curr. Opin. Struct. Biol. 15: 673-680. Holliday R. 1994. Epigenetics: An overview. Dev. Genet. 15: 453-457. Ishii K.J. and Akira S. 2005. TLR ignores methylated RNA? Immunity 23: 111-113. Jackson J.P., Lindroth A.M., CaoX., and Jacobsen S.E. 2002. Control of CpNpG DNA methylation by the KRYPTONITE histone H3 methyltransferase. Nature 416: 556-560. Jacobson R.H., Ladumer A.G., King D.S. andTjian R. 2000. Structure and function of a human TAFII250 double bromodomain module. Science. 288: 1422-1425. Jaenisch R. and Bird A. 2003. Epigenetic regulation of gene expression: How the genome integrates intrinsic and environmental signals. Nat. Genet, (suppl.) 33: 245-254. Janicki S.M., Tsukamoto T., Salghetti S.E., Tansey W.P., Sachidanan- dam R., Prasanth K.V., Ried T., Shav-Tal Y., Bertrand E., Singer R.H., and Spector D.L. 2004. From silencing to gene expression: Real-time analysis in single cells. Cell 116: 683-698. Jeddeloh J.A., Stokes..L., and Richards E.J. 1999. Maintenance of genomic methylation requires a SWI2/SNF2-like protein. Nat. Genet. 22: 94-97. Jenuwein T. and Allis C.D. 2001. Translating the histone code. Science 293: 1074-1080. Jones RA. and Martienssen R. 2005. A blueprint for a Human Epigenome Project: The AACR Human Epigenome Workshop. Cancer Res. 65: 11241-11246. Kanellopoulou C, Muljo S.A., Kung A.L., Ganesan S., Drapkin R., Jenuwein T., Livingston D.M., and Rajewsky K. 2005. Dicer- deficient mouse embryonic stem cells are defective in differentiation and centromeric silencing. Genes Dev. 19: 489-501. Kayne P.S., Kim U.J., Han M., Mullen J.R., Yoshizaki E, and Grunstein M. 1988. Extremely conserved histone H4 N terminus is dispensable for growth but essential for repressing the silent mating loci in yeast. Cell 55: 27- 39. Khochbin S. 2001. Histone HI diversity: Bridging regulatory signals to linker histone function. Gene 271: 1-12. Khorasanizadeh S. 2004. The nucleosome: From genomic organization to genomic regulation. Cell 116: 259-272. Kim J., Daniel J., Espejo A., Lake A., Krishna M., Xia L., Zhang Y., and Bedford M.X. 2006. Tudor, MBT and chromo domains gauge the degree of lysine methylation. EMBO Rep. 4: 397-403. Kimmins S. and Sassone-Corsi P. 2005. Chromatin remodeling and epigenetic features of germ cells. Nature 434: 583-589. KlarAJ. 1998. Propagating epigenetic states through meiosis: Where Mendel’s gene is more than a DNA moiety. Trends Genet. 14: 299-301. KlarAJ. 2004. An epigenetic hypothesis for human brain laterality, handedness, and psychosis development. Cold Spring Harbor Symp. Quant. Biol. 69: 499-506. Knoepfler P.S., ZhangX.-Y., Cheng R.E., Gafken P.R., McMahon S.B., and Eisenman R.N 2006. Myc influences global chromatin structure. EMBO J. 25: 2723-2734. Komberg R.D. 1974. Chromatin structure: A repeating unit of histones and DNA. Science 184: 868-871. Lachner M., O’Sullivan R.J., and Jenuwein T 2003. An epigenetic road map for histone lysine methylation. J. Cell Sci. 116: 2117-2124. Lachner M., Sengupta R., Schotta G., and Jenuwein T. 2004. Trilogies of histone lysine methylation as epigenetic landmarks of the eukaryotic genome. Cold Spring Harbor Symp. Quant. Biol. 69: 209-218. Lachner M., O’Carroll D., Rea S., Mechtler K., and Jenuwein T. 2001 Methylation of histone H3 lysine 9 creates a binding site for HP1 proteins. Nature 410: 116-120. Langst G. and Becker P.B. 2004. Nucleosome remodeling: One mechanism, many phenomena? Biochim. Biophys. Acta 1677: 58-63. Lee D.Y., Teyssier C, Strahl B.D., and Stallcup M.R. 2005. Role of protein methylation in regulation of transcription. Endocr. Rev. 26: 147-170. Lee T.L, Jenner R.G., Boyer L.A., Guenther M.G., Levine S.S., Kumar R.M., Chevalier B., Johnstone S.E., Cole M.F., Isono K., et al. 2006. Control of developmental regulators by Polycomb in human embryonic stem cells. Cell 125: 301-313. LengauerC., KinzlerK.W., and Vogelstein B. 1998. Genetic instabilities in human cancers. Nature 396: 643-649. Li E., Bestor T.H., and Jaenisch R. 1992. Targeted mutation of the DNA methyltransferase gene results in embryonic lethality. Cell 69: 915-926. Lippman Z., Gendrel A.V., Black M., Vaughn M.W., Dedhia N., McCombie W.R., Lavine K., Mittal V., May B., Kasschau K.D., et al. 2004. Role of transposable elements in heterochromatin and epigenetic control. Nature 430: 471-476. Litt M.D., Simpson M., Gaszner M., Allis C.D., and Felsenfeld G. 2001. Correlation between histone lysine methylation and developmental changes at the chicken beta-globin locus. Science 293: 2453-2455. Luger K., Mader A.W., Richmond R.K., Sargent D.F., and Richmond T.J. 1997. Crystal structure of the nucleosome core particle at 2.8 E resolution. Nature 389: 251-260. Lund A.H. and van Lohuizen M. 2004. Polycomb complexes and silencing mechanisms. Curr. Opin. Cell Biol. 16: 239-246. Lyko F. 2001. DNA methylation learns to fly. Trends Genet. 17: 169- 172. Maher E.R. 2005. Imprinting and assisted reproductive technology. Hum. Mol. Genet 14 Spec. No. 1: R133-R138. Maison C., Bailly D., Peters A.H., Quivy J.P., Roche D., Taddei A., Lachner M., Jenuwein T., and Almouzni G. 2002. Higher-order structure in pericentric heterochromatin involves a distinct pattern of histone modification and an RNA component. Nat. Genet. 30: 329-334. Marks P. A. and Jiang X. 2005. Histone deacetylase inhibitors in programmed cell death and cancer therapy. Cell Cycle 4: 549-551. Martens J.H., O’Sullivan R.J., Braunschweig U., Opravil S., Radolf M , Steinlein P., and Jenuwein T. 2005. The profile of repeat- associated histone lysine methylation states in the mouse epigenome. EMBO J. 24: 800-812. Maurer-Stroh S., Dickens N.J., Hughes-Davies L., Kouzarides T., Eisenhaber R., and Ponting C.P. 2003. The Tudor domain ‘Royal Family’: Tudor, plant Agenet, Chromo, PWWP and MBT domains. Trends Biochem. Sci. 28: 69-74. MayerW., Niveleau A., Walter J., Fundele R., and HaafT. 2000. Dem- ethylation of the zygotic paternal genome. Nature 403: 501-502. McClintock B. 1951. Chromosome organization and genic expression. Cold Spring Harbor Symp. Quant. Biol. 16: 13-47. McGarvey K., Fahmer J., Green E., Martens J., Jenuwein T., and Baylin S.B. 2006. Silenced tumor suppressor genes reactivated by DNA demethylation do not return to a fully euchromatic chromatin state. Cancer Res. 66: 3541-3549. McGrath J. and Solter D. 1984. Completion of mouse embryogenesis requires both the maternal and paternal genomes. Cell 37: 179-183. Metzger E., Wissmann M., Yin N., Muller J.M., Schneider R., Peters A.H., Gunther T, Buettner R., and Schule R. 2005. LSD1 demethylates repressive histone marks to promote androgen- receptor-dependent transcription. Nature 437: 436-439. Meyer B.J., McDonel P., Csankovszki G., and Ralston E. 2004. Sex and X-chromosome-wide repression in Caenorhabditis elegans. Cold Spring Harbor Symp. Quant. Biol. 69: 71-79. Misteli T. 2004. Spatial positioning; a new dimension in genome function. Cell 119: 153-156. Mito Y., Henikoff J.G., and Henikoff S. 2005. Genome-scale profiling of histone H3.3 replacement patterns. Nat. Genet. 37: 1090-1097. Mizuguchi G, Shen X., Landry J., Wu W.H., Sen S., and Wu C. 2004 ATP-driven exchange of histone H2AZ variant catalyzed by SWR1 chromatin remodeling complex. Science 303: 343-348. Mochizuki K., Fine N.A., Fujisawa T., and Gorovsky M.A. 2002. Analysis of a piwi-related gene implicates small RNAs in genome rearrangement in tetrahymena. Cell 110: 689-699. Mohrmann L. and Verrijzer C.P. 2005. Composition and functional specificity of SWI2/SNF2 class chromatin remodeling complexes. Biochim. Biophys. Acta 1681: 59-73. Morgan H.D., Santos F, Green K., Dean W., and Reik W. 2005. Epigenetic reprogramming in mammals. Hum. Mol. Genet. 14 Spec. No. 1: R47-R58. Motamedi M.R., Verdel A., Colmenares S.U., Gerber S.A., Gygi S.R, and Moazed D. 2004. Two RNAi complexes, RITS and RDRC, physically interact and localize to noncoding centromeric RNAs. Cell 119: 789-802. Muller H.J. 1930. Types of visible variations induced by X-rays in Drosophila. J. Genet. 22: 299-334. Nakayama J., Rice J.C., Strahl B.D., Allis C.D., and Grewal S.I. 2001. Role of histone H3 lysine 9 methylation in epigenetic control of heterochromatin assembly. Science 292: 110-113. Narita M., Nunez S., Heard E., Narita M., Lin A.W., Hearn S.A., Spector D.L., Hannon G.J., and Lowe S.W. 2003. Rb-mediated heterochromatin formation and silencing of E2F target genes during cellular senescence. Cell 113: 703-716. Narlikar G.J., Fan H.Y., and Kingston R.E. 2002. Cooperation between complexes that regulate chromatin structure and transcription. Cell 108: 475-487. Nowak S.J. and Corces V.G. 2004. Phosphorylation of histone H3: A balancing act between chromosome condensation and transcriptional activation. Trends Genet. 20: 214-220. Orphanides C., LeRoy G., Chang C.H., Luse D.S., and Reinberg D. 1998. FACT, a factor that facilitates transcript elongation through nucleosomes. Cell 92: 105-116. Pal-Bhadra M., Leibovitch B.A., Gandhi S.G., Rao M., Bhadra U., Birchler J.A., and Elgin S.C. 2004. Heterochromatic silencing and HP1 localization in Drosophila are dependent on the RNAi machinery. Science 303: 669-672. Paro R. and Hogness D.S. 1991. The Polycomb protein shares a homologous domain with a heterochromatin-associated protein of Drosophila. Proc. Natl. Acad. Sci. 88: 263-267. Petersen-Mahrt S. 2005. DNA deamination in immunity. Immunol. Rev. 203: 80-97. Pirrotta V. 1998. Polycombingthe genome: PcG, trxG, and chromatin silencing. Cell 93: 333-336. Pontier D., Yahubyan G., Vega D., Bulski A., Saez-Vasquez J., Hakimi M.A., Lerbs-Mache S., Colot V., and Lagrange T. 2005. Reinforcement of silencing at transposons and highly repeated sequences requires the concerted action of two distinct RNA polymerases IV in Arabidopsis. Genes Dev. 19: 2030-2040. Ratcliff R., Harrison B.D., and Baulcombe D.C. 1997. A similarity between viral defense and gene silencing in plants. Science 276: 1558-1560. Razin A. and Riggs A.D. 1980. DNA methylation and gene function. Science 210: 604-610. Rea S., Eisenhaber E., O’Carroll D., Strahl B.D., Sun Z.W., Schmid M., Opravil S., Mechtler K., Ponting C.P., Allis C.D., and Jenuwein T 2000. Regulation of chromatin structure by site-specific histone H3 methyltransferases. Nature 406: 593-599. Reinberg D., Chuikov S., Famham P., Karachentsev D., Kirmizis A., Kuzmichev A., Margueron R., Nishioka K., Preissner T.S., Sarma K., et al. 2004. Steps toward understanding the inheritance of repressive methyl-lysine marks in histones. Cold Spring Harbor Symp. Quant. Biol. 69: 171-182. Reinhart B.J. and Bartel D.P. 2002. Small RNAs correspond to centromere heterochromatic repeats. Science 297: 1831. Rme J. 2005. Cell biology. Twists in the tale of the aging yeast. Science 310: 1124-1125. Ringrose L. and Paro R. 2004 Epigenetic regulation of cellular memory by the Polycomb and Trithorax group proteins. Annu. Rev. Genet. 38: 413-443. Ringrose L., Ehret H., and Paro R. 2004. Distinct contributions of histone H3 lysine 9 and 27 methylation to locus-specific stability of polycomb complexes. Mol. Cell 16: 641-653. Robertson K.D. 2005. DNA methylation and human disease. Nat. Rev. Genet. 6: 597-610. RoloffT.C. and Nuber U.A. 2005. Chromatin, epigenetics and stem cells. Eur. J. Cell Biol. 84: 123-135. Roth S.Y., Denu J.M., and Allis C.D. 2001. Histone acetyltrans- ferases. Annu. Rev. Biochem. 70: 81-120. Sanchez-Eisner T., Gou D., Kremmer E., and Sauer F. 2006. Noncoding RNAs of trithorax response elements recruit Drosophila Ashl to ultrabithorax. Science 311: 1118-1123. Santos-Rosa H., Schneider R., Bannister A. J., Sherriff J., Bernstein B. E., Emre N.C., Schreiber S.L., Mellor J., and Kouzarides T. 2002. Active genes are tri-methylated at K4 of histone H3. Nature 419: 407-411. Sarma K. and Reinberg D. 2005. Histone variants meet their match. Nat. Rev. Mol. Cell Biol. 6: 139-149. Scaffidi P., Gordon L., and Misteli T. 2005. The cell nucleus and aging: Tantalizing clues and hopeful promises. PLoS. Biol. 3: e395. Schalch T., Duda S., Sargent D.E, and Richmond T.J. 2005. X-ray structure of a tetranucleosome and its implications for the chromatin fibre. Nature 436: 138-141. Schmitt S., Prestel M., and Paro R. 2005. Intergenic transcription through a polycomb group response element counteracts silencing. Genes Dev. 19: 697-708. Schneider R., Bannister A. J., and Kouzarides T. 2002. Unsafe SETs: Histone lysine methyltransferases and cancer. Trends Biochem. Sci. 27: 396-402. Schreiber S.L. and Bernstein B.E. 2002. Signaling network model of chromatin. Cell 111: 771-778. Schwartz B.E. and Ahmad K. 2005. Transcnptional activation triggers deposition and removal of the histone variant H3.3. Genes Dev. 19: 804-814. Schwartz Y.B., Kahn T.G., and Pirrotta V. 2005. Characteristic low density and shear sensitivity of cross-linked chromatin containing polycomb complexes. Mol. Cell Biol. 25: 432-439. Sekinger E.A., Moqtaderi Z., and Struhl K. 2005. Intrinsic histone- DNA interactions and low nucleosome density are important for preferential accessibility of promoter regions in yeast. Mol Cell 18: 735-748. Seligson D.B., Horvath S., Shi T., Yu H., Tze S., Grunstein M., and Kurdistani S.K. 2005. Global histone modification patterns predict risk of prostate cancer recurrence. Nature 435: 1262-1266. ShenX., Mizuguchi G., Hamiche A., and Wu C. 2000. A chromatin remodeling complex involved in transcription and DNA processing. Nature 406: 541-544 Shi Y., Lan E., Matson C, Mulligan P., Whetstine J.R., Cole P.A., Casero R.A., and Shi Y. 2004. Histone demethylation mediated by the nuclear amine oxidase homolog LSD1. Cell 119: 941-953. Shorter J. and Lindquist S. 2005. Prions as adaptive conduits of memory and inheritance. Nat. Rev. Genet. 6: 435-450. Sims R.J., III, Belotserkovskaya R., and Reinberg D. 2004. Elongation by RNA polymerase II : The short and long of it. Genes Dev. 18: 2437-2468. Smith C.L. and Peterson C.L. 2005. ATP-dependent chromatin remodeling. Curr. Top. Dev. Biol. 65: 115-148. Squazzo S.L., O’Geen H., Komashko V.M., Krig S.R., Jin V.X., Jang S.W., Margueron R., Reinberg D., Green R., and Famham RJ. 2006 Suzl2 binds to silenced regions on the genome in a cell- type-specific manner. Genome Res. 16: 890-900. Sterner D.E. and Berger S.L. 2000. Acetylation of histones and transcription-related factors. Microbiol. Mol. Biol. Rev. 64: 435- 459. Strahl B.D. and Allis C.D. 2000. The language of covalent histone modifications. Nature 403: 41-45. Strahl B.D., Ohba R., Cook R.G., and Allis C.D. 1999. Methylation of histone H3 at lysine 4 is highly conserved and correlates with transcriptionally active nuclei in Tetrahymena. Proc. Natl. Acad. Sci. 96: 14967-14972. Su G.H., Sohn T.A., Ryu B., and Kern S.E. 2000. A novel histone deacetylase inhibitor identified by high-throughput transcriptional screening of a compound library. Cancer Res. 60: 3137-3142. Sung S. and Amasino R.M. 2004. Vernalization in Arabidopsis thaliana is mediated by the PHD finger protein VIN3. Nature 427: 159-164. Surani M.A., Barton S.C, and Norris M.X. 1984. Development of reconstituted mouse eggs suggests imprinting of the genome during gametogenesis. Nature 308: 548-550. Tagami H., Ray-Gallet D., Almouzni G., and Nakatani Y. 2004 Histone H3.1 and H3.3 complexes mediate nucleosome assembly pathways dependent or independent of DNA synthesis. Cell 116: 51-61. Tamaru H. and Selker E.V. 2001. A histone H3 methyltransferase controls DNA methylation in Neurospora crassa. Nature 414: 277-283. Tanaka E.M. 2003. Regeneration: If they can do it, why can’t we? Cell 113: 559-562. Thomas J.O. 1999. Histone HI: Location and role. Curr. Opin. Cell Biol. 11: 312-317. Tsukada Y., Fang J., Erdjument-Bromage H., Warren M.E., Borch- ers C.H., Tempst P., and Zhang Y. 2006. Histone demethylation by a family of JmjC domain-containing proteins. Nature 439: 811-816 TsukiyamaT., Daniel C., Tamkun J., and Wu C. 1995. ISWI, amember of the SWI2/SNF2 ATPase family, encodes the 140 kDa subunit of the nucleosome remodeling factor Cell 83: 1021-1026. Turner B.M. 2000. Histone acetylation and an epigenetic code. Bio Essays 22: 836-845. Valk-Lingbeek M.E., Bruggeman S.W., and van Lohuizen M. 2004. Stem cells and cancer; the polycomb connection. Cell 118: 409-418 van Attikum H. and Gasser S.M. 2005. The histone code at DNA breaks: A guide to repair? Nat. Rev. Mol. Cell Biol. 6: 757-765. van der Heijden G.W., Dieker J.W., DerijckA.A., Muller S., Berden J.H , Braat D.D., van der Vlag J., and de Boer P. 2005. Asymmetry in histone H3 variants and lysine methylation between paternal and maternal chromatin of the early mouse zygote. Mech. Dev. 122: 1008-1022. Vaquero A., Loyola A., and Reinberg D. 2003. The constantly changing face of chromatin. Sci. Aging Knowledge Environ. 2003: RE4. Varga-Weisz P.D., Wilm M., Bonte E., Dumas K., Mann M., and Becker P.B. 1997. Chromatin-remodeling factor CHRAC contains the ATPases ISWI and topoisomerase II. Nature 388: 598-602 Verdel A., Jia S., Gerber S., Sugiyama T., Gygi S., Grewal S.L, and Moazed D. 2004. RNAi-mediated targeting of heterochromatin by the RITS complex. Science 303: 672-676. Vidanes C.M., Bonilla C.Y., and Toczyski D.P. 2005. Complicated tails: Histone modifications and the DNA damage response. Cell 121: 973-976. Vignali M., Hassan A.H., Neely K.E., and Workman J.L.. 2000. ATP-dependent chromatin-remodeling complexes. Mol. Cell. Biol. 20: 1899-1910. Vire E., Brenner C., Deplus R., Blanchon L., Fraga M., Didelot C. , Morey L., Van E.A., Bernard D., Vanderwinden J.M., et al. 2005. The Polycomb group protein EZH2 directly controls DNA methylation Nature 439: 861-874. Volpe T.A., Kidner C., Hall I.M., Teng C., Grewal S.L, and Mar- tienssen R.A. 2002. Regulation of heterochromatic silencing and histone H3 lysine-9 methylation by RNAi. Science 297: 1833-1837. Waddington C.H. 1957. The strategy of the genes. MacMillan, New York. Wade P.A., Gegonne A., Jones P.L., Ballestar E., Aubry E., and Wolffe A.P. 1999. Mi-2 complex couples DNA methylation to chromatin remodeling and histone deacetylation. Nat. Genet. 23: 62-66. Walsh C.P., Chaillet J .R., and Bestor T.H. 1998. Transcription of IAP endogenous retroviruses is constrained by cytosine methylation. Nat. Genet. 20: 116-117. Watanabe Y., Yokobayashi S., Yamamoto M., and Nurse P. 2001. Premeiotic S phase is linked to reductional chromosome segregation and recombination. Nature 409: 359-363. Watson J.D. 2003. Celebrating the genetic jubilee: A conversation with James D. Watson. Interviewed by John Rennie. Sci. Am. 288: 66-69. Wei Y., Yu L., Bowen J., Gorovsky M.A., and Allis C.D. 1999. Phosphorylation of histone H3 is required for proper chromosome condensation and segregation. Cell 97: 99-109. Whetstine J.R., Nottke A., Lan R., Huarte M., Smolikov S., Chen Z., Spooner E., Li E., Zhang G., Colaiacovo M., and Shi Y. 2006. Reversal of histone lysine trimethylation by the JMJD2 family of histone demethylases. Cell 125: 467-481. Wolffe A.P. and Matzke M.A. 1999. Epigenetics: Regulation through repression. Science 286: 481-486. Wysocka J., Swigut T., Milne T.A., Dou Y., Zhang X., Burlingame A.L., Roeder R.G., Brivanlou A.H., and Allis C.D. 2005. WDR5 associates with histone H3 methylated at K4 and is essential for H3 K4 methylation and vertebrate development. Cell 121: 859-872. Yan Q., Huang J., Fan T., Zhu H., and Muegge K. 2003. Lsh, a modulator of CpG methylation. is crucial for normal histone methylation. EMBO J. 22: 5154-5162. Yu B., Yang Z., Li J., Minakhina S., Yang M., Padgett R.W., Steward R., and Chen X. 2005. Methylation as a crucial step in plant micro RNA biogenesis. Science 307: 932-935. Zhang Y. and Reinberg D. 2001. Transcription regulation by histone methylation: Interplay between different covalent modifications of the core histone tails. Genes Dev. 15: 2343-2360. Zhang Y., LeRoy G., Seeiig H.R, Lane W.S., and Reinberg D. 1998. The dermatomyositis-specific autoantigen Mi2 is a component of a complex containing histone deacetylase and nucleosome remodeling activities. Cell 95: 279-289.Глава 4. Эпигенетика дрожжей Saccharomyces cerevisiae
 Michael Grunstein1 и Susan М. Gasser2
1University of California, LosAngeles, California 90095-1570
2Fried rich Miescher Institute for Biomedical Research, 4058 Basel, Switzerland
Michael Grunstein1 и Susan М. Gasser2
1University of California, LosAngeles, California 90095-1570
2Fried rich Miescher Institute for Biomedical Research, 4058 Basel, Switzerland
Общее резюме
В ядре эукариот фракция хроматина, содержащая активные гены, называется эухроматином. Во время митоза она подвергается конденсации, чтобы обеспечить сегрегацию хромосом, а в интерфазе клеточного цикла снова деконденсируется, чтобы сделать возможной транскрипцию. Цитологическими методами было обнаружено, что некоторые хромосомные домены остаются конденсированными и во время интерфазы. Эти конститутивно компактные участки хроматина и были названы гетерохроматином. С развитием новых методов эту часть генома стали определять по молекулярным, а не цитологическим критериям: было показано, что конститутивно компактный хроматин в области центромер и теломер содержит тысячи копий простых повторяющихся последовательностей. Такой гетерохроматин, как правило, реплицируется на поздних этапах S-фазы клеточного цикла и образует скопления по периферии ядра и вблизи ядрышка. Существенной чертой гетерохроматина является способность к стохастичному распространению своей характерной, устойчивой к действию нуклеаз, структуры и связанной с нею репрессии транскрипции на соседние гены. Например, в случае гена white дрозофилы, детерминирующего красный цвет глаз, такая эпигенетическая репрессия проявляется в появлении чередующихся красных и белых участков глаза. Это явление получило название «мозаичность, обусловленная эффектом положения» (position-effect variegation — PEV) В его основе — узнавание метилированной по 9-му остатку лизина формы гистона H3 (H3K9) гетерохроматиновым белком 1 (heterochromatin protein 1 — НР1) и распространение этой метки вдоль хромосомы. У пекарских дрожжей Saccharomyces cerevisiae в ходе эволюции возник другой механизм образования гетерохроматина, но приводит он к очень похожему результату. S. cerevisiae — микроорганизм, широко используемый при производстве пива и в хлебопечении. Однако, в отличие от бактерий, это — эукариот. Хромосомы у пекарских дрожжей, как и у более сложно организованных эукариот, связаны с гистонами, заключены в ядро и реплицируются в ходе S-фазы клеточного цикла с использованием множественных точек начала репликации (ориджинов). Тем не менее, геном у дрожжей очень маленький: всего 14 миллионов пар оснований ДНК на 16 хромосом. Это ненамного больше, чем геномы некоторых бактериофагов. Всего в геноме дрожжей около 6000 довольно тесно расположенных генов: промежутки между ними обычно составляют не более 2 т.п.н. (тысяч пар нуклеотидов). Подавляющее большинство генов у дрожжей находится в хроматине открытой конфигурации, обеспечивающей их активную транскрипцию или возможность ее быстрой индукции. Это обстоятельство и очень небольшое количество простых повторяющихся последовательностей ДНК делает практически невозможной детекцию гетерохроматина у дрожжей цитологическими методами. Тем не менее, с помощью молекулярных методов было показано, что у дрожжей имеются четко выделяющиеся гетерохроматиновые участки по соседству с теломерами всех 16-ти хромосом, а также в двух «молчащих» локусах типов спаривания III хромосомы. Репрессия транскрипции этих двух локусов существенна для поддержания компетентного к спариванию гаплоидного состояния. И субтеломерные области, и «молчащие» локусы типов спаривания репрессируют интегрированные репортерные гены позиционно-зависимым эпигенетическим механизмом, реплицируются во время поздней S-фазы и расположены по периферии ядра. Таким образом, эти локусы имеют все характерные для гетерохроматина черты, за исключением цитологически наблюдаемой конденсации в интерфазе. Для ученого, изучающего гетерохроматин, дрожжи сочетают преимущества малого генома, возможности использования генетических и биохимических методов исследования микроорганизмов и важные аспекты организации хромосом высших эукариот.1. Генетические и молекулярные методы исследования дрожжей
Дрожжи представляют собой гибкую и быструю генетическую систему для изучения клеточных процессов. При времени клеточной генерации около 90 мин. всего за два дня можно вырастить колонии, содержащие миллионы клеток. К тому же дрожжи можно поддерживать в гаплоидной и диплоидной формах, что резко упрощает их генетический анализ. Как и бактерий, гаплоидные клетки дрожжей можно использовать для получения ауксотрофных мутантов со специфическими требованиями к составу питательной среды. Рецессивные летальные мутации можно поддерживать в культуре гаплоидных клеток в виде условных летальных аллелей (например, температуро-чувствительных мутантов) или в культуре гетерозиготных диплоидных клеток (содержащих и аллель дикого типа и мутацию). Наличие высокоэффективной системы гомологичной рекомбинации у дрожжей позволяет произвольно изменять любую выбранную хромосомную последовательность ДНК. К тому же, можно осуществлять манипуляции с участками хромосом в составе рекомбинантных плазмид, которые стабильно поддерживаются в делящихся клетках дрожжей, благодаря включению в них коротких последовательностей центромеры и ориджина репликации ДНК. В дрожжах стабильно поддерживаются даже линейные плазмиды (минихромосомы), содержащие теломерные повторы по концам. Явление мозаичности, обусловленной эффектом положения, на модели репортерного гена white дрозофилы сыграло важную роль в изучении эпигенетической регуляции генов, а также генов, влияющих на эту уникальную форму репрессии (см. более детально в главе 5). Открытию и изучению аналогичного явления в области теломер у дрожжей, теломерного эффекта положения (telomere position effect — ТРЕ) помогло использование в качестве репортерных генов Ura3 и Ade2 (рис. 4.1). В присутствии 5-фтороротовой кислоты (5-fluoroorotic acid-5-FOA) продукт гена Ura3 превращает ее в 5-фторурацил (5-fluorouracil-5-FU) — ингибитор синтеза ДНК, вызывающий гибель клеток Однако, при интеграции в область гетерохроматина ген Ura3 оказывается репрессированным в части клеток, и именно эти клетки оказываются способными расти на среде с 5-FOA. Таким образом, определяя эффективность роста на среде с 5-FOA с помощью серийных разведений культуры клеток дрожжей (рис. 4.1а), можно количественно измерять степень репрессии репортерного гена в очень широких пределах (например, в 10— 106-кратных). Более того, мутации, нарушающие ТРЕ, могут быть легко идентифицированы по повышению чувствительности к 5-FOA. Аналогично, при интеграции гена Ade2 в область гетерохроматина происходит его репрессия, и в клетке накопливается предшественник биосинтеза аденина, окрашивая ее в красный цвет Существенно, что эпигенетическая природа репрессии Ade2 видна в пределах одиночной колонии генетически идентичных клеток. Ген может быть «включен» в некоторых клетках и «выключен» в остальных. Внешне это проявляется как наличие красных участков на фоне белой колонии или наоборот (рис. 4.16). В отличие от теста с использованием Ura3, селекции против клеток, в которых остался не репрессированным ген Ade2, не происходит, поэтому фенотип клеток с интегрированным в субтеломерный гетерохроматин геном-репортером можно использовать как показатель скорости переключения и наследования эпигенетического состояния. Цветной тест с использованием Ade2 представляет собой удивительную иллюстрацию полустабильной природы репрессированного и дерепрессированного состояний. Рис. 4.1. Сайленсинги ТРЕ у дрожжей
(а) Ген Ura3, встроенный рядом с простыми TG-богатыми теломерными повторами в левом плече VII хромосомы, подвергается сайленсингу теломерным гетерохроматином в данном штамме дрожжей. При выращивании на обычной богатой среде (YPD) не наблюдается различий между клетками дикого типа (wt), клетками с репрессированным субтеломерным геном Ura3 и мутантами по сайленсингу, у которых теломерный гетерохроматин утрачен, а ген Ura3 экспрессируется. На среде, содержащей 5-FOA (нижняя панель), с другой стороны, клетки с репрессированным геном Ura3 (например, клетки дикого типа) могут расти, а клетки, экспрессирующие его (sir2nyku70 мутанты), не могут. Это объясняется тем, что продукт гена Ura3 превращает 5-FOA в токсичный интермедиат 5-фторурацил. Тест с серийными разведениями позволяет детектировать события сайленсинга даже при частоте 1 на 106 клеток.
(б) Клетки, содержащие ген Ade2 дикого типа, дают «белую» колонию, а клетки с мутантным ade2 — красную, что связано с накоплением красного интермедиата биосинтеза аденина. При встраивании гена Ade2 рядом с теломерой в правом плече V хромосомы происходит его эпигенетический сайленсинг. И «молчащее», и активное состояния гена Ade2 наследуются в генетически идентичных клетках, в результате чего образуются колонии с белыми и красными секторами (весьма похоже на картину, наблюдаемую при PEV)
Рис. 4.1. Сайленсинги ТРЕ у дрожжей
(а) Ген Ura3, встроенный рядом с простыми TG-богатыми теломерными повторами в левом плече VII хромосомы, подвергается сайленсингу теломерным гетерохроматином в данном штамме дрожжей. При выращивании на обычной богатой среде (YPD) не наблюдается различий между клетками дикого типа (wt), клетками с репрессированным субтеломерным геном Ura3 и мутантами по сайленсингу, у которых теломерный гетерохроматин утрачен, а ген Ura3 экспрессируется. На среде, содержащей 5-FOA (нижняя панель), с другой стороны, клетки с репрессированным геном Ura3 (например, клетки дикого типа) могут расти, а клетки, экспрессирующие его (sir2nyku70 мутанты), не могут. Это объясняется тем, что продукт гена Ura3 превращает 5-FOA в токсичный интермедиат 5-фторурацил. Тест с серийными разведениями позволяет детектировать события сайленсинга даже при частоте 1 на 106 клеток.
(б) Клетки, содержащие ген Ade2 дикого типа, дают «белую» колонию, а клетки с мутантным ade2 — красную, что связано с накоплением красного интермедиата биосинтеза аденина. При встраивании гена Ade2 рядом с теломерой в правом плече V хромосомы происходит его эпигенетический сайленсинг. И «молчащее», и активное состояния гена Ade2 наследуются в генетически идентичных клетках, в результате чего образуются колонии с белыми и красными секторами (весьма похоже на картину, наблюдаемую при PEV)
Вместе с описанными генетическими подходами к протеазо-дефицитным штаммам, растущим в синхронных и асинхронных крупномасштабных культурах, вполне применимы биохимические методы. В последние годы арсенал доступных средств расширился изощренными методами анализа с помощью микрочипов и белковых сетей, легко охватывающих весь небольшой геном дрожжей. Эти методы позволяют осуществлять полногеномный анализ транскрипции, связывания факторов транскрипции, модификации гистонов и белок-белковых взаимодействий. Этот широкий арсенал изощренных методов позволил ученым исследовать механизмы регуляции формирования гетерохроматина и его физиологическую роль в клетках дрожжей. Однако, прежде чем описать эти открытия, необходимо более детально рассмотреть жизненный цикл дрожжей.
2. Жизненный цикл дрожжей
Дрожжи S. cerevisiae размножаются путем митотических делений в гаплоидном или диплоидном состоянии, образуя почку, которая постепенно увеличивается и в какой-то момент отделяется от материнской клетки (рис. 4.2а). Гаплоидные клетки дрожжей могут спариваться друг с другом (коньюгировать), поскольку существуют в виде одного из двух типов спаривания, обозначаемых как а и а, напоминающих два пола у млекопитающих. Клетки каждого типа образуют свой феромон, привлекающий клетки противоположного типа: клетки типа а синтезируют 12-членный пептид, называемый а-фактор, который связывается мембранным рецептором а-фактора на поверхности клеток типа α. И наоборот, клетки типа а синтезируют 13-членный пептид. который связывается рецептором α-фактора на поверхности клеток типа а. Эти взаимодействия приводят к остановке клеток на стадии от средней до поздней G1-фазы клеточного цикла. При этом клетки приобретают грушевидную форму, называемую «шму» (shmoo) по имени персонажа известного мультфильма (рис. 4.2б). Клетки противоположных типов сливаются своими выпячиваниями, образуя диплоидную клетку а/а. В диплоидных клетках способность к спариванию репрессирована: они размножаются вегетативно (т.е. путем митотических делений), как и гаплоидные клетки. С другой стороны, в условиях голодания в них индуцируется мейотическая программа, приводящая к формированию аска (сумки) с четырьмя спорами, по две каждого типа спаривания. При поступлении достаточного количества питательных веществ гаплоидные споры превращаются в клетки, способные к спариванию, т.е. возобновляется нормальный жизненный цикл.Хотя в лабораторных условиях гаплоидные клетки дрожжей обычно маркируются одним из двух типов спаривания, в естественных условиях они переключают свои тип спаривания практически с каждым клеточным циклом (рис. 4.3а). Такое переключение индуцируется эндонуклеазной активностью (НО), осуществляющей сайт-специфический двунитчатый разрыв в области локуса МАТ. Происходящий затем процесс конверсии генов переносит информацию о противоположном типе спаривания из конститутивно «молчащего» донорского локуса НМLa или HMRα, в активныйлокус МАТ. Такие штаммы называют гомоталлическими (homothallic). Это означает, что вегетативно растущая клетка типа МАТа быстро даст МАТα потомство и наоборот. В условиях лаборатории удобно использовать клетки со стабильным типом спаривания, поэтому лабораторные штаммы конструируют с дефектным геном эндонуклеазы НО, что исключает расщепления локуса МАТ и. соответственно, переключение типов спаривания. В результате образуется гетероталлический штамм. Такие штаммы содержат «молчащие» локусы НМ и активный локус МАТ стабильно а- или α-типа. Два «молчащих» локуса типов спаривания (рис. 4.3б), по одному для каждого «пола», поддерживаются в конститутивно «молчащем» эпигенетическом состоянии и стали классической моделью для изучения гетерохроматина.
3. Гетерохроматин у дрожжей находится в «молчащих» локусах типов спаривания НМ и теломерах
У дрожжей информация, детерминирующая типы спаривания (а или а), находится в трех локусах, НМ La, МАТ, и HMRa, III хромосомы. Локусы HMLα (~11 т.п.н. от левой теломеры) и HMRa (-23 т.п.н. от правой теломеры; рис. 4.36,в) расположены между короткими элементами ДНК, называемыми сайленсерами Е и I. Только когда любая из двух «молчащих» кассет копируется и интегрируется в активный локус МАТ, она приобретает способность транскрибироваться в нормальной клетке. Перенос информации из локуса HMLα в локус МАТ приводит к образованию клетки с типом спаривания α (МАТα), а перенос информации из локуса HMRa в локус МАТ — клетки типа а (МАТа) (рис. 4.36). Это показывает, что гены и промоторы в локусах ЯМ невредимы, но находятся в стабильно репрессированном состоянии до тех пор, пока остаются в этих локусах. Это — существенное для поддержания способности к скрещиванию обстоятельство, поскольку одновременная экспрессия в одной и той же клетке транскриптов обоих типов (а и α) приводит к возникновению не способного к скрещиванию стерильного состояния. Регистрация стерильного фенотипа оказалась весьма полезной для идентификации мутаций, нарушающих сайленсинг локусов НМ. Белки-регуляторы сайленсинга (silent information regulatory proteins — SIRs) SIR1, SIR2, SIR3 и SIR4 были обнаружены именно как необходимые для полной репрессии «молчащих» локусов НМ (см. обзор Rusche et al., 2003). Мутации sir2, sir3, и sir4 приводят к полной утрате сайленсинга, в то время как при мутациях sirl лишь часть клеток МАТа утрачивает способность к спариванию из-за нарушения репрессии локуса НМ. Благодаря частичному фенотипу sirl-дефектных клеток удалось показать, что альтернативные состояния (спаривающееся-неспаривающееся) могут наследоваться в последовательных поколениях делящихся генетически идентичных клеток (Pillus and Rine 1989). Это послужило ясной демонстрацией того, что репрессия типов спаривания обладает характерными чертами эпигенетически контролируемого процесса. Кроме того, в других исследованиях было показано, что в образовании структуры гетерохроматина участвуют N-концевые участки молекул гистонов H3 и Н4, белок-активатор репрессора 1 (repressor activator protein 1 - Rap1) и комплекс узнавания ориджинов репликации (origin recognition complex — ORC) (см. обзор Rusche et al., 2003).Гетерохроматин присутствует также непосредственно по соседству с повторами теломерной ДНК дрожжей (C1-3A/TG1-3). Как упоминалось выше, при интеграции репортерных генов, таких как Ura3 или Ade2, рядом с теломерными повторами происходит их репрессия по мозаичному и эпигенетическому типу (Gottschling et al. 1990) Этот эффект (ТРЕ), как и сайленсинг локусов НМ, зависит от Rap1, Sir2, Sir3, Sir4 и N-концевых участков молекул гистонов (Kayne et al., 1988; Aparicio et al., 1991). Генетические исследования свидетельствуют о том, что, за исключением Sir1, близкие механизмы обеспечивают сайленсинг в области локусов НМ и в примыкающих к теломерам участках. Более того, учитывая способность репортерных генов в субтеломерных участках достаточно часто переключаться между «молчащим» и экспрессирующимся состояниями, данный тип репрессии, по-видимому, весьма близок явлению мозаичности, обусловленной эффектом положения (PEV) у дрозофилы. У дрожжей четыре белка Sir, осуществляющих репрессию, не имеют существенной взаимной гомологии. Белки Sir1, Sir3 и Sir4 консервативны только у самих S. cerevisiae и близких им видах почкующихся дрожжей. Sir2, напротив, является родоначальником большого семейства НАД-зависимых деацетилаз гистонов, консервативного от бактерий до человека (рис. 4.4). Роль 8п2-подобных деацетилаз гистонов в репрессии транскрипции обнаружена даже у организмов, не имеющих других Sir белков, таких как делящиеся дрожжи и двукрылые. У дрожжей Schizosaccharomyces pombe активность Sir2 необходима для сайленсинга транскрипции вблизи теломер, а у дрозофилы она влияет на стабильность эффекта PEV (см. обзор Chopra and Mishra, 2005). Сопряженный с деацегилированием гидролиз НАД белком Sir2 приводит к образованию О-ацетил-АДФ-рибозы, интермедиата, возможно имеющего свою собственную функцию (Tanner et al. 2000; также см. раздел 13). Важно отметить, что помимо гистонов ферменты семейства Sir2 модифицируют множество других субстратов, причем имеется обширная ветвь этого семейства, состоящая из цитоплазматических ферментов (рис. 4.4). Разнообразие функций Sir2 можно проиллюстрировать тем, что у млекопитающих ферменты этого семейства деацетилируют факторы транскрипции FOXO и р53 в ответ на стресс и повреждение ДНК, изменяя тем самым их взаимодействие. У почкующихся дрожжей Sir2 имеет важную роль помимо участия в сайленсинге, а именно подавляет нереципрокную рекомбинацию высокоповторяющихся генов рДНК локуса в области ядрышка (Gottlieb and Esposito 1989).
4. Гетерохроматин отличается репрессивной структурой, которая распространяется на весь «молчащий» домен
Репрессия активности генов в эухроматине может происходить вследствие связывания репрессорного белка или комплекса, узнающего определенную последовательность в промоторе гена и препятствующего движению или посадке аппарата транскрипции. Репрессия в области гетерохроматина достигается другим способом, который не является промотор-специфичным. Она начинается с определенных участков, от которых распространяется непрерывно по всему домену, репрессируя все промоторы, находящиеся в соответствующей области (рис. 4.5) (Renauld et al., 1993). Наиболее четко это было показано с помощью метода иммуно-преципитации хроматина: оказалось, что белки Sir2, Sir3 и Sir4 физически связаны с хроматином по всему «молчащему» субтеломерному домену (Hecht et al., 1996; Strahl-Bolsinger et al., 1997). Доказательства, что такая связь приводит к формированию менее доступной репрессивной структуры были получены в других экспериментах. Например, ДНК «молчащих» доменов хроматина плохо метилировалась экспрессируемой в дрожжевых клетках бактериальной метилазой dam, тогда как последовательности ДНК вне этих доменов метилировались вполне эффективно. По-видимому, гетерохроматин затрудняет доступ к ДНК таким молекулам как dfom-метилтрансфераза (Gottschling. 1992). Аналогично, 3-т.п.н. локус HMR избирательно устойчив к действию определенных рестрикционных эндонуклеаз в изолированных ядрах (Loo and Rine, 1994), а нуклеосомы между двух сайленсер-элементов в «молчащих» локусах НМ расположены близко друг к другу, образуя нуклеазо-резистентный домен, отсутствующий в активных локусах (Weiss and Simpson, 1998). Итак, гетерохроматин у дрожжей имеет особую структурную организацию. Рис. 4.4. Семейство деацетилаз Sir2
Sir2 является прототипом большого семейства НАД-зависимых деацетилаз. Семейство белков Sir2 необычно консервативно и найдено у организмов от бактерий до человека. Его эволюционное древо содержит как ядерные, так и цитоплазматические ветви. Это филогенетическое древо без корня было построено с помощью программ CLUSTAL W® и TREEVIEW® для сравнения последовательности коровых доменов гомологов, идентифицированных в библиотеках кДНК и уникальных генов. Шесть подклассов и несвязанная группа описаны в работе Фрая (Frye 2000). Гомологи млекопитающих обозначены как SirT1-7 жирным шрифтом, а белки почкующихся дрожжей подчеркнуты Остальные обозначены названием вида (модифицировано с разрешения из Frye 2000 [©Elsevier])
Рис. 4.4. Семейство деацетилаз Sir2
Sir2 является прототипом большого семейства НАД-зависимых деацетилаз. Семейство белков Sir2 необычно консервативно и найдено у организмов от бактерий до человека. Его эволюционное древо содержит как ядерные, так и цитоплазматические ветви. Это филогенетическое древо без корня было построено с помощью программ CLUSTAL W® и TREEVIEW® для сравнения последовательности коровых доменов гомологов, идентифицированных в библиотеках кДНК и уникальных генов. Шесть подклассов и несвязанная группа описаны в работе Фрая (Frye 2000). Гомологи млекопитающих обозначены как SirT1-7 жирным шрифтом, а белки почкующихся дрожжей подчеркнуты Остальные обозначены названием вида (модифицировано с разрешения из Frye 2000 [©Elsevier])
 Рис. 4.5. Модель гетерохроматина дрожжей в теломерах и локусах НМ
Для распространения SIR-комплексов механизмы сайленсинга и теломер, и НМ-локусов используют Rap1, Sir2, Sir3 и Sir4, но они различаются тем, что теломерный зависит также от yKu, в то время как НМ-сайленсеры используют факторы ORC, Abf1 и Sir1. Предполагается, что теломерный гетерохроматин образует обратную петлю сам на себя. В результате получается структура, защищающая теломеру от деградации. Ее конденсация и сворачивание приводят к сайленсингу генов. В случае HM-гетерохроматина репрессированный домен между сайленсерными элементами состоит из тесно расположенных нуклеосом, образующих конденсированную структуру И теломерные, и НМ «молчащие» области недоступны аппарату транскрипции и деградирующим ферментам
Рис. 4.5. Модель гетерохроматина дрожжей в теломерах и локусах НМ
Для распространения SIR-комплексов механизмы сайленсинга и теломер, и НМ-локусов используют Rap1, Sir2, Sir3 и Sir4, но они различаются тем, что теломерный зависит также от yKu, в то время как НМ-сайленсеры используют факторы ORC, Abf1 и Sir1. Предполагается, что теломерный гетерохроматин образует обратную петлю сам на себя. В результате получается структура, защищающая теломеру от деградации. Ее конденсация и сворачивание приводят к сайленсингу генов. В случае HM-гетерохроматина репрессированный домен между сайленсерными элементами состоит из тесно расположенных нуклеосом, образующих конденсированную структуру И теломерные, и НМ «молчащие» области недоступны аппарату транскрипции и деградирующим ферментам
Не столь ясен вопрос о степени гиперконденсации гетерохроматина у дрожжей и многоклеточных организмов, и обусловленного ею затруднения доступа факторов транскрипции к ДНК. Репрессивный комплекс, образующийся при взаимодействии белков Sir с гистонами, оказался неожиданно динамичным: эти белки могут включаться в хроматин «молчащего» локуса НМ даже при остановке клеток в фазе клеточного цикла, в которой образования гетерохроматина обычно не происходит (Cheng and Gartenberg, 2000). Возможно, именно этим обстоятельством объясняется способность Sir-содержащего хроматина связываться с определенными факторами транскрипции даже в репрессированном состоянии (Sekinger and Gross, 1999). Тем не менее, хотя эти исследования и свидетельствуют о том, что гетерохроматин не является механическим препятствием для связывания с ДНК всех негистоновых белков, в нем не обнаруживается транскрипционной активности и связанных РНК-полимераз. Судя по результатам экспериментов Чена и Видома (Chen and Widom, 2005), специфически подавляемым гетерохроматином процессом является связывание с промотором комплексов РНК-полимеразы II и транскрипционных факторов TFIIB и TFIIE. Итак, хотя «молчащий» хроматин дрожжей является динамичным образованием, допускающим обмен белков SIR и, возможно, некоторых факторов транскрипции, он избирательно препятствует связыванию основного аппарата транскрипции и тем самым блокирует синтез мРНК (более детально см. главу 10).
5. Отдельные этапы сборки гетерохроматина
Формирование гетерохроматина у всех видов включает несколько молекулярных этапов, некоторые из которых были найдены и у почкующихся дрожжей. Один из наиболее изученных из них — сайт-специфическая нуклеация гетерохроматина, требующая участия сайт-специфических ДНК-связывающих факторов. Затем гетерохроматин распространяется из сайтов инициации. Распространение ограничивается специальными пограничными механизмами, которые у дрожжей хорошо изучены. Наконец, дрожжи успешно использовали для демонстрации роли субъядерных компартментов в опосредованной гетерохроматином репрессии. Формирование гетерохроматина в области теломер несколько отличается от его формирования в локусах НМ, но в обоих случаях действует общий принцип, что специфические ДНК-связывающие факторы инициируют распространение репрессоров общего назначения. В деталях эти механизмы описаны ниже (рис. 4.6). Рис. 4.6. Этапы сборки теломерного гетерохроматина
ЭТАП 1. Рекрутирование Sir4, затем Sir2 и Sir3 связанным с теломерами Rap1. Нателомерах Rap1 и yKuрекрутируют Sir4даже в отсутствии Sir2 и Sir3. Только Sir4 может быть рекрутирован в отсутствии остальных Sir-белков, причем его связыванию препятствуют Rifl и Rif2 (Mishra and Shore 1999).
ЭТАП 2. Опосредованное Sir2 деацетилирование гистона H4K16. Sir4-Sir2 и Sir4-Sir3 активно взаимодействуют, образуя Sir-комплексы по длине TG-повторов. НАД-зависимая гистон-деацетилазная активность Sir2 стимулируется образующимися комплексами и деанетилирует К16 остаток гистона Н4 в близлежащих нуклеосомах.
ЭТАП 3. Распространение SIR-комплекса по нуклеосомам. SIR-комплексы распространяются по нуклеосомам, возможно, с использованием О-ацетил-АДФ-рибозных интермедиатов, образующихся в результате НАД-гидролиза (Liou et al. 2005). Sir3 и Sir4 связываются с деацетилированными хвостами гистона Н4. Хотя деацетилированный N-концевой хвост гистона H3 также связывает белки Sir3 и Sir4, он не показан.
ЭТАП 4. Свертывание «молчащей» теломеры в структуру более высокого уровня. «Молчащий» хроматин «созревает» в конце М-фазы с образованием недоступной структуры. Этот процесс может включать более высокие уровни свертывания и связывание с ядерной оболочкой.
Рис. 4.6. Этапы сборки теломерного гетерохроматина
ЭТАП 1. Рекрутирование Sir4, затем Sir2 и Sir3 связанным с теломерами Rap1. Нателомерах Rap1 и yKuрекрутируют Sir4даже в отсутствии Sir2 и Sir3. Только Sir4 может быть рекрутирован в отсутствии остальных Sir-белков, причем его связыванию препятствуют Rifl и Rif2 (Mishra and Shore 1999).
ЭТАП 2. Опосредованное Sir2 деацетилирование гистона H4K16. Sir4-Sir2 и Sir4-Sir3 активно взаимодействуют, образуя Sir-комплексы по длине TG-повторов. НАД-зависимая гистон-деацетилазная активность Sir2 стимулируется образующимися комплексами и деанетилирует К16 остаток гистона Н4 в близлежащих нуклеосомах.
ЭТАП 3. Распространение SIR-комплекса по нуклеосомам. SIR-комплексы распространяются по нуклеосомам, возможно, с использованием О-ацетил-АДФ-рибозных интермедиатов, образующихся в результате НАД-гидролиза (Liou et al. 2005). Sir3 и Sir4 связываются с деацетилированными хвостами гистона Н4. Хотя деацетилированный N-концевой хвост гистона H3 также связывает белки Sir3 и Sir4, он не показан.
ЭТАП 4. Свертывание «молчащей» теломеры в структуру более высокого уровня. «Молчащий» хроматин «созревает» в конце М-фазы с образованием недоступной структуры. Этот процесс может включать более высокие уровни свертывания и связывание с ядерной оболочкой.
5.1. НМ гетерохроматин
«Молчащие» локусы типов спаривания HML и HMR ограничены по бокам короткими последовательностями ДНК — сайленсерами, обозначаемыми как Е (essential — существенный) и I (important — важный; рис. 4.36, в). Сайленсеры содержат участки связывания, как минимум, двух полифункциональных ядерных факторов, а именно Rap1 и Abf1, а также ориджин-узнающего комплекса (origin recognition complex — ORC) (Brand et al., 1987). Хотя делепия HMR-E, содержащего все три участка узнавания, гораздо сильнее влияет на сайленсинг, чем делеция HMR-1, содержащего лишь два из них, каждый из сайленсеров в локусах HMR и HML может служить специфическим сайтом нуклеации для связывания репрессирующего Sir-комплекса и последующего распространения белков Sir на лежащие между сайленсерами нуклеосомы. Показано, что между молекулами Rap1, ассоциированными с разными участками связывания in vitro, существуют непосредственные физические контакты. Это свидетельствует о том, что факторы, ассоциированные с сайленсерами Е и I, могут взаимодействовать друг с другом путем «выпетливания» лежащего между ними репрессированного домена. Такая модель легко объясняет наличие кооперативного эффекта этих сайленсеров на инициацию репрессии (Hofmann et al., 1989). Избыточность функции сайленсерных элементов является характерной чертой гетерохроматиновой репрессии и наблюдается также внутри самих сайленсеров. Факторы транскрипции общего назначения Rap1 и Abf1, а также ориджин-узнающий комплекс ORC, обеспечивающий посадку пререпликативного комплекса на ориджины репликации, функционально дублируют друг друга. Как показали эксперименты с делециями, сайтов связывания любых двух из этих факторов достаточно для сайленсинга (Brand et al., 1987), хотя сколько-нибудь существенного структурного сходства между Rap1, Abf1 и ORC не обнаружено. Их функциональная избыточность объясняется рекрутируемыми (вовлекаемыми) ими белками. Например, Rap1 рекрутирует белок Sir4 в области сайленсеров НМ и теломер, Abf1 взаимодействует с Sir3, а ORC имеет высокое сродство к Sir1, специфическому для репрессии локусов НМ фактору SIR (см. обзор Rusche et al., 2003). Сам Sir1 непосредственно взаимодействует с N-концом Sir4, образуя мостик между ORC и комплексом SIR2-3-4. Таким образом, разные связывающиеся с сайленсерами факторы приводят к рекрутированию Sir4, а затем и комплекса SIR2-3-4, необходимого для репрессии во всех случаях. Видимая избыточность между Rap1, Abf1 и ORC (в сайленсерах), а также гетеродимера Ки (в области теломер, см. ниже), может быть связана с их способностью инициировать репрессию с помощью прямых контактов с разными компонентами комплекса SIR. Следует заметить, что Sir1 участвует скорее в формировании гетерохроматиновой репрессии, чем ее поддержании. После установки репрессированного состояния участия Sir1 уже не требуется (Pillus and Rine, 1989). Его важная роль в установке репрессии была показана путем пришивки к нему ДНК-связывающего домена Gal4. При замещении сайленсера HMR-Е сайтами связывания Gal4 такой химерный GBD-Sir1 белок эффективно инициирует репрессию в отсутствии самого сайленсера и узнающего его фактора (Chien et al., 1993). Однако такая репрессия все равно требует участия остальных белков Sir и сохранности гистоновых хвостов. Следовательно одной из основных функций сайленсер-связывающих факторов является рекрутирование белка Sir1, который, в свою очередь, инициирует репрессию, рекрутируя другие Sir-белки во взаимодействия с близлежащими нуклеосомами. Это подтверждается и данными о том, что, в отличие от других Sir-белков, Sir1 не распространяется с комплексом SIR за пределы сайленсеров (рис. 4.5) (Rusche et al., 2002).5.2. Теломерный гетерохроматин
В области теломер РНК-содержащий фермент теломераза поддерживает простую, но не регулярную TG-богатую повторяющуюся последовательность длиной в 300-350 н.п. Она содержит 16—20 сайтов связывания белка Rap1. Этот набор Rap1-связывающих сайтов образует ненуклеосомный «колпачек» на конце хромосомы и играет критическую роль в поддержании длины теломеры (Marcand et al., 1997). По длине теломерных повторов Rap1 связывается центральным ДНК-связывающим доменом со своими сайтами узнавания и С-концевым доменом с Sir4. Последнее происходит даже в отсутствие других SIR-белков и N-концов гистона Н4. Поскольку дефекты Sir4 нарушают связывание других белков с теломерным хроматином (Luo et al.. 2002), он, по-видимому, служит главным звеном между этапами нуклеации и следующим за ней формированием репрессированной структуры хроматина (рис. 4.6). Связывающийся с концевыми участками ДНК комплекс yKu70/yKu80 помогает белку Rap1 рекрутировать Sir4 на концы хромосом. И действительно, утрата yKu резко уменьшает степень теломерной репрессии, а химерный белок GBD-yKu эффективно инициирует репрессию репортерных генов с поврежденными сайленсерными элементами. Необходимость yKu можно преодолеть элиминацией Rap1-связывающего фактора Rifl, конкурирующего с С-концевым доменом Rap1 за связывание с Sir4 (рис. 6) (Mishra and Shore, 1999). О кооперативных эффектах yKu и Rap1 в нуклеации гетерохроматина свидетельствует наблюдение, что 600-п.н. повторяющейся последовательности ДНК теломеры, содержащей более 30 сайтов связывания Rap1, недостаточно для нуклеации репрессии во внутренних локусах хромосом, хотя инсерпии 900-п.н. последователности, содержащей около 45 сайтов связывания Rap1, может быть достаточно (Stavenhagen and Zakian, 1994). Следует заметить, что в промоторах по всему геному дрожжей Rap1 служит транскрипционным фактором общего назначения. участвующим в активации многих генов, например, кодирующих белки рибосом. Почему в этих промоторах Rap1 рекрутирует факторы активации, а не нуклеации гетерохроматина, пока неизвестно.6. Деацетилирование гистонов белком Sir2 обеспечивает сайты связывания для распространения SIR-комплексов
Молекулярные взаимодействия белков SIR хорошо изучены. Белок Sir4 играет роль ключевого «скелетного» фактора для их сборки. Sir4 и Sir2 активно взаимодействуют in vitro. Sir4 также независимо взаимодействует с Sir3, в то время как Sir3 и Sir2 взаимодействуют слабо (Moazed et al., 1997; Strahl-Bolsinger et al., 1997; Hoppe et al., 2002). Sir3 и Sir4 образуют также и гомодимеры (Moretti et al., 1994). При коэкспрессии в клетках насекомых Sir2, Sir3 и Sir4 образуют стабильный 360-kD комплекс, содержащий эти SIR-белки в стехиометрическом соотношении 1: 1: 1 (Cubizolles et al.. 2006). С моделью функционального гетеротримерного комплекса SIR2-3-4 согласуются и результаты исследования распределения этих трех белков в гетерохроматиновых доменах с помощью метода иммунопреципитации хроматина. Оказалось, что их содержание в разных участках гетерохроматиновых доменов одинаково (Hecht et al., 1996; Strahl-Bolsinger et al., 1997). Тем не менее, вполне очевидно, что белок Sir3 играет особую роль в распределении гетерохроматина. При суперэкспрессии Sir3 наблюдается расширение «молчащего» домена, совпадающее с распространением самого Sir3 за свою обычную границу в положении ~3 т.п.н. до -15 т.п.н. (Renauld et al., 1993; Hecht etal., 1996). Несбалансированная экспрессия одиночных Sir2 и Sir4 или даже их субдоменов имеет прямо противоположный эффект в виде нарушения ТРЕ, хотя скоординированная эктопическая экспрессия Sir3 и Sir4 противодействует дисбалансу и восстанавливает сайленсинг (Maillet et al., 1996). Все это иллюстрирует важное значение дозы белков комплекса SIR для его репрессорной функции, аналогично ситуации с комплексами Polycomb у дрозофилы. Уникальная способность Sir3 распространяться вдоль доменов хроматина при суперэкспрессии коррелирует с наблюдением, что in vitro он образует стабильные мультимеры (Liou et al., 2005). Основа, по которой распространяется SIR-комплекс, представляет собой нуклеосомы с деацетилированными по N-концевым участкам гистонами H3 и Н4 (Braun-stein et al., 1996; Suka et al., 2001). Механизм распространения можно объяснить способом взаимодействия SIR-белков с гистонами (рис. 4.7). Белки Sir3 и Sir4 связываются с деацетилированными N-концами гистонов H3 и Н4 in vitro и in vivo (Hecht et al., 1995, 1996), причем участия хвостов H2A и Н2В для этого взаимодействия не требуется. Наиболее важная в этом отношении область гистонов — 16—29-й аминокислотные остатки гистона Н4, среди которых 16-й остаток лизина, в частности, должен быть деацетилирован (положительно заряжен) для связывания Sir3 (Johnson et al., 1990,1992). В отличие от мутаций по другим сайтам ацетилирования, даже консервативные мутации по остатку H4K16 полностью нарушают теломерный сайленсинг. Хвосты гистонов H3/Н4, и особенно область 16—24-го остатков Н4, способствуют компактизации нуклеосомных цепей in vitro, а деацетилирование H4K16 в этом случае, вероятно, регулирует наднуклеосомные уровни сворачивания нуклеосомной цепи. Как же регулируется само деацетилирование H4K16 in vivo? Рис. 4.7. Пограничные функции гетерохроматина у почкующихся дрожжей
Распространение гетерохроматина посредством деацетилирования белком Sir2 гистона Н4 по остатку К16 ограничивается конкурирующей активностью гистоновой ацетил-трансферазы Sas2, ацетилирующей H4K16 в прилегающем эухроматине, тем самым предотвращая связывание Sir3. Метилирование H3K79 в прилегающем эухроматине также влияет на распространение гетерохроматина. Пограничные функции могут иметь и такие факторы как Reb1, Tbf1 и белки млекопитающих и вирусов Ctf 1 и VP 16, прикрепление к ядерным порам и присутствие генов тРНК. Вполне возможно, что некоторые из них действуют, рекрутируя гистоновые ацетилтрансферазы
Рис. 4.7. Пограничные функции гетерохроматина у почкующихся дрожжей
Распространение гетерохроматина посредством деацетилирования белком Sir2 гистона Н4 по остатку К16 ограничивается конкурирующей активностью гистоновой ацетил-трансферазы Sas2, ацетилирующей H4K16 в прилегающем эухроматине, тем самым предотвращая связывание Sir3. Метилирование H3K79 в прилегающем эухроматине также влияет на распространение гетерохроматина. Пограничные функции могут иметь и такие факторы как Reb1, Tbf1 и белки млекопитающих и вирусов Ctf 1 и VP 16, прикрепление к ядерным порам и присутствие генов тРНК. Вполне возможно, что некоторые из них действуют, рекрутируя гистоновые ацетилтрансферазы
7. Sir2 деацетилирует гистон Н4 по 16-му остатку лизина
Sir2 является НАД-зависимой деацетилазой гистонов, активность которой возрастает при ассоциации с Sir4. Активность Sir2 сопрягает деацетилирование с превращением НАД в О-ацетил-АДФ-рибозу с использованием АДФ-рибозил-трансферазной активности (Tanneret al., 2000). Учитывая, что положительно заряженный остаток H4K16 играет ключевую роль в формировании гетерохроматина, удивительно, что Sir2 может деацетилировать его in vitro и in vivo, хотя он также деацетилирует другие остатки лизина в N-концевом участке Н4 и остатки К9 и К14 гистона H3 (Imai et al., 2000; Suka et al., 2002; Cubizolles et al., 2006). Все эти сайты-мишени расположены в доменах гистонов H3 и Н4, необходимых для сайленсинга. Интересно, что О-ацетил-АДФ-рибоза сама по себе способствует не только мультимеризации Sir3, но также и взаимодействию Sir3 и Sir4-Sir2 in vitro (Liou et al., 2005). В совокупности эти данные показывают, что деацетилирование гистонов белком Sir2 способствует формированию и мультимеризации Sir-комплекса, а также подготавливает деацетил ированные сайты на соседних нуклеосомах к связыванию с SIR-белками. Различные этапы инициации и распространения гетерохроматина в теломерных областях и локусах НМ показаны на рис. 4.6. В теломерах Rap1 и yKu рекрутируют Sir4, a Sir4 рекрутирует Sir2 для деацетилирования N-концевых доменов гистонов Н4 и H3. Sir4 также рекрутирует Sir3. Деацетилирование гистоновых хвостов приводит к образованию сайтов связывания Sir3/Sir4 и запускает процесс нуклеации комплексом SIR2-3-4. Взаимодействие Sir3 и Sir4 друг с другом и N-концами гистонов, как считается, стабилизируют SIR-комплексы на нуклеосомной фибрилле, что позволяет им распространяться по гистоновым хвостам. Наконец, репрессированное состояние может стабилизироваться свертыванием хромосомной фибриллы (обсуждается ниже). Большинство этих процессов очень сходным образом протекает в области локусов ЯМ, хотя исходное рекрутирование Sir4 опосредовано Rap1, Abf1, ORC и Sir1. Что же останавливает процесс распространения?8. Ацетилирование гистонов в эухроматине ограничивает распространение SIR-комплексов
Поскольку деацетилирование гистона Н4 по 16-му остатку лизина белком Sir2 критично для формирования гетерохроматина, не удивительно, что модификация этого сайта также играет ключевую роль в ограничении распространения гетерохроматина. Интересно, что из всех сайтов ацетилирования гистонов в моноацетилированных молекулах гистона Н4 в эухроматине модифицирован только H4K16 (Clarke et al., 1993). Одним из ферментов, участвующих в ацетилировании H4K16 в субтеломерных областях, у дрожжей является Sas2, член консервативного класса MYST гистоновых ацетилтрансфераз (HATs — his-tone acetyltransferases). При делениях Sas2, предотвращающих ацетилирование H4K16, и при мутациях H4K16 в аргинин, имитирующих деацетилированное состояние, SIR-комплекс распространяется на нижних уровнях в правой теломере VI хромосомы примерно в пять раз дальше, чем в клетках дикого типа. Это показывает, что распространение субтеломерного гетерохроматина контролируется, как минимум отчасти, противоположными активностями Sir2 и Sas2 в отношении H4K16 (рис. 4.7) (Kimura et al., 2002; Suka et al., 2002). В области локусов НМ ограничение распространения «молчащего» хроматина, возможно, еще более важно, чем в теломерных участках, поскольку по ходу соответствующего плеча III хромосомы расположены существенные для роста гены, а сайленсеры имеют бидирекциональную активность, то есть репрессируют соседние последовательности ДНК с обеих сторон. Одной из границ, предотвращающих дальнейшее распространение сайленсинга, в направлении теломеры от локуса HMR служит ген тРНК (Donze and Kamakaka, 2001). Его пограничная функция зависит от HAT активности и связана с его транскрипционным потенциалом. Существенно, что одной из таких HAT является Sas2, хотя и ацетилтрансфераза гистона H3, Gcn5 также способствует пограничной функции генов тРНК. Это позволяет предположить, что активаторы транскрипции в целом могут ограничивать распространение SIR-комплексов, рекрутируя гистоновые ацетилтрансферазы. И действительно, пограничные активности были обнаружены у факторов транскрипции Reb1 и Tbf1, фактора млекопитающих CTCF, а также кислого транс-активирующего домена вирусного фактора VP16 (Fourel et al., 1999, 2001). Каждый из них способствует гипер-ацетилированию гистонов и тем самым препятствует распространению SIR-комплексов, ослабляя их связь с нуклеосомами (рис. 4.7). Наконец, было показано, что ограничению распространения «молчащих» доменов хроматина, помимо вышеописанного механизма, способствуют присутствие в эухроматине гистона H2A.Z и ассоциированного с РНК-полимеразой фактора Bdfl (Meneghini et al., 2003), метилирование гистона H3 по 79-му остатку лизина (van Leeuwen et al., 2002) и присоединение ДНК к ядерным порам (Ishii et al., 2002). И хотя механизмы действия этих факторов неизвестны, интересно отметить, что некоторые активные гены ассоциированы с ядерными порами (Ishii et al., 2002; Brickner and Walter, 2004). Итак, обшей чертой пограничных факторов у дрожжей может быть сильная стимулирующая транскрипцию или ремоделирующая нуклеосомы активность, которая прямо или опосредовано нарушает взаимодействие гистонов с белками гетерохроматина9. Образование теломерных петель
Существует ряд данных, свидетельствующих о возможности образования петель по концам хромосом, в результате которого теломеры могут преодолевать пограничные элементы и стабилизировать репрессивную структуру хроматина в субтеломерных генах (рис. 4.5,4.6). Например, несмотря на то, что сайты связывания Rap1 присутствуют только в пределах первых 300 н.п. повторяющихся TG-богатых последовательностей ДНК на концах теломер, с помощью иммунопреципитации хроматина обнаружено присутствие Rap1 в нуклеосомах на расстоянии до ~3 т.п.н. от TG-повторов (Strahl-Bolsinger et al., 1997). Аналогично, yKu обнаружен на расстоянии ~3 т.п.н. от нормальных сайтов своего связывания на конце хромосомы (Martin et al., 1999). Более того, при нарушении сайленсинга мутациями генов SIR происходит потеря Rap1 и yKu во внутренних последовательностях при их полной сохранности в области концевых TG-повторов (Martin et al., 1999). Для объяснения распространения содержащего белки Rap1 и yKu гетерохроматина на расстояние около 3 т.п.н. даже в препаратах хроматина фрагментированного на куски <500 н.п. была предложена модель петлеобразования по концам хромосомы, в которой связанные с TG-повторами молекулы Rap1 и yKu взаимодействуют с SIR-белками более внутренних областей in trans (рис. 4.5, 4.6). Такая структура, возможно, участвует в реализации «кэпирующей» функции связанных с теломерой белков. Результаты в пользу модели петлеобразования теломер были получены в работе де Брюна и соавторов (de Bruin et al., 2001), которые использовали неспособность таких активаторов транскрипции как Gal4 осуществлять свою функцию, когда они находятся ниже активируемого гена. Были сконструированы штаммы, в которых верхняя активирующая последовательность (upstream activating sequence — UAS) Gal4 помещалась ниже гена-репортера, и вся рекомбинантная конструкция вставлялась во внутренние локусы хромосом или вблизи теломеры. Оказалось, что во внутренних локусах эта конструкция не способна к галактозо-индуцибельной транскрипции, а в субтеломерных участках Gal4 UAS элемент может активировать промотор, расположенный в 1.9 т.п.н. выше, Sir3-зависимым механизмом. Вероятно, в присутствии Sir3 теломерный конец образует обратную петлю, позиционирующую Gal4 UAS в непосредственной близости от промотора активируемого гена (de Bruin et al., 2001).10. Нарушение непрерывности репрессии естественных субтеломерных элементов теломерными петлями
Выше мы нарисовали упрощенную картину образования непрерывных участков «молчащего» хроматина, начинающихся с теломерных сайтов связывания белка Rap1. В действительности в природных теломерах все происходит более сложным образом в значительной степени из-за наличия пограничных элементов в области субтеломерных повторяющихся последовательностей. В большинстве экспериментов по включению в эту область репортерных конструкций для изучения теломерной репрессии субтеломерные повторяющиеся элементы X и Y’ удаляют. В результате репортерный ген оказывается непосредственно по соседству с TG-повторами. С другой стороны, все природные теломеры содержат субтеломерный повторяющийся элемент X, расположенный между TG-повторами и самым близким к теломере геном. Около 50—70% природных теломер содержат также не менее одной копии более длинного субтеломерного элемента У’ (рис. 4.8). И X, и У’ элементы содержат сайты связывания регуляторов транскрипции Tbf1 и Reb1, ограничивающие распространение «молчащего» хроматина (Fourel et al., 1999). Однако, X элементы содержат также каноническую последовательность ORC и сайты связывания Abf1, действующие противоположным образом. Они реинициируют или усиливают репрессию репортерных генов, находящихся с внутренней от них стороны. В результате сайленсинг в природных теломерах приобретает прерывистый характер, что отличает его от модели непрерывного распространения, изображенной на рис. 4.6. Для объяснения такого несовпадения Прайд и Луис (Pryde and Louis, 1999) также предложили модель петлеобразования в области теломеры, в которой область не репрессированного хроматина оказывается между двумя репрессированными доменами. Тем самым прерывистый характер «молчащих» доменов объяснялся без отказа от представлений о нуклеации и распространения гетерохроматина от TG-повторов.11. Взаимодействие теломер in trans и перинуклеарное прикрепление гетерохроматина
Одной из наиболее консервативных черт гетерохроматина является его локализация в дискретных ядерных субкомпартментах. Это верно и для почкующихся дрожжей, у которых теломеры во время интерфазы образуют кластеры и остаются тесно ассоциированными с ядерной периферией. Такие кластеры были впервые обнаружены методом иммунно-окрашивания как фокусы локализации белков Rap1 и SIR на фоне их диффузного распределения по всему ядру (рис. 4.9). Подавление сайленсинга мутациями по остатку H4K16 или нарушениями в активности белков Rap1 и yKu сопровождается диспергированием белков SIR из этих кластеров (Hecht et al., 1995; Laroche et al., 1998). Позже было показано, что с ядерной оболочкой связаны не только теломеры, но и локусы HML и HMR Эта связь осуществляется несколькими дублирующими друг друга механизмами, зависящими либо от ассоциированного с тедомерой фактора yKu, либо от формирования «молчащего» хроматина как такового (Hediger et al., 2002). В «молчащем» хроматине функция прикрепления к ядерной оболочке приписывается субдомену белка Sir4, который связывается с белком ядерной оболочки Esc1 (enhances silent chromatin 1; Taddei et al., 2004). Взаимодействия Sir4-Esc1 прикрепляют SIR-репрессированные домены хроматина к участкам ядерной оболочки, отличным от ядерных пор. Даже в отсутствии прикрепления с помощью yKu-механизма ассоциация теломер с ядерной мембраной может поддерживаться посредством комплекса Sir4-Esc1 до тех пор, пока сохраняется сама репрессия. Более того, участки репрессированного хроматина, отделившиеся от теломер в результате рекомбинации, сохраняют SIR-зависимую ассоциацию с ядерной оболочкой (Gartenberg et al., 2004). Рис. 4.8. Организация природных теломер и характер их сайленсинга
Показаны субтеломерные элементы и содержащиеся в них сайты связывания белков. Теломеры деляться на два основных класса: с Х-содержащими и Х+Y’-содержащими концами. Элементы STAR и STR подавляют распространение репрессии и оставляют область сниженной репрессии внутри Y’- и Х-элементов. Этого не наблюдается в искусственно укороченных теломерах, в которых присутствует градиент репрессии, распространяющийся на 3—4 т.п.н. от TG-повторов. Предполагается что природные теломеры образуют петли, аналогичные изображенным на рис. 4.6, в результате чего репрессированные области контактируют друг с другом, а не репрессированные остаются между областями контакта, (адаптировано из работы Pryde and Louis, 1999)
Рис. 4.8. Организация природных теломер и характер их сайленсинга
Показаны субтеломерные элементы и содержащиеся в них сайты связывания белков. Теломеры деляться на два основных класса: с Х-содержащими и Х+Y’-содержащими концами. Элементы STAR и STR подавляют распространение репрессии и оставляют область сниженной репрессии внутри Y’- и Х-элементов. Этого не наблюдается в искусственно укороченных теломерах, в которых присутствует градиент репрессии, распространяющийся на 3—4 т.п.н. от TG-повторов. Предполагается что природные теломеры образуют петли, аналогичные изображенным на рис. 4.6, в результате чего репрессированные области контактируют друг с другом, а не репрессированные остаются между областями контакта, (адаптировано из работы Pryde and Louis, 1999)
 Рис. 4.9. SIR-белки и Rap1 образуют кластеры по периферии ядра
На панели а, Rap1 (зеленый) указывает на семь кластеров, представляющих все 64 теломеры данной диплоидной клетки Они расположены либо по периферии ядра, либо по соседству с ядрышком (голубое, помечено антителами к Nop1). ДНК помечена красным красителем. На панели б теломерная ДНК (красная) идентифицирована с помощью флюоресцентной гибридизации in situ (FISH), а HML помечен зеленым красителем. Они имеют одинаковую локализацию примерно в 70% случаев и находятся рядом с ядерной оболочкой (синяя) (Heun et al. 2001). Панель в показывает фокальное распределение Sir4 (зеленый) рядом с ядерной оболочкой (помечена МаЬ414, красная). Такой характер распределения утрачивается в штамме с делецией yKu 70, что совпадает с утратой теломерного сайленсинга (Laroche et al. 1998)
Рис. 4.9. SIR-белки и Rap1 образуют кластеры по периферии ядра
На панели а, Rap1 (зеленый) указывает на семь кластеров, представляющих все 64 теломеры данной диплоидной клетки Они расположены либо по периферии ядра, либо по соседству с ядрышком (голубое, помечено антителами к Nop1). ДНК помечена красным красителем. На панели б теломерная ДНК (красная) идентифицирована с помощью флюоресцентной гибридизации in situ (FISH), а HML помечен зеленым красителем. Они имеют одинаковую локализацию примерно в 70% случаев и находятся рядом с ядерной оболочкой (синяя) (Heun et al. 2001). Панель в показывает фокальное распределение Sir4 (зеленый) рядом с ядерной оболочкой (помечена МаЬ414, красная). Такой характер распределения утрачивается в штамме с делецией yKu 70, что совпадает с утратой теломерного сайленсинга (Laroche et al. 1998)
Исходно прикрепление теломер к ядерной оболочке, вероятно, происходит посредством yKu-зависимого пути, поскольку он работает даже в отсутствии сайленсинга. Благодаря этому прикреплению и взаимодействию между теломерами in trans происходит формирование ядерного субкомпартмента, который в свою очередь связывает SIR-белки (рис. 4.10). Этот компартмент имеет ключевое значение для образования градиента сайленсинга в области теломер. Даже фланкированные сайленсерами конструкты локуса НМ более эффективно репрессируются, когда интегрируются вблизи теломер (Thompson et al., 1994; Maillet et al., 1996) или когда они искусственно прикрепляются к ядерной оболочке трансмембранным фактором (Andrulis et al., 1998). Существенно, что способность усиливать репрессию за счет близости к теломерам утрачивается, когда Sir3 и Sir4 перестают захватываться кластерами или суперэкспрессируются (Maillet et al., 1996; Marcand et al., 1996). Это показывает, что градиент концентрации SIR-белков является той самой характеристикой теломерных кластеров, которая важна для усиления репрессии. Наконец, предполагается, что захват репрессоров общего назначения, присутствующих в лимитирующих концентрациях, помогает клетке обеспечить эпигенетическое наследование молчащего состояния, как показано на рис. 4.10. Вкратце, предложенная модель предполагает, что сборке вновь реплицированной ДНК в гетерохроматиновую структуру способствует ее локализация в субкомпартменте, обогащенном факторами сайленсинга.
12. Наследование эпигенетических состояний
Универсальной характеристикой гетерохроматина является передача «молчащего» состояния по наследству. Это означает, что формирование гетерохроматина на дочерних цепях происходит вскоре после репликации. Пионерское исследование вопроса о наследовании состояний хроматина в клеточном цикле принадлежит Миллеру и Насмиту (Miller and Nasmyth, 1984), изучавшим возникновение и потерю сайленсинга на термочувствительных мутантах sir3. Изменение температуры с пермиссивной на непермиссивную приводил к немедленной утрате сайленсинга, что доказывает необходимость продукта гена Sir3 для поддержания репрессированного состояния. Однако в обратных экспериментах при переходе от непермиссивной температуре к пермиссивной немедленного восстановления репрессии не происходило: требовалось прохождение клеточного цикла. Авторы сделали вывод, что для установления наследуемого репрессированного состояния хроматина требуется некое событие в S-фазе клеточного цикла. Позднее было показано, что в действительности требуются события, происходящие в фазах S и G2/M (Lau et al., 2002). Рис. 4.10. Спонтанное формирование субкомпартментов сайленсинга
Показана простая модель формирования субъядерных компартментов. (1) Сначала происходит рекрутирование Sir4 в центры нуклеации ДНК-связывающими белками, способными связывать Sir4. В их число входят Rap1, ORC, Abf1 и yKu. (2) Присутствие Sir4 в определенном локусе в свою очередь приводит к его перемещению на ядерную периферию посредством одного из двух Sir4-зависимых путей (yKu или Esc1). (3) Высокая локальная концентрация SIR у ядерной оболочки способствует сборке и распространению комплексов сайленсинга. (4) Способность «молчащих» локусов оставаться связанными с периферией повышает локальную концентрацию SIR-белков и усиливает сайленсинг других локусов в этой области. Важно, что связанный с теломерами yKu может независимо рекрутировать теломеры к ядерной оболочке также, как Sir4 рекурутирует сайленсерные последовательности
Рис. 4.10. Спонтанное формирование субкомпартментов сайленсинга
Показана простая модель формирования субъядерных компартментов. (1) Сначала происходит рекрутирование Sir4 в центры нуклеации ДНК-связывающими белками, способными связывать Sir4. В их число входят Rap1, ORC, Abf1 и yKu. (2) Присутствие Sir4 в определенном локусе в свою очередь приводит к его перемещению на ядерную периферию посредством одного из двух Sir4-зависимых путей (yKu или Esc1). (3) Высокая локальная концентрация SIR у ядерной оболочки способствует сборке и распространению комплексов сайленсинга. (4) Способность «молчащих» локусов оставаться связанными с периферией повышает локальную концентрацию SIR-белков и усиливает сайленсинг других локусов в этой области. Важно, что связанный с теломерами yKu может независимо рекрутировать теломеры к ядерной оболочке также, как Sir4 рекурутирует сайленсерные последовательности
Вначале предполагалось, что для установления и наследования «молчащего» хроматина существенно использование ориджинов репликации из связанных с сайленсерами ARS элементов. Однако, на ориджинах локуса HML инициации репликации не наблюдалось, поэтому это объяснение сочли маловероятным. И действительно, в экспериментах по замене ORC химерным белкос GDB-Sir1 было окончательно доказано, что срабатывание ориджинов репликации не имеет существенного значения для наследования «молчащего» хроматина. С другой стороны, исследования в нескольких направлениях показывали, что прохождение через S-фазу необходимо для формирования гетерохроматина. Это широко трактовалось как необходимость в репликации ДНК и связанной с нею пересборке нуклеосомной структуры. Однако недавние эксперименты показали, что установка репрессированного состояния может происходить и в отсутствие репликации ДНК (Kirchmaier and Rine, 2001; Li et al., 2001). Следовательно, искомыми факторами, необходимыми для формирования репрессированного хроматина, могут быть какие-то белки, специфически активируемые во время поздней S-фазы или играющие специфическую роль на границе S-G2 фаз. Таковыми могут быть вновь синтезируемые гистоны или модифицирующие их ферменты. Также среди них могут быть шапероны, такие как CAF1 (chromatin assembly factor 1), обеспечивающие критические этапы сборки гистонов. Другие исследования показали, что устойчивый сайленсинг достигается не ранее телофазы, то есть существенно позже периода сборки нуклеосом в S-фазе. По-видимому, субъединица когезина Seel ингибирует стабильную репрессию до тех пор, пока не разрушается на границе метафазы и анафазы (Lau et al., 2002). Это согласуется с данными о том, что факторы транскрипции могут успешно нарушать или противодействовать установке «молчащего» хроматина в G2/М-фазе, но не после того, как клетки прошли М-фазу и вступили в G1-фазу (Aparicio and Gottschling, 1994). В совокупности эти данные показывают, что помимо какого-то критического компонента или события в S-фазе, необходим дополнительный этап, включающий прохождение митоза и прямо или опосредованно зависящий от утраты сцепления между сестринскими хроматидами.
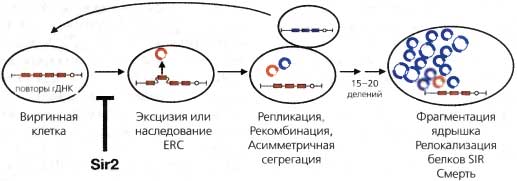 Рис. 4.11. Рекомбинация рДНК приводит к старению клеток у дрожжей
рДНК организована в массив из 140—200 прямых повторов 9.1-т.п.н. единицы {красный блок). Они кодируют 18S, 5.8S, 25S и 5S рРНК и содержат два Sir2-чувствительных элемента ниже гена 5S и внутри гена 18S. рДНК повторы имеют склонность вырезаться в стареющих клетках дрожжей и накапливаться в материнских клетках в виде кольцевых молекул (Kaeberlein et al., 1999). Это явление коррелирует с преждевременным старением. Sir2 препятствует ему, подавляя процессы неравной рекомбинации и вырезания
Рис. 4.11. Рекомбинация рДНК приводит к старению клеток у дрожжей
рДНК организована в массив из 140—200 прямых повторов 9.1-т.п.н. единицы {красный блок). Они кодируют 18S, 5.8S, 25S и 5S рРНК и содержат два Sir2-чувствительных элемента ниже гена 5S и внутри гена 18S. рДНК повторы имеют склонность вырезаться в стареющих клетках дрожжей и накапливаться в материнских клетках в виде кольцевых молекул (Kaeberlein et al., 1999). Это явление коррелирует с преждевременным старением. Sir2 препятствует ему, подавляя процессы неравной рекомбинации и вырезания
Накопление вырезанных колец рДНК не было обнаружено у каких-либо других видов. Однако для Caenorhabditis elegans и грызунов предполагалось, что уменьшение продолжителности жизни связано с другими видами нестабильности генома. Аналогично эффекту потери Sir2, приводящей к неравным обменам между сестринскими хроматидами, у дрожжей, возможно, что нарушения теломерного гетерохроматина у млекопитающих приводят к слиянию хромосом «конец-в-конец», тем самым нарушая способность клеток к делениям. И хотя пока неизвестно, влияет ли на эти механизмы белок Sir2 у млекопитающих, тем не менее роль геномной нестабильности как общего фактора старения весьма вероятна, как и специфическая роль нарушений в структуре гетерохроматина.
14. Резюме
С помощью генетических, биохимических и цитологических методов при исследовании почкующихся дрожжей были установлены фундаментальные принципы репрессии (сайленсинга) генов при формировании гетерохроматина. Они включают механизмы инициации, распространения и ограничения распространения гетерохроматина, баланс факторов гетерохроматина и их распределение на уровне субъядерного пространства, образование петель гетерохроматина и роль клеточного цикла в его формировании. Более того, разрабатываются системы реконструкции гетерохроматина дрожжей in vitro. Эти исследования in vivo и in vitro представляют надежную механистическую основу для нашего понимания принципов формирования гетерохроматина из хроматиновых фибрилл у всех эукариот.Литература
Andrulis E.D., Neiman A.M., Zappulla D.C., and Stemglanz R. 1998 Perinuclear localization of chromatin facilitates transcriptional silencing. Nature 394: 592-595. Aparicio O.M. and Gottschling D.E. 1994. Overcoming telomeric silencing: A trans-activator competes to establish gene expression in a cell cycle-dependent way. Genes Dev. 8: 1133-1146. Aparicio O.M., Billington B.L., and Gottschling D.E. 1991. Modifiers of position effect are shared between telomeric and silent mating-type loci in S. cerevisiae. Cell 66: 1279-1287. Boscheron C., Maillet L., Marcand S., Tsai-Pflugfelder M., Gasser S.M., and Gilson E. 1996. Cooperation at a distance between silencers and proto-silencers at the yeast HML locus. EMBO J. 15: 2184-2195. Brand A.H., Micklem G., and Nasmyth K. 1987. Ayeast silencer contains sequences that can promote autonomous plasmid replication and transcriptional activation. Cell 51: 709-719. Braunstein M., Sobel R.E., Allis CD., Turner B.M., and Broach J.R. 1996. Efficient transcriptional silencing in Saccharomyces cerevisiae requires a heterochromatin histone acetylation pattern. Mol. Cell. Biol. 16: 4349-4356. Brickner J.H. and Walter P. 2004. Gene recruitment of the activated INOl locus to the nuclear membrane. PLoS Biol. 2: e342. Chen L. and Widom J. 2005. Mechanism of transcriptional silencing in yeast. Cell 120: 37-48. Cheng T.H. and Gartenberg M.R. 2000. Yeast heterochromatin is a dynamic structure that requires silencers continuously Genes Dev. 14: 452-463. Chien C.T., Buck S., Stemglanz R., and Shore D. 1993. Targeting of SIR1 protein establishes transcriptional silencing at HM loci and telomeres in yeast. Cell 75: 531-541 Chopra V.S. and Mishra R.K. 2005. To SIR with Polycomb: Linking silencing mechanisms. Bioessays 27: 119-121. Clarke D.J., O’Neill L.P., and Turner B.M. 1993. Selective use of H4 acetylation sites in the yeast S. cerevisiae. Biochem. J. 294: 557-561. Cubizolles E, Martino E, Perrod S., and Gasser S.M. 2006. A homotrimer-heterotrimer switch in Sir2 stmcture differentiates rDNA and telomeric silencing. Mol. Cell 21: 825-836. de Bruin D., Zaman Z., Liberatore R.A., and Ptashne M. 2001. Telomere looping permits gene activation by a downstream UAS in yeast. Nature 409: 109-113. Defossez P.A., Pmsty R., Kaeberlein M., Lin S.J., Ferrigno P., Silver P.A., Keil R.L., and Guarente L. 1999. Elimination of replication block protein Fobl extends the life span of yeast mother cells. Mol. Cell 3: 447-455. Donze D. and Kamakaka R.T. 2001. RNA polymerase III and RNA polymerase II promoter complexes are heterochromatin barriers in S. cerevisiae. EMBO J. 20: 520-531. Fourel G., Revardel E., Koering C.E., and Gilson E. 1999. Cohabitation of insulators and silencing elements in yeast subtelomeric regions. EMBO J. 18: 2522-2537. Fourel G., Boscheron C., Revardel E., Lebrun E., Hu Y.E, Simmen K.C, Muller K., Li R., Mermod N.. and Gilson E. 2001. An activation-independent role of transcription factors in insulator function. EMBO Rep. 2: 124-132. Fritze C.E., Verschueren K., Stnch R., and Easton Esposito R. 1997. Direct evidence for SIR2 modulation of chromatin stmcture in yeast rDNA. EMBO J. 16: 6495-6509. Frye R.A. 2000. Phylogenetic classification of prokaryotic and eukaryotic Sir2-like proteins. Biochem. Biophys. Res. Comm. 273: 793-798. Gartenberg M.R., Neumann F.R., Laroche T., Baszczyk M., and Gasser S.M. 2004. Sir-mediated repression can occur independently of chromosomal and subnuclear contexts. Cell 119: 955-967. Gotta M., Strahf-Bofsinger S., Renaufd H., Laroche T, Kennedy B.K., Gmnstein M., and Gasser S.M. 1997. Localization of Sir2p: The nucleolus as a compartment for silent information regulators. EMBO J. 16: 3243-5503. Gottlieb S. and Esposito R.E. 1989. A new role for a yeast transcriptional silencer gene, SIR2, in regulation of recombination in ribosomal DNA. Cell 56: 771-776. Gottschling D.E. 1992. Telomere-proximal DNA in Saccharomyces cerevisiae is refractory to methyltransferase activity in vivo. Proc. Natl. Acad. Sci. 89: 4062-4065. Gottschling D.E., Aparicio O.M., Billington B.L., and Zakian V.A. 1990. Position effect at S. cerevisiae telomeres: Reversible repression of PolII transcription. Cell 63: 751-762. Hecht A., Strahl-Bolsinger S., and Gmnstein M. 1996. Spreading of transcriptional repressor SIR3 from telomeric heterochromatin. Nature 383: 92-96. Hecht A., Laroche T., Strahl-Bolsinger S., Gasser S.M., and Gmnstein M. 1995. Histone H3 and H4 N-termini interact with SIR3 and SIR4 proteins: A molecular model for the formation of heterochromatin in yeast. Cell 80: 583-592. Hediger E, Neumann F.R., Van Houwe G., Dubrana K., and Gasser S.M. 2002. Live imaging of telomeres: yKu and Sir proteins define redundant telomere-anchoring pathways in yeast. Curr. Biol. 12: 2076-2089. Heun P., Laroche T, Raghuraman M.K., and Gasser S.M. 2001. The positioning and dynamics of origins of replication in the budding yeast nucleus./. Cell Biol. 152: 385-400. Hoppe G.J., Tanny J.C., Rudner A.D., Gerber S.A., Danaie S., Gygi S.P., and Moazed D. 2002. Steps in assembly of silent chromatin in yeast: Sir3-independent binding of a Sir2/Sir4 complex to silencers and role for Sir2-dependent deacetylation. Mol. Cell. Biol. 12: 4167-4180. Imai S.I., Armstrong C, Kaeberlein M., and Guarente L. 2000. Transcriptional silencing and longevity protein Sir2 is an NAD-dependent histone deacetylase. Nature 403: 795-800. Ishii K., Arib G., Lin C, Van Houwe G., and Laemmli U.K. 2002. Chromatin boundaries in budding yeast: The nuclear pore connection. Cell 109: 551-562. Johnson L.M., Fisher-Adams G., and Gmnstein M. 1992. Identification of a non-basic domain in the histone H4 N-terminus required for repression of the yeast silent mating loci. EMBO J. 11: 2201-2209. Johnson L.M., Kayne P.S., Kahn E.S., and Gmnstein M. 1990. Genetic evidence for an interaction between SIR3 and histone H4 in the repression of the silent mating loci in S. cerevisiae. Proc. Natl. Acad. Sci. 87: 6286-6290. Kaeberlein M., McVey M., and Guarente L. 1999. The SIR2/3/4 complex and SIR2 alone promote longevity in S. cerevisiae by two different mechanisms. Genes Dev. 13: 2570-2580. Kaeberlein M., Kirkland K.T., Fields S., and Kennedy B.K. 2004. Sir2-independent life span extension by calone restriction in yeast. PLoS Biol. 2: 296-307. Kayne P.S., Kim U.J., Han M., Mullen J.R., Yoshizaki F., and Gmnstein M. 1988. Extremely conserved histone H4 N terminus is dispensable for growth but essential for repressing the silent mating loci in yeast. Cell 55: 27-39. Kimura A., Umehara T., and Horikoshi M. 2002. Chromosomal gradient of histone acetylation established by Sas2p and Sir2p functions as a shield against gene silencing. Nat. Genet. 3: 370-377. Kirchmaier A.L. and Rine J. 2001. DNA replication-independent silencing in S. cerevisiae. Science 291: 646-650. Kobayashi X, Horiuchi T., Tongaonkar R, Vu L., and Nomura M. 2004. Sir2 regulates recombination between different rDNA repeats, but not recombination within individual rRNA genes in yeast. Cell 117: 441-453. Laroche T., Martin S.G., Gotta M., Gorham H.C., Pryde RE., Louis E.J., and Gasser S.M. 1998. Mutation of yeast Ku genes disrupts the subnuclear organization of telomeres. Curr. Biol. 8: 653-656. Lau A., Blitzblau H., and Bell S.P. 2002. Cell-cycle control of the establishment of mating-type silencing in S. cerevisiae. Genes Dev. 16: 2935-2945. Li Y.C., Cheng T.H., and Gartenberg M.R. 2001. Establishment of transcriptional silencing in the absence of DNA replication. Science 291: 650-653. Liou G.G., Tanny J.C., Kruger R.G., Walz T., and Moazed D. 2005. Assembly of the SIR complex and its regulation by O-acetyl-ADP-ribose, a product of NAD-dependent histone deacetylation. Cell 121: 515-527. Loo S. and Rine J. 1994. Silencers and domains of generalized repression. Science 264: 1768-1771. Luo K., Vega-Palas M.A., and Grunstein M. 2002. Rap1-Sir4 binding independent of other Sir, yKu, or histone interactions initiates the assembly of telomeric heterochromatin in yeast. Genes Dev. 12: 1528-1539. Maillet L., Boscheron C, Gotta M., Marcand S., Gilson E., and Gasser S.M. 1996. Evidence for silencing compartments within the yeast nucleus: A role for telomere proximity and Sir protein concentration in silencer-mediated repression. Genes Dev. 10: 1796-1811. Marcand S., Gilson E., and Shore D. 1997. A protein-counting mechanism for telomere length regulation in yeast. Science 275: 986-990. Marcand S., Buck S.W., Moretti P., Gilson E., and Shore D. 1996. Silencing of genes at nontelomeric sites in yeast is controlled by sequestration of silencing factors at telomeres by Rap1 protein. Genes Dev. 10: 1297-1309. Martin S.G., Laroche T., Suka N, Grunstein M., and Gasser S.M. 1999. Relocalization of telomeric Ku and SIR proteins in response to DNA strand breaks in yeast. Cell 97: 621-633. Meneghini M.D., Wu M., and Madhani H.D. 2003. Conserved histone variant H2A.Z protects euchromatin from the ectopic spread of silent heterochromatin. Cell 112: 725-736. Miller A.M. and Nasmyth K.A. 1984. Role of DNA replication in the repression of silent mating type loci in yeast. Nature 312: 247-251. Mishra K. and Shore D. 1999. Yeast Ku protein plays a direct role in telomeric silencing and counteracts inhibition by Rif proteins. Curr. Biol. 9: 1123-1126. Moazed D., Kistler A., Axelrod A., Rine J., and Johnson A.D. 1997. Silent information regulator protein complexes in S. cerevisiae: A S1R2/SIR4 complex and evidence for a regulatory domain in SIR4 that inhibits its interaction with SIR3. Proc. Natl. Acad. Sci. 94: 2186-2191 Moretti P, Freeman K., Coodly L., and Shore D. 1994. Evidence that a complex of SIR proteins interacts with the silencer and telomere-binding protein RAPl. Genes Dev. 8: 2257-2269. Palladino E, Laroche X, Gilson E., Axelrod A., Pillus L., and Gasser S.M. 1993. SIR3 and SIR4 proteins are required forthe positioning and integnty of yeast telomeres. Cell 75: 542-555. Pillus L. and Rine J. 1989. Epigenetic inheritance of transcriptional states in S. cerevisiae. Cell 59: 637-647. Pryde F.E. and Louis E.J. 1999. Limitations of silencing at native yeast telomeres. EMBO J. 18: 2538-2550. Renauld H., Aparicio O.M., Zierath P.D., Billington B.L., Chhablani S.K., and Gottschling D.E. 1993. Silent domains are assembled continuously from the telomere and are defined by promoter distance and strength, and by SIR3 dosage. Genes Dev. 7: 1133-1145. Rusche L.N., Kirchmaier A. L., and Rine J. 2002. Ordered nucleation and spreading of silenced chromatin in Saccharomyces cerevisiae. Mol. Biol. Cell 7: 2207-2222. -------- , 2003. The establishment, inheritance, and function of silenced chromatin in Saccharomyces cerevisiae. Annu. Rev. Biochem. 72: 481-516. Sekinger E.A. and Gross D.S. 1999. SIR repression of a yeast heat shock gene: UAS and TATA footprints persist within heterochromatin. EMBO J. 18: 7041-7055. Sinclair D.A. and Guarente L. 1997. Extrachromosomal rDNA circles—A cause of aging in yeast. Cell 91: 1033-1042. Stavenhagen J.B. and Zakian V.A. 1994. Internal tracts of telomeric DNA act as silencers in Saccharomyces cerevisiae. Genes Dev. 8: 1411-1422. Strahl-Bolsinger S., Hecht A., Luo K., and Grunstein M. 1997. SIR2 and SIR4 interactions differ in core and extended telomeric heterochromatin in yeast. Genes Dev. 11: 83-93. Suka N., Luo K., and Grunstein M. 2002. Sir2p and Sas2p opposingly regulate acetylation of yeast histone H4 lysine 16 and spreading of heterochromatin. Nat. Genet. 3: 378-383. Suka N., Suka Y., Carmen A.A., Wu J., and Grunstein M. 2001. Highly specific antibodies determine histone acetylation site usage in yeast heterochromatin and euchromatin. Mol. Cell 8: 473-479. Taddei A., Hediger E, Neumann F.R., Bauer C, and Gasser S.M. 2004. Separation of silencing from perinuclear anchoring functions in yeast Ku80 Sir4 and Esc1 proteins. EMBO J. 23: 1301-1312. Tanner K.G., Landry J., Stemglanz R., and Denu J.M. 2000. Silent information regulator 2 family of NAD-dependent histone/ protein deacetylases generates a unique product, 1-O-acetyl-ADP-ribose. Proc. Natl Acad. Set. 97: 14178-14182. Thompson J.S., Johnson L.M., and Gmnstein M. 1994. Specific repression of the yeast silent mating locus HMR by an adjacent telomere. Mol. Cell. Biol. 14: 446-455. van Leeuwen R, Gafken PR., and Gottschling D.E. 2002. Dotlp modulates silencing in yeast by methylation of the nucleosome core. Cell 109: 745-756. Weiss K. and Simpson R.T. 1998. High-resolution stmctural analysis of chromatin at specific loci: S. cerevisiae silent mating type locus HMLa. Mol Cell. Biol. 18: 5392-5403.Глава 5. Эффект положения мозаичного типа, формирование гетерохроматина и сайленсинг генов у Drosophila
 Sarah C.R. Elgin1 и Gunter Reuter2
1Department of Bilogy, Washington University, St. Louis, Missouri 63130
2Institute of Genetics, Biologicum, Martin Luther University Halle, D-06120 Halle, Germany
Sarah C.R. Elgin1 и Gunter Reuter2
1Department of Bilogy, Washington University, St. Louis, Missouri 63130
2Institute of Genetics, Biologicum, Martin Luther University Halle, D-06120 Halle, Germany
Общее резюме
Гены, оказавшиеся в ненормальном соседстве с гетерохроматином в результате либо перестройки, либо транспозиции [transposition], обнаруживают мозаичный фенотип, показывая тем самым, что данный ген оказался сайленсированным в некоторых клетках, в которых в норме он активен (эффект положения мозаичного типа — PEV, position-effect variegation). Сайленсинг, происходящий при PEV, можно приписать упаковке репортерного гена в гетерохроматиновой форме; это показывает, что формирование гетерохроматина, будучи однажды инициировано, может распространяться и охватывать близлежащие гены. На Drosophila melanogaster возможен генетический, цитологический и биохимический анализ, и в этой главе мы показываем, как эти разные подходы в совокупности помогли идентифицировать многих потенциальных участников этой системы, позволив в результате охарактеризовать несколько белков, играющих ключевую роль в установлении и поддержании гетерохроматина. Формирование гетерохроматина решающим образом зависит от метилирования гистона H3 по лизину 9, с сопутствующей ассоциацией Белка Гетерохроматина 1 (НР1 — Heterochromatin Protein 1) и других взаимодействующих белков, в том числе H3K9-метилтрансфераз; множественные взаимодействия этих белков необходимы для поддержания и распространения гетерохроматина. «Нацеливание» на гетерохроматин, в том числе накопление H3K9ше, происходит, по-видимому, с участием машинерии РНК-интерференции (RNAi), хотя играют роль и специфические ДНК-белковые взаимодействия. Хотя гетерохроматиновые районы (перицентромерные районы, теломеры и маленькая четвертая хромосома) обладают общей биохимией, каждый из них отличается от других, а перицентромерные районы мозаичны. Гетерохроматин у Drosophila беден генами, но не лишен их вовсе, и гены, находящиеся в гетерохроматине, зависят в своей экспрессии от этой среды. Окончательная модель формирования и поддержания гетерохроматина (включая «нацеливание» и распространение) должна будет принять в расчет различные реакции разных генов на это хроматиновое окружение.1. Гены, оказывающиеся в ненормальном соседстве с гетерохроматином, обнаруживают мозаичный фенотип
Большие сегменты эукариотического генома, в основном повторяющиеся последовательности, упакованы в постоянно неактивной форме как конститутивный гетерохроматин. Эта фракция хроматина была исходно идентифицирована как та часть генома, которая остается конденсированной и интенсивно окрашивающейся (гетеропикнотической), по мере того, как клетка переходит от метафазы к интерфазе; такой материал обычно ассоциирован с теломерами и перицентромерными районами хромосом. Гетерохроматиновые районы обнаруживают тенденцию к поздней репликации и демонстрируют лишь незначительную мейотическую рекомбинацию или даже вовсе никакой. Эти районы бедны генами, но не лишены их вовсе, и те гены, которые там есть, для своей оптимальной экспрессии часто зависят от этой среды. Около одной трети генома Drosophila считается гетерохроматиновой, включая целую Y-хромосому, большую часть маленькой четвертой хромосомы, перицентромерные 40 % Х-хромосомы и перицентромерные 20 % больших аутосом. На протяжении нескольких последних десятилетий мы узнали очень многое о биохимии гетерохроматина, и многие из этих сведений получены в наших исследованиях, проведенных на Drosophila (Richards and Elgin, 2002; Schotta et al., 2003). Одной из первых мутаций, идентифицированных у D. melanogaster, была мутация white — мутация, результатом которой оказывается белая окраска глаз мухи, а не характерная для них красная пигментация. Используя Х-лучи в качестве мутагена, Меллер (Muller, 1930) наблюдал необычный фенотип, при котором глаз был мозаичным, с участками красных и участками белых фасеток (рис. 5.1). Этот фенотип заставлял думать, что сам ген white не поврежден — в конце концов, некоторые фасетки оставались красными, и даже можно было получить мух-ревертантов с полностью красными глазами, вновь используя Х-лучи как мутаген. Однако ген white был несомненно сайленсирован в некоторых клетках, в которых он экспрессируется в норме Последующие исследования политенных хромосом (представлены ниже, см. рис. 5.4) показали, что такие фенотипы были следствием инверсии или перестройки, когда одна точка разрыва находилась в пределах перицентромерного гетерохроматина, а другая — вблизи гена white (см. рис. 5.1). Поскольку причина такого мозаичного фенотипа — в изменении положения гена в пределах хромосомы, это явление называется эффектом положения мозаичного типа (PEV) У Drosophila было показано, что по существу каждый ген, который был изучен в соответствующей перестройке, проявляет мозаипизм, и перестройки, включающие перицентромерный гетерохроматин любой хромосомы, могут приводить к PEV. PEV наблюдали у ряда организмов, в том числе у дрожжей, мух и млекопитающих, но как инструмент для изучения формирования гетерохроматина он был использован в основном у Drosophila. Рис. 5.1. Схематическое изображение мозаичности white в инверсии In(1)wm4 в Х-хромосоме
Локус white, в норме расположенный в дистальном эухроматине (синий цвет), теперь помещен в пределах 25 т.о. от точки разрыва в перицентромерном гетерохроматине (розовый цвет) Х-хромосомы благодаря индуцированной Х-лучами инверсии. Распространение гетерохроматиновой упаковки в эухроматиновый район приводит к сайленсингу; утрата сайленсинга в некоторых клетках в ходе дифференцировки дает мозаичный фенотип. Используя мух, обнаруживающих PEV, можно отселектировать мутации во втором сайте, которые либо супрессируют этот фенотип (мутации Su(var); приводят к утрате сайленсинга), либо усиливают фенотип (мутации Е(var); вызывают усиление сайленсинга)
Рис. 5.1. Схематическое изображение мозаичности white в инверсии In(1)wm4 в Х-хромосоме
Локус white, в норме расположенный в дистальном эухроматине (синий цвет), теперь помещен в пределах 25 т.о. от точки разрыва в перицентромерном гетерохроматине (розовый цвет) Х-хромосомы благодаря индуцированной Х-лучами инверсии. Распространение гетерохроматиновой упаковки в эухроматиновый район приводит к сайленсингу; утрата сайленсинга в некоторых клетках в ходе дифференцировки дает мозаичный фенотип. Используя мух, обнаруживающих PEV, можно отселектировать мутации во втором сайте, которые либо супрессируют этот фенотип (мутации Su(var); приводят к утрате сайленсинга), либо усиливают фенотип (мутации Е(var); вызывают усиление сайленсинга)
PEV показывает, что такие перестройки позволяют упаковке в гетерохроматиновую конфигурацию «распространяться» вдоль по длине хромосомы. Все выглядит таким образом, как если бы перестройка удалила существующий в норме барьер или буферную зону. Следствием этого является измененная упаковка и сайленсинг генов, в норме организованных в эухроматиновой форме. Визуальное обследование политенных хромосом личинок, несущих такую перестройку, показывает, что район, несущий репортерный ген, упакован теперь в плотный блок гетерохроматина, но только в тех клетках, в которых этот ген неактивен (Zhimulev et al., 1986). Картина, наблюдаемая вследствие перестройки white, может варьировать по числу пигментированных клеток, величине пигментированных пятен и уровню содержания пигмента в наблюдаемых двух разных клеточных типах (рис. 5.1). В системе, использующей в качестве репортера индуцибельный ген lac-Z, исследователи наблюдали, что сайленсинг происходит в эмбриогенезе (когда впервые цитологически наблюдается гетерохроматин) и эпигенетически наследуется как в соматической, так и в зародышевой линиях; мозаичный фенотип был определен в ходе дифференцировки по мозаичной релаксации сайленсинга у личинок третьего возраста (Lu et al., 1996). Однако не все гены, обнаруживающие мозаицизм, остаются «молчащими» до периода после дифферениировки, и для разных генов баланс факторов, приводящий к решению «включить/ выключить», несомненно различен (дополнительное детальное обсуждение см. Ashburner et al., 2005b). При наличии мух, имеющих PEV-фенотип, довольно просто провести скрининг на доминантные мутации во втором сайте (индуцированные химическими мутагенами, вызывающими точечные мутации или мелкие инсерции/делеции), которые либо являются супрессорами PEV (обозначаются Supressor of variegation, Su [varj) и приводят к утрате сайленсинга, либо являются энхансерами PEV (обозначаются Enhancer of variegation, E[var]), приводящими к усилению сайленсинга (рис. 5.1). Изолировали и охарактеризовали около 30 модификаторов PEV, но на основе такого скрининга можно предсказать существование значительно большего числа кандидатов на эту роль. Там, где такой ген был клонирован, а его продукт охарактеризован, обычно обнаруживают хромосомный белок или модификатор хромосомного белка (см. ниже). Небольшая выборка этих локусов вызывает как гаплоаномальный, так и триплоаномальный фенотип; т.е. если одна копия гена приводит к супрессии PEV, три его копии приводят к усилению PEV. Идентификация таких локусов привела к предположению, что белковые продукты этих генов играют структурную роль в гетерохроматине и что распространение гетерохроматиновой упаковки может управляться дозой этих белков в стохастическом режиме (рис. 5.2) (Locke et al., 1988). Однако «распространение» является не простым линейным континуумом, а сложным процессом, который, вероятнее всего, зависит от организации ДНК в том районе, который сайленсирован (см. ниже). Результаты, наблюдаемые по перестройкам хромосом, заставляют предполагать, что эухроматиновый ген, в результате транспозиции вставленный в гетерохроматиновый район, также будет обнаруживать мозаичный фенотип. Так оно и оказалось. Для этой цели можно подвергнуть генноинженным манипуляциям Р-элемент — ДНК-транспозон, обнаруживамый во многих природных линиях Drosophila. Природный P-элемент имеет на каждом конце особые инвертированные повторяющиеся последовательностиикодируетвсеголишьодинфермент— P-специфическую ДНК-транспозазу Репортерные конструкты, лишенные ДНК-транспозазы, но содержащие другие гены, представляющие интерес для исследователя, можно вставить в геном Drosophila в присутствии активной транспозазы путем их совместной инъекции в эмбрионы Drosophila. Мобильный элемент на основе Р (такой, как показано на рис. 5.3а), несущий управляемую hsp70 копию white, можно использовать в мухах, лишенных эндогенной копии white, чтобы идентифицировать домены гетерохроматина Когда P-элемент вставляется в эухроматин, муха имеет красные глаза. Когда же этот Р мобилизуется (путем встраивания в ген, кодирующий транспозазу), приблизительно 1 % выявляемых линий обнаруживают мозаичный фенотип глаз. Гибридизация in situ показывает, что в этих случаях P-элемент перескочил в перицентромерный гетерохроматин, теломеры или небольшую четвертую хромосому (Wallrath and Elgin, 1995). Эта идентификация гетерохроматиновых доменов согласуется с более ранними цитологическими исследованиями.
 Рис. 5.2. Зависимые от дозы эффекты некоторых модификаторов PEV
Полагают, что модификаторы PEV, обнаруживающие зависимый от дозы эффект, являются структурными белками гетерохроматина. В то время как в присутствии двух копий гена-модификатора дикого типа наблюдается мозаичный фенотип (обнаруживаемый здесь репортерным геном white; средняя хромосома, средний глаз мухи), присутствие трех копий гена-модификатора дикого типа обычно обусловливает более экстенсивное формирование гетерохроматина, что приводит к усилению сайленсинга репортерного гена (нижняя хромосома, нижний глаз мухи). Наоборот, присутствие только одной копии гена-модификатора дикого типа обычно приводит к пониженному формированию гетерохроматина и к повышенной экспрессии репортерного гена (верхняя хромосома, верхний глаз мухи)
Рис. 5.2. Зависимые от дозы эффекты некоторых модификаторов PEV
Полагают, что модификаторы PEV, обнаруживающие зависимый от дозы эффект, являются структурными белками гетерохроматина. В то время как в присутствии двух копий гена-модификатора дикого типа наблюдается мозаичный фенотип (обнаруживаемый здесь репортерным геном white; средняя хромосома, средний глаз мухи), присутствие трех копий гена-модификатора дикого типа обычно обусловливает более экстенсивное формирование гетерохроматина, что приводит к усилению сайленсинга репортерного гена (нижняя хромосома, нижний глаз мухи). Наоборот, присутствие только одной копии гена-модификатора дикого типа обычно приводит к пониженному формированию гетерохроматина и к повышенной экспрессии репортерного гена (верхняя хромосома, верхний глаз мухи)
Использование таких P-элементов позволило сравнить упаковку одного и того же репортерного гена в гетерохроматиновом и эухроматиновом окружении. Гетерохроматин относительно устойчив к расщеплению нуклеазами, как неспецифическими (например, ДНКаза 1), так и специфическими (рестрикционные энзимы), и менее доступен для других экзогенных зондов, таких как метилтрансфераза dam. Анализ одного и того же трансгена hsp26 (маркированного фрагментом уникальной растительной ДНК, рис. 5.3а) в эухроматине и в перицентромерном гетерохроматине с использованием микрококковой нуклеазы (MNase) выявил сдвиг в сторону более упорядоченного расположения нуклеосом в гетерохроматине (рис. 5.36, в). Фрагменты, полученные путем расщепления ферментом MNase, четко определены, что позволяет предполагать наличие меньшей, чем обычно, мишени для MNase в линкерном районе. Упорядоченное расположение нуклеосом простирается на весь 5’-регуляторный район гена; этот сдвиг несомненно обусловливает наблюдаемую потерю 5’-гиперчувствительных (HS) сайтов (Sun et al., 2001). Действительно, хотя механизм сайленсинга понят еще не полностью, имеются многочисленные данные о транскрипционной репрессии сильно мозаичных генов, включая утрату связывания TFIID и других транскрипционных факторов (Cryderman et al., 1999b).
2. Скрининг супрессоров и энхансеров PEV позволил идентифицировать хромосомные белки и модификаторы хромосомных белков
PEV можно модифицировать различными факторами. Температура во время развития и количество гетерохроматина в геноме были первыми факторами, влияющими, как было показано, на степень мозаицизма. Как правило, повышение температуры во время развития (с 25 до 29°С) приводит к супрессии мозаицизма (утрате сайленсинга), тогда как более низкие температуры (например, 18°С) вызывают усиление мозаицизма (увеличение сайленсинга). Другие изменения в условиях культивирования, ускоряющие или замедляющие скорость развития, могут давать похожие эффекты. Сильная супрессия обнаруживается у мух, несущих дополнительную Y-хромосому (самки XXY и самцы XYY), тогда как у самцов без Y-хромосомы (Х0) обнаруживается значительное усиление. В целом дупликация гетерохроматинового материала подавляет, а делециии гетерохроматинового материала усиливают мозаицизм. Эти эффекты могут быть обусловлены титрованием фиксированного количества ключевых белков, необходимых для упаковки гетерохроматина. Первые мутации во втором сайте, супрессирующие или усиливающие PEV, были идентифицированы Шульцем (Schultz, 1950) и Споффордом (Spofford, 1967). В настоящее время приблизительно 150 генов предположительно рассматриваются как модификаторы локусов PEV. Рис. 5.3. Гетерохроматин упакован в регулярный нуклеосомный порядок
Мобильный элемент (а), несущий маркированную копию гена теплового шока для исследования и hsp70-управляемую копию white в качестве визуального маркера, можно использовать для изучения одного и того же гена в разных хроматиновых доменах. Ядра эмбрионов Drosophila из линии, несущей этот трансген в эухроматиновом домене (39С-Х; красные глаза), и из линии, несущей тот же самый трансген в гетерохроматиновом домене (HS-2; мозаичный глаз), были переварены возрастающими количествами фермента MNase, ДНК очистили и разогнали в агарозном геле, а Саузерн-блот гибридизировали с зондом, уникальным для трансгена (б). Линкерные сайты, расщепленные MNase, отмечены стрелками, (в) Сравниваются денситограммы последней дорожки каждой пробы (сверху вниз — слева направо). В гетерохроматине можно видеть набор 9—10 нуклеосом (красная линия) по сравнению с 5—6 нуклеосомами в эухроматине (синяя линия), что показывает наличие более регулярного «шага» в первом случае, (г) Схематическое представление этих результатов (б, в — с любезного разрешения из Sun et al., 2001, с изменениями [©American Society for Microbiology])
Рис. 5.3. Гетерохроматин упакован в регулярный нуклеосомный порядок
Мобильный элемент (а), несущий маркированную копию гена теплового шока для исследования и hsp70-управляемую копию white в качестве визуального маркера, можно использовать для изучения одного и того же гена в разных хроматиновых доменах. Ядра эмбрионов Drosophila из линии, несущей этот трансген в эухроматиновом домене (39С-Х; красные глаза), и из линии, несущей тот же самый трансген в гетерохроматиновом домене (HS-2; мозаичный глаз), были переварены возрастающими количествами фермента MNase, ДНК очистили и разогнали в агарозном геле, а Саузерн-блот гибридизировали с зондом, уникальным для трансгена (б). Линкерные сайты, расщепленные MNase, отмечены стрелками, (в) Сравниваются денситограммы последней дорожки каждой пробы (сверху вниз — слева направо). В гетерохроматине можно видеть набор 9—10 нуклеосом (красная линия) по сравнению с 5—6 нуклеосомами в эухроматине (синяя линия), что показывает наличие более регулярного «шага» в первом случае, (г) Схематическое представление этих результатов (б, в — с любезного разрешения из Sun et al., 2001, с изменениями [©American Society for Microbiology])
Мутации Su(var) и E(var) идентифицируют гены, причинно связанные с началом сайленсинга гетерохроматиновых генов при PEV [with the onset of hetero-chromatic gene silencing in PEV]. Молекулярный анализ этих генов сыграл существенную роль в углублении понимания механизмов, приводящих к формированию гетерохроматина и сайленсингу генов. В большинстве случаев модифицирующее влияние мутаций на PEV является доминантным, и гетерозиготы Su(var)/+ или E(var)/+ демонстрируют фенотип с подавленным или усиленным PEV (рис. 5.1). Эффективное выделение и детальный генетический анализ мутаций Su(var) и E(var) зависят от наличия подходящей для эксперимента PEV-перестройки. Хотя было описано большое число PEV-перестроек (Flybase, 2005), лишь немногими из них можно легко воспользоваться для эффективного генетического скрининга и изоляции доминантных мутаций-модификаторов. Одна из наиболее полезных для такой экспериментальной работы PEV-перестроек— In(1)wm4 (Muller 1930). Эта перестройка обусловливает мозаицизм по white — фенотип, легко различимый на глазах взрослых мух, как показано на рис.5.1. Пенетрантность мозаицизма по white у wm4 является 100 %-ной, так что каждая муха в исходном штамме [the starting stock] имеет глаза с белой пятнистостью. Инактивация гена white не влияет на жизнеспособность или фертильность, что обусловливает возможность неограниченной работы с мухами, гомозиготными по wm4. В перестройке wm4 ген white в результате инверсии оказывается в непосредственной близости с гетерохроматиновым материалом Х-хромосомы, локализованным на дистальной границе ядрышкового организатора (Cooper, 1959). Этот район содержит тандемные порядки мобильных элементов типа R1; гетерохроматиновая точка разрыва In(1)wm4 находится внутри единицы повтора R1 (A. Ebert and G. Reuter, неопубликовано). После воздействия Х-лучами или EMS (этанметилсульфонат, химический мутаген) были изолированы ревертанты wm4, имеющие фенотип w+ (Tartof et al., 1984; Reuter et al., 1985). Анализ более 50 ревертантных хромосом w+ (все они обнаружили реинверсию или транслокацию гена white в соседство с эухроматином) позволил предположить, что гетерохроматиновый материал, фланкирующий непосредственно точку разрыва, вызывает инактивацию гена white у wm4. Большинство ревертантов снова обнаруживают белую пятнистость, если вводятся сильные мутации E(var), что заставляет предполагать, что некоторые гетерохроматиновые последовательности после перемещения остаются ассоциированными с геном white. Эти исследования позволяют считать повторяющуюся ДНК (в данном случае повторы R1) мишенью для формирования гетерохроматина. Большинство известных мутаций-модификаторов PEV были изолированы с использованием сенсибилизированного генетического фона. Для изоляции доминантных супрессорных мутаций тест-генотип содержит доминантный энхансер, тогда как в схемах для изоляции энхансерных мутаций используется доминантный супрессор (Dorn et al., 1993b). Если тест-генотип содержит энхансер мозаичности, все мухи wт4 имеют белые глаза, и исключения, имеющие пятнистые или красные глаза, указывают на вновь индуцированные мутации Su(var). Соответственно, в тест-линии с доминантным супрессором все мухи wт4 имеют красные глаза, а исключительные мухи с мозаичным фенотипом указывают на вновь индуцированные мутации E(var). Эти сенсибилизированные генетические схемы благоприятствуют изоляции сильно доминантных мутаций Su(var) и E(var), которые оказались очень полезными для детального генетического анализа. С использованием этого подхода в разных опытах по скринингу просмотрели более миллиона мух, и были изолированы более 140 мутаций Su(var) и 230 мутаций E(var) (Schotta et al., 2003). Мутации были индуцированы EMS, Х-лучами или ремобилизацией элементов Р. Еще один набор мутаций Su(var) был изолирован в ходе прямого скрининга с wm4 (Sinclair et al., 1983). Скрининг с хромосомой Df(l'J), демонстрирующей сильный мозаицизм по гену yellow (маркер, желтая окраска тела), привел к изоляции 70 мутаций-модификаторов PEV (Donaldson et al., 2002). Кроме того, скрининг на доминантные модификаторы экспрессии транспозонного репортерного гена позволил идентифицировать несколько мутаций с эффектом Su(var) (Birchler et al., 1994). Известно, что выборка критических регуляторных генов даун — регулируется генами группы Polycomb (PcG) и ап — регулируется генами группы trithorax (trxG). В прямых тестах относительно немногие мутации в генах PcG модифицируют PEV (например, Sinclair et al., 1998). Напротив, многие мутации в генах trxG являются энхансерами PEV (Dorn et al., 1993а; Farkas et al., 1994). В совокупности этот скрининг позволил идентифицировать большое число доминантных мутаций Su(var) и E(var). По данным выполненного к настоящему времени генетического анализа общее число мутаций Su(var) и E(var) можно оценить как приблизительно 150. Большое число генов Su(var) и E(var) с почти идентичными фенотипическими эффектами иногда приводит к несоответствиям в генетической номенклатуре. Чаще всего символы генов Su(var) и E(var) комбинируются с цифрами, указывающими хромосому, в которой локализована данная мутация, с номером гена и номером аллели Так, Su(var)3-917 символизирует аллель 17 девятого гена Su(var), идентифицированного в третьей хромосоме. В настоящее время были тщательно картированы лишь около 30 соответствующих генов и идентифицированы соответствующие аллели (табл. 5.1). Зависящие от дозы эффекты наблюдались для примерно одной трети идентифицированных генов, с использованием серии перекрывающихся нехваток и дупликаций. В этих случаях уменьшение количества генных продуктов из-за утери одной копии гена неизменно приводит к модификации мозаичного фенотипа. Делеции этих локусов Su(var) или E(var) супрессируют или, соответственно, усиливают сайленсинг генов. Исследования с использованием дупликаций позволили идентифицировать новые локусы-модификаторы, которые обнаруживают противоположное (антиподное) влияние на PEV, если путем дупликации или с помощью инсерции трансгена вводится лишняя копия данного гена. Общее число генов-модификаторов PEV, обнаруживающих зависящие от дозы эффекты, оценивается примерно в 15—20 (Schotta et al., 2003). Если утрата одной копии гена приводит к супрессии PEV, а присутствие трех копий гена ведет к усилению PEV, это позволяет предполагать, что для установления гетерохроматина требуется, в стоихиометрических количествах, продукт, кодируемый этим геном, с сопутствующим сайленсингом гена (рис. 5.2). Были детально охарактеризованы три таких локуса, Su(var)2-5 (кодирующий НР1), Su(var)3-7 (кодирующий белок типа «цинковых пальцев») и Su(var)3-9 (кодирующий метилтрансферазу лизина гистонов). Su(var)2-5 был клонирован путем скрининга библиотеки экспрессии кДНК с помощью моноклонального антитела, распознающего гетерохроматин (James and Elgin, 1986). Кодируемый белок, ассоциированный с гетерохроматином, был впоследствии обозначен НР1 (белок гетерохроматина 1). Гибридизация in situ с использованием выделенной клонированной ДНК позволила идентифицировать ген в районе 28—29 политенных хромосом,
Таблица 5.1. Генетически установленные гены Su(var) и E(var) и их молекулярные функции
 См. оригинальное цитирование во Flybase.
См. оригинальное цитирование во Flybase.
где ранее был картирован Su(var)2-5- Анализ нуклеотидной последовательности ДНК мутантных аллелей подтвердил, что локус Su(var)2-5 в положении 28F1-2 на хромосоме кодирует HP 1 (Eissenberg et al., 1990), HP1 содержит два консервативных домена, аминотерминальный хромодомен и карбокситерминальный домен «chromoshadow» (Paro and Hogness, 1991), и взаимодействует с несколькими другими хромосомными белками. Su(var)3- 7 был сперва цитогенетически картирован (с помощью серии перекрывающихся делеций и дупликаций) в районе 87Е1-4 в третьей хромосоме. Этот район был проанализирован на уровне ДНК как часть первой «прогулки по хромосоме» [chromosomal walk], выполненной у Drosophila (Bender et al., 1983). С помощью серии перекрывающихся геномных клонов Su(var)3-7был определен в пределах фрагмента ДНК величиной 7.8 т.о., который обладал трипло-энхансерным влиянием на репортер, обнаруживающий мозаичность (Reuter et al., 1990). Su(var)3-7кодирует белок с семью регулярно расположенными [regularly spaced] «цинковыми пальцами» — доменами, которые, как было показано, функционируют в связывании с ДНК (Cleard and Spierer, 2001). Su(var)3-9 был клонирован с помощью таггирования транспозоном P-элементом (Tschiersch et al., 1994). Ген Su(var)3-9 у Drosophila (и у всех других голометаболических насекомых, изученных к настоящему времени) образует бицистронную единицу с геном, кодирующим eIF2y (Krauss and Reuter, 2000). Поскольку транскрипционная единица Su(var)3-9 не имеет интронов, вполне вероятно, что Su(var)3-9 был вставлен в интрон гена eIF2y путем ретротранспозиции. Белок SU(VAR)3-9 содержит хромодомен в своем аминотерминальном участке и домен SET (идентифицированный впервые в белках SU(VAR)3-9, ENHANCER OF ZESTE [E(Z)] и TRITHORAX) (Jones and Gelbart, 1993; Tschiersch et al., 1994) на своем карбоксильном конце. Этот белок является метилтрансферазой гистонов, специфически модифицирующей гистон H3 по лизину 9. Были описаны семь разных мутантных аллелей Su(var)2-5, в том числе миссенс-мутации в хромодомене, преждевременные стоп-кодоны и ошибки сплайсинга (Eisenberg et al., 1992). Мутации Su(var)3-7 были получены с помощью гомологичной рекомбинации (Seum et al., 2002); дополнительные аллели были выявлены как супрессоры сайленсинга, зависимого от P-элемента (Bush-еу and Locke, 2004). Сорок мутантных аллелей Su(var)3-9 были выявлены и определены на молекулярном уровне (Ebert et al., 2004). Иммуноцитологический анализ с использованием специфических антител или химерных белков слияния, экспрессируемых трансгеном [transgene-expressed fusion proteins], показал, что все три белка преимущественно ассоциированы с гетерохроматином (см. ниже и рис. 5.4) (James et al., 1989; Cleard et al., 1997; Schotta et al., 2002). Сильная колокализация особенно очевидна для НР1 и SU(VAR)3-9. Эти белки также связываются с теломерами и в ряде эухроматиновых сайтов (Fanti et al., 1998; Schotta et al., 2002). Несколько инсерций P-элемента, несущих репортерный ген w+ в теломерные районы, обнаруживают белую пятнистость. Этот феномен называется теломерным эффектом положения (ТРЕ). Упаковка, подобная гетерохроматину, наблюдается в ассоциированных с теломерами сателлитных последовательностях (TAS), кластерах повторяющейся ДНК, расположенных проксимально по отношению к ретровирусным элементам НеТ-А и TART, составляющим теломеры Drosophila (Cryderman et al., 1999a). В целом, не было обнаружено модификации ТРЕ мутациями в известных генах-модификаторах, хотя НР1 важен для целостности теломер. В клетках с недостаточностью по этому белку хромосомы часто сливаются в области своих теломер (Fanti et al., 1998). У Drosophila в ходе недавнего скрининга не было обнаружено никаких /гая5-действуюших доминантных модификаторов ТРЕ (Mason et al., 2004), что заставляет предполагать, что эти участки сайленсированы двумя (или несколькими) независимыми механизмами.
3. Иммунофлуоресцентное окрашивание политенных хромосом позволило идентифицировать белки, специфически ассоциированные с гетерохроматином
Одним из преимуществ работы с Drosophila является возможность изучения политенных хромосом, дающая визуальную «дорожную карту» генома. На стадии личинки хромосомы во многих терминально дифференцированных клетках реплицируются, но не проходят через митоз; нити хроматина остаются спаренными, в состоянии совершенного синапсиса, и все копии выравнены друг с другом. Наиболее крайний случай имеет место в слюнных железах, где эухроматиновые плечи хромосом претерпели 10 раундов репликации, дав в результате около 1000 копий. Однако репликация не является однородной; многие повторяющиеся последовательности недореплицируются, а сателлитные последовательности ДНК не реплицируются вовсе Все хромосомные плечи сливаются в общем хромоцентре. Таким образом, у D. melanogaster наблюдаются пять длинных плечей (X, второе левое [2L], второе правое [2R], третье левое [3L], третье правое [3R]) и короткое плечо четвертой хромосомы, выступающее из конденсированного хромоцентра, состоящего из перицентромерного гетерохроматина (рис. 5.4а) (обзор см. Ashburner et al., 2005) Хотя генетический анализ позволил идентифицировать многие локусы, необходимые для формирования гетерохроматина, сам по себе он не позволяет определить, играет ли продукт данного локуса прямую или же косвенную роль. Специфическая ассоциация белка с гетерохроматином первоначально наблюдалась при скрининге моноклональных антител (полученных с использованием прочно-связывающихся ядерных белков, где анализировали паттерны распределения на политенных хромосомах. Антитела, специфичные к белку 22 кДа, впоследствии обозначенному как НР1, давали иммунофлуоресцентное «окрашивание» перицентромерного гетерохроматина, теломер и бэндированной [banded] части маленькой четвертой хромосомы, т.е. известных сайтов гетерохроматина (рис. 5.4а) (James and Elgin, 1986). Последующий анализ (описанный выше) показал, что белок НР1 кодируется Su(var)2-5, известным супрессором PEV (Eissenberg et al., 1990). Изучение хромосомной локализации специфическими антителами с использованием либо митотических хромосом (Fanti and Pimpinelli, 2004), либо политенных хромосом (обеспечивающих большее разрешение, но недостаточных по центромерному гетерохроматину) (Silver and Elgin 1976) остается наилучшим способом демонстрации того, что продукт локуса Su(var) кодирует хромосомный белок. Были идентифицированы приблизительно 10 таких специфичных для гетерохроматина белков; если есть мутации в генах, кодирующих эти белки, часто наблюдают доминантную супрессиюPEV (см. табл. 5.1) (Ashburner et al., 2005b). Эти белки, в том числе недавно идентифицированный НР2 (рис. 5.4а) (Shaffer et al., 2002), являются кандидатами на роль структурных компонентов гетерохроматина. Рис. 5.4. Иммунофлуоресцентное окрашивание политенныххромосом позволяет идентифицировать белки, преимущественно ассоциированные с гетерохроматином
(а) Политенные хромосомы, на фиксированных и давленых препаратах слюнных желез (микроскопия с фазовым контрастом, слева) «окрашены» с помощью инкубирования сначала с антителами, специфичными к данному хромосомному белку, а затем со вторичным антителом, конъюгированным с флуоресцентной меткой. НР1 (справа) и НР2 (в центре) имеют сходный рисунок распределения, демонстрирующий бросающуюся в глаза связь с перицентромерным гетерохроматином, маленькой четвертой хромосомой (врезка, стрелка) и небольшой группой сайтов в эухроматиновых плечах. Обратите внимание на то, что на эффективность любого антитела может влиять выбор протокола фиксации (см. Stephens et al. 2003). (б, в) Ассоциация НР1 и SU(VAR)3-9 с перицентромерным гетерохроматином является взаимозависимой. Мутации в Su(var)3-9 приводят к потере НР1 из перицентромерного гетерохроматина (но не четвертой хромосомы; см. текст) (б), тогда как мутации в Su(var)2-5 приводят к делокализации SU(VAR)3-9 (в) (из: Shatter et al. 2002, с изменениями)
Рис. 5.4. Иммунофлуоресцентное окрашивание политенныххромосом позволяет идентифицировать белки, преимущественно ассоциированные с гетерохроматином
(а) Политенные хромосомы, на фиксированных и давленых препаратах слюнных желез (микроскопия с фазовым контрастом, слева) «окрашены» с помощью инкубирования сначала с антителами, специфичными к данному хромосомному белку, а затем со вторичным антителом, конъюгированным с флуоресцентной меткой. НР1 (справа) и НР2 (в центре) имеют сходный рисунок распределения, демонстрирующий бросающуюся в глаза связь с перицентромерным гетерохроматином, маленькой четвертой хромосомой (врезка, стрелка) и небольшой группой сайтов в эухроматиновых плечах. Обратите внимание на то, что на эффективность любого антитела может влиять выбор протокола фиксации (см. Stephens et al. 2003). (б, в) Ассоциация НР1 и SU(VAR)3-9 с перицентромерным гетерохроматином является взаимозависимой. Мутации в Su(var)3-9 приводят к потере НР1 из перицентромерного гетерохроматина (но не четвертой хромосомы; см. текст) (б), тогда как мутации в Su(var)2-5 приводят к делокализации SU(VAR)3-9 (в) (из: Shatter et al. 2002, с изменениями)
4. Модификация гистонов играет ключевую роль в сайленсинге гетерохроматина
Анализ SU(VAR)3-9 позволил идентифицировать ключевую функцию, необходимую для сайленсинга гетерохроматиновых генов (Tschiersch et al., 1994). Этот белок содержит домен SET, функционирующий как фермент в метилировании H3K9 гистонов. То, что этот белок является метилтрансферазой лизина гистонов (HKMT), «нацеленной» на H3K9, было впервые показано в ходе изучения гомологичного белка человека, SUV39H1 (Rea et al., 2000). У Drosophila SU(VAR)3-9 является главной, но не единственной HKMT H3K9 (Schotta et al., 2002; Ebert et al., 2004). SU(VAR)3-9 контролирует диметилирование H3K9в основной массе перицентромерного гетерохроматина, но не в четвертой хромосоме, теломерах или эухроматиновых сайтах. Триметилирование H3K9, которое у Drosophila наблюдется, главным образом, во внутреннем хромоцентре, также контролируется SU(VAR)3-9. Диметилирование этого внутреннего района не зависит от SU(VAR)3-9, как и монометилирование H3K9 в перицентромерном гетерохроматине (Ebert et al., 2004). HKMTs, ответственные за эти модификации, все еще неизвестны. Важное значение диметилирования H3K9 в сайленсинге гетерохроматиновых генов демонстрируется сильным зависящим от дозы влиянием SU(VAR)3-9 на PEV (обсуждается выше), атакже тем фактом, что супрессия сайленсинга генов мутациями Su(var)3-9 коррелирует с активностью их HKMT Ферментативно гиперактивная мутация Su(var)3-9 pth является сильным энхансером PEV и вызывает повышенное содержание H3K9me2 и H3K9me3 в хромоцентре, а также порождает заметные сигналы H3K9me2 во многих эухроматиновых сайтах (эктопический гетерохроматин). S-Аденозилметионин функционирует как донор метальной группы для всех этих реакций метилирования; следовательно, мутации в гене, кодирующем S-аденозилметионинсинтазу, Su(z)5, являются доминантными супрессорами PEV (Larsson et al., 1996). Исследования с использованием генов Su(var) начали вскрывать последовательность молекулярных реакций, необходимых для установления гетерохроматиновых доменов. Связывание SU(VAR)3-9 в гетерохроматиновых нуклеотидных последовательностях зависит как от его хромодоменов, так от SET-доменов (Schotta et al., 2002). Как контролируется SU(VAR)3-9 — все еще неизвестно. Метилирование H3K9 белком SU(VAR)3-9 устанавливает сайты связывания для НР1. Хромодомен НР1 специфически связывается с H3K9me2 и H3K9me3 (Bannister et al., 2001; Lachner et al., 2001). Что SU(VAR)3-9 связывается с HP1, было показано двугибридными тестами на дрожжах [yeast two-hybrid tests] и иммунопреципитацией (Schotta et al., 2002). Район SU(VAR)3-9, аминотерминальный по отношению к его хромодомену взаимодействует с доменом «chromoshadow» НР1. Этот район SU(VAR)3-9 взаимодействует также с карбокситерминальным доменом SU(VAR)3-7. SU(VAR)3-7 взаимодействует в трех разных сайтах с доменом «chromoshadow» НР1 (Delattre et al., 2000). При таком паттерне взаимодействий можно предположить, что эти три белка — НР1, SU(VAR)3-7 и SU(VAR)3-9 — физически связаны в мультимерных белковых комплексах гетерохроматина. Ассоциация SU(VAR)3-9 и НР1 с перицентромерным гетерохроматином является взаимозависимой (Schotta et al., 2002). SU(VAR)3-9 вызывает диметилирование H3K9, который специфически узнается хромодоменом НР1 (Bannister etal., 2001; Lachner etal., 2001). Следовательно, у личинок нуль-Su(var)3-9 связывание НР1 с перицентромерным гетерохроматином нарушено (см. рис. 5.4Ь). Это отражает специфическую активность НР1, который связывается с H3K9me2, но не с H3K9me1; SU(VAR)3-9 не затрагивает монометилирование (Ebert et al., 2004). Диметилирование H3K9 во внутреннем хромоцентре, четвертой хромосоме в теломерах и в эухроматиновых сайтах не зависит от SU(VAR)3-9, и, следовательно, в мутантных линиях НР1 продолжает обнаруживаться во всех этих сайтах. В клетках дикого типа SU(VAR)3-9 связывается с этими сайтами, но, по-видимому, неактивен; неизвестная HKMT контролирует метилирование H3K9 в этих районах. Напротив, если НР1 не присутствует (устранен мутациями), SU(VAR)3-9 больше не связывается с пери-центромерным гетерохроматином, но обнаруживается также по длине эухроматиновых хромосомных плечей (рис. 5.46). Теперь он виден почти во всех бэндах, где он вызывает эктопическое моно- и диметилирование H3K9 (H3K9me1 и H3K9me2) (рис. 5.5). Таким образом, НР1 существен для ограниченного связывания SU(VAR)3-9 с перицентромерным гетерохроматином. Эти данные позволяют представить себе последовательность реакций, начинающуюся со связывания SU(VAR)3-9 с гетерохроматиновыми доменами и последующего образования H3K9me2. Эта метка распознается хромодоменом НР1; связывание SU(VAR)3-9 с доменом «chromoshadow» белка НР1 обеспечивает его ассоциацию с гетерохроматином. Был создан химерный белок НР1-РС, в котором хромодомен НР1 был заменен хромодоменом белка Polycomb (PC) (Platero et al., 1996). Хромодомен PC прочно связывается с H3K27me3 (Fischle et al., 2003). Химерный белок HP1-PC узнает, следовательно, сайты связывания H3K27me3 Polycomb в эухроматиновых плечах; в присутствии такого химерного белка НР1-РС белок SU(VAR)3-9 также обнаруживается в сайтах связывания PC, демонстрируя свою сильную связь с доменом «chromoshadow» белка НР1 (Schotta et al., 2002). В клетках нуль-SU(VAR)3-9 сильно уменьшено содержание еще одной гетерохроматин-специфичной метки метилирования — триметилирования H4K20 (H4K20me3) (Schotta et al., 2004). Было показано, что взаимозависимость между диметилированием H3K9 и триметилированием H4K20 отражает взаимодействие между белками SU(VAR)3-9, НР1 и SUV4-20. SUV4-20 является HKMT, контролирующей метилирование H4K20 в гетерохроматине. Это гетерохроматин-специфичная метка метилирования сильно ослаблена в нуль-клетках по SU(VAR)3-9, как и по НР1, заставляя предполагать ассоциацию SU(VAR)3-9, НР1 и SUV4-20 в комплекс взаимно зависимых белков. Мутации в гене Suv4-20 вызывают сильную супрессию индуцированного PEV сайленсинга генов, показывая, что для этого процесса требуется метка H4K20me3. Рис. 5.5. Взаимодействие SU(VAR)3-9 и НР1 в установлении паттерна распределения H3K9me
(a) SU(VAR)3-9 отвечает за деметилирование НЗК9 (H3K9me2); утрата энзима приводит к утрате этой модификации в перицентромерном гетерохроматине, как показывает утрата окрашивания антителами политенных хромосом (сравни среднюю панель с верхней панелью). Утрата НР1 приводит к утрате «нацеливания» SU(VAR)3-9; высокие уровни H3K9me2 видны теперь на всех хромосомных плечах (нижняя панель), (б) YH1 взаимодействует с H3K9me2 через свой хромодомен, а с SU(VAR)3-9 — через домен «chromoshadow». Узнавая и модификацию гистонов, и фермент, отвечающий за эту модификацию, НР1 обеспечивает механизм распространения гетерохроматина и эпигенетического наследования
Рис. 5.5. Взаимодействие SU(VAR)3-9 и НР1 в установлении паттерна распределения H3K9me
(a) SU(VAR)3-9 отвечает за деметилирование НЗК9 (H3K9me2); утрата энзима приводит к утрате этой модификации в перицентромерном гетерохроматине, как показывает утрата окрашивания антителами политенных хромосом (сравни среднюю панель с верхней панелью). Утрата НР1 приводит к утрате «нацеливания» SU(VAR)3-9; высокие уровни H3K9me2 видны теперь на всех хромосомных плечах (нижняя панель), (б) YH1 взаимодействует с H3K9me2 через свой хромодомен, а с SU(VAR)3-9 — через домен «chromoshadow». Узнавая и модификацию гистонов, и фермент, отвечающий за эту модификацию, НР1 обеспечивает механизм распространения гетерохроматина и эпигенетического наследования
Третья метка метилирования гистонов, функционально связанная с формированием гетерохроматина, — это метилирование H3K27, катализируемое HKMT E(Z). У Drosophila E(Z) контролирует все моно-, ди- и триметилирование H3K27 и в эухроматине, и в гетерохроматине. Следовательно, в нуль-клетках по E(z) все метилирование H3K27 утрачивается (Ebert et al., 2004). На функцию метилирования H3K27 в сайленсинге гетерохроматиновых генов указывает как Su(var)-эффект мутаций E(z) типа утраты функции, так и энхансерный эффект дополнительных копий гена E(z) (Laible et al., 1997). Неясно, является ли этот эффект прямым или косвенным. Метилирование H3K27 является критическим для системы сайленсинга Polycomb, которая действует в эухроматиновых доменах. Между паттернами распределения и функциональными ролями PC и НР1 наблюдается относительно небольшое перекрывание. Каким образом могла бы осуществляться подгонка метилирования H3K27 к зависимым от НР1 гетерохроматиновым комплексам — еще предстоит выяснить. Белок НР1 выполняет центральную линкерную функцию в формировании гетерохроматина и ассоциированном сайленсинге генов, связывании H3K9me2 и H3K9me3 и взаимодействии непосредственно с SU(VAR)3-9 и несколькими дополнительными белками. Учитывая число идентифицированных локусов Su(var), эта модель определенно становится более сложной. У млекопитающих и растений метилирование H3K9 гистонов и метилирование ДНК представляют взаимосвязанные метки репрессированного хроматина (Martienssen and Colot, 2001; Bird, 2002). Происходит ли вообще метилирование ДНК у Drosophila или нет, многие годы было предметом полемики. Недавние сообщения о низком уровне метилирования ДНК у ранних эмбрионов вновь подогрели эту дискуссию (Kunert et al., 2003). Анализ генома показывает, что единственная имеющаяся различимая ДНК-метилтрансфераза — это Dnmt2. Мутации в этом гене мало влияют на организм. Тем не менее, его роль в раннем эмбриогенезе исключать нельзя.
5. Хромосомные белки образуют взаимозависимые комплексы для поддержания и распространения гетерохроматиновой структуры
PEV отражает изменение в экспрессии гена вследствие генетической перестройки, а именно утрату экспрессии репортерного гена в некоторых клетках, в которых он в норме активен. Для объяснения PEV предложено несколько разных моделей; не все из них являются взаимоисключающими. Одна из возможностей, рассмотренная исходно, — это случайная потеря гена, возможно вследствие поздней репликации (Karpen and Spradling, 1990). Анализ с помощью количественного Саузерн-блоттинга показал, что это объяснение в общем виде неприменимо; гены, обнаруживающие мозаицизм, обычно полностью реплицируются в диплоидной ткани (Wallrath et al., 1996). Другие модели делают акцент на ассоциации гена, обнаруживающего мозаицизм, с гетерохроматиновым компонентом ядра и (или) на распространении гетерохроматиновой структуры с гетерохроматина, оказавшегося по соседству. Эта модель распространения, базирующаяся на многочисленных генетических и цитологических данных, объясняет сайленсинг как следствие распространения гетерохроматиновой упаковки через точку разрыва в эухроматиновые в норме районы. В нормальных хромосомах эухроматиновые и гетерохроматиновые районы, по-видимому, изолированы [insulated] друг от друга специфическими последовательностями или буферными зонами. Поскольку эти «изолирующие последовательности» [«insulating sequences»] (которые никогда не были полностью определены у Drosophila) отсутствуют в местах соединения эухроматина и гетерохроматина при PEV-перестройках (см. рис. 5.1), гетерохроматинизация эухроматиновых последовательностей индуцируется с переменным успехом. Эту гетерохроматинизацию можно видеть на цитологическом уровне в политенных хромосомах как сдвиг от бэндированной к аморфной структуре в основании хромосомных плечей (Hartmann-Goldstein, 1967); степень этого изменения можно модифицировать мутациями Su(var) и E(var) (Reuter et al., 1982). Инактивацию эухроматиновых генов на расстоянии вдоль по длине хромосомы можно продемонстрировать генетически (Demerec and Slizynska, 1937). Затронутые районы становятся связанными с НР1 (Belyaeva et al., 1993) и обнаруживают H3K9me2, типичную метку гетерохроматина Drosophila (Ebert et al., 2004). Поскольку модель распространения постулирует конкуренцию между упаковкой в эухроматин и упаковкой в гетерохроматин, гены-модификаторы PEV могли бы кодировать функции контроля либо формирования гетерохроматина, либо формирования эухроматина. Обнаружение зависимых от дозы модификаторов, как обсуждается выше, свидетельствует в пользу такой модели (Locke et al., 1988; Henikoff, 1996). И действительно, недавно были идентифицированы мутации Su(var), контролирующие баланс между эухроматином и гетерохроматином (Ebert et al., 2004). PEV-перестройки позволили нам визуализировать и изучить случаи, где гетерохроматиновая упаковка распространяется на фланкирующий эухроматиновый домен. Этот эффект распространения несомненно зависит от ряда молекулярных реакций в эухроматиновых районах. Известны несколько модификаций гистонов, которые являются взаимоисключающими и которые определяют эти альтернативные хромосомные состояния. Ацетилирование H3K9, метилирование H3K4 и фосфорилирование H3S10 — типичные метки активного эухроматина, тогда как метилирование H3K9, H3K27 и H4K20 является специфической меткой «молчащих» районов. Следовательно, гетерохроматинизация эухроматиновых районов требует специфических реакций деацетилирования, деметилирования и дефосфорилирования в эухроматине, как это изображено на рис. 5.6. Этот переход исходно зависит от деацетилирования H3K9 ферментом HDAC1 Мутации в гене rpd3, кодирующем специфическую для H3K9 деацетилазу гистонов HDAC1, являются сильными супрессорами PEV(Mottus et al., 2000), выступая антагонистами эффекта SU(VAR)3-9 в сайленсинге генов (Czermin et al., 2001). Как было показано, HDAC1 in vivo ассоциирован с комплексом SU(VAR)3-9/HPl; эти два энзима работают кооперативно, метилируя предацетилированные гистоны. Недавно наблюдали, что распространение гетерохроматина в эухроматин полностью блокируется у мутантов Su(var)3-1 (Ebert et al., 2004). Мутации Su(var)3-1 являются мутациями сдвига рамки считывания в гене, кодирующем киназу JIL1; они приводят к экспрессии усеченного белка JIL1, не имеющего карбокситерминального района. Белок JIL1 содержит два киназных домена и катализирует фосфорилирование H3S10 в эухроматине. Мутации JIL1Su(var)3~1 не влияют на фосфорилирование H3S10, но, вероятно, нарушают дефосфорилирование H3S10, эффективно подавляя метилирование H3K9. Это заставляет предположить участие фосфатазы. Неизвестно, участвует ли энзим РР1 (который был идентифицирован с помощью мутаций Su(var)3-5) (Baksa et al., 1993) непосредственно в этой реакции. Деметилирование H3K4 является, по-видимому, еще одной предпосылкой для гетерохроматинизации эухроматиновых районов. Недавние работы показали, что аминооксидаза LSD1 функционирует у млекопитающих как деметил аза H3K4 (Shi et al., 2005). Предполагаемый гомолог LSD1 у Drosophila, SU(VAR)3-3, облегчает распространение гетерохроматина в эухроматиновые районы во всех испытанных PEV-перестройках (S. Lein et al., неопубликовано). В соответствии с этим в нуль-клетках по Su(var)3-3, у которых нет LSD1, приобретение метилирования H3K9 в эухроматине, фланкирующем точку разрыва, отменяется, хотя конститутивно гетерохроматиновые районы не затрагиваются. Эти открытия показывают, что для удаления специфических для эухроматина меток модификаций гистонов необходима координированная функция нескольких энзимов, прежде чем может иметь место переход к гетерохроматиновой упаковке (см. рис. 5.6). Вполне вероятно, будет обнаружено, что эти необходимые энзимы образуют комплексы с SU(VAR)3-9/HPl, как это было уже показано для HDAC1.6. Как формирование гетерохроматина «нацеливается» у Drosophila?
Хотя мы многое узнали о механистических аспектах и биохимии структуры гетерохроматина, как это описано выше, остается открытым вопрос о том, каким образом формирование гетерохроматина «нацеливается» на избранные районы генома в его нормальной конфигурации. Все гетерохроматиновые домены обладают некоторыми общими чертами, и две такие особенности признаны существенными входными сигналами [inputs] для сборки гетерохроматина на данной нуклеотидной последовательности ДНК: положение локуса относительно пространственно обособленных [distinct] субдоменов гетерохроматина в ядре и присутствие повторяющейся ДНК Рис. 5.6. Переход из эухроматинового состояния в гетерохроматиновое состояние требует ряда изменений в модификациях гистонов
(а) Активные гены маркированы H3K4me2 и me3; эта метка, если присутствует, предположительно должна быть удалена LSD1 (у Drosophila пока еще не охарактеризован). В эухроматине НЗК9 в норме апетилирован; эта метка должна быть удалена деацетилазой гистонов, HDAC1. Фосфорилирование H3S10 может интерферировать с метилированием НЗК9; дефосфорилирование, по-видимому, происходит с участием фосфатазы, «нацеливаемой» взаимодействием с карбоксильным концом киназы JIL1 Эти переходы создают обстановку для приобретения модификаций, связанных с сайленсингом (показано на б), в том числе метилирования НЗК9 белком SU(VAR)3-9, связывания НР1 и последующего метилирования Н4К20 белком SUV4-20, ферментом, рекрутируемым НР1. Может также происходить метилирование НЗК27 энзимом E(Z)
Рис. 5.6. Переход из эухроматинового состояния в гетерохроматиновое состояние требует ряда изменений в модификациях гистонов
(а) Активные гены маркированы H3K4me2 и me3; эта метка, если присутствует, предположительно должна быть удалена LSD1 (у Drosophila пока еще не охарактеризован). В эухроматине НЗК9 в норме апетилирован; эта метка должна быть удалена деацетилазой гистонов, HDAC1. Фосфорилирование H3S10 может интерферировать с метилированием НЗК9; дефосфорилирование, по-видимому, происходит с участием фосфатазы, «нацеливаемой» взаимодействием с карбоксильным концом киназы JIL1 Эти переходы создают обстановку для приобретения модификаций, связанных с сайленсингом (показано на б), в том числе метилирования НЗК9 белком SU(VAR)3-9, связывания НР1 и последующего метилирования Н4К20 белком SUV4-20, ферментом, рекрутируемым НР1. Может также происходить метилирование НЗК27 энзимом E(Z)
В целом гетерохроматиновые массы видны на периферии ядра и вокруг ядрышка. У эмбрионов Drosophila эта тенденция выражена еще более отчетливо. Гетерохроматиновые массы впервые видны в раннем эмбриогнезе, когда ядра перемещаются к периферии яйца. Раннее развитие у Drosophila является синцитиальным вплоть до 14-го цикла ядерных делений, когда образуются клеточные стенки между ядрами, и образуется типичная бластула (шарик из клеток). Гетерохромати новый материал (центромеры, четвертая хромосома) концентрируется на одной стороне ядра, ориентированной в сторону внешней поверхности яйца (Foe and Alberts, 1985). Такое пространственное подразделение ядра сохраняется в ходе развития, приводя к концепции [the concept] гетерохроматиновых «компартментов» в ядре. Эти компартменты могут поддерживать высокую концентрацию факторов, необходимых для формирования гетерохроматина (таких как НР1 и HKMTs), и в то же время могут быть лишены факторов, необходимых для сборки эухроматина и экспрессии генов (таких как HATs и RNA pol II). Действительно, было показано, что близость к гетерохроматиновым массам, как по положению вдоль по длине хромосомы, так и в трех измерениях, является одним из факторов в PEV. Было показано, что близость к массе центрического [centric] гетерохроматина влияет на мозаицизм как для эухроматиновых генов (примером которых является white; см. выше), так и для гетерохроматиновых генов (наиболее изученными примерами которых являются light и rolled). Можно наблюдать, что гетерохроматиновые гены, картированные в эти домены, обнаруживают мозаичность, когда перестройка помещает их в непосредственной близости от эухроматина; обычно они демонстрируют противоположную зависимость, требуя для полной экспрессии нормальных уровней HP 1 и показывая усиление мозаичности, когда количество НР1 мало. Мозаицизм light зависит не только от его близости к эухроматину, но и от положения точки разрыва а именно от расстояния от гетерохроматина, измеряемого по длине хромосомного плеча (Wakimoto and Hearn 1990). Аналогичные данные были опубликованы для rolled. Исследования brown dominant (bwD), эухроматинового гена, мозаицизм экспрессии которого был индуцирован вставкой повторяющейся ДНК, показали, что сдвиг в степени близости этого локуса к центрическому гетерохроматину может приводить к усилению сайленсинга (если ближе) или подавлению сайленсинга (если дальше) (Henikoff et al., 1995). Аналогичным образом транслокация четвертой хромосомы, несушей репортер white, в дистальную половину хромосомного плеча 2L или 2R приводит к резкой утрате сайленсинга; в ядрах слюнных желез это коррелирует с изменением во внутриядерном расположении, вплоть до того, что часто оказываются занятыми сайты, удаленные от хромоцентра (Cryder-manetal., 1999а). В недавнем исследовании с использованием микроскопии высокого разрешения изучали как активность гена (используя антитела, специфичные к продукту), так и ядерную локализацию репортера (используя FISH — fluorescence in situ hybridization) в одной и той же клетке в нормальных временных рамках экспрессии. Инверсия, вызывающая мозаицизм white, а также bwD и трансген lacZ с мозаичной экспрессией изучались в дифференцирующихся глазных дисках или в глазах взрослых мух. В этом исследовании обнаружили сильную корреляцию между положением репортерного гена в клеточном ядре по отношению к перицентромерному гетерохроматину и уровнем экспрессии, что говорило в пользу существования гетерохроматинового «компартмента» и корреляции между положением в этом компартменте и сайленсингом гена (Harmon and Sedat, 2005). Однако эта корреляция не является абсолютной. Это неудивительно, при том что исследования с репортером white указывают на присутствие как эухроматиновых, так и гетерохроматиновых доменов, чередующихся в маленькой четвертой хромосоме (которая всегда располагается вблизи массы перицентромерного гетерохроматина). Эти последние наблюдения указывают на другие локальные детерминанты, вносящие вклад в упаковку хроматина в той или в другой форме. У D. melanogaster, согласно оценке по цитологическим критериям, одна треть генома является гетерохроматиновой. Сюда входят крупные блоки, которые фланкируют центромеры, более мелкие блоки, связанные с теломерами, вся Y-хромосома и большая часть маленькой четвертой хромосомы. Центромерные районы состоят из крупных (0,2—1 млн о.) блоков сателлитной ДНК, чередующихся с «островками» сложных нуклеотидных последовательностей, обычно мобильных элементов (Le et al., 1995). Эти районы, хотя и бедны генами, не лишены их вовсе; согласно современным оценкам, в перицентромерном гетерохроматине находятся несколько сотен генов (Hoskins et al., 2002). Теломеры Drosophila не содержат типичных повторов, обогащенных G, которые наблюдаются в других местах, но состоят из копий ретротранспозонов НеТ-А и TART. Ассоциированные с теломерами последовательности (TAS — telomere-associated sequences), блоки из повторов 102—103 нуклеотидов, обнаруживаются в проксимальном положении, и трансгенные репортеры white, вставленные в эти районы, демонстрируют мозаичный фенотип. Хотя Y-хромосома и несет гены для ряда факторов мужской фертильности, основная масса этой хромосомы составлена из сателлитной ДНК, и она остается конденсированной во всех клетках за исключением мужской зародышевой линии. Размеры маленькой четвертой хромосомы порядка 4,3 млн о., в том числе около 3 млн о., состоящих из сателлитной ДНК. Дистальные 1,2 млн о. могут считаться эухроматиновыми в том отношении, что они политенизированы в слюнной железе (см. рис. 5.4), но, судя по их поздней репликации, полному отсутствию в них меиотических обменов и по их связи с НР1, НР2 и H3K9me2, они, по-видимому, являются гетерохроматиновыми (рис. 5.4). Плотность фрагментов транспозонов в этом районе в шесть—семь раз выше, чем в эухроматиновых плечах, подобно участкам на границе между центрическим гетерохроматином и эухроматином на других хромосомах (Kaminker et al., 2002). Интересно, что в исследованиях четвертой хромосомы с помощью P-элемента с репортером white, обсуждавшегося выше (рис. 5.3а), обнаружили чередование как эухроматиновых доменов (приводящих к «красноглазому» фенотипу) так и гетерохроматиновых доменов (приводящих к мозаичному фенотипу) (Sun et al., 2004). Эти данные заставляют предполагать присутствие локальных элементов в ДНК, способных управлять формированием гетерохроматина или эухроматина. Генетический скрининг на переключение фенотипа (с красной окраски на мозаичность и наоборот) показал, что локальные делеции или дупликации 5—80 т.о. ДНК, фланкирующей транспозонный репортер, могут приводить к утрате или приобретению мозаичности, указывая на наличие cis-действующих (на короткие расстояния) детерминантов сайленсинга (рис. 5.7). Этот сайленсинг зависит от НР1 и коррелирует с изменением в структуре хроматина, как показывает изменение в доступности для нуклеаз; все это указывает на сдвиг от эухроматинового к гетерохроматиновому состоянию. Данные по картированию в одном из районов четвертой хромосомы позволяют предполагать, что транспозон 1360 является мишенью для формирования гетерохроматина, и показывают, что, коль скоро формирование гетерохроматина начинается в диспергированных повторяющихся элементах, оно может распространяться вдоль по длине четвертой хромосомы примерно на 10 т.о. или пока не столкнется с конкуренцией со стороны эухроматинового детерминанта (Sun et al., 2004). Наблюдения, показывающие, что тандемные или инвертированные повторы репортерных Р- элементов приводят к формированию гетерохроматина и сайленсингу генов, также позволяют предполагать наличие действующих на короткие расстояния cis-активных детерминантов, связанных с числом копий (Dorer and Henikoff, 1994). Такие cis-активные элементы в ДНК могли бы функционировать посредством сиквенс-специфичного связывания белка, способного включать формирование гетерохроматина Были идентифицированы белки, специфически связывающиеся с некоторыми из сателлитных ДНК (например, D1 — Aulner et al., 2002). Вывод о важности этих взаимодействий был сделан, исходя из влияния специфичных для сателлитной ДНК веществ, связывающихся с ДНК и способных подавлять PEV (Janssen et al., 2000). Однако данные, полученные на дрожжах и растениях (Elgin and Grewal, 2003; Matzke and Birchler, 2005; см. Главы 8 и 9), позволяют предложить другую модель, а именно, что некий основанный на RNAi механизм мог бы использоваться для «нацеливания» формирования гетерохроматина на повторяющиеся элементы. Работы из нескольких лабораторий показали, что система RNAi у Drosophila имеется и играет важную роль в регуляции в ходе развития посредством посттранскрипционного сайленсинга генов (PTGS). D. melanogaster обладает двумя генами, кодирующими белки DICER, и многочисленными генами (aubergine, AGO1, AGO2, spindle [известный также как homeless], vasa intronic gene [VIG], armitage, Fmr1), кодирующими компоненты или белки, необходимые для сборки индуцируемого РНК сайленсирующего комплекса (RISC) (Sontheimer, 2005). Участие этой системы предположили в PTGS повторяющихся последовательностей, особенно тандемно повторяющихся генов Stellate, нескольких ретротранспозонов и трансгенов Alcohol dehy-rogenase (Adh) и в транскрипционном сайленсинге (TGS) трансгенов Adh (Aravin et al., 2001; Pal-Bhadra et al., 2002). Пал-Бхадра с соавторами (Pal-Bhadra et al., 2004) обнаружили при прямом тестировании, что мутации вpiwi (член семейства домена PAZ) и homeless (DEAD-боксовая геликаза) подавляют PEV, связанный с тандемными порядками гена white, и что мутации в piwi, aubergine и homeless подавляют сайленсинг трансгена white P[hsp70-w] в перицентромерном гетерохроматине или четвертой хромосоме. Эта супрессия PEV была связана со значительным снижением уровня метилирования H3K9. Связанные с повторами малые интерферирующие РНК (rasiRNAs) были идентифицированы с 40 % известных мобильных элементов (включая 1360) и других повторяющихся последовательностей (Aravin et al., 2003).
 Рис. 5.7. Возможная модель гетерохроматинового «нацеливания»
dsRNA с повторяющихся последовательностей процессируется с помощью RISC и генерирует гипотетический «комплекс нацеливания», который управляет либо модификацией гистонов, либо ассоциацией с НР1 как начальным этапом в сборке гетерохроматина в сайте, идентифицированном малой ssRNA. Данные, полученные на четвертой хромосоме, позволяют предположить, что фрагменты ДНК-транспозона 1360 (оранжевые полосы) являются мишенью для формирования гетерохроматина: локальные делеции или дупликации, которые сдвигают положение репортера R-элемента (треугольник) в сторону от элемента 1360, ведут к утрате сайленсинга (красный треугольник обозначает красный глаз), тогда как близость к 1360 приводит к сайленсингу (треугольник с точками обозначает мозаичный глаз) (на основе данных Sun et al., 2004)
Рис. 5.7. Возможная модель гетерохроматинового «нацеливания»
dsRNA с повторяющихся последовательностей процессируется с помощью RISC и генерирует гипотетический «комплекс нацеливания», который управляет либо модификацией гистонов, либо ассоциацией с НР1 как начальным этапом в сборке гетерохроматина в сайте, идентифицированном малой ssRNA. Данные, полученные на четвертой хромосоме, позволяют предположить, что фрагменты ДНК-транспозона 1360 (оранжевые полосы) являются мишенью для формирования гетерохроматина: локальные делеции или дупликации, которые сдвигают положение репортера R-элемента (треугольник) в сторону от элемента 1360, ведут к утрате сайленсинга (красный треугольник обозначает красный глаз), тогда как близость к 1360 приводит к сайленсингу (треугольник с точками обозначает мозаичный глаз) (на основе данных Sun et al., 2004)
В совокупности эти обсуждавшиеся выше результаты заставляют предполагать, что формирование гетерохроматина может зависеть как от ядерной локализации (возможно, создающих богатый пул требующихся белков), так и от специфического «нацеливания» на основе RNAi-распознавания и процессинга двунитевой РНК с повторяющихся элементов, в особенности некоторых из ДНК-транспозонов. Такое «нацеливание» посредством RISC могло бы привлечь либо метилтрансферазу гистона H3, либо комплекс, включающий НР1 (либо и то, и другое) к сайту для включения процесса сборки, обсуждавшегося в разделе 4.
7. Не весь гетерохроматин идентичен
Хотя в общих терминах гетерохроматин был описан выше, ясно, что гетерохроматиновые домены варьируют в деталях. Все гетерохроматиновые домены характеризуются повторяющейся ДНК (см. выше), но это может варьировать от тандемных последовательностей коротких повторов (сателлитная ДНК), обнаруживаемых в блоках в центромерных районах, до высокой плотности перемежающихся повторяющихся последовательностей, что наблюдается в четвертой хромосоме. В то время как все гетерохроматиновые районы, по-видимому, ассоциированы с НР1 и H3K9me2, ясно, что связанные с этим белковые комплексы должны отличаться в иных отношениях. Исследование влияния 70 разных модификаторов на разные гены, демонстрирующие мозаицизм (в том числе wт4, bwD, репортеры R-элемента в перицентромерном гетерохроматине или в порядке [array] TAS), показало, что на фоне существенного перекрывания в мишенях модификаторов имеет место удивительная сложность. С помощью использованного набора тестов эти модификаторы разделили на семь разных групп с точки зрения их способности влиять на сайленсинг в данном компартменте (Donaldson et al., 2002). Интересно, что единственным модификатором в этой группе, влияющим на сайленсинг в порядке TAS, была новая аллель Su(var)3-9. Эти различия несомненно отражают изменения в локальной биохимии или в энзимах, используемых для этого. Например, цитологические результаты показывают, что в то время, как H3K9me2 сильно концентрируется вдоль по длине четвертой хромосомы, ответственный за это энзим — это не SU(VAR)3-9 (Schotta et al., 2002; К.A. Haynes et al., неопубликовано). Даже в пределах перицентромерного гетерохроматина следует ожидать мозаицизм, принимая во внимание различия в составляющих его основу блоках ДНК, которые варьируют от сателлитной ДНК до кластеров перемежающихся повторов (Le et al., 1995), которые могли бы использовать разную смесь гетерохроматиновых белков. Последствия были видны в исследованиях, где изучали влияние разных блоков перицентромерного гетерохроматина на экспрессию с репортера, и можно было наблюдать, что степень выраженности [severity] фенотипа зависит не просто от количества гетерохроматина в cis-конфигурации, но варьирует в зависимости от локального гетерохроматинового окружения (Howe et al., 1995). Связанные с гетерохроматином белки, которые могут играть роль в специфических субдоменах, включают AT-hook белок D1, преимущественно связанный с сателлитом III с плотностью 1,688 г/см3 (Aulner et al., 2002), и DDP1, мульти-КН-доменный белок, гомологичный вигилину, который связывается с богатой пиримидинами С-нитью додекасателлита (Cortes and Azonn, 2000).8. PEV, формирование гетерохроматина и сайленсинг генов у различных организмов
Явление мозаицизма, обусловленного эффектом положения (PEV), первоначально было установлено на Drosophla просто потому, что это был один из первых организмов, на которых для получения мутаций было использовано Х-излучение. Х-излучение с гораздо большей вероятностью, чем другие обычно используемые мутагены, индуцирует хромосомные перестройки, результатом которых может быть PEV. Сходные мутации были изолированы у мышей, где пятнистая окраска меха указывает на PEV. Генетический анализ выявил вставку аутосомного района, несущего аллели дикого типа генов окраски меха, в Х-хромосому (Cattanach, 1961; Russel and Bangham, 1961). Мозаичность наблюдается только у самок, несущих эту вставку в сочетании с гомозиготной мутацией в исходных генах окраски меха. У этих самок аллель дикого типа становится инактивированной вследствие Х-инактивации путем гетерохроматинизации (глава 17). У растений единственный несомненный случай PEV был описан у Oenothera blandina (Catcheside, 1939). В этих случаях, как и у Drosophila, PEV-сайленсинг эухроматиновых генов связан с перемещением этих генов в новое гетерохроматиновое окружение. Транскрипционный сайленсинг генов наблюдали также для повторяющихся последовательностей (RIGS; repeat-induced gene silencing), особенно у растений. Анализ затрагиваемых последовательностей обнаружил появление эпигенетических меток (метилирование гистонов и ДНК), аналогичных тем, которые обнаруживаются в гетерохроматине и в районах, сайленсированных PEV. Если ввести в Arabidopsis фрагменты ДНК, содержащие тандемно расположенные гены люциферазы, наблюдается мозаичная экспрессия люциферазы. Опять-таки, за наблюдаемый сайленсинг генов отвечает формирование гетерохроматина. Лежащие в основе этого молекулярные механизмы консервативны у высших эукариотических организмов. Центральной особенностью сайленсинга гетерохроматиновых генов у Drosophila является взаимодействие НР1 с H3K9me2 и HKMT SU(VAR)3-9. НР1 консервативен от дрожжей Schizosaccharomyces pombe до человека и неизменно связан с перицентромерным гетерохроматином. Гены НР1 человека можно использовать для «спасения» нехваток [deficiency] у Drosophila (Ма et al., 2001). Однако у растений НР1 как таковой не был идентифицирован. SU(VAR)3-9 представлен еще более широко, будучи идентифицирован у дробянковых дрожжей (Clr4), Neurospora (DIM5), Arabidopsis и млекопитающих (SUV39H). Все эти гомологи (SU(VAR)3-9 катализируют метилирование H3K9 и функционируют в формировании гетерохроматина. Опять-таки, трансген SUV39H1 человека может полностью компенсировать утрату эндогенного белка в мутантных линиях Drosophila (Schotta et al., 2002). У высших растений (Arabidopsis, рис и кукуруза) обнаружено несколько белков (SUVH), гомологичных SU(VAR)3-9 (Baumbusch et al, 2001). Большое число HKMTs может отражать пластичность развития у растений или необходимость реагировать на факторы внешней среды (см. дальнейшее обсуждение в главе 9). Четыре белка SUVH — SUVH1, SUVH2, SUVH4 (KYP) и SUVH6 - были изучены детально (Jackson et al., 2002; Naumann et al., 2005). Bee они оказались метилтрансферазами H3K9 гистонов. SUVH2 играет центральную роль в контроле состояний гетерохроматина, обнаруживая зависимое от дозы влияние на формирование гетерохроматина, подобное тому, что сообщалось для SU(VAR)3-9 Drosophila (Naumann et al., 2005). Утрата функции SUVH2 сильно подавляет зависимый от повторов сайленсинг, а сверхэкспрессия вызывает значительное усиление такого сайленсинга у растений с люциферазными трансгенами. Другие гены, идентифицированные с помощью мутаций Su(var) Drosophila, кодируют белки с консервативными функциями. HKMT SUV4-20 была охарактеризована у млекопитающих и у Drosophila (Schotta et al., 2004). У этих организмов она контролирует триметилирование по H4K20. Деметилазы гистонов, ацетилазы и деацетилазы также являются консервативными (Т. Rudolph et al., неопубликовано). Эволюционный консерватизм многих ключевых энзимов, контролирующих модификацию гистонов, говорит в пользу идеи гистонового кода (Jenuwein and Allis, 2001). Однако изучение специфичных для хроматина меток модификации гистонов, наблюдающихся у Drosophila, млекопитающих и растений (Arabidopsis), выявляет и некоторые специфичные для рода элементы. В число существенных признаков конститутивного гетерохроматина у млекопитающих входят H3K9me3, H3K27me1 и H4K20me3 (Peters etal., 2003; Rice etal., 2003; Schotta et al., 2004). Гетерохроматин Drosophila характеризуется H3K9me1/me2, H3K27me1/me2/me3 и H4K20me3 (Schotta et al., 2002, 2004; Ebert et al., 2004). В противоположность млекопитающим у Drosophila H3K9me3 недопредставлен. У млекопитающих H3K9me1 не является меткой гетерохроматина. У Arabidopsis, как у Drosophila, H3K9me1/me2 — метки гетерохроматина, тогда как H3K9me3 — эухроматиновая метка (Naumann et al., 2005). H3K27me1 и H3K27me2 являются гетерохроматиновыми метками у Arabidopsis, тогда как эти же метки у Drosophila обнаруживаются в эухроматине и гетерохроматине. H3K27me3 — исключительно эухроматиновая метка у Arabidopsis. H4K20mel у Arabidopsis является гетерохроматиновым, но H4K20me2 и H4K20me3 — эухроматиновыми. Еще одно бросающееся в глаза различие между Arabidopsis и животными касается хромосомного распределения фосфорилирования H3S10. Эта метка является гетерохроматиновой у Arabidopsis (A. Fischer and G. Reuter, неопубликовано), но эухроматиновой у Drosophila (Wang et al., 2001; Ebert et al., 2004). Сходство и различие в специфичных для гетерохроматина метках модификации гистонов между млекопитающими, Drosophila и Arabidopsis несомненно указывают на то, что гистоновый код не является полностью универсальным, а, скорее, существует в виде разных диалектов. -9. Подведение итогов: мы не знаем о гетерохроматине очень многое
Хотя PEV предоставил нам чрезвычайные возможности для изучения формирования гетерохроматина и сайленсинга генов, сам этот фенотип остается загадочным. Почему мы наблюдаем мозаичный паттерн сайленсинга? Что нарушает равновесие, приводя к переключению с активного состояния в «молчащее» или наоборот? Почему этот эффект оказывается клонально наследуемым? PEV обычно анализируется как проблема поддержания репортерного гена в состоянии «ВКЛЮЧЕНО» или «ВЫКЛЮЧЕНО», но во многих случаях (особенно при использовании репортеров на базе Р-элемента) наблюдаются красные фасетки на желтом или бледно-оранжевом фоне, заставляя предполагать, что экспрессия генов была снижена единообразно, но что в некоторых клетках эта даун-регуляция была утрачена. Тщательный анализ таких линий мог бы привести к идентификации состояний хроматина с промежуточным влиянием на экспрессию генов. Хотя эти данные свидетельствуют в пользу грубой модели утраты или поддержания сайленсинга на основе действия масс, окончательная модель будет сложной, включающей многочисленные взаимодействующие белки (см., например, предложения Henikoff, 1996) Соблазнительно рассматривать нуклеосому как суммирующее устройство, собирающее модификации и выдающее результаты в терминах как конкретных паттернов связывания белков, так и возможности ремоделинга в этом районе. Состояние хроматина могло бы тогда отражать результаты конкуренции за достижение различных модификаций. Такая модель могла бы быть полезной в рассортировке отмеченных выше эффектов. Она также совместима с наблюдениями, показывающими, что частота сайленсинга репортера, зависимого от GAL4, чувствительна к уровню содержания GAL4 (Ahmad and Henikoff, 2001). Система RNAi обеспечивает правдоподобный механизм «нацеливания» формирования гетерохроматина предположительно путем «нацеливания» комплекса, включающего НР1, HKMT H3K9 или оба этих белка. Однако многие вопросы остаются открытыми. Каков источник dsRNA? Должна ли эта РНК продуцироваться в cis-конфигурации (на что указывают результаты, полученные на S. pombe) или же она может действовать в trans-конфигурации (что заставляют предполагать результаты, полученные на растениях); т.е. может ли образование dsRNA с одного сайта 1360 привести к «нацеливанию» на все сайты 1360? Являются ли все повторяющиеся элементы потенциальными мишенями? Это кажется маловероятным, если учесть описанные выше данные анализа четвертой хромосомы. Если ключевую роль играет выборка повторяющихся элементов, что определяет этот выбор? Результаты, полученные на четвертой хромосоме, свидетельствуют, что плотность и распределение критичных повторяющихся элементов будет влиять на экспрессию генов, находящихся поблизости. Это говорит о необходимости выявлять этот признак при секвенировании генома. Каким образом осуществляется распространение гетерохроматина и что является нормальными барьерами для такого распространения? Отметим, что нет никаких данных в пользу транзитивной RNAi у Drosophila, т.е. распространения сайленсинга на мишени в транскрипте, лежащие «вверх по течению» от последовательности dsRNA (Celotto and Gravely, 2002). Это согласуется с отсутствием доказательств в пользу какой-либо зависимой от РНК РНК-полимеразы в этой системе. Система сборки на основе взаимодействий НР1, H3K9me2 и HKMT вполне могла бы объяснить распространение гетерохроматина приблизительно на 10 т.о., как это наблюдается на четвертой хромосоме; этот тип распространения мог бы ограничиваться сайтом ацетилирования гистонов. Но что можно сказать о распространении, происходящем в перестройках, которое, как оказалось, простирается на сотни тысяч оснований? Эта форма распространения не является непрерывной [contiguous], но, опять-таки, критически зависит от белков хроматина, в особенности от JIL-1, выступающего в роли, которая не зависит от его киназной активности. Эти и другие вопросы остаются без ответа.Благодарности
Мы благодарим Gabriella Farkas за создание используемых здесь рисунков, Anja Ebert за иммунопитологические фотографии и членов наших исследовательских групп за критический просмотр этой главы. Наша работа поддержана Deutsche Forschungsgemeinschaft и Epigenome Network of Excelelnce of the European Union (G.R.) и грантами National Institutes of Health (S.C.R.E.).Литература
Ahmad K. and Henikoff S. 2001. Modulation of a transcription factor counteracts heterochromatin gene silencing in Drosophila. Cell 104: 839-847. Aravin A.A., Numova H. M., Tulin A. V., Vagin, V.V., Rozovsky Y.M., and Gvozdev V.A. 2001. Double-stranded RNA-mediated silencing of genomic tandem repeats and transposable elements in the D. melanogaster germline. Curr. Biol. 11: 1017-1027. Aravin A. A., Lagos-Quintana M.. Yalcin A., Zavolan M., Marks D., Snyder B., Gaasterland T., Meyer J., and Tuschl T. 2003. The small RNA profile during Drosophila melanogaster development. Dev. Cell 5: 337-350. Ashbumer M., Golic K.G., and Hawley R.S. 2005a. Chromosomes. In Drosophila: A laboratory handbook. 2nd edition. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, pp. 24-57. Ashbumer M., Golic K.G., and Hawley R.S. 2005b. Position effect variegation. In Drosophila: A laboratory handbook, 2nd edition. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, pp. 1007-1049. Aulner N., Monod C, Mandicourt G., Jullien D., Cuvier O., Sail A., Janssen S., Laemmli U.K, and Kas E. 2002. The AT-hook protein D1 is essential for Drosophila melanogaster development and is implicated in position-effect variegation. Mol. Cell. Biol. 22: 1218-1232. BaksaK., Morawietz H., Dombradi V., Axton M., Taubert H., Szabo G., Torok I., Gyurkovics H., Szoor B., Gloover D., et al., 1993. Mutations in the phosphatase 1 gene at 87B can differentially affect suppression of position-effect variegation and mitosis in Drosophila melanogaster. Genetics 135: 117-125. Bannister A.J., Zegermann P., Patridge J.F., Miska E.A., Thomas J.O., Allshire T.C., and Kouzarides T. 2001. Selective recognition of methylated lysine 9 on histone H3 by the HP1 chromo domain. Nature 410: 120-124. Baumbusch L.O., ThorstensenT., Krauss V., Fischer A., Naumann K., Assalkhou R., Schulz I., Reuter G., and Aalen R. 2001. The Arabidopsis thaliana genome contains at least 29 active genes encoding SET domain proteins that can be assigned to four evolutionary conserved classes. Nucleic Acids Res. 29: 4319-4333. Belyaeva E.S., Demakova O.V., Umbetova G.H., and Zhimulev I.F. 1993. Cytogenetic and molecular aspects of position-effect variegation in Drosophila melanogaster V. Heterochromatin-associated protein HP1 appears in euchromatic chromosoma] regions that are inactivated as a result of position-effect variegation. Chromosoma 102: 583-590. Bender W., Spierer P., and Hogness D.S. 1983. Chromosome walking and r jumping to isolate DNA from the Ace and rosy loci and the bithorax complex of Drosophila melanogaster. J. Mol. Biol.168: 17-33. Birchler J.A., BhadraU., Rabinow L., Linsk R., and Nguyen-Huyuh A.T. 1994. Weakener of white (Wow), a gene that modifies the expression of white eye color locus and that suppresses position effect variegation in Drosophila melanogaster. Genetics 137: 1057-1070. Bird A. 2002. DNA methylation patterns and epigenetic memory. Genes Dev. 16: 6-21. Bushey D. and Locke J. 2004. Mutations in Su(var)205 and Su(var)3-7 suppress P-element-dependent silencing in Drosophila melanogaster. Genetics 168: 1395-1411. Catcheside D.G. 1939. A position effect in Oenothera. J. Genet. 38: 345-352. Cattanach B.M. 1961. A chemically-induced variegated-type position effect in the mouse. Z. Vererbungsl. 92: 165-182. Celotto A.M. and Graveley B.R. 2002 Exon-specific RNAi: A tool for dissecting the functional relevance of alternative splicing. RNA 8: 718-724. Cleard F. and Spierer P. 2001. Position-effect variegation in Drosophila: The modifier Su(var)3-7 is a modular DNA-binding protein. EMBO Rep. 21: 1095-1100. Cleard E, Delattre M., and Spierer P. 1997. SU(VAR)3-7 a Drosophila heterochromatin-associated protein and companion of HP1 in the genomic silencing of position-effect variegation. EMBO J. 16: 5280-5288. Cooper K.W. 1959. Cytogenetic analysis of major heterochromatic elements (especially Xh and Y) in Drosophila melanogaster and the theory of “heterochromatin”. Chromosoma 10: 535-588. Cortes A. and Azorin F. 2000. DDP1, a heterochromatin-asociated multi-KH-domain protein of Drosophila melanogaster, interacts specifically with centromeric satellite DNA sequences. Mol. Cell. Biol. 20: 3860-3869. Cryderman D.E., Morris E.J., Biessmann H., Elgin S.C.R., and Wallrath L.L. 1999a. Silencing at Drosophila telomeres: Nuclear organization and chromatin structure play critical roles. EMBO J. 18: 3724-3735. Cryderman D. E., Tang H., Bell C, Gilmour D.S., and Wallrath L.L. 1999b. Heterochromatic silencing of Drosophila heat shock genes acts at the level of promoter potentiation. Nucleic Acids Res. 27: 3364-3370. Czermin B., Schotta G., Hblsmann B.B., Brehm A., Becker P.B., Reuter G., and Imhof A. 2001. Physical and functional interaction of SU(VAR)3-9 and HDAC1 m Drosophila. EMBO Rep. 2: 915-919. Delattre M., Spierer A., Tonka C.H., and Spierer P. 2000. The genomic silencing of position-effect variegation in Drosophila melanogaster. Interaction between the heterochromatm-associated proteins Su(var)3-7 and HP1. J. Cell Sci. 113: 4253-4261 Demerec M. and Slizynska H. 1937. Mottled white 258-18 of Drosophila melanogaster. Genetics 22: 641-649. Donaldson K.M., Lui A., and Karpen G.H. 2002. Modifiers of terminal deficiency-associated position effect variegation in Drosophila. Genetics 160: 995-1009. Dorer D.R. and Henikoff S. 1994. Expansion of transgene repeats causes heterochromatin formation and gene silencing in Drosophila. Cell 77: 993-1002. Dorn R., Krauss V., Reuter G., and Saumweber H. 1993a. The enhancer of position-effect variegation E(var)93D, codes for a chromatin protein containing a conserved domain common to several transcriptional regulators. Proc. Natl. Acad. Sci. 90: 11376-11380. Dorn R., Szidonya J., Korge G., Sehnen M., Taubert H., Archouk-ieh I., Tschiersch B., Morawietz H., Wustmann G., Hoffmann G., and Reuter G. 1993b. P Transposon-induced dominant enhancer mutations of position-effect variegation in Drosophila melanogaster. Genetics 133: 279-290. Ebert A., Schotta G., Lein S., Kubicek S., Krauss V., Jenuwein T., and Reuter G. 2004. Su(var) genes regulate the balance between euchromatin and heterochromatin in Drosophila. Genes Dev. 18: 2973-2983. Eissenberg J.C., Morris G.D., Reuter G., and Hartnett T. 1992. The heterochromatin-associated protein HP-1 is an essential protein in Drosophila with dosage-dependent effects on position-effect variegation. Genetics 131: 345-352. Eissenberg J.C., James T.C., Foster-Hartnett D.M., Hartnett T., Ngan V., and Elgin S.C.R. 1990. A mutation in a heterochromatin-specific chromosomal protein is associated with suppression of position effect variegation in Drosophila melanogaster. Proc. Natl. Acad. Sci. 87: 9923-9927. Elgin S.C.R. and Grewal S.I.S. 2003. Heterochromatin: Silence is Golden. Curr. Biol. 13: R895-R898. Fanti L. and Pimpinelli S. 2004. Immunostaining of squash preparations of chromosomes of larval brains. Methods Mol. Biol. 247: 353-361. Fanti L., Giovinazzo G., Berloco M., and Pimpinelli S. 1998. The heterochromatin protein 1 prevents telomere fusions in Drosophila. Mol. Cell 2: 527-538. Farkas G., Gausz J., Galloni M., Reuter G., Gyurkovics H., and Krach F. 1994. The trithorax-like gene encodes the Drosophila GAGA factor. Nature 371: 806-808. Fischle W., Wang Y.. Jacobs S.A., Kim Y., Allis C.D., and Khorasani-zadeh S. 2003. Molecular basis for the discrimination of repres sive methyl-lysine marks in histone H3 by Polycomb and HP1 chromodomains. Genes Dev. 17: 1870-1881. Flybase 2005. The Drosophila database. Available from World Wide Web at the URLs http://morganZharvard.edu and http://www.ebi.ac.uk/flybase/ Foe V.E. and Alberts B.M. 1985. Reversible chromosome condensation induced in Drosophila embryos by anoxia: Visualization of interphase nuclear organization. /. Cell Biol. 100: 1623-1636. Harmon B. and Sedat J. 2005. Cell-by-cell dissection of gene expression and chromosomal interactions reveals consequences of nuclear reorganization. PLoS Biol. 3: e67. Hartmann-Goldstein I. J. 1967. On the relationship between hetero-chromatization and variegation in Drosophila, with special reference to temperature sensitive periods. Genet. Res. 10: 143-159. Henikoff S. 1996. Dosage-dependent modification of position-effect variegation in Drosophila. Bio Essays 18: 401-409. Henikoff S., Jackson J.M., and Talbert P.B. 1995. Distance and pairing effects on the brownDominant heterochromatic element in Drosophila. Genetics 140: 1007-1017. Hoskins R.A., Smith C.D., Carlson J.W., Carvalho A.B., Halpem A., Kaminker J.S., Kennedey C, Mungall C.J., Sullivan B.A., Sutton G.G., et al., 2002. Heterochromatic sequences in a Drosophila whole-genome shotgun assembly. Genome Biol. 3: RESEARCH0085 Howe M., Dimitri P., Berloco M.. and Wakimoto B.T 1995. cis-effects of heterochromatin on heterochromatic and euchromatic gene activity in Drosophila melanogaster. Genetics. 140: 1033-1045. Jackson J.P., Lindroth A.M., CaoX., and Jacobsen S.E. 2002. Control of CpNpG DNA methylation by the KRYPONITE histone H3 methyl -transferase. Nature 416: 556-560. James T.C. and Elgin S.C.R. 1986. Identification of a nonhistone chromosomal protein associated with heterochromatin in Drosophila melanogaster and its gene. Mol. Cell Biol. 6: 3862-3872. James T.C, Eissenberg J.C, Craig C, Dietrich V., Hobson A., and Elgin S.C.R. 1989. Distribution patterns of HP1, a heterochromatin-associated nonhistone chromosomal protein of Drosophila Eur. J. Cell Biol. 50: 170-180. Janssen S., Cuvier O., Muller M, and Laemmli U.K. 2000. Specific gain- and loss-of-function phenotypes induced by satellite-specific DNA-binding drugs fed to Drosophila melanogaster. Mol Cell 6: 1013-1024. Jenuwein T. and Allis CD. 2001. Translating the histone code. Science 293: 1074-1080. Jones R.S. and Gelbart W.M. 1993. The Drosophila Polycomb-group gene Enhancer of zeste contains a region with sequence similarity to trithorax. Mol. Cell. Biol. 13: 6357-6366. Kaminker J.S. Bergman CM., Kronmiller B., Carlson J., Svir-skas R., Patel S., Frise E., Wheeler D.A., Lewis S.E., Rubin CM., et al., 2002. The transposable elements of the Drosophila melanogaster genome: A genomics perspective. Genome Biol. 3: RESEARCH0084. Karpen G.H. and Spradling A.C. 1990. Reduced DNA polytenization of a minichromosorne region undergoing position-effect variegation in Drosophila. Cell 63: 97-107. Krauss V. and Reuter G. 2000. Two genes become one: The genes encoding heterochromatin protein SU(VAR)3-9 and translation initiation factor subunit elF-2y are joined to a dicistronic unit in holometabolic insects. Genetics 156: 1157-1167. Kunert N., Marhold J., Stanke J., Stach D., and Lyko F. 2003. A Dnmt2-like protein mediates DNA methylation in Drosophila. Development 130: 5083-5090. Lachner M., O’Carroll D., Rea S., Mechtler K., and Jenuwein T. 2001. Methylation of histone H3 lysine 9 creates a binding site for HP1 proteins. Nature 410: 116-120. Laible G., Wolf A., Dorn R., Reuter C, Nislow C, Lebesorger A., Popkin D., Pillus L., and Jenuwein T 1997. Mammalian homo-logues of the Polycomb-group gene Enhancer of zeste mediate gene silencing in Drosophila heterochromatin and at S. cerevisiae. EMBO J. 16: 3219-3232. Larsson J., Zhang J., and Rasmuson-Lestander A. 1996. Mutations in the Drosophila melanogaster S-adenosylmethionine synthase suppress position-effect variegation. Genetics 143: 887-896. Le M.H., Duricka D., and Karpen G.H. 1995. Islands of complex DNA are widespread in Drosophila centric heterochromatin. Genetics 141: 283-303. Locke J.. Kotarski M.A.,and Tartof K.D. 1988. Dosage-dependent modifiers of position effect variegation in Drosophila and a mass action model that explains their effect. Genetics 120: 181-198. Lu B.Y., Bishop C.P., and Eissenberg J.C 1996. Developmetal timing and tissue specificity of heterochromatin-mediated silencing. EMBO J. 15: 1323-1332. Ma J., Hwang K.K., Worman H.J., Courvalin J.C, and Eissenberg J.C. 2001. Expression and functional analysis of three isoforms of human heterochromatin-associated protein HP1 in Drosophila. Chromosoma 109: 536-544. Martienssen R.A. and Colot V. 2001. DNA methylation and epigenetic inheritance in plants and filamentous fungi. Science 293: 1070-1074. Mason J.M., Ransom J., and Konev A.Y. 2004. A deficiency screen for dominant suppressors of telomeric silencing in Drosophila. Genetics 168: 1353-1370. Matzke M.A. and Birchler J.A. 2005. RNAi-mediated pathways in the nucleus. Nat. Rev. Genet. 6: 24-35 Mottus R., Sobels R.E., and Grigliatti T.A. 2000. Mutational analysis of a histone deacetylase in Drosophila melanogaster: Missense mutations suppress gene silencing associated with position effect variegation. Genetics 154: 657-668. Muller H.J. 1930. Types of visible variations induced by X-rays in Drosophila. J. Genet. 22: 299-334. Naumann K., Fischer A., Hofmann I., Krauss V., Phalke S., Irmler K., Hause G., Aurich A.C., Dorn R., Jenuwein T., and Reuter G. 2005. Pivotal role oL4/SUVH2 in control of heterochromatic histone methylation and gene silencing in Arabidopsis. EMBO J. 24: 1418-1429. PaJ-Bhadra M., Bhadra U., and Birchler J.A. 2002. RNAi related mechanisms affect both transcriptional and post-transcriptional transgene silencing in Drosophila. Mol. Cell 9: 315-327. Pal-Bhadra M., Leibovitch B.A., Gandhi S.G., Rao M., Bhadra U., Birchler J.A., and Elgin S.C.R. 2004. Heterochromatic silencing and HP1 localization in Drosophila are dependent on the RNAi machinery. Science 303: 669-672. Paro R. and Hogness D.S. 1991. The Polycomb protein shares a homologous domain with a heterochromatin-associated protein of Drosophila. Proc. Natl. Acad. Sci. 88: 263-267. Peters A.H.F.M., Kubicek S., Mechtler K., OSullivan J., Derijck A.A.H.A., Perez-Burgos L., Kohlmaier A., Opravil S., Tachibana M., Shinkai Y., et al., 2003. Partitioning and plasticity of repressive histone methylation states in mammalian chromatin. Mol. Cell 12: 1577-1589. Platero J.S., Sharp E.J., Adler P.N., and Eissenberg J.C. 1996. In vivo assay for protein-protein interaction using Drosophila chromosomes. Chromosoma 104: 393-404. Rea S., Eisenhaber R, O’Carroll D., Strahl B.D., Sun Z-W., Schmid M., Opravil S., Mechtler K., Ponting C.P., Allis C.D., and Jenuwein T. 2000. Regulation of chromatin structure by site-specific histone H3 methyltransferases. Nature 406: 593-599. Reuter G., Werner W., and Hofmann H.J. 1982. Mutants affecting position-effect heterochromatinization in Drosophila melanogaster. Chromosoma 85: 539-551. Reuter G., Wolff I., and Friede B. 1985. Functional properties of the heterochromatic sequences inducing wm4 position-effect variegation in Drosophila melanogaster. Chromosoma 93: 132-139. Reuter G., Giarre N., Farah J., Gausz J., Spierer A., and Spierer P. 1990. Dependence of position-effect variegation in Drosophila on dose of a gene encoding an unusual zinc-finger protein. Nature 344: 219-223. Rice J.C, Briggs S.D., Ueberheide B., Barber C. M., Shabanowitz J., Hunt D.F., Shinkai Y., and Allis CD. 2003. Histone methyltransferases direct different degrees of methylation to define distinct chromatin domains. Mol. Cell 12: 1591-1598. Richards E.J. and Elgin S.C.R. 2002. Epigenetic codes for heterochromatin formation and silencing: Rounding up the usual suspects Cell 108: 489-500. Russel L.B. and Bangham J.W. 1961. Variegated type position effects in the mouse. Genetics 46: 509-525. Schotta C., Ebert A., Krauss V., Fischer A., Hoffmann J., Rea S., Jenuwein T, and Reuter G. 2002. Central role of Drosophila SU(VAR)3-9 in histone H3-K9 methylation and heterochromatic gene silencing. EMBO J. 21: 1121-1131. Schotta C., Ebert A., Dorn R., and Reuter G. 2003. Position-effect variegation and the genetic dissection of chromatin regulation in Drosophila. Semin. Cell Dev. Biol. 14: 67-75. Schotta G., Lachner M., Sarma K., Ebert A., Sengupta R., Reuter G., Reinberg D., and Jenuwein T. 2004. A silencing pathway to induce H3-K9 and H4-K20 trimethylation at constitutive heterochromatin. Genes Dev. 18: 1251-1262. Schultz J. 1950. Interrelations of factors affecting heterochromatin-induced variegation in Drosophila. Genetics 35: 134. Seum C., Pauli D., Delattre M., Jaquet Y., Spierer A., and Spierer P. 2002. Isolation of Su(var)3- 7mutations by homologous recombination in Drosophila melanogaster. Genetics 161: 1125-1136. Shaffer C.D., Stephens G.E., Thompson B.A., Funches L., Bemat J.A., Craig C.A., and Elgin S.C.R. 2002. Heterochromatin protein 2 (HP2), a partner of HP1 in Drosophila heterochromatin. Proc. Natl. Acad. Sci. 99: 14332-14337. Shi Y., Lan E., Matson C., Mulligan P., Wlietstine J.R., Cole P.A., Casero R.A., and ShiY. 2005. Histone demethylation mediated by the nuclear amine oxidase homolog LSD1. Cell 119: 941-953. Silver L.M., and Elgin S.C.R. 1976. A method for determination of the in situ distribution of chromosomal proteins. Proc. Natl. Acad. Sci. 73: 423-427. Sinclair D.A.R., Mottus R.C, and Grigliatti T.A. 1983. Genes which suppress position effect variegation in Drosophila melanogaster axe clustered. Mol. Gen. Genet. 191: 326-333. Sinclair D.A.R., Clegg N.J, Antonchuk J, Milner T.A., Stankunas K., Ruse C, Grigliatti T.A., Kassis J., and Brock H.W 1998. Enhancer of Polycomb is a suppressor of position-effect variegation in Drosophila melanogaster. Genetics 148: 211-220. Sontheimer E.J. 2005. Assembly and function of RNA silencing complexes. Nat. Rev. Mol. Cell Biol. 6: 127-138. Spofford J.B. 1967. Single-locus modification of position-effect variegation in Drosophila melanogaster. I. white variegation. Genetics 57: 751-766. Stephens G.E., Craig C.A., LKY, Wallrath L.L., and Elgin S.C.R. 2003. Immunofluorescent staining of polytene chromosomes: Exploiting genetic tools. Methods Enzymol. 376: 372- 393. Sun F.-L., Cuaycong M.H., and Elgin S.C.R. 2001. Long-range nucleosome ordering is associated with gene silencing in Drosophila melanogaster pericentromeric heterochromatin. Mol. Cell. Biol. 21: 2867-2879. Sun F.-L., Haynes K., Simpson C.L., Lee S.D., Collins L., Wuller J., Eissenberg J.C., and Elgin S.C.R. 2004. cis-acting determinants of heterochromatic formation on Drosophila melanogaster chromosome four. Mol. Cell. Biol. 24: 8210-8220. Tartof K.D., Hobbs C., and Johnes M. 1984. A structural basis of variegating position effects. Cell 37: 869-878. Tschiersch B., Hofmann A., Krauss V., Dorn R., Korge G., and Reuter G. 1994. The protein encoded by the Drosophila position effect variegation suppressor gene Su(var)3- 9 combines domains of antagonistic regulators of homeotic gene complexes. EMBO J. 13: 3822-3831. Wakimoto B.T. and Heam M.G. 1990. The effects of chromosome rearrangements on the expression of heterochromatic genes in chromosome 2L of Drosophila melanogaster. Genetics 125: 141-154. Wallrath L.L. and Elgin S.C.R. 1995. Position effect variegation in Drosophila is associated with an altered chromatin structure. Genes Dev. 9: 1263-1277. Wallrath L.L., Gunter V.P., Rosman L.E., and Elgm S.C.R. 1996. DNA representation of variegating heterochromatic P element inserts in diploid and polytene tissue of Drosophila melanogaster. Chromosoma 104: 519-527. Wang Y., Zhang W., Jin Y., Johansen J., and Johansen K.M. 2001. The JIL-1 tandem kinase mediates histone H3 phosphorylation and is required for maintenance of chromatin structure in Drosophila. Cell 105: 433-443. Zhimulev I.F., Belyaeva E.S., Fomina O.V, Protopopov M.O., and Bolsh-kov VN. 1986. Cytogenetic and molecular aspects of position effect variegation in Drosophila melanogaster. Chromosoma 94: 492-504.Глава 6. Грибы как модельные организмы для эпигенетических исследований: Schizosaccharomyces pombe и Neurospora crassa
 Robin С. Allshire1 и Eric U. Selker2
1Wellcome Trust Center for Cell Biology, The University of Edinburgh, Edinburgh E119 3JR, Scotland, United Kingdom
2Institute of Molecular Biology, University of Oregon, Eugene, Oregon 97403-1229
Robin С. Allshire1 и Eric U. Selker2
1Wellcome Trust Center for Cell Biology, The University of Edinburgh, Edinburgh E119 3JR, Scotland, United Kingdom
2Institute of Molecular Biology, University of Oregon, Eugene, Oregon 97403-1229
Общее резюме
Грибы дают нам превосходные модели для понимания структуры и функции хроматина как в активно транскрибируемых районах (эухроматин), так и в транскрипционно «молчащих» районах (гетерохроматин). Почкующиеся дрожжи, Saccharomyces cerevisiae, явились бесценной эукариотической моделью для изучения структуры хроматина, связанной с транскрипцией в эухроматиновых районах, и для создания парадигмы для «молчащего» хроматина. С другой стороны, дробянковые дрожжи Schizosaccharomyces pombe и нитчатый гриб Neurospora crassa явились эффективным средством для исследования форм сайленсинга, более тесно связанных с таковыми у высших эукариот. У этих грибов гетерохроматиновые районы сравнительно малы и несущественны для жизнеспособности, что делает их более легкими для расчленения [to dissect] и манипулирования. Наше понимание гетерохроматина вокруг центромерных и теломерных районов достигло наибольших успехов в работе с дрожжами S. cerevisiae и S. pombe; однако механизм сайленсинга хроматина, используемый S. pombe, демонстрирует особенности, консервативные и у этих дрожжей, и у гетерохроматиновых районов высших эукариот. Действительно, оба гриба, обсуждаемые в этой главе, — N. crassa и S. pombe — контрастируют с S. cerevisiae в том отношении, что они используют РНК-интерференцию (RNAi), метилирование гистона H3 по лизину 9 и белки типа белка I гетерохроматина (НР1) для формирования «молчащего» гетерохроматина способом, который консервативен или сходен с таковым у растений и многоклеточных животных. Кроме того, N. crassa широко использует метилирование ДНК, являющееся характерной чертой гетерохроматина у многих высших эукариот и классическим эпигенетическим феноменом. Сначала обсуждаются природа и функции гетерохроматина у S. pombe после краткого знакомства с этим организмом. Затем мы обратимся к N. crassa, чтобы продемонстрировать вклад этого нитчатого гриба в эпигенетические исследования.1. Schizosaccharomyces pombe: организм
Дробянковые дрожжи, S. pombe, обнаружены при брожении, связанном с производством пива в субтропических регионах; «pombe», в сущности, и означает «пиво» на языке суахили. S. pombe, в основном, являются гаплоидными (1N) одноклеточными организмами. В богатой питательными веществами среде клетки дикого типа претерпевают митотическое деление приблизительно каждые 2 часа. Но можно использовать целый ряд условий или условных мутантов, чтобы заблокировать клетки на разных стадиях клеточного цикла или синхронизировать клеточные культуры в G/S, G2 или в метафазе. Это особенно полезно, поскольку фаза G1 у быстро растущих культур очень короткая, и клетки почти немедленно переходят после цитокинеза в фазу S; основная часть клеточного цикла приходится на G2 (рис. 1) (Egel, 2004). Рис. 6.1. Жизненный цикл дробянковых дрожжей S. pombe
Дробянковые дрожжи имеют короткую G1, занимающую менее 10 % клеточного цикла (покрытая пунктиром площадь расширена для облегчения восприятия). В богатой питательными веществами среде клетки, находящиеся в фазе G1, переходят в фазу S. за которой следуют длительная G2 (-70 % клеточного цикла), митоз и цитокинез. В условиях азотного голодания клетки противоположных типов спаривания (+ и -) конъюгируют, после чего ядра сливаются в процессе, называемом кариогамией. Премейотическая репликация и рекомбинация делают возможным прохождение мейоза I и II; в результате образуются четыре ядра, которые обособляются в четыре споры, заключенные в аск. Перенос в среду, богатую питательными веществами, вызывает прорастание спор и возобновление вегетативного клеточного цикла
Рис. 6.1. Жизненный цикл дробянковых дрожжей S. pombe
Дробянковые дрожжи имеют короткую G1, занимающую менее 10 % клеточного цикла (покрытая пунктиром площадь расширена для облегчения восприятия). В богатой питательными веществами среде клетки, находящиеся в фазе G1, переходят в фазу S. за которой следуют длительная G2 (-70 % клеточного цикла), митоз и цитокинез. В условиях азотного голодания клетки противоположных типов спаривания (+ и -) конъюгируют, после чего ядра сливаются в процессе, называемом кариогамией. Премейотическая репликация и рекомбинация делают возможным прохождение мейоза I и II; в результате образуются четыре ядра, которые обособляются в четыре споры, заключенные в аск. Перенос в среду, богатую питательными веществами, вызывает прорастание спор и возобновление вегетативного клеточного цикла
Подобно S. cerevisiae, S. pombe может переключаться с одного из противоположных типов спаривания на другой; эти типы спаривания называются Плюс (+) и Минус (-). Типы спаривания эквивалентны диморфным полам у высших эукариот, хотя они гаплоидны. Информация для обоих типов спаривания находится в геноме в виде эпигенетически регулируемых «молчащих» кассет — локусов mat2-Р(+) или mat3-М(-). Эти «молчащие» локусы обеспечивают генетическую матрицу для идентичности по типу спаривания, но сам тип спаривания определяется тем, какая конкретная информация (+ или -) находится в активном локусе mat1 Переключение информации в активном локусе mat1 (и, следовательно, типа спаривания) происходит путем рекомбинации между «молчащим» локусом и локусом mat1 в соответствии со строгим паттерном (Egel, 2004). В условиях азотного голодания клетки перестают делиться и останавливаются в G,, что активирует половую фазу жизненного цикла — конъюгацию пар клеток + и — с образованием диплоидных зигот (рис. 6.1). После спаривания и слияния ядер происходит премейотическая репликация (увеличивающая содержание ДНК с 2N до 4N). затем происходят спаривание и рекомбинация гомологичных хромосом, и за этим следует редукционное деление мейоза 1 и эквационное деление мейоза II. Это дает четыре отдельных гаплоидных ядра (1N), которые инкапсулируются в споры, заключенные в аск. Последующее предоставление богатого источника питательных веществ делает возможным прорастание спор и возобновление вегетативного роста и митотического деления клеток. Были изолированы или сконструированы непереключающиеся дериваты, у которых все клетки относятся либо к «+»-, либо к «-»-типу спаривания. Это облегчает контролируемое спаривание между штаммами разных генотипов. Хотя в норме S. pombe гаплоидны, можно отселектировать диплоидные штаммы Такие диплоидные клетки могут затем делиться митозом в ходе вегетативного роста до начала азотного голодания, когда они также претерпевают мейоз и образуют «азиготические аски» (рис. 6.1).
1.1. Сайленсинг хроматина у S. pombe отличается от такового у S. cerevisiae
Дробянковые дрожжи являются очень полезным модельным организмом для изучения «молчащего» хроматина и связанных с этим эпигенетических эффектов. Они непохожи на S. cerevisiae, но более сходны с N. crassa, растениями и многоклеточными животными в отношении механизмов, которые они используют для достижения сайленсинга через гетерохроматин. И у S. cerevisiae, и у S. pombe теломеры и районы локусов типа спаривания в геноме подвержены сайленсингу, и, кроме того, у S. pombe сайленсинг обнаруживают центромеры. Однако, как описано в главе 4, S. cerevisiae используют для достижения сайленсинга хроматина уникальный набор белков — белки Sir. С другой стороны, дробянковые дрожжи и другие эукариоты, по-видимому, используют сочетание различных модификаций гистонов (в частности, метилирование гистона H3K9) и белки РНК-интерфернции (RNAi) для того, чтобы сайленсировать хроматин. Как детально обсуждается ниже, в исследованиях на S. pombe обнаружили, что этот «молчащий» хроматин имеет существенное значение для функционирования каждого специализированного района гетерохроматина (т.е. центромер и локусов типа спаривания). В центромерах гетерохроматин необходим для обеспечения нормального расхождения хромосом (Allshire et al., 1995; Ekwall et al., 1995), тогда как в локусах типа спаривания он облегчает и регулирует переключение типа спаривания (обзор см. Egel, 2004). Кроме того, «молчащий» хроматин формируется по соседству с теломерами, хотя для этого теломерного «молчащего» хроматина еще нужно найти функцию (Nimmo et al., 1994; Kanoh et al., 2005). Маркерные гены, вставленные в рДНК, тоже сайленсируются (Thon and Verhein-Hansen 2000; Cam et al., 2005). В отличие от N. crassa и высших эукариот, у S. pombe, по-видимому, отсутствует сколько-нибудь заметное метилирование ДНК (Wilkinson et al., 1995) — обычный механизм, используемый для сайленсирования хроматина у многих эукариот (главы 9 и 18); так, сайленсинг у дробянковых дрожжей опосредован главным образом модификациями хроматина. Как обсуждается ниже, для установления этих модификаций и, таким образом, «молчащего» хроматина используется машинерия RNAi.1.2. Гены, помещенные в центромеры дробянковых дрожжей, сайленсированы
Формирование гетерохроматина в центромерах дробянковых дрожжей важно для обеспечения нормального расхождения хромосом при делении ядра. Исследования показали, что центромера в действительности состоит из двух различных хроматиновых структур: гетерохроматина и содержащего CENP-Акинетохорного хроматина Это было продемонстрировано путем изучения варьирующего сайленсинга репортерных генов, вставленных в разные центромерные участки. На уровне ДНК центромерные районы у дробянковых дрожжей состоят из внешних [outer] повторов (подразделенных на элементы, известные как dg и dh, или К и L), которые фланкируют центральный домен, включающий внутренние [inner] повторы (imr, или В), и центральный кор (cnt, или СС) (рис. 6.2а). Три центромеры, сеп 1, cen2 и cen3, занимают -40, -60 и -120 т.о. на хромосомах I, II и III, соответственно (обзоры см. Egel, 2004; Pidoux and Allshire, 2004). Повторяющаяся природа центромерной ДНК у дробянковых дрожжей напоминает более крупные, более сложные повторяющиеся структуры, связанные с центромерами многих многоклеточных животных, но с ними легче манипулировать (Takahashi et al., 1992; Steiner et al., 1993; Ngan and Clarke, 1997). Поскольку у других эукариот повторяющаяся ДНК часто коррелирует с присутствием гетерохроматина (см. также главу 5), наличие повторяющейся ДНК в центромерах дробянковых дрожжей позволяет предполагать, что они могли бы обладать такими свойствами гетерохроматина, как способность препятствовать экспрессии генов. Как описывается ниже, два блока гетерохроматина фланкируют центральный домен каждой центромеры дробянковых дрожжей. Сам этот центральный домен собран в хроматин другого типа (CENP-A-хроматин), который отличается от соседнего гетерохроматина. Хорошо известно, что тип хроматина, окружающего ген, может сильно влиять на его экспрессию. Первоначально это было продемонстрировано у плодовой мушки Drosophila melanogaster, где хромосомные перестройки, перемещающие ген white в соседство с центромерным гетерохроматином, приводят к его варьирующей экспрессии в глазных фасетках и, таким образом, к мозаичной окраске глаза (см. рис. 5.1 в главе 5). Сейчас очевидно, что трансгены у многих организмов могут испытывать влияние того окружения, в котором они оказались. У дробянковых дрожжей сайленсинг генов можно отслеживать с помощью фенотипических тестов, подобных тем, которые используются у S. cerevisiae и оценивают экспрессию репортерных генов. Например, когда репортер ura4+ сайленсирован, формируются колонии, резистентные к 5-фтороротовой кислоте. Другой пример: сайленсинг репортера ade6+ приводит к образованию красных, а не белых колоний (рис. 6.3а). Перемещение нормально экспрессирующегося гена, такого как ura4+ или ade6+, внутрь центромеры (что определяется по элементам внешних повторов и центрального домена) приводит к его транскрипционному сайленсингу. Сайленсинг во внешних повторах очень прочный — такой, что большинство клеток формируют колонии, в которых стабильно поддерживается репрессия маркеров (т.е. в случае репортера ade64 формируются красные колонии). Однако в центральном домене сайленсинг ade6+ сравнительно нестабилен, результатом чего являются мозаичные колонии, выглядящие как секторированные колонии с красными, белыми либо краснобелыми секторами (рис. 6.3а). Однако на расстоянии всего 1 т.о. дистально от внешних повторов никакого сайленсинга не происходит (Allshire et al., 1994, 1995), показывая тем самым, что эта репрессия транскрипции ограничена центромерой, определяемой центральным доменом и фланкирующими внешними повторами.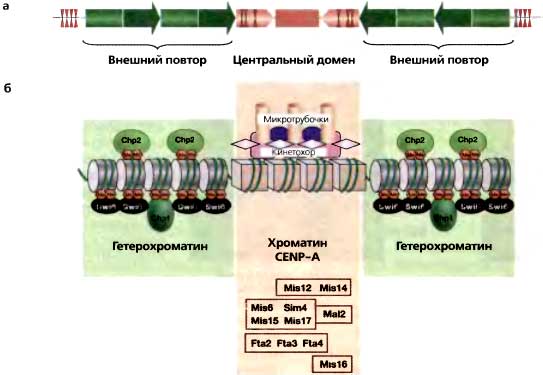 Рис. 6.2. Отличающийся гетерохроматин внешних повторов и центральные кинетохорные домены в центромерах дробянковых дрожжей
(а) Изображение центромеры дробянковых дрожжей. Центральный домен (розовый цвет, кинетохор) состоит из элементов imr и cnt, внешние повторы содержат транскрибируемые повторы dg и dh (зеленый цвет, гетерохроматин) Все три центромеры имеют сходное общее устройство; однако число внешних повторов различается: cenl (10 т.о.) имеет два, cen2 (65 n/j/) имеет три и cen3 — приблизительно тринадцать. Кластеры генов тРНК (двойные концы стрелок) находятся в районе imr и на концах всех трех центромер. Транскрипция маркерных генов, помещенных внутрь внешних повторов или в центральный домен, сайленсируется. (b) Гетерохроматин: внешние повторы упакованы в нуклеосомы, которые метилированы по H3K9me2, что делает возможным связывание хромодоменных белков Chp1, Chp2 и Swi6. Центральный «кинетохорный» хроматин: CENP-A обнаруживается в центральном домене, где он, вероятно, замещает большую часть H3, чтобы сформировать специализированные нуклеосомы (розовые квадратики). Было показано, что, в дополнение к CENP-A, несколько кинетохорных белков (указаны) связываются с нуклеотидными последовательностями центрального домена, но не с внешними повторами. Сборка кинетохора в центральном домене опосредует прикрепление к микротрубочкам после образования веретена и расхождение хромосом. Мутация компонентов гетерохроматина облегчает сайленсинг маркерных генов во внешних повторах, но не в центральном домене. Дефекты в некоторых компонентах кинетохора делают возможной экспрессию маркерных генов в центральном домене, но не во внешних повторах
Рис. 6.2. Отличающийся гетерохроматин внешних повторов и центральные кинетохорные домены в центромерах дробянковых дрожжей
(а) Изображение центромеры дробянковых дрожжей. Центральный домен (розовый цвет, кинетохор) состоит из элементов imr и cnt, внешние повторы содержат транскрибируемые повторы dg и dh (зеленый цвет, гетерохроматин) Все три центромеры имеют сходное общее устройство; однако число внешних повторов различается: cenl (10 т.о.) имеет два, cen2 (65 n/j/) имеет три и cen3 — приблизительно тринадцать. Кластеры генов тРНК (двойные концы стрелок) находятся в районе imr и на концах всех трех центромер. Транскрипция маркерных генов, помещенных внутрь внешних повторов или в центральный домен, сайленсируется. (b) Гетерохроматин: внешние повторы упакованы в нуклеосомы, которые метилированы по H3K9me2, что делает возможным связывание хромодоменных белков Chp1, Chp2 и Swi6. Центральный «кинетохорный» хроматин: CENP-A обнаруживается в центральном домене, где он, вероятно, замещает большую часть H3, чтобы сформировать специализированные нуклеосомы (розовые квадратики). Было показано, что, в дополнение к CENP-A, несколько кинетохорных белков (указаны) связываются с нуклеотидными последовательностями центрального домена, но не с внешними повторами. Сборка кинетохора в центральном домене опосредует прикрепление к микротрубочкам после образования веретена и расхождение хромосом. Мутация компонентов гетерохроматина облегчает сайленсинг маркерных генов во внешних повторах, но не в центральном домене. Дефекты в некоторых компонентах кинетохора делают возможной экспрессию маркерных генов в центральном домене, но не во внешних повторах
1.3. Центромеры дробянковых дрожжей состоят из разных гетерохроматиновых и центральных кинетохорных доменов
У дробянковых дрожжей разница в качестве сайленсинга по длине центромер отражает тот факт, что репрессия транскрипции является результатом разных хроматиновых структур, включая ассоциации различных негистоновых белков, во внешних повторах и в центральном домене (Partridge et al., 2000). Имеются две разные хроматиновые структуры, которые были охарактеризованы в центромерных районах дробянковых дрожжей: гетерохроматин над участками внешних повторов и хроматин «CENP-А», покрывающий центральный домен, где собирается кинетохор. В этих двух доменах с сайленсингом репортерных генов связаны (и для него требуются) разные белки. Гетерохроматин В хроматине аминотерминальные «хвосты» гистонов H3 и Н4 подвержены ряду посттрансляционных модификаций, которые обычно коррелируют с активными или репрессивными состояниями (глава 3). Центромерный гетерохроматин во внешних повторах ассоциируется с ди- и триметильными состояниями гистона H3 по лизину 9 (H3K9me2 и H3K9me3) (Nakayama et al., 2001; Yamada et al., 2005). Для формирования центромерного гетерохроматина требуется действие нескольких белков, модифицирующих хроматин и, тем самым, стимулирующих связывание других факторов. Для формирования гетерохроматина сначала требуются деацетилазы гистонов (HDACs; такие как ClrЗ, Clr6 и Sir2), чтобы деацетилировать гистон H3. Это впоследствии позволяет метил-трансферазе лизина гистонов (HKMT) Clr4 метилировать гистон H3 по лизину 9 над центромерными внешними повторами. Эта модификация создает специфический сайт связывания, который распознается хромодоменным мотивом, присутствующим в Swi6 и Chp2 (гомологах гетерохроматинового белка 1 [НР1], описываемого в главе 5) и в еще одном хромодоменном белке Chp1 (рис. 6.26). Все эти белки вносят вклад в формирование «молчащего» хроматина над внешними повторами (Allshire et al., 1995; Cowieson et al., 2000; Partridge et al., 2000; Bannister et al., 2001; Nakayama et al., 2001; Shankaranarayana et al., 2003; Sadaie et al., 2004). Рис. 6.3. Мозаицизм и облегчение сайленсинга маркерных генов
(а) Экспрессия ade6+ из центрального домена носит мозаичный характер, давая в результате красные, белые и секторированные колонии. Клетки, экспрессирующие ade6+, образуют белые колонии; когда же ade6+ репрессирован, образуются красные колонии, (б) ade6+, вставленный во внешние повторы, накрепко сайленсирован, что в результате дает однородные красные колонии. Для этого сайленсинга требуются белки гетерохроматина, такие как Swi6 (который связывается с метилированным H3K9). и компоненты RNAi, такие как Dcr1 (Dicer, РНКаза-III-рибонуклеаза)
Рис. 6.3. Мозаицизм и облегчение сайленсинга маркерных генов
(а) Экспрессия ade6+ из центрального домена носит мозаичный характер, давая в результате красные, белые и секторированные колонии. Клетки, экспрессирующие ade6+, образуют белые колонии; когда же ade6+ репрессирован, образуются красные колонии, (б) ade6+, вставленный во внешние повторы, накрепко сайленсирован, что в результате дает однородные красные колонии. Для этого сайленсинга требуются белки гетерохроматина, такие как Swi6 (который связывается с метилированным H3K9). и компоненты RNAi, такие как Dcr1 (Dicer, РНКаза-III-рибонуклеаза)
Хроматин, ассоциированный со вставками репортерного гена во внешние повторы (например, гена ura4+), заметно обогащен белками H3K9me2 и Swi6. Это показывает, что модификация хроматина и Swi6 могут распространяться из соседней центромерной повторяющейся ДНК в вклинивающиеся [interposing] последовательности (Cowieson et al., 2000; Nakayama et al., 2001). Локализация Swi6 и сайленсинг зависят от метилирования H3K9, что иллюстрируется нарушением локализации Swi6 в клетках, у которых нет специфичной для H3K9 HKMT, Clr4, или у мутантов по H3, где лизин 9 замещен аргинином (Ekwall et al., 1996; Mellone et al., 2003). Белок Swi6 димеризуется через свой «chromoshadow»-домен (Cowieson et al., 2000) и это, вероятно, облегчает его распространение вдоль хроматиновых фибрилл, которому способствует последовательное действие HDACs и специфичной для H3K9 HKMT Clr4. Кроме Swi6, с хроматином внешних повторов в центромерах ассоциируются также хромодоменные белки Chp1 и Chp2 путем связывания гистона H3, метилированного по лизину 9. Было показано, что Chp1 является компонентом эффекторного комплекса RNAi, RITS (глава 8), и необходим для полного метилирования гистона H3K9 над внешними повторами и вставленными репортерными генами (Partridge et al., 2002; Motamedi et al., 2004; Sadaie et al., 2004). Хроматин центрального кинетохорного домена Прежде чем обсуждать детали формирования гетерохроматина на внешних повторах в центромерах, важно принять во внимание, что хроматин центрального домена, где собирается кинетохор, очень отличается от гетерохроматина, фланкирующего внешние повторы, потому что именно там собирается кинетохор. В противоположность сайленсингу во внешних повторах сайленсинг репортерных генов в центральном домене сеп 1 (имеющем длину приблизительно 10 т.о.), по существу, не зависит от Clr4 и поэтому не связан с метилированием гистона H3 по лизину 9. Действительно, было показано, что центральный домен обладает отличающимся составом хроматина. Первоначально это было продемонстрировано в ходе анализа с использованием микрококковой нуклеазы, MNase (объяснение ее действия см. в главе 5), когда обнаружили «мазок» [smear] в противоположность регулярной «лесенке» с интервалом 150 п.н., характерной для хроматина фланкирующих внешних повторов (Polizzi and Clarke, 1991; Takahashi et al., 1992). Этот особый паттерн отличает хроматин центрального домена от гетерохроматина и эухроматина и имеет отношение к его сборке в особом CENP-A-хроматине и сборке кинетохора над этим районом. У всех изученных эукариот с активными центромерами специфически связывается белок, подобный гистону H3 и известный как CTNP-A (или сепH3), (Cleveland et al., 2003), а CENP-A-хроматин играет решающую роль в определении места сборки кинетохора (рис. 6.26). В хроматине центрального домена центромер у дробянковых дрожжей большая часть гистона H3 замещена ортологом CENP-A, известным как Cnp1 (рис. 6.46) (Takahashi et al., 2000). Откладка CENP-ACnp1 может происходить зависимым от репликации образом в фазе S или независимым от репликации способом в G2 (дополнительные детали см. в главе 13). Кинетохорные белки сами управляют локализацией и сборкой CENP-ACnp1 специфически в пределах центрального домена центромеры (Goshima et al., 1999; Takahashi et al., 2000; Pidoux et al., 2003). Ams2 (фактор GATA), например, управляет связанной с репликацией откладкой CENP-ACnp1 в фазе S. В его отсутствие независимая от репликации откладка с помощью Mis6 в G2 может обеспечивать компенсацию, доводя уровни CENP-ACnp1 до максимума в интерфазе (Chen et al., 2003; Takahashi et al., 2005). Если структура хроматина CENP-ACnp1 разрушается (как в случае мутантов cnpl, mal2, mis6, sim4 и других), специфический «смазанный» паттерн, получаемый при обработке ми-крококковой нуклеазой, превращается в паттерн, более типичный для основной массы хроматина (т.е. в нуклеосомную «лесенку»). Мутанты, затрагивающие хроматин центрального домена, не оказывают никакого заметного влияния на сайленсинг во внешних повторах (Cowieson et al., 2000; Jin et al., 2002; Pidoux et al., 2003; Hayashi et al., 2004). Более того, тот факт, что CENP-ACnp1, Ма12, Mis6, Sim4 и другие кинетохорные белки связываются только с центральным доменом, показывает, что центральный кинетохорный домен является структурно сложным и функционально отличается от «молчащего» хроматина внешних повторов (рис. 6.26). Были протестированы не все белки кинетохорного домена, но создается впечатление, что сайленсинг в центральном домене является результатом сборки интактного кинетохора, который, как и у S. cerevisiae, включает по меньшей мере 50 белков (Measday and Hieter, 2004). Этот крупный комплекс белков предположительно ограничивает доступ РНК-полимеразы II к репортерным генам, помешенным в этот район, и тем самым тормозит их транскрипцию. У таких мутантов, как cnpl, mal2, mis6 и sim4, при пермиссивной температуре целостность кинетохора, несомненно, частично нарушена, и это делает возможной увеличенную транскрипцию репортерных генов. Побочный результат этого состоит в том, что в норме «молчаший» репортерный ген был использован для тестирования дефектов в хроматине центрального кора, что привело к идентификации новых кинетохорных белков (Pidoux et al., 2003).
 Рис. 6.4. «Молчащий» хроматин в ядрах S. pombe
Два интерфазных ядра с гетерохроматином (центромеры, теломеры и «молчащие» локусы mat2-mat3), декорированных красной флуоресцентной иммунолокализацией Swi6, и кинетохорный хроматин (только центромеры), декорированный зеленой флуоресцентной иммунолокализацией CENP-ACnp1. Красные сигналы не в самом соседстве с зелеными представляют теломеры или mat2-mat3. Все нентромеры собраны в кластер на периферии ядра рядом с организующим центром митотического веретена
Рис. 6.4. «Молчащий» хроматин в ядрах S. pombe
Два интерфазных ядра с гетерохроматином (центромеры, теломеры и «молчащие» локусы mat2-mat3), декорированных красной флуоресцентной иммунолокализацией Swi6, и кинетохорный хроматин (только центромеры), декорированный зеленой флуоресцентной иммунолокализацией CENP-ACnp1. Красные сигналы не в самом соседстве с зелеными представляют теломеры или mat2-mat3. Все нентромеры собраны в кластер на периферии ядра рядом с организующим центром митотического веретена
Центромерные районы не полностью лишены генов, и любопытно, что несколько генов тРНК находятся между внешними повторами и центральным кинетохорным районом (рис. 6.2а) (Kuhn et al., 1991; Takahashi et al., 1991). Недавно было показано, что они действуют как барьер, предотвращая вторжение гетерохроматина в центральный домен (Scott et al., 2006).
1.4. Центромерные внешние повторы без посторонней помощи делают возможной сборку «молчащего» хроматина
Зависимый от Clr4 «молчащий» хроматин собирается не только в центромерах, но и над районом размером около 20 т.о., содержащим «молчащие» локусы типа спаривания (mat2-mat3) (Noma et al., 2001) и соседствующим с терминальными теломерными повторами (консенсус TTACAGG), добавляемыми теломеразой (Nimmo et al., 1994, 1998; Allshire et al., 1995; Kanohetal., 2005). Район cenH (т.е. гомологичный центромере), который находится "Между mat2 и mat3, имеет большое сходство, свыше ~7 т.о., с внешними повторами, обнаруживаемыми в центромерах (Grewal and Klar, 1997). Кроме того, по крайней мере 0.5 т.о. нуклеотидных последовательностей ДНК, имеющих >84 % идентичности с повторами cenH, могли бы действовать в cis-конфигурации, осуществляя сборку «молчащего» хроматина. Сборка зависимого от Clr4 «молчащего» хроматина происходит даже на соседних маркерных генах, когда центромерный внешний повтор (dg) или нуклеотидные последовательности mat2-mat3 (cenH) вставляются в районы генома, где в норме сайленсинг не происходит («эктопический» сайленсинг; рис. 5) (Ayoub et al., 2000; Partridge et al., 2002; Volpe et al., 2003). Простое объяснение могло бы заключаться в том, что связывающиеся с ДНК белки узнают эти повторы и, когда связываются, эти белки рекрутируют HDACs и HKMT Clr4, результатом чего является метилирование H3K9, связывание хромодоменных белков и формирование гетерохроматина. Однако ситуация на самом деле еще более сложная. Теперь известно, что центромерные внешние повторы транскрибируются. Замечательно, что эта транскрипция приводит к образованию двухнитчатой РНК (dsRNA) — субстрата для RNAi-машинерии, — а она затем рекрутирует Clr4 HKMT для включения сборки «молчащего» хроматина (Volpe et al., 2002; Sadaie et al., 2004). RNAi также действует на родственные повторы cenH, обнаруживаемые в районе mat2-mat3 и в повторах TAS в теломерах (Cam et al., 2005; Kanoh et al., 2005). Рис. 6.5. Нуклеотидные последовательности центромерных повторов опосредуют сайленсинг
Вставка фрагментов (1—2 т.о.) рядом с экспрессируемым геном ura4+ в локусе, который в норме не склонен к сайленсингу, приводит к метилированию НЗК9, связыванию Swi6 и Chp1 и транскрипционному сайленсингу
Рис. 6.5. Нуклеотидные последовательности центромерных повторов опосредуют сайленсинг
Вставка фрагментов (1—2 т.о.) рядом с экспрессируемым геном ura4+ в локусе, который в норме не склонен к сайленсингу, приводит к метилированию НЗК9, связыванию Swi6 и Chp1 и транскрипционному сайленсингу
Однако картина еще более усложняется тем обстоятельством, что в mat2-mat3 RNAi действует, устанавливая «молчащий» хроматин, в то время как связывающиеся с ДНК белки Arf1 и Perl связываются вблиз cenH и поддерживают «молчащий» хроматин над mat2-mat3 даже в отсутствие ключевых компонентов RNAi (Jia et al., 2004; Kim et al., 2004). Аналогично этому, перекрывающиеся механизмы сайленсинга действуют и в теломерах; терминальные повторы без посторонней помощи могут рекрутировать Clr4 HKMT и. таким образом, Swi6 через связывающийся с теломерными повторами белок Tazl, но RNAi действует также через cenH-часть элементов TAS, формируя расширенный район «молчащего» хроматина в теломерах (Nimmo et al., 1994; Allshire et al., 1995; Kanoh et al., 2005). Существует ли сравнимый перекрывающийся механизм для поддержания «молчащего» хроматина в центромерах? Хотя в клетках, лишенных RNAi, сайленсинг репортерных генов внешних повторов и самих транскриптов центромерных внешних повторов является дефектным, H3K9me2 сохраняется на хроматине внешних повторов в отсутствие компонентов RNAi (Sadaie et al., 2004). Какие факторы отвечают за поддержание этого метилирования? Одна возможность заключается в том, что белки, родственные CENP-B (Abpl, Cbhl, Cbh2), содержащие консервативный связывающийся с ДНК домен, связываются с ДНК центромерных повторов и являются необходимыми для эффективного формирования «молчащего» хроматина (Irelan et al., 2001; Nakagawa et al., 2002) Другие наблюдения показывают, что HDAC Clr4 также действует независимо от RNAi, поддерживая целостность гетерохроматина (Yamada et al., 2005).
1.5. РНК-интерференция направляет сборку «молчащего» хроматина
Феномен RNAi был впервые открыт у Caenorhabditis elegans, где было найдено, что результатом экспрессии dsRNA является утрата экспрессии гомологичного гена. Вскоре стало очевидным, что эта форма RNAi связана с процессом транскрипционного сайленсинга генов (TGS), описанного у растений, и подавлением [quelling] у N. crassa (описывается ниже). У растений и многоклеточных животных известно, что dsRNA, будучи подвергнута процессингу с помощью машинерии RNAi, дает малые РНК, которые осуществляют модификации ДНК и (или) хроматина на гомологичном хроматине. Наличие у дробянковых дрожжей ортологов основных компонентов пути RNAi, т.е. Argonaute (Ago1), Dicer (Dcrl) и РНК-зависимой РНК-полимеразы (Rdpl), стимулировало их исследование у этих организмов (Volpe et al., 2002), что привело к значительным успехам в понимании опосредованных RNAi модификаций хроматина и сайленсинга. Фенотипические последствия утери функции Ago1, Dcr1 или Rdpl сходны с таковыми у мутантов swi6: пониженное содержание H3K9me2 и потеря сайленсинга над внешними повторами центромер (рис. 6.36). Однако у мутантов по RNAi были выявлены перекрывающиеся некодирующие РНК-транскрипты (ncRNA) дискретной величины, происходящие с центромерных внешних повторов. Эти ncRNA гомологичны естественно встречающимся малым РНК, называемым короткими интерферирующими РНК (siRNAs; ~21 н.), которые изолированы и секвенированы у S. pombe (Reinhart and Bartel, 2002; Cam et al., 2005). Эти siRNAs генерируются Dicer (компонентом RNAi) посредством расщепления двунитчатых дериватов гомологичных некодирующих транскриптов длинного центромерного повтора [mediated by cleavage of the double-stranded derivatives of the long centromere repeat homologous noncoding transcripts]. Хромодоменный белок Chp1 также оказывается компонентом машинерии RNAi. Chp1 связывается с хроматином H3K9me2 и необходим для сайленсинга репортерных генов во внешних повторах центромер, но он также требуется и для генерации siRNAs, гомологичных центромерным повторам (Noma et al., 2004), и для нормальных уровней метилирования H3K9 на центромерных повторах (Partridge et al., 2002; Sadai et al., 2004). Роль Chp1 была далее подтверждена идентификацией эффекторного комплекса RITS (RNA-induced transcriptional silencing), который содержит Chp1, Ago1, Tas3 и siRNAs, гомологичные центромерным внешним повторам (Motamedi et al., 2004). Кроме RITS был идентифицирован комплекс, содержащий Rdpl (RDRC — RNA-directed RNA polymerase complex), который содержит предсказанную РНК-геликазу (Hrrl) и предполагаемую поли (А) полимеразу (Cidl2). Эти компоненты, по-видимому, также являются важной составной частью процесса RNAi и сборки интактного «молчащего» хроматина на внешних повторах в центромерах (рис. 6.6) (Motamedi et al., 2004). Наличие независимого от RNAi (и зависимого от Atfl/Pcrl) механизма сайленсинга, действующего в «молчащем» локусе типа спаривания для поддержки гетерохроматина, было обнаружено путем обработки клеток без RNAi ингибитором HDAC трихостатином А (TSA). Результатом этого явилась полная утрата «молчащего» хроматина из района mat2-mat3, имитирующая эффект делетирования atfl или pcrl у мутантов по RNAi (Hall et al., 2002; Jia et al., 2004). Однако, как отмечалось выше, для формирования «молчащего» хроматина в центромерных внешних повторах Atfl и Perl не требуются (Kim et al., 2004). Кратковременное воздействие TSA также вызывает утрату сайленсинга в центромерах, приводя к гиперацетилированию гистонов, сопряженных с дефектной функцией центромеры (Ekwall et al., 1997). Хотя это индуцированное TSA «эписостояние» является метастабильным, оно может воспроизводиться в нескольких циклах клеточного деления и даже в мейозе Наиболее вероятное объяснение заключается в том, что гетерохроматин трудно установить заново, коль скоро достигается это аномальное гиперацетили-рованное состояние. Эписостояния могут также устанавливаться в нарушенном (compromised) локусе mat2-mat3, и они тоже воспроизводятся в мейозе (Nakayama et al., 2000).1.6. Транскрипция центромерных повторов РНК-полимеразой II связывает RNAi с модификациями хроматина
В предыдущем разделе было показано, что RNAi и модификации гистонов необходимы для сборки центромерного гетерохроматина, который может распространяться на соседние вставленные репортерные гены. Эти наблюдения поднимают такие очевидные вопросы, как вопрос о том, каким образом RNAi связана с ковалентной модификацией гистонов в формировании «молчащего» хроматина, и вопрос о том, как конкретные районы генома становятся мишенью для такой направляемой RNAi модификации хроматина и сайленсинга. У многих организмов экспрессия специфических dsRNA, гомологичных рассматриваемому гену, приводит либо к транскрипционному (модификация ДНК/хроматина) сайленсингу гена (TGS), либо к посттранскрипционному (деградация иРНК) сайленсингу гена (PTGS). Может ли любая dsRNA у дробянковых дрожжей процессироваться так, что образует siRNAs, и индуцируют ли такие siRNAs только посттранскрипци-онный сайленсинг (РНК-нокдаун) или же они могут осуществлять также и модификации хроматина (например, H3K9me2), которые сайленсируют транскрипцию с гомологичного гена? Экспрессия dsRNAs, гомологичных репортеру GFR, продуцирует siRNAs, которые вызывают редукцию транскриптов GFP, но транскрипционная активность репортерного гена GFP не снижается Таким образом, хотя GFP-siRNAs понижают уровни иРНК GFP, они не способны осуществлять модификации хроматина, которые приводят к транскрипционному сайленсингу. Эти GFP-siRNAs должны, следовательно, действовать лишь посттранскрипционно, разрушая иРНК GFP (Sigova et al., 2004). Неясно, почему GFP-siRNAs не индуцируют модификацию хроматина на гомологичном гене, но это может быть связано с природой синтезирующегося транскрипта или с силой промотора RNA pol II, приводящей в действие экспрессию GFP. Какая РНК-полимераза отвечает за транскрипцию центромерных повторов? Мутация любой издвух субъединиц RNApol II (Rpb2 и Rpb7) приводит к дефектному сайленсингу центромер (Djupedal et al., 2005; Kato et al., 2005), хотя эти мутации демонстрируют очень разные фенотипы. У мутанта rpb7-1 обнаруживаются пониженные уровни транскрипции центромерных повторов, что приводит к меньшему образованию ncRNA и, следовательно, меньшему образованию siRNA и утрате «молчащего» хроматина. Это означает, что RNA pol II необходима для транскрипции центромерных повторов, чтобы обеспечить первичный субстрат для RNAi. Напротив, у мутанта грЬ2-т203 центромерные транскрипты образуются, но они не процессируются в siRNA, и содержание H3K9me в центромерах уменьшается. Эти исследования показывают не только то, что для RNAi требуется транскрипт RNApol II, но и что, подобно другим событиям процессинга РНК, образование центромерной siRNA может быть сопряжено с транскрипцией через взаимодействия между машинерией RNAi, хроматином, модифицирующими ферментами и RNA pol II (рис. 6.6). Возможно, что ассоциированные с RITS siRNAs могут «наводиться» на синтезируемые транскрипты по мере того, как они появляются из RNA pol II, занятой гомологичным локусом. Коль скоро происходит узнавание, комплекс RITS-siRNA мог бы стабилизироваться на этих транскриптах, результатом чего могло бы стать рекрутирование таких модифицирующих хроматин активностей, как Clr4 Удивительно, что центромерные siRNAs также исчезают в клетках, лишенных активности HKMT Clr4 (Noma et al., 2004; Hong et al., 2005). Возможно, что отсутствие Clr4 влияет на продукцию siRNA путем дестабилизации связей между различными компонентами в интерфейсе между транскрипцией, RNAi и модификацией хроматина (Motamedi et al., 2004). Альтернативная возможность сводится к тому, что метилирование H3K9 может быть необходимо для того, чтобы сделать возможным генерацию siRNAs в cis-конфигурации посредством действия различных активностей, осуществляющих процессинг РНК (например, RdRP), на первичные центромерные транскрипты (рис. 6.6) (Noma et al., 2004; Sugiyama et al., 2005; глава 8).1.7. «Молчащий» хроматин в центромерах необходим для опосредования когезии сестринских центромер и нормальной сегрегации хромосом
Как гетерохроматин центромерных внешних повторов и CENP-ACnp1-хроматин кинетохора влияют на общую функцию расхождения хромосом? Зависимый от Clr4 «молчащий» хроматин собирается на внешних повторах в центромерах, в родственном повторе в локусе типа спаривания и по соседству с теломерами. Эксперименты с «голыми» плазмидными ДНК-конструктами [naked DNA plasmid constructs] показали, что внешние повторы каким-то образом вносят свой вклад в сборку функциональной центромеры, наделяя эти Cen-плазмиды способностью сегрегировать на митотическом и мейотическом веретене. Но ни внешних повторов, ни центрального домена самих по себе недостаточно для сборки функциональной центромеры (Clarke and Baum, 1990; Takahashi et al., 1992; Baum et al., 1994; Ngan and Clarke, 1997; Pidoux and Allshire, 2004). Puc. 6.6. Транскрипция центромерных повторов связывает RNAi, образование гетерохроматина и когезию
Транскрипция внешних повторов с помощью RNA pol II обеспечивает первичный субстрат для RNAi и зависимого от Dicer образования siRNA. Загрузка Ago1 в комплексе RITS (Ago1, Tas3, Chp1) молекулами siRNA делает возможным «нацеливание» гомологичного транскрипта. Действие RDRC (Rdpl, Cidl2 и Hrrl) делало бы возможной продукцию dsRNA, обеспечивая большее количество субстрата для Dcr1 для производства siRNA и, возможно, усиления сигнала. Взаимодействия между транскриптом, субъединицами RNA pol II и компонентами RNAi рекрутируют Clr4, который метилирует гистон H3 по лизину 9, делая возможным связывание хромодоменных белков, рекрутирование когезина и когезию сестринских центромер
Puc. 6.6. Транскрипция центромерных повторов связывает RNAi, образование гетерохроматина и когезию
Транскрипция внешних повторов с помощью RNA pol II обеспечивает первичный субстрат для RNAi и зависимого от Dicer образования siRNA. Загрузка Ago1 в комплексе RITS (Ago1, Tas3, Chp1) молекулами siRNA делает возможным «нацеливание» гомологичного транскрипта. Действие RDRC (Rdpl, Cidl2 и Hrrl) делало бы возможной продукцию dsRNA, обеспечивая большее количество субстрата для Dcr1 для производства siRNA и, возможно, усиления сигнала. Взаимодействия между транскриптом, субъединицами RNA pol II и компонентами RNAi рекрутируют Clr4, который метилирует гистон H3 по лизину 9, делая возможным связывание хромодоменных белков, рекрутирование когезина и когезию сестринских центромер
Мутанты, вызывающие утрату сайленсинга во внешних повторах (т.е. дефектные по Clr4, компонентам RNAi или Swi6), повысили частоту утери хромосом в митозе и встречаемость отстающих хромосом на веретенах поздней анафазы (рис. 7а) (Allshire et al., 1995; Ekwall et al., 1996; Bernard et al., 2001; Nonaka et al., 2002; Hall et al., 2003; Volpe et al., 2003). Клетки без Swi6 дефектны по когезии в центромерах, но сохраняют когезию вдоль хромосомных плеч (Bernard et al., 2001; Nonaka et al., 2002). Формирование должным образом би-ориентированного веретена требует, чтобы сестринские кинетохоры прикреплялись к микротрубочковым фибрилам, отходящим от противоположных полюсов веретена. Силы, прилагаемые к би-ориентированным кинетохорам, требуют, чтобы сестринские кинетохоры прочно удерживались вместе (рис. 6.76). Swi6 необходим для рекрутирования когезина к хроматину внешних повторов и, тем самым, опосредует прочную физическую когезию между сестринскими центромерами (рис. 6.6). Таким образом, одна из функций «молчащего» хроматина в центромерах — быть посредником в когезии. Когезин также прочно ассоциирован с теломерами и районом mat2-mat3 (Bernard et al., 2001; Nonaka et al., 2002). Кроме того, когезин также рекрутируется к «молчащему» хроматину, сформированному на гене ura+ в ответ на расположенный рядом эктопический центромерный повтор (рис. 6.5), подчеркивая связь между «молчащим» хроматином и когезией (Partridge et al., 2002). Таким образом, рекрутирование когезина, по-видимому, является общим свойством ассоциированного со Swi6 «молчащего» хроматина. Каким образом Swi6-хроматин осуществляет рекрутирование когезина — неизвестно, но Swi6 взаимодействует с субъединицей Psc3 когезина (Nonaka et al., 2002). Кроме того, Dfp1, регуляторная субъединица консервативной киназы Hskl (Cdc7), взаимодействует с Swi6 и требуется для рекрутирования когезина к центромерам (Bailis et al, 2003). Эта функциональная связь между гетерохроматином и когезией хроматид, по-видимому, сохраняется и у других организмов, поскольку уменьшение содержания компонента RNAi, Dicer, по-видимому, влияет на целостность гетерохроматина и когезию сестринских центромер в клетках позвоночных (Fukagawa et al., 2004).
1.8. Эпигенетическое наследование функционального состояния центромеры
Интересное эпигенетическое явление было описано в отношении сборки функциональных центромер у дробянковых дрожжей на плазмидах, содержащих минимальные участки для центромерной функции. Хотя конструкты, сохраняющие лишь часть внешнего повтора и большую часть центрального домена, собирают функциональную центромеру неэффективно, но, как это ни удивительно, коль скоро это активное функциональное состояние центромеры установлено, оно может воспроизводиться в ряду многих митотических делений и даже в мейозе (Steiner and Clarke, 1994; Ngan and Clarke, 1997). Одно из объяснений этого сводится к тому, что внешние повторы обеспечивают среду, благоприятную для сборки кинетохора (Pidoux and Allshire, 2005), но, будучи собранным, CENP-ACnp1-хроматин (и, следовательно, кинетохор) воспроизводится в этом положении с помощью матричного механизма, который может быть сопряжен с репликацией (Takahashi et al., 2005). Возможно, что гетерохроматин каким-то образом индуцирует откладку CENP-ACnp1 в центральном домене или способствует ей (рис. 6.8) и что один только блок гетерохроматина не обеспечивает эффективную сборку кинетохора. Альтернативное объяснение заключается в том, что один внешний повтор не достаточен для рекрутирования достаточных количеств когезина, и это приводит к дефектной центромерной когезии и повышенным частотам утери хромосом. Такие центромерные конструкты после нескольких клеточных делений могут стохастически накапливать достаточные количества когезина, результатом чего оказывается увеличенная митотическая стабильность. Однажды достигнутое, это стабилизированное состояние должно каким-то образом дуплицироваться на дочерних молекулах, чтобы сделать возможным его воспроизведение в последующих делениях (рис. 6.8). Рис. 6.7. Утрата гетерохроматина приводит к дефектному расхождению хромосом
(а) Клетки, лишенные RNAi или компонентов гетерохроматина, обнаруживают увеличенную частоту хромосомных потерь и отстающих хромосом на веретенах в поздней анафазе, (б) Отстающие хромосомы в клетках с дефектным гетерохроматином могут быть результатом дезорганизации кинетохоров, так что одна центромера может прикрепляться к микротрубочкам от противоположных полюсов. Такая меротелическая ориентация могла бы сохраняться при переходе в анафазу; разрыв прикрепления к одному или другому полюсу приводил бы к случайной сегерегации, результатом чего были бы случаи потери-приобретения хромосом
Рис. 6.7. Утрата гетерохроматина приводит к дефектному расхождению хромосом
(а) Клетки, лишенные RNAi или компонентов гетерохроматина, обнаруживают увеличенную частоту хромосомных потерь и отстающих хромосом на веретенах в поздней анафазе, (б) Отстающие хромосомы в клетках с дефектным гетерохроматином могут быть результатом дезорганизации кинетохоров, так что одна центромера может прикрепляться к микротрубочкам от противоположных полюсов. Такая меротелическая ориентация могла бы сохраняться при переходе в анафазу; разрыв прикрепления к одному или другому полюсу приводил бы к случайной сегерегации, результатом чего были бы случаи потери-приобретения хромосом
 Рис. 6.8. Установление и поддержание хроматина CENP-A
ДНК центрального домена сама по себе не способна устанавливать функциональную центромеру; необходимы внешние повторы. Утрата гетерохроматина из установленных центромер не влияет на сборку CENP-ACnp1 или кинетохора на центральном домене. Это позволяет предполагать, что гетерохроматин каким-то образом указывает сайт CENP-ACnp1-хроматина и, тем самым, сборки кинетохора. Неизвестно, как CENP-ACnp1-хроматин откладывается в нуклеосомах или каким образом этот специализированный хроматин поддерживается в центральном домене
Рис. 6.8. Установление и поддержание хроматина CENP-A
ДНК центрального домена сама по себе не способна устанавливать функциональную центромеру; необходимы внешние повторы. Утрата гетерохроматина из установленных центромер не влияет на сборку CENP-ACnp1 или кинетохора на центральном домене. Это позволяет предполагать, что гетерохроматин каким-то образом указывает сайт CENP-ACnp1-хроматина и, тем самым, сборки кинетохора. Неизвестно, как CENP-ACnp1-хроматин откладывается в нуклеосомах или каким образом этот специализированный хроматин поддерживается в центральном домене
Как упоминалось выше, TSA также может устанавливать дефектное по центромере состояние, вызываемое утратой сайленсинга (Ekwall et al., 1997). С учетом связи между формированием «молчащего» хроматина и когезией в центромерах представляется вероятным, что индуцированное TSA гиперацетилирование блокирует эффективную реконструкцию «молчащего» хроматина посредством RNAi и что дефектная функция центромеры воспроизводится благодаря утрате сайленсинга и, таким образом, когезии сестринских центромер (дополнительные детали см. в главе 14).
1.9. Различные механизмы сайленсинга у грибов
В первой половине этой главы мы описали, как у одного, относительно простого эукариотного организма, дробянковых дрожжей S. pombe, репортерные гены сайленсируются двумя разными типами хроматина в центромерах. Хроматин CENP-A расположен в середине центромеры и фланкирован с обеих сторон блоками гетерохроматина. Хроматин CENP-A маркирует район, над которым формируется кинетохор, предположительно прикрепляющийся к микротрубочкам. RNAi используется при формировании фланкирующего гетерохроматина для «нацеливания» некодирующих транскриптов. получаемых с внешних повторов, и поставляет модифицирующие хроматин энзимы, такие как Clr4 (H3K9-метилтрансфераза гистонов), которая создает сайты связывания для хромодоменных белков и, тем самым, прочного сайленсинга. Этот гетерохроматин участвует в центромерной функции, обеспечивая плотную физическую когезию и, возможно, способствуя организации кинетохора. Использование RNAi в формировании «молчащего» хроматина в центромерах может быть производным от ее роли в защите генома от РНК-вирусов и мобильных элементов, как это было описано у растений. В самом деле, возможно, что сами центромерные повторы являются остатками древних мобильных элементов. В пользу этой возможности говорят ранние исследования центромер нитчатого гриба N. crassa — объекта второй половины этой главы. Хотя у пары разных грибов, представленных в этой главе, работают несомненно общие эпигенетические механизмы, ясно, что эти грибы демонстрируют серьезные различия, как это описано ниже. Например, в отличие от хорошо изученных почкующихся и дробянковых дрожжей Neurospora использует метилирование ДНК — классический эпигенетический процесс, общий для таких высших эукариот, как млекопитающие и цветковые растения Кроме того, исследования на Neurospora вскрыли несколько независимых систем сайленсинга, действующих на разных стадиях ее жизненного цикла. Первый такой механизм, названный механизмом точечных мутаций, индуцируемых повторами (RIP — repeat-induced point mutation), имеет как эпигенетические, так и генетические аспекты и несомненно служит в качестве системы защиты генома. Второй механизм, названный механизмом подавления (quelling), представляет собой основанный на RNAi механизм, который приводит к сайленсингу трансгенов и их нативных гомологов. Третий, названный мейотическим сайленсингом с помощью неспаренной ДНК (MSUD — meiotic silencing by unpaired DNA), также базируется на RNAi, но отличается от подавления (quelling) временем своего действия, мишенями и предполагаемой целью. Хотя мы все еще находимся в начале эпигенетических исследований у всех организмов, включая модельные грибы, представленные в этой главе, уже ясно, что S. pombe и N. crassa будут по-прежнему служить богатым источником информации по эпигенетическим механизмам, действующим у эукариот.2. Neurospora crassa: история и особенности организма
Нитчатый гриб Neurospora crassa (рис. 6.9 и 6.10) впервые сделан экспериментальным организмом Доджем (Dodge) в конце 1920-х годов и примерно 10 годами позже приспособлен Бидлом и Тейтумом (Beadle и Tatum) для своих знаменитых исследований в рамках концепции «один ген — один белок», связывающих биохимию и генетику (Davis, 2000). Бидл и Тейтум выбрали Neurospora отчасти потому, что этот организм быстро растет и легко размножается на ростовых средах определенного состава, а также потому, что на Neurospora просто выполнять такие генетические манипуляции, как мутагенез, тесты на комплементацию и картирование. Neurospora, хотя и не столь широко используется, как некоторые модельные эукариоты, продолжает привлекать исследователей в силу ее умеренной сложности и потому, что она хорошо подходит для разнообразных генетических, эмбриологических [developmental] и субклеточных исследований (Borkovich et al., 2004). Neurospora оказалась особенно полезной для исследований по фотобиологии, циркадным ритмам, популяционной биологии, морфогенезу, митохондриальному импорту, репарации и рекомбинации ДНК, метилированию ДНК и другим эпигенетическим процессам. Жизненный цикл N. crassa проиллюстрирован на рис. 6.9. Вегететивная фаза начинается, когда либо половая спора (аскоспора), либо бесполая спора (конидий) прорастают, давая начало многоядерной клетке, которая формирует разветвляющиеся нити (гифы; рис. 6.10В). Два типа спаривания (А и а) морфологически неразличимы (рис. 6.10Б). Для прорастания аскоспор требуется тепловой шок, что удобно, тогда как конидии прорастают спонтанно. Система гиф быстро распространяется (линейный рост >5 мм в час при 37°С), образуя «мицелий». После того как мицелий хорошо развился, образуются воздушные гифы, продуцирующие многочисленные оранжевые конидии, характерные для этого организма (рис. 6.10А,Б). Конидии, содержащие от одного до нескольких ядер каждый, могут либо служить началом новых вегетативных культур, либо осуществлять оплодотворение в скрещиваниях. Если питательные вещества ограничены, Neurospora готовится вступить в половую фазу своего цикла, продуцируя заново образующиеся плодовые тела («протоперитеции»). Когда специализированная гифа («трихогина»), выступающая из протоперитециума, контактирует с тканью противоположного типа спаривания, ядро подхватывается [is picked up] и транспортируется обратно в протоперитеций. Половая фаза Neurospora и других нитчатых аскомицетов отличается от таковой у дрожжей тем, что имеет продолжительную гетерокариотическую фазу между оплодотворением и кариогамией (слиянием ядер). Гетерокариотические клетки, получающиеся в результате оплодотворения, разрастаются в развивающийся перитеций. При конечных делениях эти клетки двухъядерные и содержат по одному ядру каждого типа спаривания. Эти клетки изгибаются, образуя крючковидные клетки («crazier» — «епископский посох»), происходит последний митоз, дающий четыре ядра, и создаются септы, давая одну двухъядерную клетку в крючке «посоха». Эта клетка дает начало аску. Генетический анализ показал, что, в целом, -100 асков (или более) перитеция происходят от одного материнского и одного отцовского ядра. Когда происходит кариогамия, получающееся диплоидное ядро немедленно вступает в мейоз. Таким образом, диплоидная фаза жизненного цикла непродолжительна и ограничена одной клеткой. Продукты мейоза претерпевают одно митотическое деление, а затем упаковываются в аскоспоры и в развивающихся аскоспорах проходят дополнительные митозы (см. рис. 6.9 и Davis, 2000). Рис. 6.9. Жизненный цикл N. crassa
Указываются стадии, на которых происходят эпигенетические процессы, описанные в тексте (с любезного разрешения, из: Shiii et al. 2001, с изменениями)
Рис. 6.9. Жизненный цикл N. crassa
Указываются стадии, на которых происходят эпигенетические процессы, описанные в тексте (с любезного разрешения, из: Shiii et al. 2001, с изменениями)
Геном N. crassa (~40 млн о.) состоит из семи хромосом с примерно 10000 предсказанными генами, кодирующими белки (Galagan et al., 2003), и общей длиной генетической карты, равной, огрубленно, 1000 единицам (Perkins et al., 2001). Лишь около 10 % этого генома состоят из повторяющейся ДНК, и, помимо тандемного порядка из -70 копий сегмента рДНК длиной ~9 т.н., кодирующего три большие рРНК, большая часть повторяющейся ДНК состоит из инактивированных перемещающихся элементов. Тот факт, что большинство штаммов Neurospora не имеет активных транспозонов и имеет очень мало близких паралогов, почти наверняка отражает действие RIP, первой открытой у эукариот системы защиты генома, зависящей от гомологии (Selker, 1990). Мы знаем, что у Neurospora имеются по крайней мере три процесса сайленсинга генов, которые должны служить для консервации структуры генома: RIP, подавление (quelling) и MSUD (Borkovich et al., 2004). У всех этих процессов имеются эпигенетические аспекты и все они имеют прямые или косвенные связи с метилированием ДНК — базовым эпигенетическим механизмом, обнаруживаемым у Neurospora и многих других эукариот. Мы обсудим метилирование ДНК, а затем RIP, подавление (quelling) и MSUD.
2.1. Метилирование ДНК у Neurospora
Со времени своего открытия десятилетия тому назад метилирование ДНК у эукариот остается в высшей степени загадочным. Все еще вызывают споры такие базовые вопросы, как вопрос о том, что определяет, какие именно хромосомные районы метилируются, и какова функция метилирования ДНК. Neurospora проявила себя как превосходная система для изучения контроля и функции метилирования ДНК. У некоторых модельных эукариот, в том числе нематоды С. elegans и дрожжей S. cerevisiae и S. pombe, сколько-нибудь заметное метилирование ДНК отсутствует, а сообщения о метилировании ДНК у еще одного модельного организма, D. melanogaster, остаются спорными. У некоторых организмов, таких как млекопитающие, метилирование ДНК имеет существенное значение для выживаемости, усложняя некоторые анализы. В ДНК Neurospora около 1,5 % цитозинов метилированы, но этим метилированием можно пренебречь, что облегчает генетические исследования. Хотя следует быть осторожным при экстраполяции с одной системы на другую, по крайней мере некоторые аспекты метилирования ДНК оказываются консервативными. Например, все известные ДНК-метилтрансферазы (DMTs), включая DMTs и прокариот, и эукариот, обнаруживают поразительную гомологию в своих каталитических доменах (Grace Goll and Bestor, 2005). Полученные за последнее десятилетие данные по Neurospora, Arabidopsis, мышам и другим системам выявили как важное сходство, так и интересные различия в контроле и функциях метилирования ДНК, демонстрируя ценность проведения исследований на многих модельных системах. Рис. 6.10. Изображения N. crassa
(А) Вегетативный рост в природных условиях на сахарном тростнике (фото D. Jackobson; Stanford University)
(Б) Агаровые «косяки» с вегетативными культурами N. crassa в лаборатории (фото N.B.Raju, Stanford University)
(В) Гифы N. crassa, окрашенные DAPI, чтобы показать многочисленные ядра (фото М. Springer, Stanford University).
(Г) Розетка созревающих асков, демонстрирующая разные паттерны аскоспор. (Г перепечатано, с любезного разрешения, из: Raju, 1980 [©Elsevier])
Рис. 6.10. Изображения N. crassa
(А) Вегетативный рост в природных условиях на сахарном тростнике (фото D. Jackobson; Stanford University)
(Б) Агаровые «косяки» с вегетативными культурами N. crassa в лаборатории (фото N.B.Raju, Stanford University)
(В) Гифы N. crassa, окрашенные DAPI, чтобы показать многочисленные ядра (фото М. Springer, Stanford University).
(Г) Розетка созревающих асков, демонстрирующая разные паттерны аскоспор. (Г перепечатано, с любезного разрешения, из: Raju, 1980 [©Elsevier])
Открытие метилирования ДНК у Neurospora первоначально вызвало интерес в связи с тем, что оно не было ограничено симметричными сайтами, такими как динуклеотиды CpG или тринуклеотиды CpNpG. Риггс (Riggs), а также Холлидей и Нью (Holliday и Pugh), предложили привлекательную модель для «наследования» или «поддержания» паттернов метилирования, базирующуюся на симметричной природе метилированных сайтов у животных. Хотя результаты разнообразных исследований in vitro и in vivo были в пользу модели «поддерживающей метилазы» (глава 18), можно представить себе и механизмы поддерживающего метилирования, которые не основываются на точном копировании в симметричных сайтах; такие механизмы могут действовать у ряда организмов (см., например: Selker et al., 2002). Вероятность того, что наблюдаемое метилирование в асимметричных сайтах представляло собой «метилирование de novo», казалась очень привлекательной, потому что механизмы, слепо воспроизводящие паттерны метилирования, могут усложнять определение нуклеотидных последовательностей, метилируемых изначально [in the first place]. Действительно, проведенные на Neurospora исследования с ДНК-опосредованной трансформацией и ингибиторами метилирования продемонстрировали воспроизводящееся метилирование de novo (см., например: Singer et al., 1995). Дополнительные исследования определили, отчасти, основные сигналы для метилирования de novo (см., например: Tamaru and Selker, 2003).
 Рис. 6.11. Индуцированная повторами точечная мутация (RIP)
Для упрощения показаны лишь две хромосомы. Пустой прямоугольник представляет ген или любой хромосомный сегмент, который во время дупликации (например, в штамме, показанном наверху справа) подвержен R1P (символизируется знаком молнии) между оплодотворением и кариогамией. Результаты генетических экспериментов показывают, что дупликации могут повторно подвергаться залпам транзиций С в Т (символизируются заполненными прямоугольниками) на протяжении этого периода времени, равного -10 митозам, как раз к конечному премейотическому синтезу ДНК [right up to the final premeiotic DNA synthesis] (Selker et al., 1987; Watters et al., 1999). Показаны четыре возможные комбинации хромосом в потомстве, и красное «т» изображает метилирование ДНК, которое часто (хотя и не всегда) связано с продуктами RIP
Рис. 6.11. Индуцированная повторами точечная мутация (RIP)
Для упрощения показаны лишь две хромосомы. Пустой прямоугольник представляет ген или любой хромосомный сегмент, который во время дупликации (например, в штамме, показанном наверху справа) подвержен R1P (символизируется знаком молнии) между оплодотворением и кариогамией. Результаты генетических экспериментов показывают, что дупликации могут повторно подвергаться залпам транзиций С в Т (символизируются заполненными прямоугольниками) на протяжении этого периода времени, равного -10 митозам, как раз к конечному премейотическому синтезу ДНК [right up to the final premeiotic DNA synthesis] (Selker et al., 1987; Watters et al., 1999). Показаны четыре возможные комбинации хромосом в потомстве, и красное «т» изображает метилирование ДНК, которое часто (хотя и не всегда) связано с продуктами RIP
Первым метилированным пэтчем, охарактеризованным в деталях, был участок длиной 1,6 т.о., который состоит из дивергировавшей тандемной дупликации сегмента ДНК длиной 0,8 т.о., включающего ген 5S рРНК. Сравнение этого участка с соответствующим хромосомным районом таких штаммов, у которых этой дупликации нет, первоначально привело к идее, что повторяющиеся последовательности могут каким-то образом индуцировать метилирование ДНК, и в конце концов привело к открытию системы защиты генома, названной RIP. Расшифровка RIP показала, что повторяющиеся последовательности не могут прямо включать метилирование ДНК, по крайней мере у Neurospora; вместо этого повторы включают RIP, который тесно связан с метилированием ДНК, как описано ниже. И район ?-?, и район ?63, второй метилированный район, открытый у Neurospora, являются продуктами RIP. Более того, последующие анализы метилирования ДНК по всему геному обнаружили, что большинство метилированных участков у Neurospora являются реликтами транспозонов, инактивированных RIP (Galagan et al., 2003; Selker et al., 2003). Действительно, единственное метилирование ДНК у Neurospora, которое , возможно, не является результатом RIP, — это метилрование в тандемных порядках рРНК (Perkins et al., 1986).
2.2. RIP — система защиты генома, имеющая как генетические, так и эпигенетические аспекты
RIP был открыт в результате детального анализа потомства от скрещиваний трансформантов Neurospora (Selker 1990). Обратили внимание на то, что дуплицированные последовательности — как нативные, так и чужеродные, как сцепленные, так и несцепленные — подвержены многочисленным поляризованным мутациям типатранзиций (G:C в А:Т) в гаплоидных геномах специальных двухъядерных клеток, получающихся в результате оплодотворения (рис. 6.12). Эксперименты, в которых стабильность гена тестировали, когда он был один в геноме или в комбинации с несцепленным гомологом, показали, что RIP не просто ассоциирован с повторами; он действительно индуцируется повторами. В дуплицированных последовательностях в одном пассаже с половым циклом могут мутировать примерно до 30 % пар G:C. Нередко (но не всегда) последовательности, измененные RIP, становятся метилированными de novo. Вполне вероятно, что мутации, индуцированные RIP, происходят путем ферментативного дезаминирования 5-meС или путем дезаминирования С, сопровождающегося репликацией ДНК (Selker, 1990). Метилирование цитозинов включает образование промежуточного соединения, склонного к спонтанному дезаминированию; это заставляет предполагать, что этап RIP, связанный с предполагаемым дезаминированием, мог бы катализироваться DMT или DMT-подобным энзимом. С этой возможностью согласуется тот факт, что один из двух гомологов DMT, предсказанных по геномной последовательности Neurospora, участвует в RIP (Freitag et al., 2002). Потомство от гомозиготных скрещиваний мутантов с дефектами в этом гене, rid (RIP defective), не дает новых случаев RIP. Мутанты rid не обнаруживают сколько-нибудь заметных дефектов в метилировании ДНК, фертильности, росте или развитии. Напротив, второй гомолог DMT у Neurospora (DIM-2), который был идентифицирован генетически и который, как было показано, необходим для всех известных видов метилирования ДНК, не требуется для RIP (Kouzminova and Selker, 2001). Рис. 6.12. Мутации от RIP и статус метилирования восьми аллелей am
Вертикальными линиями обозначены мутации. Аллели, изображенные черным цветом, были неметилированными, аллели, изображенные синим, были первоначально метилированными, но, после того, как с помощью 5-азацитидина или путем клонирования и замещения гена была индуцирована утрата метилирования, не стали реметилированными. Аллели, изображенные красным цветом, были не только изначально метилированы, но и включали метилирование de novo (из Singer et al., 1995, с изменениями)
Рис. 6.12. Мутации от RIP и статус метилирования восьми аллелей am
Вертикальными линиями обозначены мутации. Аллели, изображенные черным цветом, были неметилированными, аллели, изображенные синим, были первоначально метилированными, но, после того, как с помощью 5-азацитидина или путем клонирования и замещения гена была индуцирована утрата метилирования, не стали реметилированными. Аллели, изображенные красным цветом, были не только изначально метилированы, но и включали метилирование de novo (из Singer et al., 1995, с изменениями)
Все указывает на то, что каждая дупликация достаточной величины (больше чем ~400 п.н. для тандемной дупликации или -1000 п.н. для несцепленной дупликации) подвержена RIP в некоторой доле специальных двухъядерных клеток. Тем не менее, дупликации с некоторой частотой (обычно менее 1 % для тандемной дупликации или -50 % для несцепленной дупликации) избегают RIP. Даже дупликации хромосомных сегментов, содержащих многочисленные гены, чувствительны к RIP (Perkins et al., 1997; Bhat and Kasbekar, 2001). Хотя RIP ограничен половой фазой жизненного цикла, существование этого процесса ставит вопрос о том, может ли Neurospora использовать дупликации генов для эволюции. В геномной последовательности обнаружили семейства генов, но практически все паралоги, как оказалось, достаточно дивергировали, чтобы не включать RIP (Galagan and Selker, 2004). Мы приходим к заключению, что RIP действительно может ограничивать эволюцию у Neurospora. Интересно, что некоторые грибы демонстрируют то, что, по-видимому, является мягкими системами защиты генома, сходными с RIP. Наиболее заметный пример — премейотически индуцируемое метилирование (MIP), процесс, выявляющий сцепленные и несцепленные дупликации последовательностей в период между оплодотворением и кариогамией подобно RIP, но зависящий для инактивации исключительно от метилирования ДНК; в последовательностях, инактивированных MIP, не было обнаружено никаких свидетельств мутаций (Rossignol and Faugeron 1994).
2.3 Исследования реликтов RIP позволило проникнуть в контроль метилирования ДНК
Неканоническое поддерживающее метилирование
Обнаружение того, что одна DMT, а именно DIM-2, ответственна за все выявляемое метилирование ДНК, было столь же удивительным, как и первоначальное обнаружение безудержного Irampant] метилирования в несимметричных сайтах у Neurospora, поскольку ни для одной ранее идентифицированной DMT не было известно, чтобы она метилировала цитозины в разнообразных по последовательности контекстах. Очевидный, но важный вопрос заключался в следующем: обязательно ли метилирование в несимметричных сайтах отражает потенциальную способность соответствующих последовательностей индуцировать метилирование de novo? Ранние опыты по трансформации не противоречили такой возможности; метилированные последовательности, лишенные их метилирования (например, с помощью клонирования), вновь обретали свое нормальное метилирование, будучи реинтродуцированы в вегетативные клетки. С сюрпризом столкнулись, однако, когда восемь аллелей гена ат, сгенерированных RIP, были протестированы на их способность индуцировать метилирование de novo (Singer et al., 1995). Некоторые продукты RIP с относительно немногочисленными мутациями (рис. 6.12, amRIP3 и amRIP4) не сделались реметилированными, даже в своем нормальном локусе; это позволяло предположить, что наблюдаемое метилирование представляло собой воспроизведение метилирования, установленного ранее. Важно отметить, что их метилирование, подобно другому метилированию, наблюдаемому у Neurospora, не было ограничено симметричными сайтами, не распространялось сколько-нибудь существенно с течением времени и было «гетерогенным» в том смысле, что паттерн метилированных остатков не был инвариантным в пределах клональной популяции клеток. Таким образом, это метилирование, хотя и зависимое от предшествовавшего метилирования, установленного в половой фазе (вероятно, с помощью RIP), могло не отражать действие «поддерживающей метилазы» того типа, который предполагался в оригинальной модели наследования паттернов метилирования. Заслуживает внимания, что MIP у Ascobolus, результатом которого также является гетерогенное метилирование, представляет первое доказательство воспроизведения метилирования ДНК у грибов (Rossignol and Faugeron, 1994). Способность Neurospora осуществлять поддерживающее метилирование была подтверждена экспериментально (Selker etal., 2002). Интересно, что воспроизведение метилирования оказалось сиквенс-специфичным (т.е. оно работает не на всех последовательностях), что добавляет новое измерение к концепции поддерживающего метилирования Хотя можно представить себе ряд возможных схем, результатом которых будет воспроизведение метилирования ДНК, действительный механизм, работающий у Neurospora, остается неизвестным. В принципе, поддержание метилирования в несимметричных сайтах могло бы зависеть от метилирования близлежащих симметричных сайтов, но наблюдаемое гетерогенное метилирование, включая сайты CpG, делает этот вариант маловероятным. Механизмы обратной связи с участием белков, ассоциированных с метилированной ДНК, могли бы приводить к метилированию, зависящему от предсуществующего метилирования, т.е. к поддерживающему метилированию. Как обсуждается ниже, данные, полученные на Neurospora (и других организмах), означают участие модификаций гистонов в контроле метилирования ДНК, указывая тем самым на возможную роль гистонов в поддерживающем метилированииУчастие гистонов в метилировании ДНК
Первым указанием на роль гистонов в метилировании ДНК было наблюдение, что обработка Neurospora ингибитором деацетилазы гистонов трихостатином А (TSA) снижала уровень метилирования в некоторых хромосомных районах (Selker, 1998). Селективность деметилирования под воздействием TSA могла бы отражать дифференциальный доступ к ацетилтрансферазам гистонов, но это не было достаточно тщательно исследовано (Selker et al., 2002). Благодаря исследованиям с мутантом dim-5 у Neurospora хроматин был однозначно связан с контролем метилирования ДНК. Этот мутант, подобно штаммам dim-2, обнаруживает полную утрату метилирования ДНК. SET-доменный белок DIM-5 оказался метилтрансферазой гистона H3, которая специфически триметилирует лизин 9 (Tamaru and Selker, 2001; Tamaru et al., 2003). Подтверждение того, что гистон H3 является физиологически релевантным субстратом DIM-5, дали два наблюдения: (1) замещение лизина 9 в H3 другими аминокислотами вызывает утрату метилирования ДНК и (2) триметил-лизин 9 обнаруживается специфически в метилированных участках хромосом. Открытие того, что метилирование гистонов контролирует метилирование ДНК, по крайней мере у Neurospora, привело к постановке двух важных вопросов: (1) Что говорит белку DIM-5, какие нуклеосомы надо метилировать? (2) Что считывает триметильную метку и передает эту информацию к DMT, DIM-2? Факторы, контролирующие DIM-5, не были определенным образом идентифицированы, но имеются серьезные предположения, что он контролируется одним или несколькими белками, распознающими продукты RIP, и состоянием модификации аминокислотных остатков по соседству с местом его действия (Selker et al., 2002). Последнее должно давать возможность DIM-5 интегрировать информацию о том, должна ли быть метилирована ДНК в определенном участке, и дает возможное объяснение наблюдению, что TSA может ингибировать метилирование ДНК в некоторых районах. Данные, полученные на других системах, привели к открытию того, что считывает триметильную метку на лизине 9 гистона H3 у. Знания о том, что НР1, белок, впервые идентифицированный у Drosophila (глава 5), связывается с метилированным лизином 9 гистона H3 in vitro, стимулировали поиски гомолога HPI у Neurospora. Вероятный гомолог был найден, и его участие в метилировании ДНК было протестировано методом дизрупции гена (Freitag et al., 2004а). Ген, названный hpo (НРопе), действительно оказался существенным для метилирования ДНК. Для еще одной проверки того, считывает ли НР1 у Neurospora метку, сгенерированную DIM-5, изучили его субклеточную локализацию у штаммов дикого типа и dim-5 У дикого типа HP1-GFP локализовался в гетерохроматиновых фокусах, но эта локализация была утрачена у dim-5; это подтверждало, что HPI Neurospora рекрутируется меткой (триметиллизин 9), сгенерированной DIM-5. Данные о том. что РНК-интерференция (RNAi) играет важную роль в формировании и поддержании гетерохроматина у S. pombe, ставят вопрос о том, участвует ли машинерия RNAi у Neurospora в локализации НР1 и (или) метилировании ДНК. У Neurospora есть гомологи ряда генов, участвующих в RNAi (Borkovich et al., 2004). Исследования мутантов с нуль-мутациями во всех трех генах РНК-зависимой PHК-полимеразы (RdRP), в обоих генах Dicer или в других генах, предположительно относящихся к RNAi, не обнаружили никаких свидетельств того, что RNAi участвует в метилировании H3K9. формировании гетерохроматина или метилировании ДНК у Neurospora (Chicas et al., 2004; Freitag et al., 2004c). Однако, как обсуждается ниже, гены RNAi у Neurospora принимают участие, по крайней мере, в двух других механизмах сайленсинга, имеющих эпигенетические аспекты: в «подавлении» (quelling) и в мейотическом сайленсинге.2.4. «Подавление» (quelling)
Вскоре после того, как для Neurospora были разработаны методы трансформации, исследователи в нескольких лабораториях заметили, что заметная доля (например, ~30 %) трансформантов Neurospora обнаруживают сайленсинг трансформирующей ДНК и, что еще более удивительно, сайленсинг нативных последовательностей, гомологичных последовательностям трансформирующей ДНК. Эта последняя форма сайленсинга в вегетативной фазе была названа лабораторией Макино (Macino) «подавлением» («quelling»). К настоящему времени эта лаборатория выполнила большую часть исследований этого феномена (Pickford et al., 2002). Подавление выглядит наиболее демонстративно с видимыми маркерами, такими как гены albino, которые кодируют ферменты, необходимые для биосинтеза каротиноидов (рис. 6.13). Полагают, что оно сопоставимо с «косупрессией» или _ посттранскрипционным сайленсингом генов (PTGS) у растений. Интересно, что гены, по-видимому, варьируют по своей чувствительности к подавлению. Для генов, которые чувствительны, подавление кажется самым обычным у трансформантов, несущих множественные копии трансформирующей ДНК, расположенные компактно. Ядра свободно плавают в гифах Neurospora, создавая ситуации «гетерокариоза», в которых генетически различающиеся ядра находятся в общей цитоплазме. Таким образом, легко показать, что «подавление» является «доминантным»; т.е. трансформированное ядро может сайленсировать гомологичные последовательности в соседних ядрах (Cogoni et al., 1996). Это предполагает наличие цитоплазматического фактора сайленсинга, возможно какой-то РНК. В согласии с этой возможностью идентификация генов, участвующих в «подавлении», показала, что «подавление» тесно связано с RNAi в других системах (Pickford et al., 2002). Говоря конкретно, qde-1, qde-2, qde-3, dcl-1 и dcl-2 кодируют, соответственно, RdRP, белок, подобный белку “Argonaute”, который, как полагают, участвует в направляемом малыми интерферирующими РНК (siRNA) расщеплении иРНК (Baumberger and Baulcombe 2005), RecQ-подобную презумптивную ДНК-геликазу (йву-3) и два «Dicer», которые предположительно участвуют в образовании siRNA (Catalanotto et al., 2004). Хотя критические детали пока отсутствуют, разрабатываемая модель сводится к тому, что в некоторых случаях трансформирующая ДНК генерирует «аберрантный» транскрипт, который каким-то образом включает машинерию RNAi, что ведет к деградации гомологичных иРНК. Хотя метилирование ДНК часто связано с трансформирующей ДНК, ни метил-трансфераза ДНК, DIM-2, ни метилтрансфераза лизина 9 гистона H3, DIM-5, для подавления не нужны (Cogoni et al., 1996; Chicas et al., 2005). Рис. 6.13. Подавление (quelling)
Для простоты изображены лишь две из семи хромосомы (отрезки прямых линий в серых кругах, представляющих ядра). Нативный ген albino (al) показан темно-оранжевым прямоугольником на верхней хромосоме; другой (темно-оранжевый или желтый) прямоугольник представляет эктопические последовательности al, введенные путем трансформации. Поскольку трансформированные клетки часто являются многоядерными, трансформанты, как показано, часто бывают гетерокариотическими. Независимо от того, включает ли трансформирующая ДНК весь кодирующий район или нет, у некоторых трансформантов он сайленсирует («подавляет») нативный ген аl+ как в трансформированных, так и в нетрансформированных ядрах посредством неидентифицированной trans-действующей молекулы (красные линии, отходящие от трансформирующей ДНК, обозначенной желтым прямоугольником). Результатом этого оказывается слабопигментированная или альбинотическая (Аl-) ткань у некоторых трансформантов, как это показано на рисунке
Рис. 6.13. Подавление (quelling)
Для простоты изображены лишь две из семи хромосомы (отрезки прямых линий в серых кругах, представляющих ядра). Нативный ген albino (al) показан темно-оранжевым прямоугольником на верхней хромосоме; другой (темно-оранжевый или желтый) прямоугольник представляет эктопические последовательности al, введенные путем трансформации. Поскольку трансформированные клетки часто являются многоядерными, трансформанты, как показано, часто бывают гетерокариотическими. Независимо от того, включает ли трансформирующая ДНК весь кодирующий район или нет, у некоторых трансформантов он сайленсирует («подавляет») нативный ген аl+ как в трансформированных, так и в нетрансформированных ядрах посредством неидентифицированной trans-действующей молекулы (красные линии, отходящие от трансформирующей ДНК, обозначенной желтым прямоугольником). Результатом этого оказывается слабопигментированная или альбинотическая (Аl-) ткань у некоторых трансформантов, как это показано на рисунке
2.5. Мейотический сайленсинг, осуществляемый неспаренной ДНК (MSUD)
MSUD, самое недавнее добавление к списку механизмов сайленсинга, действующих у Neurospora, был открыт Метценбергом и его сотрудниками (Агашауо and Metzenberg, 1996; Shiu et al., 2001; Shiu and Metzenberg, 2002) в ходе анализа любопытного наблюдения, заключавшегося в том, что мутация типа делеции в гене Asm-1 (созревание аскоспор) является функционально доминантной. Серия элегантных экспериментов, изображенная на рис. 6.14, привела к выводу, что последовательности, лишенные партнера по спариванию в мейотической профазе, вызывают мейотический сайленсинг идентичных или почти идентичных последовательностей. Наблюдение, что деления Awz-1 является доминантной (рис. 6.146), могло объясняться тем, что остающаяся единичная доза гена продуцирует неадекватный генный продукт, но эту возможность сделало маловероятной наблюдение, что функциональная копия этого гена в эктопическом положении не может комплементировать дефект (рис. 6.14в). Напротив, только одна функциональная копия этого гена требовалась в мейозе, если у функциональной аллели был партнер по спариванию, т.е. ее партнер мог нести мутации, делающие его неспособным производить функциональный продукт (рис. 6.14г). Нормальная мейотическая экспрессия этого гена наблюдалась у штамма, имеющего спаренные эктопические аллели и делеции нативного гена на обоих гомологах, что свидетельствовало о том, что сама по себе делеция не была «токсичной» и что эктопические копии действительно были функциональными (рис. 6.14д). Интересно, что некоторые аллели, индуцированные RIP, вызывают (elicit) MSUD, если эти штаммы способны к метилированию ДНК. но не могут вызвать MSUD в штаммах dim-2; это заставляет предполагать, что метилирование ДНК, нередко ассоциированное с такими аллелями, может подавлять спаривание (сравни рис. 6.14 г и 6.14 е) (Pratt et al., 2004). (Кстати говоря, это наблюдение дает нам также первое доказательство того, что DIM-2 является функциональным в половой фазе Neurospora.) Аллели с высокой плотностью мутаций, индуцированных RIP, оказались, подобно делециям, доминантными (рис. 6.14ж) (Shiu et al., 2001; Shiu and Metzenberg, 2002; Pratt et al., 2004), что согласуется с гипотезой о том, что они не способны спариваться с аллелью дикого типа Для того чтобы разграничить две возможности — что MSUD обусловлен отсутствием спаривания и что он обусловлен присутствием неспаренной аллели, — исследователи проанализировали скрещивание, в котором мейотическое ядро имело три копии гена: две аллели дикого типа (которые должны спариваться) и эктопическую копию (которая должна быть неспаренной). Наблюдался сайленсинг, что означало, что MSUD является результатом присутствия неспаренных аллелей, а не отсутствия спаренных аллелей (рис. 6.14з). MSUD можно наблюдать цитологически в скрещиваниях, гетерозиготных по гену, кодирующему белок, меченный [таггированный — tagged] GFP, как это показано на рис. 6.15. Охота за мутантами, дефектными по MSUD, привела к идентификации эффективного [telling] члена машинерии MSUD. Ген Sad-1 (Supressor of ascus dominance — супрессор доминантности асков), идентифицированный путем отбора мутантов, способных проходить через скрещивание, в котором asm-1 не спарен, кодирует RdRP (Shiu et al., 2001). Это позволяло предполагать, что MSUD родствен «подавлению» (quelling) у Neurospora и, в целом, RNAi. Интересно, что геном Neurospora содержит гены, которые, согласно предсказанию, кодируют три предполагаемых RdRP (одна, необходимая для «подавления», одна — для MSUD и одна с неизвестной функцией), два белка, подобных Argonaute (один для «подавления» и один для MSUD) и два белка, подобных Dicer. Было бы замечательно, если бы удалось выяснить детальный механизм MSUD Рис. 6.14. Мейотический сайленсинг. вызываемый неспаренной MHK(MSUD)
Изображение тестов, проведенных в лабораториях Метценберга и Арамайо (Aramayo and Metzenberg, 1996; Shiuetal., 2001; Prattet al., 2004), описавших это явление Показаны только две из семи хромосомы Neurospora; их нуклеотидные последовательности изображены, соответственно, зеленым и синим цветом Прямоугольником показан ген, нормально функционирующий в мейозе. Вертикальными линиями показаны мутации, а метилирование ДНК показано красным цветом. Делеции изображены в виде пустых промежутков. Пояснения см. в тексте
Рис. 6.14. Мейотический сайленсинг. вызываемый неспаренной MHK(MSUD)
Изображение тестов, проведенных в лабораториях Метценберга и Арамайо (Aramayo and Metzenberg, 1996; Shiuetal., 2001; Prattet al., 2004), описавших это явление Показаны только две из семи хромосомы Neurospora; их нуклеотидные последовательности изображены, соответственно, зеленым и синим цветом Прямоугольником показан ген, нормально функционирующий в мейозе. Вертикальными линиями показаны мутации, а метилирование ДНК показано красным цветом. Делеции изображены в виде пустых промежутков. Пояснения см. в тексте
2.6. Вероятные функции и практическое использование RIP, «подавления» и MSUD
RIP, по-видимому, «изготовлен по специальному заказу», чтобы ограничить экспрессию «эгоистичной ДНК», такой как транспозоны, которыеуправляют производством собственных копий в геноме. В соответствии с этой возможностью, огромное большинство реликтов RIP обладает очевидным сходством с транспозонами, известными у других организмов, а большинство штаммов Neurospora не имеют активныхтранспозонов (Galagan et al., 2003; Selker et al., 2003). Тем не менее, поскольку RIP ограничен премейотическими двухъядерными клетками, этот процесс не должен ни предотвращать распространение нового (например, «горизонтально» приобретенного) транспозона в вегетативных клетках, ни препятствовать дупликации однокопийного транспозона в мейотических клетках. Рис. 6.15. Neurospora crassa
Флуорограмма розетки созревающих асков от гетерозиготного скрещивания трансформанта, сконструированного таким образом, что он экспрессирует гистон Н1, меченный (tagged) GFP Четыре аскоспоры в каждом аске обнаруживают светящиеся ядра (Freitag et al., 2004b) (фото любезно предоставлено N.B. Raju, Stanford University)
Рис. 6.15. Neurospora crassa
Флуорограмма розетки созревающих асков от гетерозиготного скрещивания трансформанта, сконструированного таким образом, что он экспрессирует гистон Н1, меченный (tagged) GFP Четыре аскоспоры в каждом аске обнаруживают светящиеся ядра (Freitag et al., 2004b) (фото любезно предоставлено N.B. Raju, Stanford University)
Однако с такими возможными ситуациями должны справляться механизмы «подавления» и MSUD. Хотя «подавление» не полностью супрессирует распространение транспозонов в вегетативных клетках, о чем свидетельствует пролиферация интродуцированной копии транспозона Tad, подобного LINE, оно («подавление») действительно частично сайленсирует такие транспозоны (Nolan et al., 2005). Информация о действии MSUD позволяет считать, что этот процесс будет сайленсировать любую транспозированную последовательность в мейотических клетках, даже если она присутствует лишь в виде единственной копии в геноме (Shiu et al., 2001). Кроме борьбы с блуждающими транспозонами в мейозе MSUD, по-видимому, играет также важную роль в процессе видообразования, как показывает наблюдение, согласно которому мутанты, дефектные по MSUD, ослабляют стерильность штаммов, несуших большие дупликации хромосомных сегментов, и создают возможность скрещивания близкородственных видов с N. crassa (Shiu et al., 2001). Хотя RIP, «подавление» и MSUD могут быть помехой в некоторых генетических экспериментах, все эти явления были использованы для исследовательских целей. RIP дал первый простой способ нокаута генов у Neurospora и все еще остается предпочтительным методом получения мутантов с частичной функцией. «Подавление» тоже было использовано для уменьшения, если не полного устранения, функции гена — во многом так же, как была использована RNAi у целого ряда организмов. A MSUD дает простой способ протестировать, требуются ли те или иные конкретные гены для функционирования в мейозе (или сразу после него); если оказывается, что ген, будучи дуплицирован или находясь в эктопическом положении, вызывает стерильность, и эта стерильность устраняется мутацией, блокирующей MSUD, можно с уверенностью принять, что он играет важную роль в мейозе. Кроме этих эволюционных ролей, постулированных для RIP, «подавления» и MSUD, а также их полезности в лабораторных исследованиях следует рассмотреть возможность того, что эти процессы используются и иным образом. Например, тот факт, что функция Sad-1 необходима для полной фертильности, позволяет предполагать, что MSUD, прямо или косвенно, необходим для мейоза (Shiu and Metzenberg, 2002). В случае RIP (хотя этот процесс и не является существенным) распределение продуктов RIP в геноме Neurospora позволяет предполагать, что «мусорные» (junked) транспозоны могут служить организму в качестве субстрата для формирования кинетохоров — во многом так же, как служат повторяющиеся последовательности у S. pombe и других организмов. Анализ нуклеотидных последовательностей ДНК хромомосмы 7 показывает, что последовательности вокруг генетически картированных центромер Neurospora состоят в основном из остатков транспозонов, интенсивно мутировавших в результате действия RIP (рис. 6.16). Реликты RIP обнаруживаются также по соседству с теломерными последовательностями Neurospora. Интересно, что транспозоны и остатки транспозонов обычно обнаруживаются и в гетерохроматиновых последовательностях других организмов, таких как Drosophila (глава 5), млекопитающие (глава 17), растения (глава 9) и другие грибы.
3. Заключительные замечания
Грибы S. pombe и N. crassa оказались мощными системами для обнаружения и объяснения эпигенетических явлений. Эпигенетика как область науки все еще находится в стадии младенчества, и эпигенетические механизмы продолжают появляться на свет. Поэтому не удивительно, что глубина и широта нашего сегодняшнего понимания таких эпигенетических процессов, как те, что описаны в настоящей главе, варьируют от организма к организму. Еще слишком рано судить о том, насколько общими являются описанные эпигенетические механизмы. Например, возможно, что для сайленсинга и формирования гетерохроматина некоторые организмы, подобно S. pombe, базируются главным образом на RNAi, тогда как другие, такие как N. crassa, основываются в большей степени на метилировании ДНК. Уже ясно, что даже эти два этих модельных эукариотных организма обладают и важными различиями, и существенным сходством. Оба организма используют метилирование гистона H3K9 и RNAi, при том что ни один из этих механизмов не обнаружен у почкующихся дрожжей, S. cerevisiae. Из этих трех грибов, однако, только Neurospora практикует метилирование ДНК. Стоит также заметить, что данный процесс может быть функционально довольно различным у этих двух организмов. Например, у Neurospora участие компонентов RNAi предполагается в «подавлении» и мейотическом сайленсинге, но не в формировании гетерохроматина, тогда как у дробянковых дрожжей компоненты RNAi вносят вклад в формирование гетерохроматина, но другие их роли не установлены. Наконец, следует отметить, что даже такие обшие черты, как гетерохроматин, ассоциированный с центромерами, у дробянковых дрожжей и у Neurospora могут обладать важными различиями. Важная цель на будущее состоит в том, чтобы открыть, в какой степени информация, собранная на одном организме, приложима к другим объектам. Дальнейшие исследования эпигенетических процессов у различных модельных организмов, в том числе S. pombe и N. crassa, дадут эту информацию. Мы надеемся, что грибы как чрезвычайно разнообразные организмы будут продолжать служить полезными системами для эпигенетических исследований на многие годы. Рис. 6.16. Организация района центромеры 7 у N. crassa
Были собраны контиги 249,255 и 21 релиза 7.0 геномной последовательности (http://www.broad.mit.edu/annorntion/fungi-neurospora_crassa_7/index.html) и все кроме первых 400 т.о. последовательности контига 10, и этот объединенный файл последовательностей был проанализирован с инкрементом 200 п.н. на «индексы RIP» (ТрА/АрТ [синий цвет] и CpA+TpG/ApC+GpT [красный цвет]) (Galagan et al., 2003; Selker et al., 2003; Galagan and Selker, 2004). Район длиной -360 т.о. с высокой плотностью перемещаемых элементов (ТЕ), инактивированных RIP (остатки ретротранспозонов — синий цвет, остаток ДНК-транспозона — фиолетовый цвет), был обнаружен между маркерами, фланкирующими центромеру, которая была картирована генетически. Изображенный сегмент длиной -1.5 млн о. включает 383 аннотированных гена (над линией и под ней, чтобы показать гены в противоположных ориентациях), из которых только 20 коротких предсказанных гена находятся в пределах предсказанного центромерного района. Размеры перерывов в последовательности [sequence gaps] между контигами (позиции 0.5466, 0.6956 и 0.9058 млн о. на рисунке) неизвестны
Рис. 6.16. Организация района центромеры 7 у N. crassa
Были собраны контиги 249,255 и 21 релиза 7.0 геномной последовательности (http://www.broad.mit.edu/annorntion/fungi-neurospora_crassa_7/index.html) и все кроме первых 400 т.о. последовательности контига 10, и этот объединенный файл последовательностей был проанализирован с инкрементом 200 п.н. на «индексы RIP» (ТрА/АрТ [синий цвет] и CpA+TpG/ApC+GpT [красный цвет]) (Galagan et al., 2003; Selker et al., 2003; Galagan and Selker, 2004). Район длиной -360 т.о. с высокой плотностью перемещаемых элементов (ТЕ), инактивированных RIP (остатки ретротранспозонов — синий цвет, остаток ДНК-транспозона — фиолетовый цвет), был обнаружен между маркерами, фланкирующими центромеру, которая была картирована генетически. Изображенный сегмент длиной -1.5 млн о. включает 383 аннотированных гена (над линией и под ней, чтобы показать гены в противоположных ориентациях), из которых только 20 коротких предсказанных гена находятся в пределах предсказанного центромерного района. Размеры перерывов в последовательности [sequence gaps] между контигами (позиции 0.5466, 0.6956 и 0.9058 млн о. на рисунке) неизвестны
Благодарности
R.C.A. благодарит Alison L. Pidoux и Sharon A White за Рис. 4 и Рис. 3, соответственно; а также Alison L. Pidoux и Elizabeth Н. Bayne за замечания по рукописи. Исследования в лаборатории Allshire поддержаны the Wellcome Trust, MRC, и the EC FP6 Epigenome Network of Excellence. R.CA. является a Wellcome Trust Principal Research Fellow. E.U.S. благодарит N.B. Raju за помошь в подборе рисунков по Neurospora и Robert L. Metzenberg за замечания по рукописи. Исследования в Selker-лаборатории поддерживаются U.S. Public Health Service grant GM35690 от the National Institutes of Health и National Science Foundation grant MCB0131383.Литература
Allshire R.C., Javerzat J.P., Redhead N.J., and Cranston G. 1994. Position effect variegation at fission yeast centromeres. Cell 76: 157-169. Allshire R.C., Nimmo E.R., Ekwall K., Javerzat J.P., and Cranston G. 1995. Mutations derepressing silent centromeric domains in fission yeast disrupt chromosome segregation. Genes Dev. 9: 218-233. Aramayo R. and Metzenberg R.L. 1996. Meiotic transvection in fungi. Cell 86: 103-113. Ayoub N., Goldshmidt 1., Lyakhovetsky R., and Cohen A. 2000. A fission yeast repression element cooperates with centromere-like sequences and defines a mat silent domain boundary. Genetics 156: 983-994. Bailis J.M., Bernard P., Antonelli R., Allshire R.C., and Forsbuig S.L. 2003. Hskl-Dfp1 is required for heterochromatin-mediated cohesion at centromeres. Nat. Cell Biol. 5: 1111-1116. Bannister A. J., Zegerman P., Partridge J.F., Miska E.A., Thomas J.O., Allshire R.C., and Kouzarides T. 2001 Selective recognition of methylated lysine 9 on histone H3 by the HP1 chromo domain. Nature 410: 120-124. Baum M., Ngan V.K., and Clarke L. 1994. The centromeric K-type repeat and the central core are together sufficient to establish a functional Schizosaccharomyces pombe centromere. Mol. Biol. Cell 5: 747-761. Baumberger N. and Baulcombe D.C. 2005. Arabidopsis ARGO-NAUTE1 is an RNA Slicer that selectively recruits micro RNAs and short interfering RNAs. Proc. Natl. Acad. Sci. 102: 11928-11933. Bernard P, Maure J.F., Partridge J.F., Genier S., Javerzat J.P., and Allshire R.C. 2001. Requirement of heterochromatin for cohesion at centromeres. Science 294: 2539-2542. Bhat A. and Kasbekar D.P 2001. Escape from repeat-induced point mutation of a gene-sized duplication in Neurospora crassa crosses that are heterozygous for a larger chromosome segment duplication. Genetics 157: 1581-1590. Borkovich K.A., Alex L.A., Yarden O., Freitag M., Turner G.E., Read N.D., Seiler S., Bell-Pedersen D., Paietta J., Plesofsky N., et al., 2004. Lessons from the genome sequence of Neurospora crassa: Tracing the path from genomic blueprint to multicellular organism. Microbiol. Mol. Biol. Rev. 68: 1-108. Cam H.P., SugiyamaT., Chen E.S., Chen X., FitzGerald P.C., and Grewal S.I. 2005. Comprehensive analysis of heterochromatin- and RNAi-mediated epigenetic control of the fission yeast genome. Nat. Genet. 37: 809-819. Catalanotto C., Pallotta M., ReFalo P., Sachs M.S., Vayssie L., Macino G., and Cogoni C. 2004. Redundancy of the two dicer genes in transgene-induced posttranscriptional gene silencing in Neurospora crassa. Mol. Cell. Biol. 24: 2536-2545. Chen E.S., Saitoh S., Yanagida M., and Takahashi K. 2003. A cell cycle-regulated GATA factor promotes centromeric localization of CENP-A in fission yeast. Mol. Cell 11: 175-187. Chicas A.. Cogoni C., and Macino G. 2004. RNAi-dependent and RNAi-independent mechanisms contribute to the silencing of RIPed sequences in Neurospora crassa. Nucleic Acids Res. 32: 4237-4243. Chicas A., Forrest E.C., Sepich S., Cogoni C., and Macino G. 2005 Small interfering RNAs that trigger posttranscriptional gene silencing are not required for the histone H3 Lys9 methylation necessary for transgenic tandem repeat stabilization in Neurospora crassa. Mol. Cell. Biol. 25: 3793-3801. Clarke L. and Baum M.P. 1990. Functional analysis of a centromere from fission yeast: A role for centromere-specific repeated DNA sequences. Mol. Cell. Biol. 10: 1863-1872. Cleveland D.W., Mao Y., and Sullivan K.F. 2003. Centromeres and kinetochores: From epigenetics to mitotic checkpoint signaling. Cell 112: 407-421. Cogoni C., Irelan J.T., Schumacher M., Schmidhauser T.J., Selker E.U., and Macino G. 1996. Transgene silencing of the al-1 gene in vegetative cells of Neurospora is mediated by a cytoplasmic effector and does not depend on DNA-DNA interactions or DNA methylation. EMBO J. 15: 3153-3163. Cowieson N.P., Partridge J.F., Allshire R.C., and McLaughlin P.J. 2000. Dimerisation of a chromo shadow domain and distinctions from the chromodomain as revealed by structural analysis. Curr. Biol. 10: 517-525. Davis R.H. 2000. Neurospora: Contributions of a model organism. Oxford University Press, New York. Djupedal I., Portoso M., Spahr H., Bonilla C., Gustafsson C.M., Allshire R.C., and Ekwall K. 2005. RNA Pol II subunit Rpb7 promotes centromeric transcription and RNAi-directed chromatin silencing. Genes Dev. 19: 2301-2306. EgelR. 2004. The molecular biology o/Schizosaccharomyces pombe: Genetics, genomics and beyond. Springer-Verlag, Heidelberg, Germany Ekwall K.. Javerzat J.P., Lorcntz A.. Schmidt H.. Cranston G., and Allshire R. 1995. The chromodomain protein Swi6: A key component at fission yeast centromeres. Science 269: 1429-1431. Ekwall K., Nimmo E.R., Javerzat J.P., Borgstrom B., Egel R., Cranston G., and Allshire R. 1996. Mutations in the fission yeast silencing factors clr4+ and rikP disrupt the localisation of the chromo domain protein Swi6p and impair centromere function. J. Cell Sci. 109: 2637-2648. Ekwall K., Olsson T, Turner B.M., Cranston C., and Allshire R.C. 1997. Transient inhibition of histone deacetylation alters the structural and functional imprint at fission yeast centromeres. Cell 91: 1021-1032. Freitag M., Hickey P.C., Khlafallah T.K., Read N.D., and Selker E.U. 2004a. HP1 is essential for DNA methylation in Neurospora. Mol. Cell 13: 427-434. Freitag M., Hickey PC., Raju N.B., Selker E.U., and Read N.D. 2004b. GFP as a tool to analyze the organization, dynamics and function of nuclei and microtubules in Neurospora crassa. Fungal Genet. Biol. 41: 897-910. Freitag M., Lee D.W., Kothe C.O., Pratt R.J., Aramayo R., and Selker E.U. 2004c. DNA methylation is independent of RNA interference in Neurospora. Science 304: 1939. Freitag M., Williams R.L., Kothe G.O., and Selker E.U. 2002. A cytosine methyltransferase homologue is essential for repeat-induced point mutation in Neurospora crassa. Proc. Natl. Acad. Sci. 99: 8802-8807. Fukagawa T., Nogami M., Yoshikawa M., Ikeno M., Okazaki T., Takami Y., Nakayama T., and Oshimura M. 2004. Dicer is essential for formation of the heterochromatin structure in vertebrate cells. Nat. Cell Biol. 6: 784-791. Galagan I.E., Calvo S.E., Borkovich K.A., Selker E.U., ReadN.D., Jaffe D., FitzHugh W., Ma L.J., Smirnov S., Purcell S., et al., 2003. The genome sequence of the filamentous fungus Neurospora crassa. Nature 422: 859-868. Galagan J.E. and Selker E.U. 2004. RIP: The evolutionary cost of genome defense. Trends Genet. 20: 417-423. Goshima G., Saitoh S., and Yanagida M. 1999. Proper metaphase spindle length is determined by centromere proteins Misl2 and Mis6 required for faithful chromosome segregation. Genes Dev. 13: 1664-1677. Grace Goll M. and Bestor T.H. 2005. Eukaryotic cytosine methyl-transferases. Annu. Rev. Biochem. 74: 481-514. Grewal S.l. and Klar A.J. 1997. Arecombinationally repressed region between mat2 and mat3 loci shares homology to centromeric repeats and regulates directionality of mating-type switching in fission yeast. Genetics 146: 1221-1238. Hall I.M., Noma K., and Grewal S.L 2003. RNA interference machinery regulates chromosome dynamics during mitosis and meiosis in fission yeast. Proc. Natl. Acad. Sci. 100: 193-198. Hall I.M., Shankaranarayana G.D., Noma K., Ayoub N., Cohen A., and Grewal S.L 2002. Establishment and maintenance of a heterochromatin domain. Science 297: 2232-2237. Hayashi T., Fujita Y, lwasaki O., Adachi Y., Takahashi K., and Yanagida M. 2004. Misl6 and Misl8 are required for CENP-A loading and histone deacetylation at centromeres. Cell 118: 715-729. Hong E.-J.E., Villen J., Gerace E.L., Gygi S., and Moazed D. 2005 A cullin E3 ubiquitin ligase complex associates with Rikl and the Clr4 histone H3-K9 methyltransferase and is required for RNAi-mediated heterochromatin formation. RNA Biol. 2: 106 111. Irelan J.T., Gutkin G.I., and Clarke L. 2001. Functional redundancies, distinct localizations and interactions among three fission yeast homologs of centromere protein-B. Genetics 157: 1191-1203. Jia S., Noma K., and Grewal S.l. 2004. RNAi-independent heterochromatin nucleation by the stress-activated ATF/CREB family proteins. Science 304: 1971-1976. Jin Q.W., Pidoux A.L., Decker C., Allshire R.C, and Fleig U. 2002. The mal2p protein is an essential component of the fission yeast centromere. Mol Cell Biol 22: 7168-7183. Kanoh J., Sadaie M., Urano T., and Ishikawa F. 2005. Telomere binding protein Tazl establishes Swi6 heterochromatin independently of RNAi at telomeres. Curr. Biol. 15: 1808-1819. Kato H., Goto D.B., Martienssen R.A., UranoT., Furukawa K., and Murakami Y. 2005. RNA polymerase II is required for RNAi-dependent heterochromatin assembly. Science 309: 467-469. Kim H.S., Choi E.S., Shin J.A., Jang Y.K., and Park S.D. 2004. Regulation of Swi6/HPl-dependent heterochromatin assembly by cooperation of components of the mitogen-activated protein kinase pathway and a histone deacetylase Clr6. J. Biol. Chem. 279: 42850-42859. Kouzminova E.A. and Selker E.U. 2001. Dim-2 encodes a DNA-methyl-transferase responsible for all known cytosine methylation in Neurospora. EMBO J. 20: 4309-4323. Kuhn R.M., Clarke L., and Carbon J. 1991. Clustered tRNA genes in Schizosaccharomycespombe centromeric DNA sequence repeats. Proc. Natl. Acad. Sci. 88: 1306-1310. Measday V. and Hieter P 2004. Kinetochore sub-structure comes to MIND. Nat. Cell Biol. 6: 94-95. Mellone B.G., Ball L., SukaN., Grunstein M.R., Partridge J.E, and Allshire R.C. 2003. Centromere silencing and function in fission yeast is governed by the amino terminus of histone H3. Curr Biol 13: 1748-1757. Motamedi M.R., Verdel A., Colmenares S.U., Gerber S.A., Gygi S.P., and Moazed D. 2004. Two RNAi complexes, R1TS and RDRC, physically interact and localize to noncoding centromeric RNAs. Cell 119: 789-802. Nakagawa H., Lee J.K., Hurwitz J., Allshire R.C, Nakayama J., Grewal S.L, Tanaka K, and Murakami Y. 2002. Fission yeast CENP-B homologs nucleate centromeric heterochromatin by promoting heterochromatin-specific histone tail modifications. Genes Dev. 16: 1766-1778. Nakayama J., Klar A.J., and Grewal S.L 2000. A chromodomain protein, Swi6, performs imprinting functions in fission yeast during mitosis and meiosis. Cell 101: 307-317. Nakayama J., Rice J.C, Strahl B.D., Allis C.D., and Grewal S.L 2001. Role of histone H3 lysine 9 methylation in epigenetic control of heterochromatin assembly. Science 292: 110-113. Ngan V.K. and Clarke L. 1997. The centromere enhancer mediates centromere activation in Schizosaccharomyces pombe Mol. Cell. Biol. 17: 3305-3314. Nimmo E.R., Cranston C, and Allshire R.C 1994. Telomere-associated chromosome breakage in fission yeast results in variegated expression of adjacent genes. EMBO J. 13: 3801-3811. Nimmo E.R., Pidoux A.L., Perry PE., and Allshire R.C. 1998. Defective meiosis in telomere-silencing mutants of Schizosaccharomyces pombe. Nature 392: 825-828. Nolan T., Braccini L., Azzalin G., De Toni A., Macino G., and Cogoni C. 2005. The post-transcriptional gene silencing machinery functions independently of DNA methylation to repress a LINEl-like retro-transposon in Neurospora crassa. Nucleic Acids Res. 33: 1564-1573. Noma K., Allis C.D., and Grewal S.L 2001. Transitions in distinct histone H3 methylation patterns at the heterochromatin domain boundaries. Science 293: 1150-1155. Noma K., SugiyamaT., Cam H., Verdel A., Zofall M., Jia S., Moazed D., and Grewal S.L 2004. RITS acts in cis to promote RNA interference-mediated transcriptional and post-transcriptional silencing. Nat. Genet. 36: 1174-1180. Nonaka N., Kitajima T., Yokobayashi S., Xiao G., Yamamoto M., Grewal S.L, and Watanabe Y. 2002. Recruitment of cohesin to heterochromatic regions by Swi6/HPl in fission yeast. Nat. Cell Biol. 4: 89-93. Partridge J.F., Borgstrom B., and Allshire R.C. 2000. Distinct protein interaction domains and protein spreading in a complex centromere. Genes Dev. 14: 783-791. Partridge J.F., Scott K.S., Bannister A. J., KouzaridesT., and Allshire R.C. 2002. cis-acting DNA from fission yeast centromeres mediates histone H3 methylation and recruitment of silencing factors and cohesin to an ectopic site. Curr. Biol. 12: 1652-1660. Perkins D.D., Margolin B.S., Selker E.U., and Haedo S.D. 1997. Occurrence of repeat induced point mutation in long segmental duplications of Neurospora. Genetics 147: 125-136. Perkins D.D., Metzenberg R.L., Raju N.B., Selker E.U., and Barry E.G. 1986. Reversal of a Neurospora translocation by crossing over involving displaced rDNA, and methylation of the rDNA segments that result from recombination. Genetics 114: 791-817. Perkins D.D., Radford A., and Sachs M.S. 2001. The Neurospora compendium; Chromosomal loci. Academic Press, San Diego, California. Pickford A.S., Catalanotto C., Cogoni C., and Macino G. 2002. Quelling in Neurospora crassa. Adv. Genet. 46: 277-303. Pidoux A.L. and Allshire R.C. 2004. Kinetochore and heterochromatin domains of the fission yeast centromere. Chromosome Res. 12: 521-534. Pidoux A.L. and Allshire R.C. 2005. The role of heterochromatin in centromere function. Philos. Trans. R. Soc. Lond. B Biol. Sci. 360: 569-579. Pidoux A. L., Richardson W., and Allshire R.C. 2003. Sim4: A novel fission yeast kinetochore protein required for centromeric silencing and chromosome segregation. J. Cell Biol. 161: 295-307. Polizzi C. and Clarke L. 1991. The chromatin structure of centromeres from fission yeast: Differentiation of the central core that correlates with function. J. Cell Biol. 112: 191-201. Pratt R.J., Lee D.W., and Aramayo R. 2004. DNA methylation affects meiotic trans-sensing, not meiotic silencing, in Neurospora. Genetics 168: 1925-1935. Raju N.B. 1980. Meiosis and ascospore genesis in Neurospora. Eur. J. Cell Biol. 23: 208-223. Reinhart B.J. and Bartel D.P. 2002. Small RNAs correspond to centromere heterochromatic repeats. Science 297: 1831. Rossignol J.-L. and Faugeron G. 1994. Gene inactivation triggered by recognition between DNA repeats. Experientia 50: 307-317. Sadaie M., Iida T., Urano T., and Nakayama J. 2004. A chromodomain protein, Chp1, is required for the establishment of heterochromatin in fission yeast. EMBO J. 23: 3825-3835. Scott K.C., Merrett S.L., and Willard H.E 2006. Aheterochromatin barrier partitions the fission yeast centromere into discrete chromatin domains. Curr. Biol. 16: 119-129. Selker E.U. 1990. Premeiotic instability of repeated sequences in Neurospora crassa. Annu. Rev. Genet. 24: 579-613. Selker E.U. 1998. Trichostatin A causes selective loss of DNA methylation in Neurospora. Proc. Natl. Acad. Sci. 95: 9430-9435. Selker E.U., Cambareri E.B., Jensen B.C., and Haack K.R. 1987. Rearrangement of duplicated DNA in specialized cells of Neurospora. Cell 51: 741-752. Selker E.U., Freitag M., Kothe G.O., Margolin B.S., Rountree M.R., Allis C.D., and Tamaru H. 2002. Induction and maintenance of nonsymmetrical DNA methylation in Neurospora. Proc. Natl. Acad. Sci. (suppl. 4) 99: 16485-16490. SelkerE.U., TountasN.A., Cross S.H., Margolin B.S., Murphy J.G., Bird A.P., and Freitag M. 2003. The methylated component of the Neurospora crassa genome. Nature 422: 893-897. Shankaranarayana G.D., Motamedi M.R., Moazed D., and Grewal S.l. 2003. Sir2 regulates histone H3 lysine 9 methylation and heterochromatin assembly in fission yeast. Curr. Biol. 13: 1240-1246. Shiu P.K. and Metzenberg R.L. 2002. Meiotic silencing by unpaired DNA: Properties, regulation and suppression. Genetics 161: 1483-1495. Shiu P.K., Raju N.B., Zickler D., and Metzenberg R.L. 2001. Meiotic silencing by unpaired DNA. Cell 107: 905-916. Sigova A., Rhind N., and Zamore P.D. 2004. A single Argonaute protein mediates both transcriptional and posttranscriptional silencing in Schizosaccharomyces pombe. Genes Dev. 18: 2359-2367. Singer M.J., Marcotte B.A., and Selker E.U. 1995. DNA methylation associated with repeat-induced point mutation in Neurospora crassa. Mol. Cell. Biol. 15: 5586-5597. Steiner N.C. and Clarke L. 1994. A novel epigenetic effect can alter centromere function in fission yeast. Cell 79: 865-874. Steiner N.C, Hahnenberger K.M., and Clarke L. 1993. Centromeres of the fission yeast Schizosaccharomyces pombe are highly variable genetic loci. Mol. Cell. Biol. 13: 4578-4587. SugiyamaT., Cam E.L., Verdel A., Moazed D., and Grewal S.L 2005. RNA-dependent RNA polymerase is an essential component of a self-enforcing loop coupling heterochromatin assembly to siRNA production. Proc. Natl. Acad. Sci. 102: 152-157. Takahashi K., Chen E.S., and Yanagida M. 2000. Requirement of Mis6 centromere connector for localizing a CENP-A-like protein in fission yeast. Science 288: 2215-2219. Takahashi K., Murakami S., Chikashige Y., Funabiki E.L, Niwa O., and Yanagida M. 1992. A low copy number central sequence with strict symmetry and unusual chromatin structure in fission yeast centromere. Mol. Biol. Cell 3: 819-835. Takahashi K., Murakami S., Chikashige Y., Niwa O., and Yanagida M. 1991. A large number of tRNA genes are symmetrically located in fission yeast centromeres. J. Mol Biol. 218: 13-17. Takahashi K., Takayama Y., Masuda F., Kobayashi Y., and Saitoh S. 2005. Two distinct pathways responsible for the loading of CENP-A to centromeres in the fission yeast cell cycle. Philos. Trans. R. Soc. Lond. B Biol. Sci. 360: 595-607. Tamaru H. and Selker E.U. 2001. A histone H3 methyltransferase controls DNA methylation in Neurospora crassa. Nature 414: 277-283. Tamaru H. and Selker E.U. 2003. Synthesis of signals for de novo DNA methylation in Neurospora crassa. Mol.Cell. Biol. 23: 2379-2394. Tamaru E.L., Zhang X., McMillen D., Singh P.B., Nakayama J., Grewal S.L, Allis C.D., Cheng X., and Selker E.U 2003. Trim-ethylated lysine 9 of histone H3 is a mark for DNA methylation in Neurospora crassa. Nat. Genet. 34: 75-79. Thon G. and Verhein-Hansen J. 2000. Four chromo-domain proteins of Schizosaccharomyces pombe differentially repress transcription at various chromosomal locations. Genetics 155: 551-568. Volpe T., Schramke V., Hamilton G.L., White S.A., Teng G., Martiens-sen R.A., and Allshire R.C. 2003. RNA interference is required for normal centromere function in fission yeast. Chromosome Res. 11: 137-146. Volpe T.A., Kidner C., Hall I.M., Teng G., Grewal S.L, and Martienssen R.A. 2002. Regulation of heterochromatic silencing and histone H3 lysine-9 methylation by RNAi. Science 297: 1833-1837. WattersM.K.. RandallT.A., Margolin B.S., Selker E.U., and Stadler D.R. 1999. Action of repeat-induced point mutation on both strands of a duplex and on tandem duplications of various sizes in Neurospora. Genetics 153: 705-714. Wilkinson C.R., Bartlett R., Nurse P., and Bird A.P. 1995. The fission yeast gene pmtl+ encodes a DNA methyltransferase homologue. Nucleic Acids Res. 23: 203-210. Yamada T., Fischle W., SugiyamaT, Allis C.D., and Grewal S.L 2005. The nucleation and maintenance of heterochromatin by a histone deacetylase in fission yeast. Mol. Cell 20: 173-185.Глава 7. Эпигенетика инфузорий
 Eric Meyer1 и Douglas L. Chalker2
1Laboratoire de Cenetique Moleculaire, CNRS UMR 8541 Ecole Normale Superieure, 75005 Paris, France
2Department of Biology, Washington University, St. Louis, Missouri 63130
Eric Meyer1 и Douglas L. Chalker2
1Laboratoire de Cenetique Moleculaire, CNRS UMR 8541 Ecole Normale Superieure, 75005 Paris, France
2Department of Biology, Washington University, St. Louis, Missouri 63130
Общее резюме
Наверняка любой наблюдавший инфузорий под микроскопом был поражен этими сложными маленькими животными, использующих свои волосковидные реснички для плавания, питания и поисков партнера. Вегетативно растущие клетки удваиваются путем простого бинарного деления; тем не менее, периодически инфузории спариваются с партнерами или, у некоторых видов, претерпевают самооплодотворение, в результате чего получается половое потомство с иным генотипом. Уникальной отличительной чертой этих одноклеточных эукариот является то, что они поддерживают в общей цитоплазме два функционально различающихся генома, содержащихся в отдельных ядрах. Меньшее из них, микронуклеус, содержит геном зародышевой линии. Он транскрипционно «молчит» в ходе роста, но сохраняет генетическую информацию, которая передается потомству в каждом половом поколении. Более крупное ядро, макронуклеус, осуществляет соматические функции, поскольку отвечает за всю экспрессию генов и таким образом управляет фенотипом клетки. Он элиминируется в конце каждого вегетативного цикла, когда из зародышевой линии дифференцируется новый макронуклеус. Во время развития макронуклеуса в результате массивных перестроек ДНК создается отредактированная версия генома, готовая для экспрессии. Часть генома зародышевой линии, включая всю повторяющуюся ДНК, долгое время считавшуюся «мусорной», элиминируется, тогда как все гены, необходимые для выживания организма в жизненном цикле, амплифицируются до высокого уровня плоидности. Генетические странности инфузорий сделали их очень полезными модельными организмами для обнаружения и понимания эпигенетических механизмов. У некоторых видов два потомка-сибса, развивающиеся после спаривания, начинают свою жизнь с идентичными геномами, но их соматические ядра дифференцируются в контексте двух разных родительских клеток. Это позволяет легко выявлять наследственные признаки, которые не детерминируются исключительно ядерным геномом. Генетические эксперименты, проведенные с Paramecium tetraurelia, прежде всего эксперименты, проведенные Треси Соннеборном, дали одно из самых ранних описаний неменделевского наследования у эукариот вообще. Среди случаев, в которых генетически идентичные сибсы экспрессировали разные варианты специфических признаков, некоторые были истинными примерами цитоплазматической наследственности (материнского наследования ДНК органелл), но другие. такие как наследование типов спаривания особи, были случаями иного рода. Тип спаривания потомка не определялся его генотипом; скорее, он специфицировался предсуществующим типом родительской клетки, в которой развивался его соматический геном. Выражаясь простыми терминами, можно сказать, что разные внешние условия (родительская цитоплазма) направляют экспрессию альтернативных признаков, исходя из идентичных наборов ДНК. А это является отличительной чертой эпигенетики. Особая генетическая организация инфузорий предполагает также наличие механизмов, дифференциально регулирующих гомологичные последовательности, содержащиеся в разных ядрах. Ранние исследования имели целью выяснить способы, которыми зародышевая линия поддерживалась «молчащей», а соматический геном — транскрипционно активным. Компартментализация состояний генной экспрессии дала исследователям возможность изучать роль белков хроматина и их модификаций в эпигенетической регуляции. Они могли легко соотносить специфические гистоны и их модификации с транскрипционной активностью или стадией клеточного цикла. Например, в результате сравнения белков хроматина из ядер зародышевой линии и соматических ядер Tetrahymena thermophila были идентифицированы некоторые из первых вариантов гистонов. Далее у этой инфузории были идентифицированы такие новые регуляторы хроматина, как первая апетилтрансфераза гистонов (HAT) — отчасти за счет использования того факта, что только макронуклеус содержит ацетилированные гистоны. Хотя генетика инфузорий может показаться нестандартной, лежащие в ее основе механизмы широко используются для эпигенетической регуляции у эукариот, что иллюстрирует роль РНК-интерференции в перестройках целого генома. Степень и формы этих перестроек удивительно разнообразны у разных видов инфузорий, однако одна общая черта заключается в том, что они в норме направляют элиминацию транспозоноподобных элементов и других повторяющихся последовательностей. И у Paramecium, и у Tetrahymena с генома зародышевой линии во время мейоза генерируются короткие РНК. Обнаружение этих малых РНК, тот факт, что для перестроек ДНК у Tetrahymena требуются гомологи Argonaute и Dicer, позволили осознать, что здесь действует механизм, подобный РНК-интерференции. Полагают, что малые РНК нацеливают метилирование гистона H3 по лизину 9 на гомологичные последовательности, маркируя их для элиминации. Таким образом, с механистической точки зрения перестройки ДНК у инфузорий сходны с более широко используемым РНК-направляемым формированием хроматина. Использование RNAi для элиминации перемещаемых элементов еще более подчеркивает важность этого пути как механизма защиты генома. Далее, многие эксперименты показали, что паттерны перестроек ДНК не строго детерминированы геномом зародышевой линии, но контролируются — по крайней мере отчасти — предсуществующими перестройками в родительском соматическом геноме. Отсюда следует, что геномы зародышевой линии и соматический сравниваются друг с другом в ходе ядерной дифференпировки; это сравнение опосредуется, вероятно, зависящими от гомологии взаимодействиями между РНК зародышевой линии и соматическими. Полное понимание этого процесса несомненно позволит глубже проникнуть в роль РНК в эпигенетическом программировании генома.1. Инфузории: одноклеточные с двумя разными геномами
Инфузории, образующие монофилетическую группу, возникшую около одного миллиарда лет тому назад (Philippe et al. 2000), были среди первых одноклеточных эукариот, использованных в качестве генетических моделей. В конце 1930-х годов, когда Т.М.Соннеборн открыл типы спаривания у Paramecium aurelia (Sonnebom 1937), хромосомная теория наследственности, разработанная Т.Х.Морганом, всё еще не удовлетворяла многих исследователей, в особенности эмбриологов (исторические детали см. в главе 2). Будучи не способны представить себе, как такие статичные сущности, как гены, могут быть единственной основой наследственности, они полагали, что цитоплазма должна участвовать хотя бы только в координации действия генов (см. Harwood 1985). В то время как генетики в основном были сосредоточены на действии генов, ранний генетический анализ, выполненный Соннеборном, показал, что передачу многих наследуемых признаков нельзя было полностью объяснить менделевскими законами. Изучение инфузорий, благодаря их уникальной биологии, позволило обнаружить некоторые первые примеры цитоплазматической наследственности и продолжает обеспечивать новые возможности проникновения в эпигенетические механизмы. Одной из наиболее заметных черт инфузорий является ядерный диморфизм. Каждая клетка содержит ядра двух типов, различающихся по структуре и функции. Диплоидные микронуклеусы являются транскрипционно «молчащими» во время вегетативного роста, но содержат геном зародышевой линии. Эти ядра претерпевают мейоз и дают гаметические ядра, которые передают менделевский геном следующему половому поколению (рис. 7.1). В противоположность этому, высокополиплоидные макронуклеусы ответственны за экспрессию генов во время вегетативного роста и таким образом управляют фенотипом клетки, но они утрачиваются во время полового развития и могут, следовательно, рассматриваться как эквивалент сомы (рис. 7.1). Число ядер каждого типа варьирует у разных видов. Например, виды P. aurelia имеют два микронуклеуса и один макронуклеус, тогда как у Tetrahymena thermophila лишь по одному ядру каждого типа. Макро- и микронуклеусы делятся с помощью разных механизмов. Микронуклеусы делятся путем обычного закрытого митоза. Макронуклеусы, напротив, делятся с помощью все еще недостаточно изученного механизма. который не связан с образованием веретена или с видимой конденсацией не имеющих центромер соматических хромосом. После синтеза ДНК макронуклеус просто расщепляется на две приблизительно равные части. Какой-нибудь механизм, обеспечивающий равное распределение макронуклеарных хромосом в два дочерних ядра, по-видимому, отсутствует. Вместо этого, вероятно, высокий уровень плоидности (~800n у P. tetraurelia, ~45n у Т. thermophila) предотвращает летальную утрату генов на протяжении ряда вегетативных делений. Большинство видов обладают конечной продолжительностью вегетативной жизни, и клональные клеточные линии в конечном счете погибают, если не принимают участие в половом воспроизведении, прежде чем станут старыми.2. Конъюгация: реципрокное оплодотворение обнаруживает неменделевскую наследственность
Инфузории являются гермафродитными линиями, способными к конъюгации — процессу спаривания, включающему перекрестное оплодотворение между двумя родительскими клетками. Зрелые клетки соответствующего клонального возраста, обычно после легкого голодания, становятся сексуально реактивными и спариваются с клетками совместимых типов спаривания, чтобы начать конъюгацию. Если совместимый партнер отсутствует, некоторые виды обычно претерпевают процесс самооплодотворения, называемый автогамией. В обоих случаях за этим следует ядерная реорганизация, начинающаяся с мейоза микронуклеусов. Последовательность ядерных событий сходна у всех видов (хотя и имеются некоторые вариации) и изображена на рис. 7.1 для видов Р aurelia и Т. thermophila. (см. Sonnebom 1975). Постмейотическое развитие начинается с выбора единственного гаплоидного ядра в каждой клетке для передачи генома. Выбранное ядро претерпевает дополнительное деление, даюшее два генетически идентичных гаметических ядра. В случае конъюгации два партнера обмениваются одним из двух своих гаплоидных ядер, и поэтому последующая кариогамия (т.е. слияние двух гаплоидных ядер) формирует в каждом конъюганте генетически идентичные зиготические ядра (стадии 3—5 на рис. 7.1). При автогамии два гаметических ядра в одной клетке сливаются и образуют полностью гомозиготный диплоидный геном. В обоих случаях получающееся в результате диплоидное зиготическое ядро (стадия 5) делится еще два раза, и четыре продукта этих делений дифференцируются: два — в новые микронуклеусы, а два — в новые макронуклеусы (стадии 6 и 7). По завершении развития ядерного аппарата в новых вегетативных клонах сохраняются либо оба новых микронуклеуса, как это имеет место у видов P. aurelia, либо одно из двух ядер деградирует, как у Т. thermophila. У обоих видов два новых макронуклеуса при первом клеточном делении не делятся (стадия 9), а распределяются в две дочерние клетки; они начинают делиться только при втором вегетативном делении. В то время как родительские микронуклеусы дают начало новым микро- и макронуклеусам следующего поколения, родительский макронуклеус утрачивается. У P. aurelia он фрагментируется примерно на 30 кусков, в которых репликация ДНК быстро подавляется, хотя транскрипция активно продолжается на протяжении периода дифференцировки новых макронуклеусов. Когда вегетативный рост возобновляется, эти фрагменты распределяются случайным образом в дочерние клетки, пока не остается ни одного (стадия 9). У Т. thermophila родительский макронуклеус не фрагментируется, но пикнотизируется и деградирует по апоптозоподобному механизму до первого вегетативного деления (Davis et al. 1992) (стадии 7 и 8).
 Рис. 7.1. Жизненные циклы Paramecium (вверху) и Tetrahymena (внизу)
(Стадия 1) Вегетативные клетки размножаются бинарным делением. Половое развитие (стадии 2—8) обычно начинается после конъюгации двух клеток или автогамии (только у Paramecium).
(Стадии 2—3) Мейоз микронуклеуса заканчивается выбором одного из гаплоидных продуктов на роль гаметического ядра и дегенерацией остальных ядер. У Parmecium родительский макронуклеус начинает формировать лопасти.
(Стадии 4—6) Формирование зиготы. Дополнительное деление выбранного ядра дает два генетически идентичных гаплоидных ядра. В ходе конъюгации одно из этих двух идентичных гаметических ядер обменивается на такое же ядро между двумя партнерами, и последующая кариогамия дает диплоидное зиготическое ядро (красный цвет). В ходе автогамии два идентичных гаметических ядра просто сливаются вместе. Два дополнительных постзиготических деления (6) дают недифференцированные микро- и макронуклеусы.
(Стадии 6—8) Ядерная дифференцировка. После второго постзиготического деления из получившихся в результате ядер два становятся новыми микронуклеусами, тогда как два других начинают дифференцироваться в новые макронуклеусы (розовый цвет). У Paramecium материнский макронуклеус фрагментируется. У Tetrahymena он пикнотизируется. У Tetrahymena же один из новых микронуклеусов дегенерирует.
(Стадия 9) Карионидное деление: Это первое вегетативное деление является особым, поскольку новые макронуклеусы распределяются в дочерние клетки без деления, тогда как микронуклеусы расходятся в клетки-потомки путем митоза. Наконец, фрагменты родительского макронуклеуса у Paramecium не делятся, но сохраняются до тех пор, пока не утрачиваются в результате случайного распределения при последующих делениях
Рис. 7.1. Жизненные циклы Paramecium (вверху) и Tetrahymena (внизу)
(Стадия 1) Вегетативные клетки размножаются бинарным делением. Половое развитие (стадии 2—8) обычно начинается после конъюгации двух клеток или автогамии (только у Paramecium).
(Стадии 2—3) Мейоз микронуклеуса заканчивается выбором одного из гаплоидных продуктов на роль гаметического ядра и дегенерацией остальных ядер. У Parmecium родительский макронуклеус начинает формировать лопасти.
(Стадии 4—6) Формирование зиготы. Дополнительное деление выбранного ядра дает два генетически идентичных гаплоидных ядра. В ходе конъюгации одно из этих двух идентичных гаметических ядер обменивается на такое же ядро между двумя партнерами, и последующая кариогамия дает диплоидное зиготическое ядро (красный цвет). В ходе автогамии два идентичных гаметических ядра просто сливаются вместе. Два дополнительных постзиготических деления (6) дают недифференцированные микро- и макронуклеусы.
(Стадии 6—8) Ядерная дифференцировка. После второго постзиготического деления из получившихся в результате ядер два становятся новыми микронуклеусами, тогда как два других начинают дифференцироваться в новые макронуклеусы (розовый цвет). У Paramecium материнский макронуклеус фрагментируется. У Tetrahymena он пикнотизируется. У Tetrahymena же один из новых микронуклеусов дегенерирует.
(Стадия 9) Карионидное деление: Это первое вегетативное деление является особым, поскольку новые макронуклеусы распределяются в дочерние клетки без деления, тогда как микронуклеусы расходятся в клетки-потомки путем митоза. Наконец, фрагменты родительского макронуклеуса у Paramecium не делятся, но сохраняются до тех пор, пока не утрачиваются в результате случайного распределения при последующих делениях
3. Цитоплазматическая наследственность у инфузорий
Биология конъюгации P. aurelia чрезвычайно благоприятна для выявления эпигенетических явлений, связанных с влиянием цитоплазмы. В то время как реципрокное оплодотворение генерирует в двух конъюгантах генетически идентичные зиготические ядра, между ними почти не происходит обмена цитоплазмой, что позволяет эффективно различать действие ядерных генов от действия наиболее влиятельного фактора внешней среды — цитоплазмы материнской клетки (рис. 7.2). Каждое генетическое скрещивание поэтому эквивалентно изучению монозиготных близнецов, рожденных разными матерями. Исследования Соннеборна показали, что фенотипические различия между двумя родительскими клетками могут поддерживаться у потомков каждой из них даже несмотря на то, что эти потомки обладают идентичными генотипами. Позже оказалось, что в ряде случаев эти фенотипические различия детерминируются экстрануклеарными генами и сегодня не должны квалифицироваться как эпигенетические явления. Например, смертоносные свойства киллерных штаммов P. aurelia обусловлены обитающими в цитоплазме эндосимбиотическими бактериями рода Caedibacter; которые выделяют токсин, убивающий чувствительные штаммы (обзоры см. Preer et al., 1974; Pond et al., 1989). Другие случаи, такие как материнское наследование серотипа, которое требует взаимно исключающую экспрессию одного из нескольких паралогичных генов поверхностных антигенов, являются четкими случаями цитоплазматического влияния на активность генов. Рис. 7.2. Менделевская vs. цитоплазматическая наследственность
(а) Конъюгация и автогамия иллюстрируются скрещиванием между двумя клетками Paramecium, каждая из которых гомозиготна по разным аллелям, М или т. Конъюгация включает реципрокный обмен одним из двух идентичных гаметических ядер. В результате этого образуются клетки-эксконъюганты F1 с идентичными гетерозиготными генотипами. Автогамия (процесс самооплодотворения) генерирует полностью гомозиготный генотип всего в одном половом поколении, так что особи F2 имеют 50 %-ную вероятность стать М/М или m/m.
(б) Фенотипическое различие между клонами F1 выявляет цитоплазматически наследуемые признаки. У Paramecium тип спаривания (О или Е) необратимо детерминируется в ходе развития соматического макронуклеуса (большой кружок) из тотипотентного микронуклеуса зародышевой линии (маленький кружок); однако родительский макронуклеус направляет дифференцировку каждого эксконъюганта в направлении сохранения существующего типа спаривания
Рис. 7.2. Менделевская vs. цитоплазматическая наследственность
(а) Конъюгация и автогамия иллюстрируются скрещиванием между двумя клетками Paramecium, каждая из которых гомозиготна по разным аллелям, М или т. Конъюгация включает реципрокный обмен одним из двух идентичных гаметических ядер. В результате этого образуются клетки-эксконъюганты F1 с идентичными гетерозиготными генотипами. Автогамия (процесс самооплодотворения) генерирует полностью гомозиготный генотип всего в одном половом поколении, так что особи F2 имеют 50 %-ную вероятность стать М/М или m/m.
(б) Фенотипическое различие между клонами F1 выявляет цитоплазматически наследуемые признаки. У Paramecium тип спаривания (О или Е) необратимо детерминируется в ходе развития соматического макронуклеуса (большой кружок) из тотипотентного микронуклеуса зародышевой линии (маленький кружок); однако родительский макронуклеус направляет дифференцировку каждого эксконъюганта в направлении сохранения существующего типа спаривания
Как и серотипы, два комплементарных типа спаривания у P. tetraurelia, которые обозначаются как О и Е, демонстрируют цитоплазматический паттерн наследования. Признаки О и Е являются терминально дифференцированными фенотипами, которые детерминируются в ходе развития соматического макронуклеуса из тотипотентной зародышевой линии. После конъюгации вегетативный клон, происходящий от родителя О, почти всегда демонстрирует тип спаривания О, тогда как клон, происходящий от родителя Е, почти всегда относится к типу Е, несмотря на то, что оба этих эксконъюганта развиваются из идентичных зиготических геномов (рис. 7.26). Более того, когда между двумя конъюгируюшими клетками образуется большой цитоплазматический мостик, обусловливающий существенный обмен цитоплазмой, потомство обоих родителей обычно развивается как тип Е (Sonnebom, 1977). Таким образом, должен существовать некий цитоплазматический фактор, который направляет развитие типа Е. Как описывается ниже, геном зародышевой линии во время развития макронуклеуса подвергается масштабным перестройкам ДНК, и хотя предполагаемый ген типа спаривания все еще не идентифицирован, было показано, что одна менделевская мутация, влияющая на детерминацию типа спаривания, нарушает эти перестройки генома в других локусах (Meyer and Keller, 1996). Если тип спаривания определяется регулируемыми геномными перестройками, этот цитоплазматический фактор, определяющий тип Е, должен обладать способностью направлять альтернативную перестройку гена типа спаривания и давать в результате макронуклеарную форму этого гена, специфицирующую тип Е. В ходе конъюгации эта форма должна также производить цитоплазматический фактор, определяющий тип Е и необходимый для дальнейшего наследования. Как описывается в разделе 10, паттерны альтернативных перестроек могут передаваться от материнских макронуклеусов к зиготическим макронуклеусам в результате транс-нуклеарного влияния, которое по-видимому опосредуется молекулами РНК, действующими зависящим от гомологии образом. Таким образом, цитоплазматический фактор, ответственный за неменделевское наследование, является, вероятно, молекулой РНК, контролирующей «мутацию» развития в гене типа спаривания.
4. Кортикальное паттернирование: случай структурной наследственности
Исследования сложной архитектуры клеточного кортекса обнаружили еще одну форму неменделевской наследственности. Клетка Paramecium покрыта примерно 4000 ресничками, расположенными в виде продольных рядов заякоренных ячеек (рис. 7.3а). Каждая ресничка коренится в базальном тельце, или кинетосоме, — сложной структуре, обладающей и передне-задней, и лево-правой асимметрией. Когда клетки делятся, структура цилиарных ячеек накладывает определенные ограничения на дупликацию базальных телец, так что новые базальные тельца остаются в той же самой ориентации (рис. 7.3б). Однако хирургическая пересадка небольшого участка кортекса в перевернутой ориентации (с обращенной полярностью) по мере дупликации пересаженных базальных телец приведет, в конечном счете, к образованию полностью перевернутого ресничного ряда (рис. 7.3в). Эта передне-задняя инверсия будет воспроизводиться в неограниченном числе вегетативных клеточных делений и будет наследоваться по материнской линии в ходе конъюгации (Beisson and Sonnebom, 1965). Рис. 7.3. Структурное наследование полярности кортикальной ячейки у Paramecium
(а) Иммуномечение базальных телец и корешков реснички выявляет регулярную организацию параллельных кортикальных рядов у клеток дикого типа. Показаны вентральный (слева) и дорзальный (справа) виды, (б) Дорзальная сторона клетки, демонстрирующей нарушение этой регулярной организации благодаря обращенной переднее-задней полярности нескольких рядов кортикальных ячеек. Базальные тельца изображены красным цветом, цилиарные корешки — зеленым, (в) Увеличенный вид участка кортекса показывает обращенную ориентацию инвертированных рядов (I) по отношению к нормальным рядам (N). (г) Схематическое изо бражение дупликации базальных телец (зеленые кружки) в процессе роста; показано, что каждое тельце фланкировано с правой стороны переднее-ориентированным цилиарным корешком (пурпурный цвет) и двумя микротубулярными лентами. Дупликация происходит с фиксированной геометрией: каждое новое базальное тельце позиционируется спереди от своего родительского тельца, обеспечивая тем самым идентичную полярность, (д) Повторная дупликация базальных телец в пределах каждого ряда поддерживает однородную ориентацию бесконечно долго (фотографии любезно предоставлены Janine Beisson)
Рис. 7.3. Структурное наследование полярности кортикальной ячейки у Paramecium
(а) Иммуномечение базальных телец и корешков реснички выявляет регулярную организацию параллельных кортикальных рядов у клеток дикого типа. Показаны вентральный (слева) и дорзальный (справа) виды, (б) Дорзальная сторона клетки, демонстрирующей нарушение этой регулярной организации благодаря обращенной переднее-задней полярности нескольких рядов кортикальных ячеек. Базальные тельца изображены красным цветом, цилиарные корешки — зеленым, (в) Увеличенный вид участка кортекса показывает обращенную ориентацию инвертированных рядов (I) по отношению к нормальным рядам (N). (г) Схематическое изо бражение дупликации базальных телец (зеленые кружки) в процессе роста; показано, что каждое тельце фланкировано с правой стороны переднее-ориентированным цилиарным корешком (пурпурный цвет) и двумя микротубулярными лентами. Дупликация происходит с фиксированной геометрией: каждое новое базальное тельце позиционируется спереди от своего родительского тельца, обеспечивая тем самым идентичную полярность, (д) Повторная дупликация базальных телец в пределах каждого ряда поддерживает однородную ориентацию бесконечно долго (фотографии любезно предоставлены Janine Beisson)
Эти опыты с пересадками показали, что гены не отвечают за наследование таких структурных вариаций, и вскрыли существенную роль предсуществующих структур для правильной сборки новых структур. Ориентированная дупликация центриоли (Beisson and Wright, 2003) и воспроизведение формы жгутика при клеточном делении трипаносом (Moreira-Leite et al., 2001) представляют собой другие примеры этого явления. Прионы — еще один пример самовоспроизводящихся конформаций белков, которые ответственны за цитоплазматическую наследственность у дрожжей и млекопитающих (Shorter and Lindquist, 2005). Даже центромера эукариотических хромосом ведет себя как самореплицирующийся белковый комплекс, который находится на ДНК, но не детерминируется ею (Cleveland et al., 2003; см. Главу 14). Эти эпигенетические явления говорят нам, что не все клеточные структуры могут быть собраны de novo простым считыванием информации, содержащейся в генах. В более широком смысле репликация самой ДНК есть случай структурного наследования, но геном наверняка не является единственной структурой, которую делящиеся клетки вынуждены дуплицировать. Таким образом, «эпигенетическая» структурная наследственность, вместо того чтобы быть редким курьезом, может рассматриваться как один из наиболее фундаментальных механизмов жизни.
5. Макронуклеусы и микронуклеусы: модель активного и «молчащего» хроматина
Одна из основных концепций вэпигенетике заключается в том, что индивидуальные копии некоей нуклеотидной последовательности ДНК могут обладать различными активностями и что эти дифференцированные состояния могут стабильно поддерживаться (сохраняться). Ядерный диморфизм инфузорий — это естественный (природный) пример гомологичных последовательностей, которые находятся в общей цитоплазме и, тем не менее, обладают противоположными состояниями активности. Макронуклеус служит моделью транскрипционно активного состояния, а микронуклеус — репрессированного, или «молчащего» состояния (рис. 7.4). Ранние биохимические и иммуногистохимические исследования, главным образом на Tetrahymena, имели целью сравнить свойства этих различных ядер как в вегетативных клетках, так и в ходе полового развития, для того чтобы определить, каким образом эти разные состояния активности могут детерминироваться, в частности, на уровне структуры хроматина.5.1. Разделение микро- и макронуклеарных гистонов выявляет различную роль вариантов гистонов
Выделение гистоновых белков отдельно из макронуклеуса и микронуклеуса Tetrahymena привело к открытию специфических вариантов гистонов. Варианты гистонов hvl и hv2, которые, как теперь известно, аналогичны вариантам H2A.Z иH3.З других эукариот, соответственно (глава 13), обнаруживаются исключительно в макронуклеусах, что явилось одним из самых ранних указаний на то, что эти варианты важны для поддержания транскрипционной акивности (Allis et al., 1980; Hayashi et al., 1984). Было показано, что вариант hv2 (H3. 3) экспрессируется конститутивно — свойство, критичное для отложения этого варианта в хроматине вне фазы S, что позволяет этой изоформе гистона H3 служить в качестве гистона замещения (Yu and Gorovsky, 1997). В дополнение к различным наборам вариантов коровых гистонов макронуклеус и микронуклеус содержат различные линкерные гистоны. Макронуклеарный Н1 имеет аминокислотный состав и биохимические свойства, сходные с таковыми линкерных гистонов других эукариот, но у него отсутствует центральный глобулярный домен (Wu et al. 1986; Hayashi et al., 1987). Ни один ген линкерного гистона не является существенным для жизнеспособности клетки. Интересно, что нокауты по любому из них вызывают увеличение объема соответствующих ядер, показывая, что оба они играют роль в общей компактизации хроматина, возможно путем стабилизации структуры хроматина более высокого порядка (Shen et al., 1995). Утрата макронуклеарного Н1-подобного белка также приводит к ген-специфичным изменениям в экспрессии, позволяя думать, что этот линкерный гистон поддерживает должную регулировку транскрипции (Shen and Gorovsky, 1996).5.2. Модификации хроматина коррелируют с состояниями активности
Ацетилирование
Типерацетилирование гистонов в макронуклеусе и отсутствие этой модификации в микронуклеусе дали новые данные, позволяющие связать эту посттрансляционную модификацию с активацией генов (Vavra et al., 1982). Ферменты, осуществляющие ацетилирование гистонов у любого организма, оставались неизвестными до середины 1990-х годов, когда С. Дэвид Аллис и его сотрудники очистили первую гистоновую ацетилтрансферазу (HAT) типа А (ядерную) (Brownell and Allis, 1995; Brownell et al., 1996) Эти исследователи начали с высокоочищенных макронуклеусов для того, чтобы отделить эту активность от активности цитоплазматической HAT типа В, и продолжили очистку с помощью тестирования в геле (in-gel assay). Для этого метода очищенные гистоны были заполимеризованы в полиакриламидную матрицу геля, используемого для разделения фракций очищенных белков. После электрофореза эти белки были ренатурированы и проинкубированы с ацетил-СоА, несущим радиоактивную метку, для того чтобы выявить полипептид с кажущейся молекулярной массой 55 kD. который мог бы включить эту метку в гистоновый матрикс. Puc. 7.4. Ядерный диморфизм у инфузорий
Микронуклеус (зародышевая линия), развивающийся макронуклеус и соматический макронуклеус содержат разные наборы гистонов и их модификаций. Перечислены те из них, о которых известно, что они специфически локализованы в ядрах каждого из этих типов или в развивающемся соматическом геноме
Puc. 7.4. Ядерный диморфизм у инфузорий
Микронуклеус (зародышевая линия), развивающийся макронуклеус и соматический макронуклеус содержат разные наборы гистонов и их модификаций. Перечислены те из них, о которых известно, что они специфически локализованы в ядрах каждого из этих типов или в развивающемся соматическом геноме
Действительный прорыв произошел после микро-секвенирования этого очищенного белка и клонирования гена. Эта HAT, выделенная из Tetrahymena, оказалась гомологичной хорошо охарактеризованному регулятору транскрипции пекарских дрожжей — белку Gcn5. До этого открытия думали, что активаторы транскрипции в основном действуют, рекрутируя РНК-полимеразу к промоторам, но эта работа показала, что активаторы транскрипции могут также обладать ферментативной активностью, модифицируя хроматин или другие регуляторы транскрипции и меняя таким образом состояние матрицы. Дверь была открыта, и вскоре после этого было показано, что многие известные регуляторы действуют как HATs.
Метилирование
Ядерный диморфизм инфузорий еще раз доказал свои преимущества в выяснении роли метилирования гистонов. Эта модификация у растущих клеток Tetrahymena ограничена макронуклеусами (рис. 7.4). Активность метилтрансферазы лизина гистонов (HKMT), очищенная из этих ядер, специфически модифицировала гистон 3 по лизину 4 (H3K4те), установив тем самым одну из первых корреляций между этой специфической модификацией и транскрипционной активностью (Strahl et al., 1999). Метилирование гистона H3 по лизину 9 у вегетативно размножающихся клеток отсутствует, но специфически происходит во время развития макронуклеусов на ограниченных зародышевой линией последовательностях, которые элиминируются из соматического генома (Tav-ema et al., 2002). Регулируемое развитием установление H3K9me2 (диметилирование) на этих специфических последовательностях дает нам полезную модель для выяснения нацеливания этой модификации на эквивалент гетерохроматина (в деталях описывается ниже)Фосфорилирование
Очистка меченных Р32 гистонов из микро- и макронуклеусов показала, что H3, Н2А и линкерные гистоны сильно фосфорилированы (Allis and Gorovsky, 1981). Фосфорилированы множественные сайты макронуклеарного Н1, и эта модификация, как было показано, участвует в регулировании транскрипции специфических генов (Mizzen et al., 1999). С помощью мутационного анализа Доу и Горовски [Dou and Gorovsky] обнаружили, что эту потребность в фосфорилировании можно было имитировать добавлением в Н1 заряженых аминокислот (Dou et al., 1999). Однако эти заряженные остатки не обязательно должны находиться в соответствующих позициях фосфорилированной аминокислоты; для комплементарного эффекта требуется наличие кластера заряженных сайтов (Dou and Gorovsky, 2000,2002). Эти исследования показали, что само по себе фосфорилирование не требовалось, но что соответствующая транскрипция стимулировалась критической плотностью зарядов. В гистоне H3 фосфорилирована единственная позиция. серии 10 (H3S10ph) (Wei et al., 1998). Эта модификация зависит от клеточного цикла и коррелирует с митозом у многих эукариот. У Tetrahymena в ходе митоза и мейоза она ограничена микронуклеусами. Замещение нормального гена гистона H3 мутантной формой, содержащей замену серина 10 аланином (S10A), вызывает дефекты в делении микронуклеуса, результатом чего оказывается отставание хромосом и анэуплоидия (Wei et al., 1999). Однако амитотическое деление макронуклеуса не затрагивается. Эти результаты демонстрируют, что фосфорилирование H3 играет важную роль в конденсации и (или) сегрегации хромосом. Уникальный ядерный диморфизм инфузорий опять позволил получить ключевые данные о роли модификаций хроматина.6. В ходе развития макронуклеуса происходят общегеномные перестройки
Секвенирование соматических (макронуклеарных) геномов P. tetraurelia и Т. thermophila обнаружило очень большое число генов (-40 000 и -27 000, соответственно) несмотря на относительно небольшие размеры геномов (-72 Мб и -104 Мб, соответственно). Эта организация согласуется с геномом, оптимизированным для эффективной экспрессии генов (сравнение с другими эукариотными организмами см. на рис. 3.15). Это «упрощение» («streamlining») соматического генома достигается за счет массивных перестроек ДНК хромосом, происходящих из зародышевой линии, которые имеют место на специфических стадиях макронуклеарного развития (обзоры см.: Prescott, 1994: Coyne et al., 1996; Klobutcher and Herrick, 1997; Jahn and Klobutcher, 2002). Таким образом, ядерная дифференцировка генома зародышевой линии и генома соматического включает физическую реорганизацию хромосом в дополнение к установлению только что описанных различных состояний хроматина. Обычно наблюдаются два типа перестроек, которые поистине уникальны для всех инфузорий, которые только были исследованы: внутренние делеции ДНК и фрагментация хромосом (рис. 7.5). Примеры этого у других эукариот могут быть представлены локализованной рекомбинацией локуса VDJ в лимфоцитах млекопитающих (глава 21). В зависимости от вида инфузории из каждого вновь формирующегося генома в результате этих событий элиминируются от 10 до 95 % генома зародышевой линии Элиминируются фактически все повторяющиеся последовательности, включая перемещаемые элементы, что частично объясняет наблюдаемую высокую плотность генов в макронуклеусах. Число сайтов перестроек также варьирует у разных видов, от примерно 6 000 у Tetrahymena до, вероятно, 100 000 у брюхоресничных инфузорий. Распределение по всему геному этих высоко регулируемых и воспроизводимых событий дает возможность исследовать, каким образом клетки идентифицируют конкретные сегменты ДНК и направляют свое действие на них. Изучение перестроек ДНК у инфузорий уже позволило вскрыть уникальные особенности эпигенетических механизмов, в частности относящихся к зависящим от гомологии процессам. Нижеследующее описание событий, связанных с перестройками ДНК, должно дать достаточную основу для последующего обсуждения связанной с этим эпигенетической регуляции. Рис. 7.5. Перестройки ДНК у инфузорий
В ходе развития нового макронуклеуса происходят широкомасштабные фрагментация хромосом и элиминация ДНК. (Вверху) Перестройки ДНК, происходящие у Paramecium, включают как точные делеции IESs, ограниченных нуклеотидами ТА (цветные прямоугольники, находящиеся в кодирующих (стрелка) и некодирующих районах), так и неточные делециии (оранжевые прямоугольники), дающие в результате либо делецию ДНК. либо фрагментацию (G4T3). (Внизу) У Tetrahymena неточная деления IESs (цветные прямоугольники) происходит примерно в 6000 локусов, а фрагментация хромосом детерминируется консервативной последовательностью длиной 15 пн — CBS (звездочка)
Рис. 7.5. Перестройки ДНК у инфузорий
В ходе развития нового макронуклеуса происходят широкомасштабные фрагментация хромосом и элиминация ДНК. (Вверху) Перестройки ДНК, происходящие у Paramecium, включают как точные делеции IESs, ограниченных нуклеотидами ТА (цветные прямоугольники, находящиеся в кодирующих (стрелка) и некодирующих районах), так и неточные делециии (оранжевые прямоугольники), дающие в результате либо делецию ДНК. либо фрагментацию (G4T3). (Внизу) У Tetrahymena неточная деления IESs (цветные прямоугольники) происходит примерно в 6000 локусов, а фрагментация хромосом детерминируется консервативной последовательностью длиной 15 пн — CBS (звездочка)
6.1. Внутренняя делеция ДНК: события, связанные с точными (внутригенные IESs) и неточными (межгенные повторы) делециями
Точные делеции Точные делеции — это такие делеции, которые происходят в одних и тех же позициях нуклеотидной последовательности во всех копиях макронуклеарных хромосом. Внутренние элиминируемые последовательности (IESs) — это короткие, однокопийные сегменты ДНК, которые удаляются главным образом из кодирующих последовательностей, но обнаруживаются и в межгенных или интронных районах хромосом зародышевой линии (рис. 7.5). Точно вырезаемые IESs ограничены короткими прямыми повторами, которые, как правило, различаются по последовательности у разных видов. Заметный класс так называемых “ТА”-IESs, обнаруживаемых у Paramecium и некоторых спиротрих, таких как Euplotes crassus, идентифицируется как обладающий инвариабельными повторами 5’-ТА-3’ на их границах, одна копия которых остается в макронуклеарном локусе после эксцизии (Betermier, 2004). Немногочисленные нуклеотидные позиции, внутренние по отношению к динуклеотидам ТА, не являются случайными и образуют вырожденный консенсус, напоминающий концы транспозонов Тс1/ mariner. Таким образом, эти IESs эволюционно могут быть производными древних инсерций таких мобильных элементов (Klobutcher and Herrick, 1997). Тем не менее, концы многих IESs плохо соответствуют этой консенсусной последовательности, тогда как многие хорошие соответствия можно обнаружить в макронуклеарных последовательностях, которые не вырезаются, что указывает на то, что этот консенсус не содержит достаточной информации для того чтобы специфицировать вырезание приблизительно 60 000 IESs на гаплоидный геном P. tetraurelia. Возникает вопрос, каким же образом они распознаются. Удивительное варьирование точного вырезания наблюдается у стихотрих (подгруппа спиротрих), у которых удаление IES происходит одновременно с «упорядочиванием» («unscrambling») генов (Prescott, 1999). В микронуклеарной версии «перетасованных» генов последовательности, предназначенные для оставления в макронуклеусе (MDSs, т.е. ДНК-«экзоны») не только разделяются IESs, но и «перетасованы» относительно линейного порядка, обнаруживаемого в реорганизованной макронуклеарной последовательности. В зародышевой линии две MDS, которые окажутся соединенными, чтобы образовать экспрессируемый ген, могут быть локализованы далеко друг от друга, иногда даже в несцепленных локусах (Landweber et al., 2000), и могут даже находиться в инвертированной ориентации относительно друг друга. Точность упорядочивания, по-видимому, направляется относительно длинными (в среднем 11 пн) гомологичными повторами, общими для родственных MDS-концов, которые не родственны по последовательности повторам на концах других MDS Хотя эти длинные повторы наверняка вносят вклад в точное упорядочивание, остается неясным, достаточно ли их; это привело к предположению, что здесь возможно участие предсуществующей матрицы (Prescott et al., 2003). Неточные делеции Хотя IESs эффективно и воспроизводимо удаляются из соматического генома, в некоторых случаях границы делеции, формируемые независимыми событиями вырезания в полиплоидном ядре, варьируют по своему положению (рис. 7.5). Эта гетерогенность распространяется на десятки пар оснований у Tetrahymena и до нескольких килобаз у Paramecium. Неточная делеция характерна для всех исследованных IESs у Tetrahymena и в первую очередь ответственна за удаление повторяющихся последовательностей, таких как межгенные транспозоны или минисателлиты у Paramecium (Le Motuil et al., 2003). Подобно точной эксцизии IESs эти делеции в норме происходят между короткими прямыми повторами, один из которых сохраняется в макронуклеарной последовательности. У Tetrahymena повторяющиеся последовательности очень вариабельны среди известных IESs, тогда как у Paramecium эти повторы всегда содержат по крайней мере один динуклеотид ТА; это позволяет предположить, что соответствующий механизм может быть связан с механизмом точного вырезания IES.6.2. Фрагментация хромосом
Во время развития макронуклеуса хромосомы, происходящие из зародышевой линии, фрагментируются на более короткие молекулы, которые кепируются добавлением de novo теломерных повторов (рис. 7.5). Получающиеся в результате этого макронуклеарные хромосомы, по всей видимости, не имеют центромер, и таким образом хромосомная фрагментация может облегчать равное распределение этих молекул при амитотических делениях макронуклеуса. Степень фрагментации широко варьирует у разных видов. У спиротрих фрагментация достигает крайней степени, давая крошечные «нанохромосомы», обычно содержащие по одному гену, тогда как у Paramecium и Tetrahymena макронуклеарные хромосомы варьируют по размеру от 20 Кб до более чем 1 Мб и содержат по много генов. У большинства инфузорий этот процесс является неточным, так что точное положение добавления теломерных повторов оказывается гетерогенным и часто приводит к некоторым потерям последовательностей зародышевой линии. Одно из исключений — Euplotes crassus, у которого теломеры всегда добавляются в одних и тех же нуклеотидных позициях (Klobutcher, 1999). У Tetrahymena консервативная последовательность хромосомного разрыва длиной 15 пн (CBS), обнаруженная в 280 локусах хромосом зародышевой линии (Cassidy-Hanley et al., 2005; Hamilton et al., 2005), является и необходимой, и достаточной для направления фрагментации и добавления новых теломер (Fan and Yao, 1996). Напротив, у видов P. aurelia никаких аналогичных CBS не было идентифицировано. Скорее, все данные показывают, что фрагментация хромосом является альтернативным результатом неточных делеций (рис. 7.5); при таких делециях элиминация ДНК залечивается либо путем воссоединения фланкирующих последовательностей, либо путем добавления теломер (Le Моил1 et al., 2003).7. Механизмы перестроек генома
Хотя геномные перестройки инфузорий исследуются более 30 лет, молекулярные механизмы, лежащие в основе этих событий, остаются в основном неизвестными (Yao et al., 2002). Частично задачей, стояшей перед исследователями, было объяснить разнообразие событий, которые наблюдаются у разных инфузорий. Для нескольких инфузорий были описаны эксцизионные интермедиаты, а также (побочные) продукты циркулярной эксцизии (Jaraczewski and Jahn, 1993; Klobutcher et al., 1993; Williams et al., 1993; Saveliev and Cox, 1995, 1996; Betermier et al., 2000; Gratias and Betermier, 2003). Эти данные не позволяют вывести единый механизм эксцизии даже для тех IESs разных инфузорий, которые имеют на своих концах сходные консенсусные последовательности (см. Klobutcher and Herrick, 1995; Gratias and Betermier, 2001; Betermier, 2004). Несмотря на разнообразие механизмов эксцизии может все же иметь место значительное перекрывание в событиях, направляющих перестройки ДНК. Одной из общих черт является то, что транспозоноподобные и повторяющиеся последовательности элиминируются, по-видимому, преимущественно. Как описывается в этой книге, одна из ролей эпигенетических механизмов заключается в том, чтобы подавлять активность этих потенциально вредоносных ДНК-элементов. Разрешение для транспозона переместиться из «молчащей» зародышевой линии в высоко активный макронуклеус является потенциально гибельным для соматического генома. Многие и разнообразные данные указывают на механизмы, связанные с RNAi и формированием гетерохроматина, как на участников этих процессов перестроек ДНК (Mochizuki and Gorovsky, 2004; Yao and Chao, 2005). У большинства эукариот гистон H3, метилированный по лизину 9 (H3K9me), в значительной степени ассоциирован с репрессированной ДНК, вычленяемой в ядре как гетерохроматин (см. раздел 7 главы 3). У Tetrahymena эта модификация не обнаруживается в транскрипционно «молчащем» микронуклеусе, как можно было бы предположить, но обнаруживается исключительно в развивающихся макронуклеусах непосредственно перед перестройками ДНК или одновременно с ними (Taverna et al., 2002). Эксперименты по иммунопреципитации хроматина показали, что этой модификацией обогащены гистоны, связанные с IESs. Элиминация ДНК и формирование гетерохроматина были первоначально сцеплены друг с другом в результате идентификации хромодоменсодержащего белка (Pddl — Programmed DNA Degradation 1 protein) — обильно представленного, экспрессируемого в ходе развития белка, колокализующегося в фокусах, содержащих ДНК, ограниченную зародышевой линией и подлежащую элиминации (т.е. IESs) из соматического генома (Madireddi et al., 1994, 1996). Хромодомены — это белковые мотивы, обладающие сродством, способностью связываться с некоторыми остатками метилированных гистонов. Возможно, что архетипическая модель участия хромодоменного белка в регуляции хроматина — это связывание гетерохроматинового белка 1 (НР1 — содержащий хромодомен) с метилированным H3K9 у Drosophila, играющее роль в формировании гетерохроматиновых доменов (детали см в главе 5). Хромодомены Pddl и Pdd3, два белка, требующихся для перестроек ДНК (Coyne et al., 1999; Nikiforov et al., 2002), связываются с пептидами H3K9me2 (Taverna et al., 2002). Для того чтобы продемонстрировать, что эта модификация хроматина требуется для перестройки ДНК, Лиу, Мочицуки и Горовски [Liu, Mochizuki and Gorovsky] использовали методику гомологичного замещения гена, чтобы заменить гены основного гистона H3 копиями, содержащими мутацию, поменявшую лизин 9 (K9Q) (Liu et al., 2004). Эти клетки не могли эффективно удалять IESs в ходе развития несмотря на тот факт, что Pddl локализовалась соответственно в предшественниках макронуклеусов, показывая тем самым, что H3K9me2 требуется для элиминации ДНК. Из-за того, что установление состояний хроматина является ключевым детерминантом эпигенетической регуляции, важный вопрос заключается в следующем: каким образом метка H3K9me2 специфически нацеливается на сегменты ДНК, обреченные на элиминацию? Как описывается ниже, несколько экспериментов продемонстрировали, что в направлении перестроек ДНК участвуют гомологичные РНК.8. Зависящий от гомологии сайленсинг генов у инфузорий
Зависящие от гомологии, опосредуемые РНК механизмы сайленсинга широко используются эукариотами для эпигенетической регуляции. Данные о том, что такие механизмы активны у инфузорий, впервые были получены на Paramecium после трансформации вегетативного макронуклеуса неэкспрессибельными трансгенами, которые производят фенокопию менделевских мутантов в эндогенных генах. Сходные эффекты были затем воспроизведены у Paramecium и спиротрих при скармливании клеткам двунитевых РНК, что позволяло предполагать участие механизмов RNAi. Один из этих механизмов ведет к крайней форме сайленсинга генов — элиминации ДНК.8.1. Сайленсинг, индуцируемый трансгенами
Макронуклеус Paramecium легко трансформировать с помощью микроинъекций, потому что любой введенный в него фрагмент ДНК может поддерживаться в широком диапазоне числа копий, реплицируясь автономно без потребности в каком-либо специфическом ориджине. Трансформация высококопийными, неэкспрессибельными трансгенами может переключить посттранскрипционный сайленсинг эндогенных генов, обладающих достаточным сходством по последовательности (Ruiz et al., 1998; Galvani and Sperling, 2001). Сайленсинг не наблюдается, если в трансгене присутствует 3’UTR гена (Galvani and Sperling, 2001), что заставляет предполагать, что регуляторные сигналы, присутствующие в РНК, влияют на способность конструкта индуцировать сайленсинг. Впоследствии оказалось, что сайленсинг коррелирует с накоплением гомологичных коротких РНК длиной приблизительно 23 нуклеотида (н) (Gamier et al., 2004); это указывает на связь с путем RNAi. Эти короткие РНК длиной -23 н, по-видимому, ответственны за прицельную деградацию гомологичных mRNAs и могут быть поэтому названы siRNAs (short interfering RNAs — короткие интерферирующие РНК). Сходный класс РНК длиной 23—24 н был также идентифицирован в вегетативных клетках Tetrahymena, и хотя какие-либо данные об их возможной роли отсутствуют, вполне вероятно, что они представляют собой эндогенные siRNAs (Lee and Collins, 2006).8.2. Сайленсинг индуцируется двунитевой РНК
Двунитевая РНК (dsRNA) является вероятным первичным триггером для индуцируемого трансгеном сайленсинга, наблюдаемого у Paramecium. Сайленсирующая эффективность трансгенов коррелирует с образованием аберрантных молекул РНК, соответствующих как смысловой, так и антисмысловой нитям инъецированной последовательности. Более того, способность dsRNA стимулировать сайленсинг гена была продемонстрирована путем скармливания клеткам Paramecium бактерий Escherichia coli, экспрессирующих dsRNA клонированного гена, с использованием методологии, разработанной для Caenorhabditis elegans (Timmons and Fire, 1998; Timmons et al., 2001). Сайленсинг эндогенного гена можно наблюдать фенотипически спустя всего три вегетативных деления, т.е. меньше чем через 24 часа (Galvani and Sperling, 2002). Скармливание убитых нагреванием E.coli цнфузориям-спиротрихам, в норме питающимся водорослями, также индуцирует генный сайленсинг (Pashka et al., 2003), заставляя предполагать, что многие разные инфузории обладают этим механизмом. У Paramecium молекулярный анализ показал, что кормление dsRNA приводит к накоплению таких же -23-нуклеотидных siRNAs, какие наблюдаются после сайленсинга, индуцируемого трансгеном (Nowacki et al., 2005); это указывает, что оба эти явления базируются на общем RNAi-пути. Сайленсинг, индуцируемый у Paramecium скармливанием dsRNA, может быть немедленно ревертирован замещением E.coli в культуральной среде нормальными пищевыми бактериями; аналогичным образом прямая микроинъекция dsRNA в цитоплазму индуцирует лишь временный, преходящий сайленсинг гомологичных генов, предположительно потому, что инъецированная dsRNA быстро разбавляется в ходе вегетативного роста (Galvani and Sperling, 2002). Эти наблюдения позволяют предположить, что молекулы dsRNA не могут быть амплифицированы до сколько-нибудь значительного уровня в цитоплазме вегетативных клеток, в отличие от судьбы dsRNA в С.elegans, где это может приводить к наследуемому сайленсированному состоянию. Это, далее, предполагает, что RNAi у Paramecium не приводит к установлению стабильного транскрипционного сайленсинга гена в макронуклеусе. Наследуемый сайленсинг, вероятно, требовал бы метилирования гистона H3K9. А, как упоминалось выше, эта модификация, очевидно, отсутствует в вегетативном макронуклеусе, по крайней мере у Т. thermophila.9. Перестройки генома направляются зависящими от гомологии механизмами
Во время развития инфузории три разных генома должны различаться и канализироваться по трем раздельным направлениям: микронуклеарный геном зародышевой линии должен сохраняться интактным, в то время как развивающийся соматический геном в новом макронуклеусе направляется таким образом, чтобы подвергнуться экстенсивной реорганизации; материнский же соматический геном обречен на разрушение. В этих более широких рамках цель исследователей, работающих на инфузориях, заключалась в том, чтобы понять воспроизводимость паттернов ДНК-перестроек. Первоначальные усилия были направлены на то, чтобы идентифицировать ds-активные мотивы ДНК-последовательностей, которые могли бы рекрутировать рекомбинационные белки, но поиски дали мало четких результатов (см.: Yao et al., 2002; Betermier, 2004). Первичная ДНК-последовательность определенно не является единственным детерминантом, направляющим реорганизацию макронуклеарного генома, — вывод, подкрепляемый данными о том, что H3K9-метилирование маркирует сегменты ДНК для элиминации. Более того, многие паттерны перестроек, как описано ниже, чувствительны к зависящим от гомологии эффектам, что делает возможным наследование альтернативных паттернов по материнской линии в последующих половых поколениях, независимо от Менделевской передачи генома дикого типа зародышевой линии Наследование паттернов перестройки удовлетворяет, следовательно, определению эпигенетического явления.9.1. Экспериментальная индукция специфических делеций в развивающемся макронуклеусе
Еще до того как посттранскрипционный сайленсинг генов был описан у Paramecium, было обнаружено, что введение клонированных последовательностей в большом числе копий в вегетативный макронуклеус изменяет ДНК-перестройки в половом потомстве трансформированных клонов. Удивительно, что последовательности, гомологичные трансгену, специфическим образом делегировались по неточному механизму, в то время как микронулеарный геном оставался интактным (рис. 7.6) (Meyer, 1992). Это явление, по-видимому, было весьма общим, поскольку все испытанные фрагменты ДНК могли производить делеции (Meyer et al., 1997). Эти эксперименты показывали, что в ходе половых событий сиквенс-специфичная информация передается через цитоплазму из трансформированного материнского макронуклеуса в развивающийся зиготический макронуклеус. Эта всеобщность данного эффекта говорила не в пользу тех трактовок, в которых роль отводилась сиквенс-специфичным ДНК-связывающим белкам, продуцируемым или титруемым инъецированными трансгенами. Наиболее экономное объяснение, согласующееся с наблюдаемой специфичностью, предполагает, что нуклеиновые кислоты, предположительно молекулы РНК, переносятся между ядрами и распознают свои мишени на основе взаимодействий, базирующихся на спаривании. Рис. 7.6. Индуцированные трансгеном делеции у Paramecium
(а) У дикого типа ген А (красные стрелки) расположен вблизи гетерогенных концов макронуклеарной хромосомы; розовые прямоугольники = макронуклеарные теломеры. Паттерн перестроек макронуклеарной хромосомы надежно репродуцируется в ряду поколений, (б) Введение большого числа копий трансгенов А в материнский макронуклеус может индуцировать полную делецию эндогенного гена А в половом потомстве, когда новый макронуклеус развивается из производного зародышевой линии дикого типа. Новые макронуклеарные теломеры располагаются непосредственно «вверх по течению» от гена А
Рис. 7.6. Индуцированные трансгеном делеции у Paramecium
(а) У дикого типа ген А (красные стрелки) расположен вблизи гетерогенных концов макронуклеарной хромосомы; розовые прямоугольники = макронуклеарные теломеры. Паттерн перестроек макронуклеарной хромосомы надежно репродуцируется в ряду поколений, (б) Введение большого числа копий трансгенов А в материнский макронуклеус может индуцировать полную делецию эндогенного гена А в половом потомстве, когда новый макронуклеус развивается из производного зародышевой линии дикого типа. Новые макронуклеарные теломеры располагаются непосредственно «вверх по течению» от гена А
Конструкты, которые эффективно индуцируют постзиготические делеции, являются неэкспрессибельными трансгенами, такими как трансгены, содержащие мутации типа сдвига рамки считывания или усечения 5’ или 3’ UTRs (Gamier et al., 2004). Те из них, которые могут продуцировать стабильные, способные транслироваться иРНК, не стимулируют элиминацию гомологичных генов из развивающихся макронуклеусов. Те же конструкты, которые стимулируют делецию ДНК, вызывают также сайленсинг эндогенных материнских генов в ходе вегетативного роста трансформированных клонов. Таким образом, постзиготические делеции коррелируют с презиготическим сайленсингом и с накоплением ~ 2 3 - нукл еотид н ых siRNAs. Эти siRNAs, как было показано далее, сохраняются в клетках на протяжении всего развития, что заставляет предполагать, что они могут отвечать за включение этих делеций. Если ассоциированные с сайленсингом siRNAs направляют ДНК-перестройки, тогда введение dsRNA до начала или во время развития должно стимулировать элиминацию гомологичной последовательности в потомстве. Чтобы это проверить, клеткам Paramecium, которым скармливались E.coli штамма, продуцирующего dsRNA, гомологичную кодирующей последовательности ND7 — гену, участвующему в регулируемом экзоцитозе секреторных пузырьков, называемых трихоцистами, — дали возможность пройти автогамию и развить новые макронуклеусы из микронуклеусов дикого типа. Некоторое число поставтогамных потомков продемонстрировали мутантный фенотип ND7благодаря элиминации этого гена из их макронуклеусов (Gamier et al., 2004). Даже потомство фенотипически дикого типа показало частичную элиминацию копий гена ND7. Как и~23-нуклеотидные siRNAs, связанные с трансген-индуцированным сайленсингом, ~23-нуклеотидные siRNAs, связанные с кормлением dsRNA, сохранялись, как было показано, в этих клетках на протяжении всей аутогамии (Nowacki et al., 2005), подтверждая их участие в «нацеливании» постзиготических делеций. Явление индуцированной ДНК делеции, направляемой dsRNA, не ограничивается Paramecium. Микроинъекция конъюгирующим Tetrahymena смысловой и антисмысловой РНК, транскрибированной in vitro и гомологичной геномным локусам, в норме сохраняющимся в макронуклеусе, приводит к неточной делеции этих последовательностей (Yao et al., 2003).
10. Паттерны перестроек определяются, вероятно, путем сравнения геномов зародышевой линии и соматического
10.1. Парадигма d48: эпигенетическое наследование альтернативных перестроек
Хотя перестройки, индуцируемые трансгенами и dsRNA, иллюстрируют эпигенетическую природу процесса элиминации ДНК, возможно еще более удивительными являются наблюдения, что паттерны индуцированных перестроек могут наследоваться в последовательных раундах макронуклеарного развития. Первое доказательство эпигенетической регуляции перестроек было обнаружено, когда аберрантная делеция из макронуклеуса гена, кодирующего у P.tetraurelia поверхностный антиген А, оказалась цитоплазматически наследующейся в скрещиваниях с диким типом (рис. 7.7) (Epstein and Fomey, 1984). В макронуклеусах дикого типа ген А локализован вблизи конца хромосомы на расстоянии 8,13 либо 26 тн от теломеры, что диктуется тремя альтернативными сайтами фрагментации. Было обнаружено, что вариантная клеточная линия, называемая d48, не экспрессирует ген А, потому что сам этот ген был утерян вместе со всеми последовательностями «вниз по течению», когда формировалась его теломера на 5’-конце этого гена (Fomey and Blackburn, 1988). Эксперименты по трансплантации ядер подтвердили, что микронуклеус зародышевой линии d48 несёт ген А дикого типа. Например, замена микронуклеуса d48 микронуклеусом штамма дикого типа не предотвращает материнской передачи делеции гена А половому потомству; и наоборот, микронуклеус d48, будучи трансплантирован в клетку дикого типа, давал начало после автогамии новому макронуклеусу, который содержал ген A (Harumoto, 1986; Kobayashi and Koizumi, 1990). Сходные эксперименты, сфокусированные на поддержании или делеции еще одного проксимального по отношению к теломере гена поверхностного антигена, гена В, показали, что такие материнские эффекты могут наблюдаться и в других районах генома (Scott et al., 1994). В совокупности эти исследования заставляют предполагать, что некий геномный район должен присутствовать в материнском макронуклеусе для того, чтобы эффективно сохраняться и амплифицироваться в развивающемся макронуклеусе до числа копий, характерного для дикого типа. Рис. 7.7. Эпигенетическое наследование и экспериментальное «спасение» делеций макронуклеарного гена А
(а) Штамм дикого типа. (б) У штамма d48 нет гена А в его макронуклеусе, но его микронуклеус — дикого типа. Ген А воспроизводимо делетируется в ходе развития макронуклеуса в каждом поколении, (в) Трансформация макронуклеуса штамма d48 последовательностями гена А специфически восстанавливает амплификацию гена А зародышевой линии в развивающемся макронуклеусе полового потомства
Рис. 7.7. Эпигенетическое наследование и экспериментальное «спасение» делеций макронуклеарного гена А
(а) Штамм дикого типа. (б) У штамма d48 нет гена А в его макронуклеусе, но его микронуклеус — дикого типа. Ген А воспроизводимо делетируется в ходе развития макронуклеуса в каждом поколении, (в) Трансформация макронуклеуса штамма d48 последовательностями гена А специфически восстанавливает амплификацию гена А зародышевой линии в развивающемся макронуклеусе полового потомства
10.2. Эпигенетическое наследование экспериментально индуцированных делеций
Материнское влияние на перестройки ДНК. подобное тому, как это наблюдалось для d48, по-видимому контролирует развитие многих, а возможно и всех, районов макронуклеарного генома Paramecium. В самом деле, макронуклеарные делеции, создаваемые экспериментально в половом потомстве, могут «спонтанно» воспроизводиться в последующих половых поколениях, по материнскому типу наследования. Это наблюдали и для делеций гена G, индуцированных у Pprimaurelia высококопийным трансгеном, для другого субтеломерного гена поверхностного антигена (Меуег, 1992), и для макронуклеарных делеций гена ND7, которые превоначально были индуцированы скармливанием dsRNA (Gamier et al., 2004). В любом случае индуцирующий трансген или введенная dsRNA не были больше необходимыми для воспроизведения данной делеции в половом потомстве. У d48 и в этих индуцированных вариантных клеточных линиях данное состояние соматического генома может время от времени после автогамии ревертировать к перестроечному паттерну дикого типа, подтверждая тем самым, что этот ген все еще наличествует в микронуклеарном геноме, и высвечивая эпигенетический способ наследования. Замечательно, что сайленсинг гена и подучающаяся в результате делеция ДНК могут «запоминаться» в последующих поколениях; при этом целевой геномный район обрабатывается в ходе развития макронуклеуса так же, как транспозоны и IESs. Рекуррентная делеция гена в каждом половом поколении, по-видимому, не индуцируется ~23-нуклеотидными siRNAs, поскольку эти РНК выявлялись лишь тогда, когда сайленсинг экспериментально индуцируется в первом поколении. Более того, генетический анализ таких клеточных линий показал, что этот микронуклеарный ген не несет никакого постоянного импринта, поскольку он может нормально амплифицироваться в ходе макронуклеарного развития, когда он переносится при конъюгации в клеточную линию с макронуклеусом дикого типа. Создается, следовательно, впечатление, что этот ген делегируется в развивающемся макронуклеусе просто потому, что он отсутствует в материнском макронуклеусе.10.3. «Спонтанная» элиминация чужеродных последовательностей, интродуцированных в микронуклеарный геном
Воспроизведение материнских перестроечных состояний позволяет предполагать, что геном зародышевой линии, которому предстоит реорганизация, сравнивается с существующим перестроенным геномом, и последовательности, отсутствовавшие в предшествующем поколении, делаются целевыми для удаления из вновь формирующегося соматического генома. Если бы это действительно было так, то можно было бы предсказать, что трансгены, интродунируемые в микронуклеус зародышевой линии, часто делегировались бы в ходе развития нового макронуклеуса. У Tetrahymena, где была разработана трансформация микронуклеуса, исследователи наблюдали, что интегрированные маркеры лекарственной устойчивости, используемые для исследований с дизрупцией генов, могут делегироваться из макронуклеарного генома в ходе последовательных раундов конъюгации (Yao et al., 2003; Liu et al., 2005). Геномная локализация трансгена, а также число копий, вводимых в геном зародышевой линии, существенно влияли на эффективность элиминации (Liu et al., 2005), что указывает на то, что индукция данного явления у этой инфузории носит менее общий характер. Тем не менее, эти результаты демонстрируют, что чужеродная последовательность, бактериальный неоген, может распознаваться клеткой как IES.10.4. Экспериментальное «спасение» наследуемых макронуклеарных делеций
Является ли простое отсутствие некоего геномного района в материнском соматическом макронуклеусе достаточным для направления его будущей элиминации? Если это так, тогда повторное введение гена А в макронуклеус d48 должно было бы «спасать» этот дефект в воспроизведении гена А в ходе развития. Сначала было показано, что инъекция либо макронуклеоплазмы дикого типа в вегетативный макронуклеус d48 (Harumoto, 1986), либо цитоплазмы от автогамных клеток дикого типа в клетки d48 в раннем развития (Koizumi and Kobayashi, 1989) приводили к перманентной реверсии d48 к дикому типу. Впоследствии прямая микроинъекция нескольких неперекрывающихся фрагментов гена >4, распространяющихся на большую часть ~8-тн кодирующей последовательности, в макронуклеус d48 продемонстрировала, что последовательность гена А сама по себе достаточна для восстановления макронуклеарного перестроечного паттерна дикого типа (рис. 7) (Koizumi and Kobayashi, 1989; Jessop-Murray et al., 1991; You et al., 1991). Влияние материнского генома на перестройки ДНК показывает заметную специфичность по последовательности. Кодирующие последовательности генов А и В в целом идентичны на 74 %. Тем не менее, инъекция последовательностей гена А в макронуклеус клеточной линии, несущей макронуклеарные делеции обоих генов, могла лишь предотвращать делению гена А из нового макронуклеуса; и сходным же образом, инъекция гена В могла лишь препятствовать своей собственной делеции (Scott et al., 1994). Кроме того, макронуклеарную делецию d48 нельзя было «спасти» трансформацией геном G от P.primaurelia, на 78 % идентичным с геном А. С другой стороны, макронуклеарная делеция гена А могла быть «спасена» трансформацией другой аллелью гена Л, демонстрирующей 97%-ную идентичность (Forney et al., 1996). Таким образом, материнское «спасение» макронуклеарных делеций является зависящим от гомологии процессом, который не нуждается в какой-либо специфической последовательности внутри генов, но требует некоего минимального уровня идентичности последовательностей. Этот материнский эффект «спасения» d48, на первый взгляд, выглядит как не согласующийся с индуцированными трансгеном делециями, поскольку в этих экспериментах инъекция последовательностей гена А в материнский макронуклеус имела в точности противоположные последовательности в зиготическом гене А. Этот кажущийся парадокс был разрешен, когда было показано, что постзиготический эффект делеций зависит от установления зависяшего от гомологии сайленсинга в трансформированных клонах (Gamier et al., 2004). Наоборот, эффект «спасения» наблюдается лишь в условиях трансформации, которые не вызывают сайленсинга (т.е. лишь умеренные числа копий для неэкспрессируемых конструктов или любое число копий для экспрессируемых трансгенов) (Gamier et al., 2004). Таким образом, оказывается, что накопление ~23-нуклеотидных siRNA может предотвратить эффект «спасения» последовательностей гена А в материнском макронуклеусе, который стимулирует амплификацию гена А в развивающемся макронуклеусе. Это является сильным доводом в пользу того, что цитоплазматическим фактором, опосредующим транс-ядерный эффект, является транскрипт гена А. Однако это не обязательно должна быть полноразмерная mRNA, потому что даже фрагменты кодирующей последовательности обладают, как было показано, «спасающей» активностью. Более того, клоны, содержащие целый ген, часто экспрессируют эту mRNA на протяжении всего вегетативного роста, тогда как продукция «спасающего» цитоплазматического фактора ограничена, как было показано, периодом ядерной реорганизации.10.5. Экспериментальное подавление элиминации IES в развивающемся макронуклеусе
Зависящее от гомологии подавление IES у Paramecium
Если делеция или сохранение клеточных генов контролируются путем сравнения содержания соматического генома и генома зародышевой линии, тогда даже эффективная в норме эксцизия IESs могла бы, возможно, нарушаться, когда копии присутствуют в материнском макронуклеусе. Изучение менделевской мутации, mtFE, обладающей плейотропными влияниями на развитие макронуклеуса, в том числе влиянием на детерминацию типа спаривания (Brygoo and Keller, 1981a,b), дало возможность проверить это предсказание. Оказалось, что эта мутация, будучи в гомозиготном состоянии, отменяет вырезание IES-последовательности, локализованной в гене поверхностного антигена G. Удивительно, но когда аллель дикого типа гена mtF была реинтродуцирована в мутантный штамм в результате конъюгации, эта IES все еще не вырезалась в ходе последующего развития макронуклеуса (Meyer and Keller, 1996). Генетический анализ получившегося в результате вариантного штамма, названного штамм IES4, подтвердил, что генетически он является диким типом и что специфическое сохранение этой IES наследуется по материнской линии в половом потомстве (Duharcourt et al., 1995). Является ли эксцизия IES в развивающихся макронуклеусах индуцированной материнскими копиями корректно перестроенного гена G или же ингибированной материнскими копиями сохраняющего IES гена G? Чтобы ответить на этот вопрос, макронуклеусы клеток1ES+ или IES были трансформированы с помощью прямой микроинъекции плазмид, содержащих фрагмент кодирующей последовательности G в ее микронуклеарной (IES+) или макронуклеарной (IES ) версиях (рис. 7.8) (Duharcourt et al., 1995). После автогамии трансформированные клоны, содержавшие плазмиду IES", дали линии потомков, которые сохранили IES в своих вновь сформировавшихся макронуклеусах, тогда как клетки IES+, трансформированные плазмидой IES", оказались неспособными индуцировать эксцизию, и их потомство оставалось в состоянии IES+. Плазмида, содержавшая только IES, без каких-либо фланкирующих последовательностей, также вызывала сохранение IES, показывая тем самым, что одни только материнские копии IES подавляют эксцизию из материнских макронуклеусов (Duharcourt et al., 1995).«Матерински контролируемые» versus «не матерински контролируемые» IESs у Paramecium
Может ли вырезание других IESs контролироваться подобными материнскими влияниями? Для ответа на этот вопрос макронуклеусы клеток дикого типа трансформировали большими сегментами микронуклеарной ДНК (IES+), содержащими гены поверхностных антигенов либо G, либо A (Duharcourt et al., 1998). Эти инъецированные сегменты содержали, соответственно, шесть и девять IESs. Изучали эксцизию 13 из этих IESs, и оказалось, что пять IESs сохранялись в макронуклеусах поставтогамных потомков этих трансформированных клеток. Инъекция плазмид, содержащих одиночные IESs, показала, что подавление было строго специфичным: каждая из этих пять IESs индуцировала сохранение только гомологичной зиготической IES, но не влияла на какие-либо другие. Контрольный фрагмент ДНК, содержавший большую часть макронуклеарного (IES) гена (7, не оказывал никакого влияния на любую из тестируемых IESs. Среди 13 испытанных IESs Paramecium не было сколько-нибудь очевидных различий в величине, составе оснований или в положении внутри генов между этими пятью, которые продемонстрировали материнский эффект, и восьмью, которые его не обнаружили (Duharcourt et al., 1998).Зависящее от гомологии подавление элиминации IES у Tetrahymena
Эксперименты, аналогичные проведенным на Paramecium, показали, что содержание ДНК родительского макронуклеуса Tetrahymena может регулировать элиминацию гомологичных последовательностей из развивающегося соматического генома Две хорошо охарактеризованные IESs, делеционные элементы М и R, были введены путем микроинъекций в макронуклеусы штаммов дикого типа таким образом, что они поддерживались на высококопийных векторах. Когда у этих клеток была индуцирована конъюгация, потомство клеток, содержащих материнские копии элемента М, оказалось неспособным эффективно элиминировать соответствующие IESs во время развития макронуклеуса (Chalker and Yao, 1996). Подобным же образом клетки, родительские макронуклеусы которых содержали копии элемента R, оказались неспособными вырезать гомологичную IES. Существенное подавление эксцизии негомологичных элементов не наблюдали. Таким образом, подавление элиминации ДНК было специфичным в отношении последовательности. Последовательности, гомологичные самой IES, были достаточны для этого подавления, а непосредственно фланкирующие ДНК таким эффектом не обладали. Важно отметить, что эта индуцированная неспособность к элиминации ДНК была наследуемой, поскольку последующие поколения также сохраняли геномные копии этой IES в своих макронуклеусах. Поскольку у Tetrahymena в конъюгирующих парах во время развития происходит интенсивный обмен цитоплазмой, исследователи имели возможность наблюдать, что это подавление передавалось через цитоплазму таким образом, что лишь один из партнеров должен был нести эту IES в своем родительском соматическом геноме для того, чтобы были затронуты гомологичные последовательности во всех развивающихся ядрах в паре, включая ядра в партнере дикого типа. Следовательно, состояние перестройки ДНК, характерное для родительских ядер, передается через цитоплазму и регулирует события, происходящие во время формирования нового соматического генома следующего поколения. Никакого обмена ядрами зародышевой линии не требуется для передачи состояния одного партнера по спариванию другому; это наблюдение исключает возможность того, что передача происходит путем наложения импринта на зародышевую линию в ходе нормального клеточного роста до вступления в развитие (Chalker et al., 2005). Действительно, путем физического разделения конъюгирующих пар, состоящих из клетки дикого типа и ее партнера, содержавшего копии элемента М в своем материнском соматическом ядре, было показано, что передача происходит после мейоза и очень близко к тому моменту, когда развивающиеся ядра впервые начинают дифференцироваться в новые макронуклеусы и микронуклеусы. Следовательно, влияние материнского соматического генома активно устанавливается в ходе развития.Биологические следствия материнского контроля
Способность инфузорий изменять перестройки ДНК таким образом, чтобы отражать материнский паттерн, дает клеткам простой способ передавать альтернативные соматические версии генома половому потомству. Эта динамическая регуляция означает, что стабильное равновесие между двумя альтернативными генетическими состояниями, например IES+(100 % эксцизии) и IES(0 % эксцизии) может достигаться и поддерживаться на протяжении многих половых поколений. Это было показано по крайней мере для одной IES Paramecium, для которой такое материнское влияние достаточно для того, чтобы превратить меньшую долю макронуклеарных копий IES+ в большую фракцию в макронуклеусе следующего поколения (Duharcourt et al., 1995). Такое влияние параллельно стабильному, материнскому наследованию типов спаривания О и Еу P.tetraurelia. Сопоставимая асимметрия обнаруживается в обеих системах, потому что и эксцизия IES, и детерминация О-типа, по-видимому, являются путями развития «по умолчанию», тогда как и сохранение IES, и детерминация Е-типа нуждаются в некоем цитоплазматическом сигнале из материнского макронуклеуса для изменения этих своих путей развития. Эти системы вполне могут быть родственными, потому что менделевская мутация mtFE, нарушающая эксцизию одной IES гена G независимо от родительского состояния, сходным образом делает детерминацию к Е конститутивной — наблюдение, связывающее альтернативные состояния обоих примеров. Выяснение механизма (механизмов), лежащего в основе этих явлений, несомненно вскроет новые способы материнского наследования эпигенетической информации. Рис. 7.8. Зависимое от гомологии подавление эксцизии IES материнским макронуклеусом
В ходе нормального развития IESs (красные и зеленые прямоугольники) эффективно вырезаются. Однако трансформация материнского макронуклеуса данной IES (исходные трансформанты = поколение t) может подавить элиминацию гомологичной IES во время последующих (поколение t + 1) (b будущих) раундов дифференцировки нового макронуклеуса
Рис. 7.8. Зависимое от гомологии подавление эксцизии IES материнским макронуклеусом
В ходе нормального развития IESs (красные и зеленые прямоугольники) эффективно вырезаются. Однако трансформация материнского макронуклеуса данной IES (исходные трансформанты = поколение t) может подавить элиминацию гомологичной IES во время последующих (поколение t + 1) (b будущих) раундов дифференцировки нового макронуклеуса
11. Trans-нуклеарное сравнение целых геномов, опосредованное РНК-интерференцией
Зависящие от гомологии эффекты, описанные выше, демонстрируют существование «переговоров» [a cross talk] между материнским соматическим геномом и геномом зародышевой линии в процессе ядерной дифференцировки, которые могут существенным образом менять паттерны перестройки ДНК. Тот факт, что затрагиваются только высоко гомологичные последовательности, является сильным аргументом в пользу предположения, что эти «переговоры» опосредуются нуклеиновыми кислотами. В этом регуляторном механизме могли бы, возможно, участвовать транскрипты из материнского макронуклеуса, экспортируемые в развивающийся макронуклеус, где, в случае, если они содержат IES, они предотвращали бы элиминацию гомологичных последовательностей. Однако было показано, что эти предполагаемые материнские транскрипты не участвуют в качестве донорских матриц в ходе репарации двунитевых разрывов, индуцируемых конститутивной эксцизией IES (Duharcourt et al., 1995). Если материнские защитные транскрипты существуют, эти ~23-нуклеотидные siRNAs, которые диктуют сайленсинг генов, могут косвенным образом «нацеливать» делецию ДНК, стимулируя разрушение тех из них, которые идентичны по последовательности. Сама по себе эта роль siRNAs не может объяснить материнское наследование перестроечных паттернов в последовательных поколениях. Как это обсуждается ниже, возможно, что в конечном счете реорганизацией генома управляет взаимодействие между материнскими макронуклеарными транскриптами и новым классом коротких РНК, происходящих из мейотического микронуклеуса.11.1. Связь коротких РНК с элиминацией ДНК
У Tetrahymena каноническая модификация гетерохроматина, H3K9-метилирование, маркирует хроматин, связанный с IESs, непосредственно перед их вырезанием. Каким образом эта модификация осуществляет специфическое «нацеливание» на эти сегменты ДНК, предназначенные для элиминации? Был описан RNAi-подобный путь, который использует RNA-гиды, чтобы направить ее на соответствующие локусы (обзор см. Mochizuki and GorovskY, 2004; Yao and Chao, 2005). Первоначальным указанием на то, что делеция ДНК использует молекулы гомологичных РНК, явилось наблюдение, что у Tetrahymena IESs двунаправлено транскрибируются на ранних этапах конъюгации (Chalker and Yao, 2001). Реальный прорыв случился, когда Mochizuki и др. (2002) идентифицировали белок семейства PIWI/Argonaute, кодируемый геном TWI1, который экспрессируется в ходе развития и необходим для перестройки ДНК (Mochizuki et al., 2002) Поскольку белки Argonaute являются ключевыми игроками в процессах, включаемых RNAi, эти исследователи искали и нашли такой класс эндогенных малых (-28 нуклеотидов) РНК, которые предпочтительно комплементарны к последовательностям, ограниченным зародышевой линией. Деструкция гена TWI1 дестабилизировала эти короткие РНК и ликвидировала метилирование H3K9 в развивющемся соматическом ядре. Эта работа, опубликованная в 2002 году, в совокупности с экспериментами на Schizosaccharomyces pombe (главы 6 и 8) утвердила новую парадигму, согласно которой гетерохроматин генерируется действием гомологичных РНК, «нацеливающих» метку сайленсинга (H3K9) на специфичные локусы. Характеристика гена DCLl, кодирующего рибонуклеазу Dicer, осуществляющую процессинг двусторонних транскриптов в ~28-нуклеотидные малые РНК, обеспечила еще более глубокое проникновение в общую регуляцию этого процесса (Malone et al., 2005; Mochizuki and Gorovsky, 2005). Этот белок экспрессируется на высоком уровне на ранних этапах конъюгации и локализуется в премейотических микронуклеусах, что указывает на то, что генерация малых РНК компартментализована во времени и пространстве в пределах этого ядра зародышевого пути. Разрушение гена DCL1 вызывало утрату способности производить малые РНК, аккумуляцию транскриптов зародышевой линии и, в конечном счете, неспособность к вырезанию IES. Интригующим моментом является то, что утрата малых РНК не ликвидирует метилирование H3K9, как это наблюдалось в линиях с нокаутом по TWI1. Тем не менее, анализ с помощью иммунопреципитации хроматина показал, что эта модификация больше не является обогащенной на IESs; таким образом, малые РНК необходимы для того, чтобы «нацеливать» эту модификацию хроматина на нужные локусы (Malone et al., 2005). Чтобы объяснить роль материнского генома в регуляции этих событий, была предложена модель сканирующей РНК (Mochizuki et al., 2002). В варианте этой модели, изображенном на рис. 7.9, 28-нуклеотидные «сканирующие» РНК, генерируемые в микронуклеусе, - связываются с RISC-подобным комплексом в цитоплазме, содержащим Twil, и изначально направляются в материнский макронуклеус. Здесь они сканируют существующий перестроенный геном на наличие гомологии. Те scnRNAs, которые спариваются с материнскими последовательностями, удаляются из пула активных комплексов. Остающиеся scnRNAs, ассоциированные с Twil, транспортируются затем в развивающийся макронуклеус, где они «нацеливают» метилирование H3K9 на гомологичные последовательности, маркируя их для вырезания с помощью механизма перестройки ДНК. Эта модель подкрепляется далее наблюдением, согласно которому Twil локализуется в материнском макронуклеусе на ранних этапах развития после образования основной массы малых РНК, но до появления предшественников новых макронуклеусов. Таким образом, регулируемый трафик комплексов малых РНК и белков облегчает сравнение соматического генома и генома зародышевой линии.11.2. Транспорт РНК из материнского в зиготические макронуклеусы у Paramecium
Для сравнения последовательностей зародышевой линии и соматических в масштабах всего генома был бы необходим весьма сложный механизм, как для обеспечения массивного транспорта молекул РНК между ядрами, так и для осуществления очень большого числа взаимодействий по механизму спаривания, которые предполагаются в модели сканирования. Участником этих транс -нуклеарных «переговоров» у Paramecium оказался новый белок, Nowal, связывающийся с нуклеиновой кислотой (Nowacki et al., 2005). Nowal синтезируется незадолго до мейоза и сначала аккумулируется в материнском макронуклеусе, а затем, подобно Twil Tetrahymena, релокализуется в развивающийся зиготический макронуклеус. Мечение Nowal фотоактивируемым GFP позволило исследователям убедительно продемонстрировать, что этот белок транспортируется из ядер одного типа в ядра другого. Один домен этого белка может связывать РНК, а второй домен необходим и достаточен для межъядерного транспорта; таким образом, Nowal может быть транспортером РНК. Nowal является существенным для развития жизнеспособного нового макронуклеуса, в том числе для элиминации транспозонов зародышевой линии и подгруппы IESs. Удивительно, но только те IESs, которые подвержены материнскому контролю, затрагиваются нокдауном Nowal; это позволяет предполагать, что этот белок участвует в trans-нуклеарном сопоставлении. Те IESs, которые нечувствительны к присутствию гомологичных последовательностей в материнском макронуклеусе, не зависят в своей эксцизии от Nowal, что подтверждает существование механистически различных классов IESs у Paramecium. Хотя нуклеиновые кислоты, связываемые Nowal in vivo, пока еще не известны, эффекты удаления Nowal согласуются с предлагаемой моделью сканирования (рис. 7.9) и позволяют предполагать, что этот белок может нести РНК, отобранные для «нацеливания» элиминации находящихся под материнским контролем IESs и транспозонов в развивающемся макронуклеусе. Рис. 7.9. Модель сканирования РНК, объясняющая контроль делеции ДНК
Двунаправленная транскрипция большой части генома зародышевой линии происходит на ранних этапах развития и приводит к продукции scnRNAs. Эти РНК затем транспортируются в материнский макронуклеус, где любая встреча с гомологичной последовательностью включает их удаление из активного пула. Остающиеся, микронуклеус-специфичные РНК перенаправляются в развивающийся макронуклеус, где они «нацеливают» НЗК9-метилирование на гомологичные последовательности, создавая сигнал об их удалении из генома. Модель адаптирована из: Mochizuki et al. (2002)
Рис. 7.9. Модель сканирования РНК, объясняющая контроль делеции ДНК
Двунаправленная транскрипция большой части генома зародышевой линии происходит на ранних этапах развития и приводит к продукции scnRNAs. Эти РНК затем транспортируются в материнский макронуклеус, где любая встреча с гомологичной последовательностью включает их удаление из активного пула. Остающиеся, микронуклеус-специфичные РНК перенаправляются в развивающийся макронуклеус, где они «нацеливают» НЗК9-метилирование на гомологичные последовательности, создавая сигнал об их удалении из генома. Модель адаптирована из: Mochizuki et al. (2002)
12. Заключение: элиминация ДНК как механизм защиты генома
Исследования RNAi, в особенности у растений и нематод, привели к гипотезе, что этот путь развился как защитный механизм, позволяющий клеткам контролировать пролиферацию вирусов и транспозонов путем разрушения mRNAs и «нацеливания» формирования гетерохроматина на этих геномных паразитах (Matzke and Birchler, 2005). Как уже упоминалось, перемещающиеся элементы, присутствующие в геноме зародышевой линии инфузорий, элиминируются в ходе развития соматического макронуклеуса, что эффективно сводит на нет их влияние. Сделанное на Tetrahymena наблюдение, что метилирование H3K9 маркирует геномные районы для делеции ДНК в ходе развития, заставляет предполагать, что использование RNAi у инфузорий в основе своей сходно с его ролью в формировании гетерохроматина у других эукариот: инфузории лишь продвинулись на шаг дальше и элиминируют гетерохроматин из своего соматического генома. Тем не менее, одним оригинальным вкладом, полученным в исследованиях на инфузориях, является идея о том, что специфические последовательности, «предназначаемые» RNAi для формирования (элиминации) гетерохроматина в ходе раннего развития, селектируются с помощью глобального сопоставления материнских соматического генома и генома зародышевой линии, начинающегося во время мейоза. Этот механизм эффективно защищал бы от вредоносных влияний транспозиции в зародышевой линии: любой новый транспозон, интегрирующийся в материнскую зародышевую линию, распознавался бы как чужеродный путем сравнения с соматическим геномом в ходе полового воспроизведения, что вело бы к его удалению из транскрибированного соматического генома потомков, ограничивая тем самым его будущее распространение. У Tetrahymena scnRNAs, которые «нацеливают» элиминацию ДНК, весьма вероятно опосредуют trans-нуклеарные «переговоры» между геномом зародышевого пути и соматическим геномом. Неясно, весь ли микронуклеарный геном производит scnRNAs, но неопубликованные данные, полученные на Paramecium, позволяют предполагать, что по крайней мере большая его часть делает это. Анализы с помощью Норзерн-блоттинга выявили мейоз-специфичные, эндогенные короткие РНК, соответствующие клеточным генам, а также транспозонам и IESs (M.Nowacki et al., неопубликовано). Эти короткие РНК имеют длину ~25 нуклеотидов и четко отличаются от ~23-нуклеотидных siRNAs. По-видимому, они функционально эквивалентны scnRNAs Tetrahymena, потому что инактивация специфических Dicer- подобных генов у Paramecium супрессирует их образование во время мейоза и устраняет элиминацию транспозонов и находящихся под материнским контролем IESs, а также материнское наследование делеций макронуклеарных генов (V.Serrano et al., неопубликовано). Оригинальная модель сканирования генома предполагала, что scnRNAs сравниваются с перестроенной ДНК в материнском макронуклеусе, инактивируя те из последовательностей, которые соответствуют макро-нуклеарным последовательностям, и отбирая для пула, специфичного для микронуклеуса (рис. 7.10а). Однако несколько линий доказательств заставляют предполагать. что scnRNAs могут сравниваться с происходящими из макронуклеуса транскриптами, а не с самой ДНК. Это освобождало бы от необходимости открывать ДНК-дуплекс по всему геному, чтобы провести испытание на комплементарность. Те из введенных в материнский макронуклеус Tetrahymena IESs, которые интерферируют с делецией ДНК, транскрибируются, допуская такую возможность (Chalker and Yao, 2001; Chalker et al., 2005). Транскрипты, возникающие с какой-то IES в материнском макронуклеусе, защищали бы зиготическую IES от элиминации, как изначально постулировалось для объяснения IES-подавления у Paramecium, путем титрования гомологичных scnRNAs. Данные в пользу цитоплазматического фактора, который может «спасать» делецию гена А в штамме d48, также говорят в пользу существования протективных транскриптов и позволяют также предполагать что в цитоплазме, как и в материнском макронуклеусе, мог бы происходить отбор scnRNAs Наконец, это объясняло бы, каким образом посттранскрипционный сайленсинг данного гена у Paramecium может вызывать его делецию в следующем поколении: если транскрипты из материнского макронуклеуса разрушаются, 23-нуклеотидные siRNAs, гомологичные scnRNAs, смогут свободно «нацеливать» делеции в новом макронуклеусе, несмотря на присутствие этого гена в материнском макронуклеусе. Один интересный аспект этой модифицированной гипотезы, которую можно назвать моделью сканирования транскриптома, заключается в том, что все взаимодействия типа образования пар могут происходить между молекулами РНК. Если scnRNAs в конечном счете «нацеливают» формирование гетерохроматина путем взаимодействия с вновь возникающими транскриптами в гомологичном локусе, как это предполагается у S. pombe и растений, эти более поздние взаимодействия по типу образования пар не обязательно должны фундаментально отличаться от взаимодействий, происходящих на этапе селекции. scnRNAs могут просто спариваться с любой доступной РНК после того как они покинут мейотический микронуклеус. Спаривание с многочисленными макронуклеарными транскриптами, присутствующими в клетке на ранних этапах развития, эффективно удаляло бы гомологичные scnRNAs из пула путем их секвестрации или разрушения. К тому времени, когда зиготический макронуклеус формируется и начинает транскрипцию своего неперестроенного генома, для спаривания с образующимися транскриптами оставались бы лишь специфические для микронуклеуса scnRNAs. Эти взаимодействия по типу спаривания могут вести к делеции ДНК, потому что они происходят в развивающемся макронуклеусе или потому, что они происходят на правильной стадии развития. В этой модели распознавание «своего» (макронуклеарных последовательностей) и «не своего» (геномных паразитов в зародышевой линии) достигается простым онтогенетическим переключением, изменяющим исход простых взаимодействий по типу спаривания. Концептуально это похоже на процесс, посредством которого иммунная система позвоночных научается различать «свое» и «не свое». Изначально генерируется огромный репертуар лимфоцитов, экспрессирующих различные антитела, но на ранних этапах развития все те из них, которые узнают имеющиеся антигены (наиболее вероятно, «свои» антигены), элиминируются из будущего пула. Коль скоро эта стадия пройдена, узнавание сходного антигена (который на этот раз, скорее всего, является чужеродным) ведет к клональному росту соответствующих лимфоцитов. Геномная иммунная система инфузорий, использующая RNAi, обнаруживает, таким образом, поразительный параллелизм с клеточной иммунной системой позвоночных животных. Рис. 7.10. Модель сканирования транскриптома для сравнения соматического генома и генома зародышевой линии
(а) Регулирование «по умолчанию». (1) После начала мейоза большинство или даже все макронуклеарные и микронуклеарные геномы транскрибируются: штриховые линии в макронуклеусе представляют неохарактеризованные транскрипты. В микронуклеусе транскрипция является двунаправленной и приводит к образованию scnRNAs (коротких двунитевых молекул) для последовательностей всех типов (клеточных генов, светлорозовые стрелки: транспозонов, оранжевая двойная стрелка; IES, зеленые прямоугольники). Эти scnRNAs экспортируются в материнский макронуклеус, где они могут спариваться с гомологичными соматическими транскриптами. Спаривание может происходить и в цитоплазме. scnRNAs, спаривающиеся с гомологичными транскриптами, секвестрируются или разрушаются, тогда как scnRNAs, специфичные для микронуклеуса, реэкспортируются в развивающийся зиготический макронуклеус, где они спариваются с гомологичными последовательностями (ДНК или только что образовавшимися транскриптами), «нацеливая» таким образом метилирование по НЗК9 на специфичные для микронуклеуса последовательности (транспозоны и IESs). (4) Маркированные последовательности элиминируются, (б) Эффекты постгранскрипционного сайленсинга гена в материнском макронуклеусе. Экспериментальная индукция постгранскрипционного сайленсинга многокопийными трансгенами или dsRNA приводит к образованию двунитевых siRNAs, гомологичных этому гену (показано красным цветом). Эти siRNAs разрушают гомологичные материнские соматические транскрипты, так что гомологичные scnRNAs не будут инактивированы и смогут «нацеливать» делецию данного гена в развивающемся зиготическом макронуклеусе
Рис. 7.10. Модель сканирования транскриптома для сравнения соматического генома и генома зародышевой линии
(а) Регулирование «по умолчанию». (1) После начала мейоза большинство или даже все макронуклеарные и микронуклеарные геномы транскрибируются: штриховые линии в макронуклеусе представляют неохарактеризованные транскрипты. В микронуклеусе транскрипция является двунаправленной и приводит к образованию scnRNAs (коротких двунитевых молекул) для последовательностей всех типов (клеточных генов, светлорозовые стрелки: транспозонов, оранжевая двойная стрелка; IES, зеленые прямоугольники). Эти scnRNAs экспортируются в материнский макронуклеус, где они могут спариваться с гомологичными соматическими транскриптами. Спаривание может происходить и в цитоплазме. scnRNAs, спаривающиеся с гомологичными транскриптами, секвестрируются или разрушаются, тогда как scnRNAs, специфичные для микронуклеуса, реэкспортируются в развивающийся зиготический макронуклеус, где они спариваются с гомологичными последовательностями (ДНК или только что образовавшимися транскриптами), «нацеливая» таким образом метилирование по НЗК9 на специфичные для микронуклеуса последовательности (транспозоны и IESs). (4) Маркированные последовательности элиминируются, (б) Эффекты постгранскрипционного сайленсинга гена в материнском макронуклеусе. Экспериментальная индукция постгранскрипционного сайленсинга многокопийными трансгенами или dsRNA приводит к образованию двунитевых siRNAs, гомологичных этому гену (показано красным цветом). Эти siRNAs разрушают гомологичные материнские соматические транскрипты, так что гомологичные scnRNAs не будут инактивированы и смогут «нацеливать» делецию данного гена в развивающемся зиготическом макронуклеусе
13. Будущий вклад исследований на инфузориях в эпигенетику
Недавнее секвенирование макронуклеарных геномов Tetrahymena и Paramecium сделает эти простые клеточные модели еще более полезными для исследований эпигенетических механизмов. Биология ядерного диморфизма облегчила открытие регуляторов хроматина и останется по-прежнему перспективной системой для новых открытий. Обладая двумя разными путями RNAi — одной, используемой для постгранскрипционного сайленсинга генов, и другой, используемой для эпигенетической модификации генома, — инфузории также уникально сбалансированы для раскрытия сложности направляемых РНК, зависящих от гомологии регуляторных процессов, участвующих в развитии. Рибонуклеазы, родственные Dicer, Argonaute-подобные белки и их партнеры уже идентифицированы или будут идентифицированы, а исследования, ведущиеся в настоящее время, обещают расшифровать их функциональную специализацию. Учитывая филогенетическое положение инфузорий на древе жизни, такая информация без сомнения прольет свет на эволюцию этих механизмов у эукариот. Именно исследование множественных эпигенетических явлений привело к признанию широкого распространения и использования РНК-опосредованной регуляции у эукариот. Тем не менее, даже до того, как это поняли, наблюдение, что ДНК-содержимое одного ядра оказывает влияние на гомологичные последовательности в другом ядре, заставило исследователей инфузорий постулировать существование Ггая$-активных молекул РНК, направляющих зависимые от гомологии «переговоры». Открытие RNAi и ее роли в перестройках ДНК подтвердило эту спекуляцию. Какие же будущие сведения, имеющие общее значение, могли бы быть получены в результате раскрытия механизмов, опосредующих trans-ядерные «переговоры»? Если гипотеза «транскрипционного сканирования» (рис. 7.10) верна, материнские соматические транскрипты защищают зиготические ДНК-последовательности от элиминации. Если приравнять элиминацию ДНК формированию гетерохроматина, тогда материнские транскрипты усливали бы, путем блокирования элиминации, эухроматин-специфичные модификации на гомологичных последовательностях. Предполагаемая позитивная роль этих транскриптов на гомологичных генах является, таким образом, непрямой, возникая из их способности инактивировать гомологичные scnRNAs, которые в противном случае «нацеливали» бы формирование гетерохроматина. Тем не менее, этот эффект материнских транскриптов, которые, как заставляют предполагать некоторые эксперименты, не обязательно являются кодирующими белки mRNAs, представлял бы новый механизм, при том, что все известные РНК-опосредованные, зависящие от гомологии механизмы ведут к даун-регуляции гена-«мишени». Деградация или секвестрирование коротких РНК длинными транскриптами является, по существу, оборотной стороной продемонстрированных механизмов, базирующихся на RNAi, где короткие РНК инактивируют длинные. Если длинные и короткие РНК могут выступать как антагонисты действия друг друга, их взаимодействие должно направлять систему в сторону одного из двух альтернативных состояний, в зависимости от их относительного количества. Это позволяет предполагать, что наследование экспрессионного статуса генов могло бы зависеть от постоянной обратной связи из пула РНК, а не исключительно от механизмов полуконсервативной репликации хроматина. Соблазнительно думать, что такой опосредованный РНК, trans-активный механизм ответствен за стабильность экспрессии генов поверхностных антигенов в ходе вегетативного роста у Paramecium, потому что это объясняло бы также, каким образом, после полового воспроизведения, развивающийся макронуклеус может наследовать материнский серотип через цитоплазму. Таким образом, эпигенетическое наследование паттернов геномных перестроек может быть лишь частным аспектом всеобъемлющей системы наследования у инфузорий, базирующейся на РНК. По мере того, как будущие исследования на инфузориях будут высвечивать опосредующих такую регуляцию игроков (РНК и белки), должно будет выявляться ее существование у других организмов и ее дальнейшая связь с известными эпигенетическими механизмами. Вполне вероятно, что базирующаяся на РНК наследственность, в ее базовой форме, широко распространена. Недавние исследования транскриптомного выхода у многоклеточных организмов обнаружили неожиданное обилие и сложность некодирующих транскриптов (Mattick, 2004; Meyers et al., 2004; Suzuki and Hayashizaki, 2004; Cheng et al., 2005; Claverie, 2005), а также частую встречаемость коротких РНК, совпадающих по последовательности с геномными районами всех типов (Lu et al., 2005). Многие зависимые от гомологии эффекты, в том числе мейотический сайленсинг у грибов и парамутация у растений (главы 6 и 9), остаются не до конца понятыми. Только комплексная картина, которая будет получена в будущих экспериментах на всех эукариотах, включая инфузорий, даст нам полное представление об эпигенетических процессах.Литература
Allis C.D. and Gorovsky M.A. 1981. Histone phosphorylation in macro- and micronuclei of Tetrahymena thermophila. Biochemistry 20: 3828-3833. Allis C.D., Glover C.V., Bowen J.K., and Gorovsky M.A. 1980. Histone variants specific to the transcriptionally active, amitotically dividing macronucleus of the unicellular eucaryote, Tetrahymena thermophila. Cell 20: 609-617. Beisson J. and Sonnebom T.M. 1965. Cytoplasmic inheritance of the organization of the cell cortex in Paramecium aurelia. Proc. Natl. Acad. Sci. 53: 275-282. Beisson J. and Wright M. 2003. Basal body/centriole assembly and continuity. Curr. Opin. Cell Biol. 15: 96-104. Betermier M. 2004. Large-scale genome remodelling by the devel-opmentally programmed elimination of germ line sequences in the ciliate Paramecium. Res. Microbiol. 155: 399-408. Betermier M., Duharcourt S., Seitz H., and Meyer E. 2000. Timing of developmentally programmed excision and circularization of Paramecium internal eliminated sequences. Mol. Cell. Biol. 20: 1553-1561. Brownell J.E. and Allis C.D. 1995. An activity gel assay detects a single, catalytically active histone acetyltransferase subunit in Tetrahymena macronuclei. Proc. Natl. Acad. Sci.A 92: 6364-6368. Brownell J.E., Zhou J., Ranalli T, Kobayashi R., Edmondson D.G., Roth S.Y., and Allis C.D. 1996. Tetrahymena histone acetyltransferase: A homolog to yeast Gcn5p linking histone acetylation to gene activation. Cell 84: 843-851. Brygoo Y. and Keller A.-M. 1981a. A mutation with pleitropic effects on macronuclearly differentiated functions in Paramecium tetraurelia. Dev. Genet. 2: 23-34. Brygoo Y. and Keller A.-M. 1981b. Genetic analysis of mating type differentiation in Paramecium tetraurelia. III. A mutation restricted to mating type E and affecting the determination of mating type. Dev. Genet. 2: 13-22. Cassidy-Hanley D., Bisharyan Y., Fridman V., Gerber J., Lin C, Orias E., Orias J.D., Ryder H., Vong L., and Hamilton E.R 2005. Genome-wide characterization of Tetrahymena thermophila chromosome breakage sites. II. Physical and genetic mapping. Genetics 170: 1623-1631 Chalker D.L. and Yao M.C. 1996. Non-Mendelian, heritable blocks to DNA rearrangement are induced by loading the somatic nucleus of Tetrahymena thermophila with germ line-limited DNA. Mol. Cell. Biol. 16: 3658-3667. Chalker D.L. and Yao M.C. 2001. Nongenic, bidirectional transcription precedes and may promote developmental DNA deletion in Tetrahymena thermophila. Genes Dev. 15: 1287-1298. Chalker D.L., Fuller P., and Yao M.C. 2005. Communication between parental and developing genomes during Tetrahymena nuclear differentiation is likely mediated by homologous RNAs. Genetics 169: 149-160. Cheng J., Kapranov P., Drenkow J., Dike S., Brubaker S., Patel S., Long J., Stem D., Tammana H., Helt G., et al. 2005. Transcriptional maps of 10 human chromosomes at 5-nucleotide resolution. Science 308: 1149-1154. Claverie J.M. 2005. Fewer genes, more noncoding RNA. Science 309: 1529-1530. Cleveland D.W., Mao, Y., and Sullivan K.F. 2003. Centromeres and kinetochores: From epigenetics to mitotic checkpoint signaling. Cell 112: 407-421. Coyne R.S., Chalker D.L., and Yao M.C. 1996. Genome downsizing during ciliate development: Nuclear division of labor through chromosome restructuring. Annu. Rev. Genet. 30: 557—578. Coyne R.S., Nikiforov M.A., Smothers J.F., Allis C.D., and Yao M.C. 1999. Parental expression of the chromodomain protein Pddlp is required for completion of programmed DNA elimination and nuclear differentiation. Mol. Cell 4: 865-872. Davis M.C, Whrd J.G., Herrick G., and Allis C.D. 1992. Programmed nuclear death: Apoptotic-like degradation of specific nuclei in conjugating Tetrahymena. Dev. Biol. 154: 419-432. Dou Y. and Gorovsky M.A. 2000. Phosphorylation of linker histone HI regulates gene expression in vivo by creating a charge patch Mol. Cell 6: 225-231. Dou Y. and Gorovsky M.A. 2002. Regulation of transcription by H1 phosphorylation in Tetrahymena is position independent and requires clustered sites. Proc. Natl. Acad. Sci. 99: 6142-6146. Dou Y.. Mizzen C.A., Abrams M., Allis C.D., and Gorovsky M.A. 1999. Phosphorylation of linker histone HI regulates gene expression in vivo by mimicking HI removal. Mol. Cell 4: 641-647. Duharcourt S., Butler A., and Meyer E. 1995. Epigenetic self-regulation of developmental excision of an internal eliminated sequence on Paramecium tetraurelia. Genes Dev. 9: 2065-2077. Duharcourt S., Keller A.M., and Meyer E. 1998. Homology-dependent maternal inhibition of developmental excision of internal eliminated sequences in Paramecium tetraurelia. Mol. Cell. Biol. 18: 7075-7085. Epstein L.M. and Forney J.D. 1984. Mendelian and non-Mendelian mutations affecting surface antigen expression in Paramecium tetraurelia. Mol. Cell. Biol. 4: 1583-1590. Fan Q. and Yao M.-C. 1996. New telomere formation coupled with site-specific chromosome breakage in Tetrahymena thermophila. Mol. Cell. Biol. 16: 1267-1274. Forney J.D. and Blackburn E.H. 1988. Developmentally controlled telomere addition in wild-type and mutant paramecia. Mol. Cell. Biol. 8: 251-258. Forney J.D., Yantiri E., and Mikami K. 1996. Developmentally controlled rearrangement of surface protein genes in Paramecium tetraurelia. J. Eukaryot. Microbiol. 43: 462-467. Galvani A. and Sperling L. 2001. Transgene-mediated post-transcriptional gene silencing is inhibited by 3’ non-coding sequences in Paramecium. Nucleic Acids Res. 29: 4387-4394. Galvani A. and Sperling L. 2002. RNA interference by feeding in Paramecium. Trends Genet. 18: 11-12. Gamier O., Serrano V., Duharcourt S., and Meyer E. 2004. RNA-mediated programming of developmental genome rearrangements in Paramecium tetraurelia. Mol. Cell. Biol. 24: 7370-7379. Gratias A. and Betermier M. 2001. Developmentally programmed excision of internal DNA sequences in Paramecium aurelia. Biochimie 83: 1009-1022. Gratias A. and Betermier M. 2003. Processing of doublestrand breaks is involved in the precise excision of Paramecium internal eliminated sequences. Mol. Cell. Biol. 23: 7152-7162. Hamilton E., Bruns P., Lin C., Merriam V., Orias E., Vong L., and Cassidy-Hanley D. 2005. Genome-wide characterization of Tetrahymena thermophila chromosome breakage sites. I. Cloning and identification of functional sites. Genetics 170: 1611-1621. Harumoto T. 1986. Induced change in a non-Mendelian determinant by transplantation of macronucleoplasm in Paramecium tetraurelia. Mol. Cell. Biol. 6: 3498-3501. Harwood J. 1985. The erratic career of cytoplasmic inheritance. Trends Genet. 1: 298-300. HayashiT., Hayashi H., Fusauchi Y., and Iwai K. 1984. Tetrahymena histone H3. Purification and two variant sequences. J. Biochem. 95: 1741-1749. Hayashi T., Hayashi H., and Iwai K. 1987. Tetrahymena histone HI. Isolation and amino acid sequence lacking the central hydrophobic domain conserved in other HI histones. J. Biochem. 102: 369-376. Jahn C.L. and Klobutcher L.A. 2002. Genome remodeling in ciliated protozoa. Annu. Rev. Microbiol. 56: 489-520. Jaraczewski J.W. and Jahn C.L. 1993. Elimination of Tec elements involves a novel excision process. Genes Dev. 7: 95-105. Jessop-Murray H., Martin L.D., Gilley D., Preer J.R., and Polisky B. 1991. Permanent rescue of a non-Mendelian mutation of Paramecium by microinjection of specific DNA sequences. Genetics 129: 727-734. Klobutcher L.A. 1999. Characterization of in vivo developmental chromosome fragmentation intermediates in E. crassus. Mol. Cell 4: 695-704. Klobutcher L.A. and Herrick G. 1995. Consensus inverted terminal repeat sequence of Paramecium IESs: Resemblance to termini of Tel-related and Euplotes Tec transposons. Nucleic Acids Res. 23: 2006-2013. Klobutcher L.A. and Herrick G. 1997. Developmental genome reorganization in ciliated protozoa: The transposon link. Prog. Nucleic Acid Res. Mol. Biol. 56: 1-62. Klobutcher L.A., Turner L.R., and LaPlante J. 1993. Circular forms of developmentally excised DNA in Euplotes crassus have a heteroduplex junction. Genes Dev. 7: 84-94. Kobayashi S. and Koizumi S. 1990. Characterization of non-Mendelian and Mendelian mutant strains by micronuclear transplantation in Paramecium tetraurelia. J. Protozool. 37: 489-492. Koizumi S. and Kobayashi S. 1989. Microinjection of plasmid DNA encoding the A surface antigen of Paramecium tetraurelia restores the ability to regenerate a wild-type macronucleus. Mol. Cell. Biol. 9: 4398-4401. Landweber L.F., Kuo T.C., and Curtis E.A. 2000. Evolution and assembly of an extremely scrambled gene. Proc. Natl. Acad. Sci. 97: 3298-3303. Le Mouel A., Butler A., Caron F, and Meyer E. 2003. Developmentally regulated chromosome fragmentation linked to imprecise elimination of repeated sequences in Paramecia. Eukaryot. Cell 2: 1076-1090. Lee S.R. and Collins K. 2006. Two classes of endogenous small RNAs in Tetrahymena thermophila. Genes Dev. 20: 28-33. Liu Y., Mochizuki K., and Gorovsky M.A. 2004. Histone H3 lysine 9 methylation is required for DNA elimination in developing macronuclei in Tetrahymena. Proc. Natl. Acad. Sci. 101: 1679-1684. Liu Y., SongX., Gorovsky M.A., and Karrer K.M. 2005. Elimination of foreign DNA during somatic differentiation in Tetrahymena thermophila shows position effect and is dosage dependent. Eukaryot. Cell 4: 421-431. Lu C., Tej S.S., Luo S., Haudenschild C.D., Meyers B.C., and Green P.J. 2005. Elucidation of the small RNA component of the transcriptome. Science 309: 1567-1569. Madireddi M.T., Davis M., and Allis D. 1994. Identification of a novel polypeptide involved in the formation of DNA-containing vesicles during macronuclear development in Tetrahymena. Dev. Biol. 165: 418-431. Madireddi M.T., Coyne R.S., Smothers J.F., Mickey K.M., Yao M.C, and Allis CD. 1996. Pddlp, a novel chromodomain-containing protein, links heterochromatin assembly and DNA elimination in Tetrahymena. Cell 87: 75-84. Malone C.D., Anderson A.M., Motl J.A., Rexer C.H., and Chalker D.L. 2005. Germ line transcripts are processed by a Dicer-like protein that is essential for developmentally programmed genome rearrangements of Tetrahymena thermophila. Mol. Cell. Biol. 25: 9151-9164. Mattick J.S. 2004. RNA regulation: A new genetics? Nat. Rev. Genet. 5: 316-323. Matzke M.A. and Birchler J.A. 2005. RNAi-mediated pathways in the nucleus. Nat. Rev. Genet. 6: 24-35. Meyer E. 1992. Induction of specific macronuclear developmental mutations by microinjection of a cloned telomeric gene in Paramecium primaurelia. Genes Dev. 6: 211-222. Meyer E. and Keller A.M. 1996. A Mendelian mutation affecting mating-type determination also affects developmental genomic rearrangements in Paramecium tetraurelia. Genetics 143: 191-202. Meyer E., Butler A., Dubrana K., Duharcourt S., and Caron F. 1997. Sequence-specific epigenetic effects of the maternal somatic genome on developmental rearrangements of the zygotic genome in Paramecium primaurelia. Mol. Cell. Biol. 17: 3589-3599. Meyers B.C., Vu T.H., Tej S.S., Ghazal H., Matvienko M., Agrawal V., Ning J., and Haudenschild C.D. 2004. Analysis of the transcriptional complexity of Arabidopsis thaliana by massively parallel signature sequencing. Nat. Biotechnol. 22: 1006-1011. Mizzen C.A., Dou Y., Liu Y., Cook R.G., Gorovsky M.A., and Allis C.D. 1999. Identification and mutation of phosphorylation sites in a linker histone. Phosphorylation of macronuclear HI is not essential for viability in Tetrahymena. J. Biol. Chem. 274: 14533-14536. Mochizuki K. and Gorovsky M.A. 2004. Small RNAs in genome rearrangement in Tetrahymena. Curr. Opin. Genet. Dev. 14: 181-187. Mochizuki K. and Gorovsky M.A. 2005. A Dicer-like protein in Tetrahymena has distinct functions in genome rearrangement, chromosome segregation, and meiotic prophase. Genes Dev. 19: 77-89. Mochizuki K., Fine N.A., Fujisawa T., and Gorovsky M.A. 2002. Analysis of a piwi-related gene implicates small RNAs in genome rearrangement in Tetrahymena. Cell 110: 689-699. Moreira-Leite F.F., SherwinX, Kohl L., and Gull K. 2001. A tiypano-some structure involved in transmitting cytoplasmic information during cell division. Science 294: 610-612. -Nikiforov M.A., Gorovsky M.A., and Allis C.D. 2000. A novel chromo-domain protein, pdd3p, associates with internal eliminated sequences during macronuclear development in Tetrahymena thermophila. Mol. Cell. Biol. 20: 4128-4134. Nowacki M., Zagorski-Ostoja W., and Meyer E. 2005. Nowalp and Nowa2p: Novel putative RNA binding proteins involved in trans-nuclear crosstalk in Paramecium tetraurelia. Curr. Biol. 15: 1616-1628. Paschka A.G., Jonsson F., Maier V., Mollenbeck M., Paeschke K., Postberg J., Rupprecht S., and Lipps H.J. 2003. The use of RNAi to analyze gene function in spirotrichous ciliates. Eur. J. Protistol 39: 449-454. Philippe H., Germot A., and Moreira D. 2000. The new phylogeny of eukaryotes. Curr. Opin. Genet. Dev. 10: 596-601. Pond F.R., Gibson I., Lalucat J., and Quackenbush R.L. 1989. R-body-producing bacteria. Microbiol. Rev. 53: 25-67. Preer J.R., Jr., Preer L.B., and Jurand A. 1974. Kappa and other endosymbionts in Paramecium aurelia. Bacterial. Rev. 38: 113-163. Prescott D.M. 1994. The DNA of ciliated protozoa. Microbiol. Rev 58: 233-267. Prescott D.M. 1999. The evolutionary scrambling and developmental unscrambling of germline genes in hypotrichous ciliates. Nucleic Acids Res. 27: 1243-1250. Prescott D.M., Ehrenfeucht A., and Rozenberg G. 2003. Template-guided recombination for IES elimination and unscrambling of genes in stichotrichous ciliates. J. Theor. Biol. 222: 323-330. Ruiz E., Vayssie L., Klotz C., Sperling L., and Madeddu L. 1998. Homology-dependent gene silencing in Paramecium. Mol. Biol. Cell 9: 931-943. Saveliev S.V. and Cox M.M. 1995. Transient DNA breaks associated with programmed genomic deletion events in conjugating cells of Tetrahymena thermophila. Genes Dev. 9: 248-255. Saveliev S.V. and Cox M.M. 1996. Developmentally programmed DNA deletion in Tetrahymena thermophila by a transposition-like reaction pathway. EMBO J. 15: 2858-2869. Scott J.M., Mikami K., Leeck C.L., and Forney J.D. 1994. Non-Mendelian inheritance of macronuclear mutations is gene specific in Paramecium tetraurelia. Mol. Cell. Biol. 14: 2479-2484. Shen X. and Gorovsky M.A. 1996. Linker histone HI regulates specific gene expression but not global transcription in vivo. Cell 86: 475-483. ShenX., Yu L., Weir J.W., and Gorovsky M.A. 1995. Linker histones are not essential and affect chromatin condensation in vivo. Cell 82: 47-56. Shorter J. and Lindquist S. 2005. Prions as adaptive conduits of memory and inheritance. Nat. Rev. Genet. 6: 435-450 Sonnebom T.M. 1937. Sex, sex inheritance and sex determination in Paramecium aurelia. Proc. Natl. Acad. Sci. 23: 378-385. Sonnebom T.M. 1975. Paramecium aurelia. In Handbook of genetics (ed. R. King), pp. 469-594. Plenum, New York. Sonneborn T.M. 1977. Genetics of cellular differentiation: Stable nuclear differentiation in eucaryotic unicells. Annu. Rev. Genet. 11: 349-367. Strahl B.D., Ohba R., Cook R.G., and Allis C.D. 1999. Methylation of histone H3 at lysine 4 is highly conserved and correlates with transcriptionally active nuclei in Tetrahymena. Proc. Natl. Acad. Sci. 96: 14967-14972. Suzuki M. and Hayashizaki Y. 2004. Mouse-centric comparative transcriptomics of protein coding and non-coding RNAs. Bioessays 26: 833-843. Taverna S.D., Coyne R.S., and Allis C.D. 2002. Methylation of histone h3 at lysine 9 targets programmed DNA elimination in Tetrahymena. Cell 110: 701-711. Timmons L. and Fire A. 1998. Specific interference by ingested dsRNA. Nature 395: 854. Timmons L., Court D.L., and Fire A. 2001. Ingestion of bacterially expressed dsRNAs can produce specific and potent genetic interference in Caenorhabditis elegans. Gene 263: 103-112. Vavra K.J., Allis C.D., and Gorovsky M.A. 1982. Regulation of histone acetylation in Tetrahymena macro- and micronuclei. J. Biol. Chem. 257: 2591-2598. Wei Y., Yu L., Bowen J., Gorovsky M.A., and Allis C.D. 1999. Phosphorylation of histone H3 is required for proper chromosome condensation and segregation. Cell 97: 99-109. Wei Y., Mizzen C.A., Cook R.G., Gorovsky M.A., and Allis C.D. 1998. Phosphorylation of histone H3 at serine 10 is correlated with chromosome condensation during mitosis and meiosis in Tetrahymena. Proc. Natl. Acad. Sci. 95: 7480-7484. Williams K., Doak T.G., and Herrick G. 1993. Developmental precise excision of Oxytricha trifallax telomere-bearing elements and formation of circles closed by a copy of the flanking target duplication. EMBO J. 12: 4593-4601 Wu M., Allis C.D., Richman R., Cook R.G., and Gorovsky M.A. 1986. An intervening sequence in an unusual histone HI gene of Tetrahymena thermophila. Proc. Natl. Acad. Sci. 83: 8674-8678. Yao M.C. and Chao J.L. 2005. RNA-guided DNA deletion in Tetrahymena. An RNAi-based mechanism for programmed genome rearrangements. Annu. Rev. Genet. 39: 537-559. Yao M.C, Duharcourt S., and Chalker D.L. 2002. Genome-wide rearrangements of DNA in ciliates. in Mobile DNA IJ (ed. A. Lambowitz), pp. 730-758. Academic Press, New York. Yao M.C., Fuller P., and Xi X. 2003. Programmed DNA deletion as an RNA-guided system of genome defense. Science 300: 1581-1584. You Y., Aufderheide K., Morand J., Rodkey K., and Forney J. 1991. Macronuclear transformation with specific DNA fragments controls the content of the new macronuclear genome in Paramecium tetraurelia. Mol. Cell Biol. 11: 1133-1137. Yu L. and Gorovsky M.A. 1997. Constitutive expression, not a particular primary sequence, is the important feature of the H3 replacement variant hv2 in Tetrahymena thermophila. Mol. Cell. Biol. 17: 6303-6310.Глава 8. RNAi и сборка гетерохроматина
 Robert Martiensser1 и Danesh Moazed2
1Cold Spring Harbor Laboratory, Cold Spring Harbor, New York 11724
2Departament of Cell Biology, Harvard Medical School, Boston, Massachusetts 02115-5730
Robert Martiensser1 и Danesh Moazed2
1Cold Spring Harbor Laboratory, Cold Spring Harbor, New York 11724
2Departament of Cell Biology, Harvard Medical School, Boston, Massachusetts 02115-5730
Общее резюме
Пересечение РНК-интерференции (RNAi) и формирования гетерохроматина свело вместе две области регуляции генов, которые, как считалось прежде, используют разные, возможно даже неродственные механизмы. На основе цитологических методов окрашивания гетерохроматин был первоначально определен — почти 80 лет тому назад — как те районы хромосом, которые сохраняют конденсированное состояние на протяжении всего клеточного цикла. Ранние исследователи, изучавшие взаимоотношения между структурой хромосом и экспрессией генов, заметили, что некоторые хромосомные перестройки приводят к распространению гетерохроматина на соседние гены, которые затем становятся «молчащими». Но стохастическая природа такого распространения давала начало генетически идентичным популяциям клеток, которые имели разные фенотипы, давая тем самым поразительный пример эпигенетической регуляции. Термин «RNAi» был впервые использован для описания сайленсинга генов, когда нематоде Caenorhabditis elegans вводили гомологичную антисмысловую или двунитчатую РНК (dsRNA). Вскоре выяснили, что аналогичный механизм объясняет посттранскрипционный сайленсинг трансгена (PTGS — posttranscriptional transgene silencing), описанный ранее у петунии и других растений. Напротив, согласно широко распространенному мнению, гетерохроматин действует непосредственно на уровне хроматина, вызывая репрессию транскрипции с помощью механизма, называемого транскрипционным сайленсингом генов (TGS — transcriptional gene silencing). В этой главе мы сосредоточим наше внимание на взаимоотношениях между механизмом RNAi и формированием эпигенетически наследуемого гетерохроматина в специфических хромосомных районах. Мы воспользуемся недавними примерами, демонстрирующими эти отношения у дробянковых дрожжей Schizosaccharomyces pombe и растения Arabidopsis thaliana [резушка Таля]. Ядерный геном дробянковых дрожжей состоит из трех хромосом величиной от 3,5 до 5,7 млн. о. Каждая хромосома содержит, особенно в центромерах, большие блоки повторяющейся ДНК упакованные в гетерохроматин. Кроме того, локусы типа спаривания (контролирующие тип клетки) и субтеломерные участки ДНК также содержат повторяющиеся последовательности, упакованные в гетерохроматин. Мы знаем теперь, что сборка ДНК в гетерохроматин играет и регуляторную, и структурную роль. В случае локусов типа спаривания у дрожжей регуляция генной транскрипции гетерохроматином важна дляидентичности клеточного типа. В случае теломер и центромер гетерохроматин играет структурную роль, которая важна для правильного расхождения хромосом в ходе клеточного деления. Более того, повторяющиеся последовательности ДНК и перемещающиеся элементы составляют большую долю (в некоторых случаях более половины) генома многих эукариотных клеток. Гетерохроматин и связанные с ним механизмы играют ключевую роль в поддержании стабильности генома, регулируя активность повторяющихся последовательностей. Недавние исследования вскрыли удивительную потребность в компонентах RNAi-пути для процесса образования гетерохроматина у дробянковых дрожжей и позволили выяснить, каким образом эти два пути могут работать совместно на уровне хроматина. Говоря коротко, молекулы малых интерферирующих РНК (siRNA), являющиеся сигнатурами RNAi и других механизмов сайленсинга на основе dsRNA, собираются в комплекс индуцируемого РНК транскрипционного сайленсинга (RITS — RNA-Induced Transcriptional Silencing) и «направляют» эпигенетические модификации хроматина и формирование гетерохроматина в комплементарных участках хромосом. RITS использует зависимое от siRNA спаривание оснований для того, чтобы направлять ассоциацию либо с ДНК, либо с последовательностью вновь синтезируемой РНК в локусе-мишени, который должен быть сайленсирован, — ассоциацию, которая стабилизируется непосредственным связыванием с метилированным гистоном H3. Присутствие этих двух активностей в RITS включает формирование гетерохроматина совместно с хорошо известными, ассоциированными с гетерохроматином факторами и непосредственно связывает РНК-сайленсинг с модификацией гетерохроматина. У A. thaliana и других эукариот (за исключением Saccharomyces cerevisiae) участки центромерной ДНК также состоят из повторяющихся элементов. Эти и другие повторяющиеся последовательности, такие как ретроэлементы и другие транспозоны, являются источниками siRNAs, привлекая метилирование H3K9 и ДНК. Здесь, опять-таки, несколько компонентов пути RNAi необходимы для инициации и поддержания этих событий репрессивного метилирования. В этой главе мы обсуждаем, как образуются гетерохроматиновые siRNAs и как они опосредуют модификации ДНК и (или) хроматина у дробянковых дрожжей и A. thaliana.1. Обзор RNAi-пути
Хотя термин «RNAi» первоначально использовался для описания сайленсинга, который опосредуется экзогенной dsRNA у С. elegans (Fire et al., 1998), сейчас он в широком плане обозначает сайленсинг генов, включаемый dsRNA того или иного рода. Этапы RNAi включают образование dsRNA (которая может быть эндогенной или экзогенной, как, например, вирусная РНК), её процессинг в siRNA и «нацеливание» этих молекул либо на hRNAs (PTGS), либо на участки хроматина (TGS), чтобы вызвать сайленсинг. Поэтому, прежде чем представить компоненты механизма RNAi, специфичные для TGS, мы обсудим источник dsRNA, запускающих механизм RNAi. dsRNA могут образовываться в результате двунаправленной транскрипции повторяющихся элементов ДНК или транскрипции молекул РНК, спсобных к спариванию оснований внутри себя с образованием сегментов dsRNA (рис. 8.1, а и б, соответственно) Например, транскрипция с участков инвертированных повторов дает молекулы РНК, складывающиеся сами на себя с образованием шпилечных структур. Затем dsRNA расщепляются ферментом Dicer — рибонуклеазой класса RNase III, которая генерирует siRNAs. siRNAs — это комплементарные дуплексы величиной 21—27 нуклеотидов, обладающие характерным «свисающим концом» [overhang] длиной 2 нуклеотида на каждом 3’-конце дуплекса (Hamilton and Baulcombe, 1999; Zamore et al., 2000; Bernstein et al., 2001; Elbashir et al., 2001: Hannon. 2002; Zamore, 2002; Bartel, 2004; Baulcombe, 2004). Эти дуплексы раскручиваются в однонитевые siRNAs, которые действуют как «проводники», взаимодействуя на основе спаривания оснований с комплементарными последовательностями-мишенями. Они являются, следовательно, факторами специфичности и играют центральную роль во всех механизмах сайленсинга, опосредованных RNAi. На данный момент идентифицированы два родственных комплекса, включающие siRNA: RISC и RITS. В комплексе RISC (RNA-Induced Silencing Complex) siRNAs распознают nRNAs-«мишени» и инициируют их деградацию путем эндонуклеолитического расщепления в пределах участка nRNA, спаренного с siRNA (Hannon, 2002; Bartel, 2004). Этот первоначальный акт расщепления выполняет PHКаза-Н-домен белка семейства Argonaute/PIWI (субъединица RISC). В ядерном комплексе RITS (RNA-Induced Transcriptional Silencing), сходном с RISC, siRNAs «нацеливают» этот комплекс на хромосомные участки для модификации хроматина (Verdel et al., 2004; Buhler et al., 2006). Это и есть RITS-опосредованный РНК-путь — центральная тема этой главы. Рис. 8.1. Источники dsRNA, являющихся субстратом для образования siRNAs рибонуклеазой Dicer и триггером РНК-сайленсинга
(а) У S. pombe двунаправленную транскрипцию наблюдали в центромерных районах и районе cenH «молчащего» локуса типа спаривания. (б) Транскрипция инвертированных повторов, обнаруживаемых в клетках многих растений и животных, потенциально может производить dsRNA. (в) Транскрипция аберрантных РНК, которые могут не иметь соответствующих сигналов процессинга, может включать синтез dsRNA с помощью RdRPs
Рис. 8.1. Источники dsRNA, являющихся субстратом для образования siRNAs рибонуклеазой Dicer и триггером РНК-сайленсинга
(а) У S. pombe двунаправленную транскрипцию наблюдали в центромерных районах и районе cenH «молчащего» локуса типа спаривания. (б) Транскрипция инвертированных повторов, обнаруживаемых в клетках многих растений и животных, потенциально может производить dsRNA. (в) Транскрипция аберрантных РНК, которые могут не иметь соответствующих сигналов процессинга, может включать синтез dsRNA с помощью RdRPs
Для механизма РНК-сайленсинга дополнительного типа с участием микроРНК (miRNA) требуются ключевые белки Argonaute и Dicer. HYR, транскрибированная с эндогенных некодирующих генов и исходно образующая шпилечные РНК-структуры благодаря растянутым dsRNA-участкам, в несколько этапов процессируется в miRNA (Bartel, 2004; Filipowiicz et al., 2005). Подобно siRNAs, miRNAs имеют размеры 21—24 нуклеотида и образуют часть RISC через посредство белков Argonaute для «нацеливания» на специфические иРНК. Результатом этого «нацеливания» может быть расщепление посредством PIWI/RNaseH-домена и репрессия трансляции, включая взаимодействия с кэпом 7meG на 5’-конце иРНК. Это может сочетаться с секвестрированием иРНК в цитоплазматических РНК-процессирующих органеллах, известных как Р-тельца (Processing bodies). Таким образом, к образованию siRNA или miRNA приводят по крайней мере два разных пути процессинга dsRNA; тем не менее, эти РНК используют сходные средства для инактивации сходных иРНК. Путь miRNA отличается, поскольку все miRNAs производятся эндогенными некодирующими генами, которые в основном регулируются процессами развития и, в свою очередь, обычно «нацеливают» и регулируют в развитии сайленсинг гомологичных генов. Хотя dsRNAs могут образовываться путем отжига прямонаправленной и инверсной РНК, получающихся в результате двунаправленной транскрипции, или присутствуют в виде шпилечных структур, в некоторых клетках для RNAi требуется дополнительный энзим для образования dsRNA. Этот фермент — РНК-направляемая РНК-полимераза (RdRP), обнаруженная у растений и у С. elegans (Dalmay et al., 2000; Sijen et al., 2001). Он использует siRNAs в качестве праймеров для генерации большого количества dsRNA, которые затем могут процессироваться Dicer в дополнительные siRNA. Таким образом, считается, что первичная функция RdRP — амплификация RNAi-ответа, но, как мы обсудим позже, RdRP может играть и более специфическую роль в инициации синтеза dsRNA (раздел 5). Действительно, она, по-видимому, участвует в процессе, приспособленном для формирования лучшей защитной реакции хозяина в ответ на введение экзогенной dsRNA. Эта идея подкрепляется тем фактом, что RdRPs не являются участниками путей сайленсинга с помощью miRNA (Sijen et al., 2001). Интересно, что в геномах насекомых (в том числе Drosophila) и позвоночных (включая млекопитающих) отсутствуют распознаваемые RdRP-подобные последовательности, но остается возможность, что у этих организмов синтез dsRNA выполняют другие полимеразы. Какова же тогда функция этих разнообразных механизмов РНК-сайленсинга? Они весьма консервативны у широкого круга организмов, от дробянковых дрожжей и растений до человека, и они играют центральные роли в регуляции экспрессии генов и стабильности генома (через формирование стабильного гетерохроматина в центромерах и теломерах). Кроме того, эти механизмы сайленсинга принимают участие в защите против транспозонов и РНК-вирусов путем разрушения их РНК-транскриптов (Plasterk, 2002; Li and Ding, 2005). Наконец, транскрипция с некоторых транспозонов приводит к образованию аберрантных РНК, включающих RNAi с помощью механизма, конвертирующего, как полагают, аберрантные транскрипты в dsRNA с помощью RdRPs (рис. 8.1) (Baulcombe, 2004).
2. Ранние данные, позволяющие предполагать, что РНК является посредником в транскрипционном сайленсинге
Прежде чем обсуждать лучше изученные примеры модификаций хроматина, базирующихся на RNAi, у дробянковых дрожжей и Arabidopsis, мы кратко рассмотрим ранние эксперименты, предполагающие участие РНК как посредника в модификациях хроматина и ДНК. Самое раннее свидетельство роли РНК как промежуточного звена в TGS было получено в исследованиях вироидов растений. Вироид веретеновидности клубней у картофеля (PSTV—potato spindle tuber viroid) состоит из РНК-генома величиной 359 nt и реплицируется по механизму РНК-РНК. Введение PSTV в геном табака приводит к метилированию ДНК гомологичных ядерных последовательностей, хотя и трансгенных по происхождению (Wassenegger et al., 1994). Однако эти и интегрированные копии ДНК PSTV становятся метилированными только у растений, которые поддерживают транскрипцию вироидной РНК, что заставляет предполагать участие PHК-посредника, «направляющего» метилирование ДНК (Wassenegger et al., 1994). Далее, у Arabidopsis производство аберрантных транскриптов каким-то образом приводит к метилированию ДНК всех гомологичных промоторных участков и к транскрипционному сайленсингу генов (Mette et al., 1999). Этот факт, вместе с открытием, что репликация вирусных геномов у растений ведет к образованию малых РНК размером 22 нуклеотида, позволяет предполагать, что механизмы, родственные RNAi, опосредуют метилирование ДНК (Mette et al., 2000). Эти наблюдения, а также индуцированный повторами сайленсинг, вызываемый трансгенами, который впервые был обнаружен у петунии и у табака, сейчас широко признаны как самые ранние примеры сайленсинга с помощью RNAi (Napoli et al., 1990; обсуждается в главе 9). Дальнейшие доказательства связи между RNAi и TGS были получены на Drosophila в исследованиях сайленсинга генов, индуцируемого повторами (глава 5). Введение множественных тандемных копий трансгена приводит к сайленсингу как этого трансгена, так и эндогенных копий (Pal-Bhadra et al., 1999). Этот сайленсинг нуждается в хромосомном белке Polycomb, который также участвует в упаковке гомеотических регуляторных генов в подобные гетерохроматину структуры за пределами их собственных доменов действия (Francis and Kingston, 2001). Кроме того, для этого индуцируемого повторами сайленсинга генов требуется Piwi — свойственный Drosophila член семейства Argonaute, необходимый для RNAi (Pal-Bhadra et al., 2002). У Tetrahymena другой член белкового семейства Piwi, Twil, необходим для накопления малых PFIK и массивной элиминации ДНК, наблюдающейся в соматических ядрах простейших (глава 7). Эти и более поздние результаты, обсуждаемые в разделе 8. позволяют предполагать, что RNAi-путь участвует в сборке структур репрессивного хроматина у мух. Другие механизмы сайленсинга, индуцируемого повторами, описаны у нитчатых грибов; сюда относятся индуцируемые повторами точечные мутации (RIP — Repeat Induced Point mutation) у Neurospora crassa и npe-мейотически индуцируемое метилирование (MIP — Metylation Induced Pre-meiotically) у Ascobolus immer-sus, которые, по-видимому, осуществляются без участия РНК-посредника, поскольку они происходят независимо от транскрипционного состояния локуса (Galagan and Selker, 2004). Вместо этого в RIP и MIP участвуют спаренные локусы, где (например) две из трех копий гена сайленсированы, что заставляет предполагать какого-то рода механизм взаимодействия ДНК-ДНК, включающий гомологичные локусы для индукции сайленсинга. Напротив, для сайленсинга неспаренной ДНК в мейозе (MSUD — silencing of unpaired DNA in meiosis), который также происходит у Neurospora, требуется RNAi-путь (Shiu et al., 2001; обсуждается в главе 6); возможно, параллели MSUD имеются и у других организмов, в том числе С. elegans (Maine et al., 2005; глава 15).3. RNAi и сборка гетерохроматина у S. pombe
Хромосомы S. pombe содержат в центромерах и «молчащих» локусах типа спаривания (mat2/3) обширные участки гетерохроматиновой ДНК. ассоциированные с лежащими в их основе повторяющимися элементами ДНК (Grewal, 2000; Pidoux and Allshire, 2004). Каждая центромера дробянковых дрожжей содержит уникальный центральный коровый район (cnt), который фланкируется повторами двух типов, называемыми самыми внутренними (imr — innermost) и самыми внешними (otr — outermost) повторами (рис. 8.2). Район otr сам состоит из повторов dh и dg. Формирование гетерохроматина у S. pombe включает совместное действие ряда trans-действующих факторов Сюда входят деацетил азы гистонов (HDACs), Clr4, метилтрансфераза лизина 9 гистона H3 (HKMT) и белки, связывающиеся с H3K9-метилом гистона, Swi6 (гомолог НР1) и Chp1. Предполагается, что первоначальное рекрутирование Swi6 и Chp1 к хроматину приводит к распространению метилирования H3K9 и формированию гетерохроматина через последовательные циклы катализируемого Clr4 метилирования H3K9, сопряженного с опосредуемым Swi6 распространением на соседние нуклеосомы через его самоассоциацию (Grewal and Moazed, 2003). Мутация в компонентах пути RNAi приводит, как это ни удивительно, к утрате центромерного гетерохроматина и накоплению некодирующих «прямых» и «реверсных» транскриптов с двунаправленных промоторов в пределах каждого повтора dgwdh (рис. 8.2) (Volpe et al., 2002). У дробянковых дрожжей есть единственный ген для каждого из белков RNAi, Dicer, Argonaute и RdRP (idcrl+, agol+n rdpl+, соответственно). Удаление любого из этих генов приводит к утрате метилирования H3K9 гистонов, и мутанты обнаруживают дефекты в расхождении хромосом, которые обычно связаны с дефектами в сборке гетерохроматина (Provost et al., 2002; Volpe et al., 2003). Более того, секвенирование библиотеки малых РНК дробянковых дрожжей выявило РНК длиной ~22 нуклеотида, которые картировались исключительно в районах центромерных повторов и повторов рибосомной ДНК, позволяя предполагать, что сел PHК могут образовывать dsRNAs, которые процессируются в siRNA (Reinhart and Bartel, 2002. Таким образом, было высказано предположение, что путь RNAi может рекрутировать Swi6 и Clr4 к хроматину для того, чтобы инициировать и (или) поддерживать формирование гетерохроматина в каждом из вышеуказанных локусов (рис. 8.3) (Hall et al., 2002; Volpe et al., 2002). Рис. 8.2. Организация гетерохроматиновых районов хромосомы у S. pombe и A. thaliana
В качестве примера показана центромера хромосомы 1 S. pombe. Уникальный центральный коровый район (cntl) фланкирован «самыми внутренними» (imrL и imrR) и «самыми внешними» (otrL и otrR) повторами. Район otr транскрибируется в обоих направлениях, давая начало прямым (синий) и обратным (красный) транскриптам. Участок между генами mat2 и mat3 содержит домен, который гомологичен центромерным повторам dg и dh (cenH) и также транскрибируется в обоих направлениях. Aftl и Perl — это связывающиеся с ДНК белки, которые действуют параллельно с RNAi, обеспечивая сайленсинг типа спаривания. Центромеры Arabidopsis состоят из повторов длиной 180 п.о. (зеленый), перемежающихся с элементами типа ретротранспозонов (желтый). Показаны прямые транскрипты, инициирующиеся в пределах длинного терминального повтора (LTR), и обратные транскрипты, инициирующиеся в пределах повторов длиной 180 п.о.
Рис. 8.2. Организация гетерохроматиновых районов хромосомы у S. pombe и A. thaliana
В качестве примера показана центромера хромосомы 1 S. pombe. Уникальный центральный коровый район (cntl) фланкирован «самыми внутренними» (imrL и imrR) и «самыми внешними» (otrL и otrR) повторами. Район otr транскрибируется в обоих направлениях, давая начало прямым (синий) и обратным (красный) транскриптам. Участок между генами mat2 и mat3 содержит домен, который гомологичен центромерным повторам dg и dh (cenH) и также транскрибируется в обоих направлениях. Aftl и Perl — это связывающиеся с ДНК белки, которые действуют параллельно с RNAi, обеспечивая сайленсинг типа спаривания. Центромеры Arabidopsis состоят из повторов длиной 180 п.о. (зеленый), перемежающихся с элементами типа ретротранспозонов (желтый). Показаны прямые транскрипты, инициирующиеся в пределах длинного терминального повтора (LTR), и обратные транскрипты, инициирующиеся в пределах повторов длиной 180 п.о.
Интересно, что и механизм TGS, и мехнизм PTGS, по-видимому, вносят вклад в даун-регуляцию сел-РНК. Транскрипт с «прямой» нити в основном сайленсирован на транскрипционном уровне, как это видно на мутантах по RNAi (Volpe et al., 2002). Однако «обратная» нить транскриптов сел не затрагивается мутантами Swi6 (Volpe et al., 2002), и сайленсинг этого «обратного» cen-транскрипта происходит главным образом на посттранскрипционном уровне. RNAi играет также роль в сайленсировании локуса типа спаривания (mat2/3) (Hall et al., 2002). mat2/3 прерывается участком ДНК, который в высокой степени гомологичен центромерным повторам (называется cenH — cenHomology) (рис. 8.2). Подобно повторам сел, район cenH транскрибируется дивергентно, образуя «прямые» и «обратные» РНК (Noma et al., 2004). Эти транскрипты cenH у мутантов по RNAi накапливаются до высоких уровней. Напротив, RNAi не является необходимой для сайленсинга репортерного трансгена, вставленного в mat2/3, если сайленсинг не был сначала как-то нарушен. Причина этого различия в том, что частично избыточный механизм сайленсинга, включающий два связывающихся с ДНК белка, Perl и Atfl, которые связываются с mat2/3, рекрутирует гетерохроматиновую машинерию независимо от RNAi (Jia et al., 2004). Этого достаточно для сайленсирования репортерного гена в отсутствие RNAi, но недостаточно для предотвращения накопления некодирующих транскриптов cenH (рис. 8.2).
4. Малые РНК инициируют сборку гетерохроматина в связи с эффекторным комплексом RNAi
В связи с открытием, что путь RNAi участвует в формировании гетерохроматина у дробянковых дрожжей и в транскрипционном сайленсинге генов в других системах возник вопрос о том. каким образом этот путь может непосредственно регулировать структуру хроматина. Очистка Chp1, хромодоменного белка, являющегося структурным компонентом гетерохроматина, привела к идентификации комплекса RITS (Verdel et al., 2004). RITS, кроме Chp1, содержит белок Ago1, характерный для дробянковых дрожжей, и Tas3, белок с неизвестной функцией. Он также содержит центромерные siRNAs, которые создаются рибонуклеазой Dicer, и, что важно, RITS связывается с районами центромерных повторов зависимым от siRNA образом. Поэтому предположили, что RITS использует центромерные siRNAs для «нацеливания» на специфичные хромосомные районы для инактивации, и это обеспечивает прямую связь между RNAi и сборкой гетерохроматина (рис. 8.4). Рис. 8.3. Сборка гетерохроматина включает совместное действие модифицирующих гистоны энзимов (HDACs и Clr4) и связывающихся с гистонами белков (например, Swi6) и может направляться механизмом КТФш
Деацетилирование HDACs сопровождается рекрутированием Clr4 и метилированием H3K9 гистонов. Swi6 связывается с метилированными по H3K9 «хвостами» гистонов, и в результате последовательных циклов метилирования H3K9, сопряженных с олигомеризацией Swi6, происходит распространение гетерохроматина
Рис. 8.3. Сборка гетерохроматина включает совместное действие модифицирующих гистоны энзимов (HDACs и Clr4) и связывающихся с гистонами белков (например, Swi6) и может направляться механизмом КТФш
Деацетилирование HDACs сопровождается рекрутированием Clr4 и метилированием H3K9 гистонов. Swi6 связывается с метилированными по H3K9 «хвостами» гистонов, и в результате последовательных циклов метилирования H3K9, сопряженных с олигомеризацией Swi6, происходит распространение гетерохроматина
Подобно RISC, опосредующему PTGS, RITS использует siRNAs для прицельного распознавания. Однако в отличие от RISC RITS связывается с хроматином и инициирует формирование гетерохроматина в противоположность инактивации иРНК. Каким образом siRNAs могут «нацеливать» на определенные, специфичные хромосомные участки? Предложены два возможных механизма. Согласно первой модели, siRNAs, связанные с Ago1 в комплексе RITS, должны как-то соединяться с нераскрученной двойной спиралью ДНК за счет спаривания оснований. Во второй модели связанные с RITS siRNAs должны спариваться основаниями с некодирующими РНК-транскриптами в локусе-мишени (рис. 8.4) Согласно любой из этих моделей, в результате ассоциации RITS с хроматином посредством siRNAs рекрутируется HKMT Clr4 с последующим метилированием гистонов по H3K9. За этим следуют связывание Swi6 и распространение метилирования H3K9 и гетерохроматина. Однако для ассоциации RITS с хроматином требуется также Clr4, позволяя предполагать, что это обеспечивает метилированные H3K9, к которым может присоединяться комплекс RITS, стабилизируя тем самым свою связь с хроматином. Уже известно, что хромодомен Chp1 специфически связывается с метилированными остатками H3K9 (Partridge et al., 2002), а мутации в Clr4 или хромодомене Chp1, участвующие в этом взаимодействии, приводят к утрате связывания RITS с хроматином (Partridge et al., 2002; Noma et al., 2004). Более того, RITS может также связываться с доменами хроматина, покрытыми метилированным H3K9, через хромодомен Chp1 в mat2/3 и теломерных районах в отсутствие siRNAs (Noma et al., 2004; Petrie et al., 2005). Подводя итог, можно сказать, что комплекс RITS обнаруживает сродство с хроматином через связывание Chp1 с метилированными H3K9 и через спаривание оснований siRNA либо с ДНК, либо с транскриптами РНК. Недавно полученные данные являются сильным свидетельством в пользу роли RITS и siRNAs в инициации сборки гетерохроматина. Бюлер и соавторы (Buhler et al., 2006) использовали сайт-специфичный белок, связывающийся с РНК, чтобы искусственно привязать комплекс RITS к РНК-транскрипту активного в норме гена ura4+. Замечательно, что результатом такой привязки стала генерация siRNAs ura4+ и сайленсинг этого гена ura4+ по типу, требующему как RNAi, так и компоненты гетерохроматина. Кроме того, эта система позволяла прямо оценивать способность вновь возникших siRNAs инициировать метилирование H3K9 и связывание Swi6, которые являются молекулярными маркерами образования гетерохроматина. Интересно, что вновь образовавшиеся siRNAs ura4+ оказались под негативным контролем со стороны консервативной siRNA-рибонуклеазы, Eri1, которая ограничивает их тем локусом, с которого они были произведены. Однако, когда ген, кодирующий Eri1, делегируется, siRNAs ura4+ способны действовать в trans-конфигурации и сайленсировать вторую копию гена ura4+. вставленную в другую хромосому той же клетки. Этот эксперимент демонстрирует, следовательно, что siRNAs могут действовать как факторы специфичности, направляющие RITS и сборку гетерохроматина на прежде активный район генома.
 Рис. 8.4. RNAi и siRNA-направляемая сборка гетерохроматина у S. pombe
Для образования siRNA требуются и Dicer, и RDRC. Предполагается, что первоначальное «нацеливание» включает опосредованное RITS и siRNA распознавание похожих транскриптов. Связывание RITS стабилизируется связыванием хромодомена Chp1 с метилированным по H3K9 гистоном. Рекрутирование Clr4 и Swi6 опосредует распространение метилирования по H3K9
Рис. 8.4. RNAi и siRNA-направляемая сборка гетерохроматина у S. pombe
Для образования siRNA требуются и Dicer, и RDRC. Предполагается, что первоначальное «нацеливание» включает опосредованное RITS и siRNA распознавание похожих транскриптов. Связывание RITS стабилизируется связыванием хромодомена Chp1 с метилированным по H3K9 гистоном. Рекрутирование Clr4 и Swi6 опосредует распространение метилирования по H3K9
Способность siRNAs инициировать сайленсинг у S. pombe была также исследована другим методом, базирующимся на экспрессии шпилечной РНК для производства siRNAs, гомологичных трансгену GFP (Sigova et al., 2004). В этой системе шпилечные siRNAs стимулировали сайленсинг репортерного гена GFP на уровне PTGS, но не TGS (Sigova et al., 2004). Неясно, почему эти шпилечные siRNAs не могут индуцировать TGS и сборку гетерохроматина в хромосомной копии GFP Одно из возможных объяснений заключается в том, что гетерохроматин собирается в специфических субнуклеарных местах, а сборка вне этих мест происходит неэффективно (Gasser et al., 2004; Глава 4).
5. Синтез dsRNA и образование siRNA
Двунаправленная транскрипция центромерных ДНК-повторов в принципе могла бы обеспечить первоначальный источник dsRNA у дробянковых дрожжей (\blpe et al., 2002). dsRNA, получающиеся в результате отжига «прямых» и «обратных» транскриптов, могли бы затем стать субстратом для рибонуклеазы Dicer. Однако РНК-направляемая PHК-полимераза (Rdpl) и связанные с нею кофакторы, а также HKMT Clr4, также необходимы для производства siRNA рибонуклеазой Dicer (Hong et al., 2005; Li et al., 2005; Buhler et al., 2006). Эти наблюдения показывают, что образование гетерохроматиновых siRNAs рибонуклеазой Dicer сопряжено с событиями, зависящими от хроматина и Rdpl (рис. 8.4). Фермент Rdpl находится в мультипротеиновом комплексе, который содержит также Hrrl, РНК-геликазу, и Cidl2, члена [3-семейства ДНК-полимераз, включающего поли(А)полимеразные ферменты (Motamedi et al., 2004). Этот комплекс был назван комплексом РНК-направляемой РНК-полимеразы (RDRC — RNA-direct-ed RNA polymerase complex), и для формирования гетерохроматина в районах центромерной ДНК требуются все его субъединицы (Motamedi et al., 2004). Как ожидалось, на основании присутствия Rdpl RDRC обладает активностью PHК-направляемой РНК-полимеразы in vitro, и мутации, устраняющие эту активность, устраняют и зависимый от RNAi сайленсинг in vivo (Motamedi et al., 2004; Sugiyama et al., 2005). Активность RDRC, обусловливающая синтез РНК in vitro, не требует siRNA-праймера (Motamedi et al., 2004). RITS может, следовательно, обеспечить in vivo специфичность путем рекрутирования RDRC к выбранным РНК-матрицам посредством siRNA. В согласии с этой гипотезой, субъединицы RDRC необходимы для генерации siRNA, а комплексы RITS, изолированные из клеток, не имеющих ни одной субъединицы RDRC, лишены siRNAs (Motamedi et al., 2004; Li et al., 2005; Sugiyama et al., 2005; Buhler et al., 2006). Присутствие Cidl2 в RDRC интригует и ставит вопрос о возможности участия еще одной полимеразной активности в связанном с хромосомой РНК-сайленсинге. Поскольку некоторые члены этого семейства обладают активностью пол и (А) полимеразы, одна из возможностей заключается в том, что аденилирование dsRNA, произведенной Rdpl, может иметь важное значение для их дальнейшего гтроиессталтъ. Интересно, что Cid 12-подобные белки консервативны у всех эукариот (табл. 8.1); результатом мутаций в Rde-З, характерном для С. elegans члене этого семейства, является дефектная RNAi (Chen et al., 2005), что подтверждает консервативную роль этих ферментов в RNAi-пути. Имеются данные по синтезу и процессингу dsRNA, связанному с образованием гетерохроматиновых siRNAs, происходящим на хромосоме, в сайтах транскрипции некодирующих центромерные РНК (рис. 8.4). Среди них, во-первых, данные о том, что Rdpl может быть присоединена поперечными сшивками к центромерным ДНК-повторам (Volpe et al., 2002; Sugiyama et al., 2005) и к «прямым» и «обратным» РНК-транскриптам, происходящим из этих районов (Motamedi et al., 2004). Как и в случае поперечных сшивок с ДНК, присоединение поперечными сшивками к центромерным РНК требует участия Dicer и Clr4 и, следовательно, является зависимым от siRNA и хроматина. Во-вторых, для производства siRNA требуются компоненты хроматина, в том числе Clr4, Swi6 и РВФС Sir2 (Hong et al., 2005; Li et al., 2005; Buhler et al., 2006). Наконец, ассоциация RDRC с RITS зависит от siRNAs, а также от Clr4, что заставляет предполагать, что она происходит на хроматине (Motamedi et al., 2004). Таким образом, образование dsRNA и. siRNA гетерохроматина может включать рекрутирование RDRC к связанным с хроматином вновь синтезирующимся пре-иРНК-транс криптам, как это показано на рис. 8.5 (Martienssen et al., 2005; Verdel and Moazed, 2005). Тот факт, что транскрипция и образование siRNA происходят, вероятно, одновременно, усиливает различие между механизмами РНК-сайленсинга, опосредующими модификации хроматина, и PTGS. Однако маловероятно, чтобы это различие было абсолютным. Например, у С. elegans мутации в нескольких компонентах хроматина, подобные мутациям у S. pombe, приводят к дефектам в RNAi и индуцируемом транспозонами РНК-сайленсинге (см. табл. 8.1) (Sijen and Plasterk, 2003; Grishok et al., 2005; Kim et al., 2005), и возникает возможность, что в некоторых случаях синтез и процессинг dsRNA могут происходить на хромосоме независимо от того, происходит ли сайленсинг на уровне TGS или же PTGS.6. Модели распознавания РНК-РНК versus РНК-ДНК
Крайне важным вопросом при разработке роли RNAi в сборке гетерохроматина является вопрос о том, связывается ли RITS/RDRC с ДНК или же с вновь образующейся РНК. Наблюдение, что компоненты механизмаТаблица 8.1. Консерватизм RNAi и белков гетерохроматина [перевод]
 а Очевидный ортолог хромодоменного белка, Chp1, не был идентифицирован у других модельных организмов, перечисленных здесь, но большинство эукариотических клеток содержит множественные хромодоменные белки. СЬЕЗ у Arabidopsis является хромодоменной ДНК-метилтрансферазой, которая работает в том же пути, что и AG04, и может быть аналогичной Chp1.
6 Никакие очевидные ортологи Tas3 не были идентифицированы, но имеет место слабое сходство по аминокислотной последовательности с белком, специфичным для яичника и семенника мыши (NP 035152).
в Cid 12 относится к большому семейству консервативных белков, имеющих сходство по аминокислотной последовательности с классической поли(А)полимеразой, а также с 2’-5’-олигоаденилатными энзимами.
г С. elegans обладает примерно 20 доменными белками SET, но H3K9 HKMT не была еще идентифицирована у этого организма. д S. pombe содержит другой Rikl-подобный белок, Ddbl, который участвует в репарации повреждений ДНК, но неизвестно, участвует ли он и в формировании гетерохроматина.
а Очевидный ортолог хромодоменного белка, Chp1, не был идентифицирован у других модельных организмов, перечисленных здесь, но большинство эукариотических клеток содержит множественные хромодоменные белки. СЬЕЗ у Arabidopsis является хромодоменной ДНК-метилтрансферазой, которая работает в том же пути, что и AG04, и может быть аналогичной Chp1.
6 Никакие очевидные ортологи Tas3 не были идентифицированы, но имеет место слабое сходство по аминокислотной последовательности с белком, специфичным для яичника и семенника мыши (NP 035152).
в Cid 12 относится к большому семейству консервативных белков, имеющих сходство по аминокислотной последовательности с классической поли(А)полимеразой, а также с 2’-5’-олигоаденилатными энзимами.
г С. elegans обладает примерно 20 доменными белками SET, но H3K9 HKMT не была еще идентифицирована у этого организма. д S. pombe содержит другой Rikl-подобный белок, Ddbl, который участвует в репарации повреждений ДНК, но неизвестно, участвует ли он и в формировании гетерохроматина.
RNAi, связывающиеся с транскриптом гена, могут индуцировать зависимый от хроматина сайленсинг генов в cis-положении, ясно демонстрирует, что этот процесс может стимулироваться посредством первоначальных взаимодействий с вновь синтезируемыми РНК-транскриптами (Buhler et al., 2006). Важно, что m-ограничение исключает возможность того, что начальные события синтеза dsRNA и образование siRNA происходят на зрелых транскриптах, где hRNA, полученные с разных аллелей, нельзя различить. Более того, модель РНК-РНК-взаимодействия прямо предсказывает, что для сборки гетерохроматина, опосредованной RNAi, должна быть необходимой транскрипция в локусе-мишени. Хотя эта потребность в транскрипции и не была непосредственно проверена, мутации в двух разных субъединицах РНК-полимеразы II (RNA pol II), обозначаемых Rpb2 и Rpb7, характеризуются специфическими дефектами в образовании siRNA и сборке гетерохроматина, но не в общей транскрипции (Djupedal et al., 2005; Kato et al., 2005). Это заставляет вспомнить мутанты Rbpl, которые характеризовались дефектами в модификациях гистонов (т.е. метилировании H3K4 и убиквитинировании Н2В), сопряженными с элонгацией при транскрипции (Hampsey and Reinberg, 2003), и создает прецедент для предположения о том, что опосредованное RNAi метилирование по H3K9 и формирование гетерохроматина могли бы быть сопряжены с транскрипционной элонгацией через ассоциацию комплексов RNAi с РНК-полимеразой II. В действительности, в противоположность широко принятому мнению о том, что гетерохроматин является недоступной структурой, подавляющей транскрипцию, опосредованная RNAi сборка гетерохроматина очень мало влияет или вовсе не влияет на ассоциацию РНК-полимеразы II с центромерными повторами у S. pombe (Volpe et al., 2002; Djupedal et al., 2005; Kato et al., 2005; Buhler etal., 2006). Следовательно, вновь синтезируемые РНК-транскрипты, действующие как матрицы для RITS в модели РНК-РНК-распознавания, присутствуют в гетерохроматиновых доменах (рис. 8.4). В пользу модели РНК-РНК-«нацеливания» говорит также наблюдение, что компоненты комплексов как RITS, так и RDRC могут быть локализованы в некодирующих центромерных РНК в экспериментах по поперечным сшивкам in vivo (Motamedi et al., 2004). Эта локализация зависит от siRNA, что позволяет предположить участие в ней взаимодействий с некодирующей РНК на основе спаривания оснований. Кроме того, она требует HKMT Clr4, что позволяет предполагать, что она сопряжена со связыванием RITS с метилированными H3K9 и происходит на хроматине. Тем не менее, нельзя исключить, что siRNAs могут также распознавать ДНК непосредственно, на основе взаимодействий, базирующихся на спаривании оснований. Например, у растений siRNAs, комплементарные к промоторным районам, которые (предположительно) не транскрибируются, все еще могут направлять метилирование ДНК, которое является еще одной модификацией, происходящей в ходе формирования гетерохроматина в этих районах (глава 9).
7. Как RNAi рекрутирует энзимы, модифицирующие хроматин?
Рекрутирование Clr4 и Swi6 является ключевым этапом в инициации метилирования по H3K9 и сборки гетерохроматина в модели авторегуляторной модификации-связывания (рис. 8.3 и 8.4) (Grewal and Moazed, 2003). Однако, поскольку связь RITS с хроматином и катализируемое Clr4 метилирование гистонов по H3K9 являются взаимозависимыми процессами, оказалось трудным определить событие, обеспечивающее первоначальное переключение зависимой от RNAi сборкой гетрохроматина. Одно из решений этой проблемы «курицы и яйца» заключается в том, что первоначальный сигнал для сборки гетерохроматина мог бы быть обеспечен зависимыми от siRNA взаимодействиями на основе спаривания оснований (рис. 8.4). В соответствии с этой гипотезой генерация de novo ura4+ siRNAs стимулирует сайленсинг прежде активной копии гена ura4\ сопряженный с рекрутированием RITS и Swi6 к хроматину (Buhler et al., 2006). Исходное связывание RITS может, однако, быть преходящим и трудным для регистрации; стабильное связывание RITS с хроматином требовало бы двойных взаимодействий между (1) связанными с RITS siRNAs и вновь синтезируемым транскриптом и (2) связыванием хромодомена Chp1 с метилированными H3K9 В этой модели сам RITS непосредственно рекрутирует Clr4. Альтернативная возможность заключается в том, что Clr4 может рекрутироваться по параллельному пути с участием одного или нескольких белков, связывающихся с ДНК, как это имеет место в районе «молчащего» типа спаривания и в теломерных районах (Jia et al., 2004$ Kanoh et al., 2005). В любом сценарии опосредованное Clr4 метилирование H3K9 было бы необходимо для стабилизации связи RITS с хроматином, что затем ведет к рекрутированию RDRC, синтезу dsRNA и образованию siRNA (рис. 8.5). Рис. 8.5. Модель котранскрипционного образования dsRNA и siRNA и рекрутирование комплекса Clr4-Rik1-Сиl4-метилтрансферазы гистонов у S. pombe
Рис. 8.5. Модель котранскрипционного образования dsRNA и siRNA и рекрутирование комплекса Clr4-Rik1-Сиl4-метилтрансферазы гистонов у S. pombe
Недавно обнаружили, что Clr4 является компонентом мультипротеинового комплекса, который содержит белок Rikl гетерохроматина. Cullin E3-убиквитинлигазу и несколько других белков (Hong et al., 2005; Horn et al., 2005; Jia et al. 2005; Li et al., 2005). Далее эти ассоциированные с Clr4 белки усиливают связь между РНК и формированием гетерохроматина. Белок Rikl является членом большого семейства белков типа р propeller WD repeat, участие которых в связывании с РНК или ДНК предполагалось. Среди членов этого белкового семейства — фактор CPSF-A (Cleavage Polyadenylation Specificity Factor А), участвующий в сплайсинге пре-иРНК, и белок Ddbl (DN A damage binding 1), участвующий в связывании с поврежденной УФ ДНК. Особый интерес представляет CPSF-A, поскольку Rikl сходен по последовательности со своим предполагаемым связывающимся с РНК доменом, участвующим в распознавании последовательностей полиаденилирования иРНК (Barabino et al., 2000). Белок Ddbl, подобно белку Rikl, является компонентом комплекса Си14-Е3-убиквитинлигазы и участвует в распознавании и репарации ДНК, поврежденной УФ (Higa et al., 2003; Zhong et al., 2003). Весьма интригующая возможность заключается в том, что Rikl действует похожим на действие CPSF-A и Ddbl образом, связываясь во время сборки гетерохроматина с продуктом, произведенным RNAi (рис. 8.5).
8. Модификации хроматина и ДНК у Arabidopsis, опосредованные RNAi
Механизм, посредством которого RNAi направляет модификации гетерохроматина у растений, сходен с таковым у дробянковых дрожжей, хотя имеются и многочисленные отличия. Наиболее важное отличие заключается в том, что у растений метилированная ДНК имеется во многих репрессивных районах гетерохроматина: в этом отношении они напоминают позвоночных, но отличаются от червей и Drosophila (Lippman and Martienssen, 2004). Четыре цикла генетического скрининга, направленного на отбор мутантов с ослабленным TGS, опосредованным РНК, выявили мутантов по HKMTs, специфичным к H3K9, и по компонентам RNAi, но они также вскрыли необходимую функцию ДНК-метилтрансфераз, SWI/ SNF-комплексов ремоделинга и новую РНК-полимеразу (Baulcombe, 2004). Этот скрининг детально описан в главе 9, но здесь мы кратко сравним этот механизм у дробянковых дрожжей и у растений. Для каждого скрининга на мутанты сайленсинга использовались инвертированные повторы, введенные в trans-конфигурации, чтобы индуцировать сайленсинг эндогенных или трансгенных репортерных генов. Ослабление сайленсинга указывает на мутацию, возникшую в некоем необходимом компоненте пути, ведущем к сайленсингу. Использованными при этом эндогенными генами были PAI2 (участвует в биосинтезе аминокислот) (Mathieu and Bender, 2004) и SUPERMAN (транскрипционный фактор, регулирующий развитие цветка) (Chan et al., 2004), и эти репортерные гены управлялись либо сильным вирусным промотором, либо сильным промотором, специфичным для семени (Matzke et al., 2004). В каждом случае промотор был мишенью для сайленсинга, в некоторых случаях вместе с остальной частью данного гена. Ряд генов, найденных в результате этих экспериментов по скринингу, проиллюстрирован на рис. 8.6 (см. также табл. 9.1). Был идентифицирован лишь один мутант по RNAi (в одном из циклов скрининга), и это был ген AG04 (аргонавт). Однако в трех циклах скрининга были обнаружены мутанты по ДНК-метилтрансферазам, в том числе МЕТ1 и СМЕТЗ. Третья ДНК-метилтрансфераза, родственная DNMT3 млекопитающих, была идентифицирована методом обратной генетики, поскольку эта активность кодируется DRM1 и DRM2, двумя избыточными генами, которые невозможно определить в ходе скрининга одиночных мутантов (глава 9). И в самом деле, избыточность может объяснить невозможность обнаружить дополнительне компоненты аппарата RNAi: например, хотя DCL3 (DICER-LIKE 3) и RNA-DEPENDENT RNA POLYMERASE 2 (RDRP) преимущественно требуются для производства siRNA размером 24 нуклеотида, ассоциированной с транспозонами и повторами, по меньшей мере два других гена DCL у Arabidopsis могут в некоторой степени замещать DCL3 (Gasciolli et al., 2005). Среди других мутантов, обнаруженных при скрининге РА 12, были мутанты по гену KYP/SUVH4 (гену H3K9-метилтрансферазы) и содержащему хромодомен гену СМТЗ (гену ДНК-метилтрансферазы). Параллели с дробянковыми дрожжами в этом случае поражают, поскольку комплекс RITS содержит как белок Argonaute, так и хромодоменный белок Chp1, который для своей ассоциации с хромосомой зависит от метилирования H3K9. Однако, в отличие от дробянковых дрожжей, у Arabidopsis утрата СМТЗ или H3K9me2 не приводит к потере siRNA (Lippman et al., 2003), и еще неясно, формируют ли эти белки комплекс с AG04. У Arabidopsis имеются, однако, несколько других HKMTs, специфичных к H3K9; по крайней мере три из них обладают генетической функцией, так что и здесь избыточность может частично объяснять ситуацию (Ebbs et al., 2005) Рис. 8.6. Белки RNAi и хроматина, необходимые для метилирования ДНК и гистонов, опосредованного RNAi, у Arabidopsis
Синтез dsRNA с повторяющихся элементов ДНК обеспечивает субстрат для опосредованного Dicer расщепления и производства siRNA (DCL3 и другие белки типа Dicer). Направляемые РНК РНК-полимеразы (RdRp, RdR2) и РНК-полимераза IV (RNA Pol IV) могут непосредственно участвовать в синтезе dsRNA или ее амплификации. siRNAs затем грузятся на белки Argonaute (напр., AG04), что, вероятно, в ассоциации с другими факторами помогает «нацелить» похожие повторяющиеся последовательности для метилирования ДНК и H3K9
Рис. 8.6. Белки RNAi и хроматина, необходимые для метилирования ДНК и гистонов, опосредованного RNAi, у Arabidopsis
Синтез dsRNA с повторяющихся элементов ДНК обеспечивает субстрат для опосредованного Dicer расщепления и производства siRNA (DCL3 и другие белки типа Dicer). Направляемые РНК РНК-полимеразы (RdRp, RdR2) и РНК-полимераза IV (RNA Pol IV) могут непосредственно участвовать в синтезе dsRNA или ее амплификации. siRNAs затем грузятся на белки Argonaute (напр., AG04), что, вероятно, в ассоциации с другими факторами помогает «нацелить» похожие повторяющиеся последовательности для метилирования ДНК и H3K9
Мутанты по другим ДНК-метил трансферазам, МЕТ1 и DRM1/2, в противоположность мутантам по СМТЗ, приводят к утрате накопления siRNA, по крайней мере, с некоей подгруппы транспозонов и с тандемных повторов, которые обычно продуцируют siRNA, если они транскрибируются (Martienssen, 2003). В этих случаях утрата siRNA скоррелирована с потерей H3K9me2 (Cao et al., 2003; Lippman et al., 2003). Мутанты по AT-Фазе DDM1 (decreased DNA methylation) SWI2/SNF2-ремоделинга хроматина также ликвидируют накопление siRNA и H3K9me2 с большой группы транспозонов, хотя в тех случаях, когда siRNA сохраняется, сохраняется и H3K9me2 (Lippman et al., 2003). Возможно поэтому, что siRNA у растений связана с хромосомой через метилированную ДНК вместо связывания (или в дополнение к связыванию) через метилированные гистоны. как это имеет место у S. pombe (рис. 8.7). DDM1 обладает сильно выраженной специфичностью к транспозонам и повторам и должна как-то распознавать их как последовательности, отличные от генов. siRNA, возможно связанная с хромосомой с помощью метил-связывающих белков, могла бы обладать необходимой специфичностью для такого разграничения. В соответствии с этой идеей, транспозоны и повторы у Arabidopsis являются основным источником siRNA размером 24 нуклеотида и некоторых siRNA размером 21 нуклеотид (Lippman et al., 2004). Центромерные сателлитные повторы, расположенные в виде десятков тысяч тандемных копий по обе стороны каждой центромеры, также транскрибируются И процессируются RNAi (рис. 8.6). Этот процессинг зависит от DCL3, RDR2 и DDM1. Сайленсинг также зависит от H3K9me2 и СМТЗ. Однако сайленсинг здесь более сложный, чем у дробянковых дрожжей, поскольку ретротранспозонные вставки в эти повторы могут сайленсировать их, а это зависит от других механизмов с участием МЕТ1, DDM1 и деацетилазы гистонов HDA6 (May et al., 2005). Как упоминалось выше, у дробянковых дрожжей субъединицы РНК-полимеразы II (RNA Pol II) необходимы для сайленсинга и производства siRNA, что говорит в пользу идеи, согласно которой аппарат RNAi и модификации хроматина рекрутируется к хромосомам с помощью вновь синтезируемых транскриптов (рис. 8.5). У Arabidopsis две субъединицы новой РНК-полимеразы (RNApol IV) были обнаружены в ходе одного из четырех выше упоминавшихся скринингов (Kanno et al., 2005), но сначала были изолированы как слабые мутанты по PTGS, наряду с мутантами по РНК-зависимой РНК-полимеразе (Herr et al., 2005). Пока еще не известно, какая матрица используется RNA pol IV, но предположили (Vaughn and Martienssen, 2005), что это могут быть и метилированная ДНК (Onodera et al., 2005), и двунитевая РНК. Только самые крупные субъединицы уникальны для RNA pol IV, которая, как предполагается, использует тот же набор малых субъединиц, что и RNA pol II Дополнительные SWI2/SNF2-peмoдeлepы хроматина, которые также были обнаружены в ходе этих опытов по скринингу, могут изменять локальную структуру хроматина и облегчать процессивность RNA pol IV (Kanno et al., 2004). Сходную роль можно предположить для DDM1, хотя потребность для DDM1 (которая также является ремоделером хроматина) в сайленсирующих гранспозонах гораздо более жесткая, чем у RNA pol IV или других белков SWI2/SNF2.
 Рис. 8.7. Гипотетические модели относительно роли RNA pol IVв метилировании ДНК и (или) гистона H3, направляемом RNAi
(a) RNA pol IV транскрибирует метилированную ДНК; КвК2 синтезирует dsRNA, используя продукт, производимый RNA pol IV. Затем siRNAs «направляют» метилтрансферазный комплекс к хромосоме. (б) RNA pol IV использует матрицу dsRNA, синтезированную RdR2, для производства большего количества матриц ssRNA
Рис. 8.7. Гипотетические модели относительно роли RNA pol IVв метилировании ДНК и (или) гистона H3, направляемом RNAi
(a) RNA pol IV транскрибирует метилированную ДНК; КвК2 синтезирует dsRNA, используя продукт, производимый RNA pol IV. Затем siRNAs «направляют» метилтрансферазный комплекс к хромосоме. (б) RNA pol IV использует матрицу dsRNA, синтезированную RdR2, для производства большего количества матриц ssRNA
Гены могут быть эпигенетически сайленсированы близлежащими транспозонами; важным примером этого у Arabidopsis является импринтированный гомеобоксный ген FWA (Kinoshita et al., 2004). Первые два экзона этого гена являются некодирующими и образуют тандемный повтор благодаря древней вставке элемента SINE в этот сайт (Lippman et al., 2004). У мутантов по met1 (т.е. ДНК-метилтрансферазе) siRNAs, синтезированные с элемента SINE, утрачены, и этот ген в меристеме соцветия обнаруживает сильную ап-регуляцию, что приводит к позднему цветению. Такой фенотип не наблюдается у мутантов по RNAi, даже тогда, когда siRNA утрачены. Вместо этого RNAi может играть роль в инициации сайленсинга FWA, потому что трансгены FWA быстро сайленсируются, когда впервые вводятся в растение, и этот сайленсинг зависит от DCL3, RDR2 и AG04 (Chan et al., 2004). Сайленсинг мог бы затем поддерживаться метилированием ДНК, регулируемым МЕТ1. Подобным же образом аллели FWA, характеризующиеся поздним цветением, стабильно наследуются в бэккроссах после удаления с фона мутантов met1 или ddml, поскольку поддержание эпиаллелей является наследуемым (Soppe etal., 2000). Наконец, возможно, что при некоторых обстоятельствах miRNA могут направлять метилирование ДНК генов. У Arabidopsis miRNA 165 и 166 делают иРНК с гена PHABULOSA мишенью для расщепления, и сам этот ген метилируется «вниз по течению» от участка, который соответствует miRNA по последовательности. Интересно, что это соответствие распространяется на место присоединения экзона, так что сплайсированная РНК должна взаимодействовать с miRNA, если она «направляет» метилирование (Bao et al., 2004). Однако другие члены того же семейства генов не метилируются таким образом, как и большинство других генов, являющихся «мишенями» для miRNA (Martienssen et al., 2004; Ronemus and Martienssen, 2005). Наоборот, метилируются несколько других генов в геноме Arabidopsis, обычно на их 3’-конце, с помощью механизма, для которого нужен МЕТ1, но не нужен DDM1 (Lippman et al., 2004; Tran et al., 2005). Остается посмотреть, участвует ли в этих случаях РНК.
9. Консерватизм модификаций хроматина, опосредованных RNAi, у животных
Возможно, наиболее всесторонне изученные примеры эпигенетического сайленсинга мы находим у животных, в том числе у Drosophila и С. elegans, а также у мыши. Роль РНК и РНК-интерференции в транскрипционном сайленсинге и модификациях гетерохроматина оказывается консервативной у некоторых модельных животных, как и у протистов и растений. У Drosophila и PIW1, и Aubergine (Sting), гомолог Argonaute класса PIWI, необходимы для эпигенетического и гетерохроматинового сайленсинга (глава 5). Ретротранспозоны Gypsy являются «мишенью» сайленсинга в клетках фолликулов яичника и женских гонадах со стороны самого PIWI (Sarot et al., 2004). Это опосредуется гетерохроматиновым геном Flamenco (со всё еще не известной функцией) и требует 5 UTR полипротеинового гена Gypsy Выявление малых РНК размером 25—27 нуклеотидов из этого района заставляет предполагать, что это происходит с помошыо механизма, опосредуемого RNAi. ДНК-транспозоны типа «cut-and-paste» также подвержены влиянию RNAi Например, некоторые теломерные P-элементы (один из типов ДНК-транспозонов) могут супрессировать перемещение в другое место в геноме, когда они унаследованы через женский зародышевый путь, давая в результате сильно репрессивный «цитотип». Эта репрессия полностью зависит от гомолога PIWI, Aubergine, а также от гомолога Swi6, НР1 (Reiss et al., 2004). Однако не все Р-репрессивные цитотипы — например, цитотипы, опосредуемые другими, не теломерными Р-элементами, — зависят от Aubergine или НР1. У Drosophila несцепленные трансгены сайленсируются посттранскрипционно, если они присутствуют во многих копиях (Pal-Bhadra et al., 1997, 2002). Сайленсинг связан с большими количествами siRNa размером 21 нуклеотид и зависит от PIWI. Трансгенные слияния могут тоже сайленсировать друг друга транскрипционно, способом, требующим хроматиновый репрессор Polycomb. Этот сайленсинг не связан с повышенными уровнями siRNA из транскрипта трансгена, но (в основном) зависит от PIWI. Участие Polycomb в этом примере зависимого от PIWI сайленсинга и НР1 в других примерах указывает на путь RNAi и метилирование гистонов в процессе сайленсирования. У Drosophila тандемные порядки трансгенов также обнаруживают эффект положения мозаичного типа, и эта мозаичность сильно подавляется мутантами по HP 1, а также по piwi, aubergine и предполагаемой РНК-геликазе Spindle-Е (hornless) (Pal-Bhadra et al. 2004). Трансгены, вставленные в центрический гетерохроматин, также испытывают влияние, и в клетках, мутантных по Spindle-E, уровни H3K9me2 гетерохроматина снижены. Эти наблюдения убедительно свидетельствуют в пользу роли как белков хроматина, так и компонентов RNAi-пути в сайленсинге генов, находящихся в гетерохроматине Drosophila. В мужском зародышевом пути Drosophila гетерохроматиновые повторы Supressor of Stellate (Su(ste)), локализующиеся на Y-хромосоме, транскрибируются во время развития сперматоцитов сначала на антисмысловой нити, а затем на обеих нитях, возможно, после вставки близлежащего транспозона (Aravin et al., 2001). Эти ядерные транскрипты требуются, чтобы сайленсировать смысловые транскрипты близкородственного гена Stellate. сцепленного с X, сверхэкспрессия которого приводит к дефектам в сперматогенезе. Хотя здесь участвуют гетерохроматиновые последовательности, сайленсинг в этом случае является, по-видимому, посттранскрипционным, связан с siRNA размером 25—27 нуклеотидов и зависит как от Aubergine, так и от Spindle-E. У С. elegans были опубликованы примеры TGS в соматических клетках. Это зависит от генов RNAi-пути rde-1, dcr-1, rde-4 и rtf-1, а также от гомологов НР1 и аппарата модификации гистонов (Grishok et al.. 2005). Соматический гетерохроматин не очень широко распространен у С. elegans, но в зародышевом пути описан пример естественно происходящего зависимого от RNAi гетерохроматинового сайленсинга (Sijen and Plasterk, 2003). Во время мейоза неспаренные последовательности. такие как Х-хромосома у самцов, сайленсируются посредством H3K9me2, и этот сайленсинг зависит от РНК-зависимой РНК-полимеразы (Maine et al., 2005; глава 15), что напоминает о мейотическом сайленсинге неспаренной ДНК (MSUD) у Neurospora (см. Shiu et al., 2001; глава 6). Однако другие компоненты аппарата RNAi не связывали с этим процессом и неизвестно, связано ли это механистически [mechanistically] с опосредованной RNAi сборкой гетерохроматина у дробянковых дрожжей. Наконец, как и у Drosophila, у клеток млекопитающих нет генов, родственных генам РНК-зависимых РНК-полимераз, найденных у растений, червей и грибов. Тем не менее, участие антисмысловой РНК предполагалось в большинстве лучше всего изученных эпигенетических явлений — импринтинге и инактивации Х-хромосомы (главы 19 и 17, соответственно). В случае инактивации Х-хромосомы сплайсированная и полиаденилированная некодирующая РНК размером 17 тыс. о., известная как Xist, необходима для сайленсирования неактивной Х-хромосомы, с которой она экспрессируется. Напротив, на активной Х-хромосоме сайленсирована сама Xist; этот процесс отчасти зависит от антисмысловой РНК Tsix. Сайленсинг сопровождается модификацией гистонов, ассоциированных с участками хроматина «вверх по течению», которые маркированы H3K9me2 и H3K27me3 (глава 17). Сайленсинг других импринтированных локусов у мышей, в том числе Igf2r и района Dlk1-Gtl2, также поддерживается антисмысловыми транскриптами с отцовской или материнской аллели, соответственно. В случае Dlk1-Gtl2 эта некодирующая РНК специфически процессируется в miRNA, «нацеливающую» антисмысловой транскрипт с отцовской аллели, кодирующей ретротранспозон класса sushi (gypsy) (Davis et al., 2005). Хотя видны многочисленные параллели с «прямой» и «обратной» транскрипцией с гетерохроматиновых повторов у S. pombe, роль самой RNAi в импринтинге и инактивации Х-хромосомы до сих пор оказывалась неуловимой. Тем не менее, введение siRNA в клетки раковых линий могло приводить к тому, что хроматин оказывался маркированным H3K9me2 в гомологичных промоторах (Ting et al., 2005). В некоторых случаях это могло приводить и к метилированию ДНК (Morris et al., 2004), опосредованному, возможно, прямым связыванием малых РНК с ДНК-метилтрансферазами и белками, связанными с метилированием ДНК (Jeffery and Nakielny, 2004). Наконец, клеточные линии позвоночных, нокаутных по Dicer, демонстрировали дефекты расхождения хромосом (напоминающие те, которые были обнаружены у мутантов дробянковых дрожжей), сопровождаемые изменениями в морфологии гетерохроматина, в экспрессии сателлитных повторов и нарушениями в локализации когезина (Fukagawa et al., 2004; Kanellopoulou et al., 2005).10. Заключительные замечания
Предположение, что гены могут регулироваться молекулами малых РНК. было высказано более 40 лет тому назад (Jacob and Monod, 1961), так же как и представление о том, что «контрольная РНК» может иметь отношение к повторам (Britten and Davidson, 1969). Со времени идентификации репрессоров лямбда и lac как сайт-специфичных связывающихся с ДНК белков у Escherichia coli и инфекционного бактериофага lambda (Gilbert and Muller-Hill, 1966; Ptashne, 1967) исследования регуляции генов были сфокусированы почти исключительно на роли связывающихся с нуклеиновыми кислотами белков как факторов специфичности. Открытие молекул малых РНК как агентов специфичности в разнообразных механизмах РНК-сайленсинга четко устанавливает теперь роль РНК как сиквенс-специфичного регулятора генов и их РНК-продуктов. Исследования, проведенные на дробянковых дрожжах, Arabidopsis и других модельных организмах вскрыли удивительно непосредственную роль малых РНК в опосредовании эпигенетических модификаций генома, «направляющих» сайленсинг генов и вносящих вклад в гетерохроматиновые домены, необходимые для стабильности генома и деления ядер. Многочисленные важные механистические вопросы остаются открытыми, и будущие исследования, вероятно, принесут много сюрпризов относительно того, как РНК регулирует экспрессию генов.Литература
Aravin A.A., Naumova N.M., Tulin A. V., Vagin V.V., Rozovsky Y.M., and Gvozdev V.A. 2001. Double-stranded RNA-mediated silencing of genomic tandem repeats and transposable elements in the D. melanogaster germline. Curr. Biol. 11: 1017-1027. Bao N., Lye K.W., and Barton M.K. 2004. Micro RNA binding sites in Arabidopsis class III HD-ZIP mRNAs are required for methylation of the template chromosome. Dev. Cell 7: 653-662. Barabino S.M., Ohnacker M., and Keller W. 2000. Distinct roles of two Ythlp domains in 3’-end cleavage and polyadenylation of yeast pre-mRNAs. EMBO J. 19: 3778-3787. Bartel D.P. 2004. MicroRNAs: Genomics, biogenesis, mechanism, and function. Cell 116: 281-297. Baulcombe D. 2004. RNA silencing in plants. Nature 431: 356-363. Bernstein E., CaudyA.A., Hammond S.M., and Hannon G.J. 2001. Role for a bidentate ribonuclease in the initiation step of RNA interference. Nature 409: 363-366. Bntten R.J. and Davidson E.H. 1969. Gene regulation for higher cells: A theory. Science 165: 349-357. Buhler M., \ferdel A., and Moazed D. 2006. Tethering RITS to a nascent transcript initiates RNAi- and heterochromatin-dependent gene silencing. Cell 125: 873-886. CaoX., Aufsatz W., Zilberman D., Mette M.F., Huang M.S., Matzke M., and Jacobsen S.E. 2003. Role of the DRM and CMT3 methyltrans-ferases in RNA-directed DNA methylation. Curr. Biol. 13: 2212-2217. Chan S.W., Zilberman D., Xie Z., Johansen L.K., Carrington, J.C., and Jacobsen S.E. 2004. RNA silencing genes control de novo DNA methylation. Science 303: 1336. Chen C.C., Simard M.J., Tabara H., Brownell D.R., McCollough J.A., and Mello C.C. 2005. A member of the polymerase (3 nucleotidyltransferase superfamily is required for RNA interference in C. elegans. Curr. Biol. 15: 378-383. Dalmay T., Hamilton A., Mueller E., and Baulcombe D.C. 2000. Potato vims X amplicons in Arabidopsis mediate genetic and epigenetic gene silencing. Plant Cell 12: 369-379. Davis E., Caiment E., Tordoir X., Cavaille J., Ferguson-Smith A., Cockett N., Georges M., and Charlier C. 2005. RNAi-mediated allelic trans-interaction at the imprinted Rtl 1/Peg 11 locus. Curr. Biol. 15: 743-749. Djupedal I., Portoso M., Spahr H., Bonilla C., Gustafsson C.M., Allshire R.C., and Ekwall K. 2005. RNA Pol II subunit Rpb7 promotes centromeric transcription and RNAi-directed chromatin silencing. Genes Dev. 19: 2301-2306. Ebbs M.L., Bartee L., and Bender J. 2005. H3 lysine 9 methylation is maintained on a transcribed inverted repeat by combined action of SUVH6 and SUVH4 methyltransferases. Mol. Cell. Biol. 25: 10507-10515. Elbashir S.M., Lendeckel W., and Tuschl T. 2001. RNA interference is mediated by 21- and 22-nucleotide RNAs. Genes Dev. 15: 188-200. Filipowicz W., Jaskiewicz L., Kolb F.A., and Pillai R.S. 2005. Post-transcriptional gene silencing by siRNAs and miRNAs. Curr. Opin. Stmct. Biol. 15: 331-341. Fire A., Xu S., Montgomery M.K., Kostas S.A., Driver S.E., and Mello C.C. 1998. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature 391: 806-811. Francis N.J. and Kingston R.E. 2001. Mechanisms of transcriptional memory. Nat. Rev. Mol. Biol. 2: 409-421. Fukagawa T., Nogami M., Yoshikawa M., Ikeno M., Okazaki T., Takami Y., Nakayama T., and Oshimura M. 2004. Dicer is essential for formation of the heterochromatin structure in vertebrate cells. Nat. Cell Biol. 6: 784-791. Galagan J.E. and Selker E.U. 2004. RIP: The evolutionary cost of genome defense. Trends Genet. 20: 417-423. GasciolliV., Mallory A.C., Bartel D.P., and Vaucheret H. 2005. Partially redundant functions of Arabidopsis DICER-like enzymes and a role for DCL4 in producing trans-acting siRNAs. Curr. Biol. 15: 1494-1500. Gasser S.M., Hediger E., Taddei A., Neumann F.R., and Garten-berg M.R. 2004. The function of telomere clustering in yeast: The circe effect. Cold Spring Harbor Symp. Quant. Biol. 69: 327-337. Gilbert W. and Muller-Hill B. 1966. Isolation of the Lac repressor. Proc. Natl. Acad. Sci. 56: 1891-1898. Grewal S.I. 2000. Transcriptional silencing in fission yeast. J. Cell. Physiol. 184: 311-318. Grewal S.I. and Moazed D. 2003. Heterochromatin and epigenetic control of gene expression. Science 30: 798-802. Grishok A., Sinskey J.L., and Sharp P.A. 2005. Transcriptional silencing of a transgene by RNAi in the soma of C. elegans. Genes Dev. 19: 683-696. Hall I.M., Shankaranarayana G.D., Noma K., Ayoub N.. Cohen A., and Grewal S.I. 2002. Establishment and maintenance of a heterochromatin domain. Science 297: 2232-2237. Hamilton A.J. and Baulcombe D.C. 1999. A species of small antisense RNA in posttranscriptional gene silencing in plants. Science 286: 950-952. Hampsey M. and Reinberg D. 2003. Tails of intrigue: Phosphorylation of RNA polymerase II mediates histone methylation Cell 113: 429-432. Hannon G.J. 2002. RNA interference. Nature 418: 244-251. Herr A. J., Jensen M.B., Dalmay T, and Baulcombe D.C. 2005. RNA polymerase IV directs silencing of endogenous DNA. Science 308: 118-120. Higa L.A., Mihaylov I.S., Banks D.P., Zheng J., and Zhang H. 2003. Radiation-mediated proteolysis of CDT1 by CUL4-ROC1 and CSN complexes constitutes a new checkpoint. Nat. Cell Biol. 5: 1008-1015. Hong E.E., Villen J., Gerace E.L., Gygi, S.P., and Moazed D. 2005. A Cullin E3 ubiquitin ligase complex associates with Rikl and the Clr4 histone H3-K9 methyltransferase and is required for RNAi-mediated heterochromatin formation. RNA Biol. 2: 106-111. Horn P.J., Bastie J.N., and Peterson C.L 2005. A Rikl-associated, cullin-dependent E3 ubiquitin ligase is essential for heterochromatin formation. Genes Dev. 19: 1705-1714. Jacob F. and Monod J. 1961. Genetic regulatory mechanisms in the synthesis of proteins. J. Mol. Biol. 3: 318-356. Jeffery L. and Nakielny S. 2004. Components of the DNA methylation system of chromatin control are RNA-binding proteins. J. Biol. Chem. 279: 49479-49487. Jia S., Kobayashi R., and Grewal S.I. 2005. Ubiquitin ligase component Cul4 associates with Clr4 histone methyltransferase to assemble heterochromatin. Nat. Cell Biol. 7: 1007-1013. Jia S., Noma K., and Grewal S.I. 2004. RNAi-independent heterochromatin nucleationby the stress-activated ATF/CREB family proteins. Science 304: 1971-1976. Kanellopoulou C., Muljo S.A., Kung A.L., Ganesan S., Drapkin R., Jenuwein T., Livingston D.M., and Rajewsky K. 2005. Dicer-deficient mouse embryonic stem cells are defective in differentiation and centromeric silencing. Genes Dev. 19: 489-501. Kanno T., Huettel B., Mette M.F., Aufsatz W., Jaligot E., Daxinger L., Kreil D.P., Matzke M., and Matzke A.J. 2005. Atypical RNA polymerase subunits required for RNA-directed DNA methylation. Nat. Genet. 37: 761-765. Kanno T., Mette M.F., Kreil D.P., Aufsatz W., Matzke M., and Matzke A.J. 2004. Involvement of putative SNF2 chromatin remodeling protein DRD1 in RNA-directed DNA methylation. Curr. Biol. 14: 801-805. Kanoh J., Sadaie M., Urano T., and Ishikawa F. 2005. Telomere binding protein Tazl establishes Swi6 heterochromatin independently of RNAi at telomeres. Curr. Biol. 15: 1808-1819. Kato H., Goto D.B., Martienssen R.A., Urano T., Furukawa K., and Murakami Y. 2005. RNA polymerase II is required for RNAi-dependent heterochromatin assembly. Science 309: 467-469. Kim J.K., Gabel H.W., Kamath R.S., Tewari M., Pasquinelli A., Rual J.F., Kennedy S., Dybbs M., Bertin N., Kaplan J.M., etal. 2005. Functional genomic analysis of RNA interference in C. elegans. Science 308: 1164-1167. KinoshitaT., Miura A., Choi Y., Kinoshita Y., CaoX., Jacobsen S.E., Fischer R.L., and Kakutani T. 2004. One-way control of FWA imprinting in Arabidopsis endosperm by DNA methylation. Science 303: 521-523. Li F.. Goto D.B.. Zaratiegui M., TangX., Martienssen R., and Cande W.Z. 2005. Two novel proteins, Dosl and Dos2, interact with Rikl to regulate heterochromatic RNA interference and histone modification. Curr. Biol. 15: 1448-1457. Li H.W. and Ding S.W. 2005. Antiviral silencing in animals. FEES Lett. 579: 5965-5973. Lippman Z., Gendrel A.V., Black M., Vaughn M.W., Dedhia N., McCombie W.R., Lavine K., Mittal V., May B., Kasschau K.D., et al. 2004. Role of transposable elements in heterochromatin and epigenetic control. Nature 430: 471-476. Lippman Z. and Martienssen R. 2004. The role of RNA interference in heterochromatic silencing. Nature 431: 364-370. Lippman Z., May B., Yordan C., Singer T., and Martienssen R. 2003. Distinct mechanisms determine transposon inheritance and methylation via small interfering RNA and histone modification. PLoS Biol 1: E67. Maine E.M., Hauth J., RatliffT., Vough V.E., SheX., and Kelly W.G. 2005. EGO-1, a putative RNA-dependent RNA polymerase, is required for heterochromatin assembly on unpaired dna during C. elegans meiosis. Curr. Biol. 15: 1972-1978. Martienssen R.A. 2003. Maintenance of heterochromatin by RNA interference of tandem repeats. Nat. Genet. 35: 213—214. Martienssen R.A., Zaratiegui M., and Goto D.B. 2005. RNA interference and heterochromatin in the fission yeast Schizosaccharomyces pombe. Trends Genet. 21: 450-456. Martienssen R., Lippman Z., May B., Ronemus M., and Vaughn M. 2004. Transposons, tandem repeats, and the silencing of imprinted genes. Cold Spring Harbor Symp. Quant. Biol. 69: 371-379. Mathieu O. and Bender J. 2004. RNA-directed DNA methylation. J.Cell Sci. 117: 4881-4888. Matzke M., Aufsatz W., Kanno T., Daxinger L., Papp I., Mette M.F., and Matzke A.J. 2004. Genetic analysis of RNA-mediated transcriptional gene silencing. Biochim. Biophys. Acta 1677: 129-141. May B.P., Lippman Z.B., Fang Y., Spector D.L., and Martienssen R.A. 2005. Differential regulation of strand-specific transcripts from Arabidopsis centromeric satellite repeats. PLoS Genet. 1: e79. Mette M.F., van der Winden J., Matzke M.A., and Matzke A.J. 1999. Production of aberrant promoter transcripts contributes to methylation and silencing of unlinked homologous promoters in trans. EMBO J. 18: 241-248. Mette M.F., Aufsatz W., van der Winden J., Matzke M.A., and Matzke A.J. 2000. Transcriptional silencing and promoter methylation triggered by double-stranded RNA. EMBO J. 19: 5194-5201. Morris K.V., Chan S.W., Jacobsen S.E., and Looney D.J. 2004. Small interfering RNA-induced transcriptional gene silencing in human cells. Science 305: 1289-1292. Motamedi M.R., Wrdel A., Colmenares S.U., Gerber S.A., Gygi S.P., and Moazed D. 2004. Two RNAi complexes, RITS and RDRC, physically interact and localize to noncoding centromeric RNAs. Cell 119: 789-802. Napoli C., Lemieux C., and Jorgensen R. 1990. Introduction of a chimeric chalcone synthase gene into Petunia results in reversible co-suppression of homologous genes in trans. Plant Cell 2: 279-289. Noma K., SugiyamaT., Cam H., Verdel A., Zofall M., Jia S., Moazed D., and Grewal S.I. 2004. RITS acts in cis to promote RNA interference-mediated transcriptional and post-transcriptional silencing. Nat. Genet. 36: 1174-1180. Onodera Y., Haag J.R., ReamT., Nunes PC., Pontes O., and Pikaard C.S. 2005. Plant nuclear RNA polymerase IV mediates siRNA and DNA methylation-dependent heterochromatin formation. Cell 120: 613-622. Pal-Bhadra M., Bhadra U., and Birchler J.A. 1997. Cosuppression in Drosophila: Gene silencing of Alcohol dehydrogenase by white-Adh transgenes is Polycomb dependent. Cell 90: 479-490. Pal-Bhadra M., Bhadra U., and Birchler J.A. 1999. Cosuppression of nonhomologous transgenes in Drosophila involves mutually related endogenous sequences. Cell 99: 35-46. Pal-Bhadra M., Bhadra U., and Birchler J.A. 2002. RNAi related mechanisms affect both transcriptional and posttranscriptional transgene silencing in Drosophila. Mol. Cell. 9: 315-327. Pal-Bhadra M., Leibovitch B.A., Gandhi S.G., Rao M., Bhadra U., Birchler J.A., and Elgin S.C. 2004. Heterochromatic silencing and HP1 localization in Drosophila are dependent on the RNAi machinery. Science 303: 669-672. Partridge J.F., Scott K.S., Bannister A.J., Kouzarides T., and Allshire R.C. 2002. cA-acting DNA from fission yeast centromeres mediates histone, H3 methylation and recruitment of silencing factors and cohesin to an ectopic site. Curr. Biol. 12: 1652-1660. Petrie V.J., Wuitschick J.D., Givens C.D., Kosinski A.M., and Panridge J.F. 2005. RNA interference (RNAi)-dependent and RNAi-independent association of the Chp1 chromodomain protein with distinct heterochromatic loci in fission yeast. Mol. Cell. Biol. 25: 2331-2346. Pidoux A.L. and Allshire R.C. 2004. Kinetochore and heterochromatin domains of the fission yeast centromere. Chromosome Res. 12: 521-534. Plasterk R.H. 2002. RNA silencing: The genome’s immune system. Science 296: 1263-1265. Provost P., Silverstein R.A., Dishan D., Walfridsson J., Djupedal I., Kniola B., Wright A., Samuelsson B., Radmark O., and Ekwall K. 2002. Dicer is required for chromosome segregation and gene silencing in fission yeast cells. Proc. Natl. Acad. Sci. 99: 16648-16653. Ptashne M. 1967. Specific binding of the lambda phage repressor to lambda DNA. Nature 214: 232-234. Reinhart B.J. and Bartel D.P. 2002. Small RNAs correspond to centromere heterochromatic repeats. Science 297: 1831. Reiss D., Josse T., Anxolabehere D., and Ronsseray S. 2004. aubergine mutations in Drosophila melanogaster impair P cytotype determination by telomeric P elements inserted in heterochromatin. Mol. Genet. Genomics. 272: 336-343. Ronemus M. and Martienssen R. 2005. RNA interference: Methylation mystery. Nature 433: 472-473. Sarot E., Payen-Groschene G., Bucheton A., and Pelisson A. 2004. Evidence for a piwi-dependent RNA silencing of the gypsy endogenous retrovirus by the Drosophila melanogaster flamenco gene. Genetics 166: 1313-1321. Shiu P.K., Raju N.B., Zickler D., and Metzenberg R.L. 2001. Meiotic silencing by unpaired DNA. Cell 107: 905-916. Sigova A., Rhind N., and Zamore P.D. 2004. A single Argonaute protein mediates both transcriptional and posttranscriptional silencing in Schizosaccharomycespombe. Genes Dev. 18: 2359—2367. Sijen T. and Plasterk R.H. 2003. Transposon silencing in the Caenorhabditis elegans germ line by natural RNAi. Nature 426: 310-314. Sijen T., Fleenor J., Simmer E., Thijssen K.L., Parrish S., Timmons L., Plasterk R.H., and Fire A. 2001. On the role of RNA amplification in dsRNA-triggered gene silencing. Cell 107: 465-476. Soppe W.J., Jacobsen S.E., Alonso-Bianco C., Jackson J.P., Kakutani T., Koomneef M., and Peeters A.J. 2000. The late flowering phenotype offwa mutants is caused by gain-of-function epigenetic alleles of a homeodomain gene. Mol. Cell 6: 791-802. Sugiyama T., Cam H., Wrdel A., Moazed D., and Grewal S.I. 2005. RNA-dependent RNA polymerase is an essential component of a self-enforcing loop coupling heterochromatin assembly to siRNA production. Proc. Natl. Acad. Sci. 102: 152-157. Ting A.H., Schuebel K.E., Herman J.G., and Baylin S.B. 2005. Short double-stranded RNA induces transcriptional gene silencing in human cancer cells in the absence of DNA methylation. Nat. Genet. 37: 906-910. Tran R.K., Zilberman D., de Bustos C., Ditt R.E, Henikoff J.G., Lindroth A.M., Delrow J., Boyle T., Kwong S., Bryson T.D., et al. 2005. Chromatin and siRNA pathways cooperate to maintain DNA methylation of small transposable elements in Arabidopsis. Genome Biol. 6: R90. Vaughn M.W. and Martienssen R.A. 2005. Finding the right template: RNA Pol IV, a plant-specific RNA polymerase. Mol. Cell 17: 754-756. Verdel A., Jia S., Gerber S., Sugiyama T., Gygi S., Grewal S.I, and Moazed D. 2004. RNAi-mediated targeting of heterochromatin by the RITS complex. Science 303: 672-676. Verdel A. and Moazed D. 2005. RNAi-directed assembly of heterochromatin in fission yeast. FEBS Lett. 579: 5872-5878. Volpe T.A., Kidner C., Hall I.M., Xeng G., Grewal S.I., and Martienssen R.A. 2002. Regulation of heterochromatic silencing and histone H3 lysine-9 methylation by RNAi. Science 297: 1833-1837 Volpe T., Schramke V., Hamilton G.L., White S.A., Teng G., Martienssen R.A., and Allshire R.C. 2003. RNA interference is required for normal centromere function in fission yeast. Chromosome Res. 11: 137-146. Wassenegger M., Heimes S., Riedel L., and Sanger H.L. 1994. RNA-directed de novo methylation of genomic sequences in plants. Cell 76: 567-576. Zamore P.D. 2002. Ancient pathways programmed by small RNAs. Science 296: 1265-1269. Zamore P.D., Tuschl T., Sharp P.A., and Bartel D.P. 2000. RNAi: Double-stranded RNA directs the ATP-dependent cleavage of mRNA at 21 to 23 nucleotide intervals. Cell 101: 25-33. Zhong W., Feng H., Santiago EE., and Kipreos E.T. 2003. CUL-4 ubiquitin ligase maintains genome stability by restraining DNA-replication licensing. Nature 423: 885-889.Глава 9. Эпигенетическая регуляция у растений
 Marjori Matzke и Mittelsten Scheid
Gregor Mendel Institute of Molecular Plant Biology, Austrian Academy of Sciences. A-1030 Vienna, Austria
Marjori Matzke и Mittelsten Scheid
Gregor Mendel Institute of Molecular Plant Biology, Austrian Academy of Sciences. A-1030 Vienna, Austria
Общее резюме
Растения — мастера эпигенетической регуляции. У них имеются все основные эпигенетические механизмы, свойственные эукариотам, и часто они даже более совершенны, чем у представителей других царств живого мира. Цитозиновое метилирование ДНК, связанное в основном с инактивацией (замалчиванием) генов, происходит в CpG, CpNpG и CpNpN нуклеотидных последовательностях растительных геномов и осуществляется специфичными растительными белками, некоторые из которых обладают деметилазной активностью Гистон-модифицирующие ферменты, модулирующие структуру хроматина у растений, имеют в основном консервативные каталитические домены и часто кодируются многими семействами генов, обеспечивающих исключительную диверсификацию и обилие генетических функций. Обусловленное малыми интерферирующими РНК (siPHK) замалчивание генов предназначено для борьбы с вирусами, инактивации транспозонов, регулировки развития и организации генома. Несмотря на то, что существование взаимосвязи между метилированием ДНК и модификацией гистонов уже признано, тем не менее, недавние сведения о том, что с участием siPHK эти модификации могут происходить в определенных областях генома, привносят много нового в эпигенетические исследования. Взаимодополнения и перекрывание путей замалчивания генов лежат в основе сложных многослойных схем и представлений об эпигенетике растений. Сложная картина эпигенетической регуляции у растений отражает историю их эволюции, характер их развития и «образ жизни». Полиплоидизация — увеличение числа хромосомных наборов — условие возникновения линий растений, амплификации семейств генов и функциональной специализации дуплицированных генов. В отличие от млекопитающих, у которых образование органа или ткани в основном заканчивается во время эмбрионального развития, растения растут путем непрерывного образования над- и подземных частей из популяций самодостаточных стволовых клеток меристемы. Тем самым, постэмбриональное развитие растений определяется средой и характеризуется высокой пластичностью и вариабельностью. Поскольку растения не могут убежать из своего окружения, они вынуждены как-то справляться с изменяющимися и часто неблагоприятными условиями среды. Врожденная гибкость регуляторных эпигенетических механизмов может облегчать быстрые перемены в генетической активности и тонко настраиваемой экспрессии генов так, чтобы растения могли выживать и успешно размножаться в непредсказуемых условиях среды. Исторически растения предоставили нам отличные системы для открытия и анализа эпигенетических феноменов. Переход от билатеральной к радиальной симметрии у некоторых линий растения Linaria vulgaris, который наблюдал Карл фон Линней в 18 столетии, указывал на эпигенетическую модификацию гена cycloidea, который регулирует развитие цветка. Значительный прогресс в эпигенетике достигнут за последние пять лет благодаря расшифровке нуклеотидной последовательности генома арабидопсиса («полезный сорцяк», широко используемый в генетическом анализе) и синергизму результатов параллельных исследований эпигенетических феноменов у животных и грибов.1. Преимущества использования растений в эпигенетических исследованиях
1.1. Сходство растений и животных по организации (эпи)генома
Как только биология сформировалась как наука, животные и растения были разделены на два царства, и это деление традиционно утвердилось при обучении биологов зоологии или ботанике. Для такого разделения нашлись и подходящие аргументы, такие, например, как гетеротрофная (нуждающаяся в органической материи) выработка энергии у животных против автотрофной у растении, подвижность по сравнению с неподвижным образом жизни растений, потенциально мигрирующие и эластичные клетки животных против неподвижных и жестких клеток растений. Однако за последние десятилетия генетики и молекулярные биологи обнаружили существенные сходства между животными и растениями, которые оказались весьма удивительными в свете долгого эволюционного размежевания между ними. Общими для тех и других являются половое размножение путем мейоза или оплодотворения и регуляция индивидуального развития некоторыми главными генами, которые контролируют деление и размножение клеток некими родственными факторами, а также восприятие факторов среды с помощью сходных сигнальных каскадов. Это сходство распространяется и на многие черты организации генома и эпигенома. Поразительное сходство выявляется между теми растениями и животными, которые сравнимы по размеру и степени сложности организации генома и по доле гетерохроматина. Как и у многих других эукариот, эу- и гетерохроматин характеризуются специфическим ацетилированием и метилированием гистонов, кроме того в гетерохроматине животных и растений ДНК еще значительно метилирована. При сравнении геномной организации и эпигенетической регуляции у разных модельных систем (организмов) выяснилось, что у растений и животных существует гораздо больше общих черт, чем у разных животных (табл. 9.1). Поэтому с антропоцентрической точки зрения адресованные животным и растениям вопросы могут быть очень сходными, а полученная базовая информация часто может быть обоюдно использована и для тех, и для других.1.2. Растения предоставляют дополнительные направления эпигенетических исследований
Наряду с общими для животных и растений элементами растения приобрели некие особенности, относящиеся к эпигенетическим феноменам. В то время как у животных оплодотворение осуществляется путем слияния двух гаплоидных клеток, которые возникли в результате непосредственно предшествующего мейоза, у растений существует гаплоидная (гаметофит) фаза роста между мейозом и оплотворением (рис. 9.1). Гаметофит представляет собой прорастающее пыльцевое зерно (мужская линия) и эмбриональный мешок (женская линия), каждый из которых имеет несколько гаплоидных ядер, которые образуются из мейотических продуктов вследствие двух или трех последовательных митозов, соответственно. На стадии гаметофита утрата генетической или эпигенетической информации не может компенсироваться информацией на гомологичных хромосомах или аллелях. Хотя исчерпывающие исследования в этой области знаний еще не проведены, тем не менее доказательств массивной утраты эпигенетических признаков во время гаметогенеза у растений, в отличие от животных, еще нет. Это может объяснить, почему у растений эпигенетические изменения часто передаются в результате мейоза.Таблица 9.1. Сведения о геномных и эпигенетических компонентах у используемых эпигенетических модельных систем
 (At) Arabidopsis thaliana, (Cb) Caenorhabditis briggsae, (Ce) Caenorhabditis elegans, (Dm) Drosophila melanogaster, (Hs) Homo sapiens, (Os) Oryza saliva, (Pp) Pristionchus pacificus.
a Repeat-индуцированная точечная мутация, см. главу 6.
6 Хромосомная или геномная специфичность.
в Мутированная Dnmt2.
г Dnmt2 (Рр) и MBD-доменные белки (Се. СЬ, Рр). д Dnmt2 (Рр) и MBD-доменные белки.
(At) Arabidopsis thaliana, (Cb) Caenorhabditis briggsae, (Ce) Caenorhabditis elegans, (Dm) Drosophila melanogaster, (Hs) Homo sapiens, (Os) Oryza saliva, (Pp) Pristionchus pacificus.
a Repeat-индуцированная точечная мутация, см. главу 6.
6 Хромосомная или геномная специфичность.
в Мутированная Dnmt2.
г Dnmt2 (Рр) и MBD-доменные белки (Се. СЬ, Рр). д Dnmt2 (Рр) и MBD-доменные белки.
Другая определенная отличительная черта растений — менее четко очерченная зародышевая линия и ее отделение от соматических клеток только на поздней стадии развития (рис. 9.1). У растений в точках роста на кончиках побегов и корней имеются апикальные меристемы, из которых образуются новые ткани и органы. Апикальная меристема побега дает начало цветкам, которые образуют гаметы для полового размножения, могут вырастать и дополнителные латеральные меристемы и образовывать цветы. У многих растений появились специализированные органы — ризомы, клубни или луковицы, которые имеют меристемы. Эти механизмы вегетативного размножения могут быть даже более общими и эффективными, чем размножение семенами. Зародыши могут образоваться не только в результате развития оплодотворенной яйцеклетки, но и из соматической ткани (соматический эмбриогенез). В тканевой культуре некоторые дифференцированные соматические клетки могут дедифференцироваться и перепрограммироваться в сторону альтернативной дифференцировки. Поэтому соматическое клонирование, пока еще мало эффективное у животных, широко распространено у многих видов растений, и с годами могут быть воспроизведены бесчисленные «зеленые Долли». Однако у клонированных казалось бы генетически униформных популяций растений набюдается выраженная фенотипическая изменчивость. Эта так называемая «сомаклональная вариабельность» имеет четкую эпигенетическую основу и потенциально может быть использована в селекции и адаптации растений (см. обзор Kaeppler et al., 2000)
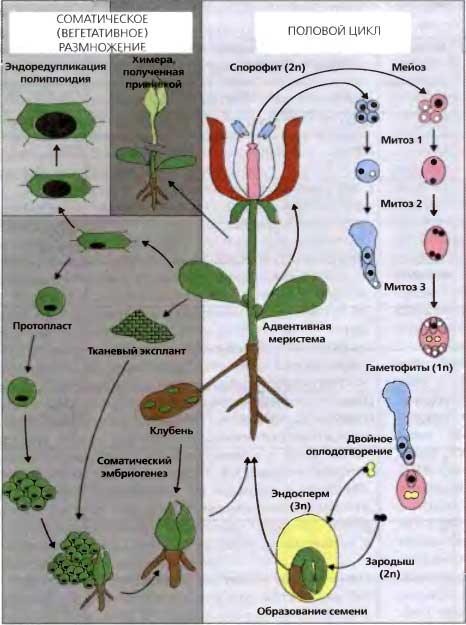 Рис. 9.1. Особенности жизненного цикла растения
Растения могут размножаться половым путем (образование гамет, оплодотворение и образование семян (правая часть рисунка) и бесполым (соматическим) путем (вегетативное размножение, де- и редифференцировка или эмбриогенез (левая часть рисунка). Тело высшего растения (корни, стебель, цветок) — диплоидный спорофит. При мейозе число хромосом уменьшается вдвое. Если у животных продукты мейоза образуют гаметы без дальнейшего деления и они сливаются с образованием диплоидного ядра, то у растений образуются гаплоидные мужской или женский гаметофиты в результате двух или трех митотических делений, соответственно. В конечном итоге пыльцевая трубка содержит одно вегетативное (белое) и два генеративных (черные) ядра. Два генеративных ядра оплодотворяют яйцеклетку (черная) и формируется центральная клетка с диплоидным ядром, произошедшим в результате слияния двух полярных ядер (желтые) Таким образом, в результате этого двойного оплодотворения и образуются диплоидный зародыш и триплоидный эндосперм, который снабжает развивающийся зародыш питанием. После прорастания семени зародыш дает начало новому спорофиту. Кроме того, большинство растений способны размножаться вегетативно благодаря активации покоящихся латеральных меристем, выросту специализированных корневых структур (клубни), амплификации в тканевых культурах или даже регенерации из индивидуальных соматических клеток после удаления клеточной стенки (протопласты). У растений часто наблюдается эндоредупликация, которая приводит к образованию полиплоидных клеток или тканей Химерные растения можно получить с помощью прививки. Поэтому генетическая и эпигенетическая информация у растений проходит гораздо меньше четко определенных путей развития зародышевой линии, чем у животных
Рис. 9.1. Особенности жизненного цикла растения
Растения могут размножаться половым путем (образование гамет, оплодотворение и образование семян (правая часть рисунка) и бесполым (соматическим) путем (вегетативное размножение, де- и редифференцировка или эмбриогенез (левая часть рисунка). Тело высшего растения (корни, стебель, цветок) — диплоидный спорофит. При мейозе число хромосом уменьшается вдвое. Если у животных продукты мейоза образуют гаметы без дальнейшего деления и они сливаются с образованием диплоидного ядра, то у растений образуются гаплоидные мужской или женский гаметофиты в результате двух или трех митотических делений, соответственно. В конечном итоге пыльцевая трубка содержит одно вегетативное (белое) и два генеративных (черные) ядра. Два генеративных ядра оплодотворяют яйцеклетку (черная) и формируется центральная клетка с диплоидным ядром, произошедшим в результате слияния двух полярных ядер (желтые) Таким образом, в результате этого двойного оплодотворения и образуются диплоидный зародыш и триплоидный эндосперм, который снабжает развивающийся зародыш питанием. После прорастания семени зародыш дает начало новому спорофиту. Кроме того, большинство растений способны размножаться вегетативно благодаря активации покоящихся латеральных меристем, выросту специализированных корневых структур (клубни), амплификации в тканевых культурах или даже регенерации из индивидуальных соматических клеток после удаления клеточной стенки (протопласты). У растений часто наблюдается эндоредупликация, которая приводит к образованию полиплоидных клеток или тканей Химерные растения можно получить с помощью прививки. Поэтому генетическая и эпигенетическая информация у растений проходит гораздо меньше четко определенных путей развития зародышевой линии, чем у животных
Еще одна отличительная черта растений — существование плазмодесм (цитоплазматические мостики между клетками), которые проницаемы для небольших молекул, некоторых белков, РНК и вирусной геномной информации. Несмотря на большую взаимосвязанность, побеги растений можно срезать и привить на генетически отличные подвои (рис. 9.1). Это приведет к образованию химер, у которых вегетативные и генеративные ткани генетически различны. Поэтому хотя эпигенетические признаки и передаются по зародышевой линии, у растений они более изменчивы и обратимы, чем у животных. Растения более толерантны к полиплоидии (умножение полного хромосомного набора), чем животные. У растений встречается множество диких и культурных полиплоидных видов (пшеница, хлопчатник, картофель, арахис, сахарный тростник, табак и другие). Полиплоидность дает им некоторые преимущества. При исследовании нуклеотидных последовательностей многих растительных геномов, включая маленький геном Arabidopsis thaliana, получены четкие доказательства дупликации исходного генома и генов. Даже диплоидные растения могут иметь полиплоидные клетки, которые возникают гораздо чаще, чем некоторые высокоспециализированные полиплоидные клетки у млекопитающих. Образование полиплоидов часто связано со значительными генетическими и эпигенетическими изменениями (см. обзор Adams and Wendel, 2005). Некоторые из этих изменений могут произойти на протяжении одного или нескольких поколений и они важны для быстрой адаптации и эволюции растений.
1.3. Растения лучше выносят некоторые методологические манипуляции, которые очень трудно применимы к млекопитающим
У животных генетические манипуляции ограничены из-за процедур, требующих генерацию мутаций и спаривание для получения гомозиготных генотипов, которые обязательны для проявления рецессивных признаков. Напротив, у растений возможен эффективный мутагенез путем химических или физических обработок или в основном с помощью хаотичных вставок помеченных трансгенов или транспозируемых элементов. Вследствие самоопыления в последующем поколении легко появляются потомки с гомозиготными мутациями растения и расщеплением признаков по закону Менделя. Поиск мутаций в эпигенетических регуляторах основан на восстановлении экспрессии у эпигенетически инактивированных маркерных генов или снижении активности стабильно активных репортерных генов. В дополнение к такой прямой объективной методологии, быстро растущие коллекции инсерционных мутантов с определенными сайтами интеграции позволяют осуществлять обратный генетический анализ мутационных эффектов в избранных определенных генах-ортологах эпигенетических регуляторов у других модельных организмов (табл. 9.2). Рис. 9.2. Изучение эпигенетического контроля у растений
Гены, кодирующие окраску тканей у растений, позволяют довольно просто и недорого анализировать экспрессию генов in vivo (а) Экспрессия гена дигидрофлавонолредуктазы (DFR) отвечает за темнопурпурную окраску цветков петунии, а при замалчивании промотора этого гена цветки становятся пестрыми, светлоокрашенными (любезно предоставлено Kooter) (б) У Arabidopsis с экспрессией гена (CHS) халконсинтетазы семена имеют темную оболочку, а после замалчивания этого гена в результате интеграции гомологичного трансгена они становятся желтыми (любезно предоставлено lan Fumer). (в) Растения кукурузы с В-1 геном имеют пурпурную пигментацию, а растения с парамутагенным инактивированным В’ геном зеленые, (г) Початок кукурузы с сегрегированной вставкой транспозона (Spm) в гене В-Peru, необходимом для образования антоцианового пигмента. Пурпурные зерна представляют собой ревертанты, у которых в гене зародышевой линии вырезан Spm элемент. Сильно пятнистые зерновки содержат активный Spm элемент, который часто индуцирует соматическое вырезание соответствующих секторов при созревании зерновки. Зерна с редкими небольшими пурпурными участками представляют собой зерновки, у которых Spm элемент эпигенетически зарепрессирован (любезно предоставлено Vicky Chandler), (д) Темная окраска соевых бобов (в середине рисунка) уменьшается у культивируемых разновидностей сои (слева) в результате природного посттранскрипционного сайленсинга CHS гена, она может частично восстанавливаться при заражении родительского растения вирусом с PTGS супрессорным белком, обусловливающим пеструю окраску (справа), (е) Эпигенетическая регуляция может отражаться и в морфологии растений: сниженное функционирование субъединицы фактора сборки хроматина приводит к образованию «сросшегося» стебля у Arabidopsis, (ж) реактивация (снятие сайленсинга) трансгенного маркера устойчивости у Arabidopsis может быть выявлена по росту растения на селективной среде (с, перепечатано с разрешения Chandler et al., 2000 [Springer Science and Business Media]; д перепечатано с разрешения Senda etal., 2004 [©American Society of Plant Biologists].)
Рис. 9.2. Изучение эпигенетического контроля у растений
Гены, кодирующие окраску тканей у растений, позволяют довольно просто и недорого анализировать экспрессию генов in vivo (а) Экспрессия гена дигидрофлавонолредуктазы (DFR) отвечает за темнопурпурную окраску цветков петунии, а при замалчивании промотора этого гена цветки становятся пестрыми, светлоокрашенными (любезно предоставлено Kooter) (б) У Arabidopsis с экспрессией гена (CHS) халконсинтетазы семена имеют темную оболочку, а после замалчивания этого гена в результате интеграции гомологичного трансгена они становятся желтыми (любезно предоставлено lan Fumer). (в) Растения кукурузы с В-1 геном имеют пурпурную пигментацию, а растения с парамутагенным инактивированным В’ геном зеленые, (г) Початок кукурузы с сегрегированной вставкой транспозона (Spm) в гене В-Peru, необходимом для образования антоцианового пигмента. Пурпурные зерна представляют собой ревертанты, у которых в гене зародышевой линии вырезан Spm элемент. Сильно пятнистые зерновки содержат активный Spm элемент, который часто индуцирует соматическое вырезание соответствующих секторов при созревании зерновки. Зерна с редкими небольшими пурпурными участками представляют собой зерновки, у которых Spm элемент эпигенетически зарепрессирован (любезно предоставлено Vicky Chandler), (д) Темная окраска соевых бобов (в середине рисунка) уменьшается у культивируемых разновидностей сои (слева) в результате природного посттранскрипционного сайленсинга CHS гена, она может частично восстанавливаться при заражении родительского растения вирусом с PTGS супрессорным белком, обусловливающим пеструю окраску (справа), (е) Эпигенетическая регуляция может отражаться и в морфологии растений: сниженное функционирование субъединицы фактора сборки хроматина приводит к образованию «сросшегося» стебля у Arabidopsis, (ж) реактивация (снятие сайленсинга) трансгенного маркера устойчивости у Arabidopsis может быть выявлена по росту растения на селективной среде (с, перепечатано с разрешения Chandler et al., 2000 [Springer Science and Business Media]; д перепечатано с разрешения Senda etal., 2004 [©American Society of Plant Biologists].)
Таблица 9.2. Компоненты эпигенетической регуляции у модельного растения Arabidopsis thaliana, выявленные при прямом и обратном скрининге


 Число членов в семействе гомологичных генов может быть весьма различным у животных и растений. Вследствие функциональной избыточности некоторые мутации могут быть не столь серьезны как у животных, так и у растений. Это важно, если потеря функции сопровождается утратой индивидуума до анализа в раннем развитии. Экспрессию относительно мало значимых генов, например, отвечающих за окраску растительных тканей, можно просто и недорого выявлять in vivo (рис. 9.2а—д). К тому же тысячи растений могут быть проанализированы в селекционных опытах путем выявления экспрессии эндогенных или трансгенных черт (рис. 9.2ж).
Знание нуклеотидной последовательности генома A. thaliana, наряду с анализом некоторых больших коллекций инсерционных мутантов, и простой мутагенез сделали это растение прекрасной моделью для изучения эпигенеза у растений. Последующие рассуждения касаются эпигенетических модификаторов, функции которых стали известны в результате анализа мутантов, дефектных по трансгенному сайленсингу (замалчиванию генов) и благодаря биоинформационной идентификации гомологии с генами, необходимыми для сайленсинга у других организмов, и обнаружению сходных фенотипов развития у других дефектных по сайленсингу мутантов Arabidopsis в результате прямого и обратного скрининга (табл. 2). Для ознакомления с полным перечнем хроматиновых генов Arabidopsis, риса и кукурузы читатель может быть адресован к Plant Chromatin Database (http://www.chromdb.org).
Число членов в семействе гомологичных генов может быть весьма различным у животных и растений. Вследствие функциональной избыточности некоторые мутации могут быть не столь серьезны как у животных, так и у растений. Это важно, если потеря функции сопровождается утратой индивидуума до анализа в раннем развитии. Экспрессию относительно мало значимых генов, например, отвечающих за окраску растительных тканей, можно просто и недорого выявлять in vivo (рис. 9.2а—д). К тому же тысячи растений могут быть проанализированы в селекционных опытах путем выявления экспрессии эндогенных или трансгенных черт (рис. 9.2ж).
Знание нуклеотидной последовательности генома A. thaliana, наряду с анализом некоторых больших коллекций инсерционных мутантов, и простой мутагенез сделали это растение прекрасной моделью для изучения эпигенеза у растений. Последующие рассуждения касаются эпигенетических модификаторов, функции которых стали известны в результате анализа мутантов, дефектных по трансгенному сайленсингу (замалчиванию генов) и благодаря биоинформационной идентификации гомологии с генами, необходимыми для сайленсинга у других организмов, и обнаружению сходных фенотипов развития у других дефектных по сайленсингу мутантов Arabidopsis в результате прямого и обратного скрининга (табл. 2). Для ознакомления с полным перечнем хроматиновых генов Arabidopsis, риса и кукурузы читатель может быть адресован к Plant Chromatin Database (http://www.chromdb.org).
1.4. Исследование растений внесло самый значимый вклад в эпигенетику
Самый ощутимый вклад в эпигенетику при исследовании различных растительных моделей внесли сведения из семеноводства. Определенные данные о различии организации эу- и гетерохроматина были получены в результате цитологического анализа мхов (Heitz, 1928). Первым доказательством так называемой неменделевской генетики (см. обзор Chandler and Stam, 2004) было обнаружение наследуемой, но обратимой экспрессии генов при взаимодействии аллелей у томатов и кукурузы, позднее названной парамутацией; это же выявлено теперь и у млекопитающих. Постоянное появление у растений цветков с измененной симметрией («peloria» или монстры) описано еще Карлом Линнеем; сегодня это могло бы объясняться образованием эпиаллели — стабильной эпигенетической модификацией регуляторного гена с такой же нуклеотидной последовательностью, как и у экспрессируемого гена (Cubas et al., 1999). В результате цитологического анализа растений выявлены существенные изменения во вторичной организации хромосом, которые оказались связанными с ядрышковым доминированием, с замолканием одного из наборов родительских генов рибосомных РНК у межвидовых гибридов, что определяется эпигенетической регуляцией (Pikaard, 2000). Пионерские исследования лауреата Нобелевской премии Барбары МакКлинток и других ученых транспозиции генетических элементов у кукурузы выявили множественные связи между генетикой и эпигенетической регуляцией (Fedoroff and Chandler, 1994). На самом деле именно анализ теперешних транспозонов и их дегенерированных останков послужил основанием для выявления эпигенетических модификаций в растительных геномах (раздел 3.4). Когда техника трансгеноза стала уже рутинной в конце 1980 годов, благодаря использованию генетических маркеров были неожиданно достигнуты значительные успехи в исследовании эпигенетики табака, петуньи и арабидопсиса (Jorgensen, 2003; Matzke and Matzke, 2004). Была сформулирована концепция гомологичного замалчивания генов, когда стало ясно, что замалчивание генов часто коррелирует с наличием множественных копий связанных или несвязанных трасгенов. Разные случаи гомологичного замолкания генов обусловлены либо усиленным обменом мРНК (посттранскрипционное замалчивание генов, ПЗГ, PTGS) или репрессией транскрипции (транскрипционное замалчивание генов, ТЗГ. TGS). Оба эти процесса коррелировали с увеличением цитозинового метилирования молчащих генов. Наиболее яркий пример ПЗГ у трансгенной петунии вначале был назван «косупрессией». Были осуществлены попытки изменить окраску цветков путем усиления экспрессии генов халконсинтазы (CHS), определяющих пурпурную окраску лепестков, от пестрой до почти полностью белой. Потеря окраски была обусловлена скоординированным замалчиванием CHS трансгена и эндогенного CHS гена (Jorgensen, 2003). ПЗГ связано с интерферирующими РНК (PHKi), которые позже выявлены у Caenorhabditis elegans и других организмов (раздел 3.2). В середине 1990-х годов была выявлена связь между ПЗГ и устойчивостью к вирусам. ПЗГ оказалось природным механизмом защиты растений от несанкционированной репликации вирусов, которые могут быть как индукторами, так и мишенью для ПЗГ. Это было установлено в опытах по замалчиванию генов у растений путем использования специально сконструированных вирусных векторов с последовательностями, гомологичными генам-мишеням, что и приводило к индуцированному вирусом замалчиванию генов ((VIGS; Burch-Smith et al., 2004). Наряду с этим было открыто метилирование ДНК, направляемое РНК (RdDM) у зараженных вироидами растений. Это послужило первым указанием на то, что РНК, воздействуя на ДНК по принципу обратной связи, может вызывать эпигенетические модификации (Wassenegger et al., 1994). Этот принцип был успешно использован для транскрипционной инактивации и метилирования промоторов с помощью специальных двутяжевых РНК (раздел 3.4, Управляемое РНК метилирование ДНК).2. Молекулярные компоненты хроматина у растений
Ранее мы уже упоминали многие компоненты систем эпигенетической регуляции у растений, которые были выявлены в результате анализа мутаций у арабидопсиса (табл. 9.2). Однако результаты скрининга мутантов могут выявлять не все эпигенетические модификаторы из-за функционального разнообразия больших семейств генов или летальных последствий утраты существенных генетических компонентов.2.1. Регуляторы метилирования ДНК у растений
Метилирование 5-го углеродного остаткав цитозине ДНК— признак эпигенетической инактивации и гетерохроматина у растений и животных (табл. 18.1). Однако у растений метилирование ДНК имеет ряд уникальных черт в отношении характера (профиля) метилирования ДНК. ферментов ДНК-метилтрансфераз и возможности обратимости метилирования в неделящихся клетках (Chan et al., 2005). В этом разделе мы описываем белки, необходимые для генерации, поддержания, интепретации и «стирания» картины метилирования ДНК Специальные компоненты для PHК-направляемого метилирования ДНК представлены в разделе 3.4.ДНК-метилтрансферазы
Различают de novo и поддерживающее метилирования ДНК De novo метилирование осуществляет модификацию прежде неметилированных последовательностей ДНК (рис. 18.1). У растений это метилирование может затрагивать CpG, CpNpG и CpNpN последовательности (где N - А, Т или С). В отличие от растений у животных метилирование ДНК, в основном ограничивается CpG динуклеотидами и пока нет сведений о существенном метилировании цитозиновых остатков в асимметричных CpNpN сайтах. Хотя природа сигналов, запускающих de novo метилирование ДНК, в основномпока еще неизвестна, однако у растений эту роль могут выполнять двутяжевые РНК (раздел 3.4). Поддерживающее метилирование сохраняет картину (pattern) метилирования генома при репликации ДНК и особенно эффективно затрагивает CpG и CpNpG нуклеотидные последовательности, обладающие палиндромной симметрией. Поддерживающему метилированию подвержены полуметилированные ДНК после репликации или репарации, у которых «гидом» для узнавания метилируемых сайтов в новообразованной цепи служат метилированные цитозиновые остатки в материнской цепи. Хотя считается, что у растений de novo и поддерживающее метилирования ДНК осуществляются разными ферментами, тем не менее, есть мнение и о том, что ферменты с различной сайтовой (CpG или не CpG) специфичностью могут часто делать то и другое. У растений имеются три консервативных семейства ДНК-метилтрансфераз. Ферменты из семейства МЕТ1 ДНК-метилтрансфераз — гомологи животных ДНК-метилтрансфераз типа Dnmt1 (глава 18) в основном являются поддерживающими CpG метилирование ДНК ферментами, хотя одна из них участвует в de novo CpG метилировании при направляемом РНК метилировании ДНК (раздел 3.4). Класс Dnmt2 ферментов, из которых один закодирован в геноме арабидопсиса, представлен семейством наиболее широко распространенных и высоко консервативных ДНК-метилтрансфераз (табл. 9.2), функция которых все еще не известна. Растительные DRM (domains rearranged methyltransferases) ДНК-метилтрансферазы и их гомологи ферментов (группа Dnmt3) млекопитающих обычно рассматриваются как de novo метилтрансферазы. Эти ферменты катализируют метилирование цитозиновых остатков во всех контекстах и участвуют в направляемом РНК метилировании ДНК (раздел 4). Как это следует из названия, домены в этих ферментах реаранжированы: в отличие от Dnmt3 у DRM белков домены I-V следуют за доменами VI-X. Это может придавать этим ферментам способность метилировать асимметричные CpNpN нуклеотидные последовательности, которые в клетках млекопитающих не метилируются. Специфичная для растений хромометилаза СМТЗ модифицирует цитозиновый остаток в тринуклеотиде CpNpG. Подобно ферменту МЕТ1 эта метилтрансфераза участвует как в de novo, так и в поддерживающем метилировании ДНК. Истинная функция СМТЗ все еще не совсем ясна, хотя известно, что утрата ее активности у соответствующих мутантов сопровождается реактивацией некоторых молчащих транспозонов (Chan et al., 2005). В отличие от млекопитающих, у которых dnmtl и dnmt3 мутанты погибают во время эмбрионального развития или сразу же после рождения животного, растительные мутанты met1, cmt3 и drm жизнеспособны и обычно даже фертильны. Такая жизненность дефектных по ДНК-метилтрансферазам растительных мутантов позволяет более экстенсивно анализировать роль таких мутаций во время развития и половой репродукции растений, что вообще невозможно сделать в отношении млекопитающих (Chan et al., 2005).Активное CpG деметилирование и ДНК-гликозилазы
Эпигенетическая регуляция свидетельствует о том, что активное или неактивное состояния генов потенцильно обратимы. Метилирование ДНК разрешает такую обратимость, потому что оно может пассивно или активно утрачиваться. Пассивная утрата происходит, когда метилирование невозможно в течение нескольких раундов репликации. Напротив, активное деметилирование может протекать в неделящихся клетках при наличии соответствующих энзиматических активностей. Относительно недавние сведения из биохимии животных указывают на то, что активное деметилирование может осуществляться под действием ДНК-гликозилаз, которые обычно участвуют в эксцизионной репарации ДНК путем выстригания оснований (Kress et al., 2001). Интерес к этому механизму вспыхнул вновь после открытия у арабидопсиса Demeter (DME) и репрессора сайленсинга (ROS1), которые представляют собой крупные белки с ДНК-гликозилазными доменами. ROS1 ген был идентифицирован при скрининге мутаций, приводящих к эпигенетической down-регуляции и гирперметлированию стабильно экспрессируемого репортерного гена (Gong et al., 2002). ROS1 белок гидролизовал (никировал) метилированную, но не неметилированную ДНК, что совпадало с его ролью в удалении метилированных цитозиновых остатков из ДНК путем выстригания основания при эксцизионной репарации ДНК. ROS1 экспрессируется конститутивно и поэтому в принципе может участвовать в утрате метилированных оснований у ДНК в неделящихся клетках на всех этапах развития (Kapoor et al., 2005а). Напротив, DME активность выявлена только в женском гаметофите, где она активирует фактор импринтинга Medea (МЕА) в зависимости от активности ДНК-гликозилазного домена (Choi et al., 2002). CG метилтрансфераза MET1 является антагонистом DME. Это указывает на то, что DME белок на самом деле нужен для деметилирования CG динуклеотидов (Hsieh and Fisher, 2005). У Arabidopsis имеются еще два уникальных для растений неохарактеризованные пока представителя семейства DME/ROS1. Такая своеобразная экспансия генов этого семейства указывает на то, что обратимое замалчивание генов путем активного деметилирования ДНК важно для физиологии растений, для их развития или адаптации к условиям среды.Метил-ДНК связывающие белки
Считается, что MBD белки с метил-ДНК связывающим доменом участвуют в трансдукции собственно характера метилирования ДНК в измененную транскрипционную активность. У млекопитающих MBD белки связываются с метилированной ДНК и рекрутируют деацетилазы гистонов для усиления сайленсинга транскрипции. Arabidopsis имеет 12 MBD-содержащих генов по сравнению с 11 генами у млекопитающих, пятью генами у Drosophila, двумя генами у С. elegans и с отсутствием их в геномах грибов (Hung and Shen, 2003). Несмотря на то, что еще мало известно о функциях MBD белков у Arabidopsis, тем не менее нокдаун с помощью PHKi одного из них, AtMBD 11, связан с плейотропными эффектами при развитии растений (Springer and Kaeppler, 2005). Ни один из MBD белков Arabidopsis не идентифицирован при генетическом скрининге, возможно из-за функциональной избыточности. Кроме того, несмотря на консерватизм аминокислотных последовательностей ДНК-метилтрансфераз у растений и животных, MBD-содержащие белки у представителей этих двух царств дивергировали целиком вне метил-CG-связывающего домена. Тем самым, хотя животные и растения используют для создания и поддержания картины метилирования генома родственные ферменты, они могут иметь возникшие в эволюции разные пути интерпретации этих картин с помощью определенных MBD белков (Springer and Kaeppler, 2005).Компоненты системы синтеза донора метильных групп
Метилирующие ферменты нуждаются в активированных метильных группах обычно в виде S-аденозилметионина. Поэтому удивительно, как это ранее биохимические пути образования этого кофактора рассматривались вне связи с эпигенетической регуляцией. Только недавно выявлено, что мутация (hogl) гена арабидопсиса, кодирующего S-аденозил-Т-гомоцистеингидролазу, отвечает за определенные эпигенетические дефекты (Rocha et al., 2005).2.2. Ферменты модификации гистонов
Подобно другим организмам (табл. 9.1), растения имеют ферменты, которые посттрансляционно модифицируют аминоконцевые хвосты гистонов, что предполагает существование гистонового кода (Loidl, 2004). У растений модифицирующие гистоны ферменты часто кодируются относительно большими семействами генов. Полезная информация о большинстве этих генов все еще очень мала. Существуют, по крайней мере, две известные модификации гистонов — ацетилирование/деацетилирование и метилирование.Гистоновые деацетилазы и ацетилтрансферазы гистонов
Разнонаправленное действие гистоновых ацетилтрансфераз (HATs) и деацетилаз (HDACs) обеспечивает обратимость этой модификации гистонов, т.е. их эпигенетического маркирования. Такая обратимость модификаций часто усиливается и тем, что в дополнение к гипоацетилированию гистонов молчащие гены еще и метилированы по CpG сайтам, из которых метилированные остатки цитозина потенциально могут быть удалены под действием ДНК-гликозилаз (раздел 2.1, подраздел «Активное CG деметилирование и ДНК-гликозилазы»). У Arabidopsis имеется 18 предполагаемых HDACs и 12 предполагаемых HATs (Pandey et al., 2002). Это больше, чем у других нерастительных эукариот; примерно такое же количество таких ферментов выявлено у млекопитающих. Эти ферменты консервативны у всех эукариот. У растений имеется одно из специфичных для них семейств белков, функциональная роль которых не известна. При генетическом скрининге обнаружены только два гена этого консервативного семейства: HDA1 и HDA6 (табл. 9.2). HDA6 участвует в поддерживающем CpG метилировании, индуцированном РНК, и модификации повторяющихся последовательностей, но почти не влияет на развитие. На это указывает нормальный фенотип у соответствующих дефектных мутантов. В отличие от этого сниженная экспрессия HDA1 сопровождается плейотропными эффектами при развитии. У Arabidopsis ни одна из HAT не найдена при генетическом скринировании, что могло бы указывать на функциональную их избыточность или участие в активации молчащих генов.Метилтрансферазы гистонов
Белки, метилирующие лизиновые остатки в гистонах (упоминающиеся в этой книге как гистоновые лизин метилтрансферазы или HKMTs) и другие, содержат общий SET домен (SU(VAR)/E(Z)/TRX). Благодаря тому, что они обладают способностью метилировать гистон H3 или Н4 по разным лизиновым остаткам, различные комплексы белков с SET доменами играют заметную роль в промотировании или ингибировании транскрипции специфических генов и формировании гетерохроматина. Некоторые белки с SET доменом являются членами так называемых групп поликомб (PcG) и триторакс (trxG), они соответственно поддерживают транскрипционно неактивное или активное состояние гомеотических генов при развитии растений и животных (главы 11 и 12). Другие SET доменные белки, такие как SU(VAR)3-9, участвуют в поддержании конденсированного состояния гетерохроматина особенно часто в областях повторяющихся последовательностей ДНК путем метилирования гистона H3 по лизину 9 (H3K9). В геноме Arabidopsis закодировано 32 SET доменных белка, из которых экспрессируются 30. Они могут быть сгруппированы в виде четырех консервативных семейств: E(Z), TRX, ASH1 и SU(VAR)3-9; имеется также небольшое пятое семейство белков, которое выявлено только у дрожжей и растений (Baumbusch et al., 2001; Springer et al., 2003). Число экспрессируемых SET доменных белков у Arabidopsis относительно велико по сравнению с 14 белками у Drosophila и четырьмя белками у делящихся дрожжей. У мышей насчитывается 50 SET доменных белков. В дополнение к экспансии SET доменных белков в результате полиплоидии, у Arabidopsis существенную роль в амплификации членов группы SU(VAR)3-9 играет ретротранспозиция. Вне SET домена соответствующие растительные и животные белки не всегда уж столь консервативны. Дивергированные области белков предназначены для белок-белковых взаимодействий, это указывает на то, что растительные S ET доменные белки могли бы функционировать в других белковых комплексах, отличных от комплексов животных белков. Хотя и неполная, доступная функциональная информация о SET доменных белках Arabidopsis указывает на то, что эти белки участвуют в регуляции активности хроматина и в эпигенетической наследственности. Первыми двумя генами SET доменных белков, идентифированными при генетическом скринировании, оказались Curly leaf ген (CLF) и ген Medea/независимое от оплодотворения образование семян (MEA/FIS1), которые являются негативными регуляторами, родственными гену E(Z) Drosophila. Будучи SET доменными белками, МЕА, CLF и E(Z) заодно являются также и PcG белками (раздел 2.3. Другие белки из группы polycomb). Мутации гена CLF приводят к изменению морфологии листа и гомеотическим изменениям в развитии цветка. MEA/FIS1 регулирует гаметофит-специфическую экспрессию генов и служит фактором импринтинга, который ингибирует развитие эндосперма без оплодотворения (Schubert et al., 2005). Наоборот, ген trithorax 1 (АТХ1) у Arabidopsis работает как активатор цветочных гомеотических генов, по-видимому, вследствие его способности катализировать метилирование четвертого лизинового остатка в гистоне H3 (H3K4), а это часто служит признаком транскрипционной активности хроматина (Hsieh and Fischer, 2005). Криптонит/гомолог 4 супрессора 3-9 пестролистности (Suppressor of variegation 3-9 homolog 4 (КУР/ SUVH4) идентифицирован как супрессор эпигенетического сайленсинга двух эндогенных генов (Jackson et al., 2002; Malagnac et al., 2002). KYP/SUVH4 катализирует моно- и диметилирование гистона H3 по остатку лизина 9 (H3K9me2/me3) и действует вместе с ДНК-метилтрансферазой СМТЗ для поддержания CpNpG метилирования ряда последовательностей в геноме Arabidopsis. KYP/SUVH4 играет небольшую роль в образовании гетерохроматина (Chan et al., 2005). В отличие от этого гомолог 2 супрессора пестролистности 3-9 (SUVH2), идентифицированный при скрининге компонентов реактивации молчащего трансгена, обладает главной метилирующей активностью, модифицирующей гистон H3 по 9 (H3K9) и 27 (H3K27) остаткам лизина в гетерохроматине Arabidopsis (Naumann et al., 2005). Лизиновые остатки в гистонах Н3 и Н4 могут быть моно-, ди- и триметилированными. Это сильно увеличивает комбинаторную сложность этих модификаций, определяет состояние гетерохроматина у разных организмов. Например, H3K9me3 служит отличительной чертой гетерохроматина у животных и грибов, а у Arabidopsis это — эпигенетический маркер эухроматина. Наоборот, H3K9mel и H3K9me2 — преимущественные маркеры неактивного хроматина у Arabidopsis, а у млекопитающих это показатели эухроматина. Происхождение этих различий и как они соотносятся с постулированным гистоновым кодом следует еще определить. Кроме этого, еще предстоит расшифровать и сильно взаимно перепутанные связи между специфическими модификациями гистонов и характером метилирования (Tariq and Paszkowski, 2004). В отличие от ацетилирования гистонов, которое может динамично регулироваться противоположными активностями HDACs и HATs, метилирование гистонов до недавнего времени рассматривалось как перманентный эпигенетический маркер. Однако недавно у млекопитающих была найдена деметилаза метилированного лизина, LSD1, которая может деметилировать H3K4mel и H3K4me2, но не H3K4me3 (глава 10). В геноме Arabidopsis закодированы четыре предполагаемые LSD гомолога. Это указывает на то, что по-крайней мере некоторые метилирования гистонов у растений могут быть обратимыми.2.3. Другие белки хроматина
Другие белки группы Polycomb
PcG белки сначала были идентифицированы у Drosophila как факторы, необходимые для поддержания репрессии гомеотических генов (глава 11). У животных экспрессия генов подавляется структурно иными PcG белками, объединенными в мультибелковый комплекс. У растений и нематоды С. elegans нет комплекса PRC1, он имеется у Drosophila и млекопитающих. У растений и животных найден комплекс PRC2, он осуществляет преимущественно метилирование 27-го лизинового остатка у гистона H3 (H3K27) с помощью гистон-метилтрансфразной активности S ET домена и PcG белка E(Z). У Arabidopsis гомологи основных компоннтов PRC2 найдены путем скринирования мутантов, полученных для анализа механизмов развития растения. У Drosophila PRC2 компоненты закодированы в виде единичных генов. Наоборот, у растений арабидопсиса эти гены содержатся по крайней мере в составе трех PRC2 комплексов -FIS (fertilization independent seeds, образование семян без оплодотворения), EMF (embryonic flower, эмбриональный цветок) и VRN (vernalization, яровизация), все они различаются по специфичности мишеней их воздействия (Schubert et al., 2005: рис. 11.2). FIS гены идентифицированы при скрининге таких мутантов, у которых происходит частичное развитие семян независимо от оплодотворения. У них основной мишенью является MADS-box, содержащие транскрипционный фактор PHERES (Kohler et al., 2005). Компоненты EMF комплекса выявлены по их общей способности подавлять экспрессию таких цветочных гомеотических генов, как Agamous и Apeiala. Ген VRN2 из семейства VRN идентифицирован по его участию в эпигенетической памяти яровизации, которая определяется как выход семян из состояния покоя под воздействием холода. Растения вынуждены программировать свою репродукцию во время соответствующего сезона, и в областях с умеренным климатом это осуществляется вследствие зацветания только после продолжительного холодового периода. Такая эпигенетическая память зимы нуждается в VRN2, который поддерживает индуцируемую холодом репрессию транскрипции гена, кодирующего ингибитор цветения FLC в последующие периоды при более высоких температурах. У мутантов vrn2 в FLC отсутствует H3K27me2, что согласуется с ролью комплекса PRC2 в метилировании гистонов (Schubert et al., 2005).Компоненты импринтинга
Родительский импринтинг свойствен лишь цветковым растениям и млекопитающим (табл. 9.1), этот эпигенетический феномен характеризуется тем. что материнские и отцовские гены экспрессируются по-разному. С учетом теории родительского конфликта в эволюции импринтинга (глава 19) импринтинг у цветковых растений и животных, по-видимому, отражает тот факт, что у этих организмов существует специфическая материнская ткань, которая поставляет питание для развивающегося зародыша. У млекопитающих это — плацента, а у растений триплоидный эндосперм — дифференцированная ткань, которая содержит один отцовский и два материнских генома (рис. 9.1). Явление родительского импринтинга одного гена впервые было выявлено в эндосперме кукурузы (Allemanand Doctor, 2000). В эндосперме Arabidopsis импринтирована экспрессия двух генов — МЕА и FWA (контролирует время цветения). В этих случаях активируются две материнские копии, по-видимому, вследствие катализируемого DME активного деметилирования CpG сайтов в женском гаметофите (см. раздел 2.1, подраздел «Активное деметилирование CpG и Д Н К гликозилазы»), в то время как отцовская копия неактивна (Autran et al., 2005). Удивительно то, что хотя у животных и растений импринтинг эволюционировал независимо, тем не менее, у тех и у других организмов для импринтинга необходимы метилирование ДНК и PcG белки (Kohler et al., 2005).Ремоделирующие хроматин белки
Switch2/caxapoзy неферментируюшие факторы 2 (SWI2/ SNF2) из консервативного семейства АТФ-зависимых ремоделирующих хроматин факторов способны сдвигать нуклеосомы или уменьшать прочность контактов между гистонами и ДНК. При генетическом скрининге получены данные примерно о 40 SWI2/SNF2 гомологах, закодированных в геноме Arabidopsis ((Plant Chromatin Database). Два из них — фактор 1 уменьшения метилирования ДНК (DDM1, Jeddeloh et al., 1999) и фактор 1 дефекта управлямого РНК метилирования ДНК (DRD1, Kanno et al., 2004) участвуют в регуляции метилирования ДНК. Дефектные по DDM1 мутанты с глобальным уменьшением степени метилирования геномной ДНК и транскрипционной реактивацией определенных молчащих транспозонов и повторяющихся последовательностей обнаруживают ряд серьезных нарушений в морфологии и развитии растений. Это выявляется после нескольких поколений инбридинга гомозиготных ddml растений вследствие накопления эпимутаиий и инсерционного мутагенеза реактивированными у мутанта транспозонами. DDM1 ортолог имеется у млекопиающих (Lymphoid-Specific Helicase (L5H), он важен для глобального CpG метилирования и эмбриогенеза. DRD1 уникален для мира растений и, по-видимому, играет специфическую роль в направляемом РНК метилировании ДНК (раздел 3.4). Мутации в молекуле Морфея (MOM, Amedeo et al., 2000), специфического для растений гена с неполным мотивом АТФ-завимой хеликазы, активируют некоторые повторяющиеся последовательности и не вызывают другие фенотипические изменения. МОМ функционирует синергично, но независимо от DDM1 метилирования ДНК. Это указывает на множественность путей регуляции транскрипции у растений (Tariq and Paszkowski, 2004). Участие в специфических модификациях хроматина трех других белков с предполагаемой функцией ремоделирования хроматина — Splayed (SPD), фактор фотопериодически независимого раннего цветения (PIE) и Pickle (PKL), идентифицированых по их влиянию на развитие соответствующих дефектных мутантов, пока еще не установлено (Wagner, 2003).Факторы сборки хроматина
В то время как SWI2/SNF2 белки, возможно, действуют на собранном хроматине, другие белковые факторы необходимы для восстановления структуры хроматина после репликации и репаративного синтеза ДНК. Комплекс факторов сборки хроматина (CAF), состоящий из трех субъединиц, помогает разместить полусобранные нуклеосомы у репликативной вилки. У Arabidopsis мутации (fasl,fas2) в генах двух больших CAF субъединиц вызывают характерные морфологические аномалии (фасциация, рис. 9.2е), дефекты в репарации ДНК и дерепрессируют повторяющиеся последовательности (Takeda et al., 2004). Это указывает на то, что правильное расположение нуклеосом в хроматине существенно для нормального развития растения и эпигенетического контроля. В то время как утрата CAF субъединиц не нарушает поддерживающее метилирование ДНК, она может приводить к стиранию других эпигенетических сигналов, таких как модификации гистонов. Снижение уровня содержания третьей CAF субъединицы MSI1 не вызывает фасцинирование, но приводит к нарушению формирования семян и различным фенотпическим изменениям (Hennig et al., 2005). Мутация в BRUгене, который не относится ни к одному из генов, кодирующих белки сборки хроматина, приводит к возникновению фенотипа, очень сходного с фенотипом fas мутантов. Возможно, что в сохранении эпигенетической информации и генетической целостности при пострепликативной сборке хроматина участвуют и другие дополнительные факторы (Takeda et al., 2004). Наконец, утрата RPA2, субъединицы белка А репликативного комплекса, вызывает увеличение чувствительности ДНК к повреждениям, транскрипционной дерепрессии и изменение модификации гистонов, но не влияет на характер метилирования ДНК (Elmayan et al., 2005; Kapoor et al., 2005b).Подобные гетерохроматиновым белки
HP1 (гетерохроматиновый белок 1) у Drosophila и млекопитающих и его гомологи у грибов являются компонентами молчащего гетерохроматина. Присоединение НР1 его хромодоменом к метилированному по 9-му лизиновому остатку гистона H3 (H3K9me) способствует распространению состояния замалчивания генов и формированию гетерохроматиновых доменов В геноме Arabidopsis закодирован один-едиственный белок, гомологичный белку НР1 Drosophila. Мутации в этом гене, называемом LHP1 (Gaudin et al., 2001), или Terminal flower 2 (TFL2) (Kotake et al., 2003) приводят к изменению строения растения, развития листа и раннему зацветанию. Хотя фенотип этого мутанта указывает на важную роль в регуляции экспрессии гена, все же мало вероятно, что LHP1 действует на образование репрессированных комплексов хроматина подобно действию НР1 у других организмов. LHP1 у Arabidopsis регулирует функционирование локусов в хроматине, которые не являются мишенями для метилирования ДНК (Kotake et al., 2003; Tariq and Paszkowski, 2004). Таким образом, в результате эволюции LHP1 у растений и НР1 у других организмов выработались разные пути действия этих белков.3. Молекулярные компоненты путей опосредованного PHKi сайленсинга
Современные эпигенетические исследования традиционно сфокусированы на изучении метилирования ДНК и модифицирования гистонов За последние несколько лет стало очевидно, что эти изменения в специфических областях генома могут происходить в результате интеференции РНК. Действительно сегодня уже невозможно рассматривать эпигенетическую регуляцию у многих организмов без участия компонентов аппарата интеферирующих РНК (PHKi) (Matzke and Birchler, 2005). Особенно это касается растений, у которых вклад работы этой машинерии в замалчивание генов гораздо выше, чем у всех других организмов.3.1. Выработка PHKi-зависимого сайленсинга у растений
PHKi и сходные типы замалчивания (сайленсинга) генов представляют собой ответ клеток на двутяжевые РНК (dsPHK). dsPHK гидролизуется РНКаза 111-подобной эндонуклеазой (Dicer) с образованием маленьких РНК, которые и обеспечивают специфичность сайленсинга, комплементарно связываясь с соответствующей последовательностью-мишенью нуклеиновых кислот. Маленькие РНК включаются в мульти-белковые эффекторные комплексы, осуществляющие непосредственно деградацию информационных РНК и подавляют трансляцию (PTGS) или индуцируют модификации хроматина (TGS) в области определенных нуклеотидных последовательностей ДНК. Ключевой компонент этого эффекторного комплекса сайленсинга — белок по названию аргонавт, который связывает маленькие РНК с помощью своего PAZ домена. Индивидуальные белки из семейства белков аргонавтов, которое представляет собой самую большую группу белков, важных для PHKi-направляемого сайленсинга, сообщают функциональную специфичность разным эффекторным (исполнительным) комплексам (Carmel] et al., 2002). РНК-направляемое замалчивание генов участвует в защите от вирусов, контролирует транспозоны и играет существенную роль в развитии растений и животных. Выработка PHKi-направляемого сайленсинга у растений отчасти отражает их коэволюцию с патогенами (РНК-содержащие вирусы, вироиды), которые образуют двутяжевые РНК (dsPHK) при репликации. На самом деле они наряду с транс генами (другой тип «чужеродных» нуклеиновых кислот) оказались бесценными для выявления и изучения разных форм PHKi-направляемого замалчивания генов у растений. Разные пути PHKi-направляемого замалчивания генов продемонстрированы в результате 1. широкого выявления и функциональной диверсификации семейств генов, кодирующих основные компоненты для продуцирования PHKi: в геноме Arabidopsis закодированы четыре DICER-подобные (DCL) белка и десять белков аргонавтов (AGO); 2. обнаружения разных по длине и функционированию маленьких РНК, включая короткие, состоящие из 21 нуклеотидного остатка, интерферирующие РНК (siPHK), образующиеся из вирусов и трансгенов, и несколько типов эндогенных маленьких РНК (21-24 нуклеотидные микроРНК; 21-нуклеотидные трансдействующие siPHK и 24—26-членные гетерохроматиновые siPHK; 3. выявления разных типов генного сайленсинга, осуществляемого разными маленькими РНК: 1) PTGS (посттранскрипционный сайленсинг) по механизму деградации информационных РНК или путем подавления трансляции; 2) TGS (транскрипционный сайленсинг) связан с такими модификациями, как цитозиновое метилирование ДНК и метилирование гистонов; 4. обнаружения важной роли PTGS в защите от вирусов, это связано с разными вирусными белками, подавляющими разными способами замалчивание генов; 5. обнаружения таких процессов, как не клеточноавтономный сайленсинг и транзитивность (раздел 3.2, подраздел «Не клеточно-автономный сайленсинг и транзитивность»), которые обусловлены РНК-зависимыми РНК-полимеразами, шесть из которых закодированы в геноме Arabidopsis. Все это обсуждается при рассмотрении трех основных путей РНК-направляемого замалчивания генов у растений (рис. 9.3а-в). Следует иметь в виду, что эти пути взаимно перекрещиваются друг с другом. Их функционально различные компоненты приведены в табл. 9.2.3.2. Путь 1: связанное с трансгенами посттранскрипционное и индуцированное вирусами замалчивание генов (PTGS/VICS)
Направляемое PHKi замалчивание генов, индуцированное трансгенами и вирусами, изначально функционировало как защитная система хозяина от чужих и инвазивных нуклеиновых кислот в виде соответствующих вирусных компонентов, транспозонов и трансгенов. Рис. 9.3. Пути РНК-обусловленного сайленсинга у растений
Несмотря на то, что отдельные элементы и пути сайленсинга могут перекрываться или быть общими, все же различают три основных пути сайленсинга, они отличаются по источникам двутяжевых РНК, классу маленьких РНК, природе мишеней-последовательностей и характеру сайленсинга. На рисунке эффекторные комплексы сайленсинга, содержащие белки аргонавты, показаны в виде светлосерых шариков. Желтыми прямоугольниками помечены процессы, протекающие в ядре. Детали и названия регуляторных элементов описаны в тексте и табл. 9.2. Специфические растительные белки отмечены зеленым. PTGS — посттранскрипционное замалчивание генов, VIGS — индуцированное вирусом замалчивание генов, TGS — транскрипционное замалчивание генов, RdDM — направляемое РНК метилирование ДНК, IR — инвертированные повторы, AS — антисенс, антисмысловая последовательность, vRdRP — вирусная РНК-зависимая РНК-полимераза, аРНК — аберрантная РНК, siPHK — короткая интерферирующая РНК, RISC — РНК-индуцированный комплекс сайленсинга (взято с изменениями из работы Meins et al., 2005)
Рис. 9.3. Пути РНК-обусловленного сайленсинга у растений
Несмотря на то, что отдельные элементы и пути сайленсинга могут перекрываться или быть общими, все же различают три основных пути сайленсинга, они отличаются по источникам двутяжевых РНК, классу маленьких РНК, природе мишеней-последовательностей и характеру сайленсинга. На рисунке эффекторные комплексы сайленсинга, содержащие белки аргонавты, показаны в виде светлосерых шариков. Желтыми прямоугольниками помечены процессы, протекающие в ядре. Детали и названия регуляторных элементов описаны в тексте и табл. 9.2. Специфические растительные белки отмечены зеленым. PTGS — посттранскрипционное замалчивание генов, VIGS — индуцированное вирусом замалчивание генов, TGS — транскрипционное замалчивание генов, RdDM — направляемое РНК метилирование ДНК, IR — инвертированные повторы, AS — антисенс, антисмысловая последовательность, vRdRP — вирусная РНК-зависимая РНК-полимераза, аРНК — аберрантная РНК, siPHK — короткая интерферирующая РНК, RISC — РНК-индуцированный комплекс сайленсинга (взято с изменениями из работы Meins et al., 2005)
Происхождение и процессирование двутяжевых РНК ( dsPHK)
Трансгенные конструкции можно ввести в растительный геном в смысловой или антисмысловой ориентации или в виде инвертированных повторяющихся последовательностей ДНК. Вирусы могут иметь геномы, представленные одно- или двутяжевыми ДНК или РНК. Поэтому dsPHK могут возникать разными путями. В принципе антисмысловые транскрипты могут комплементарно спариваться с информационными РНК-мишенями с образованием двутяжевых РНК. Транскрипция инвертированных повторов ДНК может приводить к образованию шпилечных РНК. Вирусные РНК, кодирующие собственную РНК-зависимую РНК-полимеразу (vRdRP) и реплицирующиеся с образованием двутяжевых интермедиатов РНК, включаются в игру прямо на уровне двутяжевых РНК. Наоборот, смысловые трансгены и ДНК-содержащие вирусы как, например, джеминивирусы, для образования двутяжевых РНК нуждаются в клеточной РНК-зависимой РНК-полимеразе RDR6 и других генетически идентифицированных факторах (SDE3, SGS3 и WEX; табл. 9.2). При образовании субстратов для RDR6 транскрипты или смысловые трансгены и вирусные ДНК должны быть в известном смысле аберрантными, например, без 5’ cap или полиаденилатного хвоста (Meins et al., 2005). Активность DCL, необходимая для процессирования dsPHK с образованием siPHK при PTGS, еще не идентифицирована (DCLX). Анализ dell мутантов с частично утраченными функциями показал, что DCL1, по-видимому, не вовлечен в эту стадию процессинга. Специфический растительный белок HEN 1 метилирует 3’-нуклеотид у маленьких РНК, защищая их от уридилирования и последующей деградации (Li et al., 2005). DCL2 участвует в образовании siPHK из некоторых, но не всех, вирусных РНК (Xie et al., 2004). PTGS и VIGS приводят к образованию двух разных по величине и функциональному значению классов siPHK, состоящих из 21-22 нуклеотидов и 24-26 нуклеотидов, соответственно (Baulcombe, 2004). В целом, считается, что 21-членные siPHKs участвуют в растеплении иРНК, а 24-26-членные, называемые гетерохроматиновыми siPHK, вызывают эпигенетические модификации в гомологичных последовательностях ДНК (TGS; см. раздел 3.4). Вслед за осуществленным DCL процессингом дуплекс siPHK раскручивается и антисмысловая цепочка взаимодействует с одним из белков из семейства аргонавтов с образованием комплекса индуцированного РНК сайлесинга (RISC). RISC, запрограммированный siPHK, может затем эндонуклеолитически гидролизовать мРНК-мишени в одном единственном месте примерно в середине комплементарного комплекса siPHK-мРНК. У животных это расщепление катализируется Ago2 «slicer» (см. главу 8). У Arabidopsis эту функцию в трансгенном PTGS выполняет белок AGOl (Baumberger and Baulcombe, 2005). Вслед за нуклеолитическим расщеплением отдельный 3’-фрагмент мРНК деградируется в направлении от 5’ к 3’ концу экзонуклеазой AtXRN4 (Souret et al., 2004), а 5’-фрагмент, по-видимому, гидролизуется экзосомой в направлении от 3’- к 5’-концу.Не клеточно-автономный сайленсинг и транзитивность
PTGS у растений обладает двумя особенностями, которые обусловлены активностью РНК-зависимой РНК-полимеразы RDR6: не клеточно-автономным сайленсингом и транзитивностью (рис. 9.3а). В первом случае индуцирующие PTGS сигнальные РНК перемещаются из клеток, в которых они возникли, в соседние через плазмодесмы или, как это изначально было показано в опытах с прививками, по сосудистой системе и вызывают специфичное к нуклеотидной последовательности замалчивание генов в довольно отдаленных местах (Voinnet, 2005). Небольшие мобильные РНК, являющиеся системными сигналами замалчивания генов, могли бы выполнять двойственную функцию в развитии растения: осуществлять коммуникацию между клетками и координировать их активность в разных, в том числе и отдаленных частях растения. Это предположение подкреплено открытием микроРНК (miPHK; важны для развития, раздел 3.3) и небольшого связывающего Маленькие РНК белка в соке флоэмы, который служит основным транспортером метаболитов по сосудистой системе растения (Yoo et al., 2004). Транзитивность представляет собой образование вторичных siPHK, соответствующих определенным нуклеотидным последовательностям, локализованным вне первичных мишеней. В этом случае РНК-зависимая РНК-полимераза катализирует синтез вторичных двутяжевых РНК на трансгенных или вирусных матричных РНК с использованием в качестве праймеров первичных siPHK. В результате действия дайсера образуются вторичные siPHK, которые преумножают реакцию сайленсинга и, когда речь идет о вирусных РНК, увеличивают устойчивость растений к вирусной инфекции (\binnet, 2005). Другим единственным организмом, у которого выявлены не клеточно-автономное замалчивание генов и транзитивность. является нематода С. elegans (глава 8), имеющая предполагаемую РНК-зависимую РНК-полимеразу, которой нет у млекопитающих и DrosophilaВирусные супрессоры замалчивания генов
Растительные вирусы — не только индукторы и мишени замалчивания генов, у них есть белки, которые могут подавлять сайленсинг (Voinnet, 2005). Это укрепляет идею о том, что PTGS служит природной защитой от вирусов, эти супрессорные белки стоят на вооружении контрзащитной «стратегии» патогена. В геноме большинства вирусов закодирован, по-крайней мере, один белок, подавляющий замалчивание генов, который работает на определенном этапе PTGS после процессинга двутяжевых РНК. Подавление PTGS вирусом четко наблюдается у крапчатой сои, у которой темная окраска есть результат обратимости естественного PTGS, т.е. реактивации гена, отвечающего за образование пигмента (рис. 9.2д) (Senda et al., 2004). Вирусные супрессоры PHKi недавно найдены также у вирусов насекомых и животных ретровирусов (Lecellier et al., 2005; Voinnet, 2005).3.3 Путь 2: регуляция развития растений miPHK и транс-действующими siPHK
Открытие эндогенных популяций miPHK у растении и животных знаменовало новую эру в исследовании биологии развития и обусловленного PHKi замалчивания генов (Bartel, 2004). miPHK замалчивают экспрессию генов путем комплементарного спаривания с информационными РНК-мишенями и индукции расщепления мРНК или ингибирования трансляции. На важную роль miPHK в развитии растений указывает и тот факт, что многие необходимые для биогенеза miPHK и сайленсинга гены (в том числе DCL1, AGOl, HEN1, HYL1 и HST) были обнаружены при скринировании мутантов с дефектами развития, у них и было выявлено накопление miPHK. Фенотипы мутантов, дефектных по этим белкам, указывали на разнообразную роль miPHK в функционировании меристемы, полярности органов, развитии сосудистой системы, структуре цветка и ответах растения на стресс и гормональное воздействие (Kidner and Martienssen, 2005). Недавно установлено, что miPHK участвуют в биогенезе новых типов маленьких РНК и транс-действующих siPHK.Роль и биогенез микроРНК
МикроРНК изначально были получены при клонировании разделенных по размеру маленьких РНК, содержащих 18-28 нуклеотидных остатков. Их высокая степень комплементарности к мРНК-мишеням у растений заметно облегчила идентификацию дополнительных микроРНК при компьютерном анализе. Таким путем у арабидопсиса найдены 92 локуса. в которых закодировано 27 определенных микроРНК, примерно столько же выявлено и у риса. Экспрессия многих микроРНК регулируется средой и программой развития растения. Примерно 50% их мишеней у арабидопсиса — факторы транскрипции, многие из которых являются модуляторами образования меристемы и идентичности. Это было установлено еще до их идентификации в качестве мишеней микроРНК. В отличие от этого, у животных микроРНК не всегда адресованы мишеням, кодирующим факторы транскрипции, а регулируют разные гены в клетке. Два важных белка микроРНКового пути у арабидопсиса, DCL1 и AGOl, саморегурегулируются с помощью микроРНК с участием негативной модуляции по принципу обратной связи (Kidnerand Martienssen, 2005). У эукариот многие микроРНК эволюционно консервативны (Axtell and Bartel, 2005). Примечательно, что у цветковых, голосеменных и более примитивных растений мРНК группы факторов транскрипции, регулирующих образование меристемы и асимметрию латеральных органов, сохранили совершенную комплементарность к узнающим их микроРНК. Эта особенность сохранена по-крайней мере в течение 400 миллионов лет (Floyd and Bowman, 2004). МикроРНК закодированы в таких зонах генома, которые расположены между генами, кодирующими белки, или в интронах. Они возникают из несовершенных шпилечных предшественников РНК размером от 70 до 300 и более пар оснований, которые транскрибируются ДНК-зависимой РНК-полимеразой II. Процессинг предшественников растительных микроРНК в ядре происходит в несколько этапов. Сначала концы пре-микроРНК удаляются ядерной DCL1. Для этого необходим связывающийся с двутяжевыми РНК белок HYL1, который был выделен при анализе фенотипических мутантов с дефектным гормональным ответом (Han et al., 2004; Vasquez et al., 2004a). Затем микроРНК дуплекс (miR/miR*, рис. 9.36) высвобождается под действием DCL1 и его 3’-конец метилируется с помощью HEN 1 (раздел 3.2, подраздел «Происхождение и процессинг двутяжевых РНК»). Для транспорта дуплекса miR/miR* из ядра в цитоплазму нужен HASTY (HST), гомолог животного экспортина 5 (Park et al., 2005). Зрелые микроРНК найдены также и в ядерной фракции, может быть в ядре некоторые из них могут осуществлять эпигенетические модификации. МикроРНК к сплайсированным растущим цепям транскриптов транскрипционных факторов индуцируют неким неизвестным путем цитозиновое метилирование ДНК в последовательностях, расположенных ниже гена-мишени (Schubert et al., 2005). Биогенез микроРНК у животных происходит иначе, у них есть только один дайсер, который локализован в цитоплазме, и вторая РНК-аза III-типа, Drosha, в ядре. Drosha вместе со связывающим двутяжевые РНК белком Pasha (у растений их гомологов нет) отщепляет концы от пре-микроРНК. Затем такие пре-микроРНК перемещаются в цитоплазму экспортином 5 и процессируются окончательно дайсером с образованием зрелых микроРНК (Du and Zamore, 2005, Ют, 2005).Растительные микроРНК направляют расщепление мРНК
В целом, животные микроРНК неполностью комплементарны к мРНК-мишеням, и они подавляют трансляцию, связываясь с многими сайтами в 3’-нетранслируемых областях (UTR). В отличие от этого почти совершенная комплементарность растительных микроРНК к кодирующим участкам мРНК-мишеней способствует расщеплению мРНК, по-видимому, подобно siPHK. Однако существуют исключения из этих «правил». Так, например, растительная miR172 способна блокировать трансляцию, а некоторые животные микроРНК могут участвовать в расщеплении мРНК-мишеней (Du and Zamore, 2005). AGO I — главный белок из семейства белков аргонавтов и нарезающий (слайсер) мРНК компонент в программированном микроРНК RISC у арабидопсиса (Baumberger and Baulcombe, 2005). AGOl был найден еще до открытия микроРНК при скрининге мутантов Arabidopsis с дефектным развитием листьев (Carmell et al., 2002). Название аргонавты было инспирировано фенотипом agol мутантов, которые были похожи на небольших кальмаров из-за их узких нитевидных листьев. У agol мутантов в апикальной меристеме побегов обнаруживаются такие же дефекты, как у дефектных мутантов PNH/ZLL/AGO10 (табл. 9.2), они сходны с AGOl, но еще неизвестно, нужны ли они для PTGS (Vaucheret et al., 2004). В меристемах растений белки AGO играют существенную роль в поддержании «стволовости» клеток (Carmell et al., 2002: Kidner and Martienssen, 2005).Транс-действующие siPHK
Эндогенные транс-действующие siPHK (ta-siPHK) — новый тип маленьких РНК, которые недавно были открыты у Arabidopsis. ta-siPHK, гидролизующие свои мРНК-мишени, обладают свойствами как siPHK, так и микроРНК. Подобно siPHK синтез двутяжевых РНК-предшественников ta-siPHKs зависит от RDR6 и SGS3. Как и микроРН К, ta-siPHК образуются в таких участках генома, которые мало сходны с их мРНК-мишенями. Для образования правильных ta-siPHK, комплементарных мРНК-мишеням, микроРНК настраивает фазовое расщепление предшественников двутяжевых РНК с помощью DCL4 (рис. 9.36) (Allen et al., 2005; Gasciolli et al., 2005). ta-siPHK приписывают регуляторную роль в определении времени развития растения. Побег цветкового растения во время развития проходит две фазы перемен: вегетативную фазу с переходом от молодого в зрелое состояние побега и репродуктивную фазу, которая сопровождается ростом цветочных ветвей вместо вегетативных (рис. 9.1). В то время как индукция цветения изучена генетически довольно хорошо, вегетативная фаза перемен в побеге исследована гораздо хуже. Один из белков аргонавтов, ZIPPY/AG07, играет специализированную роль в таком фазовом переходе. При скрининге мутантов с преждевременными изменениями в вегетативной фазе развития побега, аналогичных zip, ago7 мутантам, были выявлены два гена (RDR6и SGS3), которые важны для PTGS (рис. 9.36) (Peregrine et al., 2004). Последующий анализ показал, что некоторые гены с контролируемой увеличенной экспрессией у rdrb и sgs3 мутантов замалчиваются посттранскрипционно с помощью ta-siPHK (Vazquez et al., 2004b). Эти данные свидетельствуют о том, что компоненты PTGS важны не только для защиты растения от вирусов и замалчивания трансгенов, но также и для контроля за временем включения пусковых механизмов развития растения. Пока еще не известно, есть ли у животных такие ta-siPHK.3.4. Путь 3: связанный с трансгенами транскрипционный сайленсинг, направляемое РНК метилирование ДНК и образование гетерохроматина
Современные концепции обусловленного PHKi транскрипционного замалчивания генов выросли из более ранних исследований гомологичного замалчивания генов, запускаемого множественными копиями промоторных областей генома, и из результатов изучения направляемого РНК метилирования ДНК (Matzke and Matzke, 2004). Последующее изучение PHKi-зависимого образования гетерохроматина у делящихся дрожжей (главы 6 и 8) и индуцированных siPHK TGS в клетках млекопитающих заметно расширили представления о филогенетических масштабах этих процессов и подтвердили их перекрывание с PHKi.Направляемое РНК метилирование ДНК (RdDM)
Впервые RdDM наблюдали у растений табака, зараженных вироидами (Wassenegger et al., 1994). Вироиды — небольшие патогены растений, содержащие только некодирующие белки циклические РНК, состоящие из нескольких сотен нуклеотидных остатков. В изначальных экспериментах было обнаружено, что реплицирующиеся вироиды запускают de novo метилирование вироидных кДНК,интегрированных в геном табака в качестве трансгенов. При изучении таких трансгенных систем было установлено, что для RdDM необходимы двутяжевые РНК, которые процессируются с возникновением маленьких РНК (признак PHKi). Реплицирующиеся исключительно в цитоплазме РНК-содержащие вирусы индуцируют метилирование гомологичных участков в ядерной ДНК. Это указывало на то, что маленькие РНК, возникающие при PTGS, способны проникать в ядро и индуцировать в нем эпигенетические изменения. Содержащие промоторные последовательности двутяжевые РНК могут направлять метилирование ДНК и вызывать транскрипционное замалчивание узнаваемых ими промоторов-мишеней (Mathieu and Bender, 2004: Matzke et al., 2005). У растений РНК индуцируют специфическое de novo метилирование цитозиновых остатков в разных нуклеотидных последовательностях ДНК преимущественно в областях комплементарного взаимодействия. Считается, что в результате этого специфического спаривания РНК с ДНК возникает субстрат для de novo метилирования ДНК, однако это еще требует экспериментальных доказательств. В то время как асимметричное CpNpN метилирование не поддерживается после удаления триггерной РНК, симметричные CpG и CpNpG метилирования сохраняются без РНК в области разных промоторов. Различия в эффективности поддерживающих метилирований ДНК могут быть связаны с разным составом нуклеотидных последовательностей или разным характером модификаций гистонов. Молекулярные компоненты, необходимые для RdDM и TGS, выявлены в результате скрининга соответствующих трансгенов и эндогенных генетических систем. Трансгенные системы транскрибируемых инвертированных повторов или вирусов поставляют двутяжевые РНК, гомологичные соответствующим локусам ДНК-мишеней. В этом отношении информативными эндогенными генами при генетическом скрининге оказались ген фосфорибозилантранилат изомеразы (PAI) (Mathieu and Bender, 2004) и SUPERMAN ген (Chan et al., 2005). Эти гены выполняют роль мишеней или индукторов RdDM и TGS. Например, в семействе из четырех PAI генов два представляют собой инвертированные повторы. Транскрипция инвертированных повторов в области непосредственно вышестоящего промотора приводит к появлению двутяжевых РНК, которые могут специфично связываться с синглетными копиями PAI генов для метилирования ДНК и сайленсинга.Специфичная растительная машинерия направляемого РНК метилирования ДНК ( RdDM)
Почти всегда консервативные ДНК-метилтрансферазы и гистон-модифицирующие ферменты необходимы для RdDM (разделы 2.1 и 2.2). De novo метилирование цитозиновых остатков в различных нуклеотидных контекстах катализируется ДНК-метилтрансферазой из класса консервативных DRM ферментов. Консервативная МЕТ1 и специфичная для растений ДНК-метилтрансфераза СМТЗ осуществляют прежде всего поддерживающее метилирование соответственно CpG и CpNpG сайтов, хотя они в небольшой степени могут быть вовлечены и в de novo метилирование. Консервативная гистоновая деацетилаза HDA6 и SWI2/SNF2 белок DDM1 помогают поддерживать CpG метилирование в некоторых локусах. Гистоновая метилтрансфераза KYP/SUVH4 вовлечена в поддержание локус-специфичного CpNpG метилирования, индуцированного РНК (Chan et al., 2005). К удивлению, недавно было найдено, что для RdDM необходима специфичная для растений РНК-полимераза, называемая pol IV. У всех изученных до сих пор эукариот имеются три ДНК-зависимых РНК-полимеразы (pol 1, pol II и pol III), которые содержат несколько субъединиц, закодированных в определенных генах. Первое свидетельство о существовании pol IV появилось в результате анализа нуклеотидной последовательности ДНК генома, когда были выявлены гены, кодирующие две самые большие субъединицы растительной уникальной, атипичной РНК-полимеразы. Существуют два функционально различных комплекса pol IV с самыми крупными специфичными уникальными субъединицами, каждая из которых взаимодействует с общей для них второй крупной субъединицей, pol IVa необходима для образования siPHK, по-видимому, изначально в результате транскрипции генов-мишеней (Herr et al., 2005; Onodera et al., 2005). RDR2 использует исходный транскрипт в качестве матрицы для синтеза двутяжевои РНК. которая процессируется DCL3 — ядерной активностью, которая специализирована на образовании 24-членных гетерохроматиновых siPHK с транспозонов и повторяющихся последовательностей генома (Xie et al., 2004). После образования siPHK фермент pol IVb вместе со специфичным для растений SWI2/SNF2-noflo6HbiM белком DRD1 формируют сигнал для метилирования ДНК (Kanno et al., 2005), возможно это делается в кооперации с AG04 (рис. 9.3в) (Chan et al., 2005). Пока не известно, действительно ли pol IVb транскрибирует РНК, ее главная роль состоит в формировании структуры хроматина, которая разрешает ДНК-метилтрансферазам катализировать de novo цитозиновое метилирование в определяемых siPHK сайтах. Хотя у других эукариот нет субъединиц pol IV, у делящихся дрожжей две субъединицы pol II, транскрибирующие предшественники мРНК, важны для направленного РНК образования гетерохроматина (главы 6 и 8). Несмотря на то, что направленные на промотор siPHK могут индуцировать TGS в человеческих клетках, пока еще точно не ясно, сопровождается ли это заметным метилированием ДНК (Kawasaki et al., 2005; Ting et al., 2005). Многие белки, необходимые для RdDM у растений, найдены только у представителей растительного мира (рис. 9.3в). Таким образом, если RdDM и происходит регулярно у млекопитающих, его механизмы и белковые участники должны быть иными, чем у растений.Замалчивание эндогенных генов РНК-зависимым транскрипционным сайленсингом (TGS)
Многие транспозоны и повторяющиеся последовательности ДНК, включая наборы 5S рДНК и богатые транспозонами области гетерохроматина в хромосоме 4 Arabidopsis замалчиваются транскрипционно и метилируются по PHKi-направляемому механизму (Lippman and Martienssen, 2004; Chan et al., 2005). Эндогенные ДНК-мишени отражают естественную роль РНК-направляемого TGS в подавлении транспозиции и упаковке нуклеотидных повторов в гетерохроматине. Однако содержащие вставки транспозонов растительные гены могут сами по себе становиться мишенями направляемых PHKi сайленсинга и метилирования ДНК. Например, возникшие из транспозонов повторы в промоторе FWA гена цветка Arabidopsis служат мишенями для соответствующих siPHK (Lippman and Martienssen, 2004) и осуществляют замалчивание этого гена в вегетативных тканях, где его работа вовсе не нужна. У некоторых растений Arabidopsis элемент Ми в интроне FLC гена (репрессор цветения) делает этот ген доступным для репрессивных модуляций хроматина, направляемых siPHK, возникшими из диспергированных копий Ми (Liu et al., 2004). В результате сниженная экспрессия гена FLC может ускорять цветение, что может иметь адаптивное значение при определенных условиях среды. Поскольку многие растительные гены имеют транспозонные вставки в области или поблизости от промоторов или в интронах, такая регуляция генной активности может быть довольно распространенной в мире растений. Чем больше мы узнаем об эпигенетической регуляции, тем все более подтверждается идея Барбары МакКлинток о том, что транспозоны действуют как контрольные элементы хозяйских генов и развития (McClintock, 1956).4. Эпигенетическая регуляция без участия РНК
Несмотря на специфичность действия маленьких РНК, они все же не обеспечивают все эпигенетические модификации у растений. Например, МОМ белок с частичным SNF2 доменом не участвует в PHKi-направляемом TGS. Также нет и доказательств того, что у растений PcG белки направляются к своим генам-мишеням маленькими РНК. Другие типы сигналов такие, как гомологичное спаривание нетранскрибируемых повторов или специфические нуклеотидные последовательности, могли бы обусловливать образование гетерохроматина и привлекать ДНК-метилтрансферазы. Например, вся описанная PHKi машинерия не нужна для метилирования ДНК и гистонов у гриба Neurospora, у которого ТА-богатые сегменты служат предпочтительными мишенями для модификации (глава 6). Более того, у делящихся дрожжей существуют пути образования гетерохроматина, независимые от PHKi (главы 6 и 8). Не известно, вовлечена ли PHKi в такой необычный феномен, как парамутирование. Парамутирование происходит, когда некоторые аллели, называемые парамутагенными, накладывают эпигенетический отпечаток (импринт) на восприимчивые (парамутабельные) аллели. Эпигенетический импринт наследуется через мейоз и сохраняется даже после того, как две взаимодействующие аллели сегрегируют в потомстве. Парамутирование — нарушение правила Менделя, согласно которому аллели сегрегируют неизменными. Парамутирование впервые наблюдали десятки лет назад у кукурузы и томатов, однако его механизм(ы) оставался неизвестным. Подобный парамутированию феномен недавно наблюдали у млекопитающих. Значит, это явление не является уникальным, свойственным только лишь представителям растительного царства (Chandler and Stam, 2004). Локус В у кукурузы — один из наиболее изученных случаев парамутирования, примерно на расстоянии в 100 т.о. от старта транскрипции он содержит серии прямых повторов, которые неизвестным пока образом участвуют в парамутировании. Хотя при этом нельзя полностью исключать базирующийся на РНК сайленсинг, рассматриваются и некие альтернативные механизмы парамутирования, основанные на спаривании аллелей (Stam and Mittelsten Scheid, 2005).5. Перспективы
В этой главе мы рассмотрели то, что известно об основных эпигенетических закономерностях у растений и как они соотносятся с эпигенетической регуляцией у других организмов. Несомненно, некоторые черты эпигенетического контроля у растений и других организмов довольно сходны, однако в ходе эволюции растения выработали свои специфические особенности и инновации. Это связано с уникальными аспектами развития растений и их экстраординарной способностью выживать и успешно размножаться в непредсказуемых условиях среды. Среди всех специфичных инноваций у растений четко выделяется врожденная система обратимых эпигенетических модификаций, которые, по-видимому, играют ключевую роль в пластичности развития и адаптивности растений. Способность к индукции или стиранию репрессивных модификаций в неделящихся клетках, во-первых, с использованием RdDM и модификаций гистонов и, во-вторых, благодаря активности ДНК-гликозилаз DME и ROS1 позволяет осуществлять эпигенетическое репрограммирование без нарушения циклов репликации ДНК. Довольно простое стирание эпигенетических маркеров с растительного генома, по-видимому, и определяет относительную простоту клонирования целого растения из единичной соматической клетки. Тем не менее, индукция и удаление эпигенетических маркеров не являются совершенными и униформными у индивидуального растения, которое и формирует эпигенетическую вариабельность в популяциях клонированных предполагаемых генетически идентичных растений. Такая сомаклональная изменчивость может быть использована в селекции растений. Аналогичным образом дифференциальное наследование эпигенетических свойств при половом размножении может приводить к эпигенетической вариабельности природных популяций. Отбор может действовать на эту вариабельность путем фиксации специфических эпиаллелей, которые могут иметь адаптивное значение. Как было описано, в процессе яровизации сигналы среды могут вызывать эпигенетические модификации в растении и изменять его физиологические ответы. Таким образом, растения могут «заучить», какие в клетках меристемы побега изменения, вызванные средой и стрессом, попадут в зародышевую линии и являются адаптивными. Определение всего набора условий, при которых эпигенетические изменения возникают спонтанно или запрограммированно, выявит много нового относительно биологических функций модификаций. Расшифровка механизмов мейотического наследования эпигенетических маркеров у растений в конечном счете позволит ученым манипулировать ими для совершенствования сельскохозяйственных культур и садоводства. В ответ на изменения среды, под влиянием эволюции и селекции растения претерпели многие генетические изменения. Полиплоидизация и гибридизация могут вносить большой вклад в эпигенетические изменения благодаря пока еще плохо изученным процессам геномного шока, ответа на необычный стресс, приводящий к обширной мобилизации транспозонов (McClintock, 1983) Происхождение гетерозиса, природа значительного превосходства гибридов по сравнению с исходными родительскими линиями, пока еще остаются неизвестными, однако, по-видимому, в это вовлечены эпигенетические изменения, вызванные комбинацией двух относительно родственных, но определенно разных геномов Подобным образом, полиплоидизация объединяет и (или) преумножает целые геномы с бесчисленными возможностями для эпигенетических изменений. Изучение эпигенетических последствий полиплоидизации у растений может помочь понять и нашу собственную эволюционную историю, которая включает в себя дупликации двух целых геномов (Furlong and Holland, 2004). Ясно, что даже на сегодняшнем уровне знаний, эпигенетика растений — «кудесников эпигенетической регуляции» может быть весьма информативной для биологии человека.Литература
Adams K.L. and Wendel J.F. 2005. Polyploidy and genome evolution in plants. Curt. Opin. Plant Biol. 8: 135-141. Alleman M and Doctor J. 2000. Genomic imprinting in plants: Observations and evolutionary implications. Plant Mol. Biol. 43: 147-161. Allen E., Xie Z., Gustafson A.M., and Carrington J.C. 2005. mi-croRNA-directed phasing during trans-acting siRNA biogenesis in plants. Cell 121: 207-221. Amedeo P., Habu Y., Afsar K., Mittelsten Scheid O., and Paszkowski J. 2000. Disruption of the plant gene MOM releases transcriptional silencing of methylated genes. Nature 405: 203-206. Autran D., Huanca-Mamani W., and Vielle-Calzada J.P. 2005. Ge nomic imprinting in plants: The epigenetic version of an Oedipus complex. Curr. Opin. Plant Biol. 8: 19-25. Axtell M.J. and Bartel D.P. 2005. Antiquity of microRNAs and their targets in land plants. Plant Cell 17: 1658-1673. Bartel D.P. 2004. MicroRNAs: Genomics, biogenesis, mechanism, and function. Cell 116: 281-297. Baulcombe D.C. 2004. RNA silencing in plants. Nature 431: 356-363. Baumberger N. and Baulcombe D.C. 2005. Arabidopsis ARGO-NAUTE1 is an RNA sheer that selectively recruits microRNAs and short interfering RNAs. Proc. Natl. Acad. Sci. 102: 11928-11933. Baumbusch L.O., ThorstensenT., Krauss V., Fischer A., Naumann K., Assalkhou R., Schulz 1., Reuter G., and Aalen R.B. 2001. The, Arabidopsis thaliana genome contains at least 29 active genes encoding SET domain proteins that can be assigned to four evo-lutionarily conserved classes. Nucleic Acids Res. 29: 4319-4333. Burch-Smith T.M., Anderson J.C., Martin G.B., and Dinesh-Kumar S. P. 2004. Applications and advantages of virus-induced gene silencing for gene function studies in plants. Plant J. 39: 734-746. Carmell M.A., Xuan Z., Zhang M.Q., and Flannon G.J. 2002. The Arg-onaute family: Tentacles that reach into RNAi, developmental control, stem cell maintenance, and tumorigenesis. Genes Dev. 16: 2733- 2742. Chan S.W.-L., Henderson I.R., and Jacobsen S.E. 2005. Gardening the genome: DNA methylation in Arabidopsis thaliana. Nat. Rev. Genet. 6: 351-360. Chandler V.L., and Stam M. 2004. Chromatin conversations: Mechanisms and implications of paramutation. Nat. Rev. Genet. 5: 532-544. Chandler V.L., Eggleston W.B., and Dorweiler J.E. 2000. Paramutation in maize. Plant Mol. Biol. 43: 121-145. Choi Y., Gehring M., Johnson L., Hannon M., Harada J.J., Goldberg R.B., Jacobsen S.E., and Fischer R.L. 2002. DEMETER, a DNA gly-cosylase domain protein, is required for endosperm gene imprinting and seed viability in Arabidopsis. Cell 110: 33-42. Cubas P., Vincent C, and Coen E. 1999. An epigenetic mutation-responsible for natural variation in floral symmetry. Nature 401: 157-161. Du T. and Zamore P.D. 2005. microRNAPrimer: The biogenesis and function of micro RNA. Development 132: 4645-4652. Elmayan T, Proux E, and Vaucheret H. 2005. Arabidopsis RPA2: A genetic link among transcriptional gene silencing, DNA repair, and DNA replication. Curr. Biol. 15: 1919-1925. Fedoroff N.V and Chandler V1994. Inactivation of maize transpos-able elements. In Homologous recombination and gene silencing in plants (ed J. Paszkowski), pp. 349-385. Kluwer Academic Publishers, Dordrecht, The Netherlands. Floyd S.K. and Bowman J.L. 2004. Gene regulation: Ancient mi-croRNA target sequences in plants. Nature 428: 485-486. Furlong R.F. and Holland P.W. 2004. Polyploidy invertebrate ancestry: Ohno and beyond. Biol. J. Linnean Soc. 82: 425-430. Gasciolli V, Mallory A.C., Bartel D.P., and Vaucheret H. 2005. Partially redundant functions of Arabidopsis DICER-like enzymes and a role for DCL4 in producing trans-acting siRNAs. Curr. Biol. 15: 1494- 1500. Gaudin V, Libault M., Pouteau S., Juul T, Zhao G., Lefebvre D., and Grandjean O 2001. Mutations in LIKE HETEROCHROMATIN PROTEIN 1 affect flowering time and plant architecture in Arabidopsis. Development 128: 4847-4858. Gong Z., Morales-Ruiz T, Ariza R.R., Roldan-Arjona T, David L., and Zhu J.K. 2002. ROSI, a repressor of transcriptional gene silencing in Arabidopsis, encodes a DNA glycosylase/lyase. Cell 111: 803-814. HanM.H., Goud S., Song L., and Fedoroff N. 2004. The Arabidopsis double-stranded RNA-binding protein HYL1 plays a role in microRNA-mediated gene regulation. Proc. Natl. Acad. Sci. 101: 1093-1098. Heitz E. 1928. Das Heterochromatin der Moose. I. Jahrb. Wiss. Bot. 69: 762-818. Hennig L., Bouveret R., and Gruissem W. 2005. MSll-like proteins: An escort service for chromatin assembly and remodeling complexes. Trends Cell Biol. 15: 295-302. Herr A.J., Jensen M.B., Dalmay T, and Baulcomte D.C. 2005. RNA polymerase IV directs silencing of endogenous DNA Science 308: 118-120. Hsieh T.-F. and Fischer R.L. 2005. Biology of chromatin dynamics. Annu. Rev. Plant Biol. 56: 327-351. Hung M.S. and Shen C.-K. 2003. Eukaryotic methyl-CpG-binchng domain proteins and chromatin modification. Eukaryot. Cell 2: 841-846. Jackson J.P., Lindroth A.M., CaoX., and Jacobsen S.E. 2002. Control of CpNpG DNA methylation by the KRYPTON ITE histone H3 methyltransferase. Nature 416: 556-556. Jeddeloh J.A., Stokes T. L., and Richards E.J. 1999. Maintenance of genomic methylation requires a SWI2/SNFs-like protein. Nat. Genet. 22: 94-97. Jorgensen R.A. 2003. Sense cosuppression in plants: Past, present, and future. In RNAi: A guide to gene silencing (ed. G.J. Hannon), pp. 5-22. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York. Kaeppler S.M., Kaeppler H.E, and Rhee Y. 2000. Epigenetic aspects of somaclonal variation in plants. Plant Mol. Biol. 43: 59-68. Kanno T, Mette M.F., Kreil D.P., Aufsatz W., Matzke M., and Matzke A.J. 2004. Involvement of putative SNF2 chromatin remodeling protein DRD1 in RNA-directed DNA methylation. Curr. Biol. 14: 801-805 Kanno T, Huettel B., Mette M.F., Aufsatz W., Jaligot E., Daxinger L., Kreil D.P., Matzke M., and Matzke A.J.M. 2005. Atypical RNA polymerase subunits required for RNA-directed DNA methylation. Nat. Genet. 37: 761-765. Kapoor A., Agius E, and Zhu J.K. 2005a. Preventing transcriptional gene silencing by active DNA demethylation. FEES Lett. 579: 5889-5898. Kapoor A., Agarwal M., Andreucci A., Zheng X., Gong Z., Hasegawa P.M., Bressan R.A., and Zhu J.K. 2005b. Mutations in a conserved replication protein suppress transcriptional gene silencing in a DNA-methylation-independent manner in Arabidopsis. Curt. Biol. 15: 1912-1918. Kawasaki H., Taira K., and Morris K.V. 2005. siRNA induced transcriptional gene silencing in mammalian cells. Cell Cycle 4: 442-448. Kidner C.A. and Martienssen R.A. 2005. The developmental role of micro RNA in plants. Curr. Opin. Plant Biol. 8: 1-7. Kim V.N. 2005. MicroRNA biogenesis: Coordinated cropping and dicing Nat. Rev. Genet. 6: 376-385. Kohler C, Page D.R., Gagliardini V, and Grossniklaus U. 2005. The Arabidopsis thaliana MEDEA polycomb group protein controls expression of PHERES1 by parental imprinting. Nat. Genet. 37: 28-30. Kotake T., Takada S., Nakahigashi K., Ohto M., and Goto K. 2003. Arabidopsis TERMINAL FLOWER 2gene encodes a heterochromatin protein 1 homolog and represses both FLOWERING LOCUS T to regulate flowering time and several floral homeotic genes. Plant Cell Physiol. 44: 555-564. Kress C, Thomassin H., and Grange T. 2001. Local DNA demethylation in vertebrates: How could it be performed and targeted? FEES Lett. 494: 135-140. Lecellier C.-H., Dunoyer P., Arar K., Lehmann-Che J., Eyquem S., Himber C, Saib A., and Voinnet O. 2005. A cellular micro RNA mediates antiviral defense in human cells. Science 308: 557-560. Li J., Yang Z., Yu B., Liu J., and Chen X. 2005. Methylation protects miRNAs and siRNAs from 3’-end uridylation activity in Arabidopsis. Curr. Biol. 15: 1501-1507. Lippman Z. and Martienssen R. 2004. The role of RNA interference in heterochromatic silencing. Nature 431: 364-370. Liu J., He Y., Amasino R., and Chen X. 2004. siRNAs targeting an intronic transposon in the regulation of natural flowering behavior in Arabidopsis. Genes Dev. 18: 2873-2878. Loidl P. 2004. A plant dialect of the histone language. Trends Plant Sci. 9: 84-90. Malagnac E, Bartee L., and Bender J. 2002. An Arabidopsis SET domain protein required for maintenance but not establishment of DNA methylation. EMBO J. 21: 6842-6852. Mathieu O. and Bender J. 2004. RNA-directed DNA methylation. /.Cell Sci. 117: 4881-4888. Matzke M.A. and Birchler J.A. 2005. RNAi-mediated pathways in the nucleus. Nat. Rev. Genet. 6: 24-35. Matzke M. and Matzke A.J.M. 2004. Planting the seeds of a new paradigm. PLoS Biol. 2: 528-586. Matzke M., Kanno T., Huettel B., Jaligot E., Mette M.E, Kreil D.P., Daxinger L., Rovina P., Aufsatz W., and Matzke A.J.M. 2005. RNA-directed DNA methylation. In Plant epigenetics (ed. R Meyer), pp. 69-96. Blackwell Publishing, Oxford, United Kingdom. McClintock B. 1956. Intranuclear systems controlling gene action and mutation. Brookhaven Symp. Biol. 8: 58-74 McClintock B. 1983. The significance of responses of the genome to challenge. Nobel lecture, http://nobelprize.org/medicine/laureates/1983/mcclintock-lecture.pdf Meins E, Si-Ammour A., and Blevins T. 2005. RNA silencing systems and their relevance to plant development. Annu. Rev. Cell Dev. Biol. 21: 297-318. Naumann K., Fischer A., Hofmann I., Krauss V., Phalke S., Irmler K., Hause C, Aurich A.-C, Dorn R., Jenuwein T., and Reuter G. 2005. Pivotal role of AtSUVH2 in heterochromatic histone methylation and gene silencing in Arabidopsis. EMBO J. 24: 1418-1429. Onodera Y., Haag J.R., Ream T., Nunes PC, Pontes O., and Pikaard C. 2005. Plant nuclear RNA polymerase IV mediates siRNA and DNA methylation-dependent heterochromatin formation. Cell 120: 613-622. Pandey R., Miiller A., Napoli C.A., Selinger D.A., Pikaard C.S., Richards E.J., Bender J., Mount D.W., and Jorgensen R.A. 2002. Analysis of histone acetyltransferase and histone deacetylase families of Arabidopsis thaliana suggests functional diversification of chromatin modification among multicellular eukaryotes. Nucl. Acids Res. 30: 5036-5055. Park M.Y., Wu G., Gonzalez-Sulser A., Vaucheret H., and Poethig R.S. 2005. Nuclear processing and export of microRNAs in Arabidopsis. Proc. Natl. Acad. Sci. 102: 3691-3696. Peregrine A., Yoshikawa M., Wu G., Albrecht H.L., and Poethig R.S. 2004. SGS3 and SGS2/SDE1/RDR6 are required for juvenile development and the production of frans-acting siRNAs in Arabidopsis. Genes. Dev. 18: 2368-2379. Pikaard C.S. 2000. The epigenetics of nucleolar dominance. Trends Genet. 16: 495-500. Rocha P.S., Sheikh M., Melchiorre R., FagardM., Boutet S., Loach R., Moffatt B., Wagner C, Vaucheret H., and Fumer I. 2005. The Arabidopsis HOMOLOGY-DEPEN DENT GENE SILENCING) gene codes for an S-adenosyl-L-homocysteine hydrolase required for DNA methylation-dependent silencing. Plant Cell 17: 404-417. Schubert D., Clarenz O., and Goodrich J. 2005. Epigenetic control of plant development by Polycomb-group proteins. Curr. Opin. Plant Biol. 8: 553-561. Senda M., Masuta C, Ohnishi S., Goto K., Kasai A., Sano T., Hong /.-S., and MacFarlane S. 2004. Patterning of virus-infected Glycine max seed coat is associated with suppression of endogenous silencing of chalcone synthase genes. Plant Cell 16: 807-818. Souret F.F., Kastenmayer J.P., and Green P.J. 2004. AtXRN4 degrades mRNA in Arabidopsis and its substrates include selected miRNA targets. Mot Cell 15: 173-183. Springer N.M. and Kaeppler S.M. 2005. Evolutionary divergence of monocot and dicot methyl-CpG-binding domain proteins Plant Physiol. 138: 92-104. Springer N.M., Napoli C.A., Selinger D.A., Pandey R., Cone K.C., Chandler V.L., Kaeppler H.E, and Kaeppler S.M. 2003. Comparative analysis of SET domain proteins in maize and Arabidopsis reveals multiple duplications preceding the divergence of monocots and dicots. Plant Physiol. 132: 907-925. Stam M. and Mittelsten Scheid 0.2005. Paramutation: An encounter leaving a lasting impression. Trends Plant Sci. 10: 283-290. Takeda S., Tadele Z., Hofmann I., Probst A.V., Angelis K.J., Kaya H., Araki T., Mengiste T, Mittelsten Scheid O., Shibahara K., et al. 2004. BRU1, a novel link between responses to DNA damage and epigenetic gene silencing in Arabidopsis. Genes Dev. 18: 782-793. Tanq M. and Paszkowski J 2004. DNA and histone methylation in plants. Trends Genet. 20: 244-251. Ting A. H., Schuebel K.E., Herman J.G., and Baylin S.B. 2005. Short double-stranded RNA induces transcriptional gene silencing in human cancer cells in the absence of DNA methylation. Nat. Genet. 37: 906-910. Vaucheret H., Vazquez E, Crete P., and Bartel D.P. 2004. The action of ARGONAUTE1 in the miRNA pathway and its regulation by the miRNA pathway are crucial for plant development. Genes Dev. 18: 1187-1197. Vazquez P., Gasciolli V., Crete P., and Vaucheret H. 2004a. The nuclear dsRNA binding protein HYL1 is required for microRNA accumulation and plant development, but not posttranscriptional trans-gene silencing. Curr. Biol. 14: 346-345. Vazquez R, Vaucheret H., Rajagopalan R., Lepers C, Gasciolli V., Mallory A.C., Hilbert J.-L, Bartel D.P., and Crete P. 2004b. Endogenous trans-acting siRNAs regulate the accumulation of Arabidopsis mRNAs. Mol. Cell 16: 69-79. Vinnet O. 2005. Induction and suppression of RNA silencing: Insights from viral infections. Nat. Rev. Genet. 6: 206-220. Wagner D. 2003. Chromatin regulation of plant development. Curr. Opin. Plant Biol. 6: 20-28. Wang X.J., Gaasterland T., and Chua N.H. 2005. Genome-wide prediction and identification of cis-natural antisense transcripts in Arabidopsis thaliana. Genome Biol. 6: R30. Wassenegger M., Heimes S., Riedel L., and Sanger H.L. 1994. RNA-directed de novo methylation of genomic sequences in plants. Cell 76: 567-576. Xie Z., Johansen L.K., Gustafson A.M., Kasschau K.D., Lellis A.D., Hibernian D., Jacobsen S.E., and Carrington J.C. 2004. Genetic and functional diversification of small RNA pathways in plants. PLoS Biol. 2: E104. Yoo B.-C, Kragler P., Varkonyi-Gasic E., Haywood V., Archer-Evans S., Lee Y.M., Lough T.J., and Lucas W.J. 2004. A systemic small RNA signalling system in plants. Plant Cell 16: 1979-2000.WWW источники
http://asrp.cgrb.oregonstate.edu Arabidopsis thaliana small RNA project http://mpss.dbi.udel.edu MPSS (Massively parallel signature sequencing) http://www.arabidopsis.org/abrc Arabidopsis Biological Resource Center Stocks http://www.chromdb.org Plant Chromatin DatabaseГлава 10. Модификации хроматина и механизм их действия
 Tony Kouzarides1 и Shelley L. Berger2
1The Gurdon Institute, University of Cambridge, United Kingdom
2The Wistar Institute, Philadelphia, Pensylvania 19104
Tony Kouzarides1 и Shelley L. Berger2
1The Gurdon Institute, University of Cambridge, United Kingdom
2The Wistar Institute, Philadelphia, Pensylvania 19104
Общее резюме
Гистоны являются строительными блоками нуклеосом, образуя октамерную структуру, которая упаковывает ДНК у эукариот и формирует структуру, известную как хроматин Хроматин, однако, не является однородной структурой, и в последние годы произошел взрыв в наших знаниях о вариациях в структуре хроматина. Это, в свою очередь, углубило наше понимание механизмов, регулирующих геномные матричные процессы, в частности посттрансляционных модификаций гистоновых белков (центральная характеристика этого геномного регулирования). Действительно, существует большое число посттрансляционных модификаций гистонов (HPTMs, histone posttranslational modifications). Они разделяются на две группы. Во-первых, существуют малые химические группы, в том числе ацетилирование, фосфорилирование и метилирование. Во-вторых, имеются гораздо более крупные пептиды, в том числе убиквитинирование и сумоилирование. Как представляют себе влияние HPTMs на регуляцию и функционирование генома? Обычно рассматриваются три механизма, и полезно держать эти механизмы в голове, поскольку в этой главе представлены обширная информация и данные по истории HPTMs. Во-первых, HPTMs могут каким-то образом влиять на структуру хроматина —например, предотвращая ключевые контакты, облегчающие образование определенных конформаций хроматина или структур более высокого порядка (что может рассматриваться как cw-модифицирующие эффекты). Напротив, два других механизма считаются действующими в trans-конфигурации. HPTMs могут разрушать связывание белков, которые ассоциируются с хроматином или гистонами. Или же HPTMs могут создавать измененные связывающие поверхности, которые притягивают определенные эффекторные белки. Этот третий механизм был охарактеризован наиболее детально, и такое рекрутирование белков определяется по отношению к его функциональным последствиям: так, оно может иметь активирующее или же репрессивное влияние на транскрипцию. Большое число обнаруженных HPTMs и их разнообразные комбинации привели к мысли, что HPTMs осуществляют регуляцию посредством комбинаторных паттернов, во временных последовательностях, и могут устанавливаться на коротких и длинных расстояниях. Эти разнообразные механизмы определяют разные функциональные результаты — одни из них временные, преходящие, другие стабильные и эпигенетически наследуемые. В 1960-е годы Винсент Олфри (Vincent Allfrey) идентифицировал ацетилирование, метилирование и фосфорилирование гистонов, выделенных из многих эукариот. Гистоны были также первыми распознанными убиквитилированными белковыми субстратами. Тем не менее, хотя Олфри и наблюдал определенные корреляции между модификациями и источником транс-крипционно активного хроматина, генетические и функциональные доказательства в пользу роли HPTMs в регуляции генов были получены значительно позже. Действительно, многие исследователи, изучавшие биохимию и генетику регуляции генов в 1980-е и 1990-е годы, скептически относились к мысли, что HPTMs играют причинную роль в регуляции генов1. Гистоны и ацетилирование играют регуляторную роль в транскрипции
Как показано в этой главе, гистоны подвержены многим разным посттрансляционным модификациям (PTMs), и со временем несомненно будут обнаружены новые, пока еще не известные HPTMs. Известные модификации можно классифицировать либо как малые химические группы, обсуждаемые в разделах 2—4 этой главы, либо как более крупные пептидные изменения в гистонах, что обсуждается в разделе 5 (табл. 10.1). Механизм, посредством которого HPTMs влияют на хроматиновую матрицу и родственные процессы, такие как транскрипция или репрессия генов, рассматриваются в контексте трех концептуальных моделей, изображенных на рис. 10.1. Модель 1 предполагает, что посттрансляционно модифицированные гистоны могут каким-то образом изменять струкутру хроматина. В модели 2 НРТМ может подавлять связывание некоего фактора с хроматиновой матрицей, тогда как модель 3 предполагает, что НРТМ создает сайт связывания для определенного белка (см. также раздел 5 главы 3). Что, в историческом плане, изменило главенствующий взгляд, согласно которому хроматин является, в основном, материалом упаковки ДНК? Самые ранниеТаблица 10.1. Типы ковалентных посттрансляционных модификаций гистонов
 HPTMs разбиваются на две группы: группа 1 представляет модификации малыми химическими группами, а группа 2 включает более крупные химические модификации данные о том, что HPTMs регулируют активацию транскрипции и сайленсинг, были получены в экспериментах на Saccharomyces cerevisiae в конце 1980-х годов. Эти почкующиеся дрожжи являются весьма эффективной моделью для проведения генетических экспериментов (в области как прямой, так и обратной генетики) по выяснению значения гистонов. Причина этого в том, что, в отличие от высших эукариот, где имеются множественные копии каждого гистонового гена, с однокопийными гистоновыми генами дрожжей можно легко проводить генетические манипуляции. Например, на фоне удаления с помощью делеций всех гистоновых генов можно ввести копию каждого гена, закодированную в эписоме, несущей такой селективный маркер, как ген URA3, для сохранения этой эписомы. Вторую копию гистонов можно ввести на второй эписоме, несущей другой селективный маркер. В этой второй копии можно вызвать мутацию с помощью сайт-направленного мутагенеза, а затем можно вызвать утерю первой копии, копии дикого типа, из клетки, используя 5-FOA (5-фтороротовая кислота), делающую продукт гена URA3 токсичным для клетки. Конечным результатом будет присутствие в клетке единственной копии — измененной копии на второй эписоме, которая содержит любое число мутаций, подлежащих тестированию. У S. cerevisiae гистоновые гены расположены парами H3/ Н4 и Н2А/Н2В, и их транскрипция в большой степени скоординирована таким образом, что совпадает с фазой S. Каждая нуклеосома собирается из тетрамера H3/Н4 и двух димеров Н2А/Н2В; когда одна пара любой двойки оказывается недо- или сверхтранскрибированной, нуклеосомы оказываются обедненными. Это изменение дозы гистонов генетическими средствами явилось одним из первоначальных доказательств того, что структура хроматина играет ключевую роль в регулировании экспрессии. Один такой подход использовал «прямую» генетику, когда были отселектированы случайные мутации, которые приводили к инактивации гена-маркера (Clark-Adams et al., 1988). Оказалось, что эти мутации изменяют количество пар гистонов. При втором подходе использовали «обратную» генетику, когда направленное «истощение» гистоновых генов давало четкое доказательство того, что гистоны регулируют транскрипцию генов (Han and Grunstein, 1988). Следующий этап заключался в том, чтобы провести делецию только аминотерминальных «хвостов» гистонов (сайты локализации многих НРТМ) или выполнить мутации-замены сайтов ацетилирования в гистонах. Эти более тонкие «хирургические» изменения также вызывали уменьшение активации генов, позволяя предполагать, что ацетилирование необходимо для транскрипции генов (Durrin et al., 1991).
HPTMs разбиваются на две группы: группа 1 представляет модификации малыми химическими группами, а группа 2 включает более крупные химические модификации данные о том, что HPTMs регулируют активацию транскрипции и сайленсинг, были получены в экспериментах на Saccharomyces cerevisiae в конце 1980-х годов. Эти почкующиеся дрожжи являются весьма эффективной моделью для проведения генетических экспериментов (в области как прямой, так и обратной генетики) по выяснению значения гистонов. Причина этого в том, что, в отличие от высших эукариот, где имеются множественные копии каждого гистонового гена, с однокопийными гистоновыми генами дрожжей можно легко проводить генетические манипуляции. Например, на фоне удаления с помощью делеций всех гистоновых генов можно ввести копию каждого гена, закодированную в эписоме, несущей такой селективный маркер, как ген URA3, для сохранения этой эписомы. Вторую копию гистонов можно ввести на второй эписоме, несущей другой селективный маркер. В этой второй копии можно вызвать мутацию с помощью сайт-направленного мутагенеза, а затем можно вызвать утерю первой копии, копии дикого типа, из клетки, используя 5-FOA (5-фтороротовая кислота), делающую продукт гена URA3 токсичным для клетки. Конечным результатом будет присутствие в клетке единственной копии — измененной копии на второй эписоме, которая содержит любое число мутаций, подлежащих тестированию. У S. cerevisiae гистоновые гены расположены парами H3/ Н4 и Н2А/Н2В, и их транскрипция в большой степени скоординирована таким образом, что совпадает с фазой S. Каждая нуклеосома собирается из тетрамера H3/Н4 и двух димеров Н2А/Н2В; когда одна пара любой двойки оказывается недо- или сверхтранскрибированной, нуклеосомы оказываются обедненными. Это изменение дозы гистонов генетическими средствами явилось одним из первоначальных доказательств того, что структура хроматина играет ключевую роль в регулировании экспрессии. Один такой подход использовал «прямую» генетику, когда были отселектированы случайные мутации, которые приводили к инактивации гена-маркера (Clark-Adams et al., 1988). Оказалось, что эти мутации изменяют количество пар гистонов. При втором подходе использовали «обратную» генетику, когда направленное «истощение» гистоновых генов давало четкое доказательство того, что гистоны регулируют транскрипцию генов (Han and Grunstein, 1988). Следующий этап заключался в том, чтобы провести делецию только аминотерминальных «хвостов» гистонов (сайты локализации многих НРТМ) или выполнить мутации-замены сайтов ацетилирования в гистонах. Эти более тонкие «хирургические» изменения также вызывали уменьшение активации генов, позволяя предполагать, что ацетилирование необходимо для транскрипции генов (Durrin et al., 1991).
 Рис. 10.1. Модели, показывающие, каким образом посттрансляционные модификации гистонов влияют на хроматиновую матрицу
Модель 1 предполагает, что изменения в структуре хроматина опосредуются cis-эффектами ковалентных модификаций гистонов, таких как ацетилирование или фосфорилирование гистонов. Модель 2 иллюстрирует подавляющее влияние НРТМ на связывание ассоциированного с хроматином фактора (CF) на примере фосфорилирования по H3S10, блокирующего связывание НР1 в метилированном H3K9. В модели 3 НР1М может обеспечивать специфичность связывания для ассоциированного с хроматином фактора Классическим примером является связывание НР1 через посредство его хромодомена с метилированным H3K9
Рис. 10.1. Модели, показывающие, каким образом посттрансляционные модификации гистонов влияют на хроматиновую матрицу
Модель 1 предполагает, что изменения в структуре хроматина опосредуются cis-эффектами ковалентных модификаций гистонов, таких как ацетилирование или фосфорилирование гистонов. Модель 2 иллюстрирует подавляющее влияние НРТМ на связывание ассоциированного с хроматином фактора (CF) на примере фосфорилирования по H3S10, блокирующего связывание НР1 в метилированном H3K9. В модели 3 НР1М может обеспечивать специфичность связывания для ассоциированного с хроматином фактора Классическим примером является связывание НР1 через посредство его хромодомена с метилированным H3K9
При других подходах исследовали, изменяются ли нуклеосомы естественным образом в ходе активации генов. Биохимические эксперименты показали, что нуклеосомы играют репрессивную роль в транскрипции на матрицах ДНК in vitro (Workman and Roeder, 1987), но вопрос о том, происходит ли то же самое in vivo, является спорным. Некоторые промоторы обладают нуклеосомами, расположенными естественным образом «вверх по течению» от сайтов начала транскрипции, и эти позиционированные нуклеосомы становятся измененными, когда ген активируется (Svaren et al., 1994; Shim et al., 1998). В случае PH05 изменение нуклеосом требовало активатора, показывая тем самым, что без транскрипции нуклеосомы не были изменены. Однако было неясно, является ли это изменение причиной или же следствием транскрипции. Чтобы выяснить это, делетировали ТАТА-бокс, отменяющий транскрипцию у дрожжей. Положение нуклеосом, тем не менее, изменилось, заставляя предположить, что это изменение нуклеосом предшествует транскрипции. В совокупности подобные эксперименты убедительно свидетельствовали о том, что для активации транскрипции могут быть необходимы и репозиционирование нуклеосом, и ацетилирование специфических остатков в гистоновых «хвостах»
2. Ацетилирование и деацетилирование
Дополнительные экспериментальные подходы продолжали поставлять данные о том, что ацетилирование (versus отсутствие ацетилирования) коррелирует с транскрипцией. Районы, транскрипционно активные или готовые к транскрипции, склонны иметь «открытую» конфигурацию хроматина и поэтому доступны для таких ферментов, как ДНКаза и MN-ase, которые при добавлении к изолированным, но интактным ядрам могут переваривать ДНК. В начале 1990-х годов исследователи начали использовать иммунопреципитацию хроматина (ChIP, chromatin immunoprecipitation) — мощный метод для анализа того, какие белки связываются с определенными нуклеотидными последовательностями ДНК in vivo. Этот метод включает создание поперечных сшивок в белках, связанных с ДНК, с помощью таких проникающих в клетку химических реагентов, как формальдегид, и последующую обработку ультразвуком для разрушения комплексов ДНК:белок до более мелких фрагментов. Интересующие исследователя комплексы ДНК:белок затем подвергаются иммунопреципитации с использованием специфических антител в качестве зонда. Затем поперечные сшивки ликвидируются, чтобы изолировать и идентифицировать нуклеотидные последовательности ДНК, ассоциированные с белком, который связался с антителом; при этом для анализа используется либо радиоактивно меченые ДНК-зонды, либо ПЦР Одна группа использовала этот метод, чтобы исследовать корреляцию между сайтами в ДНК вокруг активных глобиновых генов, которые гиперчувствительны к перевариванию ДНКазой и ассоциируются с ацетилированными гистонами в эритроцитах курицы; корреляция оказалась очень тесной (Hebbes et al., 1994). У S. cerevisiae аналогичные подходы были применены в транскрипционно «молчащих» районах генома, и были показаны очень низкие уровни ацетилирования гистонов (Braunstein et al., 1993). Наоборот, генетическое нарушение сайленсинга коррелировало с увеличенным ацетилированием. Все эти эксперименты постепенно обнаруживали, что гистоны и, в частности, сайты обратимого ацетилирования играют роль в регуляции генов. Однако первые ферменты ацетилирования и деацетилирования ядерных гистонов не были идентифицированы вплоть до середины 1990-х годов, и они явились наиболее прямым доказательством того, что эти ферменты играют роль в ходе транскрипции. Первая ядерная ацетилтрансфераза гистонов (HAT) была выделена из так называемого макронуклеуса (очень крупного транскрипционно активного ядра в отличие от мейотического микронуклеуса) инфузории Tetrahymena, который характеризуется высокими скоростями транскрипции (Brownell et al., 1996). Ключевым подходом для выявления активности HAT оказался анализ «в геле» («in-gel»): сложная смесь белков из клеточных экстрактов была разделена на пропитанном гистонами SDS-геле, затем пептиды были подвергнуты ренатурации, и белки с активностью фермента HAT метили этот гель путем переноса радиактивно меченного кофактора, ацетилкоэнзима А, на локализованные гистоны. Это делало возможным последующее биохимическое фракционирование и очистку этого полипептида. Идентифицированный энзим HAT был гомологичен ранее изолированному у S. cerevisiae коактиватору, называемому Gcn5, о котором было известно, что он взаимодействует с транскрипционными активаторами. Одновременно первая деацетилаза гистонов (HDAC) была выделена посредством биохимической очистки (Taunton et al., 1996). В этом случае фермент был очищен из клеточных экстрактов с помощью ингибитора, связанного с нерастворимым матриксом, который физически связывался с каталитическим сайтом фермента. Энзим оказался гомологичным ранее выделенному гену, игравшему роль кофактора в репрессии генов. Эти замечательные параллельные открытия первых ферментов, которые, как оказалось, метаболизируют ацетильные группы на гистонах, привели к модели, которая в настоящее время стала парадигмой для ген-специфичных гистоновых PTMs: связанные с ДНК активаторы рекрутируют HATs для того, чтобы ацетилировать нуклеосомные гистоны, тогда как репрессоры рекрутируют YDACs для того, чтобы деацетилировать гистоны. Эти изменения ведут к изменениям нуклеосомы и, соответственно, к ап- или даун-регуляции гена (рис. 10.2). Было показано, что многие другие хорошо известные коактиваторы и корепрессоры обладают активностью HAT или HDAC или ассоциируются с такими энзимами (Sterner and Berger, 2000; Roth et al., 2001). Более того, ферментативные активности HATs и HDACs являются критическими для их роли в активации и репрессии генов. Эти энзимы часто являются компонентами крупных комплексов, модулярных по структуре и функции; модифицирующая гистоны ферментативная активность — это только одна функция, и в числе других, например, рекрутирование связывающегося с ТАТА белка (TBR TATA-binding protein) (Grant et al., 1998). Интересно, что некоторые ядерные рецепторы гормонов функционируют и как связывающиеся с ДНК репрессоры транскрипции (когда они не связаны с гормонами-лигандами), и как активаторы транскрипции (когда связаны с гормонами-лигандами); эти рецепторы осуществляют эти функции отчасти через посредство РТМ хроматиновых участков-мишеней, рекрутируя HDACs, когда они не связаны с лигандами, и HATs, когда связаны (Baek and Rosenfeld, 2004). Рис. 10.2. Энзимы, модифицирующие гистоны, рекрутируются к промоторам связывающимися с ДНК транскрипционными факторами
Ацетилтрансферазы гистонов (HAT) рекрутируются активаторами, которые связываются с активирующими нуклеотидными последовательностями «вверх по течению» (UAS, upstream activating sequences). Этот фермент катализирует ацетилирование локальных гистонов, которые, как известно, вносят вклад в активацию транскрипции. Деацетилазы гистонов (HDAC) рекрутируются репрессорами транскрипции, которые связываются с репрессивными нуклеотидными последовательностями «вверх по течению» (URS) и деацетилируют локальные гистоны Это вносит вклад в репрессию транскрипции
Рис. 10.2. Энзимы, модифицирующие гистоны, рекрутируются к промоторам связывающимися с ДНК транскрипционными факторами
Ацетилтрансферазы гистонов (HAT) рекрутируются активаторами, которые связываются с активирующими нуклеотидными последовательностями «вверх по течению» (UAS, upstream activating sequences). Этот фермент катализирует ацетилирование локальных гистонов, которые, как известно, вносят вклад в активацию транскрипции. Деацетилазы гистонов (HDAC) рекрутируются репрессорами транскрипции, которые связываются с репрессивными нуклеотидными последовательностями «вверх по течению» (URS) и деацетилируют локальные гистоны Это вносит вклад в репрессию транскрипции
Белки HAT могут ацетилировать остатки лизина на всех четырех коровых гистонах, но разные энзимы обладают разной специфичностью в отношении предпочтительного субстрата (рис. 10.3; табл. 10.1), хотя каждый энзим редко «нацелен» только на один сайт. Одно главное семейство HAT — GNAT (сокращение для Gcn5 related acetyltransferase) «нацелено» на гистон H3 как на свой основной субстрат. Второе главное семейство, семейство MYST, в качестве своего основного субстрата«нацелено» на гистон Н4. Третье главное семейство — СВР/р300 — «нацелено» и на H3, и на Н4 и является самым неразборчивым. Был выполнен структурный анализ для каталитических доменов первых двух главных семейств (GNAT и MYST), и они оказались различающимися; структура семейства СВР/р300 пока еще не раскрыта. Между прочим, каждое из этих семейств ацетилтрансфераз способно также ацетилировать негистоновые субстраты (Glozak et al., 2005). Как обсуждалось выше, существуют три модели, описывающие роль HPTMs в регулирование структуры хроматина (рис. 10.1). Первая модель рассматривает структурные изменения в хроматине, индуцируемые прямыми влияниями HPTMs, такие как изменения заряда. В этом случае нейтрализация ацетилированием положительно заряженного лизина уменьшает силу связывания сильно основных гистонов или гистоновых «хвостов» с отрицательно заряженной ДНК и таким образом открывает сайты связывания с ДНК (Vettese-Dadey et al., 1996). Имеются также данные, все еще в пользу первой модели, что ацетилирование может декомпактизировать нуклеосомные порядки, что согласуется с ролью в открывании хроматина для активации генов (Shorgen-Knaak et al., 2006). Третья модель предполагает, что HPTMs обеспечивают поверхность связывания, чтобы белки ассоциировались с хроматином и регулировали ДНК-матричные процессы; впервые это было показано для ацетилирования. Специализированный белковый домен, названный бромодоменом и обычно обнаруживаемый в ассоциированных с хроматином белках, специфически связывается с ацетилированными лизинами (рис. 10.3) (Dhalluinet al., 1999). Бромодомены присутствуют во многих HATs, таких как Gcn5 и СВР/рЗОО. Белки с этим мотивом, когда они являются частью крупных комплексов, ассоциированных с хроматином или изменяющих его, — например, таких как зависимый от АТФ ремоделирующий комплекс, Swi/ Snf — стимулируют его связывание с хроматином (Hassan et al., 2002). Другими примерами белков, которые содержат бромодомены, обладающие специфичностью связывания с ацетилированными гистонами, являются Tafl и Bdfl в комплексе TFIID, Rsc4 в ремоделирующем комплексе Rsc и Brd2 в большом семействе бромодоменных белков.
 Рис. 10.3. Охарактеризованные сайты ацетилирования гистонов
Гистоны ацетилируются главным образом по лизиновым остаткам, локализованным в аминоконцах H3 и Н4, за исключением H3K56, локализованного в глобулярном домене. Показаны белки, проявляющие специфичность связывания с ацетилированными гистонами
Рис. 10.3. Охарактеризованные сайты ацетилирования гистонов
Гистоны ацетилируются главным образом по лизиновым остаткам, локализованным в аминоконцах H3 и Н4, за исключением H3K56, локализованного в глобулярном домене. Показаны белки, проявляющие специфичность связывания с ацетилированными гистонами
Существуют многочисленные ферменты HDAC, удаляющие ацетильные группы (Kurdistani and Grunstein, 2003; Yang and Seto, 2003). Они распадаются на три каталитические группы, консервативные в эволюции от S. cerevisiae до млекопитающих, которые обозначаются как энзимы типа I, типа II и типа III, или родственные Sir2. Ферменты типа I и типа II обладают близким механизмом деацетилирования, который не связан с кофактором, тогда как ферменты, родственные Sir2, требуют кофактор NAD в качестве компонента их каталитического механизма. Структура представителей всех этих трех семейств выяснена. Многие HDACs обнаруживаются в крупных мультисубъединичных комплексах, компоненты которых служат для «нацеливания» этих энзимов на гены, что ведет к репрессии транскрипции. Например, Rpd3 является частью крупного комплекса, включающего HDAC Sin3, которая взаимодействует с репрессорами, связанными с ДНК (Kurdistani and Grunstein, 2003; Yang and Seto, 2003). Rpd3 является также частью малого комплекса, «нацеленного» на открытые «рамки считывания» генов (ORFs) через ассоциацию хромодомена с H3KЗбше (дальнейшее обсуждение хромодоменов см. в разделе 4). Результатом этого оказывается деацетилирование гистонов, частично подавляющее инициацию внутренней РНК-полимеразы II (pol II), а также регулирующее различные этапы цикла транскрипции (Carrozza et al., 2005; Joshi and Struhl, 2005).
3. Фосфорилирование
Фосфорилирование — лучше всего известная РТМ, поскольку уже давно поняли, что киназы регулируют проведение сигнала с клеточной поверхности через цитоплазму и в ядро, приводя к изменениям в экспрессии генов. Гистоны были одними из первых белков, фосфорилирование которых было обнаружено. К 1991 году открыли, что когда клетки стимулировали к пролиферации, происходила индукция так называемых «немедленных-ранних» [«immediate-early»] генов, и они становились транскрипционно активными и функционировали, стимулируя клеточный цикл. Эта повышенная экспрессия генов коррелирует с фосфорилированием гистона H3 (Mahadevan et al., 1991). Остаток серина 10гистона H3 (H3S10) оказался важным сайтом фосфорилирования для транскрипции от дрожжей до человека и, по-видимому, особенно важен у Drosophila (Nowak and Corces, 2004). Были идентифицированы многие киназы, имеющие «мишенью» этот сайт, в том числе Msk1/2 и родственная ей Rsk2 у млекопитающих и SNF1 у S. cerevisiae (Sassone-Corsietal., 1999; Loetal., 2001; Soloagaetal., 2003). Исследования линкерного гистона Н1 у Tetrahymena показали, что фосфорилирование этого гистона также может влиять на контроль транскрипции. Возможно, наперекор интуиции фосфорилирование некоторых остатков коррелирует с конденсацией хромосом в митозе и мейозе. Неясно, каким образом фосфорилирование участвует в этом процессе, но недавно было показано, что фосфорилирование H3S10 действует как временной [temporal] переключатель, извлекающий НР1, связанный с метилированным по соседству остатком H3K9, и называемый «бинарным переключателем methyl-phos» (Fischle et al., 2005; Hirota et al., 2005). Остается посмотреть, может ли это, возможно совместно с фосфорилированием H3S28 и H3Т11, влиять на конденсацию хроматина посредством рекрутирования конденсинового комплекса и митотического веретена (Nowak and Corces, 2004). Меньше известно о точной роли фосфорилирования гистонов в механистических терминах. Имеются данные в пользу всех трех моделей, касающихся роли HPTMs. Во-первых, фосфорилирование гистонов изменяет степень компактности хроматина in vivo (модель 1) Действительно, работы на Tetrahymena показали, что коллективный «пэтч отрицательных зарядов», образующийся в результате фосфорилирования кластеров, находящихся по соседству с остатками в линкерном гистоне Н1, влияет на сродство его связывания с ДНК. явно увеличивая транскрипционный потенциал локального хроматинового окружения (Dou and Gorovsky, 2002). В поддержку модели 2 говорят данные о том, что белки, связанные с хроматином, могут быть смещены фосфорилированием. Недавно это было продемонстрировано пониженной афинностью связывания НР1 во время митоза после митоз-специфичного фосфорилирования H3S10 (Fischle et al., 2005; Hirota et al., 2005). В поддержку Модели 3 свидетельствуют данные о том, что адапторный белок 14-3-3 (известный белок, связывающий фосфатную группу) распознает H3S10ph в промоторах индуцибельных генов (Macdonald et al., 2005).4. Метилирование
Метилирование как ковалентная модификация гистонов является более сложной, чем любая другая, поскольку оно может происходить как по лизинам, так и по аргининам. Кроме того, в отличие от любой другой модификации в группе 1, последствия метилирования могут быть как позитивными, так и негативными по отношению к транскрипционной экспрессии в зависимости от положения остатка в гистоне (табл. 10.1). Еще один уровень сложности связан с тем фактом, что по каждому остатку могут быть множественные метилированные состояния. Лизины могут быть моно- (me1), ди- (me2) или три- (me3) метилированными, тогда как аргинины могут быть моно- (me1) или ди- (me2) метилированными. Поскольку на H3, Н4, Н2А и Н2В имеются по меньшей мере 24 идентифицированных сайта метилирования лизинов и аргининов, число различающихся метилированных состояний нуклеосом невообразимо велико. Такой комбинаторный потенциал метилированных нуклеосом может быть необходим, по крайней мере отчасти, чтобы сделать возможным регулирование таких сложных и динамических процессов, как транскрипция, которая требует последовательных и точно размещенных во времени событий (Jenuwein and Allis, 2001; Y. Zhang and Reinberg, 2001; Lee et al., 2005; Martin and Zhang, 2005; Wysocka et al., 2006a).4.1. Метилирование лизинов
Тот факт, что лизиновые остатки в гистонах метилированы, был известен многие десятилетия. Однако биологическое значение этой модификации стало высвечиваться лишь недавно, после идентификации первой метилтрансферазы лизинов, использующей гистоны в качестве своего субстрата (Rea et al., 2000). В настоящее время идентифицировано большее количество лизиновых метилтрансфераз (HKMTs), и определены сайты, модифицируемые ими на гистонах (Martin and Zhang, 2005). Все эти ферменты, за исключением Dot 1, имеют общий домен SET, который содержит каталитически активный сайт и делает возможным связывание с S-аденозил-L-метиониновым кофактором. Из большого числа известных метилированных сайтов к сегодняшнему дню хорошо охарактеризованы шесть; пять на H3 (К4, К9, К27, К36, К79) и один на Н4 (К20). Метилирование по H3K4, H3K36 и H3K79 в целом было связано с активацией транскрипции, а остальные варианты — с репрессией (табл. 10.1). Кроме того, два из этих сайтов — H3K79me и H4K20me — участвуют, как считается, в процессе репарации ДНК. Были идентифицированы специфические белки-связки, распознающие каждый из шести охарактеризованных сайтов метилирования (рис. 10.4). Эти белки имеют домен узнавания лизина, относящийся к одному из трех разных типов: хромо, тюдор и PHD-повтор. Ниже каждая из этих охарактеризованных модификаций обсуждается более детально.Метилирование H3K4
Метилирование H3K4 связано с эухроматином, а именно с генами, которые активны или должны стать активными. Демонстрация того, что метилирование H3K4 коррелирует с активным хроматином, была получена при анализе локуса куриного β-глобина и локусов типа спаривания почкующихся дрожжей (Litt et al., 2001; Noma et al., 2001). ChlPs с использованием антител, специфичных к метилированным H3K4, показали, что островки модифицированных гистонов метят активные гены. Последующая работа на дрожжах показала, что в процессе активной транскрипции появляется триметильное состояние (H3K4me3) (Santos-Rosa etal., 2002). У дрожжей во время активации транскрипции модификация H3K4me3 наблюдается на 5’-концах генов. Рис. 10.4. Сайты метилирования гистонов, их белковые связки и функциональная роль в геномных процессах
Метилирование гистонов происходит по лизиновым остаткам в гистонах НЗ и Н4. Некоторые метилированные остатки лизина ассоциированы с активацией транскрипции (зеленый флажок Me), тогда как другие участвуют в репрессивных процессах (красный флажок Me). Показаны белки, связывающиеся с определенными метилированными остатками лизина
Рис. 10.4. Сайты метилирования гистонов, их белковые связки и функциональная роль в геномных процессах
Метилирование гистонов происходит по лизиновым остаткам в гистонах НЗ и Н4. Некоторые метилированные остатки лизина ассоциированы с активацией транскрипции (зеленый флажок Me), тогда как другие участвуют в репрессивных процессах (красный флажок Me). Показаны белки, связывающиеся с определенными метилированными остатками лизина
Полагают, что за эту метку отвечают три компонента транскрипционной машины. Во-первых, RNA pol II, фосфорилированная по Ser-5 карбокситерминального домена (CTD), может рекрутировать Setl HKMT, которая метилирует H3K4 поблизости от промоторов (рис. 10.5). Такое фосфорилирование в норме высвобождает RNApol II из комлекса инициации транскрипции в комплекс ранней элонгации (часто называемый promoter clearance или escape). Второй компонент, рекрутирующий H3K4me3, это комплекс RAF, который регулирует различные этапы метаболизма РНК и также взаимодействует с Setl. Третьим компонентом, важным для установления H3K4me3, является моноубиквитилирование Н2В по Lys-123 (H2BK123ub1 или H2BK120ub1 у человека; обсуждается ниже, в разделе 6). Что остается неясным, так это вопрос о том, какие процессы транскрипционной элонгации контролирует H3K4me3 (Hampsey and Reiberg, 2003); однако факторы, специфически связывающиеся с метилированными H3K4me3, начинают выявлять его роль. В механистическом плане метилирование H3K4 может приводить к рекрутированию таких специфических факторов, как белок CHD1, который, как было показано, связывается с H3K4me2 и me3 (рис. 10.4), и комплекс NURF, который, как известно, мобилизует нуклеосомы в активных генах у Drosophila. Домены, опосредующие связь с метилированными H3K4, являются тандемным набором хромодоменов в Chdl (Sims et al., 2006) и «пальцем» PHD в NURF (Li et al., 2006). Среди других белков, рекрутируемых метилированием H3K4, — АТФ-аза ISWI, которая связывается непрямым образом, через посредство другого белка (белков). Напротив, имеются данные, что репрессорный комплекс NuRD у млекопитающих больше не связывается с метилированными «хвостами» H3K4 (D.Y. Lee et al., 2005; Martin and Zhang, 2005). Метилирование по H3K4, по-видимому, взаимодействует с другими модификациями. Например, метилирование H3K9 HKMT SUV39H in vitro предотвращается, если H3K4 метилирован и H3S10 фосфорилирован. Это вполне может быть способом закрытия репрессивной модификации H3K9 на активно транскрибируемых генах. При более сложной форме взаимодействия типа «trans-tail» моноубиквитинилирование H2BK123 влияет на уровни H3K4me3. Как это происходит — неясно, но одно из предположений заключается в том, что комплекс Setl не может триметилировать H3K4, если нуклеосома (нуклеосомы) не находится в определенном конформационном состоянии, которое определяется убиквитилированием Н2В (Zhang and Reinberg, 2001; D.Y. Lee et al., 2005). Белок Setl/MLL/ALLl/HRX, который является гомологом Setl у человека, может рекрутироваться к промоторам гена НОХ. Другая H3K4 HKMT, SMYD3, оказалась сцепленной с транскрипционной активацией. Метилирование с помощью SMYD3 также было связано с индукцией клеточной пролиферации. В самом деле, ограниченный анализ человеческих энзимов, метилирующих H3K4, позволяет предполагать их участие в генезе рака (D.Y. Lee et al., 2005).
Метилирование H3K36
Полученные данные привели к предположению, что метилирование H3K36 необходимо для эффективной элонгации RNA pol II через колирующий участок. Кодирующий район активных генов очень обогащен этой модификацией в противоположность 5’-локализации метилирования H3K4. Белок Set2 является HKMT, способной метилировать H3K36 Фермент Set2 связывается предпочтительно с RNA pol II, которая была фосфорилирована по Ser-2 в пределах его CTD (рис. 10.5). Эта форма RNA pol II, которая, между прочим, отличается от фосфорилированного состояния, связанного с очисткой промотора, имеет тенденцию аккумулироваться в транскрибируемых районах так же, как на 3’-концах генов. Это согласуется с тем, что H3KЗбme3 достигает пика на 3’-концах генов, которые активно транскрибируются. Рекрутирование Set2 к активным генам требует также компонентов комплекса РАЕ, как в случае рекрутирования Setl. Однако моноубиквитилирование Н2В играет негативную репрессивную роль в метилировании H3K36 (Zhang and Reinberg, 2001; Martin and Zhang, 2005). Действительно, комплекс SAGA, рекрутируемый к транскрибируемым генам у дрожжей, содержит Ubp8, деубиквиназу, которая специфична к H2BK123. Дальнейшие исследования позволили предположить, что убиквитилирование и деубиквитилирование H2BK123 являются активным процессом в ходе транскрипционной элонгации. Продвижение RNA pol II через кодирующие участки требует ацетилирования нуклеосом. Транскрипционное регулирование также нужно для подавления неправильной внутренней инициации транскрипции с криптических стартовых сайтов, которые встречаются внутри кодирующих районов. Чтобы подавить этот процесс, метилирование по H3K36 с помощью Set2 создает сайт узнавания для белка EAF3 через его хромодомен, который в свою очередь опосредует рекрутирование комплекса Rpd3S HDAC. Деацетилазная активность Rpd3S удаляет затем ацетилирование гистонов, связанное с элонгацией, супрессируя таким образом внутреннюю инициацию (Carrozza et al., 2005; Joshi and Struhl, 2005; Keogh et al., 2005). Метилирование H3K36 также оказалось на гораздо более низком уровне в промоторах индуцибельных генов, но в этом случае его влияние оказывается репрессивным (Zhang and Reinberg, 2001). Рис. 10.5. Роль метилирования лизинов гистонов в транскрипционной элонгации
РНК-полимераза II рекрутирует разные типы HKMTs в зависимости от состояния фосфорилирования его карбокситерминального домена (CTD) РНК-полимераза II активируется для инициации транскрипции поблизости от промотора, когда Ser-5 фосфорилирован. Это рекрутирует Setl HKMT для метилирования H3K4. Фосфорилирование Ser-2 происходит в ходе транскрипционной элонгации, побуждая к метилированию H3K36 в результате рекрутирования Set2 HKMT к хроматиновой матрице
Рис. 10.5. Роль метилирования лизинов гистонов в транскрипционной элонгации
РНК-полимераза II рекрутирует разные типы HKMTs в зависимости от состояния фосфорилирования его карбокситерминального домена (CTD) РНК-полимераза II активируется для инициации транскрипции поблизости от промотора, когда Ser-5 фосфорилирован. Это рекрутирует Setl HKMT для метилирования H3K4. Фосфорилирование Ser-2 происходит в ходе транскрипционной элонгации, побуждая к метилированию H3K36 в результате рекрутирования Set2 HKMT к хроматиновой матрице
Метилирование по H3K79 является необычным, потому что эта модификация лежит в коре нуклеосомы, а не в «хвосте», где находится большинство других охарактеризованных сайтов метилирования Глобальный анализ показал, что H3K79 метилируется в эухроматиновых районах дрожжей и ассоциируется главным образом с кодирующим участком активных генов. Ограниченный анализ у высших эукариот демонстрирует такой же профиль. Энзим млекопитающих, метилирующий H3K79, hDOTIL, как было показано, опосредует лейкемогенные функции белка слияния MLL-AF10. Однако до сего дня не обнаружен белок, который связывается с H3K79me и связывает его с транскрипционными событиями. Единственные данные механистического плана о том. как метилирование H3K79 функционирует в активации транскрипции, были получены в работе с почкующимися дрожжами. Эта работа показывает, что данная модификация каким-то образом лимитирует такие репрессивные белки, как Sir2 и Sir3, в эухроматине, внося таким образом свой вклад в регулирование и поддержание «молчащего» гетерохроматина за счет усиления их концентрации в репрессивных участках хроматина. Другой функцией, приписываемой H3K79 HKMT Dotl у дрожжей, является опосредование «контрольной точки» репарации ДНК. В соответствии с этим последним фактом в клетках человека был идентифицирован белок Р53ВР1, который может связываться с метилированным H3K79 и играет роль в функции «контрольной точки» в репарации ДНК (Martin and Zhang, 2005).
Метилирование H3K9
Этот тип метилирования является сегодня наиболее изученной модификацией гистонов, главным образом потому, что энзим, метилирующий H3K9, — SUV39H1 — был первой идентифицированной HKMT (Rea et al., 2000). Ее гомологу Drosophila, Su(var)3-9, первоначально был идентифицирован как супрессор мозаичности, что указывало на то, что он участвует в механизме сайленсинга эффекта положения мозаичного типа (PEV), который связан с распространением гетерохроматина в соседние эухроматиновые гены (дополнительные детали см. в главе 5). Осознание того, что SUV39H1 по нуклеотидной последовательности сходен с метилтрансферазой растений, субстратом для которой является Rubisco, привело к идентификации домена Suv39 SET как каталитического домена, способного метилировать H3K9. Был достигнут прогресс в определении функции метилирования H3K9 в формировании перицентромерного гетерохроматина, что широко обсуждается также и в других главах (об исследованиях на Drosophila см. главу 5, об исследованиях на S. pombe см. главу 6 и об исследованиях по опосредованному RNAi формированию гетерохроматина см. главу 8). Эти результаты получены в основном в исследованиях на дробянковых дрожжах и млекопитающих, где гетерохроматиновые структуры, как полагают, достаточно консервативны (но обратите внимание на то, что у почкующихся дрожжей метилирование H3K9 не было обнаружено). Суммируя, можно сказать, что первый этап нашего понимания возник на основе исследований факторов, участвующих в установлении гетерохроматина. В их число входит кооперация двух белков: SUV39H (или Clr4 у дробянковых дрожжей) и его партнер по связыванию НР1 (или Swi6 у дробянковых дрожжей [Nakayamaet al., 2001; Nomaet al., 2001]). Была предложена модель, в которой SUV39H метилирует H3K9, создавая платформу для связывания НР1 через его хромодомен (Bannister et al., 2001; Lach-ner et al., 2001). Коль скоро HP1 связался, он может распространяться на соседние нуклеосомы за счет его ассоциации с SUV39Y. который далее катализирует метилирование соседних гистонов (Nakayama et al., 2001). Кроме того, НР1 ассоциируется сам с собой через домен «chromoshadow», облегчая распространение гетерохроматина. Однако каким образом распространение НР1 диктует формирование плотно упакованных гетерохроматиновых структур остается неизвестным. Вышеуказанная модель предсказывает, что должен быть специальный механизм основанного на гетерохроматине рекрутирования для фермента SUV39H HKMT. прежде чем станет возможным распространение НР1. Ключ к разгадкё того, что бы это могло быть, был получен в серии экспериментов на дробянковых дрожжах, которые продемонстрировали связь между формированием гетерохроматина и образованием коротких интерферирующих РНК (siRNAs) (Hall et al., 2002; Volpe et al., 2002). Эти РНК возникают в результате двунаправленной транскрипции центромерных повторов, которые пропессируются в siRNAs ферментом dicer. Эти siRNAs упаковываются затем в комплекс RITS, который содержит обладающий хромодоменом белок, Chp1, который связывается с метилированным H3K9. Таким образом, «нацеливание» комплекса RITS на хроматин образует начальную стадию формирования гетерохроматина. Распространение и поддержание гетерохроматина на участке, 20 т.п.н., как описано выше, требует метилирования H3K9 гистона Clr4 HKMT и связывания Swi6 с метилированным по H3K9 хроматином (Martin and Zhang, 2005; дополнительные детали см. в главе 8). Представление о взаимозависимости разных репрессивных эпигенетических механизмов возникло из исследований, проводившихся вначале на Neurospora crassa. но также и на растениях, особенно заметно продемонстрировавших связь между метилированием H3K9 и процессом метилирования ДНК (главы 6 и 8). Метилирование H3K9 необходимо для того, чтобы имело место метилирование ДНК; по-видимому, действует и реципрокная связь, когда метилирование H3K9 зависит от метилирования ДНК. Более того, недавние исследования на раковых клетках млекопитающих, у которых нет ДНК-метилтрансферазных ферментов (Dnmts), показывают сниженные уровни метилирования H3K9, и это можно приписать тому, что связывющийся с метил-CpG белок 1 (MBD1, methyl-CpG-binding protein 1) ассоциируется с H3K9 HKMT SETDB1 (Zhang and Reinberg, 2001; Martin and Zhang, 2005; дополнительные детали см. в главе 18). Метилирование по H3K9 функционирует также в репрессии эухроматиновых генов ChlPs выявляют это метилирование в промоторе генов млекопитающих, когда эти гены «молчат». Механизм этой репрессии в эухроматиновых сайтах, по-видимому, слегка отличается от механизмов, встречающихся в гетерохроматиновых районах. Репрессорный белок RB предъявляет SU-V39H1 HKMT и НР1 таким эухроматиновым генам, как ген регулируемого E2F циклина Е. Однако, в отличие от гетерохроматина, заполнение НР1, по-видимому, ограничено одной или немногими нуклеосомами вокруг сайта инициации, даже несмотря на то, что метилирование H3K9 происходит и в других местах на промоторе. В другом примере репрессор КАР1 приносит ESET/SET-DB1 HKMT к промотору генов, регулируемых КАР1, и сайленсирует транскрипцию метилированием H3K9 и рекрутированием НР1. То, что НР1 специфически ограничены этими эухроматиновыми промоторами, и предотвращение распространения позволяют предполагать для НР1 наличие отдельного механизма действия по отношению к его гетерохроматиновой роли. Один возможный способ действия НР1, получивший некоторую поддержку, заключается в том, что он действует как якорь, закрепленный в богатых гетерохроматином ядерных компартментах. В ходе репрессии эухроматиновых генов наблюдали движения, показывающие, что «молчащий» ген смешается в гетерохроматиновый район, и это перемещение зависит от гамма-изоформы НР1 (Martin and Zhang, 2005). Формирование гетерохроматина в теломерах, хотя и связано с НР1 и метилированием H3K9, отличается от вышеупомянутых перицентромерных и «молчащих» эухроматиновых районов. У Drosophila НР1 не рекрутируется к теломерным концам через его хромо- и «chromoshadow»-домен, и метилирование H3K9 катализируется неизвестной HKMT. У млекопитающих другие гомологи НР1, СВХ1, СВХЗ и СВХ5 участвуют в связывании с метилированным H3K9, преобразованным белками SUV39H1 и SUV39H2 для формирования репрессивных хроматиновых доменов на хромосомных концах (дополнительные детали см. в главе 14).Метилирование H3K27
Метилирование H3K27 является репрессивной модификацией, обнаруживаемой в клетке в трех разных местах: (1) в эухроматиновых генных локусах, преимущественно там, где имеются реагирующие элементы Polycomb (PREs, Polycomb Response Elements) в случае Drosophila, (2) в перицентромерном гетерохроматине и (3) в неактивной Х-хромосоме у млекопитающих. В клетках человека ферментом, опосредующим метилирование H3K27, является EZH2 — гомолог белка ENHANCER OF ZESTE [E(Z)] у Drosophila. Этот энзим EZH2 обнаруживается в ряде отдельных репрессивных комплексов Polycomb (PRCs), которые ассоциируются со специфичными репрессивными элементами Polycomb-ДНК в промоторах у Drosophila (глава 11). Что «нацеливает» содержащие EZH2 комплексы на специфические гены у млекопитающих — неизвестно, поскольку репрессивные элементы Polycomb не были идентифицированы. Однако «нацеливание» этих EZI-12-комплексов может быть опосредовано рядом транскрипционных факторов, в том числе GAGA и MYC. Механизмы репрессии, осуществляемой EZH2, включают метилирование H3K27 и рекрутирование белка Polycomb (Рс) к этому модифицированному сайту (как в модели 3 на рис. 10.1). Важным аспектом пути, ведущего к метилированию H3K27, является предположение о его роли в раковых заболеваниях. В ряде раковых тканей, в том числе при раке груди и простаты, обнаружена сверхэкспрессия H3K27 HKMT EZH2 (Martin and Zhang, 2005).Метилирование H4K20
Очень мало что известно, в механистическом плане, о роли этой модификации в контроле транскрипции. Что очевидно, так это то, что в перицентромерном гетерохроматине присутствуют H4K20me2 и H4K20me3 и что ферментами HKMT, опосредующими эти модификации, являются SUV4-20H1 и SUV4-20H2. Для метилирования H4K20, по-видимому, требуется метилирование H3K9. Еще одним ферментом, который может монометилировать H4K20 у высших эукариот, является PR-Set7, для которого предполагается участие в митотических событиях. Наконец, имеются функциональные доказательства того, что у почкующихся дрожжей метилирование H4K20 сцеплено с репарацией ДНК через связывание белка «контрольной точки» повреждений ДНК, CrB2 (Martin and Zhang).4.2. Деметилирование лизинов
До недавнего времени было неясно, происходит ли в клетке деметилирование лизинов в гистонах. Поиски таких ферментов оказались бесплодными, и имелись данные о том, что метильные группы в гетерохроматиновых районах могут быть весьма стабильными. Открытие LSD1 все это изменило (Shi et al., 2004). Было показано, что этот белок является энзимом, который специфически удаляет метальные группы с H3K4 и участвует в репрессии. LSD1 присутствует в ряде различных репрессорных комплексов, и некоторые из них позволяют ему более эффективно деметилировать лизиновые остатки из нуклеосомного гистона H3 (M.G. Lee et al., 2005; Shi et al., 2005). Специфичность LSD1 может изменяться, если он связывается с таким партнером, как рецептор андрогена (AR). Комплекс LSD 1-AR деметилирует H3K9 вместо H3K4 и в этих условиях активирует, а не репрессирует транскрипцию (Metzger et al., 2005). Недавно ]были идентифицированы пять новых деметил аз, которые обладают общей каталитической структурой, отличной от LSD1 и названной JmjC-доменом (рис. 10.6). Ранее было предсказано, что этот домен обладает ферментативной активностью (Trewick et al., 2005). Было обнаружено, что эти новые деметилазы деметилируют разные метальные состояния H3K9 и H3K36. JHDM1 деметилирует H3K36me1 и me2, а JHDM2A деметилирует H3K9me1 и me2 (Tsukada et al., 2006; Yamane et al., 2006). Триметильное состояние этих двух модифицированных остатков удаляется отдельным набором энзимов. JHDM3A и JHDM2A могут действовать как на H3KЗбme3, так и на H3K9me3 (Cloos et al., 2006; Fodor et al., 2006; Klose et al., 2006; Tsukada et al., 2006; Whetstine et al., 2006). Возможно, вызывает удивление, что существуют ферменты, которые могут одновременно деметилировать активную (например, H3KЗбте) и репрессивную (например, H3K9me) метку. Это можно объяснить с помощью недавно обнаруженных данных о том, что метилирование H3K9 ассоциируется также с активно транскрибируемыми генами (Vakoc et al., 2005). В более классическом механизме энзим JHDM2A рекрутируется с помощью AR к промоторам, где он участвует в активировании транскрипции через деметилирование H3K9 (Yamane et al., 2006). Структурный анализ JHDM2A показал, что четыре разных домена (JmjN, JmjC, необычный «цинковый палец» и карбокситерминальный домен), объединяясь, образуют каталитический кор. Этими объединившимися доменами формируется глубокая щель, которая требует конформационного изменения в энзиме или субстрате, чтобы приспособить метальную группу для деметилирования. Такой конформационный сдвиг может объяснить специфичность деметилирования (Chen et al., 2006). И нтересно отметить, что од на из вновь открытых деметилаз, JMJD2C, была прежде известна как GASCI — ген, амплифицированный в чешуйчатой карциноме. В соответствии с каузативной ролью этого энзима в развитии рака было показано, что сверхэкспрессия GASCI индуцирует клеточную пролиферацию (Cloos et al., 2006). Эти результаты в совокупности означают, чта деметилазы, как и HKMTs, могут быть «мишенями» для разработки противораковых лекарств (глава 24). Рис. 10.6. Деметилазы лизинов гистонов и сайты деметилирования на гистоне H3
Сайты метилирования лизинов гистонов могут быть моно-, ди- или триметилированными. Известные деметилазы лизинов гистонов обладают различной специфичностью при деметилировании остатков гистонов или метилированных состояний, как это изображено на рисунке
Рис. 10.6. Деметилазы лизинов гистонов и сайты деметилирования на гистоне H3
Сайты метилирования лизинов гистонов могут быть моно-, ди- или триметилированными. Известные деметилазы лизинов гистонов обладают различной специфичностью при деметилировании остатков гистонов или метилированных состояний, как это изображено на рисунке
4.3. Метилирование аргининов
Гистон H3К4
Понимание важной роли метилирования аргининов гистонов в контроле транскрипции пришло после идентификации CARM1, фермента, который может метилировать аргинины в H3 in vitro (Chen et al., 1999). In vivo метилирование аргининов было впоследствии продемонстрировано в экспериментах с использованием антител, специфичных к сайтам метилированных аргининов (Strahl et al., 2001; Wang et al., 2001; Bauer et al, 2002). Участие метилирования аргининов предполагают как в позитивной, так и в негативной регуляции транскрипции. Две метилтрансферазы, PRMT1 (protein arginine methyl-transferse) и PRMT4/CARM1, были связаны с активацией транскрипции. PRMT1 обладает способностью метилировать H4R3 (Strahl et al., 2001; Wang et al., 2001), тогда как PRMT4/CARM1 может катализировать метилирование H3R2, H3R17 и H3R26 (Schurter et al., 2001; Bauer et al., 2002). Специфические транскрипционные факторы (NR, p53, YY1, NFKB) рекрутируют эти ферменты к специфическим промоторам, где они активируют транскрипцию. Напротив, PRMT5 (которая может метилировать H3R8 и H4R3) действует как репрессор многочисленных генов, в том числе некоторых генов, регулируемых МУС (Fabbrizio et al., 2002; Pal et al., 2003). Большинство наших сведений о метилировании аргининов мы получаем при анализе эстрогенного сигнального пути, регулирующего ген pS2. ChlPs показали, что вслед за стимуляцией этого гена эстрогеном происходит сложная и цикличная последовательность событий.Сначала, в течение ближайших после стимула минут, рецептор эстрогена рекрутируется к промотору pS2 и приносит с собой много белковых комплексов и энзимов, которые модифицируют гистоны (Metivier et al., 2003). Важным здесь оказывается рекрутирование CARM1 и PRMT1, которые могут метилировать аргининовые остатки гистонов H3 и Н4 (Ма et al., 2001; Bauer et al., 2002). Это метилирование выявляется очень скоро после прибытия энзимов и совпадает с появлением активной RNA pol II на промоторе. Удивительно однако, что уже спустя минуты после этих событий метилирование по аргининам больше не обнаруживается специфическими антителами, a RNA pol II исчезает. Вскоре после этого метилирование аргининов и RNA pol II появляются вновь (Metivier et al., 2003; Cuthbert et al., 2004; Wang et al., 2004). Причины этих циклических событий неизвестны. Одна из возможностей заключается в том, что они представляют собой механизм быстрого отключения транскрипции, если эстрогеновый сигнал исчезает. Эксперименты, проделанные на реконструированных хроматиновых матрицах, помогли установить прямую роль метилирования аргининов в экспрессии генов. Анализ опосредованной р53 активации транскрипции in vitro показал, что имеет место синергизм между метилированием, обусловленным PRMT1 и CARM1, и ацетилированием с помощью СВР/р300 (An et al., 2004). Более того, эти тесты подтвердили наблюдения, сделанные in vitro на гене pS2, согласно которым во время активации имеет место специфический порядок событий, в ходе которых необходима последовательная активность PRMT1, СВР/р300 и С ARM! (Metivier et al., 2003). С учетом того, что метилирование аргининов представляет собой такой динамический процесс, были описаны несколько способов, которыми контролируется эффективность метилтрансферазы аргининов. Во-первых, взаимодействие этого фермента с другим белком может контролировать его субстратную специфичность. Во-вторых, имеется возможность конкуренции между энзимами за данный аргининовый субстрат. И PRMT1, и PRMT5 могут метилировать H4R3, но первый фермент является активатором, а второй — репрессором транскрипции. Третий уровень регулирования метального состояния может осуществляться деметилированием аргининов. Такая активность все еще не была выделена, но имеются четкие свидетельства быстрого исчезновения метальных групп из аргининов, что делает такую активность весьма привлекательной возможностью (Zhang and Reinberg, 2001; D.Y. Lee et al., 2005; Wysocka et al., 2006a).5. Деиминирование
Отсутствие деметилазы аргининов навело на мысль, что в качестве антагонистов метилирования аргининов могут выступать другие типы ферментативных реакций (Bannister et al., 2002). Одну из таких реакций представляет деиминирование — процесс, посредством которого аргинин может быть превращен в цитруллин за счет удаления иминогруппы. Если данный аргинин моно-метилирован, удаление метиламина эффективно приводило бы к удалению метильной группы из аргинина. В настоящее время показано присутствие цитруллина в гистонах, и идентифицирован фермент, PADI4, который может превращать аргинины в составе гистонов в цитруллины (Cuthbert et al., 2004; Wang et al., 2004). Более того, появление цитруллина в гистонах H3 и Н4 коррелирует с исчезновением метилирования аргинина in vivo. Кроме того, анализ регулируемых эстрогеном промоторов, где метилирование аргининов совпадает с активным состоянием транскрипции, показал, что цитруллин появляется, когда промотор выключен. Многие вопросы относительно этой модификации остаются без ответа. Действует ли цитруллин таким образом, что подавляет активное метилирование по аргининам, или же он репрессирует транскрипцию путем активного рекрутирования белков? Как обстоит дело с обратимостью вставки цитруллина? Это несомненно происходит на промоторах с очень высокой скоростью, но есть ли это ферментативно катализируемая реакция или же это просто обусловлено замещением нуклеосомных гистонов гистоновыми вариантами, которые содержат аргинин на месте цитруллина?6. Убиквитилирование/ деубиквитилирование и сумоилирование
Убиквитин и SUMO — совершенно иные PTMs по сравнению с ацетилированием, фосфорилированием и метилированием. В то время как эти последние PTMs представляют собою малые химические группы, Ub и SUMO — это крупные полипептиды, которые увеличивают размеры гистона приблизительно на две трети. Ub и SUMO на 18 % идентичны по нуклеотидной последовательности и имеют общую трехмерную структуру, но различаются по поверхностному заряду. Гистоны были первыми белками, для которых было показано, что они моноубиквитилированы, хотя точное положение Ub не было идентифицировано до сравнительно недавнего времени (Robzyk et al., 2000; Wang et al., 2004). Подобно метилированию и в отличие от ацетилирования и фосфорилирования (и, возможно, сумоилирования) убиквитилирование может быть либо репрессивным, либо активирующим в зависимости от специфических сайтов. Н2А и Н2В моноубиквитилированы, что контрастирует с полиубиквитилированием, ассоциированным с протеолизом. Влияние моноубиквитилирования на каждый коровый гистон противоположно (рис. 10.7). Моноубиквитилирование Н2В является активирующим для транскрипции, преобразованной RNF20/RNF40 + UbcH6) (Wood et al., 2003; Kim et al., 2005; Zhu et al., 2005), и ведет к метилированию H3K4, как описано в предыдущем разделе и в следующем разделе (Henry et al., 2003; Као et al., 2004). Эта последовательность событий, хотя пока еще непонятная в механистическом плане, консервативна от дрожжей до человека (Kim et al., 2005; Zhu et al., 2005). С другой стороны, у млекопитающих H2AK119ubl является репрессивным для транскрипции и катализируется белком В mi 1/Ring 1 из группы Polycomb (Wang et al., 2004). Нет никаких данных в пользу эволюционного консерватизма репрессивного H2Aub у дрожжей. До сих пор не идентифицирован ни один специфичный для гистонов белок, связывающий убиквитин. Однако поскольку было документировано, что многочисленные домены взаимодействия с убиквитином связываются с негистоновыми убиквитилированными субстратами, кажется весьма вероятным, что будут обнаружены эффекторы для убиквитилированных гистонов. Однако они могут взаимодействовать иным образом, чем взаимодействующие с хроматином домены для ацетилирования и метилирования; т.е., вероятно, имеются два типа одновременных связывающих взаимодействий; одно с поверхностью на убиквитине и другое взаимодействие внутри гистоновых последовательностей для обеспечения специфичности взаимодействия. Деубиквитилирование сайта H2BK123 участвует и в активации, и в поддержании гетерохроматинового сайленсинга через действие двух различных протеаз, Ubp8 и UbplO. Ubp8 является субъединицей комплекса ацетилирования гистонов, SAGA (Sanders et al., 2002), и действует вслед за убиквитилированием, производимым Rad6 (Henry et al., 2003; Daniel et al., 2004). Эта последовательность убиквитилирования H2B, за которым следует деубиквитилирование, необходима для установления соответствующих уровней метилирования H3K4 (требуется H2Bub) и H3K36 (H2Bub не требуется) (Henry et al., 2003). UbplO функционирует в «молчащих» районах, поддерживая низкие уровни H3K4me и ацетилирования лизинов H3/Н4, и таким образом помогает предотвращать транскрипцию (Emre et al., 2005; Gardner et al., 2005).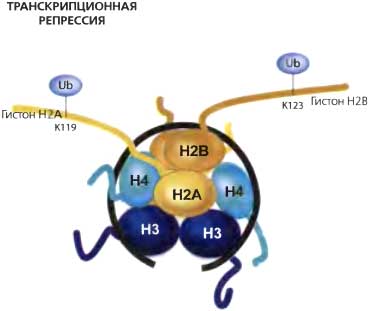 Рис. 10.7. Сайты убиквитилирования гистонов и его последствия для регулирования транскрипции
Убиквитилирование Н2А по Lys-119 коррелирует с репрессией транскрипции. Убиквитилирование H2BK123, наоборот, связано с активацией транскрипции
Рис. 10.7. Сайты убиквитилирования гистонов и его последствия для регулирования транскрипции
Убиквитилирование Н2А по Lys-119 коррелирует с репрессией транскрипции. Убиквитилирование H2BK123, наоборот, связано с активацией транскрипции
Сумоилирование является единственной НРТМ, описанной у дрожжей в качестве репрессивной, и оно консервативно у млекопитающих (Shiio and Eisenman, 2003). Его роль может сводиться, в целом, к негативному действию по предотвращению действия активирующих HPTMs. Это подавление активных HPTMs может осуществляться двумя механизмами. Во-первых, SUMO-гистон может прямо блокировать лизиновые сайты-субстраты, которые могут ацетилироваться или же сумоилироваться (как в модели 2 на рис. 10.1). Во-вторых, сумоилированные гистоны могут рекрутировать HDACs как к хроматину (модель 3), так и через группу SUMO, которая оказывается на связанных с ДНК репрессорах.
7. Темы в модификациях
Предшествовавшее обсуждение многочисленных типов и сайтов гистоновых РТМ, происходящих в транскрипции, могло бы привести к выводу, что всеохватывающих руководящих принципов или идей здесь немного. Тем не менее, по-видимому, действительно есть некоторое число широких тем, которые повторяются, хотя специфика может меняться в зависимости от гистона, сайтов НРТМ и связывающихся белков. Действительно, регулирование хроматина может варьировать в разных промоторах и отдельных путях.7.1. Гистоновый код
После этого затянувшегося обсуждения сложностей HPTMs возникает один ключевой вопрос: почему существует так много модификаций? Несомненно, что многие из них коррелируют с транскрипцией, а другие происходят во время различных матрицируемых ДНК процессов. Таким образом, одна гипотеза заключается в том, что существует гистоновый «код», сопрягающий специфические модификации с индивидуальными процессами (Strahl and Allis, 2000; Turner, 2000). Простейшим кодом могло бы быть бинарное отношение между HPTMs и активацией либо репрессией генов и отдельные HPTMs для других процессов. Данными в пользу такого кода является, как описано выше, наблюдаемая тенденция для одних HPTMs быть позитивно действующими, а для других — негативно действующими. Однако имеются наблюдения, которые не согласуются с простым бинарным кодом. Например, фосфорилирование H3S10 является как активирующим транскрипцию, что предположительно связано с раскрытием хроматина, так и участвующим в конденсации хромосом, делая хроматин еще более недоступным (Nowak and Corces, 2004). Аналогично этому недавно было показано, что уровень H3K9me возрастает во время индукции генов (Vakoc et al., 2005) в дополнение к его хорошо охарактеризованной роли в гетерохроматиновом сайленсинге. Наконец, многие из одних и тех же HPTMs возникают как в транскрипции, так и в репарации ДНК, которые в механистическом плане являются разными процессами. На основе некоторых из этих соображений была предложена более общая гипотеза, где HPTMs служат в качестве ядерного ассоциированного с ДНК пути проведения сигнала, подобного цитоплазматическому проведению сигнала, которое генерируется и воспроизводится в основном через фосфорилирование Ser/Thr (Schreiber and Bernstein, 2002). В этой модели имеет место не строгий гистоновый код, а скорее узнавание и связывание НРТМ благодаря изобилию связывающих белок мотивов. Эта модель объясняет, каким образом любой сайт мог бы быть и активирующим, и репрессирующим и участвовать в более чем одном процессе, потому что различные связывающиеся эффекторные белки имеют сродство к одной и той же НРТМ для разных процессов.7.2. Паттерны модификаций
Некоторые экспериментальные данные указывают на структурное изменение хроматина определенными HPTMs (модель 1). Это может быть результатом изменения заряда одного гистонового остатка или кластера таких остатков. Это особенно верно в тех случаях, когда остатки ацетилированы или фосфорилированы, что уменьшает положительный заряд участков гистона (см. раздел 5 главы 3). Такие c/s-изменения могут менять межнуклеосомные интервалы и снижать сродство гистонов к отрицательно заряженной ДНК, примером чего являются отрицательно заряженные пэтчи, встречающиеся на линкерном гистоне (Dou and Gorovsky, 2002). Эти типы HPTMs могут быт кумулятивными по своему влиянию, например, на транскрипционную активацию или для создания хроматиновых структур более высокого порядка, а не для производства двоичного эффекта «включено/ выключено» (Kurdistani et al., 2004; Henikoff, 2005). Еще одна модель для «конечного результата» [«output»] мириад HPTMs сводится к тому, что код является сложным и считывается паттернами, а нередко и в форме временных последовательностей. Согласно этим взглядам, сложность паттернов в трехмерном пространстве и на протяжении какого-либо процесса, требующего многих связанных с хроматином этапов, таких, например, как транскрипция, дает осмысленный механистический результат. Были идентифицированы два типа паттернов НРТМ. Во-первых, имеются паттерны на одном и том же гистоновом «хвосте», или в «cis»-конфигурации, и, во-вторых, паттерны на разных гистоновых «хвостах», или в «trans»-конфигурации. Лучше всего охарактеризованный cis-паттерн находится между H3S10ph и H3K14ас на аминотерминальном «хвосте» (Cheung et al., 2000; Lo et al., 2000), где H3S10ph ведет к H3K14ac. Механизм, лежащий в основе установления этого паттерна, выяснен в структурных деталях: ацетилируюший фермент связывается с предварительно фосфорилированным «хвостом» H3, проявляя повышенное сродство благодаря большему числу контактных точек аминокислотной боковой цепи (Clements et al., 2003). Другими c/s-паттернам и являются ацетилирование H3K23 и метилирование H3R17 (Daujat et al., 2002) и метилирование H3R3 и ацетилирование H4K8 (Wang et al., 2001). Как описано выше, был идентифицирован один trans-«хвостовой» паттерн, где первоначальное убиквитилирование H2BK123 ведет к метилированию H3K4 (Bnggs et al., 2002; Dover et al., 2002; Sun and Allis, 2002). Механизм, связывающий эти HPTMs, не выяснен, хотя существуют несколько возможных гипотез. Поскольку это связь от одной большой модификации (убиквитин) к несоседней НТРМ, одна из моделей предполагает, что убиквитин, как перемычка, закрепляет хроматин в открытом состоянии [ubiquitin wedges the chromatin open, like a crowbar] и делает возможным доступ метилирующего энзима к его сайту. Вторая общая модель сводится к тому, что H2BK123ub1 функционирует таким образом, что рекрутирует эффекторные белки, аналогично роли других HPTMs. Некаталитическая часть протеасомы требует для ассоциации хроматина убиквитилирования Н2В (Ezhkova and Tansey, 2004), и функционирование элонгационного комплекса FACT стимулируется убиквитилированием Н2В (Pavriet al., 2006), хотя еще не было показано, чтобы какой-либо комплекс непосредственно связывался бы с убиквитилированием Н2В.7.3. Изменения в структуре хроматина, связанные с активацией транскрипции и элонгацией
Транскрипционно активные эухроматиновые районы содержат нуклеосомы, но в «развернутом» состоянии, обозначаемом как «бусинки на нити», или 11-нанометровая фибрилла. Нуклеосомы в этом состоянии все еще оказывают присущее им подавляющее влияние на транскрипционную машину. Некоторые транскрипционные факторы, будь то активаторы или репрессоры, могут получать доступ к своим сайтам, когда они содержатся в нуклеосомах, но другие этого не могут. Более того, аппарат, рекрутируемый связанными с ДНК регуляторами и ответственный за доставку RNA pol II к промоторам, ограничен присутствием нуклеосом. Ряд различных механизмов служит для реконфигурирования хроматина, приведения генов в готовность для последующей транскрипции или стимулирования инициации или элонгации. Некоторые из этих механизмов изображены на рис. 10.8. Проблема с нуклеосомами во время транскрипции отчасти решается рекрутированием белковых комплексов для мобилизации и (или) изменения структуры нуклеосом. Эти комплексы делятся на два разных семейства: одно представлено SNF2H (или ISW1 и ISW2 у дрожжей), а другое — семейством Brahma-Swi/Snf (Narlikar et al., 2002; Peterson, 2002; Flaus and Owen-Hughes, 2004) Первое семейство мобилизует нуклеосомы, тогла как Swi/Snf также временно изменяет структуру нуклеосом. Ацетилированные нуклеосомы распознаются комплексом Swi/Snf через взаимодействие с бромодоменом (модель 1 на рис. 10.8). Вторым механизмом, участвующим в активации генов, является избирательная утеря октамеров в промоторах. Например, у S. cerevisiae октамеры гистонов вытесняются в промоторе гена РН05 во время индукции транскрипции (модель 2 на рис. 10.8) (Boeger et al., 2003; Reinke and Horz, 2003) Кроме того, промоторы S. cerevisiae обладают конститутивно низкой плотностью нуклеосом, что делает возможным доступ для транскрипционных факторов (Sekinger et al., 2005). Все еще неизвестно, способствуют ли комплексы АТФ-зависимош ремоделинга генерированию и поддержанию этого редкого размещения, и если способствуют, то как они это делают. Третий главный механизм, участвующий в установлении транскрипционных состояний, — это наличие вариантов гистонов. Имеются два типа вариантов гистонов, ассоциирующихся с активностью генов. Во-первых, вариант Н2А, называемый H2AZ, обнаруживается в нуклеосомах вокруг вокруг свободного от нуклеосом участка промотора [the promoter gap] и подготавливает ген к активации (Santisteban et al., 2000; Raisner et al., 2005; Zhang et al., 2005); специфичный комплекс АТФ-зависимого ремоделинга, называемый Swrl, замещает Н2А вариантом H2AZ (модель 3 на рис. 10.8) (Mizuguchi et al., 2004; дополнительные детали см. в главе 13). Во-вторых, одна из изоформ H3, называемая Н3.1, во время репликации инкорпорируется в хроматин, тогда как изоформа H3.З инкорпорируется не зависящим от репликации образом (Ahmad andHenikoff, 2002), с помощью шаперона HIRA (histone regulator А). Этот вариант преимущественно обнаруживается внутри ORFs генов (Mito et al., 2005), заставляя полагать, что его размещение является процессом, сочетанным с транскрипцией. Для преодоления нуклеосомного барьера для элонгации RNA pol II (и RNA pol I) существуют дополнительные механизмы. Было изолировано большое число факторов, влияющих на транскрипционную элонгацию (Sims et al., 2004). Обнаружили, что один из этих факторов позволяет RNA pol II преодолевать нуклеосомы. Этот фактор известен как FACT (аббревиатура от Facilitate Chromatin Transcription). Важно, что FACT функционирует исключительно через посредство нуклеосом, связывается с ними и затем стимулирует смещение одного димера Н2А/Н2В (модель 4 на рис. 10.8) (Belotserkovskaya et al., 2003). Коль скоро транскрипция прекращается, FACT также стимулирует реконституцию нуклеосомы. Интересно, что FACT осуществляет свои функции в отсутствие энергии, но физически взаимодействует с CHD1, белком, который гидролизует АТФ для мобилизации нуклеосом и связывания с активной меткой H3K4те. Более того, FACT также взаимодействует с NuA4 — комплексом, содержащим активность HAT. Хотя FACT может способствовать смещению димера Н2А/Н2В in vitro независимым от АТФ образом, возможно, что это стимулируется его взаимодействием с такими факторами, как CHD1, которые мобилизуют или изменяют структуру нуклеосом in vivo, а также взаимодействие с HPTMs (Reinberg and Sims, 2006). Рис. 10.8. Модели участия ремоделинга хроматина и обмена гистонов в процессах транскрипции
В модели 1 семейство АТФаз Swi/Snf связывается с хроматином посредством узнавания ацетилированных гистонов с помощью бромодомена и действует таким образом, чтобы изменить локальную структуру хроматина. Модель 2 изображает замещение октамера [the reported octamer eviction], происходящее в некоторых локусах, таких как РН05, с помощью неизвестного механизма. В модели 3 АТФаза SWR1 катализирует замещение гистона Н2А вариантом H2AZ. который подготавливает хроматин к транскрипции. В модели 4 делается акцент на участии FACT в транскрипционной элонгации, что способствует развертыванию [unraveling] за счет смещения димера Н2А/Н2В. Это может сопровождаться обменом гистона H3 на H3.З в ходе этого процесса
Рис. 10.8. Модели участия ремоделинга хроматина и обмена гистонов в процессах транскрипции
В модели 1 семейство АТФаз Swi/Snf связывается с хроматином посредством узнавания ацетилированных гистонов с помощью бромодомена и действует таким образом, чтобы изменить локальную структуру хроматина. Модель 2 изображает замещение октамера [the reported octamer eviction], происходящее в некоторых локусах, таких как РН05, с помощью неизвестного механизма. В модели 3 АТФаза SWR1 катализирует замещение гистона Н2А вариантом H2AZ. который подготавливает хроматин к транскрипции. В модели 4 делается акцент на участии FACT в транскрипционной элонгации, что способствует развертыванию [unraveling] за счет смещения димера Н2А/Н2В. Это может сопровождаться обменом гистона H3 на H3.З в ходе этого процесса
8. Заключительные замечания
Мы прошли долгий путь в эту «современную эпоху» модификаций гистонов, охватывающую последние 10 лет. В это время были охарактеризованы шесть разных типов путей модификации гистонов и идентифицированы многочисленные сайты модификаций. Тем не менее очевидно, что это все еще лишь начало нашего понимания проблемы. В механистическом плане нам известно, что модификации влияют на связывание белков, но мы все еще не знаем, как именно эти белки приводят к реорганизации структуры хроматина. Мы все еще не знаем, существует ли код или же модификации являются просто частью сигнального пути. Кроме того, у нас недостает знаний о многих клеточных процессах помимо транскрипции, в которых могут участвовать модификации. Таким образом, говоря коротко, мы узнали о сложности этой системы, но мы все еще далеки от понимания смысла этой сложности. Одно можно сказать наверняка: усилия оправданны, ибо модификации гистонов играют фундаментальную роль и в нормальных процессах, и в процессах, связанных с заболеваниями.Литература
Ahmad K. and HenikoffS., 2002. The histone variant H3.3 marks active chromatin by replication-independent nucleosome assembly. Mot Cell 9: 1191-1200. An W., Kim J., and Roeder R.G., 2004. Ordered cooperative functions of PRMT1, p300, and CARM1 in transcriptional activation by p53. Cell 117: 735-748. Baek S.H. and Rosenfeld M.G., 2004. Nuclear receptor coregulators: Their modification codes and regulatory mechanism by translocation. Biochem. Biophys. Res. Commun. 319: 707-714. Bannister A.J., Schneider R., and Kouzarides T., 2002. Histone modification: Dynamic or static? Cell 109: 801-806. Bannister A.J., Zegerman R, Partridge J.F., Miska E.A., Thomas J.O., Allshire R.C., and Kouzarides T., 2001. Selective recognition of methylated lysine 9 on histone H3 by the HP1 chromo domain. Nature 410: 120-124. Bauer U.M., Daujat S., Nielsen S.J., Nightingale K., and Kouzarides T., 2002. Methylation at arginine 17 of histone H3 is linked to gene activation. EMBO Rep. 3: 39-44. Belotserkovskaya R., Oh S., Bondarenko V.A., Orphanides G., Studitsky V.M., and Reinberg D., 2003. FACT facilitates transcription-dependent nucleosome alteration. Science 301: 1090-1093. Boeger H., Griesenbeck J., Strattan J.S., and Komberg R.D., 2003. Nucleosomes unfold completely at a transcriptionally active promoter. Mol. Cell 11: 1587-1598. Braunstein M., Rose A.B., Holmes S.G., Allis C.D., and Broach J.R. 1993. Transcriptional silencing in yeast is associated with reduced nucleosome acetylation. Genes Dev. 1: 592-604. Briggs S.D., XiaoT., SunZ.W., Caldwell J.A., Shabanowitz J., Hunt D.F., Allis C.D., and Strahl B.D., 2002. Gene silencing: Trans-histone regulatory pathway in chromatin. Nature 418: 498. Brownell J.E., Zhou J., RanalliT., Kobayashi R., Edmondson D.G., Roth S.Y., and Allis C.D. 1996. Tetrahymena histone acetyltrans-ferase A: A homolog to yeast Gcn5p linking histone acetylation to gene activation. Cell 84: 843-851. Carrozza M.J., Li B., Florens L., Suganuma T., Swanson S.K., Lee K.K., Shia W.J., Anderson S., Yates J., Washburn M.P., and Workman J.L., 2005. Histone H3 methylation by Set2 directs deacetylation of coding regions by Rpd3S to suppress spurious intragenic transcription. Cell 123: 581-592. Chen D., Ma H., Hong H., Koh S.S.. Huang S.M., Schurter B.T., Aswad D.W, and Stallcup M.R. 1999. Regulation of transcription by a protein methyltransferase. Science 284: 2174-2177. Chen Z., Zang J., Whetstine J., HongX., Davrazou F, Kutateladze T.G., Simpson M., Mao Q., Pan C.H., Dai S., et al., 2006. Structural insights into histone demethylation by JM JD2 family members. Cell 125: 691-702. Cheung P., Tanner K.G., Cheung W.L., Sassone-Corsi P., Denu J.M., and Allis CD., 2000. Synergistic coupling of histone H3 phosphorylation and acetylation in response to epidermal growth factor stimulation. Mol. Cell 5: 905-915. Clark-Adams C.D., Norris D., Osley M.A., Fassler J.S., and Winston F. 1988. Changes in histone gene dosage alter transcription in yeast. Genes Dev. 2: 150-159. Clements A., Poux A.N., Lo W.S., Pillus L., Berger S.L., and Mar-morstein R., 2003. Structural basis for histone and phosphohis-tone binding by the GCN5 histone acetyltransferase. Mol. Cell 12: 461-473. Cloos PA., Christensen J.. Agger K., Maiolica A., Rappsilber J., Antal T., Hansen K.H., and Helin K., 2006. The putative oncogene GASC1 demethylates tri- and dimethylated lysine 9 on histone H3. Nature 442: 307-311. Cuthbert G.L., Daujat S., Snowden A.W., Erdjument-Bromage H., Hagiwara T., Yamada M., Schneider R., Gregory P.D., Tempst P., Bannister A.J., and Kouzarides T., 2004. Histone deimination antagonizes arginine methylation. Cell 118: 545-553 Daniel J.A., Torok M.S., Sun Z.W., Schieltz D., Allis C.D., Yates J.R., III, and Grant PA., 2004. Deubiquitination of histone H2B by a yeast acetyltransferase complex regulates transcription. J. Biol. Chem. 279: 1867-1871. Daujat S., Bauer U.M., Shah V., Turner B., Berger S., and Kouzarides T., 2002. Crosstalk between CARM1 methylation and CBP acetylation on histone H3. Curr. Biol. 12: 2090-2097. Dhalluin C., Carlson J.E., Zeng L., He C, Aggarwal A.K., and Zhou M.M. 1999. Structure and ligand of a histone acetyltransferase bromodomain. Nature 399: 491-496. Dou Y. and Gorovsky M.A., 2002. Regulation of transcription by H1 phosphorylation in Tetrahymena is position independent and requires clustered sites. Proc. Natl. Acad. Sci. 99: 6142-6146. Dover J., Schneider J., Tawiah-Boateng M.A., Wood A., Dean K, Johnston M., and Shilatifard A., 2002. Methylation ofhistone H3 by COMPASS requires ubiquitination ofhistone H2B by Rad6 J. Biol. Chem. 277: 28368-28371. Durrin L.K., Mann R.K., Kayne PS., and Grunstein M. 1991. Yeast histone H4 N-terminal sequence is required for promoter activation in vivo. Cell 65: 1023-1031. Emre N.C., Ingvarsdottir K., Wyce A., Wbod A., Krogan N. J., Henry K.W., Li K., Marmorstein R., Greenblatt J.F, Shilatifard A., and Berger S.L., 2005. Maintenance of low histone ubiquitylationby UbplO correlates with telomere-proximal Sir2 association and gene silencing. Mol. Cell 17: 585-594. Ezhkova E. and Tansey W.P., 2004. Proteasomal ATPases link ubiq-uitylation of histone H2B to methylation of histone H3. Mol. Cell 13: 435-442. Fabbrizio E., El Messaoudi S., Polanowska J., Paul C., Cook J.R., Lee J.H., Negre V., Rousset M., Pestka S., Le Cam A., and Sardet C., 2002. Negative regulation of transcription by the type II ai’ginine methyltransferase PRMT5. EMBO Rep. 3: 641-645. Fischle W., Tseng B.S., Dormann H.L., Ueberheide B.M., Garcia B.A., Shabanowitz J., Hunt D.F., Funabiki H., and Allis C.D., 2005. Regulation of HP I-chromatin binding by histone H3 methylation and phosphorylation. Nature 438: 1116-1122. Flaus A. and Owen-Hughes T., 2004. Mechanisms for ATP-depen-dent chromatin remodelling: Farewell to the tunacan octamer? Curr. Opin. Genet Dev. 14: 165-173. Fodor B.D., Kubicek S., Yonezawa M., O’Sullivan R.J., Sengupta R., Perez-Burgos L., Opravil S., Mechtler K., Schotta G., and Jenuwein T., 2006. Jmjd2b antagonizes H3K9 tnmethylation at pericentric heterochromatin in mammalian cells. Genes Dev., 20: 1557-1562. Gardner R.G., Nelson Z.W., and Gottschling D.E., 2005. UbplO/ Dot4p regulates the persistence of ubiquitinated histone H2B: Distinct roles in telomeric silencing and general chromatin. Mol. Cell. Biol. 25: 6123-6139. Glozak M.A., Sengupta N., Zhang X., and Seto E., 2005. Acetylation and deacetylation of non-histone proteins. Gene 363: 15-23. Grant P.A., Sterner D.E., Duggan L.J., Workman J.L., and Berger S.L. 1998. The SAGA unfolds: Convergence of transcription regulators in chromatin-modifying complexes. Trends Cell Biol. 8: 193-197. Hall I.M., Shankaranarayana C.D., Noma K., Ayoub N., Cohen A., and Grewal S.L, 2002. Establishment and maintenance of a heterochromatin domain. Science 297: 2232-2237. Hampsey M. and Reinberg D., 2003. Tails of intrigue: Phosphorylation of RNA polymerase II mediates histone methylation. Cell 113: 429-432. Han M. and Grunstein M. 1988. Nucleosome loss activates yeast downstream promoters in vivo. Cell 55: 1137-1145. Hassan A.H., Prochasson P., Neely K.E., Galasinski S.C, Chandy M., Carrozza M.J., and Workman J.L., 2002. Function and selectivity of bromodomains in anchoring chromatin-modifying complexes to promoter nucleosomes. Cell 111: 369-379. Hebbes T.R., Clayton A.L., Thome A.W., and Crane-Robinson C. 1994. Core histone hyperacetylation co-maps with generalized DNase I sensitivity in the chicken beta-globin chromosomal domain. EMBO J. 13: 1823-1830. Henikoff S., 2005. Histone modifications: Combinatorial complexity or cumulative simplicity? Proc. Natl. Acad. Sci. 102: 5308-5309. Henry K.W., Wyce A., Lo W.S., Duggan L.J., Emre N.C., Kao C.F., Pillus L., Shilatifard A., Osley M.A., and Berger S.L., 2003. Transcriptional activation via sequential histone H2B ubiquitylation and deubiquitylation, mediated by SAGA-associated Ubp8. Genes Dev. 17: 2648-2663. Hirota T., Lipp J.J., Toh B.H., and Peters J.M., 2005. Histone H3 serine 10 phosphorylation by Aurora B causes HP1 dissociation from heterochromatin. Nature 438: 1176-1180. JenuweinT. and Allis C.D., 2001. Translating the histone code. Science 293: 1074-1080. Joshi A.A. and Struhl K., 2005. Eaf3 chromodomain interaction with methylated H3-K36 links histone deacetylation to Pol II elongation. Mol. Cell, 20: 971-978. Kao C.F., Hillyer C., Tsukuda T, Henry K., Berger S., and Osley M A, 2004. Rad6 plays a role in transcriptional activation through ubiquitylation ofhistone H2B. Genes Dev. 18: 184-195. Keogh M.C., Kurdistani S.K., Morris S.A., Ahn S.H., Podolny V., Collins S.R., Schuldiner M.. Chin K., Punna T., Thompson N.J., et al., 2005. Cotranscriptional set2 methylation ofhistone H3 lysine 36 recruits a repressive Rpd3 complex. Cell 123: 593-605. Kim J., Hake S.B., and Roeder R.G., 2005. The human homolog of yeast BRE1 functions as a transcriptional coactivator through direct activator interactions. Mol. Cell, 20: 759-770. Klose R.J., Yamane K., Bae Y., Zhang D., Erdjument-Bromage H., Tempst P., Wong J., and Zhang Y., 2006. The transcriptional repressor JHDM3A demethylates trimethyl histone H3 lysine 9 and lysine 36. Nature 442: 312-316. Kurdistani S.K. and Grunstein M., 2003. Histone acetylation and deacetylation in yeast. Nat. Rev. Mol. Cell. Biol. 4: 276-284. Kurdistani S.K., Tavazoie S., and Grunstein M., 2004. Mapping global histone acetylation patterns to gene expression. Cell 117: 721-733. Lachner M., O’Carroll D., Rea S., Mechtler K., and Jenuwein T., 2001. Methylation ofhistone H3 lysine 9 creates a binding site for HP1 proteins. Nature 410: 116-120. Lee D.Y., Teyssier C, Strahl B.D., and Stallcup M.R., 2005. Role of protein methylation in regulation of transcription. Endocr, Rev. 26: 147-170. Lee M.G., Wynder C., Cooch N., and Shiekhattar R., 2005. An essential role for CoREST in nucleosomal histone 3 lysine 4 demethylation. Nature 437: 432-435. Li H., Ilin S., Wang W., Duncan E.M., Wysocka J., Allis C.D., and Patel D.J., 2006. Molecular basis for site-specific read-out of histone H3K4me3 by the BPTF PHD finger of NURF. Nature 442: 91-95. Litt M.D., Simpson M., Gaszner M., Allis C.D., and Felsenfeld G., 2001. Correlation between histone lysine methylation and developmental changes at the chicken beta-globin locus. Science 293: 2453-2455. Lo W.S., Duggan L., Emre N.C, Belotserkovskya R., Lane W.S., Shiekhattar R., and Berger S.L., 2001. Snfl — A histone kinase that works in concert with the histone acetyltransferase Gcn5 to regulate transcription. Science 293: 1142-1146. Lo W.S., Trievel R.C, Rojas J.R., Duggan L., Hsu J.Y., Allis C.D., Marmorstein R., and Berger S.L., 2000. Phosphorylation of serine 10 in histone H3 is functionally linked in vitro and in vivo to Gcn5-mediated acetylation at lysine 14. Mol. Cell 5: 917-926. Ma H., Baumann C.T., Li H., Strahl B.D., Rice R., Jelinek M.A., Aswad D.W., Allis C.D., Hager G.L., and Stallcup M.R., 2001. Hormone-dependent, CARM1-directed, arginine-specific methylation ofhistone H3 on a steroid-regulated promoter. Curr. Biol. 11: 1981-1985. Macdonald N., Welbum J.P., Noble M.E., Nguyen A., Yaffe M.B., Clynes D., Moggs J.G., Orphanides G., Thomson S., Edmunds J.W., et al., 2005. Molecular basis for the recognition of phos-phorylated and phosphoacetylated histone H3 by 14-3-3. Mol. Cell 20: 199-211. Mahadevan L.C., Willis A.C., and Barratt M.J. 1991. Rapid histone H3 phosphorylation in response to growth factors, phorbol esters, okadaic acid, and protein synthesis inhibitors. Cell 65: 775-783. Martin C. and Zhang Y., 2005. The diverse functions ofhistone lysine methylation. Nat. Rev. Mol. Cell. Biol. 6: 838-849. Metivier R., Penot C., Hubner M.R., ReidC., Brand H., Kos M., and Gannon F., 2003. Estrogen receptor directs ordered, cyclical, and combinatorial recruitment of cofactors on a natural target promoter. Cell 115: 751-763. Metzger E., Wissmann M., Yin N., Muller J.M., Schneider R., Peters A. H., Gunther T., Buettner R., and Schule R., 2005. LSD1 demethylates repressive histone marks to promote androgen-receptor-dependent transcription. Nature 437: 436-439. Mito Y., Henikoff J.G., and Henikoff S., 2005. Genome-scale profiling ofhistone H3.3 replacement patterns. Nat. Genet. 37: 1090-1097. Mizuguchi C., Shen X., Landry J., Wu W.H., Sen S., and Wu C., 2004. ATP-driven exchange of histone H2AZ variant catalyzed by SWR1 chromatin remodeling complex. Science 303: 343-348. Nakayama J., Rice J.C., Strahl B.D., Allis C.D., and Grewal S.L, 2001. Role ofhistone H3 lysine 9 methylation in epigenetic control of heterochromatin assembly. Science 292: 110-113. Narlikar G.J., Fan H.Y., and Kingston R.E., 2002. Cooperation between complexes that regulate chromatin structure and transcription. Cell 108: 475-487. Noma K., Allis C.D., and Grewal S.L, 2001. Transitions in distinct histone H3 methylation patterns at the heterochromatin domain boundaries. Science 293: 1150-1155. Nowak S.J. and Corces V.G., 2004. Phosphorylation ofhistone H3: A balancing act between chromosome condensation and transcriptional activation. Trends Genet., 20: 214-220. Pal S., Yun R., Datta A., Lacomis L., Erdjument-Bromage H., Kumar J., Tempst P., and Sif S., 2003. mSin3A/histone deacetylase 2- and PRMT5-containing Brgl complex is involved in transcriptional repression of the Myc target gene cad. Mol. Cell. Biol. 21: 7475-7487. Pavri R., Zhu B., Li G., Trojer P., Mandal S., Shiiatifard A., and Reinberg D., 2006. Histone H2B monoubiquitination functions cooperatively with FACT to regulate elongation by RNA polymerase II. Cell 125: 703-717. Peterson C.L., 2002. Chromatin remodeling: Nucleosomes bulging at the seams. Curr. Biol. 12: R245-R247. Raisner R.M., Hartley P.D., Meneghini M.D., Bao M.Z., Liu C.L., Schreiber S.L., Rando O.J., and Madhani H.D., 2005. Histone variant H2A.Z marks the 5’ ends of both active and inactive genes in euchromatin. Cell 123: 233-248. Rea S., Eisenhaber E, O’Carroll D., Strahl B.D., Sun Z.W., Schmid M., Opravil S., Mechtler K., Pontmg C.P., Allis C.D., and Jenu-wein T., 2000. Regulation of chromatin structure by site-specific histone H3 methyltransferases. Nature 406: 593-599. Reinberg D. and Sims R.J., III., 2006. de FACTo nucleosome dynamics. J. Biol. Chem.(in press). Reinke H. and Horz W., 2003. Histones are first hyperacetylated and then lose contact with the activated PH05 promoter. Mol. Cell 11: 1599-1607. Robzyk K., Recht J., and Osley M.A., 2000. Rad6-dependent ubiq-uitination ofhistone H2B in yeast. Science 287: 501-504. Roth S.Y., Demi J.M., and Allis C.D., 2001. Histone acetyltrans-ferases. Annu. Rev. Biochem. 70: 81-120. Sanders S.L., Jennings J., Canutescu A., Link A.J., and Weil P.A., 2002. Proteomics of the eukaryotic transcription machinery: Identification of proteins associated with components of yeast TEIID by multidimensional mass spectrometry. Mol. Cell. Biol. 22: 4723-4738. Santisteban M.S., Kalashnikova T., and Smith M.M., 2000. Histone H2A.Z regulates transcription and is partially redundant with nucleosome remodeling complexes. Cell 103: 411-422. Santos-Rosa H., Schneider R., Bannister A. J., Sherriff J., Bernstein B.E., Emre N.C., Schreiber S.L., Mellor J., and Kouzarides T., 2002. Active genes are tri-methylated at K4 ofhistone H3. Nature 419: 407-411. Sassone-Corsi P., Mizzen C.A., Cheung P., Crosio C, Monaco L., Jacquot S., Hanauer A., and Allis C.D. 1999. Requirement of Rsk-2 for epidermal growth factor-activated phosphorylation of histone H3. Science 285: 886-891. Schreiber S.L. and Bernstein B.E., 2002. Signaling network model of chromatin. Cell 111: 771-778. Schurter B.T., Koh S.S., Chen D., Bunick G.J., Harp J.M., Hanson B.L, Henschen-Edman A., Mackay D.R., Stallcup M.R., and Aswad D.W., 2001. Methylation ofhistone H3bycoactivator-asso-ciated arginine methyltransferase 1. Biochemistry 40: 5747-5756. Sekinger E.A., Moqtaderi Z., and Struhl K., 2005. Intrinsic histone-DNA interactions and low nucleosome density are important for preferential accessibility of promoter regions in yeast. Mol. Cell 18: 735-748. Shi Y., Lan E., Matson C., Mulligan P., Whetstine J.R., Cole P.A., Casero R.A., and Shi Y., 2004. Histone demethylation mediated by the nuclear amine oxidase homolog LSD1. Cell 119: 941-953. Shi Y.J., Matson C., Lan E., Iwase S., Baba T., and Shi Y., 2005. Regulation of LSD 1 histone demethylase activity by its associated factors. Mol. Cell. 19: 857-864. Shiio Y. and Eisenman R.N., 2003. Histone sumoylation is associated with transcriptional repression. Proc. Natl. Acad. Sci. 100: 13225-13230. Shim E.Y., Woodcock C., and Zaret K.S. 1998. Nucleosome positioning by the winged helix transcription factor HNF3. Genes Dev. 12: 5-10. Shogren-Knaak M., Ishii H., Sun J.M., Pazin M.J., Davie J.R., and Peterson C.L., 2006. Histone H4-K16 acetylation controls chromatin structure and protein interactions. Science 311: 844-847. Sims. R.J.. Belotserkovskaya R., and Reinberg D., 2004. Elongation by RNA polymerase II: The short and long of it. Genes Dev. 18: 2437-2468. Sims R.J., Chen C.F., Santos-Rosa H., Kouzarides T., Patel S.S., and Reinberg D., 2006. Human but not yeast CHD1 binds directly and selectively to histone H3 methylated at lysine 4 via its tandem chromodomains. J. Biol. Chem. 51: 41789-41792. Soloaga A., Thomson S., Wiggin G.R., Rampersaud N., Dyson M.H., Hazzalin C.A., Mahadevan L.C., and Arthur J.S., 2003. MSK2 and MSK1 mediate the mitogen- and stress-induced phosphorylation ofhistone H3 and HMG-14. EMBO J. 22: 2788-2797. Sterner D.E. and Berger S.L., 2000. Acetylation of histones and transcription-related factors. Microbiol. Mol. Biol. Rev. 64: 435-459. Strahl B.D. and Allis C.D., 2000. The language of covalent histone modifications. Nature 403: 41-45. Strahl B.D., Briggs S.D., Brame C.J., Caldwell J.A., Koh S.S., Ma H., Cook R.G., Shabanowitz J., Hunt D.E., Stallcup M.R., and Allis C.D., 2001. Methylation ofhistone H4 at arginine 3 occurs in vivo and is mediated by the nuclear receptor coactivator PRMT1. Curr. Biol. 26: 996-1000. Sun Z.W. and Allis C.D., 2002. Ubiquitination ofhistone H2B regulates H3 methylation and gene silencing in yeast. Nature 418: 104-108. Svaren J., Schmitz J., and Horz W. 1994. The transactivation domain of Pho4 is required for nucleosome disruption at the PH05 promoter. EMBO J. 13: 4856-4862. Taunton J., Hassig C.A., and Schreiber S.L. 1996. A mammalian histone deacetylase related to the yeast transcriptional regulator Rpd3p. Science 111: 408-411. Trewick S.C., McLaughlin P.J., and Allshire R.C., 2005. Methylation: Lost in hydroxylation? EMBO Rep. 6: 315-320. Tsukada Y., Fang J., Erdjument-Bromage H., Warren M.E., Borch-ers C.H., Tempst P., and Zhang Y., 2006. Histone demethylation by a family of JmjC domain-containing proteins. Nature 439: 811-816. Turner B.M., 2000. Histone acetylation and an epigenetic code. Bioessays 22: 836-45. Vakoc C.R., Mandat S.A., Olenchock B.A., and Blobel G.A., 2005. Histone H3 lysine 9 methylation and HP1* are associated with transcription elongation through mammalian chromatin. Mol. Cell 19: 381-391. Vettese-Dadey M., Grant P.A., Hebbes T.R., Crane-Robinson C, Allis C.D., and Workman J.L. 1996. Acetylation ofhistone H4 plays a primary role in enhancing transcription factor binding to nucleosomal DNA in vitro. EMBO J. 15: 2508-2518. Volpe T.A., Kidner C., Hall I.M., Teng G., Grewal S.L, and Mar-tienssen R.A., 2002. Regulation of heterochromatic silencing and histone H3 lysine-9 methylation by RNAi. Science 297: 1833-1837. Wang H., Wang L., Erdjument-Bromage H., Vidal M., Tempst P., Jones R.S., and Zhang Y., 2004. Role ofhistone H2Aubiquitination in Polycomb silencing. Nature 431: 873-878. Wang H., Huang Z.Q., Xia L., Feng Q., Erdjument-Bromage H., Strahl B.D., Briggs S.D., Allis C.D., Wfong J., Tempst P., and Zhang Y., 2001. Methylation ofhistone H4 at arginine 3 facilitating transcriptional activation by nuclear hormone receptor. Science 293: 853-857. Wang Y., Wysocka J., Sayegh J., Lee Y.H., Perlin J.R., Leonelli L., Sonbuchner L.S., McDonald C.H., Cook R.G., Dou Y., et al., 2004. Human PAD4 regulates histone arginine methylation levels via demethylimination. Science 306: 279-283. Whetstine J.R., Noffice A., Lan F., Huarte M., Smolikov S., Chen Z., Spooner E., Li E., Zhang G., Colaiacovo M., and Shi Y., 2006. Reversal of histone lysine trimethylation by the JMJD2 family ofhistone demethylases. Cell 125: 467-481. Wood A., Krogan N.J., Dover J., Schneider J., Heidt J., Boateng M.A., Dean K., Golshani A., Zhang Y., Greenblatt J.F., et al., 2003. Brel, an E3 ubiquitin ligase required for recruitment and substrate selection of Rad6 at a promoter. Mol Cell 11: 267-274. Workman J.L. and Roeder R.G. 1987. Binding of transcription factor TFIID to the major late promoter during in vitro nucleosome assembly potentiates subsequent initiation by RNA polymerase II. Cell 51: 613-622. Wysocka J., Allis C.D., and Coonrod S., 2006a. Histone arginine methylation and its dynamic regulation. Front. Biosci. 11: 344-355. Yamane K., Toumazou C., Tsukada Y., Erdjument-Bromage H., Tempst P., Wong J., and Zhang Y., 2006. JHDM2A, a JmjC-contaimng H3K9 demethylase, facilitates transcription activation by androgen receptor. Cell 125: 483-495. Yang X.J. and Seto E., 2003. Collaborative spirit ofhistone deacety-lases in regulating chromatin structure and gene expression. Curr. Opin. Genet. Dev. 13: 143-153. Zhang H., Roberts D.N., and Cairns B.R., 2005. Genome-wide dynamics of Htz1, a histone H2A variant that poises repressed/ basal promoters for activation through histone loss. Cell 123: 219-231. Zhang Y. and Reinberg D., 2001. Transcription regulation by histone methylation: Interplay between different covalent modifications of the core histone tails. Genes Dev. 15: 2343-2360. Zhu B., Zheng Y., Pham A.D., Mandal S.S., Erdjument-Bromage H., Tempst P., and Reinberg D., 2005. Monoubiquitination of human histone H2B: The factors involved and their roles in HOX gene regulation. Mol. Cell, 20: 601-611.Глава 11. Транскрипционный сайленсинг, осуществляемый белками группы Polycomb
 Ueli Grossniklaus1 и Renato Paro2
1Institute of Plant Biology and Zurich-Basel Plant Science Center, University of Zurich, CH-8008 Zurich, Swizerland
2ZMBH, University of Heidelberg, D-69120 Heidelberg, Germany
Ueli Grossniklaus1 и Renato Paro2
1Institute of Plant Biology and Zurich-Basel Plant Science Center, University of Zurich, CH-8008 Zurich, Swizerland
2ZMBH, University of Heidelberg, D-69120 Heidelberg, Germany
Общее резюме
Органы человека, животных и растений сконструированы из большого набора разных клеточных типов, каждый из которых выполняет специальную физиологическую или структурную функцию За очень немногими исключениями все типы клеток содержат одну и ту же генетическую информацию, закодированную в их ДНК. Таким образом, отличие данного клеточного типа от других достигается посредством специфических программ экспрессии генов. Однако линии клеток нуждаются в том, чтобы поддерживать эти программы экспрессии генов в ходе своего роста и клеточного деления. Это предполагает существование системы памяти, обеспечивающей надежную передачу от материнской клетки к дочерним, информации о том, какой ген должен быть активным, а какой репрессированным. Существование такой системы иллюстрируется тем фактом, что культивируемые ткани растений и животных обычно поддерживают свои дифференцированные признаки даже при росте в чужеродной среде. Можно привести в качестве примера, что растения плюща обыкновенного, регенерировавшие после тканевой культуры, продуцируют тип листьев, соответствующий фазе развития, в которой была взята исходная ткань (т.е. ювенильный или взрослый лист). Основной вопрос, рассматриваемый в этой и последующих главах, касается молекулярной идентичности факторов, вносящих вклад в механизм (или механизмы), поддерживающий детерминированные состояния в ряду многих клеточных делений (процесс, называемый «клеточной памятью» или «транскрипционной памятью»). Генетический анализ у Drosophila позволил идентифицировать регуляторы, играющие критическую роль в поддержании судьбы индивидуальных сегментов тела и детерминируемые действием генов НОХ. У самцов Drosophila первый торакальный сегмент имеет ноги с половыми гребешками. Ноги на втором и третьем торакальном сегменте не имеют этих структур (см. левую часть рисунка на титульной странице). В 1940-е годы у Drosophila были идентифицированы мутанты (Polycomb и extra sex comb), у которых самцы имели половые гребни на всех ногах (см. правую часть рисунка на титульной странице). Они соответствуют гомеотическим трансформациям идентичностей второй и третьей пары ног в идентичность первой пары ног. Генетические и молекулярные исследования показали, что эти мутации сами по себе не влияют на продукты самих генов НОХ\ скорее, они влияют на способ, которым активность генов НОХ контролируется пространственно. На протяжении ряда лет было идентифицировано большое число таких регуляторных генов, которые можно было разбить на две антагонистические группы — Poly comb (PcG) и trithorax (trxG). В то время как белки PcG необходимы для поддержания сайленсированного состояния регуляторов развития, таких как гены НОХ, белки trxG обычно участвуют в поддержании активного состояния экспрессии генов. Таким образом, белки PcG и trxG образуют молекулярную основу клеточной памяти. Белки PcG и trxG организованы в крупные мультимерные комплексы, которые действуют на их гены-мишени, модулируя структуру хроматина. В этой главе мы делаем акцент на молекулярной природе и функции двух главных репрессивных комплексов группы Polycomb, PRC1 и PRC2; молекулярная природа комплексов trxG описывается в следующей главе. Комплексы PcG рекрутируются к генам-мишеням посредством нуклеотидной последовательности ДНК, называемой у Drosophila «Элементом ответа» PcG (PRE, PcG Response Element). Будучи рекрутированы, они устанавливают состояние «молчащего» хроматина, которое может наследоваться в ряду многих клеточных делений. Члены PRC2 консервативны у растений и животных, тогда как PRC1 присутствуют только у Drosophila и позвоночных. Это предполагает консерватизм, но и разнообразие в основных строительных блоках системы клеточной памяти. В дополнение к их функции в поддержании клеточных типов комплексы PcG могут также играть важную роль в пластичности стволовых клеток. Их дерегуляция может приводить к неопластической трансформации и раку у позвоночных. Таким образом, белки PcG играют ключевую роль во многих фундаментальных процессах нормального развития и заболеваний у многоклеточных эукариот.1. Введение
Все многоклеточные организмы начинаются с одной клетки, зиготы, которая в ходе развития дает начало множеству различных клеточных типов со специализированными функциями. Это ставит перед нами проблему: каким образом, будучи однажды детерминированы, клеточные типы могут поддерживаться на протяжении многих клеточных делений, происходящих в различных фазах роста?1.1. Концепция клеточной памяти
Взрослое животное обладает 200—300 структурно различными клеточными типами, тогда как растение — где-то между 30 и 40. Если принять во внимание сложные паттерны экспрессии генов, можно различить еще большее число разных клеточных популяций. Идентичность и функция данного клеточного типа определяются характерным для него профилем экспрессии генов, где соответствующие группы генов являются либо активными, либо «молчащими». В ходе развития и в состоянии гомеостаза взрослого организма критически важно помнить и надежно воспроизводить это состояние после каждого клеточного деления. Это особенно важно во время репликации генетического материала (фаза S) и расхождения хромосом в митозе (фаза М), которые являются событиями, повторяющимися в каждом клеточном цикле и прерывающими процессы экспрессии генов. Итак, каким же образом дифференциальные паттерны генной экспрессии могут поддерживаться от одного клеточного поколения до следующего? Мы знаем из экспериментов, проделанных в 1960— 1970-е годы, что ткани растений и животных «помнят» свое детерминированное состояние даже после продолжительных пассажей в культуре (Hadom, 1968; Hackett et al., 1987). Хадорн и сотрудники показали что клетки имагинальных дисков, обнаруживаемых в личинках Drosophila, обладают присущей им клеточной памятью, что позволяет им помнить состояния детерминации, фиксированные в эмбриогенезе. Имагинальные диски — это кластеры эпителиальных клеток, обособливающиеся в развивающемся эмбрионе в качестве предшественников специфичных внешних структур и придатков во время метаморфоза. Например, из двух пар имагинальных дисков во втором торакальном сегменте одна образует среднюю пару ног, а другая — крылья (рис. 12.2). Имагинальные диски можно культивировать путем трансплантации в гемоцель взрослых самок, где они продолжают пролиферировать, но не дифференцируются. Когда такой диск пересаживают обратно в личинку перед началом метаморфоза, он в конечном счете дифференцируется в ожидаемые структуры взрослого организма даже после нескольких трансплантационных пассажей. Позже было показано, что для поддержания этого детерминированного состояния клеток имагинальных дисков необходимы белки PcG и trxG (рис. 11.1). Однако в описанных выше экспериментах с культивированием наблюдали, что в редких случаях имагинальный диск может изменить свою судьбу в результате процесса, названного трансдетерминацией. Этот процесс включает даун-регуляцию репрессии PcG сигнальным каскадом INK в трансдетерминированных клетках (рис. 11.2а, б) (Lee et al., 2005). Мутанты по PcG также имеют повышенную частоту трансдетерминации, что, опять-таки, говорит в пользу роли белков PcG в поддержании судьбы имагинальных дисков (Klebes et al., 2005). Таким образом, белки PcG, по-видимому, играют ключевую роль в репрограммировании клеточных судеб как в ходе нормального развития, так и в процессах регенерации (дополнительные детали см. в разделе 4 3 далее в этой главе).1.2. Генетическая идентификация группы Polycomb
У всех многоклеточных передне-задняя ось специфицируется посредством определенных паттернов экспрессии генов НОХ (рис. 12.2). У Drosophila во время эмбриогенеза активность произведенных матерью (т.е. унаследованных через ооцит) и произведенных в зиготе транскрипционных факторов генерирует специфическую комбинацию экспрессии НОХ, необходимую для каждого сегмента. Этот сегмент-специфичный профиль активности генов НОХ поддерживается на протяжении всего развития мухи, спустя долгое время после того как исчезли регуляторы ранней транскрипции. Когда функция генов НОХ была охарактеризована генетически, были изолированы многие trans-действующие регуляторы. Среди них Пам и Эд Льюс (Lewis, 1978) идентифицировали и генетически проанализировали Polycomb (Рс). Гетерозиготные мутантные по Рс самцы имели дополнительные половые гребешки на второй и третьей паре ног, тогда как самцы дикого типа несли половые гребешки только на первой паре ног (см. рисунок на титульной странице этой главы). Гомозиготные мутанты были летальны на стадии эмбриона, демонстрируя трансформацию всех кутикулярных сегментов в направлении самого заднего абдоминального сегмента (рис. 11.2в, г). Эти классические фенотипы PcG были интерпретированы как обусловленные эктопической экспрессией генов НОХ. Таким образом, Рс и другие гены со сходными фенотипами были определены как репрессоры активности генов НОХ. Впоследствии детальный анализ позволил обнаружить, что белки PcG требуются лишь для поддержания репрессии НОХ, а не для установления активности НОХ в ходе формирования паттерна, специфичного по отношению к положению Эта последняя задача выполняется транскрипционными факторами, закодированными в рано действующих генах сегментации. На основе их репрессирующего или активирующего влияния на экспрессию генов НОХ эти вновь идентифицированные trans-действующие регуляторы были разделены на два антагонистических класса, PcG HtrxG, соответственно (рис. 11.1) (Kennison, 1995). Рис. 11.1. Концепция клеточной памяти
Схема, иллюстрирующая участие комплексов PcG и trxG в детерминации активного и репрессированного состояний экспрессии генов и, тем самым, клеточной дифференцировки, которая поддерживается на протяжении многих клеточных делений: (ТА) транскрипционный активатор; (TR) транскрипционный репрессор
Рис. 11.1. Концепция клеточной памяти
Схема, иллюстрирующая участие комплексов PcG и trxG в детерминации активного и репрессированного состояний экспрессии генов и, тем самым, клеточной дифференцировки, которая поддерживается на протяжении многих клеточных делений: (ТА) транскрипционный активатор; (TR) транскрипционный репрессор
 Рис. 11.2. Гомеотические трансформации у PcG-мутантов разных видов
(а-г) Drosophila melanogaster, (д, е) Mus musculus, (ж, з) Arabidopsis thaliana. (а, б) Ножные имагинальные диски, претерпевающие трансдетерминацию, на что указывает экспрессия крыло-специфического гена vestigial (маркированного GFP). (в. г) Кутикулы эмбриона дикого типа (в) и мутанта Su(z)12 (г). У мутантного эмбриона Su(z)12 все абдоминальные, торакальные и несколько головных сегментов (не все из них видны в этой фокальной плоскости) гомеотически трансформированы в копии восьмого абдоминального сегмента благодаря нарушенной экспрессии гена Abd-B в каждом сегменте, (д, е) Осевой скелет новорожденных мышей дикого типа (д) и RinglA-/- (е) Вид торакальных районов очищенных скелетов, показывающий кости (красный цвет) и хрящ (синий цвет). Мутант обнаруживает переднюю трансформацию восьмых торакальных позвонков, на что указывает наличие восьми (1—8) вертебростернальных ребер вместо семи (1—7), как у дикого типа, (ж, з) Цветок дикого типа (ж) и мутанта clf-2 (з). Цветок дикого типа демонстрирует нормальное расположение чашелистиков, лепестков, тычинок и плодолистиков. У цветка clf-2 лепестки отсутствуют или число их уменьшено. (а.б, с любезно предоставлено N. Lee and R. Раго; в, г, перепечатка, с любезного разрешения, из Birve et al., 2001 [©Company of Biologists Ltd.]; д, e, перепечатка, с любезного разрешения, из del Маг Lorente et al., 2000 [©Company of Biologists Ltd.]; з, любезно предоставлено J. Goodrich)
Рис. 11.2. Гомеотические трансформации у PcG-мутантов разных видов
(а-г) Drosophila melanogaster, (д, е) Mus musculus, (ж, з) Arabidopsis thaliana. (а, б) Ножные имагинальные диски, претерпевающие трансдетерминацию, на что указывает экспрессия крыло-специфического гена vestigial (маркированного GFP). (в. г) Кутикулы эмбриона дикого типа (в) и мутанта Su(z)12 (г). У мутантного эмбриона Su(z)12 все абдоминальные, торакальные и несколько головных сегментов (не все из них видны в этой фокальной плоскости) гомеотически трансформированы в копии восьмого абдоминального сегмента благодаря нарушенной экспрессии гена Abd-B в каждом сегменте, (д, е) Осевой скелет новорожденных мышей дикого типа (д) и RinglA-/- (е) Вид торакальных районов очищенных скелетов, показывающий кости (красный цвет) и хрящ (синий цвет). Мутант обнаруживает переднюю трансформацию восьмых торакальных позвонков, на что указывает наличие восьми (1—8) вертебростернальных ребер вместо семи (1—7), как у дикого типа, (ж, з) Цветок дикого типа (ж) и мутанта clf-2 (з). Цветок дикого типа демонстрирует нормальное расположение чашелистиков, лепестков, тычинок и плодолистиков. У цветка clf-2 лепестки отсутствуют или число их уменьшено. (а.б, с любезно предоставлено N. Lee and R. Раго; в, г, перепечатка, с любезного разрешения, из Birve et al., 2001 [©Company of Biologists Ltd.]; д, e, перепечатка, с любезного разрешения, из del Маг Lorente et al., 2000 [©Company of Biologists Ltd.]; з, любезно предоставлено J. Goodrich)
Молекулярное выделение генов PcG Drosophila сделало возможным изучение функции ортологов позвоночных у мышей, где они также оказались ключевыми регуляторами экспрессии генов НОХ (van der Lugt et al., 1994; Core et al., 1997). У млекопитающих мутации в генах PcG приводят к гомеотическим трансформациям позвонков (Рис. 11.2д, е). Кроме того, гены PcG играют ключевую роль в контроле клеточной пролиферации, поддержания стволовых клеток и рака (см. разделы 4.2 и 4.3 далее в этой главе). Замечательный консерватизм генов PcG у мух и млекопитающих облегчил биохимический анализ и привел к идентификации некоторых новых членов комплексов PcG, например белка RING 1 (Satijn and Otte, 1999). Направленная [targeted] мутация RING1 у мыши, например, привела к классической гомеотической трансформации фенотипа. Лишь впоследствии было обнаружено, что она соответствует гену Sex combs extra из группы PcG у Drosophila. У двух других модельных организмов, а именно у червя Caenorhabditis elegans и цветкового растения Arabidopsis thaliana, молекулярная характеристика мутантов, изолированных в ходе разных генетических скринингов, выявила существование других ортологов белков PcG. У С. elegans члены группы PcG были идентифицированы в ходе скрининга на мутантов maternal effect sterile (mes), и было показано, что они участвуют в сайленсинге Х-хромосомы в зародышевой линии гермафродитов (Fong et al., 2002; глава 15). У Arabidopsis гены PcG были идентифицированы в результате нескольких генетических скринингов при исследовании различных процессов развития (Hsieh et al/, 2003). Первый ген PcG у растений, CURLY LEAF (CLF), был идентифицирован как мутант с гомеотическими трансформациями органов цветка (рис. 11.2ж, з) (Goodrich et al., 1997). Мутации в генах класса FERTILIZATION-INDEPENDENT SEED (FIS) были обнаружены в ходе скрининга на мутанты, обнаруживающие материнский эффект—недоразвитие семян (Grossniklaus et al., 1998) или допускающие некоторое развитие семян в отсутствие оплодотворения (Luo et al., 1999; Ohad et al., 1999). Наконец, гены PcG были идентифицированы в результате скрининга на мутанты по срокам цветения, например мутанты, зацветающие сразу после прорастания (Yoshida et al., 2001) или с нарушенной реакцией на яровизацию — процесс, делающий растения компетентными к цветению после продолжительного воздействия холодом (Gendall et al., 2001). Разнообразие процессов, регулируемых белками PcG, иллюстрирует значение поддержания репрессированного состояния ключевых регуляторов развития у различных организмов. С одной стороны, имеет место удивительный консерватизм некоторых биологических функций от растений до млекопитающих, например, регуляции таких ключевых регуляторов развития, как гомеотические гены, или участия в жесткой регуляции клеточной пролиферации. С другой стороны, комплексы PcG оказываются гибкими и динамичными молекулярными модулями, которые используются для контроля большой группы клеточных процессов и процессов развития.
2. Установка меток сайленсинга на хроматин
Белки PcG распадаются на два биохимически охарактеризованных класса, образующих репрессивные комплексы Polycomb 1 и 2 (PRC1 и PRC2). Эти два комплекса необходимы для последовательных шагов в репрессии генной экспрессии. Сначала PRC2 обладает модифицирующей гистоны активностью и метилирует H3K27 и (или) H3K9 в генах, являющихся «мишенями» для сайленсинга. Компоненты PRC1 могут затем узнавать такие модификации, связываться с ними и индуцировать соответствующие структурные изменения в хроматине. В то время как белки PRC2 имеются у всех многоклеточных модельных видов, компоненты PRC1 не были идентифицированы у С. elegans и Arabidopsis.2.1. Компоненты PRC2 и его эволюционный консерватизм
Несколько вариантов PRC2 были выделены из эмбрионов Drosophila, но все эти комплексы содержали четыре коровых белка (Levine et al., 2004): SET-гистонметилтрансфераза Enhancer of Zeste (E(Z)), WD-40-белок ESC, связывающийся с гистонами белок р55 и SupressorofZestel2 (Su(Z)12) (табл. 11.1 ирис. 11.3). Исходя из такого состава, PRC2 первоначально называли комплексом E(Z)-ESC. В этом разделе освещаются молекулярные и биохимические детали того, что известно о разных компонентах PRC2, идентифицированных до сегодняшнего дня у различных модельных организмов. Рис. 11.3. Консервативные коровые комплексы PRC2
Показаны коровые члены PRC2 у D. melanogaster, М. musculus, A. thaliana и С. elegans. Предполагается, что у A. thaliana анцестральный комплекс диверсифицировался на три варианта с дискретными функциями в развитии. У С. elegans коровый комплекс PCR2 содержит только три белка: MES-3 не обладает гомологией ни с каким другим идентифицированным белком PRC2. Различные цвета указывают гомологию, контакты указывают на взаимодействия (из Reyes and Grossniklaus, 2003 и Chanvivattana et al., 2004, с изменениями)
Рис. 11.3. Консервативные коровые комплексы PRC2
Показаны коровые члены PRC2 у D. melanogaster, М. musculus, A. thaliana и С. elegans. Предполагается, что у A. thaliana анцестральный комплекс диверсифицировался на три варианта с дискретными функциями в развитии. У С. elegans коровый комплекс PCR2 содержит только три белка: MES-3 не обладает гомологией ни с каким другим идентифицированным белком PRC2. Различные цвета указывают гомологию, контакты указывают на взаимодействия (из Reyes and Grossniklaus, 2003 и Chanvivattana et al., 2004, с изменениями)
Ген E(z) кодирует белок из 760 аминокислот, содержащий домен SET, который придает ему активность метилтрансферазы лизинов гистонов (НКТМ). Этому домену SET предшествует домен СХС, или Pre-SET (Tschiersch et al., 1994), содержащий девять консервативных цистеинов, которые связывают три иона цинка и, как полагают, стабилизируют домен SET. В пользу такой структурной роли говорит тот факт, что несколько температурочувствительных аллелей E(z) затрагивают один из этих консервативных цистеинов (Carrington and Jones, 1996). Кроме того, E(z) содержит домены SANT, вовлеченные в связывание с гистонами, и домен С5, необходимый для физического взаимодействия с SU(Z)12. ESC — это короткий белок из 425 аминокислот, содержащий пять повторов WD40, образующих структуру типа «(3-пропеллер». Это создает платформу для белок-белковых взаимодействий, отводя ESC тем самым центральную роль в PRC2: физически взаимодействовать как с E(z), так и с р55 во всех проанализированных модельных системах. Белок SU(Z)12 состоит из 900 аминокислот и характеризуется структурой «цинковый палец» С2Н2-типа и карбокситерминальным доменом VEFS. Домен VEFS был идентифицирован как консервативный участок между SU(Z)12 и его тремя гомологами у растений: VRN2, EMF2, FIS2 (см. рис. 11.3). Несколько мутантных аллелей Su(z)12 изменяют этот домен, показывая тем самым, что он необходим для взаимодействия с доменом С5 белка E(Z) (Chanvivattana et al., 2004; Yamamoto et al., 2004). Генетически белок p55 не был идентифицирован как член PcG — возможно потому, что он участвует во множестве других белковых комплексов, ассоциированных с хроматином (Hennig et al., 2005). Однако биохимически белок р55 был идентифицирован как часть PRC2. Он состоит из 430 аминокислот и содержит шесть повторов WD40, которые физически взаимодействуют с ESC или его ортологами у млекопитающих и растений (Tie et al., 2001; КцЫег et al., 2003a).
Таблица 11.1. Гены кора PcG в модельных системах
 Кроме коровых белков PRC2 некоторые варианты этого комплекса содержат деацетилазу гистонов (HDAC) RPD3, или Polycomb-подобный белок (PCL). Взаимодействие с RPD3 заслуживает особого внимания, поскольку деацетилирование гистонов коррелирует с репрессированным состоянием экспрессии генов (глава 10). Различный состав PRC2 отражает, вероятно, динамические изменения в ходе развития или же ткане-специфичные варианты.
PRC2 высоко консервативен у беспозвоночных, позвоночных и растений (рис. 11.3). У С. elegans присутствуют только гомологи E(Z) и ESC: MES-2 и MES-6. Вместе с еще одним неконсервативным белком. MES-3, они формируют маленький комплекс с мол. массой около 230 кДа, необходимый для сайленсинга в гермафродитной зародышевой линии (глава 15). У растений и млекопитающих присутствуют все четыре коровых белка PRC2. Как и у Drosophila, комплекс млекопитающих имеет мол. массу около 600 кДа и играет роль не только в регуляции экспрессии гомеотических генов, но и в контроле клеточной пролиферации, инактивации Х-хромосомы и экспрессии импринтированных генов (см. дополнительные детали в разделе 4 этой главы и в главах, имеющих отношение к этому вопросу).
У растений несколько генов, кодирующих компоненты PRC2, претерпели дупликацию, так что теперь они представлены небольшими семействами генов. У Arabidopsis имеется только один гомолог ESC, FERTILIZATION-INDEPENDENT ENDOSPERM (FIE), но три гомолога E(Z), три гомолога SU(Z)12 и пять гомологов р55 (называемые MSI1-5) (табл. 11.1). Различные комбинации этих белков образуют по крайней мере три разных комплекса, контролирующие специфические процессы развития (рис. 11.3 и 11.4) (Reyes and Grossniklaus, 2003; Chanvivattana et al., 2004).
Из этих комплексов лучше всего изучен комплекс, образованный членами класса FERTILIZATION-INDEPENDENT SEED (FIS), который играет ключевую роль в контроле клеточной пролиферации в семени (Grossniklaus et al., 2001). Этот комплекс FIS, или МЕА-FIE содержит MEDEA, FIE, FIS2 и MSI1. Как оказалось, комплекс FIS регулирует гены, кодирующие PHERES1 (РНЕ1), транскрипционный фактор с доменом MADS [MADS domain transcription factor]; и MEIDOS, гомолог Skpl, который у дрожжей играет ключевую роль в контроле клеточной пролиферации (КцЫег et al., 2003b). Интересно, что отцовская аллель РНЕ1 экспрессируется на более высоких уровнях, чем материнская аллель. Эта регуляция экспрессии гена посредством геномного импринтинга находится под контролем комплекса FIS, который специфически репрессирует материнскую аллель (КцЫег et al., 2005). Таким образом, как описывается ниже, комплекс FIS имеет общие с его аналогом у млекопитающих функции в регулировании клеточной пролиферации, а также экспрессии импринтированных генов.
Комплекс EMF содержит CLF и EMBRYONIC FLOWER2 (EMF2) (Chanvivattana et al., 2004). Мутации по любому из этих компонентов обнаруживают слабые гомеотические трансформации и фенотип раннего цветения. Комплекс EMF необходим для репрессии гомеотических генов, чье комбинированное действие определяет идентичность органов цветка (Goodrich et al., 1997). Таким образом, комплекс EMF обладает функцией в поддержании репрессированного состояния гомеотических генов, сходной с функцией PRC2 у Drosophila и позвоночных (рис. 11.2). Однако гомеотические гены у растений кодируют не гомеодоменные белки, а, скорее, другие транскрипционные факторы, принадлежащие к семействам MADS-домена и специфичного для растений АР2-домена. Сильные [strong] мутанты EMF2, однако, имеют более резко выраженные [severe] фенотипы, когда их сеянцы производят цветки сразу же после прорастания, минуя вегетативную фазу развития (Yoshida et al., 2001). Таким образом, комплекс EMF играет роль как в раннем развитии, где он предотвращает немедленное цветение, так и позже, в ходе органогенеза цветка (Chanvivattana et al., 2004). На обеих стадиях комплекс EMF репрессирует гомеотические гены цветка, такие как AG и APETALA3 (АРЗ) (рис. 11.4). Белки FIE и MSI1, относящиеся к классу FIS, также вовлечены в контроль экспрессии гомеотических генов (рис. 11.3 и 11.4). Поскольку мутации в обоих этих белках вызывают связанную с материнским эффектом эмбриональную летальность, эта функция была обнаружена лишь тогда, когда аллели типа частичной утраты функции можно было изучать на более поздних стадиях развития (Kinoshita et al., 2001; Hennig et al., 2003).
Наконец, комплекс VRN играет ключевую роль в хорошо известном эпигенетическом процессе — яровизации (продолжительное воздействие низкой температуры). Яровизация индуцирует цветение у озимых однолетников, но этот эффект виден только после многих клеточных делений (рис. 11.4). Клетка растения будет помнить, что она была яровизирована, на протяжении многих месяцев или даже лет после холодного периода. Эта клеточная память поддерживается при пассажах в клеточной культуре, но не от одного поколения к следующему (Sung and Amasino, 2004а). Этот ответ на яровизацию опосредуется генами VERNALIZATION (VRN). Обнаружили, что VRN2 кодирует гомолог SU(Z)12 (Gendall et al., 2001), который взаимодействует с гомологами E(Z) растений, CLF и SWINGER (SWN) в двугибридных тестах у дрожжей (Chanvivattana et al., 2004). Переход к цветению контролируется не только яровизацией, но включает восприятие эндогенных (стадия развития и возраст) и экзогенных (длина дня, условия освещения, температура) факторов. Генетический анализ позволил определить четыре пути: (1) автономный путь конститутивно репрессирует цветение, (2) фотопериодический путь ускоряет цветение в условиях длинного дня, (3) яровизационный путь индуцирует цветение в ответ на действие низкой температуры и (4) гиббереллины стимулируют цветение. Ген сроков цветения FLC, содержащий MADS-бокс, является ключевым интегратором реакции цветения: он репрессирует цветение. Экспрессия FLC редуцируется как яровизанионным, так и автономным путями. В то время как первоначальная репрессия FLC не зависит от комплекса VRN, поддержание репрессии требует VRN2, который изменяет организацию хроматина в локусе FLC (Gendall et al., 2001). Важно отметить, что один из компонентов автономного пути — это гомолог р55, FVE (или MS 14), который влияет на реакцию по срокам цветения, но не действует в яровизационном пути (Ausin et al., 2004; Kim et al., 2004). Поскольку ни о каких биохимических исследованиях комплекса VRN не сообщалось, его точный состав в настоящее время неизвестен (рис. 11.3 и 11.4).
Кроме коровых белков PRC2 некоторые варианты этого комплекса содержат деацетилазу гистонов (HDAC) RPD3, или Polycomb-подобный белок (PCL). Взаимодействие с RPD3 заслуживает особого внимания, поскольку деацетилирование гистонов коррелирует с репрессированным состоянием экспрессии генов (глава 10). Различный состав PRC2 отражает, вероятно, динамические изменения в ходе развития или же ткане-специфичные варианты.
PRC2 высоко консервативен у беспозвоночных, позвоночных и растений (рис. 11.3). У С. elegans присутствуют только гомологи E(Z) и ESC: MES-2 и MES-6. Вместе с еще одним неконсервативным белком. MES-3, они формируют маленький комплекс с мол. массой около 230 кДа, необходимый для сайленсинга в гермафродитной зародышевой линии (глава 15). У растений и млекопитающих присутствуют все четыре коровых белка PRC2. Как и у Drosophila, комплекс млекопитающих имеет мол. массу около 600 кДа и играет роль не только в регуляции экспрессии гомеотических генов, но и в контроле клеточной пролиферации, инактивации Х-хромосомы и экспрессии импринтированных генов (см. дополнительные детали в разделе 4 этой главы и в главах, имеющих отношение к этому вопросу).
У растений несколько генов, кодирующих компоненты PRC2, претерпели дупликацию, так что теперь они представлены небольшими семействами генов. У Arabidopsis имеется только один гомолог ESC, FERTILIZATION-INDEPENDENT ENDOSPERM (FIE), но три гомолога E(Z), три гомолога SU(Z)12 и пять гомологов р55 (называемые MSI1-5) (табл. 11.1). Различные комбинации этих белков образуют по крайней мере три разных комплекса, контролирующие специфические процессы развития (рис. 11.3 и 11.4) (Reyes and Grossniklaus, 2003; Chanvivattana et al., 2004).
Из этих комплексов лучше всего изучен комплекс, образованный членами класса FERTILIZATION-INDEPENDENT SEED (FIS), который играет ключевую роль в контроле клеточной пролиферации в семени (Grossniklaus et al., 2001). Этот комплекс FIS, или МЕА-FIE содержит MEDEA, FIE, FIS2 и MSI1. Как оказалось, комплекс FIS регулирует гены, кодирующие PHERES1 (РНЕ1), транскрипционный фактор с доменом MADS [MADS domain transcription factor]; и MEIDOS, гомолог Skpl, который у дрожжей играет ключевую роль в контроле клеточной пролиферации (КцЫег et al., 2003b). Интересно, что отцовская аллель РНЕ1 экспрессируется на более высоких уровнях, чем материнская аллель. Эта регуляция экспрессии гена посредством геномного импринтинга находится под контролем комплекса FIS, который специфически репрессирует материнскую аллель (КцЫег et al., 2005). Таким образом, как описывается ниже, комплекс FIS имеет общие с его аналогом у млекопитающих функции в регулировании клеточной пролиферации, а также экспрессии импринтированных генов.
Комплекс EMF содержит CLF и EMBRYONIC FLOWER2 (EMF2) (Chanvivattana et al., 2004). Мутации по любому из этих компонентов обнаруживают слабые гомеотические трансформации и фенотип раннего цветения. Комплекс EMF необходим для репрессии гомеотических генов, чье комбинированное действие определяет идентичность органов цветка (Goodrich et al., 1997). Таким образом, комплекс EMF обладает функцией в поддержании репрессированного состояния гомеотических генов, сходной с функцией PRC2 у Drosophila и позвоночных (рис. 11.2). Однако гомеотические гены у растений кодируют не гомеодоменные белки, а, скорее, другие транскрипционные факторы, принадлежащие к семействам MADS-домена и специфичного для растений АР2-домена. Сильные [strong] мутанты EMF2, однако, имеют более резко выраженные [severe] фенотипы, когда их сеянцы производят цветки сразу же после прорастания, минуя вегетативную фазу развития (Yoshida et al., 2001). Таким образом, комплекс EMF играет роль как в раннем развитии, где он предотвращает немедленное цветение, так и позже, в ходе органогенеза цветка (Chanvivattana et al., 2004). На обеих стадиях комплекс EMF репрессирует гомеотические гены цветка, такие как AG и APETALA3 (АРЗ) (рис. 11.4). Белки FIE и MSI1, относящиеся к классу FIS, также вовлечены в контроль экспрессии гомеотических генов (рис. 11.3 и 11.4). Поскольку мутации в обоих этих белках вызывают связанную с материнским эффектом эмбриональную летальность, эта функция была обнаружена лишь тогда, когда аллели типа частичной утраты функции можно было изучать на более поздних стадиях развития (Kinoshita et al., 2001; Hennig et al., 2003).
Наконец, комплекс VRN играет ключевую роль в хорошо известном эпигенетическом процессе — яровизации (продолжительное воздействие низкой температуры). Яровизация индуцирует цветение у озимых однолетников, но этот эффект виден только после многих клеточных делений (рис. 11.4). Клетка растения будет помнить, что она была яровизирована, на протяжении многих месяцев или даже лет после холодного периода. Эта клеточная память поддерживается при пассажах в клеточной культуре, но не от одного поколения к следующему (Sung and Amasino, 2004а). Этот ответ на яровизацию опосредуется генами VERNALIZATION (VRN). Обнаружили, что VRN2 кодирует гомолог SU(Z)12 (Gendall et al., 2001), который взаимодействует с гомологами E(Z) растений, CLF и SWINGER (SWN) в двугибридных тестах у дрожжей (Chanvivattana et al., 2004). Переход к цветению контролируется не только яровизацией, но включает восприятие эндогенных (стадия развития и возраст) и экзогенных (длина дня, условия освещения, температура) факторов. Генетический анализ позволил определить четыре пути: (1) автономный путь конститутивно репрессирует цветение, (2) фотопериодический путь ускоряет цветение в условиях длинного дня, (3) яровизационный путь индуцирует цветение в ответ на действие низкой температуры и (4) гиббереллины стимулируют цветение. Ген сроков цветения FLC, содержащий MADS-бокс, является ключевым интегратором реакции цветения: он репрессирует цветение. Экспрессия FLC редуцируется как яровизанионным, так и автономным путями. В то время как первоначальная репрессия FLC не зависит от комплекса VRN, поддержание репрессии требует VRN2, который изменяет организацию хроматина в локусе FLC (Gendall et al., 2001). Важно отметить, что один из компонентов автономного пути — это гомолог р55, FVE (или MS 14), который влияет на реакцию по срокам цветения, но не действует в яровизационном пути (Ausin et al., 2004; Kim et al., 2004). Поскольку ни о каких биохимических исследованиях комплекса VRN не сообщалось, его точный состав в настоящее время неизвестен (рис. 11.3 и 11.4).
2.2. Модифицирующая хроматин активность PRC2
Каким образом PRC2 опосредует свое репрессирующее действие? Несколько белков PcG и trxG имеют домены SET, в том числе компонент PRC2, E(Z). Обнаружение того факта, что белки с доменом SET обладают активностью HKMT (Rea et al., 2000), позволило предположить, что в функцию PcG входит метилирование гистонов. Действительно, было показано, что комплексы PRC2 у млекопитающих и Drosophila метилируют гистон H3 по лизину 27 (H3K27) и, в меньшей степени, по H3K9 как in vivo, так и in vitro (Cao et al., 2002; Czermin et al., 2002; Kuzmichev et al., 2002; Mbller et al., 2002). Эти гистоновые метки обычно ассоциируются с транскрипционно «молчащим» состоянием. Более того, метилирование H3K9 и H3K27 было связано с репрессированными гомеотическими генами комплекса bithorax (Mbller et al., 2002). Однако лишь метилирование H3K27 утрачивалось у мутантов по E(z), подчеркивая темсамым значение метилирования H3K27 в PcG-сайленсинге. В отличие от белка SU(VAR)3-9, который сам метилирует H3K9, белки E(Z) сами по себе не обладают активностью HKMT H3K27. Наименьший комплекс, действующий как HKMT, также требует ESC и SU(Z) 12, которые могут иметь модулирующие функции. Недавно было показано, что комплексы PRC2 могут также метилировать Н1К26 (Kuzmichev et al., 2004). Разные изоформы гомолога ESC у млекопитающих, Eed, определяют специфичность PRC2 млекопитающих по отношению к метилированию Н1К26 versus H3K27 (Kuzmichev et al., 2004). Однако функциональное отношение метилирования Н1К26 к PcG-сайленсингу остается неясным. Рис. 11.4. Участие различных PRC2 на разных стадиях развития растений
В жизненном цикле растения разные варианты PRC2 (см. рис. 11.3) контролируют процесс развития. (А) Просветленная [cleared] семяпочка дикого типа с женским гаметофитом в центре. Комплекс FIS репрессирует гены-мишени, контролирующие пролиферацию центральной клетки; как и у всех мутантов классаfls, эта клетка пролиферирует в отсутствие оплодотворения. Приблизительно во время оплодотворения требуется также МЕА для поддержания низкого уровня экспрессии MEAT, но эта активность не зависит от других компонентов комплекса FIS. (Б) Срез семени дикого типа, содержащего зародыш и эндосперм, окруженный семенной оболочкой [seed coat]. После оплодотворения комплекс FIS участвует в контроле клеточной пролиферации в зародыше и эндосперме. Он поддерживает низкий уровень экспрессии РНЕ1 и необходим для удержания отцовской аллели МЕАР в «молчащем» состоянии. (В) Проростки дикого типа (справа) и мутанта ет/2 (слева), 21-й день после прорастания. Проросток ет/2 произвел цветок с гомеотическими трансформациями, но не дал листьев. Комплекс EMF предотвращает цветение и репрессирует гомеотические гены цветка, такие как AG, АРЗ и другие. (/) Яровизированное (справа) и неяровизированное (слева) растения; второе из них характеризуется продолжительной вегетативной фазой и образованием многочисленных листьев. Во время вегетативной фазы развития экзогенные и эндогенные сигналы индуцируют цветение. Яровизация ведет к репрессии цветкового репрессора FLC и таким образом стимулирует цветение. Поддержание этой репрессии зависит от комплекса VRN. (Д) Цветок Arabidopsis дикого типа. Во время органогенеза цветка комплекс EMF регулирует цветковые гомеотические гены, определяющие идентичность органов цветка. (А — любезно предоставлено J.M. Мооге и U. Grossniklaus; Б — любезно предоставлено J.-P. Vielle-Calzada и U. Grossniklaus; В — перепечатано, с любезного разрешения, из Moon et al., 2003 [©ASPB]; Г— перепечатано, с любезного разрешения, из Page and Grossniklaus, 2002 [©Macmillan].)
Рис. 11.4. Участие различных PRC2 на разных стадиях развития растений
В жизненном цикле растения разные варианты PRC2 (см. рис. 11.3) контролируют процесс развития. (А) Просветленная [cleared] семяпочка дикого типа с женским гаметофитом в центре. Комплекс FIS репрессирует гены-мишени, контролирующие пролиферацию центральной клетки; как и у всех мутантов классаfls, эта клетка пролиферирует в отсутствие оплодотворения. Приблизительно во время оплодотворения требуется также МЕА для поддержания низкого уровня экспрессии MEAT, но эта активность не зависит от других компонентов комплекса FIS. (Б) Срез семени дикого типа, содержащего зародыш и эндосперм, окруженный семенной оболочкой [seed coat]. После оплодотворения комплекс FIS участвует в контроле клеточной пролиферации в зародыше и эндосперме. Он поддерживает низкий уровень экспрессии РНЕ1 и необходим для удержания отцовской аллели МЕАР в «молчащем» состоянии. (В) Проростки дикого типа (справа) и мутанта ет/2 (слева), 21-й день после прорастания. Проросток ет/2 произвел цветок с гомеотическими трансформациями, но не дал листьев. Комплекс EMF предотвращает цветение и репрессирует гомеотические гены цветка, такие как AG, АРЗ и другие. (/) Яровизированное (справа) и неяровизированное (слева) растения; второе из них характеризуется продолжительной вегетативной фазой и образованием многочисленных листьев. Во время вегетативной фазы развития экзогенные и эндогенные сигналы индуцируют цветение. Яровизация ведет к репрессии цветкового репрессора FLC и таким образом стимулирует цветение. Поддержание этой репрессии зависит от комплекса VRN. (Д) Цветок Arabidopsis дикого типа. Во время органогенеза цветка комплекс EMF регулирует цветковые гомеотические гены, определяющие идентичность органов цветка. (А — любезно предоставлено J.M. Мооге и U. Grossniklaus; Б — любезно предоставлено J.-P. Vielle-Calzada и U. Grossniklaus; В — перепечатано, с любезного разрешения, из Moon et al., 2003 [©ASPB]; Г— перепечатано, с любезного разрешения, из Page and Grossniklaus, 2002 [©Macmillan].)
У растений HKMT-активность комплексов PRC2 еще не была продемонстрирована in vitro. Однако исследования регулирования FLC показали, что яровизация индуцирует утрату ацетилирования и увеличение метилирования H3K9 и H3K27, главным образом в первом интроне этого гена (Bastow et al., 2004; Sung and Amasino, 2004b). У мутантов vm2 обе метки метилирования утрачены, что предполагает участие комплекса VRN в установлении этих репрессивных меток метилирования гистонов. У двух других мутантов, vrnl и vernalization in-sensitive3 (vin3), исчезает лишь метка H3K9me2. VRN 1 и VIN3 кодируют транскрипционные факторы семейств ВЗ-домена и гомеодомена, соответственно, но точный молекулярный механизм их участия в модификации хроматина в настоящее время неизвестен Исходя из многочисленных исследований, выполненных к сегодняшнему дню, основной функцией PRC2 представляется обладание активностью HKMT, но у некоторых вариантов PCR2 имеются и другие активности, модифицирующие хроматин. Ген Rpd3 кодирует HDAC, которая, как полагают, участвует в PcG-сайленеинге (Tie et al., 2001). Однако, хотя мутации rpd3 усиливают фенотипы PcG, сами они не обнаруживают типичных гомеотических трансформаций. Тот факт, что RPD3 не присутствует во всех препаратах PRC2, может, таким образом, отражать либо слабое общее взаимодействие, либо ткане- и стадиеспецифичное взаимодействие с коровыми компонентами PRC2. Взаимодействие RPD3 с PRC2 представляет собой интересное партнерство, поскольку активности и HKMT, и HDAC ассоциируются с «молчащим» хроматином и в сочетании могут еще больше укреплять транскрипционно «молчащие» состояния.
2.3. Динамическая функция PRC2 в развитии
Как указывалось выше, коровые комплексы PRC1 и PRC2 ассоциируются с разными факторами, которые могут играть роль в рекрутировании комплексов PcG к тканеспецифичным локусам-мишеням или в модулировании их активности (Otte and Kwaks, 2003). Разные этапы PcG-репрессии, показанные на рис. 11.5, иллюстрируют стадиеспецифичные композиции комплексов PcG в эмбриогенезе Drosophila. До сих пор было трудно охарактеризовать различия в отношении разных тканей или клеточных типов у мух, поскольку для биохимической очистки обычно используются экстракты из целых эмбрионов. Однако исследования, выполненные на млекопитающих и растениях, ясно показывают, что комплексы PcG представлены по разному в различных конкретных тканях и что их состав изменяется в ходе клеточной дифференцировки (Chanvivattana et al.. 2004; Kuzmichev et al.. 2005; Baroux et al., 2006). У млекопитающих уровни экспрессии генов PcG различаются в огромной степени от одной клеточной линии к другой. Комплексы PcG могут различаться даже между генами-мишенями в одной и той же клетке, что заставляет предположить высоко динамичное поведение на разных стадиях развития. Рис. 11.5. Последовательность событий, ведущих к зависимому от PcG репрессированному состоянию экспрессии генов у эмбрионов Drosophila
Исходное состояние экспрессии регулируемого PRE гена определяется активностью регуляторов транскрипции — либо репрессоров (TR), либо активаторов (ТА) транскрипции. Транскрипция через PRE предотвращает установление состояния «OFF» («ВЫКЛ.») и приводит к зависимому от trxG состоянию «ON» («ВКЛ.») (детали см. рис. 12.8). (а—б) Нетранскрибируемый PRE связывается со специфическими белками, связывающимися с ДНК (например, РНО, PHOL, DSP1 или GAF), которые участвуют в рекрутировании раннего комплекса PcG, содержащего белки и PRC1, и PRC2. (в) Этот ранний комплекс PcG маркирует хроматин путем зависимого от E(Z) метилирования гистонов. (г) Поддержание «молчащего» состояния происходит через взаимодействия двух разных комплексов, PRC 1 и PRC2, в отсутствие исходного транскрипционного репрессора. Поддержание PRC1 стабилизируется посредством связывания через хромодомен ЗС. (d) PRC1 может компактизировать хроматин, устанавливая далее плотно конденсированный, «молчащий» хроматин
Рис. 11.5. Последовательность событий, ведущих к зависимому от PcG репрессированному состоянию экспрессии генов у эмбрионов Drosophila
Исходное состояние экспрессии регулируемого PRE гена определяется активностью регуляторов транскрипции — либо репрессоров (TR), либо активаторов (ТА) транскрипции. Транскрипция через PRE предотвращает установление состояния «OFF» («ВЫКЛ.») и приводит к зависимому от trxG состоянию «ON» («ВКЛ.») (детали см. рис. 12.8). (а—б) Нетранскрибируемый PRE связывается со специфическими белками, связывающимися с ДНК (например, РНО, PHOL, DSP1 или GAF), которые участвуют в рекрутировании раннего комплекса PcG, содержащего белки и PRC1, и PRC2. (в) Этот ранний комплекс PcG маркирует хроматин путем зависимого от E(Z) метилирования гистонов. (г) Поддержание «молчащего» состояния происходит через взаимодействия двух разных комплексов, PRC 1 и PRC2, в отсутствие исходного транскрипционного репрессора. Поддержание PRC1 стабилизируется посредством связывания через хромодомен ЗС. (d) PRC1 может компактизировать хроматин, устанавливая далее плотно конденсированный, «молчащий» хроматин
У Drosophila белки PcG поддерживают репрессированные состояния гомеотических генов, установившиеся в раннем эмбриогенезе, фиксируя тем самым «решения» по развитию. Коль скоро «молчащее» состояние мишени PcG зафиксировано, она будет оставаться в этом состоянии весь остаток жизни особи. У растений аналогичная ситуация может возникать с комплексом VRN: будучи однажды яровизирован, ген-мишень (гены-мишени) будет перманентно инактивированным и будет «переустановлен» только в следующем поколении. Однако другие растительные комплексы PRC2, по-видимому, более быстро реагируют на стимулы, связанные с развитием или исходящие из окружающей среды. Например, одной из функций комплекса FIS является репрессия клеточной пролиферации в отсутствие оплодотворения. После оплодотворения, однако, клеточная пролиферация быстро индуцируется, предположительно через дерепрессию генов-мишеней PcG. Это показывает, что PcG-репрессия является состоянием «по умолчанию», которое должно быть преодолено неким неизвестным механизмом, чтобы стал возможным нормальный ход развития. Инактивация комплексов PcG как часть нормального жизненного цикла растения может объяснить отсутствие белков PRC1 у растений (рис. 11.4). PRC1 играет важную роль в перманентной, стабильной и длительной инактивации генов-мишеней. Такая перманентная инактивация была бы вредной для развития растения, где нередко PcG-репрессия снимается после соответствующих стимулов.
3. Поддержание транскрипционного сайленсинга
3.1. Компоненты PRC1
Молекулярный анализ продуктов генов PcG выявил структурно разнообразную группу ассоциированных с хроматином белков. PRC1 содержит четыре белка PcG: Polycomb (PC), Polyhomeotic (PH), Posterior Sex Combs (PSC) и Ring 1 (dRingl/SCE) (см. табл. 11.1) (Francis et al., 2001). Они встречаются в стоихометрических количествах, и были идентифицированы дополнительные белки-партнеры в зависимости от материала, используемого для очистки. Из млекопитающих был выделен и очищен родственный комплекс, что заставляет предполагать, что эти четыре субъединицы образуют кор PRC1 (Levine et al., 2002). Иммуноокрашивание политенных хромосом Drosophila с использованием антител против белков PRC1 продемонстрировало перекрывающуюся локализацию, которая показывала, что эти белки взаимодействуют на определенном и общем [defined and common] наборе генов-мишеней (рис. 11.6а). Кроме того, приблизительно 100 бэндов, наблюдаемых на хромосомах, дали доказательство того, что гены НОХ являются лишь частью более крупной регуляторной сети, включающей другие генные мишени, подверженные PcG-сайленсингу. Рис. 11.6. «Нацеливание» PRC1 на PREs на политенных хромосомах
(а) Иммуноокрашивание политенных хромосом Drosophila для визуализации распределения белка РС. (б) Выравнивание хромосомных плечей, показывающее перекрывание между предсказанными сайтами PRE в геноме Drosophila и цитологически картированными сайтами связывания РС на политенных хромосомах. Два кластера генов НОХ (ANT-C и ВХ-С) являются особо заметными сайтами для PRCls
Рис. 11.6. «Нацеливание» PRC1 на PREs на политенных хромосомах
(а) Иммуноокрашивание политенных хромосом Drosophila для визуализации распределения белка РС. (б) Выравнивание хромосомных плечей, показывающее перекрывание между предсказанными сайтами PRE в геноме Drosophila и цитологически картированными сайтами связывания РС на политенных хромосомах. Два кластера генов НОХ (ANT-C и ВХ-С) являются особо заметными сайтами для PRCls
Ген РС кодирует белок из 390 аминокислот, содержащий хромодомен на своем аминотерминальном конце. Этот консервативный мотив обладает гомологией с НР1, белком Drosophila, необходимым для формирования гетерохроматина (Раю and Hogness, 1991; глава 5). Впоследствии было найдено, что хромодомен связывается с метальными компонентами в H3K27 и H3K9 (Bannister et al., 2001; Fischle et al., 2003). Еще один консервативный домен присутствует на карбокситерминальном конце. Консерватизм, как и наличие нескольких аберраций в мутантных аллелях, заставляет предполагать наличие важной, но все еще неизвестной регуляторной функции в этой части данного белка. Карбоксильный конец РС необязателен для «нацеливания» этого белка на «молчащие» гены (выполняемого хромодоменом), но, как оказалось, взаимодействует in vitro с нуклеосомами (Breiling et al., 1999). Предстоит выяснить, указывает ли это на еще не открытый узнающий мотив для еще одной модификации гистона. Для Рс2 человека была продемонстрирована SUMO ЕЗ-лигазная активность, что указывает на SUMO-модификации как на важные метки в процессе PcG-сайленсинга (Kagey et al., 2003). Аминотерминальная часть белка PSC консервативна в протоонкогене bmi-1 позвоночных и гене-супрессоре опухолей mel-18. Этот район содержит мотив С3НС4 (RING finger), который может опосредовать белок-белковые взаимодействия. Этот мотив RING finger оказался связанным с субъядерной локализацией Bmi-1/ Mel-18, которая коррелирует с клеточной трансформацией. У Drosophila локус polyhomeotic (ph) дуплицирован и состоит из проксимального (ph-p) и дистального (ph-d) генов, сохранивших обширную гомологию. У мышей были идентифицированы гомологичные белки PH. У всех у них имеются общий консервативный «цинковый палец» и домен SAM (известный также как SEP или SPM). Этот домен обнаруживается в еще одном белке PcG, SCM (Sex Combs on the Midleg). Домены SAM участвуют в белок-белковых взаимодействиях, поскольку было продемонстрировано, что они участвуют в гомо- или гетеротипических взаимодействиях с другими белками. Эти данные говорят в пользу предположения о возможной функции в генерировании крупных ядерных комплексов, необходимых для сайленсинга Действительно, белки PcG были локализованы в субнуклеарных фокусах, названных PcG-тельцами, которые могут функционировать как компартменты сайленсинга (Saurin et al., 1998). Как упоминалось выше, dRINGl первоначально не был распознан как член PcG. Лишь биохимическая очистка обнаружила присутствие этого фактора с мотивом RING finger в PRC1, в котором, как полагают, он играет структурную роль (Francis et al., 2001; Lavigne et al., 2004). Было обнаружено, что белки Ring 1А и RING 1В из PRC1 млекопитающих ассоциированы с убиквитилированным Н2А на неактивной Х-хромосоме, и поддержание этой гистоновой метки зависит от белков Ringl (de Napoles et al., 2004; Fang et al., 2004; Cao et al., 2005; дополнительные детали см. в разделе 4.1 этой главы и в главе 17). Эти четыре белка составляют коровую структуру PRC1. Однако другие белки PcG, подобные SCM или белку Zeste, оказались связанными с этим комплексом (Otte and Kwaks, 2003). Их молекулярная функция в PRC1 остается неясной, поскольку они, по-видимому, играют дополнительные роли в ядре; в качестве примера можно привести функцию активатора транскрипции, которую играет Zeste. Были идентифицированы еще и другие гены PcG по их роли как регуляторов транскрипции генов кора PcG (Ali and Bender, 2004). А именно, три гена PcG являются находящимися «вверх по течению» регуляторами генов, кодирующих компоненты PRC1. Петли отрицательной обратной связи между компонентами PRC1, а также положительная регуляция компонентов PRC1 со стороны PRC2 еще более заставляют предполагать сложную, кросс-регуляторную сеть между генами PcG для обеспечения тонкой настройки белковых уровней в этих комплексах (рис. 7а). Аналогичным образом, сложные регуляторные взаимодействия были описаны для генов комплекса FIS у Arabidopsis (Baroux et al., 2006).
3.2. «Нацеливание» PRC1 на сайленсированные гены
Трансгенный анализ кластеров гомеотических генов у Drosophila обнаружил регуляторные элементы, необходимые для поддержания сегмент-специфичной экспрессии генов НОХ. Эти ДНК-элементы — названные Polycomb Response Elements, или PREs — поддерживают сегмент-специфичную экспрессию генов НОХ за рамками фазы эмбриональной инициации. PREs привлекают белки PRC1, будучи интегрированы в эктопические сайты в политенных хромосомах; это позволяет предполагать что они определяют специфичность последовательности для узнавания комплексом PRC1 генов-мишеней и заякоривания на них. Однако тема «нацеливания» PcG оказывается довольно сложной. Размеры функционально охарактеризованных PREs варьируют от нескольких сотен до нескольких тысяч пар оснований, они содержат консенсусные сайты связывания для многих разных белков, связывающихся с ДНК, и обычно в данном локусе-мишени обнаруживаются два или более PREs. Все охарактеризованные до сих пор PREs происходят от Drosophila и ни один PRE пока еще не был определен у млекопитающих или растений. Несмотря на сложность PREs, удалось идентифицировать четыре консенсусные последовательности-мотива и показать, что они играют роль в функции PRE у Drosophila. Один из этих мотивов (GCCAT) связывается как с Плейогомеотическими (РНО, Pleiohomeotic), так и с Плейогомеотикоподобными (PHOL) белками, которые обладают отчасти избыточными функциями. РНО и PHOL функционируют в «нацеливании» PcG, поскольку они найдены в комплексах PcG, выделенных из экстрактов ранних эмбрионов, обнаруживают совместную иммунопреципитацию с членами как PRC 1, так и PRC2 и связываются с PREs in vitro (рис. 11.5а) (Poux et al., 2001). Недавно значение в рекрутировании PcG было продемонстрировано и для DSP1, который связывается с мотивом GAAA, обнаруженным во многих PREs (Dejardin et al., 2005). Наконец, белки trxG, Zeste и GAF (кодируемый геном Trithorax-like) могут помогать рекрутировать белки PcG к их мишеням. Вновь разработанный алгоритм, основывающийся на том, что собранные в кластер пары сайтов GAF, Zeste и PHO/PHOL характеризуют PRE, с высокой вероятностью предсказывает известные PREs и, таким образом, может идентифицировать потенциальные гены-мишени PcG в геноме Drosophila (рис. 11.66) (Ringrose et al., 2003). Семейство генов, контролируемых PRE, включает элементы от генов хорошо известных и важных для развития транскрипционных факторов, необходимых для формирования паттерна, до генов, кодирующих факторы, участвующие в регулировании клеточного цикла и старения. Рис. 11.7. Регуляция и функция PRC 1 входе клеточного деления
(а) Кросс-регуляторные взаимодействия между генами PcG, предполагаемые на основе генетических данных. Е(Рс), Pci и Asx — позитивные регуляторы членов кора PRC1, действующих «вверх по течению», Члены PRC2 Esc и E(z) действуют как позитивные регуляторы транскрипции Рс. Видна отрицательная обратная связь от членов кора PRC1 на Psc и dRing 1, а также на Su(z)2. Тонкая настройка уровня генного продукта, вероятно, необходима для хорошо сбалансированных процессов, базирующихся на химическом равновесии, (б) Факторы транскрипции, специфичные для нуклеотидной последовательности (TF) привязывают компоненты PRC1 к PRE. Стабильный сайленсирующий комплекс требует заякоривания PRC1 через хромодомен РС на соседних метилированных «хвостах» гистонов. (в) Возможная модель того, как могут наследоваться состояния дифференциальной экспрессии генов. Процесс межгенной транскрипции помещает позитивные эпигенетические метки (например, ацетилированные хвосты гистонов, варианты гистонов) в PREs, которые контролируют активные гены (PRE 2). Все другие PREs сайленсируются «по умолчанию» (PRE 1). Во время репликации ДНК и митоза только позитивный эпигенетический сигнал нужно передать дочерним клеткам, что гарантирует, что в следующей интерфазе межгенная транскрипция возобновляется в PRE 2, прежде чем сайленсинг «по умолчанию» вновь устанавливается во всех других PREs (а — из Ali and Bender, 2004, переработано)
Рис. 11.7. Регуляция и функция PRC 1 входе клеточного деления
(а) Кросс-регуляторные взаимодействия между генами PcG, предполагаемые на основе генетических данных. Е(Рс), Pci и Asx — позитивные регуляторы членов кора PRC1, действующих «вверх по течению», Члены PRC2 Esc и E(z) действуют как позитивные регуляторы транскрипции Рс. Видна отрицательная обратная связь от членов кора PRC1 на Psc и dRing 1, а также на Su(z)2. Тонкая настройка уровня генного продукта, вероятно, необходима для хорошо сбалансированных процессов, базирующихся на химическом равновесии, (б) Факторы транскрипции, специфичные для нуклеотидной последовательности (TF) привязывают компоненты PRC1 к PRE. Стабильный сайленсирующий комплекс требует заякоривания PRC1 через хромодомен РС на соседних метилированных «хвостах» гистонов. (в) Возможная модель того, как могут наследоваться состояния дифференциальной экспрессии генов. Процесс межгенной транскрипции помещает позитивные эпигенетические метки (например, ацетилированные хвосты гистонов, варианты гистонов) в PREs, которые контролируют активные гены (PRE 2). Все другие PREs сайленсируются «по умолчанию» (PRE 1). Во время репликации ДНК и митоза только позитивный эпигенетический сигнал нужно передать дочерним клеткам, что гарантирует, что в следующей интерфазе межгенная транскрипция возобновляется в PRE 2, прежде чем сайленсинг «по умолчанию» вновь устанавливается во всех других PREs (а — из Ali and Bender, 2004, переработано)
PRC1, будучи однажды связанным, взаимодействует с соседними гистонами и генерирует стабильные сайленсирующие комплексы в PREs (Рис. 11.76). Метки H3K27шеЗ, созданные PRC2, действуют как дополнительные места связывания для хромодомена РС (рис. 11.7в). В их отсутствие, как показывает конкуренция с растворимым пептидом метилированного «хвоста» гистона, PRCls диссоциируют со своих генов-мишеней (Czermin et al., 2002; Ringrose et al., 2004; Wang et al., 2004) Открытие у PRC2 активности HKMT и ассоциированных гистоновых меток, типичных для «молчащего» хроматина, позволило предположить новый механизм для установления репрессии PcG. Вслед за катализируемой PRC2 модификацией H3K27me3 PRC1 связывается через хромодомен белка РС и стабилизирует сайленсинг. Это подкрепляется данными о том, что (1) метки H3K27me3 и РС колокализуются на политенных хромосомах и (2) связывание РС утрачивается у мутантов E(z), у которых нет активности HKMT модифицирующей H3 метками H3K27me3 в PREs, помогая рекрутировать РС к его мишеням (рис. L 1.5). Хотя такая модель несомненно привлекательна, ситуация в PRE», по-видимому, более сложная, поскольку PRC2s и PRC1 действуют не последовательно, а, скорее, присутствуют вместе на PREs в раннем эмбриогенезе (рис. 11.56, в). Таким образом, представляется вероятным, что метилирование H3K27 является событием «вниз по течению» после рекрутирования PcG, но играет ключевую роль в установлении «молчащего» состояния. Эта описанная выше модель демонстрирует параллели с формированием гетерохроматина, где Гетерохроматиновый Белок 1 (НР1) рекрутируется через свой хромодомен к меткам H3K9me, созданным SU(VAR)3-9 (глава 5). Таким образом, продуктивный сайленсирующий комплекс «нацеливается» транскрипционными факторами на определенные элементы нуклеотидных последовательностей ДНК, но, помимо этого, требует поблизости слой соответствующим образом модифицированных гистонов для генерации структуры репрессированного хроматина более высокого порядка (рис. 11.5). В ходе эволюции PREs оказались на удивление мало консервативными по последовательности. Даже в пределах близкородственных видов Drosophila число, положение и состав PREs существенно варьируют (L. Ringrose and R. Раю, неопубликовано). Это заставляет предполагать, что требования в отношении последовательности, а также положения PREs являются нежесткими и могут быть адаптированными к видоспецифичным требованиям. Тем не менее, компоненты PRC1 высоко консервативны и предположительно используют тот же самый базовый молекулярный механизм (механизмы) для индукции изменений более высокого порядка в хроматине «молчащих» генов-мишеней.
3.3. Установление репрессивных функций с помощью PRC1
Способ, которым связанные с PRE PRCls взаимодействуют с промотором и предотвращают транскрипцию, все еще неизвестен. Заякоривание временно останавливающихся [paused] комплексов PHК-полимеразы в промоторах, предотвращающее инициацию, было приписано взаимодействиям PRE-PRC1, описанным для ре портерных конструктов (Dellino et al., 2004). Кроме того, было показано, что PRC1 противодействует ремоделингу нуклеосом in vitro и индуцирует компактную структуру хроматина. Таким образом, PRC1 потенциально блокирует доступ к ДНК транскрипционных факторов и других комплексов, необходимых для транскрипции (Francis et al., 2004). С помощью алгоритма, описанного выше, предсказывается существование PRE-подобных последовательностей в почти всех промоторах контролируемых PcG генов-мишеней Drosophila. Это позволяет предполагать, что размещение PRC1 и в промоторах, и в регуляторных сайтах могло бы благоприятствовать взаимодействиям между PREs и промоторами и устанавливать стабильно репрессированные хроматиновые структуры, неблагоприятные для транскрипции (Ringrose et al., 2003). Стабильность сайленсирующих комплексов, как показывает заякоривание через метилированные «хвосты» гистонов, оказывается признаком долговременной репрессивной функции белков PcG. Однако при анализе in vivo на клеточном уровне наблюдается замечательно динамичное поведение. Белки PcG кластеризуются в PcG-тельца, которые варьируют между клетками по величине и составу, заставляя предполагать взаимодействие сайленсирующих комплексов в ядре, которое регулируется в развитии. Более того, анализ динамики маркированных GFP белков РС и PH in vivo обнаружил очень высокую скорость обмена несвязанных белков с их комплексами в сайленсированных мишенях (Ficz et al., 2005). Эти результаты позволяют предполагать, что долговременная репрессия в основном базируется на химическом равновесии между связанными и не связанными белками, а не на высокоаффинной защите сайтов, связывающихся с ДНК.3.4. Предотвращение наследуемой репрессии антисайленсингом
Связывание PRCls с PREs, по-видимому, индуцируется «по умолчанию», поскольку многие из заякориваюшихся компонентов PcG и белков, связывающихся с ДНК, экспрессируются во всех клетках, и PREs глобально сайленсируют репортерные гены в трансгенных конструктах. Противодействующие белки группы trxG в действительности функционируют не как активаторы, но, скорее, как антирепрессоры (Klymenko and Mbller, 2004; глава 12). Таким образом, для поддержания активной транскрипции гена контролируемого PRE, сайленсинг в этом PRE должен быть предотвращен ткане- и стадиеспецифическим образом. У Drosophila, например, активация генов НОХ контролируется ранним каскадом транскрипционных факторов, кодируемых генами сегментации. Интересно, что эти факторы индуцируют транскрипцию не только генов НОХ, но и межгенных, некодирующих РНК, которые транскрибируются через ассоциированные PREs, часто обнаруживаемые «вверх по течению» или «вниз по течению» (рис. 11.5). Было показано, что транскрипция через PREs необходима для предотвращения сайленсинга и поддержания активного состояния репортерного гена с использованием трансгенных конструктов (Schmitt et al., 2005). Процесс транскрипции, вероятнее всего, ремоделирует хроматин PRE и генерирует активное состояние, характеризующиеся, например, отсутствием репрессивного метилирования гистонов и присутствием ацетилирования гистонов. Таким образом, даже несмотря на то, что белки, связывающиеся с ДНК, и привлекают PRC1 к этому конкретному активированному PRE, гистоновое окружение не разрешает заякоривание РС через H3K27шеЗ и никакой стабильный сайленсинг не будет установлен. Поскольку в системе PcG сайленсинг индуцируется «по умолчанию», эпигенетическое наследование паттерна дифференциальной экспрессии генов требует только передачи активного состояния PRE в ходе репликации ДНК и митоза (рис 11.7в). Каким образом это достигается на молекулярном уровне и какая эпигенетическая метка (метки) отвечает за поддержание активного состояния PRE — все эти вопросы пока еще остаются открытыми. Интересно, что недавно было показано, что в PRE гомеотического гена Ubx у Drosophila некодирующие РНК, продуцируемые на PREs, остаются ассоциированными с хроматином и рекрутируют регулятор trxG, Absent Small или Homeotic discs 1 (ASH1). Разрушение этих РНК с помощью RNAi ослабляет рекрутирование ASH 1 к PRE, заставляя предполагать, что это взаимодействие играет важную роль в эпигенетической активации гомеотических генов путем преодоления сайленсинга, индуцированного PcG «по умолчанию» (Sanchez-Eisner et al., 2006).4. Репрессия PcG в развитии млекопитающих
4.1. От репрессии гена к репрессии хромосомы
Мутации в компонентах мышиного PRC1 демонстрируют гомеотические трансформации аксиального скелета. Это может вызывать появление дополнительных позвонков как следствие дерепрессии генов НОХ (рис. 11.2д, е) (Core et al., 1997). Кроме того, мутантные мыши обнаруживают тяжелый комбинированный иммунодефицит, вызываемый отсутствием пролиферативных ответов гематопоэтических клеток (Raaphorst, 2005). Роль белков PcG была особенно хорошо изучена на клетках крови, в свете того факта, что большинство линий клеток крови характеризуются их хорошо описанными, специфичными для клеточного типа программами транскрипции. Однако коммитирование и рестрикция линии каким-то образом нуждаются в надежном поддержании при клеточном делении. Оказывается, что у нокаутных по PcG мышей популяции предшественников В- и Т-клеток продуцируются нормально, показывая, что контроль PcG не играет роли в установлении специфичных для линии паттернов генной экспрессии. Однако белки PcG вносят вклад в необратимость выбора линии, а не участвуют в решении следовать по определенному пути развития. Кроме контроля генов НОХ, паттерны экспрессии которых характеризуют разные линии клеток крови, белки PcG играют главную роль в контроле пролиферации. Ген bmi1, ортолог гена Psc Drosophila, был первоначально идентифицирован как онкоген, который, в кооперации с туе, индуцирует лимфомагенез у мышей (van Lohuizen et al., 1991). Белок Bmi1 контролирует регуляторы клеточного цикла р16INK4а из 19АRF (Jacobs et al., 1999). И Bmi1, и родственный белок Mel-18 являются негативными регуляторами локуса 1NK4C-ARF, необходимого для контроля нормальной лимфоидной пролиферации. Мисрегуляция этой важной контрольной точки [checkpoint] клеточного цикла влияет на апоптоз и старение у мышей (Akasaka et al., 2001). Белки PcG млекопитающих ассоциированы также с классическим эпигенетическим феноменом инактивации Х-хромосомы (глава 17). Инактивация одной Х-хромосомы в ХХ-клетках самок сопровождается серией модификаций хроматина, в которых участвуют белки PcG (Heard, 2004). В частности, компоненты PRC2, подобно гомологу ESC, Eed (Embryonic ectoderm expression), или гомологу E(Z), Enx1 (табл. 11.1), играют главную роль в установлении меток гистонов, ассоциированных с транскрипционным сайленсингом. Временная [transient] ассоциация этого PRC2 с Х-хромосомой, покрытой РНК Xist, сопровождается метилированием H3K27. Напротив, мутантные по eed эмбрионы мыши не обнаруживают рекрутирования HKMT Fnx1, и у них не наблюдается никакого метилирования H3K27. Однако отсутствие этих компонентов PRC2 не ведет к полной дерепрессии всей неактивной Х-хромосомы; скорее, в некоторых клетках наблюдаются спорадическая реэкспрессия сцепленных с X генов и увеличение эпигенетических меток, ассоциированных с активным состоянием (H3K9ас и H3K4me3). Это происходит, вероятно, потому, что другие частично избыточные эпигенетические механизмы взамен обеспечивают поддержание одной активной Х-хромосомы. Рекрутирование PRC2 к неактивной Х-хромосоме, по-видимому, зависит от РНК Xist. Поскольку связь PRC2 с неактивной X лишь временная, оказывается, что этот комплекс необходим лишь для установления эпигенетических меток (т.е. H3K27me3), чтобы поддерживать сайленсинг. В настоящее время неизвестно, узнает ли PRC1 эти метки непосредственно и требуется ли он для перманентного сайленсинга неактивной Х-хромосомы, но компоненты PRC1 оказываются связанными с неактивной Х-хромосомой. Однако известно, что метилирование ДНК сопровождает фазу поддержания и необходимо для перманентной инактивации X. PRC2 специфически участвует в регуляции моноаллельной экспрессии Х-хромосомы как у эмбриона, где инактивация Х-хромосомы является случайной, так и в экстраэмбриональных тканях, где всегда инактивирована Х-хромосома, унаследованная от отца (инактивация импринтированной Х-хромосомы). Кроме того, недавно было обнаружено, что PRC2 участвует в регуляции некоторых аутосомных импринтированных генов. Например, анализ 14 импринтированных локусов из шести несцепленных импринтированных кластеров показал, что четыре из них биаллельно экспрессировались у мутантных по eed мышей (Mager et al., 2003; дополнительные детали см в главе, 19). Интересно, что все локусы, утратившие импринтированную экспрессию, были нормально репрессированы, когда наследовались от отца, тогда как ни один из локусов, репрессированных по материнской линии, не был затронут Поскольку недавно было показано, что Ezh2 непосредственно взаимодействует с метилтрансферазами ДНК млекопитающих и требуется для их активности (Vim et al., 2006), не исключено, что PRC2 играет роль в регуляции этих импринтированных генов посредством метилирования ДНК (глава 18). Об участии PRC2 в регуляции экспрессии импринтированных генов сообщалось и для Arabidopsis, где локус РНЕ1 экспрессируется на гораздо более высоких уровнях с отцовской аллели (КцЫег et al., 2005). У мутантов по МЕА, гомологу E(z), материнская аллель РНЕ1 специфически дерепрессирована. Аналогичным образом МЕЛ регулирует также свою собственную импринтированную экспрессию: на ранних стадиях репродуктивного развития материнская аллель МЕЛ сильно дерепрессирована у мутантов теа. Этот эффект, однако, не зависит от других компонентов комплекса FIS (Baroux et al., 2006). Напротив, на более поздних стадиях развития комплекс FIS обеспечивает стабильную репрессию отцовской аллели МЕЛ (Ваших et al., 2006; Gehring et al., 2006; Jullien et al., 2006). В этом последнем случае комплекс FIS участвует в сайленсинге репрессированных у отца импринтированных генов аналогично ситуации у млекопитающих. Кроме того, МЕЛ играет также роль в поддержании экспрессии материнских аллелей РНЕ1 и МЕА на низком уровне, как описано выше (рис. 11.4). Поскольку компоненты PRC2 имеются у растений, беспозвоночных и млекопитающих, PRC2 представляет собой древний молекулярный модуль, годящийся для репрессии генов, который имелся уже у одноклеточного предка растений и животных, до развития многоклеточности. Таким образом, эти примеры позволяют предполагать, что PRC2 был мобилизован независимо для регуляции экспрессии импринтированных генов у растений и животных, в двух линиях, где возник геномный импринтинг (Grossniklaus, 2005).4.2. Последствия аберрантной активации транскрипции
Обнаружение того, что миерегуляция Bmi1 вызывает злокачественные лимфомы у мышей, ставит вопрос о том, вносит ли BMI1 человека (являющийся компонентом PRC1) сам по себе вклад в развитие рака аналогичным образом. Накапливаются данные о том, что измененная экспрессия гена PcG широко распространена в злокачественных лимфомах человека (Raaphorst, 2005). Например, уровень сверхэкспрессии BMI1 в В-клеточных лимфомах коррелирует со степенью злокачественности, заставляя предполагать, что компоненты PRC1 играют-таки роль в развитии рака у человека. Однако гены-мишени BMI1 в клетках человека, по-видимому, отличаются от генов-мишеней в мышиных лимфоцитах, поскольку никакую очевидную даун-регуляцию pl6INK4a нельзя скоррелировать со сверхэкспрессией онкогенов. Сверхэкспрессия гена PcG наблюдается не только при гематологических злокачественных новообразованиях, но обнаруживается и в солидных опухолях, в том числе в медуллобластомах и опухолях, происходящих из печени, прямой кишки, груди, легкого, пениса и простаты (рис. 11.8). Высокий уровень экспрессии Ezh2, маркера PRC2, часто обнаруживается на ранних стадиях высокопролиферативных легочных карцином. Это позволяет предположить, что хорошо известный каскад инициации PRC2 и поддержания PRC1 (рис. 11.5) мог бы также сопровождать развитие линии опухолевых клеток. Рис. 11.8. PRC2 регулирует клеточную пролиферацию у млекопитающих и растений
(а, б) Зародыши растения, происходящие из яйцеклеток дикого типа и мутанта теа. МЕА кодирует белок комплекса FIS и регулирует клеточную пролиферацию. Гигантский зародыш mea гораздо крупнее соответствующего зародыша дикого типа на той же стадии развития (поздняя стадия «сердечка» — late heart stage). Мутантные зародыши развиваются меделеннее и имеют примерно вдвое большее число клеточных слоев. (в, г) Нормальный и раковый эпителий простаты. В раковом эпителии экспрессия Ezh2 сильно увеличена (метка антителом против Ezh2). Таким образом, как утрата Е(2)-функции у растений, так и сверхэкспрессия функции E(Z) у человека может приводить к дефектам в клеточной пролиферации. (д. е) Контрольные крысиные фибробласты 1а и фибробласты со сверхэкспрессией RING1. Сверэкспрессия RING1 приводит к независимому от заякоривания росту в мягком агаре, типичному для неопластически трансформированных клеток, (а,б, любезно предоставлено J.-P. Vielle-Calzada and U. Grossniklaus; в, г, перепечатано, с любезного разрешения, из Kuzmichev et al., 2005 [©National Academy of Sciences]; д, e, перепечатано, с любезного разрешения, из Satijn and Otte, 1999 [©American Society for Microbiology].)
Рис. 11.8. PRC2 регулирует клеточную пролиферацию у млекопитающих и растений
(а, б) Зародыши растения, происходящие из яйцеклеток дикого типа и мутанта теа. МЕА кодирует белок комплекса FIS и регулирует клеточную пролиферацию. Гигантский зародыш mea гораздо крупнее соответствующего зародыша дикого типа на той же стадии развития (поздняя стадия «сердечка» — late heart stage). Мутантные зародыши развиваются меделеннее и имеют примерно вдвое большее число клеточных слоев. (в, г) Нормальный и раковый эпителий простаты. В раковом эпителии экспрессия Ezh2 сильно увеличена (метка антителом против Ezh2). Таким образом, как утрата Е(2)-функции у растений, так и сверхэкспрессия функции E(Z) у человека может приводить к дефектам в клеточной пролиферации. (д. е) Контрольные крысиные фибробласты 1а и фибробласты со сверхэкспрессией RING1. Сверэкспрессия RING1 приводит к независимому от заякоривания росту в мягком агаре, типичному для неопластически трансформированных клеток, (а,б, любезно предоставлено J.-P. Vielle-Calzada and U. Grossniklaus; в, г, перепечатано, с любезного разрешения, из Kuzmichev et al., 2005 [©National Academy of Sciences]; д, e, перепечатано, с любезного разрешения, из Satijn and Otte, 1999 [©American Society for Microbiology].)
Интересно, что компоненты PRC2 играют также ключевую роль в контроле клеточной пролиферации у Arabidopsis. Хотя у растений аберрантный рост не приводит к раку и гибели, жесткий контроль клеточной пролиферации является существенным для нормального развития. У мутантов классаfis два продукта оплодотворения у цветковых растений, зародыш и эндосперм, пролиферируют избыточно, и получающиеся в результате семена абортируют (рис. 11.8) (Grossniklaus et al., 2001; Hsieh et al., 2003; Guitton and Berger, 2005). Влияние на клеточную пролиферацию наблюдается и у двойных мутантов elf и swn, двух гомологов E(z) у растений. Такие растения демонстрируют нормальное развитие семян после прорастания, но образуют массу пролиферирующей, недифференцированной ткани (каллус), а не листья (Chanvivattana et al., 2004). Хотя и неизвестно, каким образом PRC2 контролирует клеточную пролиферацию у растений, вполне вероятно, что он должен взаимодействовать с RBR1, растительным гомологом ретинобластомного белка Rb (Ebel et al.. 2004; Mosquna et al., 2004). Мутанты в FIS-классе генов не только обнаруживают дефекты пролиферации в ходе развития семян после оплодотворения, но и необходимы для предотвращения пролиферации эндосперма в отсутствие оплодотворения. Этот последний аспект фенотипа является общим с мутантами rbr1 обеспечивая связующее звено с Rb-путем. Замечательно, что сообщалось также о связи между Rb-путем и PRC2 у млекопитающих (Bracken et al, 2003), что иллюстрирует консерватизм регуляторных сетей между растениями и млекопитающими.
4.3. Поддержание судьбы стволовой клетки
Стволовые клетки играют все возрастающую роль в медицине. Их возможность обеспечивать прогениторные клетки для заживления поврежденной ткани включает их в высокоценимый инструментарий регенеративной медицины. Неудивительно, что больше всего об идентичности и локализации стволовых клеток мы знаем на примере лучше всего охарактеризованной линии клеток крови. Гематопоэтические стволовые клетки (HSCs) поддерживают пул клеток крови путем самообновления, а также производства дочерних клеток, которые дифференцируются в лимфоидные, миелоидные и эритроидные линии. Ниша стволовых клеток в костном мозге взрослого организма обеспечивает эти клетки специфическими внешними сигналами для поддержания их судьбы. С другой стороны, внутриклеточные сигналы для поддержания состояния «стволовости», базируются, по-видимому, на системе PcG. Мутанты мышей с мутациями генов PRC 1 (например, bmi1/mel-18, mph1/rae28 и тЗЗ: см. табл. 11.1) страдают различными дефектами в гематопоэтической системе, такими как гиперплазия (т.е. увеличенная клеточная пролиферация) в селезенке и тимусе, уменьшение числа В- и Т-клеток и нарушенный пролиферативный ответ лимфоидных предшественников на цитокины. Потребность в Bmi1 и Mel-18 в процессе самообновления стволовых клеток на различных стадиях развития позволяет предполагать меняющийся пул генов-мишеней для эмбриональных и взрослых стволовых клеток. Для нейральных стволовых клеток (NSCs) также необходима система PcG, как показывают дефекты нейронов, наблюдаемые у мутантов bmi1 мышей (Bruggeman et al., 2005; Zencak et al., 2005). В частности, в постнатальном периоде мыши лишены церебральных NSCs, показывая тем самым потребность в Bmi1 in vivo в процессе обновления NSCs. Как было обнаружено для гематопоэтической системы, поддержание эмбриональных NSCs находится, как оказывается, под контролем другой сети PcG, чем самообновление взрослых NSCs. Внешние сигналы, подобные сигнальному каскаду sonic Hedgehog, модулируют ответ Bmi1 в NSCs и обеспечивают способность к пролиферации/самообновлению (Leung et al., 2004). Идентификация этих внешних сигналов, контролирующих репрессию PcG была достигнута посредством анализа развития прогениторов гранулярных нейронов мозжечка (CGNPs — cerebellar ganule neuron progenitors). Постнатальная волна пролиферации индуцируется сигнальным фактором Sonic hedgehog (Shh), секретируемым клетками Пуркинье. Сигнал Shh разветвляется и контролирует уровни N-Myc и Bmi1 (рис. 11.9). Таким образом, CGNPs с нехваткой Bmi1, демонстрируют дефектный пролиферативный ответ на стимуляцию Shh. Сигнал Shh способен в конечном счете контролировать пролиферацию этих стволовых клеток, модулируя и путь Rb «вниз по течению» (через N-myc и Bmi1/pl6INK4a), и путь р53 (через Bmi1/pl9ARF). Этот механизм объясняет, почему гиперактивация Shh-сигналинга ведет к развитию медуллобластом (Leung et al., 2004). HSCs регулируются сходным путем, контролируемым Indian hedgehog. У NSCs экспрессия локусов Hoxd8, Hoxd9 и Нохс9 находится под контролем Bmi1. Соответствующий профиль экспрессии НОХ сообщает стволовым клеткам необходимую судьбу. Действительно, поскольку стволовые клетки представляют определенную и коммитированную клеточную судьбу, неудивительно, что система PcG поддерживает эту конкретную судьбу наследуемым в митозе образом. В будущем будет интересно идентифицировать пул мишеней системы PcG в различных популяциях стволовых клеток и выяснить, каким образом можно влиять на систему поддержания, чтобы сделать возможным контролируемое репрограммирование судьбы стволовых клеток. В данный момент неясно, играет ли PcG какую-либо роль в поддержании стволовых клеток у растений. Возможно, однако, что репрограммирование растительных клеток, которые являются тотипотентными и обладают потенциальной способностью образовывать, в соответствующих условиях, полный новый организм, могло бы включать регуляцию PcG. Действительно, растения, лишенные гомологов E(z), CLF и SWN, продуцируют, после прорастания, массу недифференцированных клеток; это позволяет предположить, что для поддержания дифференцированного состояния необходимы гены PcG (Chanvivattana et al., 2004). Рис. 11.9. Сигналит Sonic Hedgehog поддерживает пролиферацию/ самообновление прогениторных клеток мозжечка
Сигнальный каскад Shh регулирует и путь Rb, и путь р53 через Bmi1-контроль контрольную точку пролиферации Р16/р19. Подавление Smoothened (Smoh) Shh-рецептором Patched (Ptch) приводит к сигналингу «вниз по течению» в ядре Одна часть этого сигнала индуцирует N-Myc, Cyclin D1 и D2, тогда как другая часть активирует Bmi1 через эффекторы Gli (адаптировано из Valk-Lmgbeek et al., 2004)
Рис. 11.9. Сигналит Sonic Hedgehog поддерживает пролиферацию/ самообновление прогениторных клеток мозжечка
Сигнальный каскад Shh регулирует и путь Rb, и путь р53 через Bmi1-контроль контрольную точку пролиферации Р16/р19. Подавление Smoothened (Smoh) Shh-рецептором Patched (Ptch) приводит к сигналингу «вниз по течению» в ядре Одна часть этого сигнала индуцирует N-Myc, Cyclin D1 и D2, тогда как другая часть активирует Bmi1 через эффекторы Gli (адаптировано из Valk-Lmgbeek et al., 2004)
5. Заключение и перспективы
Было замечательно проследить развитие наших представлений об эпигенетической регуляции PcG, начиная с первоначальной генетической идентификации мутанта Drosophila, обладающего дополнительными половыми гребешками на второй и третьей паре ног. Это в конечном счете привело к открытию нового класса регуляторов, которые, как оказалось, необходимы для таких фундаментальных эпигенетических процессов, как яровизация у растений и сайленсинг Х-хромосомы млекопитающих. Контроль генетической информации находится под сильным влиянием структуры хроматина и состава гистонов в их разнообразных модифицированных формах. Белки PcG непосредственно участвуют в генерации эпигенетических меток, например H3K27me3, вследствие «решений», принимаемых в ходе развития. Та же самая группа «считывает» эти эпигенетические метки (т.е. обнаруживает высокое сродство к ним) посредством действия белков PRC1 и транслирует их в стабильное, транскрипционно репрессированное состояние. У модельного организма Drosophila мы имеем относительно ясную картину того, как комплексы PcG заякорены в PREs для определенной группы генов-мишеней, подверженных долговременной репрессии. Однако до сегодняшнего дня не было идентифицировано никаких PREs у других организмов. Хотя основная функция белков PcG остается той же, неясно, какая часть геномов растений и позвоночных подвержена их репрессирующему действию и каким образом они «нацеливаются» на место их действия. Кроме того, нам нужно лучше понять, каким образом явно динамичная группа белков может навязывать стабильное состояние транскрипционной репрессии через химическое равновесие. Другой важный вопрос в исследованиях PcG касается наследуемости репрессированного состояния, т.е. самого существа эпигенетики. Что представляет собой идентичность молекулярных меток, требующихся для передачи состояния экспрессии генов при репликации ДНК и митозе? Мы знаем, что активное или «молчащее» состояния экспрессии генов поддерживается совместным действием белков trxG и PcG. Нужны ли для обоих этих состояний соответствующие эпигенетические метки, передающиеся дочерним клеткам, или же достаточно лишь одной, тогда как другая представляет собой состояние «по умолчанию»? Механизм, посредством которого белки PcG навязывают сайленсинг на транскрипцию во время интерфазы клеточного цикла, становится все более ясным. В будущем исследование будет сосредоточено на том, каким образом информация относительно состояния экспрессии генов сохраняется в процессе репликации ДНК и надежно передаетсядочерним клеткам после митоза.Литература
Akasaka T., van Lohuizen M., van der Lugt N., Mizutani-Koseki Y., Kanno M., Taniguchi M., Vidal M., Alkema M, BemsA., and Koseki H., 2001. Mice doubly deficient for the Polycomb Group genes Mel 18 and Bmi1 reveal synergy and requirement for maintenance but not initiation of HOXgene expression. Development 128: 1587-1597. Ali J.Y. and Bender W., 2004. Cross-regulation among the Polycomb group genes in Drosophila melanogaster. Mol. Cell. Biol. 24: 7737-7747. Ausin I., Alonso-Blanco C., Jarillo J.A., Ruiz-GarciaL., and Marti-nez-Zapater J.M., 2004. Regulation of flowering time by FVE, a retinoblastoma-associated protein. Nat. Genet. 36: 162-166. Bannister A. J., Zegerman R, Partridge J.F., MiskaE.A., Thomas J.O., Allshire R.C., and Kouzarides T., 2001. Selective recognition of methylated lysine 9 on histone H3 by the HP1 chromodomain. Nature 410: 120-124. Baroux C., Gagliardini V., Page D., and Grossniklaus U., 2006. Dynamic regulatory interactions of Polycomb group genes: MEDEA autoregulation is required for imprinted gene expression in Arabidopsis. Genes Dev., 20: 1081-1086. Bastow R., Mylne J.S., Lister C., Lippman Z., Martienssen R.A., and Dean C., 2004. Vernalization requires epigenetic silencing of EEC by histone methylation. Nature 427: 164-167. Birve A., Sengupta A.K., Beuchle D., Laisson J., Kennison J.A., Rasmuson-Lestander A., and Mbller J., 2001. Su(z) 12, a novel Drosophda Polycomb group gene that is conserved in vertebrates and plants. Development 128: 3371-3379. Bracken A.P., Pasini D., Capra M., Prosperini E., Colli E., and Helin K., 2003. EZH2 is downstream of the pRB-E2F pathway essential for proliferation and amplified in cancer. EMBO J. 22: 5323-5335. Breiling A., Bonte E., Ferrari S., Becker P.B., and Paro R., 1999. The Drosophila Polycomb protein interacts with nucleosomal core particles in vitro via its repression domain. Mol. Cell. Biol., 19: 8451-8460. Bruggeman S.W.M., Valk-Lingbeek M.E., van der Stoop P.P.M., Jacobs J.J.L., Kieboom K., Tanger E., Hulsman D., Leung C.. Arsenijevic Y., Marino S., and van Lohuizen M., 2005. Ink4a and Arf differentially affect cell proliferation and neural stem cell selfrenewal in Bmi1 -deficient mice. Genes Dev., 19: 1438-1443. Cao R.. Tsukada Y., and Zhang Y., 2005. Role of Bmi-1 and RinglA in H2A ubiquitylation and HOX gene silencing. Mol. Cell, 20: 845-854. Cao R., Wang L.J., Wang H.B., Xia L., Erdjument-Bromage H.,Tempst P., Jones R.S., and Zhang Y., 2002. Role ofhistone H3 lysine 27 methylation in Polycomb-group silencing. Science 298: 1039-1043. Carrington E.A and Jones R.S., 1996. The Drosophila Enhancer of zeste gene encodes a chromosomal protein: Examination of wild-type and mutant protein distribution. Development 122: 4073-4083. Chanvivattana Y., Bishopp A., Schubert D., Stock C., Moon Y.H., Sung Z.R., and Goodrich J., 2004. Interaction of Polycomb-group proteins controlling flowering in Arabidopsis. Development 131: 5263-5276. Core N., Charroux B., McCormick A., Vola C, Fasano L., Scott M.P., and Kerridge S., 1997. Transcriptional regulation of the Drosophila homeotic gene teashirt by the homeodomain protein Fushitarazu. Mech. Dev. 68: 157-172. Czermin B., Melfi R., McCabe D., Seitz V., lmhof A., and Pirrotta V., 2002. Drosophila enhancer of Zeste/ESC complexes have a histone H3 methyltransferase activity that marks chromosomal Polycomb sites. Cell 111: 185-196. Dejardin J., Rappailles A., CuvierO., Grimaud C., Decoville M., Locker D., and Cavalli G., 2005. Recmitment of Drosophila Polycomb group proteins to chromatin by DSP1. Nature 434: 533-538. Dellino G.I., Schwartz Y.B., Farkas G., McCabe D., Elgin S.C., and Pirrotta V., 2004. Polycomb silencing blocks transcription initiation. Mol. Cell 13: 887-893. del MarLorente D., Marcos-Gutierrez G., Perez C., Schoorlemmei J., Ramirez A., MaginT., and Vidal M., 2000. Loss- andgain-of-function mutations show a Polycomb group function for RinglA in mice. Development 127: 5093-5100. de Napoles M., Mermoud J.E., Wakao R., Tang Y.A., Endoh M., Appanah R., Nesterova T.B., Silva J., Otte A.P., Vidal M., et al., 2004. Polycomb group proteins RinglA/B link ubiquitylation of histone H2A to heritable gene silencing and X inactivation. Dev. Cell 7: 663-676. Ebel C., Mariconti L., and Gruissem W., 2004. Plant retinoblastoma homologues control nuclear proliferation in the female gameto-phyte. Nature 429: 776-780. Fang J., Chen T.P., Chadwick B., Li E., and Zhang Y., 2004. Ringlb-mediated H2A ubiquitination associates with inactive X chromosomes and is involved in initiation ofX inactivation. J. Biol. Chem. 279: 52812-52815. Ficz G., Heintzmann R., and Arndt Jovin D.J., 2005. Polycomb group protein complexes exchange rapidly in living Drosophila. Development 132: 3963-3976. Fischle W., Wang Y., Jacobs S.A., Kim Y., Allis C.D., and Khoras-anizadeh S., 2003. Molecular basis for the discrimination of repressive methyl-lysine marks in histone H3 by Polycomb and HP1 chromodomains. Genes Dev. 17: 1870-1881. FongY., Bender L., Wang W., and Strome S., 2002. Regulation of the different chromatin states of autosomes and X chromosomes in the germ line of C. elegans. Science 296: 2235-2238. Francis N.J., Kingston R.E., and Woodcock C.L., 2004. Chromatin compaction by a Polycomb group protein complex. Science 306: 1574-1577. Francis N.J., Saurin A.J., Shao Z., and Kingston R.E., 2001. Reconstitution of a functional core Polycomb repressive complex. Mol. Cell 8: 545-556. Gehnng M., Huh J.H., Hsieh T.F., Penterman J., Choi Y., Harada J.J., Goldberg R.B., and Fischer R.L., 2006. DEMETER DNA glycosylase establishes MEDEA Polycomb gene self-imprinting by allele-specific demethylation. Cell 124: 495-506. Gendall A.R., Levy Y.Y., Wilson A., and Dean C., 2001. The VERNALIZATION2 gene mediates the epigenetic regulation of vernalization in Arabidopsis. Cell 107: 525-535. Goodrich J., Puangsomlee P., Martin M., Long D., Meyerowitz E.M., and Coupland G., 1997. A Polycomb-group gene regulates homeotic gene expression in Arabidopsis. Nature 386: 44—51. Grossniklaus U., 2005. Genomic imprinting in plants: A predominantly maternal affair. In Annual plant reviews: Plant epigenet-ics (ed. P. Meyer), pp. 174-200. Blackwell, Sheffield, United Kingdom. Grossniklaus U., Spillane C., Page D.R., and Kohler C., 2001. Genomic imprinting and seed development: Endosperm formation with and without sex. Curr. Opin. Plant Biol. 4: 21-27. Grossniklaus U., Vielle-Calzada J.P., Hoeppner M.A., and Gagliano W.B., 1998. Maternal control of embryogenesis by MEDEA, a Polycomb group gene in Arahidopsis. Science 280: 446-450. Guitton A.E. and Berger F., 2005. Control of reproduction by Polycomb Group complexes in animals and plants. Int. J. Dev. Biol. 49: 707-716. Hackett W.R, Cordero R.E., and Sinivasan C., 1987. Apical meristem characteristics and activity in relation to juvenility in Hedera, In Manipulation of flowering (ed. J.G. Atherton), pp. 93-99. But-terworth, London. Hadom E., 1968. Transdetermination in cells. Sci. Am. 219: 110. Heard E., 2004. Recent advances in X-chromosome inactivation. Curr. Opin. Cell Biol. : 247-255. Hennig L., Bouveret R., and Gruissem W., 2005. MSI 1-like proteins: An escort service for chromatin assembly and remodeling complexes. Trends Cell Biol. 15: 295-302. Hennig L., Taranto P., Walser M., SchonrockN., and Gruissem W., 2003. Arahidopsis MSI 1 is required for epigenetic maintenance of reproductive development. Development 130: 2555-2565. Hsieh T.F., Hakim O., Ohad N., and Fischer R.L., 2003. From flour to flower: How Polycomb group proteins influence multiple aspects of plant development. Trends Plant Sci. 8: 439-445. Jacobs J.J.L., Scheijen B., Voncken J.W., Kieboom K., Bems A., and van Lohuizen M., 1999. Bmi-1 collaborates with c-Myc in tumorigenesis by inhibiting c-Myc-induced apoptosis via INK4a/ARF. Genes Dev. 13: 2678-2690. Jullien P.E., Katz A., Oliva M., Ohad N., and Berger F., 2006. Polycomb group complexes self-regulate imprinting of the Polycomb group gene MEDEA in Arahidopsis. Curr. Biol. 16: 486-492. Kagey M.H., Melhuish T.A., and Wotton D., 2003. The Polycomb protein Pc2 is a SUMO E3. Cell 113: 127-137. Kennison J.A., 1995. The Polycomb and trithorax group proteins of Drosophila: Trans-regulators of homeotic gene function. Annu. Rev. Genet. 29: 289-303. Kim H.J., HyunY., ParkJ.Y., Park M.J., Park M.K., Kim M.D., Kim H.J., Lee M.H., Moon J., Lee I., and Kim J., 2004. A genetic link between cold responses and flowering time through FVE in Arahidopsis thaliana. Nat. Genet. 36: 167-171. Kinoshita T., Harada J.J., Goldberg R.B., and Fischer R.L., 2001. Polycomb repression of flowering during early plant development. Proc. Natl. Acad. Sci. 98: 14156-14161. Klebes A., Sustar A., Kechris K., Li H., SchubigerG., and Romberg T. B., 2005. Regulation of cellular plasticity in Drosophila imaginal disc cells by the Polycomb group, trithorax group and lama genes. Development 132: 3753-3765. Klymenko T. and Muller J., 2004 The histone methyltransferases Trithorax and Ashl prevent transcriptional silencing by Polycomb group proteins. EMBO Rep. 5: 373-377. Kuhler C., Page D.R., Gagliardini V., and Grossniklaus U., 2005. The Arahidopsis thaliana MEDEA Polycomb group protein controls expression of PHERES1 by parental imprinting. Nat. Genet. 37: 28-30. Kuhler C., Hennig L., Bouveret R., Gheyselinck J., Grossniklaus U., and Gruissem W., 2003a. Arahidopsis MSI 1 is a component of the MEA/FIE Polycomb group complex and required for seed development. EMBO J. 22: 4804-4814. Ruhler C., Hennig L., Spillane C., Pien S., Gruissem W., and Grossniklaus U., 2003b. The Polycomb group protein MEDEA regulates seed development by controlling expression of the MADS-box gene PHERES1. Genes Dev. 17: 1540-1553. Kuzmichev A., Jenuwein T., Tempst P., and Reinberg D., 2004. Different EZH2-containing complexes target methylation ofhistone HI or nucleosomal histone H3. Mol. Cell 14: 183-193. Kuzmichev A., Nishioka K., Erdjument-Bromage H., Tempst P., and Reinberg D., 2002. Histone methyltransferase activity associated with a human multiprotein complex containing the Enhancer of Zeste protein. Genes Dev. 16: 2893-2905. Kuzmichev A., Margueron R., Vaquero A., Preissner T.S., Scher M., Kirmizis A., Ouyang X., Brockdorff N., Abate Shen C., Farnham P., and Reinberg D., 2005. Composition and histone substrates of Polycomb repressive group complexes change during cellular differentiation. Proc. Natl. Acad. Sci. 102: 1859-1864. Lavigne M., Francis N.J., King I.F., and Kingston R.E., 2004. Propagation of silencing; recruitment and repression of naive chromatin in trans by Polycomb repressed chromatin. Mol. Cell 13: 415-425. Lee N., Maurange G, Ringrose L., and Paro R., 2005. Suppression of Polycomb group proteins by JNK signalling induces transdetermination in Drosophila imaginal discs. Nature 438: 234-237. Leung C., Lingbeek M., Shakhova O., Liu J., Tanger E., Saremaslani P., van Lohuizen M., and Marino S., 2004. Bmi1 is essential for cerebellar development and is overexpressed in human medullo-blastomas. Nature 428: 337-341. Levine S.S., King I.F., and Kingston R.E., 2004. Division of labor in Polycomb group repression. Trends Biochem. Sci. 29: 478-485. Levine S.S., Weiss A., Erdjument Bromage H., Shao Z., Tempst P., and Kingston R.E., 2002. The core of the Polycomb Repressive Complex is compositionally and functionally conserved in flies and humans. Mol. Cell. Biol. 22: 6070-6078. Lewis E.B., 1978. A gene complex controlling segmentation in Drosophila. Nature 276: 565-570. Luo M., Bilodeau P., Koltunow A., Dennis E.S., Peacock W.J., and Chaudhury A.M., 1999. Genes controlling fertilization-independent seed development in Arahidopsis thaliana. Proc. Natl. Acad. Sci. 96: 296-301. Mager J., Montgomery N.D., de Villena F.P.M., and Magnuson T., 2003 Genome imprinting regulated by the mouse Polycomb group protein Eed. Nat. Genet. 33: 502-507. Marx J., 2005. Developmental biology — Combing over the Polycomb group proteins. Science 308: 624-626. Moon Y.H., Chen L., Pan R.L., Chang H.S., Zhu T., Maffeo D.M., and Sung Z.R., 2003. EMF genes maintain vegetative development by repressing the flower program in Arabidopsis. Plant Cell 15: 681-693. Mosquna A., Katz A., Shochat S., Graft G., and Ohad N., 2004. Interaction of FIE, a Polycomb protein, with pRb: a possible mechanism regulating endosperm development. Mol. Genet. Genomics 271: 651-657. Muller J., Hart C.M., Francis N.J., Vargas M.L., Sengupta A., Wild B., Miller E.L., O’Connor M.B., Kingston R.E., and Simon J.A., 2002. Histone methyltransferase activity of a Drosophila polycomb group repressor complex. Cell 111:, 197-208. Ohad N., Yadegari R., Margossian L., Hannon M., Michaeli D., Harada J.J., Goldberg R.B., and Fischer R.L., 1999. Mutations in FIE, a WD Polycomb group gene, allow endosperm development without fertilization. Plant Cell 11: 407-415. Otte A. P. and Kwaks T.H., 2003. Gene repression by Polycomb group protein complexes: A distinct complex for every occasion? Curr. Opin. Genet Dev. 13: 448-454. Page D.R. and Grossniklaus U., 2002. The art and design of genetic screens: Arabidopsis thaliana. Nat. Rev. Genet. 3: 124-136. Paro R. and Hogness D.S., 1991. The Polycomb protein shares a homologous domain with a heterochromatin-associated protein of Drosophila. Proc. Natl. Acad. Sci. 88: 263-267. Poux S., McCabe D., and Pirrotta V., 2001. Recruitment of components of Polycomb group chromatin complexes in Drosophila. Development 128: 75-85 Raaphorst F.M, 2005. Deregulated expression of Polycomb-group oncogenes in human malignant lymphomas and epithelial tumors. Hum. Mol. Genet. 14: R93-100. Rea S., Eisenhaber R., O’Carroll N., Strahl B.D., Sun Z.W., Schmid M., Opravil S., Mechtler K., Pouting C.P., Allis C.D., and Jenuwein T., 2000. Regulation of chromatin structure by site-specific histone H3 methyltransferases. Nature 406: 593-599. Reyes J.C. and Grossniklaus U., 2003. Diverse functions of Polycomb group proteins during plant development. Semin. Cell Dev. Biol 14: 77-84. Ringrose L., Ehret H., and Paro R., 2004. Distinct contributions of histone H3 lysine 9 and 27 methylation to locus-specific stability of Polycomb complexes. Mol. Cell 16: 641-653. Ringrose I., Rehmsmeier M., Dura J.M., and Paro R., 2003. Genome-wide prediction of Polycomb/Trithorax response elements in Drosophila melanogaster. Dev. Cell 5: 759-771. Sanchez-Eisner T., Gou D., Kremmer E., and Sauer E., 2006. Non-coding RNAs of trithorax response elements recruit Drosophila Ashl to Ultrabithorax. Science 311: 1118-1123. Satijn D.P. and Ottc A.P., 1999. RING1 interacts with multiple Poly comb-group proteins and displays tumorigenic activity. Mol. Cell. Biol., 19: 57-68. Saurin A.J., Shiels C., Williamson J., Satijn D.P.E., Otte A.P, Sheer D., and Freemont PS., 1998. The human polycomb group complex associates with pencentromeric heterochromatin to form a novel nuclear domain. J. Cell Biol. 142: 887-898. Schmitt S., Prestel M., and Paro R., 2005. Intergenic transcription through a Polycomb group response element counteracts silencing. Genes Dev., 19: 697-708. Sung S. and Amasino R.M., 2004a. Vernalization and cpigenetics: How plants remember winter. Curr. Opin. Plant Biol 7: 4-10. Sung S. and Amasino R.M., 2004b. Vernalization in Arabidopsis thaliana is mediated by the PHD finger protein VIN3. Nature 427: 159-164. Tie F., FuruyamaT, Prasad-Sinha J., Jane E., and Harte P.J., 2001. The Drosophila Polycomb group proteins ESC and E(Z) are present in a complex containing the histone-binding protein p55 and the histone deacetylase RPD3. Development 128: 275-286. Tschiersch B., Hofmann A., Krauss V., Dorn R., Korge G., and Reuter G., 1994. The protein encoded by the Drosophila position-effect variegation suppressor gene Su(var)3-9 combines domains of antagonistic regulators of homeotic gene complexes. EMBO J. 13: 3822-3831. Valk-Lingbeek M.E., Bruggeman S.W.M., and van Lohuizen M., 2004. Stem cells and cancer: The Polycomb connection. Cell 118: 409-418. van der Lugt N.M., Domen J., Linders K., van Roon M., Robanus-Maandag E., te Riele H., van der Valk M., Deschamps J., Sofroniew M., van Lohuizen M., et al., 1994. Posterior transformation, neurological abnormalities, and severe hematopoietic defects in mice with a targeted deletion of the bmi-1 protooncogene. Genes Dev. 8: 757-769. van Lohuizen M., Verbeek S., Scheijen B., Wientjens E., van der Gulden H., and Bems A., 1991. Identification of cooperating oncogenes in Εμ-myc transgenic mice by provirus tagging. Cell 65: 737-752. Vim E., Brenner C., Deplus R., Blanchon L., Fraga M., Didelot C, Morey L., van Eynde A., Bernhard D., Vanderwinden J.M., et al., 2006. The Polycomb group protein EZH2 directly controls DNA methylation. Nature 439: 871-874. Wang L., Brown J.L., Cao R., Zhang Y., Kassis J.A., and Jones R.S., 2004. Hierarchical recruitment of Polycomb group silencing complexes. Mol. Cell 14: 637-646. Yamamoto Z., Girard F, Bello B., Affolter M., and Gehring W.J., 1997. The cramped gene of Drosophila is a member of the Poly comb-group, and interacts with mus209, the gene encoding proliferating cell nuclear antigen. Development 124: 3385-3394. Yamamoto K., Sonoda M., Tnokuchi J., Shirasawa S., and Sasazuki T., 2004. Polycomb group Suppressor of zeste 12 links Heterochromatin Protein la and Enhancer of zeste 2. J. Biol. Chem. 279: 401-406. Yoshida N., Yanai Y., Chen L.J., Kato Y., Hiratsuka J., Miwa T., Sung Z.R., andTakahashi S., 2001. EMBRYONIC ELOWER2, a novel Polycomb group protein homolog, mediates shoot development and flowering in Arabidopsis. Plant Cell 13: 2471 -2481. ZencakD., Lingbeek M., Kostic C., Tekaya M., Tanger E., Homfeld D., Jaquet M., Munier F.L., Schorderet D.F., van Lohuizen M., and Arsenijevic Y., 2005. Bmi1 loss produces an increase in astroglial cells and a decrease in neural stem cell population and proliferation./. Neurosci. 25: 5774-5783.Глава 12. Регуляция транскрипции белками группы TRITHORAX
 Robert Е. Kingston1 и John W. Tamkun2
1 Department of Molecular Biology, Massachusetts General Hospital, Boston, Massachusetts 02114 department of Molecular Cell and Developmental Biology, University of California, Santa Cruz, California 95064
Robert Е. Kingston1 и John W. Tamkun2
1 Department of Molecular Biology, Massachusetts General Hospital, Boston, Massachusetts 02114 department of Molecular Cell and Developmental Biology, University of California, Santa Cruz, California 95064
Общее резюме
Все клетки в организме должны обладать способностью «помнить», клетками какого типа они должны быть. Для этого процесса, называемого «клеточная память», или «транскрипционная память», необходимы механизмы двух основных классов. Первый класс, обсуждавшийся в предыдущей главе, функционирует таким образом, чтобы поддерживать состояние «ВЫКЛЮЧЕНО» у тех генов, которые, будучи включены, определяли бы неправильныи клеточный тип. Белки группы Polycomb (PcG — Polycomb-Group) играют, в качестве своей основной функции, эту репрессивную роль в клеточной памяти. Ко второму классу относятся те механизмы, которые требуются для поддержания ключевых генов в состоянии «ВКЛЮЧЕНО». Любой клеточный тип требует экспрессии главных регуляторных белков, которые управляют специфическими функциями, необходимыми для данного клеточного типа. Гены, кодирующие эти главные регуляторные белки, должны поддерживаться в состоянии «ВКЛЮЧЕНО» на протяжении всей жизни организма, чтобы поддерживать соответствующие клеточные типы в этом организме. Удивительная многокрылая мушка, изображенная в левой части рисунка в начале этой главы, иллюстрирует эффектные фенотипы, которые могут получиться в результате неспособности поддерживать состояние «ВКЛЮЧЕНО» у главного регуляторного гена. Белки, участвующие в поддержании состояния «ВКЛЮЧЕНО», называются белками группы trithorax (trxG — trithorax-Group) в честь гена trithorax, члена-основателя этой группы регуляторных белков. Большая группа белков с различными функциями составляет группу trxG. Роли, которые эти белки играют в эпигенетических механизмах, поддерживающих состояние «ВКЛЮЧЕНО», оказываются на данный момент более сложными, чем роли белков PcG в репрессии. Первая сложность состоит в том, что очень большое число белков и механизмов нужно для того, чтобы активно транскрибировать РНК с любого гена. Таким образом, в противоположность репрессии, которая может быть выполнена сравнительно простыми механизмами, блокирующими доступ всех белков, активация гена требует многочисленных шагов, любой из которых может играть роль в поддержании состояния «ВКЛЮЧЕНО». Таким образом, имеются многочисленные возможные стадии, на которых мог бы работать белок trxG. Вторая сложность в представлениях о белках trxG заключается в том, что белки, функционирующие в активации, могут также, в других контекстах, функционировать в репрессии. Это могло бы показаться противоречащим интуиции, но, в зависимости от точной архитектуры гена, один и тот же белок, выполняющий свою функцию, мог бы в одном случае помогать гену становиться активированным, а в другом — помогать другому гену становиться репрессированным. В настоящее время представляется, что белки trxG не предназначены исключительно для поддержания экспрессии гена, но что эти белки могут также играть в клетке множество ролей. Эти сложности порождают несколько интересных вопросов, остающихся пока без ответа Почему лишь некоторые из этих белков, нужных для активации транскрипции, являются также критичными для поддержания транскрипции? Обладают ли эти белки функциями, уникально приспособленными для поддержания активного состояния? Или же некоторые из этих белков нужны для поддержания исключительно благодаря эволюционной случайности, сделавшей их ключевыми регуляторами гена (генов), имеющего особенно важное значение для развития? Как показано ниже, некоторые из белков trxG участвуют в регулировании структуры хроматина в противоположность механизмам, используемым белками PcG. Белки trxG могут размещать ковалентные модификации на хроматине или могут изменять хроматин, изменяя структуру и положение нуклеосом. являющихся строительными блоками хроматина. Другие белки trxG функционируют как часть транскрипционной машины. Таким образом, эти белки обнаруживаются в более широком ряду комплексов, чем белки PcG, и, вероятно, играют более сложные роли в эпигенетическом механизме.1. Введение
Многочисленные «решения» о ходе развития [developmental decisions] — включая детерминацию судьбы клеток — принимаются в ответ на временную позиционную информацию в раннем эмбрионе. Эти решения зависят от изменений в экспрессии генов. Это дает возможность клеткам с идентичными генетическими «синьками» приобретать уникальные идентичности и следовать разными путями дифферениировки. Эти изменения в экспрессии генов, лежащие в основе детерминации клеточных судеб, являются наследуемыми; судьба клетки редко изменяется, коль скоро она была детерминирована, даже после многочисленных клеточных делений и длительных периодов времени развития. Понимание молекулярных механизмов, лежащих в основе детерминированного состояния, с давних пор было целью биологов развития и молекулярных биологов. Многие из регуляторных белков, участвующих в поддержании наследуемых состояний экспрессии генов были идентифицированы в исследованиях гомеотических (НОХ) генов у Drosophila. Гены НОХ кодируют гомеодоменные транскрипционные факторы, которые регулируют транскрипцию батарей генов-мишеней, расположенных «вниз по течению» и, в свою очередь, специфицирующих идентичности сегментов тела (Gellon and McGinnis, 1998). У Drosophila гены НОХ обнаруживаются в двух комплексах генов: комплексе Antennapedia (Ant-C), который содержит НОХ-гены labial (lab), Deformed (Dfd), Sex combs reduced (Scr) и Antennapedia (Antp); и комплекс bithorax (BX-C), содержащий НОХ-гены Ultrabithorax (Ubx), abdominalA (abdA) и abdominalB (abdB) (Duncan, 1987; Kaufman et al., 1990). Каждый ген НОХ специфицирует идентичность конкретного сегмента или группы сегментов вдоль передне-задней оси развивающейся мухи. Например, Antp специфицирует идентичность второго торакального сегмента, включая вторую пару ног, тогда как Ubx специфицирует идентичность третьего торакального сегмента, включая жужжальца, расположенные позади крыльев. Таким образом, транскрипционные факторы, кодируемые генами НОХ. функционируют как главные регуляторные переключатели, определяющие выбор между альтернативными путями развития. Транскрипция генов НОХ должна регулироваться очень точно, потому что в результате их несоответствующей экспрессии могут возникать резкие изменения в клеточных судьбах (Simon, 1995; Simon and Tamkun, 2002). Например, дерепрессия Antp в головных сегментах превращает антенны в ноги, а инактивация Ubx в торакальных сегментах превращает жужжальца в крылья. У Drosophila начальные паттерны транскрипции НОХ устанавливаются на ранних стадиях эмбриогенеза транскрипционными факторами, кодируемыми генами сегментации. Белки, кодируемые генами сегментации, — включая гены группы gap, группы pair-rule и группы segment-polarity — подразделяют ранний зародыш на 14 идентичных сегментов. Эти белки устанавливают также начальные паттерны транскрипции НОХ, что является первым шагом на пути к развитию сегментов с разными идентичностями и мофологией. Будучи установлены, эти ограниченные сегментами паттерны транскрипции НОХ должны поддерживаться на протяжении последующих эмбриональной, личиночной стадий и стадии куколки для того, чтобы поддерживать идентичность индивидуальных сегментов тела. Поскольку большинство генов сегментации временно экспрессируются в раннем развитии, эта функция выполняется двумя другими группами регуляторных белков: репрессорами группы Polycomb (PcG) и транскрипционными регуляторами группы trithorax (trxG) (рис. 12.1). Регуляция транскрипции НОХ состоит, следовательно, из по крайней мере двух различных фаз: установления (генами сегментации) и поддержания (генами PcG и trxG) (рис. 12.2). Рис. 12.1. Концепция клеточной памяти
Схематическая иллюстрция, освещающая роль комплексов trxG в поддержании наследуемых состояний активной экспрессии генов в противоположность наследуемому сайленсингу, обусловленному комплексами PcG, как это первоначально было определено для кластера НОХ-генов у Drosophila
Рис. 12.1. Концепция клеточной памяти
Схематическая иллюстрция, освещающая роль комплексов trxG в поддержании наследуемых состояний активной экспрессии генов в противоположность наследуемому сайленсингу, обусловленному комплексами PcG, как это первоначально было определено для кластера НОХ-генов у Drosophila
1.1. Идентификация генов, участвующих в поддержании детерминированного состояния
Благодаря своей роли в поддержании клеточных судеб гены PcG и trxG на целые десятилетия стали объектом интенсивных исследований. Как обсуждается в предыдущей главе, большинство генов PcG были идентифицированы по мутациям, вызывающим гомеотические трансформации в силу неспособности поддерживать репрессированные состояния транскрипции НОХ. Классическим примером фенотипа, ассоциированного с мутациями PcG, является трансформация второй и третьей пары ног в ноги первой пары. Эта гомеотическая трансформация является результатом дерепрессии гена группы ANT-C, Scr, и проявляется как появление на второй и третьей парах ног щетинок, характерных для первой пары ног и известных как зубцы половых гребешков. Этот фенотип «Polycomb», или «избыточные половые гребешки» — вместе с другими гомеотическими трансформациями, являющимися результатом неспособности поддерживать репрессию генов НОХ, — привел к идентификации более чем дюжины генов PcG у Drosophila. Большинство генов PcG кодируют субъединицы двух комплексов, участвующих в репрессии транскрипции: Polycomb Repressive Complex (PRC) 1 и PRC2 (Levine et al., 2001). PRC1 и PRC2 «нацеливаются» на участки вблизи промоторов НОХ (и других) посредством cis-регуляторных элементов, известных как элементы ответа Polycomb (PREs — Polycomb-response elements). Большое число данных позволяет предполагать, что комплексы PcG репрессируют транскрипцию, модулируя структуру хроматина (Francis and Kingston, 2001; Ringrose and Paro, 2004). Члены группы trxG, в том числе trithorax (trx); absent, small или homeotic 1 (ash 1), absent, small или homeotic 2 (ash2) и female-sterile homeotic (fsh) изначально были идентифицированы по мутациям, имитирующим мутации НОХ типа «потери функции» у Drosophila (рис. 12.3) (Kennison, 1995). Например, мутации в trx — члене-основателе группы trxG — вызывают частичную трансформацию гальтеров в крылья (благодаря уменьшенной транскрипции Ubx); первой пары ног во вторую пару (благодаря сниженной транскрипции Sc г); и задних абдоминальных сегментов в более передние образования (благодаря сниженной транскрипции abdA и AbdB). Многочисленные другие члены trxG были идентифицированы в ходе скрининга на экстрагенные супрессоры мутаций Рс(Su(Pc)) (Kennison and Tamkun, 1988). Идея этих генетических скринингов заключалась в том, что снижение уровня белка, поддерживающего активное состояние, должно компенсировать снижение уровня репрессора PcG (рис. 12.4). Локус brahma (brm) и многочисленные другие локусы Su(Pc) были идентифицированы с помощью этого подхода, что довело общее число членов trxG до более чем 16 (табл. 12.1). Многие другие белки были классифицированы как члены trxG на основе других, менее строгих критериев, в том числе гомологии по последовательности с известными белками trxG, физической ассоциации с белками trxG, биохимической активности или влияния на транскрипцию НОХ in vitro или in vivo. Рис. 12.2. Регуляция транскрипции НОХ
Границы транскрипции abd-A и других генов НОХ устанавливаются белками сегментации. В число этих белков входят продукты генов gap и pair-rule, подразделяющие эмбрион на 14 идентичных сегментов. В ходе последующего развития состояния «ВЫКЛЮЧЕНО» и «ВКЛЮЧЕНО» транскрипции НОХ поддерживаются повсеместно экспрессированными членами группы активаторов trxG и репрессоров PcG посредством механизмов, которые остаются мало понятными
Рис. 12.2. Регуляция транскрипции НОХ
Границы транскрипции abd-A и других генов НОХ устанавливаются белками сегментации. В число этих белков входят продукты генов gap и pair-rule, подразделяющие эмбрион на 14 идентичных сегментов. В ходе последующего развития состояния «ВЫКЛЮЧЕНО» и «ВКЛЮЧЕНО» транскрипции НОХ поддерживаются повсеместно экспрессированными членами группы активаторов trxG и репрессоров PcG посредством механизмов, которые остаются мало понятными
Функциональные взаимоотношения между членами trxG и механистическая связь между функцией trxG и поддержанием клеточной судьбы являются сложными. Имеются многочисленные механизмы, посредством которых белок мог бы поддерживать соответствующий высокий уровень экспрессии гомеотического гена (генетическое определение белка trxG), не будучи специально предназначенным [devoted] активатором транскрипции, или белком, предназначенным для эпигенетического контроля. Формальные возможности для функции trxG (в дополнение к способности непосредственно активировать транскрипцию) включают способность усиливать функцию прямых активаторов, способность блокировать функцию репрессоров PcG и способность создавать «пермиссивное» состояние хроматина, облегчающее функционирование других многочисленных регуляторных комплексов. Более того, как обсуждается ниже, некоторые белки trxG играют сложную механистическую роль, которая на одних генах вносит вклад в активацию, а на других генах может вносить вклад в репрессию. Два коротких примера иллюстрируют сложность потенциальных ролей в отношении белков trxG. Было высказано предположение, что комплексы АТФ-зависимого ремоделинга, такие как комплекс, содержащий белки trxG BRM и MOR, увеличивают способность любого сиквенс-специфичного, связывающегося с ДНК белка связываться с хроматином. Нерешенной проблемой является вопрос о том, может ли этот АТФ-зависимый комплекс ремоделинга использовать эту способность стимулировать и активацию генов посредством увеличенного связывания активаторов, и репрессию посредством увеличенного связывания репрессоров. Другие исследования привели к гипотезе о том, что некоторые комплексы белков trxG могли бы функционировать главным образом путем блокирования способности PcG-репрессорного комплекса функционировать, и что репрессия белками PcG является состоянием «по умолчанию». Таким образом, в этом последнем случае роль в поддержании активного состояния некоторыми белками trxG могла бы отражать косвенные, в противоположность прямым, действия. Эволюционный консерватизм этого семейства и консервативные функции этого семейства наводят на мысль: механизмы какого типа нужны для поддержания соответствующего уровня активации главных регуляторных генов, определяющих клеточную судьбу.
1.2. Белки trxG у других организмов
Функциональные аналоги по существу всех белков trxG Drosophila имеются у млекопитающих, в том числе у человека (табл. 12.1). Генетические и биохимические исследования показали, что белки мух и млекопитающих играют весьма консервативную роль и в экспрессии генов, и в развитии. Хорошим примером функционального консерватизма белков trxG является MLL, ортолог trx Drosophila у млекопитающих. Мутации в MLL вызывают гомеотические трансформации аксиального скелета мышей благодаря неспособности поддерживать активную транскрипцию генов НОХ (Yu et al., 1995,1998). Функционирование как MLL, так и trx в качестве метилтрансфераз лизинов в гистонах (HKMTs) и прямое доказательство функциональной гомологии между этими двумя белками было получено при использовании MLL человека для частичного «спасения» дефектов развития, возникающих в результате утраты функции trx у мух (Muyrers-Chen et al., 2004). Таким образом, механизмы, лежащие в основе поддержания детерминированного состояния, были высококонсервативными в ходе эволюции. Рис. 12.3. Примеры трансформаций клеточной судьбы в развитии, связанных с мутациями в генах trxG y Drosophila
(А) Нога первой пары, дикий тип. Половой гребешок, уникальный для первой пары ног, помечен стрелкой. (Б) Участок мутантной по kis ткани (маркирован стрелкой) частично трансформирован от ног первой пары в ноги второй пары благодаря сниженной транскрипции Scr, хотя и недостаточной, на что указывает уменьшение числа зубцов полового гребешка. (В) Участок мутантной по тог ткани (маркирован стрелкой) обнаруживает частичную трансформацию из жужжальца в крыло благодаря сниженной экспрессии Ubx. (Г) Участок мутантной по kis ткани (маркирован стрелкой) в пятом абдоминальном сегменте частично трансформирован к более передней идентичности благодаря сниженной экспрессии Abd В, на что указывает утрата темной пигментации, характерной для этого сегмента. (А, Б, Г — перепечатано, с любезного разрешения, из Daubesse et al., 1999)
Рис. 12.3. Примеры трансформаций клеточной судьбы в развитии, связанных с мутациями в генах trxG y Drosophila
(А) Нога первой пары, дикий тип. Половой гребешок, уникальный для первой пары ног, помечен стрелкой. (Б) Участок мутантной по kis ткани (маркирован стрелкой) частично трансформирован от ног первой пары в ноги второй пары благодаря сниженной транскрипции Scr, хотя и недостаточной, на что указывает уменьшение числа зубцов полового гребешка. (В) Участок мутантной по тог ткани (маркирован стрелкой) обнаруживает частичную трансформацию из жужжальца в крыло благодаря сниженной экспрессии Ubx. (Г) Участок мутантной по kis ткани (маркирован стрелкой) в пятом абдоминальном сегменте частично трансформирован к более передней идентичности благодаря сниженной экспрессии Abd В, на что указывает утрата темной пигментации, характерной для этого сегмента. (А, Б, Г — перепечатано, с любезного разрешения, из Daubesse et al., 1999)
 Рис. 12.4. Мутации trxG блокируют дерепрессию генов Нох у мутантов PcG
(а) Ножные имагинальные диски, окрашенные антителами против белка, кодируемого геном Нох, Scr, который специфицирует идентичность лабиального и первого торакального сегментов, в том числе первой пары ног. (б) Базитарзальные сегменты ног взрослых особей дикого типа и мутантных. Обратите внимание на присутствие зубцов полового гребешка на ноге первой, но не второй и третей пары у взрослых особей дикого типа. Ген Scr частично дерепрессирован во вторых и третьих ножных дисках, где в норме он «молчит», у особей, гетерозиготных по мутациям в генах PcG, что приводит к появлению эктопических зубцов полового гребешка на ногах второй и третьей пары. Эти фенотипы супрессируются мутациями в brm и многих других генах trxG (а — перепечатано, с любезного разрешения, из Tamkun et al., 1992 [©Elsevier]; б — часть с изменениями, с любезного разрешения, из Kennison, 2003 [©Elsevier].)
Рис. 12.4. Мутации trxG блокируют дерепрессию генов Нох у мутантов PcG
(а) Ножные имагинальные диски, окрашенные антителами против белка, кодируемого геном Нох, Scr, который специфицирует идентичность лабиального и первого торакального сегментов, в том числе первой пары ног. (б) Базитарзальные сегменты ног взрослых особей дикого типа и мутантных. Обратите внимание на присутствие зубцов полового гребешка на ноге первой, но не второй и третей пары у взрослых особей дикого типа. Ген Scr частично дерепрессирован во вторых и третьих ножных дисках, где в норме он «молчит», у особей, гетерозиготных по мутациям в генах PcG, что приводит к появлению эктопических зубцов полового гребешка на ногах второй и третьей пары. Эти фенотипы супрессируются мутациями в brm и многих других генах trxG (а — перепечатано, с любезного разрешения, из Tamkun et al., 1992 [©Elsevier]; б — часть с изменениями, с любезного разрешения, из Kennison, 2003 [©Elsevier].)
Таблица 12.1. Биохимические функции белков trxG
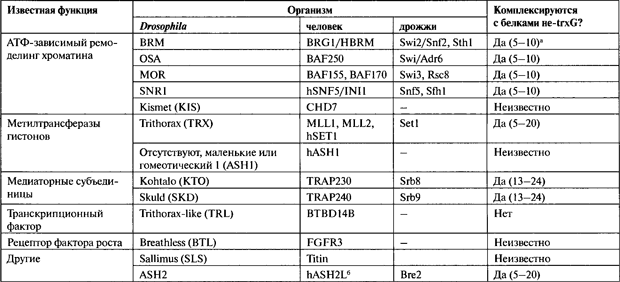 Рак и другие заболевания человека могут быть результатом неспособности поддерживать наследуемое состояние экспрессии генов. Неудивительно, что многие гены PcG и trxG у человека функционируют как протоонкогены или гены-супрессоры опухолей. Например, ген MLL из группы trxG у человека первоначально был идентифицирован по хромосомным транслокациям 1 lq23, ассоциированным с острой лимфобластозной (ALL) или миелоидной (AML) лейкемией. Мутации в других генах trxG млекопитающих также ассоциируются с различными раковыми заболеваниями (дополнительные детали см. в главе 23). Например, BRG1, аналог гена brm Drosophila у человека, физически взаимодействует с белком-супрессором опухоли ретинобластомы; нарушение этого взаимодействия приводит к ускоренному клеточному делению и злокачественной трансформации в некоторых линиях опухолевых клеток человека (Dunaief et al, 1994; Strober et al., 1996). В согласии с ролью BRG1 в супрессии опухоли мыши, гетерозиготные по мутациям в этом гене, склонны к образованию разнообразных опухолей (Bultman et al., 2000). Мутации в INI 1, человеческом аналоге гена группы trxG SNF5-related gene 1 (SNR1) у Drosophila, также делают их носителей предрасположенными к раку и были идентифицированы в большом проценте злокачественных рабдоидных опухолей (агрессивный рак у детей) (Versteege et al., 1998). Эти и другие связи с заболеваниями у человека дали исследователям дополнительную мотивацию к пониманию механизма действия белков trxG.
Рак и другие заболевания человека могут быть результатом неспособности поддерживать наследуемое состояние экспрессии генов. Неудивительно, что многие гены PcG и trxG у человека функционируют как протоонкогены или гены-супрессоры опухолей. Например, ген MLL из группы trxG у человека первоначально был идентифицирован по хромосомным транслокациям 1 lq23, ассоциированным с острой лимфобластозной (ALL) или миелоидной (AML) лейкемией. Мутации в других генах trxG млекопитающих также ассоциируются с различными раковыми заболеваниями (дополнительные детали см. в главе 23). Например, BRG1, аналог гена brm Drosophila у человека, физически взаимодействует с белком-супрессором опухоли ретинобластомы; нарушение этого взаимодействия приводит к ускоренному клеточному делению и злокачественной трансформации в некоторых линиях опухолевых клеток человека (Dunaief et al, 1994; Strober et al., 1996). В согласии с ролью BRG1 в супрессии опухоли мыши, гетерозиготные по мутациям в этом гене, склонны к образованию разнообразных опухолей (Bultman et al., 2000). Мутации в INI 1, человеческом аналоге гена группы trxG SNF5-related gene 1 (SNR1) у Drosophila, также делают их носителей предрасположенными к раку и были идентифицированы в большом проценте злокачественных рабдоидных опухолей (агрессивный рак у детей) (Versteege et al., 1998). Эти и другие связи с заболеваниями у человека дали исследователям дополнительную мотивацию к пониманию механизма действия белков trxG.
1.3. Белки trxG играют разные роли в эукариотической транскрипции
Группа активаторов trxG — это большая и функционально разнообразная группа регуляторных белков. Это может отражать сложность эукариотической транскрипции, включающей высокорегулируемые взаимодействия между геноспецифичными активаторами транскрипции, многочисленными компонентами общей транскрипционной машины и транскрибируемой матрицей ДНК Активация транскрипции включает связывание сиквенс-специфичных активирующих белков, рекрутирование этими белками общей транскрипционной машины, формирование преинициационного комплекса, в котором РНК-полимераза II связывается с промотором, раскрытие спирали ДНК возле этого промотора, эффективный уход РНК-полимеразы от промотора и эффективную элонгацию РНК-полимеразы через данный ген. Способность поддерживать состояние активной транскрипции могло бы включать любой из многочисленных этапов, необходимых для активации, поскольку на любом данном гене разные этапы могли бы играть роль, определяющую скорость процесса для транскрипционной активности. Упаковка эукариотической ДНК в хроматин представляет еще один уровень, на котором белки trxG могут регулировать транскрипцию Нуклеосомы и другие компоненты хроматина обнаруживают тенденцию к подавлению связывания общих и ген-специфичных транскрипционных факторов с ДНК, а также к подавлению элонгации РНК-полимеразы. Изменения в структуре хроматина — в том числе изменения в структуре и позиционировании нуклеосом — могут влиять практически на каждый этап в процессе транскрипции. Любой белок, необходимый для транскрипции, требуется для поддержания активного состояния. Действительно, некоторые белки trxG могут играть сравнительно общие роли в транскрипции, а не быть предназначенными исключительно для поддержания детерминированного состояния. Однако другие белки trxG могут играть специализированные роли в этом процессе, либо непосредственно противодействуя репрессии, осуществляемой PcG, либо поддерживая наследуемые состояния активности генов в ходе репликации ДНК и митоза. Этот последний класс белков trxG представляет особый интерес для биологии развития.2. Связи между белками trxG и хроматином
Генетические исследования, показывающие, что гены trxG играют ключевые роли в транскрипции и развитии, стимулировали значительные усилия, направленные на понимание биохимической функции их продуктов. Многие из этих экспериментов использовали в качестве своей концептуальной базы гипотезу, согласно которой хроматин является биологически релевантным субстратом для белков trxG. Все гены упакованы в хроматин, и эта упаковка может создать компактное и недоступное состояние или же может находиться в открытом и пермиссивном состоянии. И пермиссивное, и недоступное состояния, по-видимому, могут быть наследуемыми. Эти соображения привели к простой гипотезе, согласно которой белки trxG могли бы модулировать структуру хроматина и влиять на регуляцию. Более того, поскольку гены trxG были клонированы и секвенированы, стало очевидным, что некоторые из их продуктов родственны белкам, участвующим в АТФ-зависимом ремоделинге хроматина или ковалентной модификации нуклеосомных гистонов у других организмов, в том числе у дрожжей Saccharomyces cerevisiae. Таким образом, хотя у дрожжей отсутствуют гены НОХ или репрессоры PcG, этот организм дал ценные сведения о потенциальной роли белков trxG в эукариотической транскрипции. Одна из первых связей между trxG и хроматином вытекала из открытия, показавшего, что trxG-ген brm у Drosophila является близкородственным SWI2/SNF2 дрожжей (Tamkun et al., 1992). SWI2/SNF2 был идентифицирован в ходе скрининга на гены, участвующие в переключении типа спаривания (гены switch [xw/]) и сбраживании сахарозы (гены sucrose-nonfermenting [snf]). Впоследствии было показано, что SWI2/SNF2 необходим для активации многочисленных индуцибельных генов дрожжей (Holstegeetal., 1998; Sudarsanametal., 2000). Дефекты транскрипции, наблюдаемые у мутантов swi2/ snf2, супрессируются мутациями в нуклеосомных гистонах; это раннее наблюдение впервые позволило предположить, что SWI2/SNF2 активирует транскрипцию путем противодействия репрессии хроматина (Kruger et al., 1995). Биохимические исследования, проведенные в начале 1990-х годов, подтвердили эту гипотезу; SWI2/ SNF2 и многие другие белки, идентифицированные в ходе скрининга на swi2/snf2, функционируют как субъединицы большого белкового комплекса (SWI/SNF), использующего энергию гидролиза АТФ для увеличения способности белков связываться с нуклеосомной ДНК (Cote et al., 1994; Imbalzano et al., 1994; Kwon et al., 1994). SWI2/SNF2 функционирует как субъединица АТФазы, или «двигатель», этой машины ремоделинга хроматина; другие субъединицы комплекса SWI/SNF опосредуют взаимодействия с регуляторными белками или с его хроматиновым субстратом (Phelan et al., 1999). На еще одну связь между trxG и хроматином указывало наличие доменов SET в белках Trithorax (TRX) и Absent (малый, или гомеотический — ASH1) группы trxG. Домен SET был первоначально определен по отрезку аминокислотной последовательности, обнаруживающему гомологию между Su(var)3-9, Enhancer of zeste (E(z)) и TRX; последние два белка являются членами PcG и trxG, соответственно. В конце 1990-х годов было показано, что белки семейства SET обладают активностью НКМТ. Su(var)3-9 метилирует H3K9, тогда как (E(z)) метилирует H3K27 (Rea et al., 2000; Levine et al., 2004; Ringrose and paro, 2004) Как обсуждается в других главах, метилирование H3K9 стимулирует сборку гетерохроматина, тогда как метилирование H3K27 оказывается необходимым для PcG-репрессии (более детальное обсуждение см. в главах 5 и 11, соответственно). Присутствие доменов SET в белках trxG позволило предположить, что метилирование «хвостов» гистонов могло бы иметь важное значение для поддержания активных транскрипционных состояний. Эти открытия, вместе с растущим пониманием, что ферменты ремоделинга и модификации хроматина играют ключевую роль в активации транскрипции, побудили биохимиков идентифицировать белковые комплексы, содержащие белки trxG, и изучить влияние этих комплексов на структуру хроматина in vitro. Другие эксперименты имели своей целью проверку гипотезы о том, что белки trxG могли бы взаимодействовать непосредственно с транскрипционной машиной (еще один хорошо установленный способ влиять на регуляцию) Как описано ниже, эти исследования показали, что некоторые белки trxG влияют на регуляцию посредством модификации структуры хроматина, тогда как другие функционируют путем прямых взаимодействий с компонентами транскрипционной машины.2.1. Белки trxG, участвующие в АТФ-зависимом ремоделировании хроматина
Участие комплексов ремоделинга хроматина предполагалось в самых разных биологических процессах, в том числе в репрессии и активации транскрипции, сборке хроматина, регуляции структуры хроматина более высокого порядка и в клеточной дифференцировке. Наиболее всесторонне изученными белками trxG, участвующими в ремоделинге хроматина, являются BRM и его аналоги у человека, BRG1 и HBRM. Как и предсказывалось, эти белки функционируют как АТФазные субъединицы комплексов, очень близко родственных SWI/SNF дрожжей (Kwon et al., 1994; Wang et al., 1996). Комплексы SWI/SNF сотержат от 8 до 15 субъединиц и были очень консервативны в ходе эволюции (рис. 12.5). АТФаза каждого из этих комплексов способна функционировать как отдельная субъединица. Хотя на это семейство белков исторически ссылались как на содержащее «геликазный» мотив (в силу сходства их АТФазного домена с доменом истинных геликаз), никогда не было показано, что эти белки, родственные BRM, обладают геликазной активностью; скорее, для влияния на изменения в структуре хроматина они используют другие механизмы, такие как транслокацию вдоль ДНК (Whitehouse et al., 2003; Saha et al., 2005). Второй trxG-ген, идентифицированный при этом скрининге, moira (тог), кодирует еще один ключевой член этого АТФ-зависимого ремоделирующего комплекса у Drosophila, а гомологи BRM и MOR взаимодействуют непосредственно и формируют функциональный кор SWI/ SNF у человека (Phelan et al., 1999). SWI/SNF и другие комплексы ремоделинга хроматина используют энергию гидролиза АТФ для изменения структуры или позиционирования нуклеосом. Катализируя АТФ-зависимые изменения в структуре хроматина, комплексы ремоделинга хроматина помогают транскрипционным факторам и другим регуляторным белкам получить доступ к нуклеотидным последовательностям ДНК, которые в норме были бы закрыты гистоновыми белками (Polach and Widom, 1995; Logie and Peterson, 1997). Среди моделей создания доступа к специфическим сайтам — «скольжение» гистонов по ДНК для перемещения сайта в линкерный участок, выпетливание ДНК из гистонового октамера или же (самый крайний вариант!) выселение всего гистонового октамера в другое место в ядре (рис. 12.6). АТФ-зависимый ремоделинг может также приводить к изменениям в положении нуклеосом вдоль нуклеотидной последовательности ДНК, к изменениям в спейсинге нуклеосом и к перемещениям гистонов в гистоновый октамер (являющийся кором нуклеосомы) и из него. Другие ремоделирующие комплексы обнаруживают разную склонность к выполнению каждой из этих функций. Puc. 12.5. Семейство ремоделирующих комплексов SWI/SNF
Каждый комплекс содержит член SNF2/SWI2-семейства АТФаз и по крайней мере восемь других субъединиц, (а) Схематическое изображение белка BRM, показывающее расположение АТФазного домена и карбокситерминального бромодомена (обнаруживающего сродство к ацетилированным остаткам лизина в гистоновых «хвостах»), которые консервативны у всех членов семейства SNF2/SWI2. Показаны цветом комплексы SWI/SNF у дрожжей (б), Drosophila (в) и человека (г). Дальнейшую информацию об этих комплексах и их субъединицах можно найти в Mohrmann and Verrijzer. 2005
Puc. 12.5. Семейство ремоделирующих комплексов SWI/SNF
Каждый комплекс содержит член SNF2/SWI2-семейства АТФаз и по крайней мере восемь других субъединиц, (а) Схематическое изображение белка BRM, показывающее расположение АТФазного домена и карбокситерминального бромодомена (обнаруживающего сродство к ацетилированным остаткам лизина в гистоновых «хвостах»), которые консервативны у всех членов семейства SNF2/SWI2. Показаны цветом комплексы SWI/SNF у дрожжей (б), Drosophila (в) и человека (г). Дальнейшую информацию об этих комплексах и их субъединицах можно найти в Mohrmann and Verrijzer. 2005
 б Обмен гистонов
б Обмен гистонов
Рис. 12.6. Механизмы АТФ-зависимого ремоделинга Модели ремоделирования хроматина иллюстрируются показом изменения в положении или составе нуклеосом относительно ДНК, обернутой вокруг них. Центральная часть рисунка показывает стартовый район хроматина, где линкерная ДНК изображена желтым цветом, а нуклеосомная ДНК — красным, (а) Движение нуклеосомы трансляционно вдоль ДНК (скольжение) для открытия участка (отмеченного красным цветом), который ранее был закрыт; (б) обмен стандартного гистона на вариантный гистон для создания вариантной нуклеосомы; (в) вытеснение нуклеосом для открытия большого района ДНК. Этот механизм мог бы зависеть от других белков, таких как гистоновые шапероны или факторы, связывающиеся с ДНК, в дополнение к белкам ремоделлинга; (г) создание петли на поверхности нуклеосомы. Гипотетически предполагается, что ремоделеры семейства SWI/ SNF используют альтернативные механизмы, такие как создание стабильных петель ДНК на поверхности нуклеосомы, чтобы сделать доступными сайты, являющиеся центральными для этой нуклеосомы
У высших эукариот комплексы SWI/SNF весьма многочисленны; например, каждое ядро млекопитающих содержит около 25 ООО копий комплексов семейства SWI/SNF. Биохимические анализы показывают, что комплексы SWI/SNF способны открывать доступ к необычно широкому спектру сайтов в нуклеосоме по сравнению с другими АТФ-зависимыми комплексами ремоделинга хроматина (Fan et al., 2003). Например, комплексы SWI/SNF способны эффективно обеспечивать доступ к сайтам в центре мононуклеосомы, что в энергетическом отношении затруднительно, поскольку сайты в центре нуклеосомы имеют приблизительно 70 пар оснований ограниченной [constrained] нуклеосомной ДНК с каждой стороны. Вызывается ли это необычно мощной способностью использовать энергию гидролиза АТФ по сравнению с другими ремоделерами или же, вместо этого, представляет другой механизм ремоделинга, является темой текущих исследований (Kassabov et al., 2003). Комплексы SWI/SNF не обнаруживают сколько-нибудь измеримой способности равномерно распределять [to space] нуклеосомы, что является отличительным признаком других комплексов ремоделинга хроматина. Они также не обнаруживают такой же степени эффективности в «свопинге» [swapping — обмен одних элементов на другие] димеров Н2А/ Н2В, как некоторые другие комплексы ремоделинга хроматина, хотя при тестировании in vitro они способны осуществлять это и перемещать октамеры (Lorch et al., 1999). Какая из этихспособностей имеет отношение к функции этих комплексов в поддержании активного состояния, еще не ясно. У каждого исследованного вида предполагалось участие комплексов SWI/SNF в транскрипционной активации. Это семейство комплексов может быть «нацелено» на гены взаимодействиями с транскрипционными активаторами, может ремоделировать нуклеосомы, помогая в первоначальном связывании общих транскрипционных факторов и РНК-полимеразы II, и может становиться «нацеленным» на более поздних стадиях процесса активации, способствуя транскрипционной элонгации. Таким образом, комплексы SW1/SNF, по-видимому, функционируют на каждом этапе процесса транскрипционной активации, хотя, по-видимому, имеет место акцент на функцию, осуществляемую на ранних этапах, ведущих к загрузке РНК-полимеразы II. Анализ с использованием микрочипов (microarray analysis) у дрожжей показывает, что помимо этих влияний, стимулирующих активацию, комплексы SWI/SNF могут также облегчать репрессию некоторых генов (Sudarsanam et al., 2000). Одна простая гипотеза, объясняющая эти широкие функции in vivo, заключается в том, что эти ремоделирующие комплексы изменяют структуру нуклеосом таким образом, что облегчается связывание и функционирование широкого спектра разных регуляторных факторов и комплексов. Таким образом, эффективные [potent] характеристики ремоделинга, наблюдаемые in vitro, могли бы отражать способность существенно расширять доступ к регуляторным факторам in vivo. Возможно, что комплексы SWI/SNF обладают уникальной способностью создавать широкий доступ, которая может объяснять их важное значение в поддержании активного состояния. Каждый изученный вид обладает по крайней мере двумя разными комплексами SWI/SNF, которые оба содержат BRM или близкородственную АТФазу ремоделинга хроматина. Еще один белок trxG, OSA, обеспечивает различие между этими комплексами в том отношении, что один класс комплексов содержит OS А, а еще один эволюционно консервативный комплекс содержит белок с полибромодоменом (рис. 12.6) (Mohrmann and Verrijzer, 2005). Биохимическая функция OSA не ясна. Одна привлекательная возможность заключается в том, что он мог бы «нацеливать» комплекс SWI/SNF, в котором он находится, на специфическую группу генов. SWI/SNF — не единственный фактор ремоделинга хроматина, имеющийся в эукариотических клетках. Идентифицированы десятки различных комплексов реиоделинга хроматина, в том числе NURF, NURD, ACF и CHRAC (Vignali et al., 2000). Эти комплексы можно подразделить на несколько основных групп на основе идентичностей их АТФазных субъединиц. Комплексы SWI/SNF содержат АТФазы, родственные SWI2/SNF2; комплексы ISWI (например, NURF, CHRAC и ACF) содержат АТФазы, родственные Imitation-SWI (ISWI); наконец, комплексы CHD (например, NURD) содержат АТФазы, родственные CHD1 и Mi2. Недавние исследования позволили предположить участие имеющегося у Drosophila kismet (kis) — члена семейства CHD факторов ремоделинга хроматина — в поддержании активного состояния. Подобно brm, mor и osa, kis был идентифицирован в ходе скрининга на экстрагенные супрессоры Рс; это позволяло предполагать, что он действует антагонистически по отношению к белкам PcG и поддерживает активные состояния НОХ-транскрипции (Kennison and Tamkun, 1988). Генетические исследования показали, что kis необходим как для сегментации, так и для поддержания HOX-транскрипции в ходе развития Drosophila (Daubresse et al., 1999; Therrien et al., 2000). Консервативные домены вне АТФазного домена (в том числе бромодомены и хромодомены) вносят свой вклад в функциональную специфичность ремоделирующих хроматин факторов, опосредуя взаимодействия с нуклеосомами или другими белками. BRM и другие АТФазные субъединицы комплексов SW1/SNF содержат единственный бромодомен (белковый мотив, ассоциированный со связыванием определенных ацетилированных гистонов), тогда как KIS-L содержит два хромодомена (белковых мотива, связывающихся с определенными метилированными гистонами) и является, следовательно, более похожим на Mi2 и другие ремоделирующие хроматин факторы, члены семейства CDH. Хотя большие размеры KIS-L (~575 кДа) затруднили биохимический анализ этого белка, его последовательность убедительно свидетельствует о том, что он активирует транскрипцию, ремоделируя хроматин KIS-L не ассоциирован физически с BRM и хроматографически ведет себя так, как будто бы он находится в другом белковом комплексе (Srinivasan et al., 2005). Однако эти два белка существенно перекрываются друг с другом и с РНК-полимеразой II на политенных хромосомах, что позволяет предполагать, что оба они играют относительно глобальные роли в транскрипции (рис. 12.7) (Armstrong et al., 2002; Srinivasan et al., 2005). Утрата функции BRM блокирует относительно ранний этап в транскрипции (Armstrong et al., 2002), тогда как утрата функции KIS-L ведет к снижению уровня элонгации, но не инициации форм РНК-полимеразы II (Srinivasan et al., 2005). Эти открытия заставляют предполагать, что BRM и KIS-L облегчают различные этапы в транскрипции с помощью РНК-полимеразы II, катализируя АТФ-зависимые изменения в структуре или спейсинге нуклеосом.
 Рис. 12.7. Распределение белков trxG в хромосомах
Распределение белков trxG по всему геному изучали с помощью окрашивания политенных хромосом слюнных желез Drosophila антителами против BRM (а) или TRX (б). В соответствии с относительно глобальной ролью BRM в активации транскрипции он связан с сотнями сайтов паттерн которых существенно перекрывается с RNA pol II. Напротив, сильные сигналы TRX выявляются в значительно меньшем числе сайтов политенных хромосом
Рис. 12.7. Распределение белков trxG в хромосомах
Распределение белков trxG по всему геному изучали с помощью окрашивания политенных хромосом слюнных желез Drosophila антителами против BRM (а) или TRX (б). В соответствии с относительно глобальной ролью BRM в активации транскрипции он связан с сотнями сайтов паттерн которых существенно перекрывается с RNA pol II. Напротив, сильные сигналы TRX выявляются в значительно меньшем числе сайтов политенных хромосом
Важный вопрос для будущих исследований касается роли, которую АТФ-зависимый ремоделинг играет в поддержании активированного состояния. Весьма интригует тот факт, что четыре члена trxG известны (BRM, KIS и OSA) или подозреваются (KIS) как члены больших АТФ-зависимых ремоделирующих хроматин комплексов, но ни один из других многочисленных АТФ-зависимых ремоделирующих комплексов не был идентифицирован в ходе генетических скринингов на trxG-белки Drosophila. Две преобладающих гипотезы (не являющиеся взаимоисключающими), предложенные для объяснения этого, заключаются в том, что ремоделирующие хроматин комплексы BRM и KIS «нацелены» на гены, важные для прогрессии развития, или что они обладают специальными характеристиками ремоделинга, которые являются уникально необходимыми для поддержания. Таким образом, возможно, что родовой [generic] АТФ-зависимый ремоделинг требуется для всех активных состояний и что для поддержания активного состояния важных для развития генов оказываются необходимыми эти члены trxG, поскольку они «нацелены» на эти гены. Возможно также, что поддержание требует специальных АТФ-зависимых функций, которые могут быть выполнены комплексами, содержащими члены trxG. Заманчиво также думать о механизмах, которые могут использоваться ремоделерами для того, чтобы внести вклад в эпигенетическую регуляцию активного состояния. Можно представить себе три класса механизмов, к которым это могло бы относиться. Во-первых, функция ремоделинга могла бы потребоваться в каком-то косвенном режиме для облегчения связывания (или повторного связывания после репликации) генспецифичных активирующих белков, которые нужны для поддержания активной транскрипции. В этом случае ремоделеры не были бы «мозгами» эпигенетического механизма, но, вместо этого, действовали бы как инструмент, необходимый для эффективного функционирования требуемых белков. Во-вторых, ремоделеры могли бы работать одни или с гистоновыми шаперонами для вытеснения нуклеосом из данного района, и эта незанятость нуклеосомами гипотетически заставляла бы этот район оставаться ненуклеосомным после репликации. Как упоминалось выше, способность машины репликации/смещения нуклеосом точно рекапитулировать модификации или локализацию нуклеосом является важным вопросом эпигенетики, на который пока нет ответа. Наконец, механизмы ремоделинга могли бы повторно позиционировать нуклеосомы и создавать структуру, поддающуюся активации. Этот последний механизм получил экспериментальную поддержку в исследованиях гена альбумина (Chaya et al., 2001; Cirillo et al., 2002). Несколько связывающихся с ДНК факторов необходимы для поддержания активности этого ключевого гена в печени. Один из этих факторов, FoxA, связывается с сайтом на нуклеосоме, и эта специфическая конструкция «нуклеосома-FoxA» является ключевой для поддержания активного состояния гена альбумина. Хотя неясно, имеется ли необходимая роль для АТФ-зависимого ремоделинга, чтобы позиционировать эту специфическую нуклеосому в печени, этот пример показывает, что специфическое позиционирование нуклеосом обладает достаточным потенциалом, чтобы играть ключевую эпигенетическую роль [whether there is a required role for ATP-dependent remodeling to position this specific nucleosome in the liver, this example demonstrates the potential for specific nucleosome positioning to play a key epigenetic role].
2.2. Белки trxG, ковалентно модифицирующие нуклеосомные гистоны
Второй распространенный способ регулирования экспрессии генов включает ковалентную модификацию аминотерминальных «хвостов» коровых гистонов, составляющих белковый компонент нуклеосомы. Эти «хвосты», выступающие с поверхности нуклеосомы, могут опосредовать взаимодействия с другими нуклеосомами, а также с весьма разнообразными структурными и регуляторными белками. Ковалентная модификация гистоновых «хвостов» с помощью ацетилирования, метилирования или фосфорилирования может помогать «нацеливать» регуляторные комплексы на хроматин и может также непосредственно изменять способность нуклеосом компактизироваться в репрессивные структуры путем изменения заряда на этих «хвостах». Ковалентная модификация могла бы также обеспечивать метку, чтобы способствовать поддержанию специфического регулируемого состояния (поскольку ковалентно модифицированные гистоны обладают возможностью разделяться на две дочерние нити и тем самым воспроизводят информацию, содержащуюся в ковалентной метке) и передавать ее как материнской, так и дочерним клеткам после репликации. Остаются ли гистоны связанными с одной или с обеими дочерними нитями после репликации — это ключевой вопрос для потенциальных механизмов эпигенетического регулирования; вопрос этот остается спорным, по большей части в связи с поиском методов, которые позволили бы точно прослеживать индивидуальные гистоны в живых клетках. Несколько белков trxG способны ковалентно модифицировать «хвосты» гистонов, и эти белки часто обнаруживаются в комплексах, способных осуществлять более чем один тип реакций модификации. Например, TRX Drosophila и его аналоги у других организмов метилируют гистон H3 по лизину 4 (H3K4): эта ковалентная метка прочно ассоциирована с активными генами у самых разных организмов, в том числе у дрожжей, мух и человека. Второй белок trxG, ASH1 (см. ниже), также обладает H3K4-метилтрансферазной активностью (Beisel et al., 2002; Byrd and Sheam, 2003). Подразумевалось, что H3K4-метилирование связано с поддержанием активной экспрессии генов у дрожжей, исходя из времени его появления и исчезновения на активных генах (Santos-Rosa et al., 2002; Pokholok et al., 2005). Тот факт, что члены trxG обладают этой модификационной (в отношении гистонов) активностью, еще больше связывает метку H3K4 с поддержанием активного состояния. У дрожжей и у человека аналоги TRX обнаруживаются в комплексе, который содержит также третий белок группы trxG, Ash2, по последовательности не родственный Ash1 Дрожжевой гомолог trithorax, Setl, обнаруживается в комплексе (COMPASS или Set 1C), который имеет величину приблизительно 400 кДа и содержит пять других белков кроме Setl и Ash2 (Miller et al., 2001; Roguev et al., 2001). Единственной известной биохимической активностью этого комплекса является метилирование H3K4; пока еще не ясно, какова могла бы быть функция каждого из других белков, хотя один компонент мог бы способствовать воспроизведению метальной метки (см. ниже). У человека имеются три гомолога TRX, называемые MLL1, MLL2 и hSETl. Белок MLL1 привлек наибольшее внимание в биохимических анализах и обнаруживается в большом комплексе (>10 членов), который содержит также человеческий гомолог ASH2 (Hughes et al., 2004; Yokoyama et al., 2004). Этот комплекс и дрожжевой комплекс оба содержат повторяющийся белок [repeat protein] WD40, который у человека называется WDR5 (Dou et al., 2005; Wysocka et al., 2005). Недавно было показано, что белок WDR5 может связываться с гистоном H3, который был метилирован по лизину 4 (Wysocka et al., 2005). Таким образом, связывание этого белка с меткой, созданной комплексом MLL1, в котором он находится, могло бы дать механизм для облегчения распространения этой метки. Это сходно с предположениями, сделанными относительно репрессивных комплексов, метилирующих H3K9, которые содержат НР1, белок, специфически связывающийся с метилированным К9 (дополнительные детали см. в главах 5 и 6). Имеются данные, полученные как на Drosophila, так и на человеке, о том, что комплекс, содержащий TRX/ MLL, участвует также в ацетилировании. У человека MLL ассоциирован с ацетилтрансферазой MOF, которая ацетилирует лизин 16 гистона Н4, что является еще одной модификацией, связанной в норме с активацией (Dou et al., 2005). У мух TRX ассоциирован с dCBR — ацетилтрансферазой с широкой специфичностью, которая участвует в активации (Petruk et al., 2001). Ацетилирование могло бы работать совместно [synergistically] с метилированием H3K9, направляя активное состояние после функционирования этих комплексов trxG. Известно также, что ацетилирование предотвращает метилирование таких остатков, как H3K9 и H3K27, которые направляют репрессию матрицы. Белок ASH1, еще один член trxG, тоже является метилтрансферазой гистонов, которая метилирует H3K4 (Beisel et al., 2002; Byrd and Sheam, 2003). Состав ни у одного комплекса, содержащего ASH1, не был установлен; непонятно также, как координируются активности ASH1 и комплексов, содержащих TRX/MLL1/SET1. Однако наблюдали также, что ASH1 колокализуется и ассоциируется с семейством ацетилтрансфераз СВР (Bantignies et al., 2000), что опять-таки предполагает, что метилирование и апетилирование идут рука об руку. Существуют захватывающие, но все еще остающиеся без ответа вопросы относительно того, каким образом ковалентная модификация гистонов могла бы вносить вклад в функцию trxG. Какую функциональную роль играют метки? Ковалентная модификация может вносить свой вклад в эпигенетическое регулирование с помощью широкого спектра механизмов. Метки метилирования и ацетилирования могли служить для непосредственного изменения компактизации хроматина (иногда это обозначается как cis-эффекты, как на рис. 3.8). На способность хроматина входить в компактизированное состояние, которое, как обычно принимается, является репрессивным для транскрипции, влияет распределение зарядов на гистоновых «хвостах». Модификации, происходящие на лизине (например, ацетилирование), могут устранять положительный заряд, в норме обнаруживаемый с этим остатком, и, следовательно, могут прямо снижать способность нуклеосом формировать компактные структуры, повышая таким образом способность матрицы к транскрипции. Предположили, что ковалентные метки создают сайты прочного связывания для комплексов, управляющих [direct] транскрипционной активацией. Эти ковалентные модификации способны создавать специфические «выросты» [«knobs»] на поверхности нуклеосом, которые соответсвуют «карманам» на комплексах, стимулирующих активацию, увеличивая таким образом энергию связывания и функцию этих комплексов. Например, ацетилирование гистоновых «хвостов» увеличивает связывание гомологами белка BRM, стимулируя таким образом АТФ-зависимый ремоделинг ацетилированных матриц (Hassan et al., 2001). Механизм этого типа, часто обозначаемый как «гистоновый код» или trans-эффекты ковалентных модификаций гистонов, потенциально может быть центральной эпигенетической функцией. Нужны дальнейшие исследования, чтобы определить, какие именно метки, созданные белками trxG, усиливают связывание каких именно комплексов, определить степень, с какой энергия связывания с одним модифицированным остатком может влиять на функцию и «нацеливание», и определить временной порядок добавления этих меток и возможность их поддержания при митозе. Оборотная сторона этого механизма заключается в том, что эти метки могли бы подавлять связывание репрессивными комплексами. Ковалентная метка на ключевом остатке, необходимом для оптимального связывания каким-то репрессивным комплексом, могла бы сильно ингибировать связывание этим репрессивным комплексом. Например, известно, что связывание репрессивными комплексами увеличивается метилированием гистона H3 по К9 и К27 (Khorasanizadeh, 2004). Ацетилирование этих остатков и блокировало бы метилирование, и создавало бы «вырост» неправильной формы на гистоне, ослабляющий связывание этим репрессивным комплексом. Таким образом, способность модификаций влиять на функцию других комплексов может работать в обоих направлениях [cut in both directions], увеличивая действенность этого потенциального способа эпигенетической регуляции. Эти механизмы не только не являются взаимоисключающими, но вероятно работают совместно, помогая поддерживать активное состояние. Метки, которые химически увеличивают возможность формировать компактное состояние (cis-эффект), могли бы также увеличивать способность комплексов связываться (trans-эффект) и еще более [further] стимулировать компактное состояние. Наоборот, метки которые химически уменьшают компактизацию, могли бы увеличивать связывание комплексов, которые также декомпактизируют нуклеосомы. Это механистически экономное использование ковалентных меток для изменения нескольких характеристик структуры хроматина и способности регуляторных комплексов связываться могло бы создавать мощные средства поддержания активного состояния.3. Связи между белками trxG и общей транскрипционной машинерией
Тема частого обнаружения белков trxG в одном и том же комплексе продолжается белками skuld (skd) и kohtalo (kto). Эти два белка являются гомологами белков, биохимически идентифицированных как TRAP240 (Skuld) и TRAP230 (Kohtalo), которые оба являются членами комплекса «Mediator» (Janody et al., 2003). Этот медиаторный комплекс является крупным комплексом, функционирующим на поверхности раздела между ген-специфичными активаторными белками и образованием преинициационного комплекса, содержащего PH К-полимеразу II (Lewis and Reinberg, 2003). Таким образом, эти белки участвуют в общих активационных процессах, во многом таким же образом, каким в общей активации участвуют ремоделеры семейства SWI/SNF. SKD и КТО могли бы иметь некоторую специальную функцию, связанную с поддержанием, поскольку другие компоненты этого медиаторного комплекса не были идентифицированы при скрининге на гены trxG. Наблюдение, согласно которому SKD и КТО взаимодействуют друг с другом и согласно которому двойные мутанты skd kto имеют такой же фенотип, что и одиночные мутанты, привело к гипотезе о том, что эти два белка вместе образуют функциональный модуль, который каким-то образом изменяет действие медиатора (Janody et al., 2003).4. Биохимические функции других белков trxG
Биохимические активности большинства других белков trxG остаются довольно таинственными. Ring3, человеческий аналог гена female-sterile homeotic (fsh) из группы trxG у Drosophila, кодирует ядерную протеинкиназу с двумя бромодоменами, для которой предполагается участие в продвижении по клеточному циклу и в лейкемогенезе, но субстраты которой в настоящее время неизвестны (Denis and Green, 1996). Ген Tonalli (Тпа) из группы trxG кодирует белок, родственный белкам SPRING finger, участвующим в сумоилировании, что позволяет предполагать, что он может также регулировать транскрипцию через ковалентную модификацию других, все еще неидентифицированных, белков (Gutierrez et al., 2003). Ген sallimus (sis) из группы trxG был идентифицирован при скрининге на экстрагенные супрессоры Рс (Kennison and Tamkun, 1988) и впоследствии оказался кодирующим Titin у Drosophila (Machado and Andrew, 2000). Подобно своему аналогу у позвоночных, Titin у Drosophila помогает поддерживать целостность и эластичность саркомера. Кроме того, Titin является хромосомным белком, необходимым для конденсации и расхождения хромосом (Machado and Andrew, 2000). Эти интригующие открытия позволяют предположить потенциальную роль белков trxG в регулировании структуры хроматина более высокого порядка.5. Функциональные взаимодействия между белками trxG
Теперь, когда идентифицированы основные биохимические активности многих членов trxG и PcG, внимание переключилось на способ, каким эти активности скоординированы для регулирования транскрипции и поддержания активного состояния. Несмотря на отсутствие систем in vitro для изучения поддержания детеминированного состояния, в этом направлении был достигнут значительный прогресс. Одна популярная гипотеза заключается в том, что члены trxG и Peg облегчают последовательность зависимых событий, необходимых для поддержания активного или репрессированного состояния. Поддержка этой идеи пришла из недавних исследований PcG-комплексов PRC1 и PRC2; субъединица метилазы гистонов E(z) из комплекса PRC2, метилируя H3K27, создает ковалентную метку, которая непосредственно распознается хромодоменом субъединицы Рс комплекса PRC1 (Jacobs and Khorasanizadeh, 2002; Min et al., 2003). Таким образом, оказывается, что один комплекс PcG прямо стимулирует связывание другого комплекса PcG с хроматином По аналогии возможно, что ковалентная модификация нуклеосом членами trxG, обладающими активностями метилтрансферазы или ацетилтрансферазы гистонов (например, TRX или ASH1), непосредственно регулирует «нацеливание» или активности членов trxG, участвующих в АТФ-зависимом ремоделинге хроматина (например, BRM [SWI/SNF], или KIS) (рис. 12.8). С этой возможностью согласуется тот факт, что BRM и другие субъединицы комплексов SWI/SNF содержат бромодомены, которые могут непосредственно взаимодействовать с ацетилированными «хвостами» гистонов, a KIS содержит два хромодомена, которые могут прямо взаимодействовать с метилированными «хвостами» гистонов. Эта модель, в пользу которой свидетельствуют недавние исследования факторов ремоделинга хроматина как у дрожжей, так и у млекопитающих (Agalioti et al., 2000; Hassan et al., 2001), является особенно привлекательной, потому что она обеспечивает механизм, посредством которого наследуемая модификация гистонов могла бы воспроизводить конститутивно «открытую» конфигурацию хроматина, пермиссивную для активной транскрипции.6. Белки trxG: активаторы или антирепрессоры?
Еще одна важная проблема касается функциональных отношений между репрессорами PcG и активаторами trxG. Играют ли эти регуляторные белки независимые роли в активации и репрессии или же они функционируют в прямом противодействии, чтобы поддерживать наследуемое состояние? Недавние генетические исследования показывают, что удаление комплексов PcG обычно реактивирует гены даже в отсутствие TRX и ASH1 (Klymenko and Muller, 2004), что позволяет предположить, что белки trxG с активностью метилтрансферазы гистонов могут функционировать как антирепрессоры PcG в противоположность активаторам (рис. 12.8). И биохимические, и генетические анализы доказывают, что могут существовать прямые связи между функцией trxG и функцией PcG. Одно интересное свойство белков PcG заключается в том, что они способны репрессировать транскрипцию, когда оказываются вблизи практически любого гена, транскрибируемого PH К-полимеразой И. Члены trxG, играющие глобальную роль в транскрипции, — в том числе BRM, KIS и другие члены trxG, участвующие в ремоделинге хроматина, — оказываются таким образом превосходными кандидатами на роль прямых мишеней репрессоров PcG (рис. 12.8). Один из главных комплексов PcG, комплекс PRC1, блокирует функцию комплексов ремоделинга из семейства SWI/SNF, очевидно путем блокирования доступа этого комплекса к матрице (Francis et al., 2001). Это согласуется с представлением о том, что один механизм репрессии PcG мог бы заключаться в том, чтобы предотвращать АТФ-зависимый ремоделинг членами trxG. Комплекс Brahma и PRC1 связывает, сверх того, тот факт, что оба они непосредственно взаимодействуют с белком Zeste — белком, играющим сложную роль в регулировании экспрессии генов у Drosophila, который мог бы способствовать прямым «переговорам» между этими двумя комплексами. Вторым белком, связывающим белки PcG и белки trxG, является фактор GAGA, который кодируется геном Trithorax-like и который, таким образом, является членом trxG (Farkas et al., 1994). Этот белок может функционировать в некоторых промоторах как сиквенс-специфичный активаторный белок, но и является также заметным членом группы белков, которые связываются с репрессивным элементом Polycomb (PRE — Polycomb Repressive Element; глава 8). Нуклеотидные последовательности PRE управляют функцией PcG, и по крайней мере один PRE может действовать как модуль памяти, будучи присоединен к репортерному конструкту, что подчеркивает важность этих последовательностей. Нуклеотидные последовательности, связывающиеся с фактором GAGA, играют важную роль в функционировании PRE, и предполагается, что привязка белка GAGA к ДНК усиливает связывание и функционирование PRC1 (Mahmoudi and Verrijzer, 2001). Таким образом, фактор GAGA мог бы играть ключевые роли в поддержании активации (через его активирующие транскрипцию свойства) и в поддержании репрессии (через взаимодействия с белками PcG). Важная проблема для будущих исследований — понять, почему такие белки, как GAGA и Zeste оказываются взаимодействующими как с активирующей, так и с репрессирующей машинами, обеспечивающими поддержание состояния.7. Выводы и перспективы
Две из основных проблем, касающихся функции белков trxG, остаются в значительной мере в области догадок. Во-первых, почему относительно небольшая подгруппа белков, необходимых для транскрипционной активации, генетически оцениваются как важные для поддержания активного состояния? Не происходит ли это потому, что эти белки играют глобальную роль в транскрипции, но экспрессируются в лимитирующих количествах, или случайно, благодаря счастливой способности эволюции к открытиям, стали особенно важными для генов, играющих важную роль в развитии? Во-вторых, каким образом активное состояние может поддерживаться при репликации и митозе? Репликация создает две дочерние нити, которые обе должны регулироваться идентично, а митоз требует конденсации и, тем самым, подавления транскрипции большинства генов в клетке. Какие механизмы создают эпигенетическую метку (метки), обеспечивающую реактивацию гена на обеих дочерних нитях после митоза? Большинство белков trxG являются частью комплексов, широко используемых в экспрессии генов, и большинство этих комплексов содержат также многие другие белки, не входящие в trxG (табл. 12.1). Это ставит важный вопрос о том, существуют ли специальные функции, используемые для поддержания активной экспрессии генов. Возможно, что ремоделеры SWI/ SNF способны выполнять специальную функцию ремоделинга. что метилирование H3K4 «нацеливает» специальные комплексы и (или) конформации хроматина и что Skuld/Kohtalo изменяют функционирование Mediator каким-то специфическим образом, важным для поддержания. Как альтернатива, возможно, что каждый из этих белков осуществляет реакцию, в норме используемую для активации генов всех типов, и что эти комплексы находятся среди тех, которые возникли как существенные для поддержания по относительно неинтересной причине (например, потому, что даже сравнительно слабые изменения в экспрессии генов НОХ у Drosophila вызывают гомеотические трансформации) Для решения этих проблем нужно значительно больше сведений о точных механизмах, используемых каждым из этих белков в активации. Например, используют ли комплексы SWI/SNF энергию гидролиза АТФ таким же образом, как другие АТФ-зависимые комплексы, или же они отличаются каким-то важным образом в том, как эта энергия используется для изменения структуры нуклеосом? Структурные методы, включающие кристаллографию, биофизические методы, такие как анализ одиночных молекул [single-molecule analysis] и метод FRET (fluorescence resonance energy transfer) и получение детальных изображений in vivo, могли бы помочь пролить свет на то, существуют ли механизмы, специально предназначенные для эпигенетического поддержания активации. Начальные функциональные исследования, проведенные с комплексами trxG на простых модельных матрицах, являются всего лишь началом процесса поисков ответов на эти важные вопросы. Рис. 12.8. Функции и взаимодействия группы Trithorax и группы Polycomb
И семейство trxG, и семейство PcG включает белки, ковалентно модифицирующие гистоны, и белки, нековалентно модифицирующие хроматин. Ковалентные модификации на гистонах могут увеличивать связывание с такими нековалентно модифицирующими комплексами, как SWI/SNF, KIS или PRC1. Связывание с этими последними комплексами обладает возможностью приводить к дальнейшей ковалентной модификации, приводя таким образом к повторяющимся циклам ковалентной модификации и распознавания этих ковалентных меток
Рис. 12.8. Функции и взаимодействия группы Trithorax и группы Polycomb
И семейство trxG, и семейство PcG включает белки, ковалентно модифицирующие гистоны, и белки, нековалентно модифицирующие хроматин. Ковалентные модификации на гистонах могут увеличивать связывание с такими нековалентно модифицирующими комплексами, как SWI/SNF, KIS или PRC1. Связывание с этими последними комплексами обладает возможностью приводить к дальнейшей ковалентной модификации, приводя таким образом к повторяющимся циклам ковалентной модификации и распознавания этих ковалентных меток
Эпигенетические механизмы, которые могли бы поддерживать активное состояние, выяснены в еще меньшей степени. Распределены ли ковалентные метки таким образом, чтобы помочь создать активную метку? Поддерживаются ли позиции нуклеосом после репликации, чтобы создавать «открытые» отрезки хроматина или специально позиционированных нуклеосом, которые увеличивают связывание активаторов? Заставляет ли функционирование trxG активные гены компартментализироваться в ядре в районы, благоприятные для активной транскрипции? Это все жизнеспособные гипотезы; существует еще больше гипотез, а иные еще даже не сформулированы. Неимоверная сложность машинерии, транскрибирующей ДНК, обусловливает многочисленные возможности регулирования и развития механизмов, которые делают возможным эпигенетическое поддержание активной транскрипции Это пересечение двух богатых интеллектуальной историей областей, а именно активации транскрипции и эпигенетического механизма будет благодатной почвой для экспериментаторов на протяжении многих лет
Литература
Agalioti Т., Lomvardas S., Parekh В., Yie J., Maniatis Т., and Thanos D., 2000. Ordered recruitment of chromatin modifying and general transcription factors to the IFN-p promoter. Cell 103: 667-678. Armstrong J.A., Papoulas O., Daubresse G., Sperling A.S., Lis J.T., Scott M.P., and Tamkun J.W., 2002. The Drosophila BRM complex facilitates global transcription by RNA polymerase II. EMBO J. 21: 5245-5254. Bantignies R., Goodman R.H., and Smolik S.М., 2000. Functional interaction between the coactivator Drosophila CREB-binding protein and ASH 1, a member of the trithorax group of chromatin modifiers. Mol. Cell. Biol., 20: 9317-9330. Beisel C., Imhof A., Greene J.. Kremmer E., and Sauer F., 2002. Histone methylation by the Drosophila epigenetic transcriptional regulator Ash 1. Nature 419: 857-862. Bultman S., Gebuhr Т., Yee D., La Mantia C., Nicholson J., Gilliam A., Randazzo F., Metzger D., Chambon P., Crabtree G., and Magnuson Т., 2000. A Brgl null mutation in the mouse reveals functional differences among mammalian SWI/SNF complexes. Mol. Cell 6: 1287-1295. Byrd K.N. and Sheam A., 2003. ASH1, a Drosophila trithorax group protein, is required for methylation of lysine 4 residues on histone H3. Proc. Natl. Acad. Sci. 100: 11535-11540. Chaya D., Hayamizu Т., Bustin М., and Zaret K.S., 2001. Transcription factor FoxA (HNF3) on a nucleosome at an enhancer complex in liver chromatin. J. Biol. Chem. 276: 44385-44389. Cirillo L.A., Lin F.R., Cuesta I., Friedman D., Jamik М., and Zaret K.S., 2002. Opening of compacted chromatin by early developmental transcription factors HNF3 (FoxA) and GATA-4. Mol. Cell 9: 279-289. Cote J., Quinn J., Workman J.L., and Peterson C.L., 1994. Stimulation of GAL4 derivative binding to nucleosomal DNA by the yeast SWI/SNF complex. Science 265: 53-60. Daubresse G., Deuring R., Moore L., Papoulas O., Zakrajsek 1., Waldrip W.R., Scott M.P., Kennison J.A., and Tamkun J.W., 1999. The Drosophila kismet gene is related to chromatin-remodeling factors and is required for both segmentation and segment identity. Development 126: 1175-1187. Denis G.V. and Green M.R., 1996. A novel, mitogen-activated nuclear kinase is related to a Drosophila developmental regulator. Genes Dev. 10: 261 -271. Dou Y., Milne T.A., Tackett A.J., Smith E.R., Fukuda A., Wysocka J., Allis C.D., Chait B.T., Hess J.L., and Roeder R.G., 2005. Physical association and coordinate function of the H3 K4 methyltransferase MLL1 and the H4 K16 acetyltransferase MOF. Cell 121: 873-885. Dunaief J.L., Strober B.E., Guha S., KhavariP.A., Alin K., Luban J., Begemann М., Crabtree G.R., and Goff S.P., 1994. The retinoblastoma protein and BRG1 form a complex and cooperate to induce cell cycle arrest. Cell 79: 119-130. Duncan I., 1987. The bithorax complex. Annu. Rev. Genet. 21: 285-319. Fan H.Y., He X., Kingston R.E., and Narlikar G.J., 2003. Distinct strategies to make nucleosomal DNA accessible. Mol. Cell 11: 1311-1322. Farkas G., Gausz J., Galloni М., Reuter G., Gyurkovics H., and Karch F., 1994. The Trithorax-like gene encodes the Drosophila GAGA factor. Nature 371: 806-808. Francis N.J. and Kingston R.E., 2001. Mechanisms of transcriptional memory. Nat. Rev. Mol. Cell. Biol. 2: 409-421. Francis N.J., Saurin A.J., Shao Z., and Kingston R.E., 2001. Reconstitution of a functional core polycomb repressive complex. Mol. Cell 8: 545-556. Gellon G. and McGinnis W., 1998. Shaping animal body plans in development and evolution by modulation of Hox expression patterns. Bioessays, 20: 116-125. Gutierrez L., Zurita М., Kennison J.A., and Vazquez М., 2003. The Drosophila trithorax group gene tonalli (tna) interacts genetically with the Brahma remodeling complex and encodes an SP-R1NG finger protein. Development 130: 343-354. Hassan A.H., Neely K.E., and Workman J.L., 2001. Histone acetyltransferase complexes stabilize swi/snf binding to promoter nucleosomes. Cell 104: 817-827. Holstege E.C., Jennings E.G., Wyrick J.J., Lee T.I., Hengartner C.J., Green M.R., Golub T.R., Lander E.S., and Young R.A., 1998. Dissecting the regulatory circuitry of a eukaryotic genome. Cell 95: 717-728. Hughes C.M., Rozenblatt-Rosen O., Milne T.A., Copeland T.D., Levine S.S., Lee J.C., Hayes D.N., Shanmugam K.S., Bhattachaqee A., Biondi C.A., et al., 2004. Memn associates with a trithorax family histone methyltransferase complex and with the hoxc8 locus. Mol. Cell 13: 587-597. Imbalzano A.N., Kwon H., Green M.R., and Kingston R.E., 1994. Facilitated binding of TATA-binding protein to nucleosomal DNA. Nature 370: 481-485. Jacobs S.A. and Khorasanizadeh S., 2002. Structure of HP1 chromodomain bound to a lysine 9-methylated histone H3 tail. Science 295: 2080-2083. Janody E., Martirosyan Z., Benlali A., and Treisman J.E., 2003. Two subunits of the Drosophila mediator complex act together to control cell affinity. Development 130: 3691-3701. Kassabov S.R., Zhang B., Persinger J., and Bartholomew B., 2003. SWI/SNF unwraps, slides, and rewraps the nucleosome. Mol. Cell 11: 391-403. Kaufman T.C., Seeger M.A., and Olsen G., 1990. Molecular and genetic organization of the antennapedia gene complex of Drosophila melanogaster. Adv. Genet. 27: 309-362. Kennison J.A., 1995. The Polycomb and trithorax group proteins of Drosophila: Trans-regulators of homeotic gene function. Annu. Rev. Genet. 29: 289-303. Kennison J. A., 2003. Introduction to Trx-G and Pc-G genes. Methods Enzymol. 377: 61-70. Kennison J.A. and Tamkun J.W., 1988. Dosage-dependent modifiers of Polycomb and Antennapedia mutations in Drosophila. Proc. Natl. Acad. Sci. 85: 8136-8140. Khorasanizadeh S., 2004. The nucleosome: From genomic organization to genomic regulation. Cell 116: 259-272. Klymenko T. and Muller J., 2004. The histone methyltransferases Trithorax and Ash1 prevent transcriptional silencing by Polycomb group proteins. EM BO Rep. 5: 373-377. Kruger W., Peterson C.L., Sil A., Cobum C, Arents G., Moudrianakis E.N., and Herskowitz I., 1995. Amino acid substitutions in the structured domains of histories H3 and H4 partially relieve the requirement of the yeast SWI/SNF complex for transcription. Genes Dev. 9: 2770-2779. Kwon H., Imbalzano A.N., Khavari P.A., Kingston R.E., and Green M.R., 1994. Nucleosome disruption and enhancement of activator binding by a human SWI/SNF complex. Nature 370: 477-481. Levine S.S., King I.F., and Kingston R.E., 2004. Division of labor in Polycomb group repression. Trends Biochem. Sci. 29: 478-485. Lewis B.A. and Reinberg D., 2003. The mediator reactivator complex: Functional and physical roles in transcriptional regulation. J. Cell Sci. 116: 3667-3675. Logie C. and Peterson C.L., 1997. Catalytic activity of the yeast SWI/SNF complex on reconstituted nucleosome arrays. EMBO J. 16: 6772-6782. Lorch Y., Zhang М., and Romberg R.D., 1999. Histone octamer transfer by a chromatin-remodeling complex. Cell 96: 389-392. Machado C. and Andrew D.J., 2000. D-Titin: A giant protein with dual roles in chromosomes and muscles. J. Cell Biol. 151: 639-652. Mahmoudi T. and Verrijzer C.P., 2001. Chromatin silencing and activation by Polycomb and trithorax group proteins. Oncogene, 20: 3055-3066. Miller Т., Krogan N.J., Dover J., Erdjument-Bromage H., Tempst P., Johnston М., Greenblatt J.F., and Shilatifard A., 2001, COMPASS: A complex of proteins associated with a trithorax-related SET domain protein. Proc. Natl. Acad. Sci. 98: 12902-12907. Min J., Zhang Y., and Xu R.M., 2003. Structural basis for specific binding of Polycomb chromodomain to histone H3 methylated at Lys 27. Genes Dev. 17: 1823-1828. Mohrmann L. and Verrijzer C.P., 2005. Composition and functional specificity of SWI2/SNF2 class chromatin remodeling complexes. Biochim. Biophys. Acta 1681: 59-73. Muyrers-Chen I., Rozovskaia Т., Lee N., Kersey J.H., Nakamura Т., Canaani E., and Paro R., 2004. Expression of leukemic MLL fusion proteins in Drosophila affects cell cycle control and chromosome morphology. Oncogene 23: 8639-8648. Petruk S., Sedkov Y., Smith S., Tillib S., Kraevski V, Nakamura Т., Canaani E„ Croce C.M., and Mazo A., 2001. Trithorax and dCBP acting in a complex to maintain expression of a homeotic gene. Science 294: 1331-1334. Phelan M.L., Sif S., Narlikar G.J., and Kingston R.E., 1999. Reconstitution of a core chromatin remodeling complex from SWI/ SNF subunits. Mol. Celiy. 247-253. Pokholok D.K., Harbison C.T., Levine S., Cole М., Hannett N.M., Lee T.I., Bell G.W., Walker K., Rolfe P.A., Herbolsheimer E., et al., 2005. Genome-wide map of nucleosome acetylation and methylation in yeast. Cell 122: 517-527. Polach K.J. and Widom J., 1995. Mechanism of protein access to specific DNA sequences in chromatin: A dynamic equilibrium model for gene regulation. J. Mol. Biol. 254: 130-149. Rea S., Eisenhaber E, O’Carroll D., Strahl B.D., Sun Z.W., Schmid М., Opravil S., Mechtler K., Ponting C.P., AllisC.D., and Jenuwein Т., 2000. Regulation of chromatin structure by site-specific histone H3 methyltransferases. Nature 406: 593-599. Ringrose L. and Paro R., 2004. Epigenetic regulation of cellular memory by the polycomb and trithorax group proteins. Annu. Rev. Genet. 38: 413-443. Roguev A.,. Schaft D., Shevchenko A., Pijnappel W.W., Wilm М., Aasland R., and Stewart A.F., 2001. The Saccharomyces cerevisiae Setl complex includes an Ash2 homologue and methylates histone 3 lysine 4. EMBO J., 20: 7137-7148. Saha A., Wittmeyer J., and Cairns B.R., 2005. Chromatin remodeling through directional DNA translocation from an internal nucleosomal site. Nat. Struct. Mol. Biol. 12: 747-755. Santos-Rosa H., Schneider R., Bannister A. J., Sherriff J., Bernstein B.E., Emre N.C., Schreiber S.L., Mellor J., and Kouzandes Т., 2002. Active genes are tri-methylated at K4 of histone H3. Nature 419: 407-411. Simon J., 1995. Locking in stable states of gene expression: Transcriptional control during Drosophila development. Curr. Opin. Cell Biol. 7: 376-385. Simon J.A. and Tamkun J.W., 2002. Programming off and on states in chromatin: Mechanisms of Polycomb and trithorax group complexes. Curr. Opin. Genet. Dev. 12: 210—218. Srinivasan S., Armstrong J.A., Deuring R., Dahlsveen I.K., McNeill H., and Tamkun J.W., 2005. The Drosophila trithorax group protein Kismet facilitates an early step in transcriptional elongation by RNA Polymerase II. Development 132: 1623-1635. Strober B.E., Dunaief J.L., Guha S., and Goff S.P., 1996. Functional interactions between the hBRM/hBRGl transcriptional activators and the pRB family of proteins. Mol. Cell. Biol 16: 1576-1583. Sudarsanam P., Iyer V.R., Brown P.O., and Winston F., 2000. Whole-genome expression analysis of snf/swi mutants of Saccharomyces cerevisiae. Proc. Natl. Acad. Sci. 97: 3364-3369. Tamkun J.W., Deuring R., Scott M.P., Kissinger М., Pattatucci A.M., Kaufman T.C., and Kennison J.A., 1992. brahma: A regulator of Drosophila homeotic genes structurally related to the yeast transcriptional activator SNF2/SWI2. Cell 68: 561-572. Therrien М., Morrison D.K., Wong A.М., and Rubin G.M., 2000. A genetic screen for modifiers of a kinase suppressor of Ras-dependent rough eye phenotype in Drosophila. Genetics 156: 1231-1242. Versteege I., Sevenet N., Lange J.. Rousseau-Merck M.F., Ambros P., Handgretinger R., Aurias A., and Delattre O., 1998. Truncating mutations of hSNF5/INIl in aggressive paediatric cancer. Nature 394: 203-206. Vignali М., Hassan A.H., Neely K.E., and Workman J.L., 2000. ATP-dependent chromatin-remodeling complexes. Mol Cell Biol., 20: 1899-1910. Wang W., Cote J., Xue Y., Zhou S., Khavari P.A., Biggar S.R., Muchardt C., Kalpana G.V., Goff S.P., Yaniv М., et al., 1996. Purification and biochemical heterogeneity of the mammalian SWI-SNF complex. EMBO J. 15: 5370-5382. White house I., Stockdale G., Flaus A., Szczelkun M.D., and Owen-Hughes Т., 2003. Evidence for DNA translocation by the ISWI chromatin-remodeling enzyme. Mol. Cell. Biol. 23: 1935-1945. Wysocka J., Swigut Т., Milne T.A., Dou Y., Zhang X., Burlingame A.L., RoederR.G., Brivanlou A.H., and Allis C.D., 2005. WDR5 associates with histone H3 methylated at K4 and is essential for H3 K4 methylation and vertebrate development. Cell 121: 859-872. Yokoyama A., Wang Z., Wysocka J., Sanyal М., Aufiero D.J., Kitabayashi I., Herr W., and Cleary M.L., 2004. Leukemia protooncoprotein MLL forms a SET 1-like histone methyltransferase complex with menin to regulate Hox gene expression. Mol. Cell Biol. 24: 5639-5649. Yu B.D., Hanson R.D., Hess J.L., Homing S.E., and Korsmeyer S.J., 1998. MLL, a mammalian trithorax-group gene, functions as a transcriptional maintenance factor in morphogenesis. Proc. Natl Acad. Sci. 95: 10632-10636. Yu B.D., Hess J.L., Horning S.E., Brown G.A., and Korsmeyer S.J., 1995. Altered Hox expression and segmental identity in Mil-mutant mice. Nature 378: 505-508.Глава 13. Варианты гистонов и эпигенетика
 Steven Henikoff1 и Mitchell Smith2
1 Howard Hughes Medical Institute, Fred Hutchinson Cancer Research Center, Seattle,
Washington 98169-1024 department of Microbiology, University of Virginia, Charlottesville, Virginia 22908
Содержание:
Steven Henikoff1 и Mitchell Smith2
1 Howard Hughes Medical Institute, Fred Hutchinson Cancer Research Center, Seattle,
Washington 98169-1024 department of Microbiology, University of Virginia, Charlottesville, Virginia 22908
Содержание:
Общее резюме
Гистоны упаковывают ДНК, собираясь в коровые частицы нуклеосом, тогда как ДНК оборачивается вокруг них. На протяжении эволюционного времени белки с доменом «гистонового сворачивания» (histone fold domain proteins) диверсифицировались от своих предков, представленных у архей, в четыре различные субъединицы, которые составляют знакомый октамер эукариотической нуклеосомы. Результатом дальнейшей диверсификации гистонов в разные варианты оказывается дифференцировка хроматина, могущая иметь эпигенетические следствия. Исследования эволюции, структуры и метаболизма вариантов гистонов обеспечивают основу для понимания участия хроматина в важных клеточных процессах и эпигенетической памяти. Большинство гистонов синтезируются в фазе S для быстрой откладки позади репликационных вилок, чтобы заполнить пробелы, образовавшиеся в результате распределения предсуществовавших гистонов. Кроме того, замещение канонических гистонов S-фазы вариантами, независимо от репликации, потенциально может дифференцировать хроматин. Дифференцировка хроматина вариантами гистонов особенно заметна в центромерах, где вариант гистона H3, CENP-A, собирается в специализированные нуклеосомы, образующие фундамент для сборки кинетохора (см. левую часть рисунка в начале главы). Центромерный аналог CENP-A, CenH3, обнаруживается у всех эукариот. У растений и животных правильная сборка содержащих CenH3 нуклеосом в центромерах не требует, оказывается, центромерных нуклеотидных последовательностей ДНК, что является замечательным примером эпигенетической наследственности. Некоторые CenH3s развились адаптивно в участках, контактирующих с ДНК, что позволяет предполагать, что центромеры конкурируют друг с другом и что CenH3s и другие специфичные для центромеры белки, связывающиеся с ДНК, адаптировались в ответ на это. Этот процесс мог бы объяснить большие размеры и сложность центромер у растений и животных. Хроматин может быть дифференцированным и вне центромер путем включения конститутивно экспрессируемой формы гистона H3, называемой H3.3, которая является субстратом для независимой от репликации сборки нуклеосом. Замещение вариантом H3.3 происходит в активных генах (см. правую часть рисунка в начале главы, где зеленым цветом изображен H3.3 на хромосоме плодовой мушки); это динамический процесс с потенциальными эпигенетическими следствиями. Различия между H3 и H3.3 по их наборам ковалентных модификаций могут лежать в основе изменений в свойствах хроматина в активно транскрибируемых локусах. Несколько вариантов Н2А также могут дифференцировать или регулировать хроматин. Н2А.Х определяется как вариант по 4-аминокислотному карбокситерминальному мотиву, в котором остаток серина является сайтом для фосфорилирования в сайтах двухнитевых разрывов ДНК. Фосфорилирование Н2АХ является ранним событием в репарации двухнитевых разрывов, где, как считают, он концентрирует компоненты репарационной машины. Фосфорилирование Н2АХ также маркирует неактивный бивалент XY во время сперматогенеза млекопитающих и требуется для конденсации, спаривания и фертильности. H2AZ — это структурно отклоняющийся вариант, который долгое время был загадкой. Исследования на дрожжах позволили считать, что H2AZ устанавливает транскрипционную компетентность и противодейству ет сайленсингу гетерохроматина. Биохимический комплекс, замещающий Н2А вариантом H2AZ в нуклеосомах, является АТФ-зависимым ремоделером нуклеосом, представляя первый пример специфической функции у члена этого многообразного класса ассоциированных с хроматином машин. Два варианта, специфичных для позвоночных, macroН2А и H2ABbd, проявляют контрастирующие особенности, будучи упакованы в нуклеосомы in vitro: macroH2A препятствует, a H2ABbd облегчает транскрипцию. Эти особенности согласуются с паттернами их локализации на эпигенетически инактивированной Х-хромосоме млекопитающих, где macroH2A много, а Н2АBbd мало. На основании результатов этих исследований складывается представление, что варианты гистонов и процессы, откладывающие их в нуклеосомы, обеспечивают первичную дифференцировку хроматина, которая может служить основой для эпигенетических процессов.1. У всех организмов ДНКупаковывается архитектурными белками
Огромная длина двойной спирали ДНК по отношению к размерам содержащей ее органеллы требует плотной упаковки, и для этой цели развились архитектурные белки. Первый уровень упаковки укорачивает двойную спираль и защищает ее от повреждений, но все еще предоставляет ДНК-полимеразе полный доступ к каждой паре оснований в каждом клеточном цикле. Кроме того, эти архитектурные белки облегчают сворачивание более высокого порядка, чтобы еще больше сократить длину хромосомы. Возможно из-за жестких требований к упаковке ДНК почти у всех клеточных форм жизни обнаруживаются лишь два структурных класса архитектурных белков (Malik and Henikoff, 2003). Бактериальная ДНК упакована белками HU, эукариотическая ДНК — гистонами, а ДНК архей упакована либо белками HU, либо гистонами. Гистоны упаковывают ДНК в нуклеосомные частицы, и эта архитектурная роль может объяснить тот факт, что гистоны составляют половину массы эукариотической хромосомы. Однако было также обнаружено, что гистоны играют многообразные роли в экспрессии генов, сегрегации хромосом, репарации ДНК и других базовых хромосомных процессах у эукариот. Специфические требования, предъявляемые этими хромосомными процессами, привели к развитию разных вариантов гистонов. Включение вариантного гистона в нуклеосому представляет потенциально глубокое изменение хроматина. Действительно, недавние работы показали, что некоторые варианты гистонов откладываются разными комплексами сборки нуклеосом, что позволяет предполагать, что хроматин диверсифицируется, по крайней мере частично, включением и замещением вариантов гистонов. Четыре коровых гистона различаются в отношении их склонности диверсифицироваться в варианты. Например, у человека имеется только один изотип Н4, но несколько паралогов Н2А с разными свойствами и функциями. Очевидно, разное положение коровых гистонов в нуклеосомной частице подвергало их действию разных эволюционных сил, приводя к важным диверсификациям Н2А и H3, но не Н2В и Н4. Наличие геномных последовательностей от самых разнообразных эукариот позволяет нам сделать вывод, что эти диверсификации произошли в разное время в ходе эволюции эукариот. Однако явная диверсификация анцестрального белка «гистоновой свертки» (histone fold protein) в знакомые четыре коровых гистона должна была произойти на ранних этапах эволюции эукариотического ядра или даже, возможно, еще раньше. Рассматривая эти древние события, мы узнаем о тех силах, которые привели к последующей диверсификации в современные варианты.2. Эукариотические коровые гистоны развились из гистонов архей
Эукариотическая нуклеосома представляет собой сложную структуру, состоящую из октамера четырех коровых гистонов, обернутого почти два раза ДНК; «хвосты» гистонов и линкерные гистоны опосредуют разнообразные упаковочные взаимодействия вне коровой частицы (Arents et al., 1991; Wolffe, 1992; Luger et al., 1997). Нуклеосомы архей гораздо проще, и очевидно, что они похожи на анцестральную частицу, из которой развились эукариотические нуклеосомы (Malik and Henikoff, 2003). Нуклеосома архей состоит из белков с доменом «гистонового сворачивания» (histone fold domain proteins), которые не имеют «хвостов» и образуют тетрамерную частицу, обернутую лишь одним витком ДНК. Родство между нуклеосомами архей и эукариот можно видеть, сравнивая их структуры: остов [backbone] тетрамера архей почти накладывается на остов тетрамера (H3•Н4)2 (рис. 13.1). Когда нуклеосомы архей реконструируются и формируют хроматин, получающаяся фибрилла ведет себя подобно «тетрасомам» (H3•Н4). Поэтому полагают, что эукариотические нуклеосомы развились из нуклеосом архей путем добавления димеров Н2А•Н2В с каждой стороны тетрасомы, чтобы сделать возможным второй виток ДНК, и путем приобретения гистоновых «хвостов». Кроме того, ДНК сворачивается в правую суперспираль вокруг коров архей, но в левую суперспираль вокруг эукариотических коров. Дальнейшее проникновение в происхождение эукариотических нуклеосом становится возможным благодаря изучению субъединичных структур нуклеосом архей. В то время как большинство гистонов архей являются недиффернцированными мономерами или дифференцированы в структурно взаимозаменяемые варианты, которые сходятся вместе и формируют тетрамер, некоторые из них представляют собой димерные слияния типа «голова к хвосту», которые сходятся вместе и образуют димер из слившихся димеров (рис. 13.1). Когда два из этих слившихся димеров собираются в нуклеосомную частицу каждый член слившейся пары находится в структурно различимой позиции. Занимая различные позиции в частице, каждый член слившегося димера архей развивается независимо, давая ему возможность адаптироваться к одной позиции в нуклеосомной частице. Напротив, мономеры, занимающие взаимозаменяемые позиции, не обладают свободой для адаптации к определенным позициям. Действительно, два члена димеров архей дивергировали друг от друга в обеих независимых линиях, в которых они обнаруживаются. Этот процесс представляет возможный сценарий дифференцировки анцестрального белка с доменом «гистонового сворачивания» (histone fold domain protein) в четыре различные субъединицы, занимающие различные положения в эукариотической нуклеосоме. Подобно их предполагаемым предкам у архей эукариотические гистоны образуют димеры, где Н2А димеризуется с Н2В, а H3 — с Н4 (который также стабильно тетрамеризуется в растворе). При разрешении 2 Е структурный остов (backbone) гистонового димера у архей накладывается на остовы Н2А•Н2В и H3•Н4, причем первый член этого димерного повтора накладывается на Н2А или H3, а второй член — на Н2В или Н4. Поэтому, хотя у всех четырех эукариотических гистонов отсутствует сколько-нибудь существенное сходство по нуклеотидной последовательности друг с другом и с гистонами архей, это поразительное структурное наложение димерных единиц заставляет предполагать, что эукариотические гистоны развились и дифференцировались из более простых предков, бывших у архей. Рис. 13.1. Модель эволюции эукариотической нуклеосомы из предкового дублетного гистона (doublet histone ancestor) архей
Тетрамер архей с взаимозаменяемыми субъединицами А и В (А/В) мог развиться в димер слившихся димеров («дублет»). За этим могло бы следовать расшепление [split] гена, чтобы дать начало эукариотическому тетрамеру H3 и Н4, формирующему «тетрасому» (H3•Н4), которая занимает один виток ДНК. Н2А и Н2В могли возникнуть в результате аналогичного события, собираясь над тетрамером и под ним, как предполагается на рисунке, в результате чего становятся возможными два витка ДНК (не изображено). Одиночные точки в верхней части диаграммы изображают контакты димеров, а двойные точки — четырехспиральные пучки между соседними димерами (Перепечатано из: Malik and Henikoff 2003)
Рис. 13.1. Модель эволюции эукариотической нуклеосомы из предкового дублетного гистона (doublet histone ancestor) архей
Тетрамер архей с взаимозаменяемыми субъединицами А и В (А/В) мог развиться в димер слившихся димеров («дублет»). За этим могло бы следовать расшепление [split] гена, чтобы дать начало эукариотическому тетрамеру H3 и Н4, формирующему «тетрасому» (H3•Н4), которая занимает один виток ДНК. Н2А и Н2В могли возникнуть в результате аналогичного события, собираясь над тетрамером и под ним, как предполагается на рисунке, в результате чего становятся возможными два витка ДНК (не изображено). Одиночные точки в верхней части диаграммы изображают контакты димеров, а двойные точки — четырехспиральные пучки между соседними димерами (Перепечатано из: Malik and Henikoff 2003)
Асимметрия димеров Н2А•Н2В и H3•Н4, происходящая. по-видимому, от тандемных димеров архей. могла проложить путь для последующей диверсификации вариантов эукариотических гистонов. И Н2А. и H3 соответствуют первому члену тандемных гистоновых димеров у архей, и оба впоследствии многократно диверсифицировались в эволюции эукариот. Напротив, Н2В и Н4 соответствуют второму члену и продемонстрировали очень незначительную функциональную диверсификацию (Н2В) или вовсе никакой (Н4). И H3, и Н2А образуют гомодимерные контакты в октамере (рис. 13.2), тогда как Н4 и Н2В контактируют лишь с другими гистонами. В результате изменения в остатках, вовлеченных в гомодимеризацию либо Н2А, либо H3, могут потенциально сопротивляться образованию смешанных октамеров, позволяя нуклеосомам, содержащим вариант Н2А или H3, развиваться независимо от родительских нуклеосом. Например, четырехспиральный пучок (four-helix bundle), охватывающий интерфейс между молекулами H3, определяет левостороннее суперскручивание ДНК вокруг нуклеосомы (Arents et al., 1991; Luger et al., 1997), тогда как в нуклеосомах архей супервитки ДНК являются правосторонними (Marc et al., 2002). Очевидно, мутация этого четырехспирального пучка у предка H3 была ответственна за эту реверсию. В целом структурные особенности, облегчавшие независимую эволюцию субъединиц, могли быть предпосылками для диверсификации нуклеосомных частиц.
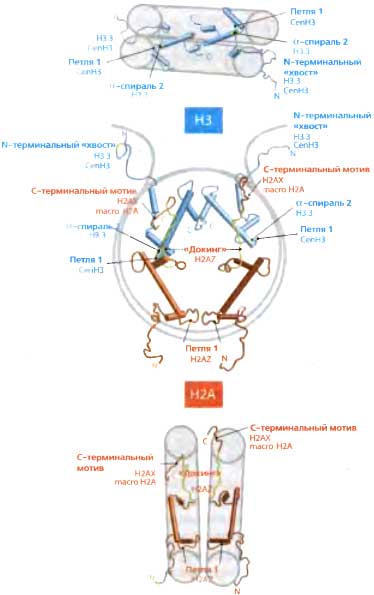 Рис. 13.2. Локализация гистона Н3 (синий цвет) и Н2А (корич невый цвет) в коровой частице нуклеосомы
Четыре остатка, различающиеся у вариантов НЗ, показаны желтым цветом (перепечатано, с любезного разрешения, из: Henikoff and Ahmad 2005)
Рис. 13.2. Локализация гистона Н3 (синий цвет) и Н2А (корич невый цвет) в коровой частице нуклеосомы
Четыре остатка, различающиеся у вариантов НЗ, показаны желтым цветом (перепечатано, с любезного разрешения, из: Henikoff and Ahmad 2005)
Хотя мы можем дать рациональное объяснение происхождению эукариотических коровых гистонов от тандемных димеров архей, остаются другие основные вопросы. Откуда появились «хвосты» гистонов? Когда вышли на сцену Н2А•Н2В? Произошли ли эти события до, во время или после возникновения эукариотического ядра? Почему все известные нуклеосомы архей состоят из тетрамеров с одним витком, тогда как эукариотические нуклеосомы состоят из октамеров с двумя витками? Почему поменялось направление суперспирали? Возможно, изучение большего числа архей и м примитивных эукариот позволит обнаружить промежуточные формы, которые смогут дать ответ на эти вопросы.
3. Основная масса гистонов откладывается после репликации ДНК
Для упаковки по существу всей ДНК эукариотической клетки в нуклеосомы необходимо, чтобы хроматин дуплицировался, когда реплицируется ДНК (рис. 13.3). Таким образом, канонические гистоны продуцируются в фазе синтеза ДНК клеточного цикла (фазе S). Сопряжение синтеза гистонов с синтезом ДНК в фазе S находится под строгим контролем клеточного цикла (Marzluff and Duronio, 2002). Это особенно очевидно у животных, где специальный процессинг гистоновых транскриптов малым ядерным рибонуклеопротеидным комплексом U7 и стабилизация иРНК белком SLBP (stem-loop-binding protein) вносят вклад в тесную координацию синтеза гистонов с репликацией ДНК. Весьма вероятно, что необходимость в быстром и массивном производстве гистонов в фазе S ответственна за тот факт, что сопряженные с репликацией (RC, replication-coupled) гистоны у животных закодированы в кластерах, содержащих много гистоновых генов.Например, в геноме человека имеется 14 генов Н4, большинство из которых находятся в двух главных кластерах, где эти гены Н4 чередуются с генами других гистонов RC (Marzluff et al., 2002). У животных гистоны RC узнаются по наличию 3’-последовательности длиной 26 п.о., которая образует структуру «стебель-петля (stem-loop)» для распознавания комплексом SLBP при транскрипции в гистоновую иРНК. Канонические гистоны растений тоже кодируются множественными генами и откладываются в фазе S, хотя транскрипты растительных гистонов полиаденилированы, а аналог SLBP, по-видимому, отсутствует. В той мере, в какой эпигенетическая наследственность является результатом наследования «состояния» хроматина, процесс сборки нуклеосом RC представляет исключительный интерес. Биохимия этого процесса была выяснена, когда были разработаны системы in vitro, способные собирать нуклеосомы на реплицирующейся ДНК. Эти исследования показали, что трех-субъелиничный комплекс, фактор сборки хроматина I (CAF-I, chromatin assembly factor I) действует как гистоновый шаперон, облегчающий включение H3•Н4 в качестве первого этапа сборки нуклеосом (Loyola and Almouzni, 2004). Было показано, что CAF-1 взаимодействует с фиксатором репликационной процессивности (replication processivity clamp), PCNA, что означает, что репликация ДНК и сборка RC происходят в тесной близости. Работы на почкующихся дрожжах показали, что ни одна из субъединиц комплексов, участвующих в сборке RC in vitro, не является существенной для роста; это позволяет предполагать, что in vivo существуют избыточные механизмы для сборки RC. Тот факт, что большая часть хроматина дрожжей собирается независимым от репликации (RI, replication-independent) образом (Altheim and Schultz, 1999), дает разумное объяснение для этой явной избыточности. Как показано ниже, варианты гистонов, как правило, откладываются путем RI-сборки нуклеосом. Рис. 13.3. Старые нуклеосомы (темные диски) случайно распределяются позади репликационной вилки, а новые нуклеосомы (светлые диски) откладываются в образующиеся бреши
Опосредованная CAF-1 сборка нуклеосом изображена, с увеличением, на ведущей и отстающей нитях. ДНК-полимераза (зеленый цвет); фиксатор поступательного хода репликации, PCNA (синее кольцо); тетрамеры гистонов H3•Н4 (розовый цвет); вновь синтезированная ДНК (красный цвет)
Рис. 13.3. Старые нуклеосомы (темные диски) случайно распределяются позади репликационной вилки, а новые нуклеосомы (светлые диски) откладываются в образующиеся бреши
Опосредованная CAF-1 сборка нуклеосом изображена, с увеличением, на ведущей и отстающей нитях. ДНК-полимераза (зеленый цвет); фиксатор поступательного хода репликации, PCNA (синее кольцо); тетрамеры гистонов H3•Н4 (розовый цвет); вновь синтезированная ДНК (красный цвет)
У почкующихся дрожжей RC-сборка не является полностью избыточной. Интригующим оказалось открытие, что отсутствие большой субъединицы CAF-1 ведет к утрате эпигенетического сайленсинга в теломерах (Loyola and Almouzni, 2004). Эта связь между RC-сборкой и эпигенетическим сайленсингом была распространена и на Arabidopsis, где утрата субъединиц CAF-1 приводит к ряду дефектов, которые можно приписать утере эпигенетической памяти. Хотя механистическая основа этих наблюдений неизвестна, кажется очевидным, что правильная откладка новых нуклеосом позади репликационной вилки важна для поддержания эпигенетически сайленсированного состояния. Предпосылкой эпигенетической наследственности нуклеосомного состояния является тот факт, что предсуществовавшие нуклеосомы после репликации должны быть распределены по дочерним хроматидам (рис. 13.3). Действительно, так оно и есть: детальные исследования показали, что старые нуклеосомы наследуются дочерними хроматидами интактными и очевидно случайным образом (рис. 13.3) (Annunziato, 2005). Однако этот процесс наследования плохо понят, как и процесс, посредством которого новые гистоны могли бы приобретать эпигенетическую информацию. Популярная модель состоит в том, что новые нуклеосомы модифицируются в результате того, что они находятся вблизи старых нуклеосом (Jenuwein, 2001), однако данные в пользу этого гипотетического процесса отсутствуют, и необходимо рассматривать альтернативные средства воспроизведения эпигенетического состояния (Henikoff and Ahmad, 2005). Каким образом эпигенетическая информация наследуется дочерними клетками, остается главным невыясненным вопросом биологии, и изучение вариантов гистонов и механизмов их откладки может дать ответ на этот вопрос
4. Варианты гистонов откладываются на протяжении всего клеточного цикла
Как мы видели, коровые гистоны можно классифицировать на основе их анцестральной последовательности и положения в нуклеосоме. Линкерные гистоны характеризуются доменом winged helix, а не доменом histone fold, и связываются с линкерной ДНК, разделяющей нуклеосомы (Wolffe, 1992). Хотя существуют минорные варианты этих канонических гистонов, они оказываются взаимозаменимыми с основной формой. Например, Н3.1 и Н3.2 различаются одной аминокислотой, и не известно, чтобы это придавало разные биологические свойства этим двум изоформам. Существование множественных генов, производящих большие количества канонических гистонов для откладки в фазе S, является типичным для эукариотических геномов. Почти повсеместная встречаемость и подавляющее изобилие канонических S-фазных гистонов привело к тому, что до последнего времени вариантам гистонов уделяли относительно мало внимания. Возрождение интереса к вариантам гистонов явилось отчасти результатом осознания, что они отличаются от канонических S-фазных гистонов таким образом, что это может приводить к глубокой дифференцировке хроматина. Одно из различий между ними — различие в способе их включения в хроматин. RC-сборка вставляет новые нуклеосомы в бреши между старыми нуклеосомами по всему геному, тогда как RI-сборка связана с локальным замещением существующей нуклеосомы или субъединицы (Marzluff et al., 2002). Поэтому RI-сборка потенциально способна переключать состояние хроматина путем замещения канонического гистона его вариантом. Замещение одного гистона другим могло бы также стирать или изменять паттерн посттрансляционных модификаций. Следовательно, RI-сборка потенциально способна «перезагружать» эпигенетические состояния, которые, как полагают, опосредуются гистонами и их модификациями. Недавние успехи в изучении вариантов гистонов и процессов, с помощью которых они откладываются, привели к углублению наших представлений об основах эпигенетической наследственности и ремоделинга. Ниже мы обсудим особенности конкретных вариантов гистонов, обусловливающие их вклад в дифференцировку хроматина и, возможно, связанные с воспроизведением эпигенетической информации.5. Центромеры идентифицируются специальным вариантом H3
Определяющей особенностью эукариотической хромосомы является центромера, которая служит местом прикрепления микротрубочек веретена во время митоза. Первыми центромерами, описанными на молекулярном уровне, были центромеры почкующихся дрожжей (Saccharomyces cerevisiae), где последовательность длиной 125 п.о. необходима и достаточна для формирования центромеры (Amor et al., 2004а). Однако центромеры растений и животных очень различаются, состоя, как правило, из мегабазных порядков коротких тандемных повторов. В отличие от ситуации с почкующимися дрожжами роль нуклеотидной последовательности ДНК в этих сложных центромерах неясна, поскольку известно, что полностью функциональные неоцентромеры образуются у человека спонтанно в эктопических сайтах, полностью лишенных последовательностей, похожих на центромерные повторы (рис. 13.4). Эти и другие наблюдения говорят против прямой роли последовательности ДНК в определении локализации центромер (глава 6) Ключевое проникновение в идентичность и наследование центромер пришло в результате идентификации варианта гистона H3, CENP-A (рисунок в начале главы). который оказался специфически локализованным в центромерах и включенным в нуклеосомные частицы вместо самого H3 (Palmer et al., 1991). Замечательно, что CENP-A остается связанным с центромерами при переходе от гистонов к протаминам во время сперматогенеза, когда, в сущности, все другие гистоны утрачиваются (Palmer et al., 1990). Это раннее наблюдение в исследовании CENP-A позволяет предполагать, что CENP-A вносит вклад в центромерную идентичность мужского генома. Общее значение этого факта не было полностью оценено, пока не осознали, что CENP-A является гораздо более хорошим маркером для центромер, чем нуклеотидная последовательность ДНК (Armor et al., 2004а), и что аналоги CENP-A можно найти в геномах всех эукариот (рис. 13.5) (Malik and Henikoff, 2003). Таким образом, хотя центромеры почкующихся дрожжей определяются по консенсусной последовательности длиной 125 п.о., это также сайт центромерной нуклеосомы, который содержит вариант Cse4 центромерного H3 (CenH3). У дробянковых дрожжей (Schizosaccharomyces pombe) группа содержащих CenH3 нуклеосом занимает центральный коровый район центромеры, фланкированный содержащими H3 нуклеосомами, обнаруживающими характерные черты гетерохроматина (Armor et al., 2004а). У мух и позвоночных CenH3s присутствуют в виде порядков [arrays], чередующихся с содержащими H3 порядками, которые демонстрируют уникальный паттерн модификаций гистонов (Sullivan and Karpen, 2004). Чередование может объяснять тот факт, что центромеры занимают лишь внешний край центромерной перетяжки метафазных хромосом (рисунок в начале главы) Это согласуется с наблюдением, что у «голокинетических» хромосом червей микротрубочки прикрепляются по всей длине каждой анафазной хромосомы, а CenH3 занимает ведущий край по всей ее длине (рис. 13.5, справа) (Malik and Henikoff, 2003). Действительно, оказалось,что уникальный вариант CenH3 точно маркирует центромеру у всех изученных в этом отношении эукариот. Эта очевидная повсеместность и присутствие центромер для осуществления митоза у всех эукариот указывает на возможность происхождения первого канонического H3 из CenH3. Рис. 13.4. Неоцентромеры человека (указаны стрелками) лишены центромерной ?-сателлитной ДНК, но имеют CENP-A и гетерохроматин
AHTH-CENP-A-окрашивание зеленым цветом и анти-CENP-B-окрашивание красным цветом (который маркирует ?-сателлитную ДНК) идентифицируют неоцентромеру хромосомы 4, которая лишена ?-сателлита (основная часть рисунка) Эта хромосома 4 в остальных отношениях нормальна и передавалась на протяжении, по крайней мере, трех мейотических поколений нормальных особей Врезка изображает анти-НР1-окрашивание, которое показывает, что несмотря на отсутствие сателлитной ДНК гетерохроматин формируются вокруг активных неоцентромер. (Перепечатано, с любезного разрешения, из: Armor et al., 2004b [©National Academy of Sciences])
Рис. 13.4. Неоцентромеры человека (указаны стрелками) лишены центромерной ?-сателлитной ДНК, но имеют CENP-A и гетерохроматин
AHTH-CENP-A-окрашивание зеленым цветом и анти-CENP-B-окрашивание красным цветом (который маркирует ?-сателлитную ДНК) идентифицируют неоцентромеру хромосомы 4, которая лишена ?-сателлита (основная часть рисунка) Эта хромосома 4 в остальных отношениях нормальна и передавалась на протяжении, по крайней мере, трех мейотических поколений нормальных особей Врезка изображает анти-НР1-окрашивание, которое показывает, что несмотря на отсутствие сателлитной ДНК гетерохроматин формируются вокруг активных неоцентромер. (Перепечатано, с любезного разрешения, из: Armor et al., 2004b [©National Academy of Sciences])
Генетические эксперименты на разных эукариотах подтвердили существенное значение CenH3 для формирования кинетохора и для расхождения хромосом (Amor et al., 2004а). Поскольку CenH3-содержащие нуклеосомы остаются на месте на протяжении всего клеточного цикла, они образуют фундамент для сборки других кинетохорных белков во время митоза и мейоза (глава 6). Чрезвычайно важным вопросом в исследованиях хромосом является вопрос о том, каким именно образом эти белки взаимодействуют, с тем чтобы обеспечить сцепление между центромерой и микротрубочками веретена, которое может противостоять сильным тянущим силам, прилагаемым к кинетохорам в анафазе. У дрожжей были идентифицированы несколько десятков специфичных для кинетохора белков (дополнительные детали см. в главе 6), хотя то, каким образом они взаимодействуют с содержащими CenH3 нуклеосомами и другими базовыми белками, такими как CENP-C, в настоящее время неизвестно. Еще одним вызовом является расшифровка процесса сборки CenH3 в нуклеосомы Тот факт, что центромеры составляют такую маленькую долю всего хроматина, затруднило биохимические подходы к этой замечательной проблеме, но мы надеемся, что совершенствующиеся технологии приведут к лучшему пониманию структуры и динамики кинетохор.
 Рис. 13.5. Центромерные варианты H3 у модельных эукариот
(Слева) Хромосома человека, окрашенная антителами против специфичного для центромеры варианта гистона H3, CENP-A (зеленый цвет), и анти-CENP-B (красный цвет), маркирующий ?-сателлитную ДНК (любезно предоставлено Peter Warburton). (В центре) У Drosophila melanogaster анти-CenH3-антитела (красный цвет) окрашивают центромеры в метафазных хромосомах и на протяжении всей интерфазы (любезно предоставлено SusoPlatero). (Справа) У Caenorhabditis elegans анти-CenH3-антитела (зеленый цвет) окрашивают расположенные «конец в конец» голоцентромеры профазных хромосом (красный цвет) (любезно предоставлено Landon Moore)
Рис. 13.5. Центромерные варианты H3 у модельных эукариот
(Слева) Хромосома человека, окрашенная антителами против специфичного для центромеры варианта гистона H3, CENP-A (зеленый цвет), и анти-CENP-B (красный цвет), маркирующий ?-сателлитную ДНК (любезно предоставлено Peter Warburton). (В центре) У Drosophila melanogaster анти-CenH3-антитела (красный цвет) окрашивают центромеры в метафазных хромосомах и на протяжении всей интерфазы (любезно предоставлено SusoPlatero). (Справа) У Caenorhabditis elegans анти-CenH3-антитела (зеленый цвет) окрашивают расположенные «конец в конец» голоцентромеры профазных хромосом (красный цвет) (любезно предоставлено Landon Moore)
Эволюция CenH3s не похожа на эволюцию гистонов любого другого класса. В то время как гистон H3 инвариантен по последовательности, что отражает действие чрезвычайно сильного очищающего отбора на каждый остаток, CenH3s эволюируют быстро, особенно в линиях растений и животных (Malik and Henikoff, 2003). Наиболее очевидным образом это демонстрируют аминотерминальные «хвосты», которые различаются по длине и последовательности до такой степени, что становится невозможным выравнивание CenH3s разных таксономических групп. Даже домен histone fold в CenH3 эволюирует на порядки быстрее, чем такой же домен H3. Какова же причина этого разительного эволюционного различия между H3, который функционирует в центромерах, и H3, который функционирует в других местах? Быстро эволюирующие участки генов CenH3 Drosophila и Arabidopsis обнаруживают избыток нуклеотидных замен типа replacement nucleotide substitutions по сравнению с тем, что можно было бы ожидать исходя из скорости синонимических замен (Malik and Henikoff, 2003). Этот избыток — признак адаптивной эволюции. Адаптивная эволюция у растений и животных видна также по еще одному главному центромерному фундаментальному белку [major centromere foundation protein], CENP-C (Talbert et al., 2004). Хотя адаптивная эволюция хорошо документирована для генов, участвующих в генетических конфликтах (таких, как «гонка вооружений» между хозяином и паразитом), эти гены являются единственными известными существенными однокопийными генами, адаптивно эволюционирующими у любого организма. В случае CenH3 и CENP-C участки адаптивной эволюции соответствуют участкам связывания и «нацеливания» на ДНК Это позволяет предполагать, что главные связывающиеся с центромерой белки адаптируются к эволюирующей центромерной ДНК, давая, таким образом, центромерному хроматину возможность взаимодействовать с консервативной кинетохорной машинерией, связывающей центромеру с микротрубочками веретена. Было высказано предположение, что центромеры конкурируют в ходе женского мейоза за включение в ядро яйцеклетки, чтобы не быть утраченными в составе полярных телец (Talbert et al., 2004). Возникла бы «гонка вооружений», ведущая к экспансии центромер, вероятно путем неравного кроссинговера между сестринскими хроматидами. Подавление хозяином этого процесса мейотического драйва с помощью CenH3 и CENP-C приводило бы к избытку изменений типа замен в участках, взаимодействующих с ДНК. Организмы, для центромер которых нет возможности конкурировать, таких как почкующиеся дрожжи, не подвергались бы центромерному драйву, и это могло бы объяснить тот факт, что у них маленькие центромеры и их белки CenH3 и CENP-C находятся под действием сильного очищающего отбора Таким образом, мы видим, что специальный район генома, центромера, отличается одним классом вариантов гистонов, последовательности которых обнаруживают остатки «гонки вооружений», которая могла привести к чрезвычайной сложности центромер. Процесс RI-сборки, в каждом клеточном цикле «нацеливающий» новые нуклеосомы, содержащие CenH3, на центромеры, остается неизвестным (Amor et al., 2004а). Центромерные нуклеосомы демонстрируют примечательное отсутствие специфичности по последовательности в том, что они не только могут надежно локализоваться на неоцентромерах, которые совершенно непохожи на нативные центромеры (рис. 13.4), но и в том, что дрожжевой гомолог Cse4 может функционально замещать CENP-A человека (Wieland et al., 2004) (ни один из них не является адаптивно эволюирующим; Talbert et al., 2004). Удивительно, что наши центромеры оставались в тех же самых положениях десятки миллионов лет без каких-либо очевидных детерминантов в виде специфических последовательностей, участвующих в поддерживающем их процессе. В той мере, в какой шигенетика означает наследственность, не зависящую от нуклеотидных последовательностей ДНК, наследование центромер в масштабах геологического времени является наиболее крайней формой, какую только можно себе представить. Тем не менее, мы все еще ищем механизм, чтобы объяснить, каким образом они поддерживают себя на протяжении даже одного клеточного цикла (дальнейшее обсуждение этой темы см. в главе 14).
6. Замещение гистоновым вариантом H3.3 обнаруживается в активном хроматине
Полагают, что транскрипционно активный хроматин, подобно центромерам, поддерживается эпигенетически и, подобно центромерам, активный хроматин обогащен вариантом гистона H3, называемым H3.3 (Henikoff and Ahmad, 2005). H3.3 очень похож по последовательности на канонические формы H3, отличаясь лишь четырьмя аминокислотами. При таких маленьких различиях можно было бы предположить, что эти две формы взаимозаменяемы. Однако у Drosophila H3.3 откладывается путем либо RC-, либо RI-сборки, тогда как H3 откладывается толко в репликационных фокусах RC-способом. Это различие между двумя вариантами закодировано в самом белке, причем три из четырех различий между H3 и H3.3 явно участвуют в предотвращении откладки H3 по способу RI (в ?-спирали 2, рис. 13.2). Очистка растворимых комплексов сборки у человека подтвердила, что эти две формы участвуют в разных процессах сборки: Н3.1 выделялся совместно с CAF-1 для RC-сборки, а H3.3 выделялся вместе с другими компонентами, в том числе с HirA, и участвовал в RI-сборке. Хотя различия по четырем аминокислотам могли бы показаться практически несущественными, но если учесть, что человек, мухи и двустворчатые моллюски обладают H3.3, имеющими в точности одинаковую последовательность. эти отличия от H3 становятся заметными. Филогенетический анализ показывает, что пара H3/H3.3 возникала в разное время в ходе эволюции эукариот по меньшей мере четыре раза: у растений, у животных/грибов, у инфузорий и у Apicomplexa (Malik and Henikoff, 2003). Несмотря на отдельное происхождение от животных и грибов, пара H3/H3.3 животных и пара от растений (называемая Н3.1 [RC] и Н3.2 [RI] — во избежание путаницы мы обозначаем все изоформы RC как H3. а все изоформы RI как H3.3) поразительно похожи друг на друга. Один и тот же кластер аминокислот (позиции 87—90, который препятствует отложению H3 по RI-типу у Drosophila, оказался отличающимся у растений, и другое различие у животных (в позиции 31 находится Аа у H3 и либо Ser, либо Thr у H3.3) также обнаруживается у растений. Грибы особенно интересны. Исходно [ancestrally] они имеют и H3, и H3.3; однако аскомицеты, к которым относятся дрожжи и плесневые грибы, утратили форму H3. Таким образом, облигатная RC-форма гистона H3, привлекшая наибольшее внимание у животных, даже не присутствует у дрожжей. Исследования H3.3 в основной массе хроматина показали, что активные фракции обогащены им (Henikoff and Ahmad, 2005). Однако разнообразные факторы вносили свой вклад в ситуацию неопределенности с этой потенциальной «меткой» активного хроматина во времена великого возбуждения в хроматиновой области, когда осознали, что модификации гистонов могут отличать активный хроматин от «молчащего». Прежде всего, отсутствовали какие-либо антитела, которые могли бы эффективно отличать H3 от H3.3 в хроматине (позиции 87—90 блокированы спиралями ДНК в нуклеосоме), тогда как превосходные антитела против многих посттрансляционных модификаций были легко доступными. Кроме того, различия по последовательности между H3 и H3.3, казавшиеся незначительными, не предполагали каких-либо фундаментальных различий в хроматине, тогда как модификации гистонов были главным образом по лизинам «хвостов», о которых было известно, что они влияют на взаимодействия хроматина или связывают ассоциированные с хроматином белки. Ощущение, что эти две формы гистона 3 должны быть взаимозаменяемыми, получило подтверждение в открытой у Tetrahyтепа возможности замены S-фазной формой гистона ее замещающего аналога. Наконец, влиятельная гипотеза «гистонового кода» представляла нуклеосомы как фиксированные мишени модификационных ферментов во время дифференцировки хроматина (Jenuwein and Allis, 2001). Однако становилось все более и более очевидным, что хроматин является высокодинамичным, и даже ассоциированные с гетерохроматином белки связываются с местами своего нахождения на минуты или даже менее (Phair et al., 2004). Оказывается, хроматин активно транскрибируемых генов находится в состоянии постоянного изменения, характеризующемся непрерывным замещением гистонов (Henikoff and Ahmad, 2005). Три коровых различия, отличающие H3 от H3.3, делают димеры H3.3•Н4 субстратом для RI-сборки, и сама по себе RI-сборка глубоко изменяет хроматин. В результате этого процесса активно транскрибируемые участки становятся маркированными H3.3 (рис. 13.6), и доказательства в пользу этого процесса следуют из наблюдения RI-замещения H3, метилированного по лизину 9 (H3K9me) меченым H3.3 [with tagged H3.3] в транскрибируемых PH К-полимеразами I и II (pol I и II) локусах (Schwartz and Ahmad, 2005). Результатом динамичной природы хроматина в активных локусах является стирание предсуществовавших модификаций гистонов. Этим обеспечивается потенциальное решение вопроса о том, каким образом «молчащий» хроматин может становиться активированным, когда он гиперметилирован по H3K9 и H3K27 (модификации гистонов, обычно ассоциированные с репрессивным хроматином). Исследования временной динамики показали, что метилы на гистонах столь же стабильны, как и сами гистоны (Waterborg, 1993), хотя недавнее открытие деметил азы, специфичной для моно- и диметилированного H3K4 (Shi et al., 2004), показывает, что некоторые метальные группы могут энзиматически удаляться с гистонов. В целом, паттерны ковалентных модификаций гистонов могли бы быть результатом модификаций, уже присутствующих на гистонах в то время, когда они откладываются. Таким путем модифицирующие ферменты шли бы по уже проложенному следу вместе с машиной сборки, возможно облегчая этот процесс (Henikoff and Ahmad, 2005). Рис. 13.6. H3.3 предпочтительно локализуется в активно транскрибируемых участках политенных хромосом Drosophila
Окрашивание DAPI (красный цвет) показывает паттерн бэндинга ДНК (слева), и H3.3-GFR (зеленый цвет) локализуется в междисковых промежутках (средняя часть), которые являются сайтами локализации РНК-полимеразы II. Правая часть рисунка — совмещение (перепечатано из: Schwartz and Ahmad, 2005)
Рис. 13.6. H3.3 предпочтительно локализуется в активно транскрибируемых участках политенных хромосом Drosophila
Окрашивание DAPI (красный цвет) показывает паттерн бэндинга ДНК (слева), и H3.3-GFR (зеленый цвет) локализуется в междисковых промежутках (средняя часть), которые являются сайтами локализации РНК-полимеразы II. Правая часть рисунка — совмещение (перепечатано из: Schwartz and Ahmad, 2005)
Эта модель динамической сборки предсказывает, что модификациями гистонов, которыми обогащен активный хроматин, должен быть обогащен и H3.3, и большинство измерений модификаций в H3 и H3.3 показали, что так оно и есть и у растений, и у животных. Более того, на основании этой модели ожидается, что активные модификации лизинов, такие как ацетилирование H3 и Н4 и метилирование H3K4 и H3K79, будут сильно коррелировать друг с другом, как наблюдалось в разных системах (O’Neill et al., 2003: Kurdistani et al., 2004; Schubeler et al., 2004). Наконец, динамическая RI-сборка в активных генах может объяснить, почему мутации CAF-1 вызывают утрату сайленсинга (Loyola and Almouzni, 2004): считается, что лишь около 10 % генома дрожжей находится в «молчащем» состоянии, и это, возможно, единственный хроматин, который не замещается динамически в геноме дрожжей. В отсутствие опосредуемой CAF-1 RC-сборки RI-сборка происходила бы по всему геному дрожжей, активируя прежде «молчащие» районы. Возможно, существование варианта H3, предназначенного для RC-сборки у многоклеточных эукариот, является адаптацией для удержания подавляющей части хроматина клетки в эпигенетически «молчащем» состоянии Замещение дифференциально модифицированными димерами H3.3•Н4 позволяет предложить простую модель наследования активного хроматина у делящихся клеток (Henikoff and Ahmad, 2005). Активный хроматин оставался бы активным после разбавления обычными нуклеосомами после RC-сборки, если эта случайная смесь RI-отложенных и RC-отложенных нуклеосом не мешает таким активным процессам, как транскрипционная инициация и элонгация. Продолжение транскрипционной активности в результате восстанавливало бы хроматин в следующем клеточном цикле, приводя к постоянному поддержанию активного хроматина на протяжении всего развития. Возможность того, что вариант гистона постоянно поддерживается процессом RI-сборки, может относиться и к CenH3s, которые вставлялись бы в бреши, создаваемые «развертыванием» обычных нуклеосом в результате анафазного натяжения. Когда клетки выходят из клеточного цикла и дифференцируются, они больше не продуцируют и не включают S-фазные гистоны, и в результате накапливается H3.3. Например, H3.3 накапливается в мозге крыс до уровня, составляющего 87 % от уровня гистона H3, ко времени достижения крысами 400-дневного возраста (Henikoff and Ahmad, 2005). Имеет ли это градуальное замещение хроматина какое-нибудь функциональное значение или не имеет — неизвестно. Неизвестно также, является ли активный процесс, делающий возможным замещение, тем же самым, что и процесс, наблюдаемый в транскрипционно активных локусах Одна из возможностей заключается в том, что разрушение хроматина проходящей РНК-полимеразой или машиной ремоделинга хроматина вызывает локальное развертывание нуклеосомы и случайную утрату димера H3.3•Н4 (рис. 13.7). Это сопровождалось бы воссозданием [reassembly] нуклеосомы вслед за полимеразой с замещением утраченного димера димером H3.3•Н4 с помощью комплекса HirA. Лишь тогда, когда полимеразы упакованы слишком плотно для осуществления сборки, нуклеосомы полностью развертываются [unravel].
7. Фосфорилирование Н2АХ функционирует в репарации двунитевых разрывов ДНК
Гистоны Н2А также образуют семейство разных вариантов, обнаруживаемых у всех эукариот. Вариант Н2АХ определяется по присутствию мотива карбокситерминальной аминокислотной последовательности, SQ(E или D)?, где ? означает гидрофобную аминокислоту. Серии в этой последовательности-мотиве является сайтом фосфорилирования, продуцируя модифицированный белок, обозначаемый «?-Н2АХ». Динамическая природа хроматина и фосфорилирование Н2АХ особенно очевидны, когда в ДНК возникают двунитевые (ds, double-stranded) разрывы (Morrison and Shen, 2005). Летальность даже одиночного двунитевого разрыва требует немедленных действий по репарации повреждения и восстановления непрерывности двойной спирали. Обнаружение ds-разрыва в норме происходит в пределах минуты или около того с момента его образования, и это, в свою очередь, включает быстрое фосфорилирование Н2АХ в непосредственной близости от сайта разрыва. Это фосфорилирование выполняется членами семейства фосфоинозитол 3-киназоподобных киназ. Вслед за этим первоначальным событием фосфорилирование Н2АХ быстро распространяется вдоль по хромосоме, маркируя относительно большой хроматиновый домен, окружающий этот разрыв. Наконец, этот ds-разрыв в конце концов репарируется либо путем гомологичной рекомбинации, либо негомологичным воссоединением концов [nonhomologous end-joining], и метка-фосфорилирование удаляется. Рис. 13.7. Модель независимого от репликации замещения или обмена
Большая молекулярная машина (либо комплекс SWR1, либо РНК-полимераза II) частично или полностью расвертывает нуклеосому во время своего прохождения. Результатом этого оказывается либо сохранение гетеродимерных субъединиц, как, например, облегчаемый FACT перенос Н2А•Н2В из положения перед РНК-полимеразой в положение позади нее (Formosa et al. 2002; Belotserkovskaya et al. 2003), либо утрата гетеродимера. В последнем случае процесс репарации хроматина заменяет утраченный гетеродимер либо H2AZ•Н2В (верхняя часть рисунка), либо Н3.3•Н4 (нижняя часть рисунка)
Рис. 13.7. Модель независимого от репликации замещения или обмена
Большая молекулярная машина (либо комплекс SWR1, либо РНК-полимераза II) частично или полностью расвертывает нуклеосому во время своего прохождения. Результатом этого оказывается либо сохранение гетеродимерных субъединиц, как, например, облегчаемый FACT перенос Н2А•Н2В из положения перед РНК-полимеразой в положение позади нее (Formosa et al. 2002; Belotserkovskaya et al. 2003), либо утрата гетеродимера. В последнем случае процесс репарации хроматина заменяет утраченный гетеродимер либо H2AZ•Н2В (верхняя часть рисунка), либо Н3.3•Н4 (нижняя часть рисунка)
Фосфорилирование Н2АХ не является существенным для обнаружения или репарации ds-разрывов, потому что делеция гена или мутация «мишени» — серинового остатка не отменяет репарацию. Однако Н2АХ не просто маркер повреждения, поскольку такие мутанты уменьшили эффективность репарации и являются гиперчувствительными к радиационному повреждению и генотоксическим агентам. В настоящее время полагают, что Н2АХ функционирует в процессе репарации ds-разрывов по крайней мере двумя способами. Во-первых, он может помогать рекрутировать или сохранять белки, требующиеся для репарации в сайте разрыва (Morrison and Shen, 2005). Во-вторых, он может стабилизировать хромосому, окружая разорванные концы, путем рекрутирования когезина, белкового комплекса, ответственного за удерживание вместе сестринских хроматид (Lowndes and Toh, 2005). Эволюция Н2АХ не похожа на эволюцию других вариантов гистонов. Хотя ген Н2АХ обнаружен почти у всех эукариот, он возникал неоднократно в относительно недавнее время (Malik and Henikoff, 2003). Например, версия Н2АХ, обнаруженная у Drosophila, отличается от версии, обнаруживаемой у другого двукрылого насекомого, Anopheles Предположительно, способность развивать новый Н2АХ из канонической формы Н2А является следствием простого мотива SQ(E или D)©. Ожидается, что развитие такого мотива на карбоксильном конце канонического Н2А происходило неоднократно в ходе эволюции. Случайная утрата существующего Н2АХ с вновь отчеканенной версией могла бы подпитываться необходимостью для Н2АХ быть очень однородно распределенным, потому что ds-разрывы могут происходить в любом месте генома. Если в существующем гене Н2АХ происходят мутации, уменьшающие его сходство с каноническим Н2А таким образом, что его сборка становится менее эффективной или однородной, возникнет сильное давление отбора, чтобы заместить его версией, которая более похожа на канонический Н2А. Эта логика могла бы помочь объяснить исключительный случай Н2Ах Drosophila, который, в отличие от других эукариот, происходит не от своего канонического Н2А, а, скорее, от удаленной линии H2AZ (описываемой ниже). Если все, что нужно, чтобы быть Н2АХ — это находиться в положении Н2А в нуклеосоме и иметь карбокситерминальный мотив для фосфорилирования, H2AZ может развить в себе эти способности.
 Рис. 13.8. Стадия пахитены сперматогенеза, показывающая зависимость формирования полового тельца от Н2АХ
В нормальных сперматоцитах млекопитающих видно, что ядерная структура, называемая половым тельцем (стрелка, помечено зеленым цветом на правых рисунках), охватывает неспаренный бивалент XY (помечен на левых рисунках). Синаптонемный комплекс, выравнивающий спаренные хромосомы, окрашен в красный цвет. Половое тельце в норме обогащено Н2АХ (Н2АХ+/+). В сперматоцитах Н2АХ-/- половое тельце не образуется, и эпитоп полового тельца становится диспергированным по аутосомам (нижний правый рисунок). Масштабная линейка = 10 мкм. Фотографии любезно предоставлены Shantha Mahadevaiah и Paul Burgoyne (Fernandez-Capetillo et al., 2003)
Рис. 13.8. Стадия пахитены сперматогенеза, показывающая зависимость формирования полового тельца от Н2АХ
В нормальных сперматоцитах млекопитающих видно, что ядерная структура, называемая половым тельцем (стрелка, помечено зеленым цветом на правых рисунках), охватывает неспаренный бивалент XY (помечен на левых рисунках). Синаптонемный комплекс, выравнивающий спаренные хромосомы, окрашен в красный цвет. Половое тельце в норме обогащено Н2АХ (Н2АХ+/+). В сперматоцитах Н2АХ-/- половое тельце не образуется, и эпитоп полового тельца становится диспергированным по аутосомам (нижний правый рисунок). Масштабная линейка = 10 мкм. Фотографии любезно предоставлены Shantha Mahadevaiah и Paul Burgoyne (Fernandez-Capetillo et al., 2003)
Репарация ds-разрывов представляет собой несомненно универсальную функцию фосфорилирования Н2АХ, и, казалось бы, у этого процесса нет никакого стабильного эпигенетического аспекта. Однако мыши с нуль-мутацией по Н2АХ стерильны, и цитологическое изучение сперматогенеза млекопитающих выявило яркую эпигенетическую особенность — специфическое фосфорилирование Н2АХ на биваленте XY (рис. 13.8) (Femandez-Capetillo et al., 2003). Эта хромосомная пара занимает отдельное «половое тельце» во время мейотической профазы, предположительно участвующее в сайленсинге сцепленных с полом генов во время мужского мейоза. Фосфорилирование Н2АХ играет существенную роль в формировании нормального полового тельца, и дефектные по Н2АХ сперматоциты не способны спариваться или конденсироваться и не могут инактивировать гены X и Y во время мейоза. Фосфорилирование Н2АХ бивалента XY отличается от процесса, происходящего в ds-разрывах. Фосфорилирование XY в половом тельце не требует разрывов; скорее, оно происходит наиболее заметным образом в неспаренных участках хромосом. Механизмы, посредством которых фосфорилирование Н2АХ «нацеливается» на неспаренные хромосомы, и то, как это событие приводит к конденсации, спариванию и сайленсингу, в настоящее время неизвестны. Однако интересно пофантазировать, что эта роль может иметь отношение к способности взаимодействовать с когезином и рекрутировать его.
8. H2AZ играет роль в регулировании транскрипции
Возрождение интереса к вариантам гистонов оказалось особенно мощным в случае H2AZ (или H2A.Z) (Karnakaka and Biggins, 2005). H2AZ почти повсеместен; он дивергировал от анцестрального Н2А на ранних этапах эволюции эукариот. В соответствии с этимотдельным происхождением генетические эксперименты с почкующимися дрожжами и мухами показали, что гистоны Н2А и H2AZ возникли для выполнения отдельных, неперекрывающихся функций. H2AZ является необходимым гистоном у большинства организмов, от ресничных простейших до млекопитающих. Однако почкующихся и дробянковых дрожжей делеция гена H2AZ дает жизнеспособные клетки, хотя эти нуль-мутанты обладают разнообразными фенотипами. Эти свойства облегчили его генетическую и биохимическую характеристику у дрожжей. У большинства протестированных на сегодня организмов H2AZ составляет приблизительно 10 % от общего белка Н2А. Он широко, но не однородно распределен по всем хромосомам. Это наиболее элегантно выглядит в случае политенных хромосом Drosophila, где он образует отчетливый паттерн бэндинга. Результаты опытов по иммунопреципитации хроматина с использованием дрожжевых и мышиных клеток согласуются с этим паттерном. Хотя H2AZ преимущественно локализуется в промоторных участках генов дрожжей, эта специфичность не соблюдается для всех сайтов его откладки. У Drosophila сколько-нибудь различимая связь между локализацией H2AZ и экспрессией генов отсутствует. Таким образом, хотя механизм откладки H2AZ известен (обсуждается ниже), правила, определяющие места его концентрации, в настоящее время неясны. Ряд наблюдений указывают на важную роль в регулировании экспрессии генов (Kamakaka and Biggins, 2005). Мутационный анализ почкующихся дрожжей показал, что функция H2AZ частично является избыточной с двумя разными классами глобальных транскрипционных факторов, комплексом ремоделинга нуклеосом, Swi/Snf, и комплексом модификации гистонов, SAGA. Хотя утрата по отдельности функции H2AZ, Swi/Snf или SAGA не лишает клетку жизнеспособности, одновременная потеря любой комбинации двух путей детальна. Дополнительные генетические и биохимические эксперименты позволяют предположить, что эта роль включает и функции как в инициации, так и в элонгации транскрипции (дополнительные детали см. в главе 10). Более того, баланс откладки H2AZ причинно связан с эпигенетикой через его роль как фактора антисайленсинга Делеция гена H2AZ приводит к экстенсивному распространению «молчащего» хроматина внутрь от теломер, и этот дефект может быть подавлен дополнительной делецией генов, кодирующих сами факторы сайленсинга (рис. 4.7). Влияние делетирования H2AZ на глобальную экспрессию генов было протестировано с помощью микрочипов дрожжевых генов. Хотя большинство регулируемых генов обнаруживают пониженную экспрессию в нуль-мутантах по H2AZ, существенная доля их демонстрирует увеличение экспрессии. Поскольку все еще не ясно, какие изменения отражают прямую регуляцию, а какие — косвенную, возможно, что нуклеосомы H2AZ функционируют как позитивно, так и негативно в регулировании транскрипции генов. Более того, неизвестно, лежит ли в основе этих разнообразных ролей H2AZ в транскрипции и гетерохроматине один унифицирующий механизм или же более сложное сочетание разных путей. В противоположность современной картине, полученной для почкующихся дрожжей, в клетках млекопитающих H2AZ предпочтительно локализуется в гетерохроматиновых участках. Действительно, было показано, что он физически взаимодействует с белком НР1 (Heterochromatin associated Protein 1) (Fan et al., 2004). Хотя это могло бы наводить на мысль о возможной роли H2AZ в сайленсинге у многоклеточных животных, следует отметить, что у Drosophila подгруппа экспрессируемых генов, локализованных в гетерохроматине, действительно нуждается в НР1 для экспрессии (Weiler and Wakimoto, 1995). Если локализация H2AZ в клетках млекопитающих отражает аналогичный процесс, тогда четко установленные роли этого варианта в облегчении транскрипции и противодействии сайленсингу у дрожжей вероятно отражали бы общие фундаментальные свойства этого варианта. H2AZ может играть еще одну роль в эпигенетике расхождения хромосом. Одним из первых фенотипов, обнаруженных у нуль-мутантов по H2AZ, был дефект расхождения хромосом в митозе, наблюдавшийся у дробянковых дрожжей. Последующие эксперименты сделали эту связь более очевидной. Экспериментальная делеция H2AZ в клетках млекопитающих с помощью РНК-интерференции (RNAi) вызывает дефекты в перицентрической ассоциации НР1, нестабильность генома и нарушения в сегрегации хромосом (Kamakaka and Briggins, 2005). Аналогичным образом, у почкующихся дрожжей нуль-мутанты по H2AZ обнаруживают повышенную частоту потери хромосом в митозе и существенные генетические взаимодействия с генами, кодирующими известные компоненты центромеры и митотического веретена (Krogan et al., 2004). Остается формально возможным, что влияние H2AZ на расхождение хромосом является косвенным следствием его роли в установке программы транскрипции генов. Однако интригующая гипотеза заключается в том, что механизмы расхождения хромосом эволюционировали таким образом, чтобы использовать не только вариант H3, но и вариант Н2А. Каким образом H2AZ влияет на транскрипционную компетентность, сайленсинг, гетерохроматин и, возможно, сегрегацию хромосом? Структура содержащей H2AZ нуклеосомы, полученная с высоким разрешением, позволяет выявить несколько уникальных свойств этого варианта (Suto et al., 2000). По сравнению с нуклеосомами Н2А H2AZ обладает расширенным кислотным пэтч-доменом на поверхности нуклеосомы, и это отличие, вероятно, имеет функциональное значение. Например, у Drosophila именно часть «докинг-домена» («docking domain») (рис. 13.2) взаимодействует с гистоном Н4 и определяет сегмент, существенный для функции. Далее, результаты мутационных исследований и экспериментов по связыванию in vitro свидетельствуют о том, что этот расширенный кислотный пэтч вносит основной вклад во взаимодействие нуклеосомы с НР1 (Dryhurst et al., 2004). Интересно, что НР1 содержит хромодомен, белковый мотив, который может связываться с H3, метилированным по лизину 9 (главы 3 и 4). Таким образом, Н2А2может действовать совместно с метилированием гистона H3, обеспечивая ассоциированным с хроматином белкам платформу для связывания. В дополнение к своему расширенному кислотному пэтчу H2AZ имеет пару остатков гистидина, координирующих дополнительный ион металла в этой структуре, который, in vivo, мог бы обеспечивать уникальный физиологический ответ, недоступный нуклеосомам, содержащим Н2А. Наконец, кристаллическая структура позволяет предсказать, что асимметричный гистоновый октамер, состоящий из одного главного димера Н2А•Н2В плюс одного вариантного димера H2AZ•Н2В, создавал бы конфликт белковых структур в петле 1 (рис. 13.2) и, по-видимому, вряд ли происходит in vivo. В совокупности эти новые особенности нуклеосом H2AZ свидетельствуют в пользу того, что этот вариант должен придавать хроматину уникальные физические свойства. Это предсказание подтверждается экспериментально. Например, H2AZ может стабилизировать димертетрамерные взаимодействия в нуклеосоме, и порядки нуклеосом, составленных из нуклеосом H2AZ, могут обнаруживать усиленное сворачивание более высокого порядка и уменьшенную межмолекулярную агрегацию (Dryhurst et al., 2004). Таким образом, H2AZ, вероятно, модулирует функцию хроматина по меньшей мере тремя различными способами. Во-первых, он несомненно изменяет физические свойства своего хроматинового окружения, влияя таким образом на доступность или активность trans-действующих факторов. Во-вторых, как и в случае с другими гистонами, посттрансляционные модификации в его аминотерминальном и карбокситерминальном доменах, вероятно, обеспечивают уникальные docking-сайты для ассоциированных с хроматином белков (так называемые эффекты, с которыми мы познакомились в главе 3), или регулируемые изменения в плотности заряда (cis-эффекты). В-третьих, его ограниченная и специфическая откладка в хроматине, вероятно, «нацеливает» уникальные функции на специфические локусы.9. Белковые комплексы для откладки и замещения вариантов Н2А
Хотя все еще остаются важные вопросы относительно того, как варианты гистона Н2А функционируют, недавние исследования выяснили основу их включения в хроматин. Первый прорыв совершился, когда был биохимически очищен комплекс, катализирующий перенос димеров Н2А•Н2В в хроматин (Sarma and Reinberg, 2005). Этот мультисубъединичный комплекс, названный SWR1-C, содержит в качестве каталитической субъединицы белок Swrl, член семейства SWI/SNF FNA-зависимых ремоделеров хроматина. In vivo SWR1 -С, оказывается, предназначен для этой работы, потому что эффекты делетирования гена SWR1 сходны с эффектами делетирования гена, кодирующего сам H2AZ. Более того, у нуль-мутанта по swrl предпочтительная откладка H2AZ в специфических локусах полностью утрачена. In vitro, когда очищенный SWR1-C представлен с набором нуклеосом, он специфически замещает димеры Н2А•Н2В димерами H2AZ•Н2В в АТФ-зависимой реакции (рис. 11. Эволюция многих гистонов была направлена на более плотную упаковку ДНК 13.7). Интересный аспект этой реакции вытекает из предсказания кристаллической структуры, упомянутой выше: смешанные нуклеосомы, содержащие и Н2А, и H2AZ, не должны быть стабильными. Таким образом, замещение димера, опосредованное SWR1-C, может быть совместной реакцией, в которой замещение одного димера H2AZ•Н2В облегчает извлечение и замещение остающегося димера Н2А•Н2В. Второй мультисубъединичный белковый комплекс выполняет у Drosophila замещение фосфорилированного Н2АХ нефосфорилированной молекулой (Morrison and Shen, 2005). Замечательно, что этот единственный у Drosophila комплекс, названный dTip60, состоит из белков, обычно обнаруживаемых в двух отдельных комплексах: SWR1-C, АТФ-зависимом комплексе ремоделирования хроматина, описанном выше, и NuA4/Tip60, комплексе модификации гистонов с ацетилтрансферазной активностью. In vitro эта реакция требует и АТФ. и ацетил-СоА. Таким образом, один этот комплекс интегрирует ацетилирование гистонов, ремоделинг нуклеосом и замещение гистонов их вариантами. Это сочетание вероятно отражает тот факт, что Н2АХ Drosophila является также ее H2AZ, тогда как у других эукариот Н2АХ эволюционировал из канонического Н2А. Несмотря на это различие, есть основания ожидать, что основной путь консервативен. У почкующихся дрожжей и в клетках млекопитающих SWR1-C, NuA4/ Tip60 и еще один АТФ-зависимый комплекс ремоделинга нуклеосом, INO80-C, имеют общие субъединицы. Одной из них является родственный актину белок Агр4. Интересно, что было показано, что у почкующихся дрожжей Агр4 взаимодействует с фосфорилированным Н2АХ, результатом чего является последовательное рекрутирование комплексов NuA4, SWR1 и INO80 (Downs et al., 2004). Это позволяет предполагать, что и у этих организмов эти комплексы катализируют замещение как Н2АХ, так и H2AZ. Остается продемонстрировать это предсказание непосредственно. Открытие того, что комплексы ремоделинга хроматина предназначены для RI-сборки нуклеосом, важно не только для понимания того, как варианты гистонов включаются, но и для обеспечения первых специфических in vivo функций для машин ремоделинга хроматина. До этих открытий было неясно, почему клетки обычно имеют такое обилие крупных машин, облегчающих движение нуклеосом (Becker and Horz. 2002). Разнообразие АТФаз SWI/SNF представляло загадку, которую теперь, возможно, легче понять, если некоторые машины ремоделинга предназначены для сборки разных вариантов в нуклеосомы. Возможно, сборка нуклеосом является согласованным процессом, в котором ферменты, модифицирующие гистоны, действуют на свои субстраты, в то время как АТФ-зависимые ремоделеры обеспечивают рабочий ход и специфичность, необходимые для RI-замещения10. Другие варианты Н2А дифференцируют хроматин, но их функции все еще неизвестны
Дальнейшая диверсификация Н2А произошла у позвоночных. У млекопитающих macroH2A и H2ABbd (Н2А Barr body deficient) представляют уникальные линии, которые, по-видимому, играют роль в эпигенетическом феномене компенсации дозы (детально обсуждается в главе 17). МасгоН2А называется так потому, что, кроме домена histone fold и карбокситерминальных «хвостов», он содержит большой карбокситерминальный глобулярный домен (Ladurner, 2003). С учетом того, что карбокситерминальный «хвост» Н2А выходит поблизости от линкерной ДНК, возможно, что этот глобулярный домен взаимодействует с линкерами, «хвостами» H3 или с такими линкерными белками, как Н1 и белки HMG (High Mobility Group). В чем именно заключается это взаимодействие — неизвестно, хотя интригующая возможность заключается в том, что оно обладает ферментативной активностью. В пользу этой возможности говорит сходство глобулярного домена (имеющего длину, 200 аминокислотных остатков) с белками, обладающими гидролитической активностью по отношению к полинуклеотидам и полипептидам. Другая возможность заключается в том. что глобулярный домен может просто действовать как препятствие для инициации транскрипции; на мысль о такой роли наводит его способность блокировать связывание транскрипционных факторов in vitro (Sarma and Reinberg, 2005). Домен histone fold macroH2A также обладает специфическими свойствами, поскольку он не действует на ремоделеры хроматина. Эти наблюдения позволяют предполагать, что нуклеосомы, содержащие macroH2A, менее мобильны и потому могут быть устойчивыми к активной транскрипции. Это могло бы объяснить обогащенность дискретных районов факультативно неактивной Х-хромосомы вариантом macroH2A у женщин — районов, которые чередуются с участками конститутивного гетерохроматина (рис. 13.9а) (Chadwick and Willard, 2004). В противоположность macroH2A H2ABbd, по-видимому, не выявляется на тельце Бара, но в остальном наблюдается повсеместно в ядре (рис. 13.96) (Chadwick and Willard. 2001). Поведение in vitro нуклеосом, содержащих H2ABbd, согласуется с предположением, что он играет роль в облегчении транскрипции (Sarma and Reinberg, 2005). H2ABbd является быстро эволюционирующим белком по сравнению с другими известными изоформами Н2А, хотя причины этой ускоренной эволюции неясны.11. Эволюция многих гистонов была направлена на более плотную упаковку ДНК
Когда больше нет необходимости получать доступ к ДНК для репликации и транскрипции, хроматин обычно становится еще более конденсированным, и это нередко связано с замещением канонических гистонов. Это очевидно для спермиев, и в некоторых линиях у паралогов гистонов выработалась специализированная роль упаковщиков. Например, сперии морского ежа содержат варианты Н1 и Н2В с повторяющимися «хвостовыми» мотивами, связывающимися с малой бороздкой ДНК (Malik and Henikoff, 2003), что предположительно является адаптацией к тому, чтобы более плотно упаковать хромосомы для включения в головки спермиев. Аналогичная адаптация обнаруживается у специфичных для пыльцы вариантов Н2А у цветковых растений, У позвоночных специфичные для спермиев специализированные варианты гистонов обнаруживаются в семенниках млекопитающих, в том числе паралог Н2В (SubH2Bv), локализующийся в акросоме, и специфичный для семенников вариант H3 (Witt et al., 1996). Рис. 13.9. Варианты Н2A и неактивная Х-хромосома у женщин
(а) macroH2A (красный цвет) окрашивает дискретные районы неактивной Х-хромосомы, которые чередуются с маркером гетерохроматина (гистоном H3K9me3). (б) H2ABbd (зеленый цвет) исключается из неактивной Х-хромосомы (красная точка с указывающей на нее стрелкой), (в) То же самое ядро, что и на б, но окрашенное DAPI, чтобы показать хроматин (а — перепечатано, с любезного разрешения, из: Chadwick and Willard, 2004 [© National Academy of Sciences]; б, в — перепечатано, с любезного разрешения, из: Chadwick and Willard, 2001 [©The Rockefeller University Press])
Рис. 13.9. Варианты Н2A и неактивная Х-хромосома у женщин
(а) macroH2A (красный цвет) окрашивает дискретные районы неактивной Х-хромосомы, которые чередуются с маркером гетерохроматина (гистоном H3K9me3). (б) H2ABbd (зеленый цвет) исключается из неактивной Х-хромосомы (красная точка с указывающей на нее стрелкой), (в) То же самое ядро, что и на б, но окрашенное DAPI, чтобы показать хроматин (а — перепечатано, с любезного разрешения, из: Chadwick and Willard, 2004 [© National Academy of Sciences]; б, в — перепечатано, с любезного разрешения, из: Chadwick and Willard, 2001 [©The Rockefeller University Press])
Замещение гистонов во время созревания спермиев протаминами и другими белками обеспечивает потенциальные средства для стирания эпигенетической информации в мужской зародышевой линии. Однако данные о трансгенерационной наследственности (Rakyan and Wbitelaw, 2003), особенно у животных, у которых нет метилирования ДНК, указывают на то, что некоторая выборка нуклеосомных гистонов, возможно, сохраняется при этом переходе и передает эпигенетическую информацию Как уже указывалось, это именно то, что происходите CENP-А в центромерах (Palmer et al., 1990), и возможно, что небольшая фракция других вариантов, таких как H3.3, остается в спермиях для эпигенетического наследования информации об экспрессии генов. Хотя наше понимание о процессе замещения гистонов в ходе развития спермиев является рудиментарным, мы надеемся, что многое удастся узнать, когда мы поймем, каким образом CENP-A переживает этот переход. Увеличенная компактизация происходит также в соматических клетках, прекративших деления и претерпевающих дифференцировку. В некоторых случаях компактизация включает количественные и качественные изменения в линкерных гистонах. Стоихиометрия гистона Н1 относительно нуклеосом определяет средний интервал в нуклеосомных порядках in vivo (Fan et al., 2003). Кроме того, присутствие HI в хроматине способствует формированию структуры более высокого порядка, которая обычно подавляет транскрипцию (Wblffe, 1992). Линкерные гистоны in vivo гораздо более мобильны, чем коровые гистоны. Время пребывания [residence times] для Н2А и Н2В — часы, а для H3 и Н4 оно даже не может быть измерено, тогда как время пребывания для Н1 — несколько минут (Phair et al., 2004). В результате крайне мало вероятно, что включение вариантных линкерных гистонов дифференцирует хроматин наследуемым образом. Скорее, роль вариантов Н1, как полагают, сводится к тому, чтобы изменять свойства основной массы хроматина, которые могут влиять на компактизацию (Wblffe, 1992). Варианты Н1 разделяют с коровыми гистонами разграничение между RC- и RI-формами (Marzluff et al., 2002). RC-вариантные формы HI, по-видимому, взаимозаменяемы друг с другом — предположение, основывающееся на том факте, что нокаутные мыши, лишенные одного или двух из пяти RC-вариантов Н1, фенотипически нормальны (Fan et al., 2003). У птиц вариант линкерного гистона Н5 откладывается во время созревания эритроцитов, что сопровождает крайнюю степень компактизации ядра. Еще один вариант, который откладывается до высоких уровней в неделящихся клетках, — это Н10, сильно дивергировавший от канонических форм. Сверхэкспрессия Н10 делает хроматин менее доступным для нуклеаз, чем аналогичная сверхэкспрессия канонической формы. Обычное накопление Н10 в неделящихся клетках могло бы быть общим механизмом компактизации хроматина, по мере того как клетки переходят в состояние покоя.
12. Заключение и перспективы исследований
Варианты гистонов обеспечивают наиболее фундаментальный уровень дифференцировки хроматина, и альтернативные механизмы откладки различных вариантов потенциально могут устанавливать и поддерживать эпигенетические состояния. Гистоны Н2А, Н2В, H3 и Н4 занимают разные положения в коровой частице в результате эволюционного процесса, начавшегося до появления последнего общего предка эукариот. Ключевые эволюционные инновации остаются неопределенными, в том числе возникновение октамера из анйцестрального тетрамера типа H3•Н4, и мы ожидаем секвенирование большего числа геномов архей и примитивных эукариот, которые могли бы оказаться отсутствующими связующими звеньями. Последующее усложнение четырех коровых гистонов в разные варианты обеспечило основу для эпигенетических процессов, включая развитие и расхождение хромосом. Для полного понимания эпигенетической наследственности нам нужно лучше понимать процессы включения вариантов путем замещения канонических гистонов. Важным достижением последнего времени является характеристика независимых от репликации путей сборки, предназначенных для конкретных вариантов. Центромеры представляют собой наиболее бросающиеся в глаза примеры очень разного хроматина, которые можно приписать особым свойствам того или иного варианта гистона. Хотя ясно, что нуклеосомы, содержащие CenH3, образуют фундамент центромеры, главным вызовом для будущих исследований остается вопрос о том, каким именно образом они откладываются в одно и то же место в каждом клеточном поколении в отсутствие даже намека на сиквенс-специфичность. Становится очевидным, что с вариантами гистонов связаны также эпигенетические свойства активных генов. Транскрипиионно активные локусы обогащены и H3 3, и H2AZ, и расшифровка процессов сборки, ответственных за это обогащение, представляет собой важную область текущих исследований. Динамическое поведение хроматина ведет к пониманию того, что транскрипция, ремоделинг хроматина и модификация гистонов могли бы быть сопряжены со сборкой и разборкой нуклеосом. Изучение динамических процессов, связанных с обновлением гистонов, находится лишь на ранней стадии, и мы ожидаем технологических достижений в молекулярной биологии, цитогенетике, биохимии и структурной биологии, которые можно будет использовать для лучшего понимания динамической природы хроматина. Помимо этих универсальных процессов варианты гистонов участвуют и в конкретных эпигенетических явлениях. В случае Х-хромосомы млекопитающих три разных варианта Н2А, фосфо-Н2АХ, macroH2A и H2ABbd, рекрутированы для участия в сайленсинге или активации генов в целях инактивации зародышевой линии или компенсации дозы. Понимание функции этих вариантов в эпигенетических процессах остается важным вызовом на будущее Получение первой структуры коровой частицы нуклеосомы с высоким разрешением (Luger et al., 1997) стало плодотворным достижением в выяснении свойств хроматина. Путем такого усложнения этой базовой структуры, которое имело биологические последствия, варианты гистонов дают возможность углубить наше понимание того, каким образом эти удивительные [fascinating] архитектурные белки эволюционировали, чтобы играть разнообразные роли в эпигенетических процессахЛитература
Agalioti T., Lomvardas S., Parekh B., Yie J., Maniatis T., and Thanos D., 2000. Ordered recruitment of chromatin modifying and general transcription factors to the IFN-p promoter. Cell 103: 667-678. Armstrong J.A., Papoulas O., Daubresse G., Sperling A.S., Lis J.T., Scott M.P., and Tamkun J.W., 2002. The Drosophila BRM complex facilitates global transcription by RNA polymerase II. EMBO J. 21: 5245-5254. Bantignies R., Goodman R.H., and Smolik S.M., 2000. Functional interaction between the coactivator Drosophila CREB-binding protein and ASH 1, a member of the trithorax group of chromatin modifiers. Mol. Cell. Biol., 20: 9317-9330. Beisel C., Imhof A.. Greene J.. Kremmer E., and Sauer F., 2002. Histone methylation by the Drosophila epigenetic transcriptional regulator Ash 1. Nature 419: 857-862. Bultman S., Gebuhr T., Yee D., La Mantia C., Nicholson J., Gilliam A., Randazzo F., Metzger D., Chambon P., Crabtree G., and Magnuson T., 2000. A Brgl null mutation in the mouse reveals functional differences among mammalian SWI/SNF complexes. Mol. Cell 6: 1287-1295. Byrd K.N. and Sheam A., 2003. ASH1, a Drosophila trithorax group protein, is required for methylation of lysine 4 residues on histone H3. Proc. Natl. Acad. Sci. 100: 11535-11540. Chaya D., Hayamizu T., Bustin M., and Zaret K.S., 2001. Transcription factor FoxA (HNF3) on a nucleosome at an enhancer complex in liver chromatin. J. Biol. Chem. 276: 44385-44389. Cirillo L.A., Lin F.R., Cuesta I., Friedman D., Jamik M., and Zaret K.S., 2002. Opening of compacted chromatin by early developmental transcription factors HNF3 (FoxA) and GATA-4. Mol. Cell 9: 279-289. Cote J., Quinn J., Workman J.L., and Peterson C.L., 1994. Stimulation of GAL4 derivative binding to nucleosomal DNA by the yeast SWI/SNF complex. Science 265: 53-60. Daubresse G., Deuring R., Moore L., Papoulas O., Zakrajsek L, Waldrip W.R., Scott M.P., Kennison J.A., and Tamkun J.W., 1999. The Drosophila kismet gene is related to chromatin-remodeling factors and is required for both segmentation and segment identity. Development 126: 1175-1187. Denis G.V. and Green M.R., 1996. A novel, mitogen-activated nuclear kinase is related to a Drosophila developmental regulator. Genes Dev. 10: 261 -271. Dou Y., Milne T.A., Tackett A.J., Smith E.R., Fukuda A., Wysocka J., Allis C.D., Chait B.T., Hess J.L., and Roeder R.G., 2005. Physical association and coordinate function of the H3 K4 methyltransferase MLL1 and the H4 K16 acetyltransferase MOF. Cell 121: 873-885. Dunaief J.L., Strober B.E., Guha S., KhavariP.A., Alin K., Luban J., Begemann M., Crabtree G.R., and Goff S.P., 1994. The retinoblastoma protein and BRG1 form a complex and cooperate to induce cell cycle arrest. Cell 79: 119-130. Duncan I., 1987. The bithorax complex. Annu. Rev. Genet. 21: 285-319. Fan H.Y., He X., Kingston R.E., and Narlikar G.J., 2003. Distinct strategies to make nucleosomal DNA accessible. Mol. Cell 11: 1311-1322. Farkas G., Gausz J., Galloni M., Reuter G., Gyurkovics H., and Karch F., 1994. The Trithorax-like gene encodes the Drosophila GAGA factor. Nature 371: 806-808. Francis N.J. and Kingston R.E., 2001. Mechanisms of transcriptional memory. Nat. Rev. Mol. Cell. Biol. 2: 409-421. Francis N.J., Saurin A.J., Shao Z., and Kingston R.E., 2001. Reconstitution of a functional core polycomb repressive complex. Mol. Cell 8: 545-556. Gellon G. and McGinnis W., 1998. Shaping animal body plans in development and evolution by modulation of Hox expression patterns. Bioessays, 20: 116-125. Gutierrez L., Zurita M., Kennison J.A., and Vazquez M., 2003. The Drosophila trithorax group gene tonalli (tna) interacts genetically with the Brahma remodeling complex and encodes an SP-R1NG finger protein. Development 130: 343-354. Hassan A.H., Neely K.E., and Workman J.L., 2001. Histone acetyltransferase complexes stabilize swi/snf binding to promoter nucleosomes. Cell 104: 817-827. Holstege E.C., Jennings E.G., Wyrick J.J., Lee T.I., Hengartner 1998. Dissecting the regulatory circuitry of a eukaryotic genome. Cell 95: 717-728. Hughes C.M., Rozenblatt-Rosen O., Milne T.A., Copeland T.D., Levine S.S., Lee J.C., Hayes D.N., Shanmugam K.S., Bhattachaqee A., Biondi C.A., et al., 2004. Memn associates with a trithorax family histone methyltransferase complex and with the hoxc8locus. Mol. Cell 13: 587-597. Imbalzano A.N., Kwon H., Green M.R., and Kingston R.E., 1994. Facilitated binding of TATA-binding protein to nucleosomal DNA. Nature 370: 481-485. Jacobs S.A. and Khorasanizadeh S., 2002. Structure of HP1 chromodomain bound to a lysine 9-methylated histone H3 tail. Science 295: 2080-2083. Janody E., Martirosyan Z., Benlali A., and Treisman J.E., 2003. Two subunits of the Drosophila mediator complex act together to control cell affinity. Development 130: 3691-3701. Kassabov S.R., Zhang B., Persinger J., and Bartholomew B., 2003. SWI/SNF unwraps, slides, and rewraps the nucleosome. Mol. Cell 11: 391-403. Kaufman T.C., Seeger M.A., and Olsen G., 1990. Molecular and genetic organization of the antennapedia gene complex of Drosophila melanogaster. Adv. Genet. 27: 309-362. Kennison J.A., 1995. The Polycomb and trithorax group proteins of Drosophila: Trans-regulators of homeotic gene function. Annu. Rev. Genet. 29: 289-303. Kennison J. A., 2003. Introduction to Trx-G and Pc-G genes. Methods Enzymol. 377: 61-70. Kennison J.A. and Tamkun J.W., 1988. Dosage-dependent modifiers of Polycomb and Antennapedia mutations in Drosophila. Proc. Natl. Acad. Sci. 85: 8136-8140. Khorasanizadeh S., 2004. The nucleosome: From genomic organization to genomic regulation. Cell 116: 259-272. Klymenko T. and Muller J., 2004. The histone methyltransferases Trithorax and Ash1 prevent transcriptional silencing by Polycomb group proteins. EM BO Rep. 5: 373-377. Kruger W., Peterson C.L., Sil A., Cobum C, Arents G., Moudrianakis E.N., and Herskowitz I., 1995. Amino acid substitutions in the structured domains of histories H3 and H4 partially relieve the requirement of the yeast SWI/SNF complex for transcription. Genes Dev. 9: 2770-2779. Kwon H., Imbalzano A.N., Khavari P.A., Kingston R.E., and Green M.R., 1994. Nucleosome disruption and enhancement of activator binding by a human SWI/SNF complex. Nature 370: 477-481. Levine S.S., King I.F., and Kingston R.E., 2004. Division of labor in Polycomb group repression. Trends Biochem. Sci. 29: 478-485. Lewis B.A. and Reinberg D., 2003. The mediator reactivator complex: Functional and physical roles in transcriptional regulation. J. Cell Sci. 116: 3667-3675. Logie C. and Peterson C.L., 1997. Catalytic activity of the yeast SWI/SNF complex on reconstituted nucleosome arrays. EMBO J. 16: 6772-6782. Lorch Y., Zhang M., and Romberg R.D., 1999. Histone octamer transfer by a chromatin-remodeling complex. Cell 96: 389-392. Machado C. and Andrew D.J., 2000. D-Titin: A giant protein with dual roles in chromosomes and muscles. J. Cell Biol. 151: 639-652. Mahmoudi T. and Verrijzer C.P., 2001. Chromatin silencing and activation by Polycomb and trithorax group proteins. Oncogene, 20: 3055-3066. Miller T., Krogan N.J., Dover J., Erdjument-Bromage H., Tempst P., Johnston M., Greenblatt J.F., and Shilatifard A., 2001, COMPASS: A complex of proteins associated with a trithorax-related SET domain protein. Proc. Natl. Acad. Sci. 98: 12902-12907. Min J., Zhang Y., and Xu R.M., 2003. Structural basis for specific binding of Polycomb chromodomain to histone H3 methylated at Lys 27. Genes Dev. 17: 1823-1828. Mohrmann L. and Verrijzer C.P., 2005. Composition and functional specificity of SWI2/SNF2 class chromatin remodeling complexes. Biochim. Biophys. Acta 1681: 59-73. Muyrers-Chen I., Rozovskaia T., Lee N., Kersey J.H., Nakamura T., Canaani E., and Paro R., 2004. Expression of leukemic MLL fusion proteins in Drosophila affects cell cycle control and chromosome morphology. Oncogene 23: 8639-8648. Petruk S., Sedkov Y., Smith S., Tillib S., Kraevski V, Nakamura T., Canaani E., Croce C.M., and Mazo A., 2001. Trithorax and dCBP acting in a complex to maintain expression of a homeotic gene. Science 294: 1331-1334. Phelan M.L., Sif S., Narlikar G.J., and Kingston R.E., 1999. Reconstitution of a core chromatin remodeling complex from SWI/SNF subunits. Mol. Cell 3: 247-253. Pokholok D.K., Harbison C.T., Levine S., Cole M., Hannett N.M., Lee T.I., Bell G.W., Walker K., Rolfe P.A., Herbolsheimer E., et al., 2005. Genome-wide map of nucleosome acetylation and methylation in yeast. Cell 122: 517-527. Polach K.J. and Widom J., 1995. Mechanism of protein access to specific DNA sequences in chromatin: A dynamic equilibrium model for gene regulation. J. Mol. Biol. 254: 130-149. Rea S., Eisenhaber E, O’Carroll D., Strahl B.D., Sun Z.W, Schmid M., Opravil S., Mechtler K., Ponting C.P., Allis C.D., and Jenuwein T., 2000. Regulation of chromatin structure by site-specific histone H3 methyltransferases. Nature 406: 593-599. Ringrose L. and Paro R., 2004. Epigenetic regulation of cellular memory by the polycomb and trithorax group proteins. Annu. Rev. Genet. 38: 413-443. Roguev A.,. Schaft D., Shevchenko A., Pijnappel W.W., Wilm M., Aasland R., and Stewart A.F., 2001. The Saccharomyces cerevisiae Setl complex includes an Ash2 homologue and methylates histone 3 lysine 4. EMBO J., 20: 7137-7148. Saha A., Wittmeyer J., and Cairns B.R., 2005. Chromatin remodeling through directional DNA translocation from an internal nucleosomal site. Nat. Struct. Mol. Biol. 12: 747-755. Santos-Rosa H., Schneider R., Bannister A. J., Sherriff J., Bernstein B.E., Emre N.C., Schreiber S.L., Mellor J., and Kouzandes T., 2002. Active genes are tri-methylated at K4 of histone H3. Nature 419: 407-411. Simon J., 1995. Locking in stable states of gene expression: Transcriptional control during Drosophila development. Curr. Opin. Cell Biol. 7: 376-385. Simon J.A. and Tamkun J.W., 2002. Programming off and on states in chromatin: Mechanisms of Polycomb and trithorax group complexes. Curr. Opin. Genet. Dev. 12: 210—218. Srinivasan S., Armstrong J.A., Deuring R., Dahlsveen I.K., McNeill H., and Tamkun J.W., 2005. The Drosophila trithorax group protein Kismet facilitates an early step in transcriptional elongation by RNA Polymerase II. Development 132: 1623-1635. Strober B.E., Dunaief J.L., Guha S., and Goff S.P., 1996. Functional interactions between the hBRM/hBRGl transcriptional activators and the pRB family of proteins. Mol. Cell. Biol 16: 1576-1583. Sudarsanam P., Iyer V.R., Brown P.O., and Winston F., 2000. Whole-genome expression analysis of snf/swi mutants of Saccharomyces cerevisiae. Proc. Natl. Acad. Sci. 97: 3364-3369. Tamkun J.W., Deuring R., Scott M.P., Kissinger M., Pattatucci A.M., Kaufman T.C., and Kennison J.A., 1992. brahma: A regulator of Drosophila homeotic genes structurally related to the yeast transcriptional activator SNF2/SWI2. Cell 68: 561-572. Therrien M., Morrison D.K., Wong A.M., and Rubin G.M., 2000. A genetic screen for modifiers of a kinase suppressor of Ras-dependent rough eye phenotype in Drosophila. Genetics 156: 1231-1242. Versteege I., Sevenet N., Lange J.. Rousseau-Merck M.F., Ambros P., Handgretinger R., Aurias A., and Delattre O., 1998. Truncating mutations of hSNF5/INIl in aggressive paediatric cancer. Nature 394: 203-206. Vignali M., Hassan A.H., Neely K.E., and Workman J.L., 2000. ATP-dependent chromatin-remodeling complexes. Mol Cell Biol., 20: 1899-1910. Wang W., Cote J., Xue Y., Zhou S., Khavari P.A., Biggar S.R., Muchardt C., Kalpana G.V., Goff S.P., Yaniv M., et al., 1996. Purification and biochemical heterogeneity of the mammalian SWI-SNF complex. EMBO J. 15: 5370-5382. White house I., Stockdale G., Flaus A., Szczelkun M.D., and Owen-Hughes T., 2003. Evidence for DNA translocation by the ISWI chromatin-remodeling enzyme. Mol. Cell. Biol. 23: 1935-1945. Wysocka J., Swigut T., Milne T.A., Dou Y., Zhang X., Burlingame A.L., RoederR.G., Brivanlou A.H., and Allis C.D., 2005. WDR5 associates with histone H3 methylated at K4 and is essential for H3 K4 methylation and vertebrate development. Cell 121: 859-872. Yokoyama A., Wang Z., Wysocka J., Sanyal M., Aufiero D.J., Kitabayashi I., Herr W., and Cleary M.L., 2004. Leukemia protooncoprotein MLL forms a SET 1-like histone methyltransferase complex with menin to regulate Hox gene expression. Mol. Cell Biol. 24: 5639-5649. Yu B.D., Hanson R.D., Hess J.L., Homing S.E., and Korsmeyer S.J., 1998. MLL, a mammalian trithorax-group gene, functions as a transcriptional maintenance factor in morphogenesis. Proc. Natl Acad. Sci. 95: 10632-10636. Yu B.D., Hess J.L., Horning S.E., Brown G.A., and Korsmeyer S.J., 1995. Altered Hox expression and segmental identity in M/-mutant mice. Nature 378: 505-508.Глава 14. Эпигенетическая регуляция хромосомного наследования
 Gary Н. Karen1 и R. Scott Hawley2
1Lawrence Berkeley National Laboratory, Department of Genome Biology, University of California at Berkeley, Department of Molecular and Cell Biology, Berkeley, California 94720 2Stower Institute for Medical Research, Kansas City, Missouri 64110and Department of Phisiology, University of Kansas Medical Center, Kansas City, Missouri 66160
Gary Н. Karen1 и R. Scott Hawley2
1Lawrence Berkeley National Laboratory, Department of Genome Biology, University of California at Berkeley, Department of Molecular and Cell Biology, Berkeley, California 94720 2Stower Institute for Medical Research, Kansas City, Missouri 64110and Department of Phisiology, University of Kansas Medical Center, Kansas City, Missouri 66160
Общее резюме
Удвоение и передача генетической информации выполняются двумя типами клеточного деления, митозом и мейозом, которые оба являются фундаментальными для жизни и эволюции. Митоз — это ядерное деление, происходящее в соматических клетках, включающее идентичное разделение в дочерние клетки дуплицированного генетического материала в форме хромосом. Мейоз — это редукционное ядерное деление, происходящее только в зародышевых клетках многоклеточных организмов или на определенных стадиях жизненного цикла одноклеточных, чтобы произвести клетки с гаплоидным геномом перед оплодотворением (или конъюгацией у некоторых эукариот). Аномальная репликация или репарация ДНК приводит к мутациям и хромосомным перестройкам. Вероятно, более важно, что неправильная сегрегация хромосом в ходе ядерного деления вызывает утерю или приобретение целых хромосом (анеуплоидия). Эти типы «геномной нестабильности» влияют на жизнеспособность клеток и фертильность эукариот. Более того, они играют ключевую роль в этиологии врожденных дефектов и рака у человека. Ранние исследования позволяли предполагать, что нуклеотидная последовательность ДНК играет преобладающую роль в определении сайтов и функций хромосомных элементов, необходимых для собственно митоза и мейоза, таких как «ориджины» репликации ДНК, сайты прикрепления веретена (центромеры и кинетохоры), концы хромосом (теломеры) и сайты мейотического спаривания. Однако в последнее десятилетие мы пришли к пониманию того, что эпигенетические механизмы могут регулировать многие ключевые функции, необходимые для стабильности генома наследования хромосом. К ним относятся роли в инициации репликации ДНК, репарации и рекомбинации ДНК, защиты концов хромосом (теломеры), движения хромосом (центромеры) и сегрегации гомологичных хромосом в мейозе. На первый взгляд, эпигенетическая регуляция оказывается в противоречии с тем фактом, что эти хромосомные функции существенны для изменчивости клеток и организмов, что означает, что они должны быть «зашиты» в нуклеотидной последовательности ДНК. Однако при взгляде сквозь «очки эволюции» эпигенетическая «пластичность» хромосом в ходе митоза и мейоза оказывается важной для компенсации тех типов изменений нуклеотидной последовательности и хромосомных перестроек, которые связаны с видообразованием. Понимание молекулярных основ эпигенетического регулирования наследственности является фундаментальным для выяснения этих основных биологических процессов и для диагностики и лечения болезней человека.1. Введение
1.1. Как осуществляется хромосомная наследственность?
Митоз является основным типом клеточного деления, который производит идентичные, диплоидные дочерние клетки и используется соматическими клетками и премейотическими зародышевыми клетками (рис. 14.1а). В митотическом клеточном цикле выделяют четыре фазы, называемые Gj (gap 1, стадия «покоя» после митоза), S (synthesis — репликация ДНК и экспрессия генов), G2 (gap 2, «покой» после S, подготовка к митозу) и М (mitosis, состоящий из профазы, метафазы, анафазы и телофазы). Во время S-фазы ДНК реплицируется, и дуплицированные сестринские хроматиды удерживаются вместе за счет установления когезии. В начале митоза хромосомы конденсируются, а гистон H3 становится фосфорилированным по Ser-10 (H3S10ph) (глава 10). Кроме того, у большинства организмов единичный сайт (центромера) на каждый сестринской хроматиде формирует структуру, называемую кинетохором, которая опосредует прикрепление микротрубочки веретена и служит в качестве «контрольной точки» (checkpoint) клеточного цикла (рис. 14.1а). В прометафазе пары сестринских хроматид собираются в метафазную пластинку и в анафазе расходятся к полюсам. Эти движения совершаются как за счет активности связанных с кинетохором микротрубочковых моторов (кинезинов и динеинов) и регуляции сборки и разборки микротрубочек, а также требуют разрушения когезии сестринских хроматид при переходе из метафазы к анафазе. Мейоз происходит только в зародышевых клетках и характеризуется одним раундом репликации, за которым следуют два деления (мейоз 1 и И, рис. 14.16); это дает гаплоидные яйцеклетки в женской зародышевой линии и гаплоидные спермин в мужской зародышевой линии многоклеточных животных, а не диплоидные дочерние клетки. В мейозе I реплицированные гомологи спариваются и расходятся вместе. Сестринские хроматиды каждого гомолога не расходятся друг с другом до мейоза II. Для нормальной сегрегации во время мейоза требуется частая рекомбинация между гомологами, а также специальная когезия в центромерном районе, которая обеспечивает ассоциацию сестринских хроматид во время мейоза I (Watanabe, 2005).1.2. Какие элементы требуются для хромосомной наследственности?
И митотические, и мейотические клеточные деления нуждаются в активности специфических хромосомных элементов и связывающихся белков для выполнения точной дупликации генома и расхождения хромосом (рис. 14.2). Рис. 14.1. Стадии митоза и мейоза
(а) Микрофотографии клеток Drosophila показывают поведение хромосом (синий цвет, описание см. ниже), микротрубочек (зеленый цвет) и центромер (красный цвет) в интерфазе и митозе, (б) Поведение хромосом показано для профазы мейоза I у кукурузы; это стадия, на которой происходят спаривание гомологов, синапсис и рекомбинация (микрофотографии предоставлены Hank Bass и Shaun Murphy, Университет штата Флорида). Ключевые функции хромосом на каждой стадии показаны внизу (синим шрифтом). Впоследствии, в анафазе мейоза 1, гомологи расходятся к противоположным полюсам, завершая редукционное деление. Сестринские хроматиды разделяются лишь во время мейоза II (рис. 14.9)
Рис. 14.1. Стадии митоза и мейоза
(а) Микрофотографии клеток Drosophila показывают поведение хромосом (синий цвет, описание см. ниже), микротрубочек (зеленый цвет) и центромер (красный цвет) в интерфазе и митозе, (б) Поведение хромосом показано для профазы мейоза I у кукурузы; это стадия, на которой происходят спаривание гомологов, синапсис и рекомбинация (микрофотографии предоставлены Hank Bass и Shaun Murphy, Университет штата Флорида). Ключевые функции хромосом на каждой стадии показаны внизу (синим шрифтом). Впоследствии, в анафазе мейоза 1, гомологи расходятся к противоположным полюсам, завершая редукционное деление. Сестринские хроматиды разделяются лишь во время мейоза II (рис. 14.9)
Репликация ДНК начинается в «ориджинах» [точках начала репликации], которые у большинства эукариот не строго зависят от нуклеотидной последовательности (обсуждается в разделе 2 этой главы). В митотически делящихся клетках сцепление сестринских хроматид становится затем видимым по всей длине этих хроматид, хотя в перицентромерном гетерохроматине концентрация когезинов более высокая. Центромеры — это большие участки, состоящие из ДНК и специальных белков хроматина, которые служат в качестве фундамента для формирования кинетохора и играют ключевую роль в прикреплении веретена и нормальной сегерегации мейотических и митотических хромосом (обсуждается в разделе 3 этой главы). У большинства эукариот имеется одна и только одна центромера на хромосому. Утрата центромеры приводит к нарушениям в прикреплении веретена и к утере хромосом, а присутствие более чем одной центромеры ведет к прикреплению одной и той же хроматиды к обоим полюсам, что вызывает образование хромосомных мостов и фрагментацию в анафазе. Изредка организмы (например, круглый червь Caenorhabditis elegans) содержат «полицентрические», или «голоцентрические» хромосомы, в которых кинетохоры присутствуют во многих районах (см., например, рис. 13.5). Такие хромосомы используют специальные механизмы для обеспечения прикрепления и расхождения сестринских хроматид к противоположным полюсам. Теломеры — это специализированные хроматиновые структуры, находящиеся на концах хромосом для защиты их от деградации или рекомбинации и для обеспечения полной дупликации ДНК. Для мейотической сегрегации требуются также центромеры, теломеры, сцепление (когезия) и «ориджины» репликации. Однако для обеспечения спаривания гомологов и их расхождения в мейозе I необходимы некоторые дополнительные элементы и изменение поведения центромер (обсуждется в разделе 4 этой главы).
 Рис. 14.2. Элементы хромосомной наследственности
Диаграмма показывает элементы хромосомы, существенные для нормальной дупликации («ориджины» репликации) и наследования (центромеры, сцепление, теломеры) в митозе и мейозе. Для нормального расхождения хромосом в мейозе требуются также сайты спаривания гомологов (не показаны) и, в большинстве случаев, рекомбинация
Рис. 14.2. Элементы хромосомной наследственности
Диаграмма показывает элементы хромосомы, существенные для нормальной дупликации («ориджины» репликации) и наследования (центромеры, сцепление, теломеры) в митозе и мейозе. Для нормального расхождения хромосом в мейозе требуются также сайты спаривания гомологов (не показаны) и, в большинстве случаев, рекомбинация
Сама природа хромосомной наследственности предполагает, что спецификация и локализация элементов наследственности должны быть «зашиты» в нуклеотидной последовательности ДНК. Поэтому вызывает удивление, что многие элементы, в том числе перечисленные в этом разделе, вместо этого регулируются эпигенетически, особенно у многоклеточных эукариот Говоря коротко, элементами, предрасположенными к эпигенетической регуляции для обеспечения надежной хромосомной наследственности, являются «ориджины» репликации ДНК, теломеры, сайты сцепления (когезии) сестринских хроматид и сайты спаривания гомологов.
2. Эпигенетическая регуляция репликации ДНК, репарации и теломер
Первым этапом в обеспечении наследования генетической информации является надежная дупликация всего генома, которая осуществляется процессом, известным как репликация ДНК. К сожалению, в ходе репликации происходят ошибки, вызывая изменения в ДНК (мутации), которые могут быть вредными для жизнеспособности организма. Кроме того, такие агенты внешней среды, как радиация, производят мутации, в том числе изменения оснований в ДНК, делеции, инсерции (вставки) и перестройки. Клетки реагируют на повреждение ДНК активацией механизмов репарации ДНК, выполняющих удивительную работу по поддержанию надежности и стабильности генома. Наконец, дупликация линейных молекул ДНК ставит задачи, которые решаются наличием специализированных последовательностей и структур на концах хромосомы, известных как теломеры. Недавние исследования показали, что на эти базовые процессы, необходимые для точного удвоения и поддержания нуклеотидных последовательностей ДНК, влияют эпигенетические механизмы, регулирующие хроматин.2.1. Инициация репликации ДНК контролируется эпигенетическими механизмами
Надежное копирование ДНК осуществляется ДНК-полимеразами, действующими от 5’- к З’-концу, и начинается в специфических сайтах, называемых «ориджинами» [точками начала репликации ДНК]. В «ориджинах» образуется «пузырь», состоящий из двухрепликационных «вилок», и репликация идет в двух направлениях, пока не встречаются «вилки», генерируемые следующими «ориджинами». Домены, реплицируемые с одного «ориджина», обычно очень большие, длиной в сотни тысяч пар оснований (Aladjem and Fanning, 2004). «Ориджины» у дрожжей Saccharomyces cerevisiae (известные также как ARSs — autonomously replicating sequences, автономно реплицирующиеся последовательности) функционируют эктопически, будучи клонированы в плазмиды, и обычно после интеграции в другие хромосомные сайты, показывая тем самым, что инициация репликации регулируется специфическими последовательностями нуклеотидов ДНК. ARSs имеют величину приблизительно 100—150 п.н. и содержат одну или несколько копий важной последовательности длиной приблизительно 11 п.н. и обогащенной АТ плюс другие консервативные элементы (Weireich et al., 2004). Для инициации необходим белковый комплекс, известный как комплекс распознавания «ориджинов» (ORC, origin recognition complex), который отвечает за рекрутирование предрепликационного комплекса (PRC, prereplication complex), включающего белки поддержания минихромосом (МСМ, minichromosome maintenance proteins) (Prasanth et al., 2004). У многоклеточных «ориджины» репликации можно идентифицировать in situ, но обычно после клонирования и реинтродукции они не активны, что позволяет предполагать, что у этих организмов инициация регулируется эпигенетически, а не строгой зависимостью от последовательности ДНК (Aladjem and Fanning, 2004). Хотя у многоклеточных белки ORC и МСМ консервативны, факторы и механизмы, ответственные за регуляцию активности «ориджинов» у этих организмов, остаются загадкой. Кроме того, неясно, влияет ли структура хроматина на работу репликационных «вилок». Ключ к тому, каким образом «ориджины» многоклеточных могли бы регулироваться эпигенетически, дают детальные исследования на S. cerevisiae. Хотя нуклеотидные последовательности ДНК в «ориджинах» необходимы и, по большей части, достаточны для инициации репликации у этого организма, имеются четкие данные о влиянии структуры хроматина на активность «ориджинов» (Weinreich et al., 2004). Анализ с использованием микрочипов (microarray analysis) показал, что не все из 332 сайтов двунаправленной репликации или из 429 сайтов связывания белков ORC и МСМ активны в каждом клеточном цикле.Хромосомный контекст и структура хроматина влияют на способность предполагаемого «ориджина» быть активным в инициации репликации. Например, ARS, локализованная в «молчащих» локусах типа спаривания, не может инициировать репликацию, если не будет перемещена в другие места хромосомы. Другой пример эпигенетической регуляции «ориджинов» относится к приблизительно 100—200 генам, кодирующим рибосомную РНК (rDNA), которые расположены в виде тандемных повторов (Pasero et al., 2002). Каждая единица rDNA длиной 9.1 т.п.н. содержит ARS, которая инициирует репликацию, будучи вставлена в плазмиду или в другое место генома. Однако в каждой S-фазе активны лишь около 20 % «ориджинов» rDNA. «Ориджины» могут также регулироваться таким образом, что будут работать [to fire] на разных стадиях S-фазы (Weinreich et al., 2004). Например, «ориджины» возле теломер обычно активны в поздней S-фазе (см. раздел 2.3 далее в этой главе), но вставка тех же самых последовательностей в кольцевые плазмиды приводит к репликации в ранней S-фазе (рис. 14.3) (Ferguson and Fangman, 1992) Поздняя репликация может рекапитулировать в результате линеаризации такой плазмиды и добавления теломер, что помещает ARSs вблизи концов. Рис. 14.3. Эпигенетическая регуляция сроков репликации у дрожжей
Один из лучших примеров эпигенетических влияний на репликации был продемонстрирован у дрожжей Saccharomyces cerevisiae. Вставка поздно реплицирующегося «ориджина» в кольцевую плазмиду приводит к ранней репликации в S-фазе, а поздняя репликация восстанавливается после линеаризации этой плазмиды и добавления теломер (Ferguson and Fangman, 1992; Weinreich et al., 2004)
Рис. 14.3. Эпигенетическая регуляция сроков репликации у дрожжей
Один из лучших примеров эпигенетических влияний на репликации был продемонстрирован у дрожжей Saccharomyces cerevisiae. Вставка поздно реплицирующегося «ориджина» в кольцевую плазмиду приводит к ранней репликации в S-фазе, а поздняя репликация восстанавливается после линеаризации этой плазмиды и добавления теломер (Ferguson and Fangman, 1992; Weinreich et al., 2004)
Эти результаты показывают, что как активность «ориджинов», так и время начала работы «ориджина» в ходе S-фазы регулируются эпигенетически. Дальнейшие доказательства вытекают из наблюдений, согласно которым «расписание» S-фазы, сайленсинг «ориджинов» в rDNA, теломеры и локусы типа спаривания регулируются многими из модификаций гистонов и белками, отвечающими за эпигенетический сайленсинг генов, в том числе белками SIR (глава 4).
2.2. Репарация ДНК включает эпигенетические изменения в структуре хроматина
Накопление повреждений ДНК из-за ошибок репликации или воздействия внешними агентами может приводить к вредным мутациям, нестабильности генома, раку, старению клеток и смерти. Повреждения ДНК исправляются механизмами исправления ошибок в ходе репликации ДНК, а также независимыми механизмами, действующими в фазе Gr Клетки содержат «контрольные точки» («checkpoints»), выявляющие наличие повреждений ДНК и останавливающие или задерживающие клеточный цикл до тех пор, пока не завершится репарация; эти механизмы индуцируют также гибель клетки (апоптоз), если повреждение не исправляется, что способствует выживаемости организма за счет удаления дефектных клеток. Эти процессы в норме весьма эффективны; например, клетки кожи человека, подвергнутые УФ-облучению солнечного света, содержат удивительно большое количество повреждений ДНК, подавляющее большинство которых должным образом вылечиваются (Friedberg et al., 1995). Индивидуумы, дефектные по репарации в силу мутаций в одном или нескольких компонентах механизмов «контрольной точки» или репарации, страдают от целого ряда заболеваний, в том числе предрасположенностью к раку прямой кишки, груди и кожи и подвержены преждевременному старению. В ранних исследованиях были успешно идентифицированы молекулы и механизмы, распознающие разные типы повреждений в ДНК, такие как двунитевые разрывы (DSBs) и пиримидиновые димеры, и рекрутирующие специфические комплексы для исправления этих повреждений. Однако упаковка ДНК в хроматин могла бы потенциально блокировать доступ факторов, участвующих в распознавании сайтов повреждения или осуществляющих репарцию, подобно репрессивному влиянию гетерохроматина на экспрессию генов (Hassa and Hottiger, 2005). Однако репарация использует АТФ-зависимые комплексы ремоделинга хроматина, которые, как предполагается, «экспонируют» дефектную ДНК для репарации Более недавние исследования показали, что специфические изменения в хроматиновой матрице, такие как присутствие вариантов гистонов и посттрансляционные модификации гистонов, играют ключевую роль в распознавании повреждений ДНК и в рекрутировании соответствующих механизмов репарации (Hassa and Hottiger, 2005). Например, присутствие DSBs имеет своим результатом быстрое фосфорилирование варианта гистона Н2А, Н2АХ, по серинам 136 и 139 (обозначается у ШАХ). Фосфорилирование Н2АХ необходимо для накопления белков репарации в больших (мегабазы) районах, окружающих DBSs, и для сборки «фокусов» репарации, а не для первоначального рекрутирования репарационных комплексов к первичным сайтам повреждения ДНК (Bassing et al., 2002; Celeste et al., 2002). Эти наблюдения позволяют предполагать, что «распространение» у ШАХ из DBSs действует для усиления сигнала, исходящего из DBSs, увеличивая рекрутирование и, возможно, сохранение факторов репарации (Fernandez-Capetillo et al., 2004). В дополнение к участию в репарации DBSs фосфорилирование Н2АХ влияет на рекомбинацию V(D)J в лимфоцитах млекопитающих, а также действует как супрессор геномной нестабильности и опухолей у мышей (Fernandez-Capetillo et al., 2004). Другие типы изменений хроматина, такие как ацетилирование гистонов, SUMOhjiирование, убиквитинирование и метилирование, также играют заметную роль в успешной репарации ДНК. Например, метилирование гистона H3 по лизину 79 (H3K79me) необходимо для рекрутирования к DSBs белка репарационной «контрольной точки» 53ВР1 и опосредуется DOT1-метилтрансферазой лизинов гистонов (НКМТ) (Huyen et al., 2004). Интересно, что индуцированные повреждения ДНК не изменяют уровни метилирования H3K79, позволяя предполагать, что эта модификация не добавляется в ответ на DSBs. Одна из возможностей заключается в том, что рекрутирование 53ВР1 и «ощущение» («sensing») DSBs связано с экспозицией предсуществующего метилирования H3K79 в ответ на ремоделинг хроматина в сайтах повреждений ДНК. Хотя наше современное понимание влияния этих и других факторов хроматина на репарацию ДНК предполагает участие в сигналинге и рекрутировании соответствующих комплексов к повреждениям ДНК, вполне вероятно, что будущие исследования выявят новые направления, по которым эпигенетические механизмы регулируют пути, поддерживающие стабильность генома. Важно отметить, что роль хроматина в репарации ДНК является динамической и происходит в ответ на повреждение. Хотя модификации гистонов и другие эпигенетические регуляторные белки играют ключевые роли, эти изменения не наследуются при клеточном делении, в отличие от других примеров, обсуждаемых в этой главе.2.3. Эпигенетический контроль структуры и функции теломер
Концы линейных эукариотических хромосом являются специализированными сайтами, известными как теломеры; они выполняют три существенные функции. Во-первых, теломеры обеспечивают включение самых дистальных концов хромосом в репликацию ДНК, решая тем самым «проблему репликации концов» (Lue, 2004). Во-вторых, теломеры защищают концы хромосом от деградации и подавляют слияния с другими хромосомами. В-третьих, у многих, но не у всех, организмов теломеры облегчают спаривание хромосом в мейозе. У большинства эукариот теломеры состоят из простых, коротких повторов, которые восстанавливаются ферментом теломеразой. Теломерные функции регулируются как механизмами на основе нуклеотидных последовательностей, так и эпигенетическими механизмами. Проблема репликации концов возникает в связи с тем, что ДНК-полимеразе требуется праймер для инициации синтеза в направлении 5’ к 3’ «отстающей нити»; следствием этой ограниченной активности фермента оказывается тот факт, что репликация не может проходить до самого конца хромосомы (Lue, 2004). Для преодоления этой проблемы используются два механизма. Преобладающий механизм, используемый большинством организмов, в том числе дрожжами, млекопитающими и растениями, включает необычный ферментативный комплекс, известный как теломераза. Теломеры у большинства эукариот состоят из простых повторов длиной 6 п.н., распространяющихся на расстояние от десятков до сотен тысяч пар оснований. Теломеразные комплексы содержат энзиматическую активность, подобную обратной транскриптазе, а также РНК, обладающими гомологией с теломерными повторами. Суть дела состоит в том, что репликация конца выполняется путем «нацеливания» этого комплекса на теломерные повторы с помощью РНК-компонента; за этим следует обратная транскрипция (3’ к 5’), производящая новые повторы. Интересно, что утрата теломеразной активности и укороченные теломеры коррелируют с клеточным дряхлением и старением и, наоборот, раковые клетки обнаруживают повышенную теломеразную активность и удлиненные теломеры (Blasco, 2005). Существуют также независящие от теломеразы механизмы поддержания хромосомных концов (Louis and Vershinin, 2005). Одна хорошо изученная альтернативная система, по-видимому, ограничена дрозофилой и другими двукрылыми. У этих организмов теломераза не идентифицируется, а концы не содержат простых, коротких повторов, обнаруживаемых у большинства других эукариот. Вместо этого концы хромосом Drosophila состоят из перетасованныхкластеровразличныхретротранспозонов типа non-LTR (LTR — длинный терминальный повтор), размеры которых варьируют от 3 до 5 т.п.н., и других повторов (TAS — telomere-associated repeats) (Biessmann and mason, 2003). Эти транспозоны кодируют ферменты типа обратной транскриптазы (отсюда re/rot ransposon), позволяя предполагать, что здесь имеется эволюционное родство с более стандартными теломеразными механизмами. Основное различие, однако, заключается в том, что хромосомы Drosophila не реплицируются до самого конца; они теряют примерно 70 п.н. на мушиное поколение, т.е. примерно то самое количество, которое ожидается в связи с проблемой репликации концов. Эта утрата не выбывает делеции существенных генов, потому что домены теломерных и субтеломерных повторов имеют длину около 50—100 т.п.н., и потребовалось бы много поколений, чтобы потерялось достаточное количество ДНК и были достигнуты участки с генами. Эта утеря теломерных последовательностей компенсируется, однако, нечастым добавлением ретротранспозонов типа non-LTR (Biessmann and Mason, 2003). Эпигенетическая регуляция затрагивает функции теломер и экспрессию генов, находящихся в этом районе. «Голая» теломерная ДНК или внутренние DSBs приводят к хромосомным слияниям и анеуплоидии. Барбара МакКлинток (Barbara McClintock) первой описала явление, известное как цикл «разрыв-слияние-мостик». в котором слияния между разорванными хромосомами или слияния концов хромосом производят дицентрические хромосомы и анафазные мосты, которые генерируют дальнейшие разрывы. Доказательства эпигенетической регуляции теломерной защиты концов хромосом вытекает из исследований на Drosophila, показавших, что она не зависит от нуклеотидных последовательностей ДНК. Оторванный конец хромосомы у Drosophila может вести себя как DSB в одном поколении, но действует как полностью функциональная теломера впоследствии, без какого-либо добавления ретротранспозонов или каких-либо изменений последовательности (Ahmad and Golic, 1998). Более того, любой конец, созданный у Drosophila (известно как терминальные делеции), может быть упакован как теломера и защищен от событий слияния (Karpen and Spradling, 1992). Кроме того, у Schizosaccharomyces pombe теломерные функции зависят от белка Tazl (Miller and Cooper, 2003) и теломерного хроматина, и эта зависимость не связана с каноническими теломерными повторами (Sadaie et al., 2003). Теломерные районы содержат модификации хроматина и обладают свойствами, сходными с перицентромерным гетерохроматином, описанным в разделе 3 далее в этой главе. Характеристика эпигенетических механизмов, регулирующих теломерные и субтеломерные районы, была получена в исследованиях экспрессии генов у дрожжей и Drosophila, но наблюдается также у человека. Сайленсинг эухроматиновых генов, вставленных в теломерные районы, варьирует. Это явление называется теломерным эффектом положения (ТРЕ, telomere position effect); оно похоже на эффект положения мозаичного типа (PEV, position-effect variegation), индуцируемый соседним центромерным гетерохроматином у мух и S. pombe (детали см. в главах 5 и 6, соответственно). У почкующихся дрожжей многие факторы, связанные с хроматином, такие как белки SIR, влияющие на сайленсинг типа спаривания, влияют также на сайленсинг, индуцируемый теломерой (глава 4). Удивительно, что почти ни один из генов, регулирующих PEV у Drosophila (Супрессоры и Энхансеры Мозаицизма, Su(var) s и E(var)s, описанные в главе 5), никак не влияет на теломерный сайленсинг. Это заставляет предположить, что PEV и ТРЕ опосредованы, по крайней мере отчасти, разными механизмами (Cryderman et al., 1999; Donaldson et al., 2002). Гетерохроматиновый белок 1 (HP1, продукт гена Su(var)) и метилирвание H3K9, которые являются ключевыми компонентами сайленсинга, опосредованного хроматином (глава 8), присутствуют в теломерах Drosophila и необходимы для удлинения теломер (рис. 14.4) (Perrini et al., 2004). Результатом делеции НР1 или его партнера по связыванию НОАР (сокращение для НР1/ ORC-associated protein) оказывается очень высокая частота теломерных слияний (Cenci et al., 2003). НР1 обычно рекрутируется к хроматину благодаря своему сродству к метилированному H3K9 через хромодомен. Интересно, что кэпирование теломеры белком НР1 не зависит от метилирования H3K9; это позволяет предполагать, что защита концов опосредуется альтернативным механизмом, в котором участвует прямое связывание с теломерной ДНК или нетеломерными последовательностями, присутствующими в терминальных делециях (рис. 14.4а) (Perrini et al., 2004). Одна из привлекательных моделей сводится к тому, что НР1 связывается и защищает концы независимо от нуклеотидной последовательности ДНК, затем рекрутирует неизвестную НКМТ H3K9; локальное метилирование H3K9 могло бы затем рекрутировать к этому участку большие количества НР1, что стимулирует распространение теломерного сайленсинга (рис. 14.4). Этот механизм, вероятно, не требует средств RNAi, участвующих в установлении и сайленсинге центромерного гетерохроматина (глава 8), но этот компонент модели нуждается в прямой проверке. Недавние исследования показали, что у млекопитающих зависимое от теломеразы удлинение теломеры также регулируется эпигенетически (Lai et al., 2005). Например, мыши с делецией обеих копий HKMTs H3K9. Suvar39hl/2, имеют теломеры с редуцированными уровнями H3K9me2 и H3K9me3 и демонстрируют аномально длинные теломеры (рис. 14.46) (Garcia-Cao et al., 2004). Эти результаты позволяют предполагать, что активность НКМТ Suvar39hl/2 превращает модификацию H3K9me в ди- и триметилированные формы, облегчая связывание гомологов НР1, СЬх 3 и 5, которые необходимы для сборки нормальной структуры теломерного хроматина и регуляции длины теломер. Наконец, эпигенетические модификации, происходящие в теломерах, влияют также и на мейотическую рекомбинацию и передачу хромосом. Например, у почкующихся дрожжей утрата Ndjl, теломерного белка, необходимого как для формирования теломерного букета (т.е. образования кластера), так и для мейотической рекомбинации (Wu and Burgess, 2006), приводит к резкой редукции частоты теломерных делеций (Joseph et al., 2005). Джозеф и сотрудники предполагают что Ndj 1 облегчает теломерную делецию, «стимулируя взаимодействия теломер в ходе мейоза, что приводит к эффективному увеличению содержания факторов, необходимых для делеции». Аналогичным образом, мутанты, дефектные по транскрипционному сайленсингу генов, помещенных поблизости от теломер, демонстрируют серьезные нарушения в мейотическом спаривании и рекомбинации, что приводит к неправильной агрегации во время мейоза (Nimmo et al., 1998). Таким образом, эпигенетические события, которые контролируют как длину теломер, так и транскрипционную компетентность, используются также в процессах, контролирующих поведение хромосом в ходе мейоза.3. Эпигенетическая регуляция идентичности и функции центромер
Для нормального наследования генетического материала требуется, чтобы после того как геном точно дуплицировался и репарировался в S-фазе, хромосомы надежно расходились во время митоза и мейоза. Центромеры были впервые определены в 1880 году Флемингом (Flemming) как цитологически видимая «первичная» перетяжка в хромосоме. В начале 1900-х годов центромеры были определены и генетически как хромосомные сайты, существенные для нормального наследования, и как участки с резко сниженной или даже вовсе отсутствующей мейотической рекомбинацией. В настоящее время мы определяем центромеру (CEN) как ДНК плюс белки хроматина, ответственные за формирование кинетохора. Кинетохор — это белковая структура, облегчающая прикрепление микротрубочек и движение вдоль них, обращенная к пластинке во время прометафазы и к полюсам во время анафазы митоза и мейоза. Кинетохор служит также местом действия ключевой для клеточного цикла «контрольной точки», известной как «контрольная точка сборки веретена» (SAC, spindle assembly checkpoint), или «митотическая контрольная точка» (Cleveland et al., 2003). Рис. 14.4. У мух и млекопитающих функции теломер регулируются эпигенетически
(а) У Drosophila гетерохроматиновый белок 1 (НР1) связывается с теломерной ДНК независимо от ее хромодомена и «кэпирует» теломеры, что обеспечивает нормальное расхождение благодаря блокировке теломерных слияний (Fanti et al. 1998; Perrini et al. 2004). Затем HP1 рекрутирует неизвестную метилтрансферазу гистонов (НКМТ; не Su(var)3-9), которая триметилирует H3K9 на близлежащих нуклеосомах; НР1 связывается с H3K9me3 через хромодомен, что, в свою очередь, рекрутирует большие количества НКМТ, а последовательные раунды связывания НР1 — рекрутирования НКМТ стимулируют распространение «молчащего» хроматина по субтеломерным районам, (б) У мышей нокаут обоих локусов НКМТ Suv39 понижает уровни H3K9me3 и me2 и увеличивает содержание модификаций H3K9me, измененной структуры хроматина и изменений в уровнях белков, связывающихся с ди- и триметилированными H3K9 (1 СЬх 3 и 5), H3K9me (Т Cbx 1) и TERF 1 и 2 (не показано) в теломерах (Garcia-Cao et al. 2004). Эти изменения коррелируют с увеличенной длиной теломер, позволяя предполагать, чтотриметилирование H3K9 с помощью Suv39hs необходимо для нормального функционирования теломеразы и регуляции размера теломер
Рис. 14.4. У мух и млекопитающих функции теломер регулируются эпигенетически
(а) У Drosophila гетерохроматиновый белок 1 (НР1) связывается с теломерной ДНК независимо от ее хромодомена и «кэпирует» теломеры, что обеспечивает нормальное расхождение благодаря блокировке теломерных слияний (Fanti et al. 1998; Perrini et al. 2004). Затем HP1 рекрутирует неизвестную метилтрансферазу гистонов (НКМТ; не Su(var)3-9), которая триметилирует H3K9 на близлежащих нуклеосомах; НР1 связывается с H3K9me3 через хромодомен, что, в свою очередь, рекрутирует большие количества НКМТ, а последовательные раунды связывания НР1 — рекрутирования НКМТ стимулируют распространение «молчащего» хроматина по субтеломерным районам, (б) У мышей нокаут обоих локусов НКМТ Suv39 понижает уровни H3K9me3 и me2 и увеличивает содержание модификаций H3K9me, измененной структуры хроматина и изменений в уровнях белков, связывающихся с ди- и триметилированными H3K9 (1 СЬх 3 и 5), H3K9me (Т Cbx 1) и TERF 1 и 2 (не показано) в теломерах (Garcia-Cao et al. 2004). Эти изменения коррелируют с увеличенной длиной теломер, позволяя предполагать, чтотриметилирование H3K9 с помощью Suv39hs необходимо для нормального функционирования теломеразы и регуляции размера теломер
Ключевой вопрос для организмов с моноцентрическими хромосомами сводится к тому, каким образом один и только один сайт на хромосому ассоциируется с функцией центромеры (известной как «идентичность центромеры» — «centromere identity»). Здесь мы представим доказательства того, что у большинства эукариот идентичность и воспроизведение центромеры регулируются эпигенетически посредством структуры хроматина, а не специфическими нуклеотидными последовательностями ДНК (Carroll and Straight, 2006). Сводка этих ключевых данных включает следующие положения: (1) центромерные последовательности не являются консервативными даже у близкородственных видов и даже у хромосом одного какого-нибудь вида, (2) центромерная ДНК не является необходимой или достаточной для формирования кинетохора и (3) позиционирование центромеры на хромосоме обнаруживает удивительную пластичность в ходе эволюции.
3.1. Структура и функция центромеры у разных эукариот
Исследования, проведенные на дрожжах S. cerevisiae в 1980-е годы, привели к первому клонированию и анализу эукариотной центромеры. Было показано, что структура размером 125 п.н., присутствующая на всех 16 хромосомах S. cerevisiae, необходима и достаточна для нормального функционирования центромеры (Bloom et al., 1989); даже однонуклеотидные изменения в высококонсервативных элементах I и III приводили к полной утрате функции. Таким образом, идентичность и воспроизведение центромеры у этого одноклеточного эукариотического организма определяются нуклеотидной последовательностью ДНК. Надежда на то, что аналогичные механизмы, базирующиеся на нуклеотидной последовательности, могли бы регулировать идентичность центромеры у других эукариот, впервые была развеяна исследованиями на другом «простом» эукариотическом организме, S. pombe. Центромерные последовательности у этих дробянковых дрожжей структурно более крупные и более сложные, чем у S. cerevisiae (Clarke et al., 1986; Nakaseko et al., 1987). Негомологичные последовательности «центрального кора» длиной 4—5 т.п.н., являющиеся сайтами формирования кинетохора, фланкированы инвертированными повторами различных классов, общими для трех хромосом. Минимум 25 т.п.н., содержащие неповторяющийся центральный кор, внутренние повторы и часть внешних повторов, абсолютно необходимы для функционирования центромеры и стабильной передачи хромосом (Baum et al., 1994). Достаточная центромерная функция наблюдается для трансфицированных плазмидных конструктов, несущих центральный кор плюс внутренние повторы (т.е. центральный домен) и два фланкирующих внешних повтора. Интересно, что делеция внутренних повторов нарушает расхождение сестринских хроматид в мейозе, демонстрируя тем самым, что центромерные районы играют роль в процессах, отличающихся от сборки кинетохора. Действительно, и кинетохор, и домены когезии тесно сцеплены и важны для правильного расхождения хромосом. Хотя центромерные районы у многоклеточных эукариот даже больше и более сложные, чем у S. pombe (сотни или тысячи тысяч пар оснований повторяющихся ДНК), общая организация и функционирование центромер дробянковых дрожжей послужили превосходной моделью центромер у млекопитающих, растений и насекомых. Центромеры у этих организмов заключены в крупные гетерохроматиновые блоки, присутствующие на каждой хромосоме, которые преимущественно состоят из сателлитных ДНК (простые, короткие повторы) и транспозонов. Эти центромерные районы составлены из субдоменов, отвечающих за различные функции, прежде всего за формирование кинетохора и сестринскую когезию. Центромерные последовательности, однако, не консервативны у эукариот или даже у разных хромосом отдельного вида. Именно эпигенетический состав функциональных субдоменов центромеры демонстрирует консерватизм, особенно по составу гистоновых вариантов и паттернам модификаций гистонов, которые, по-видимому, регулируются эпигенетически У нематоды С. elegans и у других видов голоцентрические хромосомы рекрутируют и собирают центромерные белки по всей длине хромосомы (Demburg, 2001). Специфические для червя последовательности не являются, очевидно, необходимыми, поскольку конкатемеры лямбда и ДНК многих других типов стабильно передаются. Белки рекрутируются «пакетами» [«bundles»] в профазе, но к метафазе распределяются ровным слоем на обращенной к полюсу поверхности хромосомных плеч, заставляя предполагать, что многие области генома С. elegans могут поддерживать сборку кинетохора в эпигенетическом режиме. Несмотря на очевидные различия с моноцентрическими хромосомами, возможно, что организационные и структурные атрибуты, такие как ЗБ-спирализация или выпетливание ДНК CEN, являются консервативными (см. раздел 3.3 далее в этой главе).3.2. Центромерные последовательности не являются необходимыми или достаточными для формирования и функционирования кинетохора
Большая величина и сложность центромерных последовательностей у многоклеточных эукариот сделали затруднительным анализ потребностей в нуклеотидной последовательности ДНК с помощью определенных конструктов, столь успешно использовавшихся в исследованиях на дрожжах. Тем не менее, путем трансфекции клеток культуры ткани набором сателлитных ДНК были созданы с низкой частотой искусственные хромосомы человека (HACs), но они обнаружили высокий уровень митотической нестабильности (Rudd et al., 2003). Мы знаем, однако, что HACs образованы путем конкатемеризации введенных наборов сателлитов, и тем не менее некоторые альф?-сателлитные наборы не могут формировать сентромеры de novo, что заставляет предположить потребность в множественных, неизвестных этапах или факторах. Более недавние исследования показали, что уникальные свойства и компоненты иентромерного хроматина (как объясняется в разделе 3.3 далее в этой главе) имеются в HACs как в сателлитных наборах, так и в нецентромерных последовательностях (например, последовательностях плазмидного вектора и селектируемого маркера) (Lam et al., 2006). Таким образом, остается все еще неясным, насколько специфические последовательности ДНК достаточны для сборки и поддержания функциональных центромер человека. Первое указание на то, что идентичность и воспроизведение центромер регулируются эпигенетически, было получено в исследованиях «минимальных» центромерных конструктций у S. pombe (Steiner and Clarke, 1994). Небольшая доля трансформантов, полученных с помощью конструктов, обнаруживала переключение с редуцированной центромерной функции к высоко «активному» центромерному функционированию (0,6 % клеток), что впоследствии могло воспроизводиться в линии на протяжении многих поколений. Таким образом, одни и те же нуклеотидные последовательности ДНК могут демонстрировать два функционально различных, наследуемых состояния, аналогично наблюдениям эпигенетических влияний на генную экспрессию при PEV (глава 5) или ТРЕ (глава 4). Другие наблюдения заставляют предполагать главную роль эпигенетических механизмов в детерминации идентичности центромер и формировании кинетохоров у многоклеточных эукариот. Во-первых, нуклеотидные последовательности ДНК, в норме ассоциированные с центромерами, не достаточны для функционирования. Например, только подгруппа гетерохроматиновых сателлитных последовательностей мыши и человека связана с центромерной функцией (Lam et al., 2006). Кроме того, в функциональных хромосомах с двумя участками центромерных сателлитов (дицентрики), наблюдаемых у мух и у человека, один из этих участков теряет способность формировать кинетохор (Sullivan and Willard, 1998). Во-вторых, центромерные последовательности не являются необходимыми для формирования кинетохора, поскольку нецентромерная ДНК может приобретать и надежно воспроизводить центромерную функцию благодаря процессу, известному как «формирование неоцентромеры» (рис. 14.5а). У человека были идентифицированы многочисленные функциональные неоцентромеры, и анализ нуклеотидной последовательности показал, что эти новые районы формирования кинетохоров не приобрели сателлитных ДНК. Однако участки, фланкирующие новый кинетохор, приобрели эпигенетические свойства, сравнимые с соответствующими районами в эндогенных центромерах (т.е. перицентрическом хроматине), такими как метилирование H3JT9 и связывание НР1 (Lo et al., 2001). Хотя механизм формирования неоцентромер у человека не известен, в модельной системе неоцентромеры были созданы экспериментально. У Drosophila неопентромеры получаются из минихромосом, когда помещаются рядом нецентромерная ДНК и эндогенная центромера (рис. 14.56) (Maggert and Karpen, 2001). Таким образом, у Drosophila для активации неоцентромеры требуется близость к функциональной центромере, заставляя предполагать, что одним из механизмов приобретения центромеры является распространение центромерных белков в с/^-конфигурации на соседние, нецентромерные участки. Коль скоро это распространение произошло, центромерная функция затем воспроизводится в этом новом сайте эпигенетически. Интересно, что формирование неоцентромеры подавляется, когда между эндогенной центромерой и участком формирования неоцентромеры присутствует гетерохроматин, заставляя предполагать, что в определении величины центромеры играют роль дополнительные эпигенетические механизмы. Наконец, признаком эволюции являются хромосомные перестройки. Эти изменения сопровождаются приобретением, утратой и перемещениями центромер по отношению к нуклеотидным последовательностям генома (Ferreri et al., 2005). Такую пластичность легче всего объяснить, если идентичность центромеры определяется эпигенетически, как это описано в разделе 3.5.3.3. Необычный состав центромерного хроматина
Данные об эпигенетическом регулировании центромерной идентичности и воспроизведении указывают на вероятность того, что ключевыми детерминантами являются структура и состав хроматина, а не первичные последовательности ДНК. Здесь мы обсудим различные компоненты и структуры, обнаруживаемые в хроматине CEN, а также удивительное наблюдение, показывающее, что эти свойства консервативны у далеко отстоящих друг от друга эукариот. Рис. 14.5. Формирование неоцентромер у человека и мух (а)
Хромосомы человека, несущие неоцентромеры, которые демонстрируют центромерную функцию и формирование кинтетохора в отсутствие центромерной ДНК, обычно связаны с крупными перестройками (Amor and Choo, 2002). В этом примере происходящая от хромосомы 10 неоцентромера (mar(del)10), структура которой указывает на формирование посредством большой интерстициальной делеции. удалившей эндогенную центромеру (серые пунктирные линии). Mar(del) 10 была открыта у индивидуума, в кариотипе которого была также кольцевая хромосома (ring(del)10, не показана), содержавшая ДНК из делегированного участка Последовательность событий для неоцентромер человека неясна; формирование неоцентромеры могло бы происходить вначале, давая дицентрическую хромосому, которая впоследствии подвергается перестройкам, или же формирование неоцентромеры могло бы происходить после делеции эндогенной центромеры, (б) У мух неоцентромеры могут создаваться экспериментально из минихромосомы, охарактеризованной на молекулярном уровне. Фрагмент эухроматина величиной 320 т.п.н. и теломерный хроматин, не содержащий центромерной ДНК. можно отделить от остальной минихромосомы, используя облучение. Этот фрагмент, который должен бы быть «ацентрическим», может стать функциональной неоцентромерой, которая надежно воспроизводится в митозе и мейозе и содержит белки центромеры и кинетохора, в норме ограниченные эндогенной центромерой (Blower and Karpen, 2001). Однако для формирования неоцентромеры требуется близость к эндогенной неоцентромере (420 т.п.н.), как в инверсионном деривате ?238; более того, формирование неоцентромеры не происходит по обе стороны от центромеры, когда присутствует перицентрический гетерохроматин (Maggert and Karpen, 2001) Эти результаты заставляют предполагать, что формирование неоцентромеры происходит через эпигенетическое распространение центромерного хроматина в соседний эухроматин, за которым следует эпигенетическое воспроизведение центромерной идентичности и функции. Блокирование этого процесса гетерохроматином согласуется с наблюдением, что сверхэкспрессированная CENP-A включается эктопически в эухроматин. но не в гетерохроматин (Heun et al. 2006), и позволяет предполагать, что протяженность центромерного хроматина определяется двумя эпигенетическими процессами: загрузкой и распространением CENP-A и формированием — блокированием гетерохроматина
Рис. 14.5. Формирование неоцентромер у человека и мух (а)
Хромосомы человека, несущие неоцентромеры, которые демонстрируют центромерную функцию и формирование кинтетохора в отсутствие центромерной ДНК, обычно связаны с крупными перестройками (Amor and Choo, 2002). В этом примере происходящая от хромосомы 10 неоцентромера (mar(del)10), структура которой указывает на формирование посредством большой интерстициальной делеции. удалившей эндогенную центромеру (серые пунктирные линии). Mar(del) 10 была открыта у индивидуума, в кариотипе которого была также кольцевая хромосома (ring(del)10, не показана), содержавшая ДНК из делегированного участка Последовательность событий для неоцентромер человека неясна; формирование неоцентромеры могло бы происходить вначале, давая дицентрическую хромосому, которая впоследствии подвергается перестройкам, или же формирование неоцентромеры могло бы происходить после делеции эндогенной центромеры, (б) У мух неоцентромеры могут создаваться экспериментально из минихромосомы, охарактеризованной на молекулярном уровне. Фрагмент эухроматина величиной 320 т.п.н. и теломерный хроматин, не содержащий центромерной ДНК. можно отделить от остальной минихромосомы, используя облучение. Этот фрагмент, который должен бы быть «ацентрическим», может стать функциональной неоцентромерой, которая надежно воспроизводится в митозе и мейозе и содержит белки центромеры и кинетохора, в норме ограниченные эндогенной центромерой (Blower and Karpen, 2001). Однако для формирования неоцентромеры требуется близость к эндогенной неоцентромере (420 т.п.н.), как в инверсионном деривате ?238; более того, формирование неоцентромеры не происходит по обе стороны от центромеры, когда присутствует перицентрический гетерохроматин (Maggert and Karpen, 2001) Эти результаты заставляют предполагать, что формирование неоцентромеры происходит через эпигенетическое распространение центромерного хроматина в соседний эухроматин, за которым следует эпигенетическое воспроизведение центромерной идентичности и функции. Блокирование этого процесса гетерохроматином согласуется с наблюдением, что сверхэкспрессированная CENP-A включается эктопически в эухроматин. но не в гетерохроматин (Heun et al. 2006), и позволяет предполагать, что протяженность центромерного хроматина определяется двумя эпигенетическими процессами: загрузкой и распространением CENP-A и формированием — блокированием гетерохроматина
У всех эукариот в центромерных нуклеосомах присутствуют специфичные для центромер белки семейства CENP-A, подобные гистону H3 (рис. 14.6а). Они служат и структурной, и функциональной основой для кинетохора и являются превосходными кандидатами на роль эпигенетической метки, устанавливающей и воспроизводящей центромерную идентичность (Cleveland et al., 2003). В отличие от большинства белков кинетохоров, собирающихся во время митоза, CENP-A присутствует в центромерах на протяжении всего клеточного цикла, что является одним из первых указаний на его важность для центромерной идентичности. У дрожжей, червей, мух и млекопитающих хроматин, содержащий CENP-A, обеспечивает также основу, существенную для рекрутирования белков кинетохора, прикрепления веретена и нормального расхождения хромосом (Carroll and Straight, 2006). Эксперименты по реципрокному эпистазу показали, что CENP-A является первым белком на пути сборки кинетохора, что согласуется с его физической локализацией в хроматине в основании кинетохора в митотических хромосомах. Дальнейшие доказательства важности CENP-A для формирования кинетохора вытекают из опытов по сверхэкспрессии у мух, в которых неправильная локализация CENP-A в нецентромерных районах производит функциональные эктопические кинетохоры (Heun et al., 2006). Поэтому, коль скоро этот вариант гистона существен для центромерной функции, мы в настоящее время определяем CEN-хроматин как район ДНК и белков, связанных с CENP-A. Структура нуклеосом, содержащих CENP-A. необычна по сравнению с каноническими гистоновыми корами, содержащими H3, Н2А, Н2В и Н4. Нуклеосомы CENP-A можно собрать in vitro из очищенного CENP-A и гистонов Н2А, Н2В и Н4, что согласуется с предыдущими наблюдениями, показывающими, что in vivo они гомотипичны (т.е.содержат две копии CENP-А, а не одну копию H3 и одну копию CENP-A) (Yoda et al., 2000). Детальный биофизический анализ показал, что интерфейс между CENP-A и Н4 отличается от интерфейса H3—Н4, и домен, взаимодействующий с Н4 достаточен для «нацеливания» CENP-A на центромеры в присутствии эндогенного CENP-A (Black et al., 2004). Замещение гистона H3 белком CENP-A в центромерных нуклеосомах первоначально позволяло думать, что CENP-A составляет весь хроматин, связанный с кинетохором. У S. pombe CENP-A равномерно распределен по центральным коровым участкам величиной 5—7 т.п.н. Эти коры фланкируются крупными гетерохроматиновыми доменами, содержащими метилирование H3K9 и белки гетерохроматина (Pidoux and Allshire, 2004). Однако детальный цитологический анализ и исследования с использованием иммунопреципитации обнаружили, что у многоклеточных эукариот центромерный хроматин имеет более сложный состав и организацию. Центромеры Drosophila, человека и риса содержат перемежающиеся блоки нуклеосом, содержащих H3 и CENP-A (в совокупности называемые CEN-хроматином), фланкированные еще более крупными блоками (от тысяч до миллионов пар нуклеотидов) перицентромерного гетерохроматина (рис. 14.66) (Blower et al., 2002; Yan et al., 2005).
 Рис. 14.6. Организация центромерного хроматина
(a) CENP-A является высококонсервативным, специфичным для центромер вариантом гистона Рисунок показывает его локализацию исключительно в центромерах в митотических хромосомах Drosophila (б) CEN-хроматин у мух и человека содержит перемежающиеся блоки содержащих Н3 и содержащих CENP-A нуклеосом и фланкирован перицентромерным гетерохроматином (Blower et al. 2002)
Рис. 14.6. Организация центромерного хроматина
(a) CENP-A является высококонсервативным, специфичным для центромер вариантом гистона Рисунок показывает его локализацию исключительно в центромерах в митотических хромосомах Drosophila (б) CEN-хроматин у мух и человека содержит перемежающиеся блоки содержащих Н3 и содержащих CENP-A нуклеосом и фланкирован перицентромерным гетерохроматином (Blower et al. 2002)
Чередование [interspersion] доменов H3 и CENP-A ставит ключевые вопросы относительно эпигенетической природы CEN-хроматина. В частности, модифицированы ли субдомены H3 в CEN-хроматине многоклеточных эукариот подобно гетерохроматину или эухроматину? Или же они маркированы уникальным образом? Далее, эквивалентна ли каждая перемежающаяся единица CENP-A/H3 в более крупных эукариотических центромерах единичной центромере S. pombe? К этим вопросам обратились, изучая посттрансляционные модификации, характеризующие перемежающиеся блоки нуклеосом H3 и CENP-A и обнаружившие еще большую сложность. Удивительно, что у человека и мух перемежающиеся домены H3 содержат H3K9me2 — метку, обычно ассоциированную с эухроматином — и, более того, не имеют H3K9me2 и H3K9me3, ассоциированных с фланкирующим гетерохроматином (рис. 14.7а) (Sullivan and Karpen, 2004; Lam et al., 2006). Однако, как и в гетерохроматине, в перемежающихся нуклеосомах H3 отсутствовали множественные формы ацетилирования H3 и Н4, как отсутствовал и H3K4me3. Таким образом, нуклеосомы H3 в CEN-хроматине обнаруживают паттерн модификаций, отличающийся от канонических эухроматина или гетерохроматина (рис. 14.76). Эти результаты наводят также на мысль, что центросомы мух и человека не составлены просто из повторяющихся S. pombe-подобных центромер. Важно, однако, отметить, что общая организация центромерных районов консервативна, так что у всех многоклеточных эукариот и у S. pombe весь хроматиновый домен CENP-A фланкируется перицентромерным гетерохроматином, содержащим метилирование H3K9. Какова возможная функциональная роль модификаций гистонов в CEN и фланкирующем хроматине? Отдельные состояния хроматина в районе CEN, вероятно, вносят вклад в разнообразные свойства центромерных доменов, такие как установление сроков для дифференциальной репликации CEN и фланкирующего гетерохроматина (Sullivan and Karpen, 2001; Blower et al., 2002). Модификации фланкирующего перицентромерного гетерохроматина могут также поддерживать размеры центромер, создавая барьер против расширения CEN-хроматина. У Drosophila CEN-хроматин легко распространяется на соседние последовательности, когда фланкирующий гетерохроматин удаляется, делая возможной активацию неоцентромеры (рис. 14.56) (Maggert and Karpen, 2001), а сверхэкспрессия CENP-A приводит к неправильной локализации в эухроматин, но не гетерохроматин (Heun et al., 2006). Интересно, что результатом сверхэкспрессии CENP-A в клетках человека является распространение CEN -хроматина и изменения в метилировании H3K9 во фланкирующих участках (Lam et al, 2006). Таким образом, размеры центромер, по-видимому, определяются балансом между двумя эпигенетическими состояниями: CEN-хроматином и фланкирующим перицентромерным гетерохроматином. Концентрация белков, необходимых для сцепления (когезии) сестринских хроматид, которое устанавливается одновременно с репликацией ДНК в фазе S, выше всего в гетерохроматине, фланкирующем центромеру. Это распределение, по-видимому, вносит вклад в соответствующую двойную ориентацию кинетохоров в митозе, а также в поддержание сцепления во время метафазы несмотря на развиваемые веретеном силы, концентрирующиеся в кинетохорах/центромерах (Watanabe, 2005). Эпигенетическое регулирование сцепления включает рекрутирование когезинов белками НР1 (Swi6у S. pombe), которое, в свою очередь, опосредуется высокими концентрациями метилирования H3K9 в перицентромерном гетерохроматине (Nonaka et al., 2002). Таким образом, специфичные для CEN комбинации модификаций гистонов тоже могли бы быть важными для рекрутирования когезионных комплексов к гетерохроматину вблизи сестринских кинетохоров, обеспечивая в то же время пространственное разделение когезионных и кинетохорных доменов (Sullivan and Karpen, 2004; см. также главу 6).
 Рис. 14.7. Различные паттерны модификаций гистонов в центромерном хроматине
(а) Иммунофлуоресцентный анализ с использованием антител, распознающих специфические модификации гистонов на расправленных хромосомных фибриллах, показал, что перемежающиеся блоки нуклеосом, содержащих H3, обладают паттерном модификаций, отличающимся от канонических эухроматина и гетерохроматина (Sullivan and Karpen, 2004). Например, несмотря на то, что центромеры у большинства эукариот погружены в крупные блоки перицентрического гетерохроматина, перемежающиеся блоки H3 содержат модификацию H3K9me2, в норме ассоциирующуюся с «открытым» эухроматином (наверху) и лишены гетерохроматинового маркера H3K9me2, присутствующей в перицентрических фланкирующих участках (внизу), (б) Сводка «двумерной» организации центромерного хроматина в интерфазе, основывающаяся на исследованиях растянутых фибрилл хроматина у мух и человека. + и — обозначают присутствие и отсутствие указанных модификаций гистонов (соответственно) в эухроматине, перицентромерном гетерохроматине и перемежающихся блоках нуклеосом H3 в центромерном хроматине (Sullivan and Karpen 2004; Lam et al., 2006). (в) Модель трехмерной организации хроматина в центромерном районе митотических хромосом. Предполагается, что ассоциации между сходным образом модифицированными нуклеосомами вносят вклад в формирование отдельных трехмерных структур в центромерном и фланкирующем хроматине. Перемежающиеся CENP-A/ CID и по-разному модифицированные H3 и Н4 могут опосредовать формирование «цилиндрических» трехмерных структур, наблюдаемых в метафазных хромосомах (Blower et al., 2002; Sullivan and Karpen, 2004). Хроматин H3K9me2, рекрутирующий такие белки гетерохроматина, как НР1, и такие белки когезии, как RAD21/SCC1, присутствует во внутреннем кинетохорном пространстве между митотическими сестринскими хроматидами и в участках, фланкирующих центромерный хроматин. Это расположение может быть необходимо для «презентации» CENP-A направленной к полюсу поверхности митотической хромосомы и облегчения рекрутирования внешних кинетохорных белков, а также для стимуляции взаимодействия НР1 с самим собой и правильной конденсации/когезии хромосом. Когезины изображены в виде кольцевидных структур в соответствии с последними моделями
Рис. 14.7. Различные паттерны модификаций гистонов в центромерном хроматине
(а) Иммунофлуоресцентный анализ с использованием антител, распознающих специфические модификации гистонов на расправленных хромосомных фибриллах, показал, что перемежающиеся блоки нуклеосом, содержащих H3, обладают паттерном модификаций, отличающимся от канонических эухроматина и гетерохроматина (Sullivan and Karpen, 2004). Например, несмотря на то, что центромеры у большинства эукариот погружены в крупные блоки перицентрического гетерохроматина, перемежающиеся блоки H3 содержат модификацию H3K9me2, в норме ассоциирующуюся с «открытым» эухроматином (наверху) и лишены гетерохроматинового маркера H3K9me2, присутствующей в перицентрических фланкирующих участках (внизу), (б) Сводка «двумерной» организации центромерного хроматина в интерфазе, основывающаяся на исследованиях растянутых фибрилл хроматина у мух и человека. + и — обозначают присутствие и отсутствие указанных модификаций гистонов (соответственно) в эухроматине, перицентромерном гетерохроматине и перемежающихся блоках нуклеосом H3 в центромерном хроматине (Sullivan and Karpen 2004; Lam et al., 2006). (в) Модель трехмерной организации хроматина в центромерном районе митотических хромосом. Предполагается, что ассоциации между сходным образом модифицированными нуклеосомами вносят вклад в формирование отдельных трехмерных структур в центромерном и фланкирующем хроматине. Перемежающиеся CENP-A/ CID и по-разному модифицированные H3 и Н4 могут опосредовать формирование «цилиндрических» трехмерных структур, наблюдаемых в метафазных хромосомах (Blower et al., 2002; Sullivan and Karpen, 2004). Хроматин H3K9me2, рекрутирующий такие белки гетерохроматина, как НР1, и такие белки когезии, как RAD21/SCC1, присутствует во внутреннем кинетохорном пространстве между митотическими сестринскими хроматидами и в участках, фланкирующих центромерный хроматин. Это расположение может быть необходимо для «презентации» CENP-A направленной к полюсу поверхности митотической хромосомы и облегчения рекрутирования внешних кинетохорных белков, а также для стимуляции взаимодействия НР1 с самим собой и правильной конденсации/когезии хромосом. Когезины изображены в виде кольцевидных структур в соответствии с последними моделями
В митотических хромосомах человека и Drosophila субдомены CENP-A сливаются, образуя трехмерную цилиндрическую структуру, в значительной мере исключающую нуклеосомы H3 (Blower et al., 2002). Блоки нуклеосом CENP-A ориентированы на поверхности хромосом, направленной к полюсам, а блоки нуклеосом H3 локализованы по направлению к внутреннему району хроматид. Внутренние и внешние белки кинетохора обернуты вокруг цилиндра CENP-A; это трехмерное расположение согласуется с CENP-A, играющим центральную роль в рекрутировании других кинетохорных белков (Blower et al., 2002). Для того чтобы согласовать двумерное чередование блоков CENP-Аи H3 (рис. 14.66 и 14.76) с разделением в трехмерных митотических хромосомах, предположили, что CEN-ДНК может закручиваться спиралью или выпетливаться в цилиндрической структуре, приводя к выравниванию нуклеосом с одним и тем же составом по одной линии [alignment] или в стопку (рис. 14.7в). Таким образом, раздельно модифицированные перемежающиеся нуклеосомы H3 и фланкирующий гетерохроматин могли бы отвечать за сборку трехмерной структуры CEN-хроматина в митозе (Sullivan and Karpen, 2004). Такое расположение может быть необходимо, чтобы экспонировать хроматин CENP-A внешней стороне хромосомы, где он может рекрутировать кинетохорные белки таким образом, который устанавливает правильную двойную ориентацию сестринских кинетохоров по отношению к полюсам веретена.
3.4. Модели структуры, функции и воспроизведения центромеры
Ключевым вопросом, исследуемым в настоящее время, является вопрос о том, как CENP-A и другие эпигенетические маркеры специфически локализуются и воспроизводятся в центромерах. Другой подход к этому же вопросу заключается в том, чтобы рассмотреть, каким образом CENP-A собирается только в центрмерном хроматине. Одна из привлекательных моделей предполагает, что включение CENP-A специфически в центромеры регулируется дифференциальными сроками и репликации CEN-ДНК, и экспрессии CENP-A по сравнению с основной массой хроматина (Ahmad and Heniloff, 2001). Однако репликация CEN-ДНК у человека и мух происходит на протяжении всей фазы S, одновременно с репликацией основной ДНК (Shelby et al., 2000; Sullivan and Karpen, 2001), а включениеCENP-A происходит в отсутствие репликации ДНК (Shelby et al., 2000; Ahmad and Heniloff, 2001). Эти наблюдения исключают механизм строгой привязки ко времени репликации для воспроизведения CENP-A и центромерной идентичности. Более привлекательный механизм вытекает из интригующего наблюдения, согласно которому CENP-A активно инкорпорируется в нуклеосомы не зависящим от репликации образом с помощью комплекса обмена гистонов (Shelby et al., 2000; Ahmad and Heniloff, 2001). H3.3 является вариантом H3, сборка которого, не зависящая от репликации (Ahmad and Heniloff, 2002), опосредуется комплексом, известным как регулятор гистонов A (HIRA), а не комплексами фактора сборки хроматина (CAF, chromatin assembly factor), ответственными за зависимое от репликации включение канонических нуклеосом H3 (Nakatani et al., 2004). У S. cerevisiae устранение компонентов HIRA приводит к неправильной локализации CENP-A (Sharp et al., 2002). Однако в настоящее время неясно, влияют ли компоненты HIRA на центромерный хроматин у многоклеточных эукариот или у S. pombe, где центромерная идентичность определяется эпигенетически. Более важно, что эти белки играют роль в сборке и структуре хроматина, например путем откладки H3.3; таким образом, широкая активность идентифицированных компонентов HIRA не объясняет специфичности включения CENP-A в центромеры. Возможно, что некая подгруппа комплексов HIRA содержит факторы, взаимодействующие только с CENP-A и распознающие существующие нуклеосомы CENP-A в реплицированном хроматине CEN; однако никаких таких факторов специфичности идентифицировать не удалось. Один из способов согласовать участие неспецифических факторов сборки — это представить себе, что специфичность обеспечивается CENP-A или нуклеосомами CENP-A. Например, определенные структурные взаимоотношения между CENP-A и Н4 могли бы обеспечить специфичность сборки новой CENP-A в центромерах; на эту мысль наводит способность взаимодействующего домена «нацеливать» CENP-A на центромеры (Black et al., 2004). Неясно, однако, достаточны ли эти домены для «нацеливания» центромер в отсутствие эндогенной CENP-A. Сейчас очевидно, что требуется по-новому представлять себе эпигенетическую регуляцию центромерной идентичности и воспроизведения. У S. cerevisiae результатом дефектов в протеолизе CENP-A оказывается неправильное включение в нецентромерные в норме районы, что в норме удаляется неизвестным механизмом «очищения» отовсюду, кроме эндогенной центромеры (Collins et al., 2004). Это позволяет предполагать, что центромерная идентичность может регулироваться после сборки нуклеосом. Однако неправильная локализация CENP-A у мух приводит к эктопическому формированию кинетохора (Heun et al., 2006), заставляя предполагать, что удаление неправильно включенного CENP-A может быть специфичным для S. cerevisiae. Тем не менее, вариации такой модели «негативной специфичности» стоит рассмотреть. Ключевой вопрос для всех моделей центромерной идентичности заключается в следующем: что обеспечивает специфичность? В данном случае, почему такие белки, как CENP-A, должны сохраняться только в одном сайте? Одна новая идея возникает в связи с тем фактом, что стабильная ассоциация с веретеном является тем свойством, которое уникально для функциональных центромер, кинетохоров (Mellone and Allshire, 2003). Таким образом, воспроизведение центромеры и сайт включения CENP-A могут определяться в ходе митоза, с помощью механизма, чувствующего продуктивные прикрепления кинетохора и веретена, или опосредованное веретеном натяжение. Другая идея, которую стоит рассмотреть, заключается в том, что паттерн модификации перемежающихся нуклеосом H3 белками, модифицирующими гистоны (т.е. ацетилтрансферазами, метилтрансферазами и киназами), может помогать воспроизводить центромерную идентичность вместо ассоциированных с CENP-A белков (или в дополнение к ним) (Sullivan and Karpen, 2004). По-разному модифицированные перемежающиеся субдомены H3 (рис. 14.7) могли бы создавать «пермиссивную» структуру хроматина, необходимую для сборки новой CENP-A. Идентификация факторов, требующихся для помещения CENP-A в центромеры, независимо от конкретной модели, является стратегией, которая, вероятно, обеспечит новое понимание. Биохимические и генетические исследования позволили идентифицировать некоторые из них как влияющие на сигналы CENP-A в центромерах, включая ранее известные факторы, участвующие в не зависящей от хроматина сборке хроматина. Однако ни один из идентифицированных до сих пор факторов не взаимодействует специфическим образом с CENP-A или другими белками центромерного хроматина или модификациями. Тем не менее, удивительно, что факторы все же идентифицируются, и должно скоро последовать выяснение специфических механизмов.3.5. Эпигенетика и эволюция центромер
При том значении, которое центромеры имеют для клетки и жизнеспособности организма, не может быть и речи о приобретении или утрате центромерной функции. Тогда почему же центромеры используют эпигенетические механизмы регуляции, если существенным преимуществом для отдельной клетки и организма в целом было бы иметь центромеры «зашитыми» в первичную нуклеотидную последовательность ДНК? Можно возразить, что эпигенетическая регуляция центромерной идентичности необходима для подгонки к изменениям, происходящим в ходе эволюции с хромосомами, нуклеотидными последовательностями и белками. Исследования на млекопитающих (например, приматах и сумчатых), насекомых и организмах других таксонов показали, что приобретение и утрата центромер являются характерными событиями в эволюции хромосом (Ferreri et al., 2005). Родственные виды часто различаются расположением и ассоциацией хромосомных плеч, даже в тех случаях, когда нуклеотидные последовательности ДНК почти идентичны. Эти приобретения и утраты центромер часто сопровождают транслокации и другие перестройки и, вероятно, поддерживаются ими. Например, потребность в одной, и только в одной, центромере делала бы многие из получающихся в результате дицентрических и ацентрических хромосомных перестроек бесполезными, если бы центромеры не могли инактивироваться, а неоцентромеры— активироваться (рис. 14.8а). Таким образом, способность перемещать центромеры из одной нуклеотидной последовательности ДНК в другую путем распространения, перескакивания или активации может ускорять эволюцию хромосом. Кроме того, в ходе эволюции в высокоповторяющихся сателлитных последовательностях очень часто происходят наращивания, сокращения и замены оснований и они могут быть связаны с изменениями в локализации центромер (рис. 14.86). Центромеры растений в особенности демонстрируют в ходе эволюции быстрые и значительные изменения в нуклеотидных последовательностях ДНК и в локализации (Hall et al., 2006). Неясно, однако, вызывают ли изменения ДНК перемещения центромер, или они происходят в ответ на перемещения центромер, или же и те и другие полностью независимы. Тем не менее, должен существовать механизм поддержания функции и воспроизведения центромер, не зависимый от изменений нуклеотидных последовательностей, и такой механизм обеспечивает эпигенетическая регуляция. Сравнение аминокислотных последовательностей у центромерных белков разных видов привело к предположению, что домены, связанные с CEN-ДНК, «коэволюируют», чтобы приспособиться к изменениям в сателлитных последовательностях (Malik and Henikoff, 2002; см. также главу 13). Интересный компонент этой модели предполагает, что эти изменения стимулируются «мейотическим драйвом» — явлением аллельного отбора (а по умолчанию, отбора целой хромосомы), происходящего во время мейоза. Так, центромера, обладающая самым высоким сродством к белкам CEN-хроматина, достигает наибольшего успеха во включении в функциональные зародышевые клетки (т.е. в ооцит, а не в полярное тельце в случае женского мейоза) (см. другие примеры мейотического драйва в разделе 5). Это, в свою очередь, могло бы принуждать другие центромеры к тому, чтобы приспосабливаться к тем же вариантам нуклеотидных последовательностей и белков, чтобы эффективно расходиться. Утрата такой эпигенетической метки, как CENP-A, дает другой механизм для инактивации центромеры без делеции центромерной ДНК, как показывают последствия обеднения CENP-A у многочисленных организмов (Cleveland et al., 2003). Идентификация механизмов приобретения центромеры является большим вызовом, поскольку она требует приобретения эпигенетической метки в отсутствие изменений в нуклеотидных последовательностях ДНК. Исследования экспериментально индуцированных центромер у мух позволяют предположить один такой молекулярный механизм для приобретения центромеры — за счет cis-распространения таких ключевых белков центромерного хроматина, как CENP-A (рис. 14.56) (Maggert and Karpen, 2001). Однако эта модель не может объяснить формирование неоцентромер у человека или большинство примеров приобретения центромеры в эволюции, которое может происходить на больших расстояниях от родительской центромеры. Возможно, механизм, более соответствующий этим случаям приобретения центромеры, включает неправильную локализацию CENP-A в ответ на преходящую сверхэкспрессию, приводя к формированию эктопических кинетохоров, как это наблюдали в опытах на мухах (Heun et al., 2006). Сверхэкспрессию CENP-A наблюдали в опухолях прямой кишки и груди, заставляя предполагать потенциальную связь с массивной нестабильностью генома, наблюдаемую при раке. Для прямой проверки этой гипотезы, а также ее роли в эволюции центромер необходимы дальнейшие исследования преобладания неправильной локализации CENP-A в различных типах рака у человека и сроков этой неправильной локализации в ходе инициации и прогрессии рака. Рис. 14.8. Эволюция хромосом и эпигенетическая регуляция центромерной идентичности
Пластичность центромер в отношении ассоциации со специфическими нуклеотидными последовательностями ДНК может быть нужна для приспособления к тем изменениям нуклеотидных последовательностей и хромосомным перестройкам, которые происходят в ходе эволюции, (а) Транслокации, часто наблюдаемые в ходе эволюции, могут создавать ацентрические и дицентрические хромосомы; и те, и другие в норме теряются при митотических или мейотических делениях Эпигенетическая регуляция и пластичность позволяют ацентрическим фрагментам приобрести неоцентромерную функцию, так же как инактивация одной центромеры в дицентрической хромосоме, что приводит к нормальному наследованию обоих продуктов транслокации (В.Р. = точки разрывов при транслокации). (б) У большинства эукариот центромеры погружены в гетерохроматин и повторяющиеся ДНК, особенно в высокоповторяющиеся сателлитные последовательности. В ходе эволюции эти последовательности изменяются с огромной частотой и претерпевают частые замены оснований, а также приращения и сокращения. Строгая зависимость центромерной идентичности от специфических нуклеотидных последовательностей ДНК приводила бы к утрате функций центромеры и кинетохора и к пагубной потере хромосомы. Напротив, эпигенетическая регуляция идентичности и локализации центромеры обеспечивает механизм поддержания центромер несмотря на изменения нуклеотидных последовательностей
Рис. 14.8. Эволюция хромосом и эпигенетическая регуляция центромерной идентичности
Пластичность центромер в отношении ассоциации со специфическими нуклеотидными последовательностями ДНК может быть нужна для приспособления к тем изменениям нуклеотидных последовательностей и хромосомным перестройкам, которые происходят в ходе эволюции, (а) Транслокации, часто наблюдаемые в ходе эволюции, могут создавать ацентрические и дицентрические хромосомы; и те, и другие в норме теряются при митотических или мейотических делениях Эпигенетическая регуляция и пластичность позволяют ацентрическим фрагментам приобрести неоцентромерную функцию, так же как инактивация одной центромеры в дицентрической хромосоме, что приводит к нормальному наследованию обоих продуктов транслокации (В.Р. = точки разрывов при транслокации). (б) У большинства эукариот центромеры погружены в гетерохроматин и повторяющиеся ДНК, особенно в высокоповторяющиеся сателлитные последовательности. В ходе эволюции эти последовательности изменяются с огромной частотой и претерпевают частые замены оснований, а также приращения и сокращения. Строгая зависимость центромерной идентичности от специфических нуклеотидных последовательностей ДНК приводила бы к утрате функций центромеры и кинетохора и к пагубной потере хромосомы. Напротив, эпигенетическая регуляция идентичности и локализации центромеры обеспечивает механизм поддержания центромер несмотря на изменения нуклеотидных последовательностей
Наконец, первые центромеры могли бы быть представлены голоцентрическими хромосомами; формирование кинетохоров могло бы вначале развиваться со случайной специфичностью в отношении нуклеотидной последовательности, за чем могла следовать эволюция моноцентрических хромосом, возникающих благодаря инвазии транспозонов, экспансии сателлитной ДНК и формированию фланкирующего гетерохроматина. Однако возможно также, что голоцентрические хромосомы развились из моноцентрических хромосом благодаря утрате гетерохроматиновых граничных элементов и as-распространению центромерного хроматина, примерно так же, как это происходит при возникновении неоцентромер у Drosophila (Maggert and Karpen, 2001).
4. Гетерохроматин и мейотическое спаривание / расхождение
Меотический процесс у большинства организмов охватывает (1) спаривание, которое выравнивает гомологи относительно друг друга; (2) синапсис, которое соединяет гомологи структурой, известной как синаптонемный комплекс (SC); (3) рекомбинацию, которая физически сцепляет гомологичные хромосомы и осуществляет обмен генетической информацией; (4) расхождение гомологов к противоположным полюсам в мейозе I и (5) разделение сестринских хроматид в мейозе II (рис. 14.9). Такие гетерохроматиновые элементы, как центромеры и теломеры, играют важную роль в контроле положения рекомбинационных событий в эухроматине; и наверняка гетерохроматиновые элементы (в особенности центромера) играют критическую роль в расхождении Более того, многочисленные недавние исследования убедительно свидетельствуют, что модификации гистонов и, возможно, другие эпигенетические компоненты и процессы играют критическую роль в облегчении мейотического процесса. Например, белок HIM-17 у С. elegans, который нужен для метилирования H3K9, необходим для формирования DSBs, инициирующих рекомбинацию (Reddy and Villeneuve, 2004). Аналогичным образом, для инициации DSBs у S. pombe требуется киназа гистонов (Ogino et al., 2006). Метилирование гистонов также необходимо, чтобы сделать мейотические хромосомы компетентными к завершению мейотических делений у Drosophila (Cullen et al., 2005; Ivanovska et al., 2005) и млекопитающих (De La Fuente, 2006). Рис. 14.9. Механистическое представление мейотического процесса
Пара гомологичных хромосом во время первого мейотического деления должна совершить три вещи. Во-первых, гомологи должны спариться по всей своей длине. Практически у всех организмов кульминацией этого спаривания является интимная ассоциация, при которой эти гомологи соединены вдоль всей своей длины синаптонемным комплексом. Это состояние называется синапсисом. Во-вторых, практически у всех организмов гомологичные хромосомы соединяются вместе рекомбинацией, называемой также кроссинговером. События обмена (кроссоверы) формируют структуры, называемые хиазмами, которые физически соединяют хромосомы друг с другом посредством сестринской хроматиды, представленной на каждом гомологе на обеих сторонах кроссоверного события. Как спаривание, так и рекомбинация происходят во время профазы (до разрушения ядерной оболочки). Третье важное событие, расхождение (сегрегация), происходит на MI-веретене, которое создается после разрушения ядерной оболочки. В ходе ранних стадий сборки веретена (прометафаза) хромосомы собираются вместе и образуют метафазную пластинку. У большинства животных самцы содержат центриолярные мейотические веретена, тогда как у самок большинства животных веретено ацентриолярно. В этом случае сами хромосомы образуют массу, на месте которой в конечном счете формируется метафазная пластинка, и организуют вокруг нее биполярное веретено. Коль скоро хромосомы должным образом совместно ориентированы (т.е. уравновешены в метафазной пластинке гомологичными кинетохорами, прикрепленными к противоположным полюсам веретена), ряд механизмов включают начало анафазы. В анафазе соединение (когезия) сестринских хроматид ослабляется вдоль плеч (но не возле центромер). Это растворяет связи, называемые хиазмами и созданные кроссоверами, и таким образом дает гомологам возможность разделиться и отойти к противоположным полюсам в анафазе I. Мейоз II в основе своей является гаплоидным митозом, который происходит и без репликации, и без рекомбинации
Рис. 14.9. Механистическое представление мейотического процесса
Пара гомологичных хромосом во время первого мейотического деления должна совершить три вещи. Во-первых, гомологи должны спариться по всей своей длине. Практически у всех организмов кульминацией этого спаривания является интимная ассоциация, при которой эти гомологи соединены вдоль всей своей длины синаптонемным комплексом. Это состояние называется синапсисом. Во-вторых, практически у всех организмов гомологичные хромосомы соединяются вместе рекомбинацией, называемой также кроссинговером. События обмена (кроссоверы) формируют структуры, называемые хиазмами, которые физически соединяют хромосомы друг с другом посредством сестринской хроматиды, представленной на каждом гомологе на обеих сторонах кроссоверного события. Как спаривание, так и рекомбинация происходят во время профазы (до разрушения ядерной оболочки). Третье важное событие, расхождение (сегрегация), происходит на MI-веретене, которое создается после разрушения ядерной оболочки. В ходе ранних стадий сборки веретена (прометафаза) хромосомы собираются вместе и образуют метафазную пластинку. У большинства животных самцы содержат центриолярные мейотические веретена, тогда как у самок большинства животных веретено ацентриолярно. В этом случае сами хромосомы образуют массу, на месте которой в конечном счете формируется метафазная пластинка, и организуют вокруг нее биполярное веретено. Коль скоро хромосомы должным образом совместно ориентированы (т.е. уравновешены в метафазной пластинке гомологичными кинетохорами, прикрепленными к противоположным полюсам веретена), ряд механизмов включают начало анафазы. В анафазе соединение (когезия) сестринских хроматид ослабляется вдоль плеч (но не возле центромер). Это растворяет связи, называемые хиазмами и созданные кроссоверами, и таким образом дает гомологам возможность разделиться и отойти к противоположным полюсам в анафазе I. Мейоз II в основе своей является гаплоидным митозом, который происходит и без репликации, и без рекомбинации
Хотя использование рекомбинации для обеспечения расхождения мейотических хромосом является почти универсальным, существуют также мейотические системы, в которых ассоциации гомологов могут устанавливаться без рекомбинации (т.е. так называемые ахиазматические мейотические системы). В таких системах гетерохроматиновые спаривания и, возможно, другие субстраты для эпигенетических модификаций оказываются играющими критическую роль. Это в особенности верно в отношении самок и самцов Drosophila melanogaster, но может быть верным и по отношению к дрожжам. Наконец, известны многие системы мейотического драйва — например, благоприятствование одной из аллелей в ходе мейотической сегрегации, — в которых модификация специфических гетерохроматиновых элементов вызывает или делает возможной последующую утрату инактивации специфической хромосомы или целого хромосомного набора.
4.1. Обнаружение сайта гетерохроматинового спаривания у самцов Drosophila
Первым доказательством существования гетерохроматинового элемента, опосредующего спаривание и расхождение гомологов, была идентификация структур в перицентромерном гетерохроматине, опосредующих спаривание и расхождение ахиазматических пар половых хромосом в сперматогенезе у самцов Drosophila. Было показано, что эти структуры, известные как коллохоры, соответствую! повторам рДНК; было показано, что интеграция генов рДНК в лишенные коллохоров Х-хромосомы восстанавливает спаривание Х-Y в сайте вставки рДНК (McKee, 1998). Ключевым сегментом повтора рДНК в отношении спаривания является повторяющаяся последовательность длиной 240 п.о. в межгенном спейсере. Когда эта последовательность в 240 п.о. присутствует во многих копиях, она облегчает спаривание и последующее расхождение хромосом X и Y в мейозе у самцов Drosophila. Хотя степень, с которой гетерохроматиновые ассоциации в сперматоцитах Drosophila облегчают эухроматиновое спаривание, остается открытым вопросом, ниже мы обсудим ряд наблюдений, позволяющих предполагать, что неспособность опосредовать или поддерживать спаривание приводит, оказывается, к неправильной активации или инактивации гетерохроматина. Результатом такого события часто оказываются нарушения сперматогенеза (McKee, 1998).4.2. Спаривание гетерохроматина облегчает расхождение у самок Drosophila
Имеются два главных механизма для обеспечения расхождения (сегрегации) гомологов у самок Drosophila: система хиазм, которая опосредует расхождение гомологов, которые подверглись кроссинговеру, и ахиазматическая система, которая обеспечивает расхождене тех пар гомологов. которые не претерпели кроссинговер. Например, мелкие точечные четвертые хромосомы никогда не претерпевают кроссинговер, и тем не менее они расходятся друг с другом во время мейоза с очень высокой степенью надежности. Цитологические и генетические эксперименты показали, что для ахиазматического спаривания и расхождения необходим гетерохроматин. Спаривание гомологичных гетерохроматиновых участков ахиазматических хромосом поддерживается начиная с ранней профазы и до того момента, когда ахиазматические гомологи начинают отделяться от своих партнеров в прометафазе I (рис. 10) (Dernburg et al., 1996). Более того, опыты с использованием делеций показали, что гомологичная ахиазматическая сегрегация у Drosophila полностью зависит от гетерохроматиновых гомологий (Hawley et al., 1993; Karpen et al., 1996). Все еще неясно, является ли способность опосредовать эти события спаривания и расхождения общим свойством гетерохроматиновых последовательностей или белков хроматина или же результатом ряда специфических участков, диспергированных в гетерохроматине.4.3. Роль центромеры в облегчении ахиазматической сегрегации у почкующихся дрожжей
Хотя фланкирующие гетерохроматиновые районы, по-видимому, достаточны для того, чтобы опосредовать ахиазматическую сегрегацию у самок Drosophila, кажется вероятным, что у почкующихся дрожжей одни только центромерные последовательности могут быть способны играть эту роль. Дин Даусон (Dean Dawson) и его сотрудники проанализировали мейоз у дрожжей, несущих пару гомеологичных (т.е. частично гомологичных) хромосом, происходящих от разных видов дрожжей (Kemp et al., 2004). Несмотря на тот факт, что эти хромосомы несут сходные наборы генов, они дивергировали в достаточной степени, чтобы между ними не происходил кроссинговер; тем не менее, они надежно расходились. Хотя плечи этих гомеологичных хромосом соединяются друг с другом во время профазы мейоза не чаще, чем плечи гетерологичных хромосом, эти гомеологичные хромосомы, тем не менее, обнаруживают высокую степень центромерного спаривания (Kemp et al., 2004). Более того, это спаривание уменьшается в присутствии третьей безобменной хромосомы, даже если она несет другой центромерный участок; это заставляет предполагать, что центромерное спаривание действительно является независимым от последовательности. Рис. 14.10. У самок Drosophila melanogaster имеются два механизма обеспечения расхождения гомологов
Верхний ряд изображений повторяет канонический процесс, как он показан на рис. 14.9. Нижний ряд описывает мейотический процесс у самок Drosophila, у которых необычная диплотена. При каноническом мейозе диплотена (иногда называемая «диплотена— диакинез») определяется как последняя стадия в профазе, на которой гомологи отталкиваются друг от друга и удерживаются вместе лишь хиазмами. Однако у самок Drosophila в конце профазы отталкиваются (или разделяются) лишь эухроматиновые плечи хромосом; гетерохроматиновые районы остаются тесно спаренными даже позже конца профазы (разрушения ядерной оболочки) и вплоть до прометафазы (Dernburg et al., 1996). Как обсуждается в тексте, это спаривание гетерохроматина и необходимо, и достаточно для обеспечения надежной сегрегации в отсутствие кроссинговера (Hawley et al., 1993; Karpen et al., 1996)
Рис. 14.10. У самок Drosophila melanogaster имеются два механизма обеспечения расхождения гомологов
Верхний ряд изображений повторяет канонический процесс, как он показан на рис. 14.9. Нижний ряд описывает мейотический процесс у самок Drosophila, у которых необычная диплотена. При каноническом мейозе диплотена (иногда называемая «диплотена— диакинез») определяется как последняя стадия в профазе, на которой гомологи отталкиваются друг от друга и удерживаются вместе лишь хиазмами. Однако у самок Drosophila в конце профазы отталкиваются (или разделяются) лишь эухроматиновые плечи хромосом; гетерохроматиновые районы остаются тесно спаренными даже позже конца профазы (разрушения ядерной оболочки) и вплоть до прометафазы (Dernburg et al., 1996). Как обсуждается в тексте, это спаривание гетерохроматина и необходимо, и достаточно для обеспечения надежной сегрегации в отсутствие кроссинговера (Hawley et al., 1993; Karpen et al., 1996)
Если для центромерного спаривания не требуется гомология последовательностей, почему тогда расхождение гомеологичных хромосом у дрожжей является неслучайным? Кемп и сотрудники (Kemp et al., 2004) предполагают, что «Именно обмен и следующий за обменом синапсис помещают гомологичные центромеры рядом и блокируют случайное спаривание центромер». Согласно этой модели, центромеры могли бы первоначально спариваться полностью независимым от последовательности образом. По мере того как плечи гомологичных хромосом претерпевают обмены, их центромеры «выдергиваются» из потенциально негомологичных ассоциаций и принуждаются к гомологичным спариваниям. Центромеры, оставляемые таким зависимым от обменов ресортингом как «синглеты», могут затем свободно реассоциироваться с другими неспаренными центромерами, приводя в конечном счете к сприванию центромер тех хромосом, которые по тем или иным причинам не обменивались. В то время как Кемп и сотрудники приводят в качестве аналогии прогрессивное формирование пар из более привлекательных танцоров на школьной танцевальной вечеринке, что, по умолчанию, заставляет менее привлекательных становиться партнерами по танцам, более формальный взгляд на этот процесс был описан Род ой Грелль (Rhoda Grell) десятилетия тому назад. Она предположила, что коль скоро обменные спаривания произошли, имеющиеся в наличии хромосомы были бы свободны для реассоциации (Grell, 1976). Действительно, недавние исследования показали, что во время мейоза все дрожжевые центромеры негомологично ассоциированы и подвергаются процессу ресортинга, соединяющего в пары гомологичные центромеры после рекомбинации (Tsubouchi and Roeder, 2005). В совокупности эти исследования свидетельствуют о том, что независимое от последовательности узнавание центромерных районов играет важную роль в создании хромосомных ассоциаций в раннем мейозе. В то время как эти связи могут часто соединять негомологичные хромосомы, негомологичные ассоциации могут корректироваться физическими связями между гомологичными хромосомами, создаваемыми при обменах. Механизм, посредством которого такие обмены, происходящие на больших расстояниях от самих центромер, могут облегчать такую центромерную пересортировку, остается неясным. Однако соблазнительно по крайней мере высказать предположение, что «соединение» хиазм (физического выражения события обмена) с центромерами могло бы быть одной из функций синаптонемного комплекса (SC). В соответствии с такой моделью, SC служил бы для сообщения двум гомологичным центромерам о том, что хиазма действительно сформирована, индуцируя таким образом ее совместную ориентацию задолго до разрушения ядерной оболочки.
4.4. Ассоциированный с гетерохроматином локус Ph1 у кукурузы и его роль в опосредовании гомологичного versus негомологичного спаривания
У пшеницы правильное спаривание гомологичных хромосом и предотвращение гомеологичных спариваний опосредуются локусом Phi (Griffiths et al., 2006). В отсутствие гена Phi спаривание и обмен между гомеологичными хромосомами становятся частыми (Luo et al., 1996) и уменьшается надежность как мейотического, так и митотического спаривания. Значение неправильного спаривания центромер в терминах более беспорядочного спаривания и обменов между плечами гомеологичных хромосом остается спорным (Dvorak and Lukaszewski, 2000). Однако ясно, что эффекты делетирования Phi могут быть супрессированы добавлением к геному гетерохроматиновых сверхчисленных В-хромосом (Bennett et al., 1974). Недавно локус Phi был локализован в интервале величиной 2,5 млн. п.о., в котором содержится субтеломерный гетерохроматин, вставленный в кластер генов, родственных cdc2, что произошло после полиплоидизации, характерной для эволюции современных пшениц (Griffiths et al., 2006). Хотя в совокупности эти исследования локуса Phi позволяют предположить эпигенетическое регулирование выбора партнера в мейозе пшеницы, роль (или роли) гетерохроматина в опосредовании предотвращения гомеологичного спаривания и, таким образом, в стимулировании гомологичных спариваний остается несколько неясной.5. Гетерохроматин и мейотический драйв
Существуют многочисленные случаи, когда гетерохроматиновые районы играют роль в опосредовании процесса, называемого мейотическим драйвом. Термин «мейотический драйв» обозначает способность одного гомолога увеличивать вероятность его передачи за счет своего партнера, так что в гетерозиготе А/а гаметы, несущие А, производятся или используются чаще, чем гаметы, несущие а. Мы сосредоточимся прежде всего на тех случаях, где гетерохроматиновые элементы вызывают утрату или деструкцию их гомологов. Хотя мы детально описываем лишь систему CD у D. melanogaster и утерю хромосом у Sciara и Nasonia, существуют и другие системы связанного с гетерохроматином мейотического драйва, такие как гетерохроматинизация и последующая утеря хромосомы, ограниченной зародышевой линией, у зяблика, и накоплением В-хромосом у кукурузы.5.1. Нарушитель сегрегации (Segregation Distorter) у самцов Drosophila
Одним из наиболее впечатляющих примеров роли гетерохроматина в опосредовании мейотического драйва является гаплотип у D. melanogaster; изолированный из природной популяции и названный Segregation Distorter [нарушитель сегрегации], или просто SD (Sandler and Hiraizumi, 1959). Вторая хромосома плодовой мушки, несущая гаплотип SD, обладает способностью элиминировать свой гомолог дикого типа (обозначаемый SD+) в процессе созревания спермы и делает это, предотвращая правильную конденсацию этого гомолога. Только сперма, несущая - SD, завершает созревание, становится зрелыми сперматидами и, следовательно, передается потомству. Хромосома с SD несет несколько дискретных генетических элементов, существенных для ее функции. Первым из них является сам эухроматиновый мутант 5Z), вызывающий дисфункцию сперматид, действуя на отдельный гетерохроматиновый элемент-мишень, расположенный на гомологе и называемый Rsp (Ganetzky, 1977). Сам Rsp включает повторяющийся элемент, локализованный в перицентромерном гетерохроматине второй хромосомы (Wu et al., 1988). Чувствительность гомологичной хромосомы SD+ к нарушению конденсации зависит от числа копий повтора Rsp. Имеется также ряд других элементов, обычно локализованных в хромосомах, несущих SD и укрепляющих способность SD вызывать нарушение расхождения. Сама мутация SD является результатом небольшой тандемной дупликации, включающей ген RanGAP. Эта перестройка производит мутантный белок RanGAP, усеченный на 234 аминокислоты на карбоксильном конце и вызывающий дефект в ядерном транспорте (Kusano et al., 2003). Почему такой дефект может приводить к тому, что не происходит конденсация хроматина хромосом, несущих локус Rsp, остается неясным (но см. обсуждение возможных механизмов: Kusano et al., 2003).5.2. Утеря отцовской хромосомы у Sciara и картирование реагирующего элемента
Мухи-сциариды претерпевают сложные процессы элиминации отцовской хромосомы и в соме, и в зародышевом пути. Все эмбрионы возникают из зигот генотипа АтАрХтХрХр, что означает, что они получили один набор аутосом и одну Х-хромосому от своих матерей и один набор аутосом и две копии Х-хромосом от своих отцов. Соматические клетки тех эмбрионов, которые должны стать самками, утрачивают одну из двух полученных от отца Х-хромосом, а соматические клетки эмбрионов, которые должны развиваться как самцы, утрачивают две полученные от отца Х-хромосомы. Критический прорыв в действительный механизм элиминации Х-хромосомы, включающий неполное разделение сестринских хроматид, был сделан Сен Фаллем и Салливаном (Saint Phalle and Sullivan, 1996). Утрата отцовской Х-хромосомы происходит и в клетках, составляющих зародышевый путь. На более поздних стадиях развития зародышевой линии единственная хромосома Хр отбрасывается у обоих полов. Вслед за утратой этой отцовской Х-хромосомы весь отцовский хромосомный набор оказывается деконденсированным, как показывает его более светлая окраска. Это различие в конденсации поддерживается у обоих полов до позднего первого личиночного возраста, иначе говоря до начала гениальных митотических делений. На этом этапе и материнские, и отцовские хромосомы выглядят полностью конденсированными. Хотя наступающий мейоз у самок цитологически нормален, мейоз у самцов необычен в двух отношениях. Во-первых, элиминируется весь отцовский хромосомный набор и, во-вторых, полученная от матери Х-хромосома претерпевает направленное нерасхождение в мейозе И, и формируется спермий с одним набором аутосом и двумя Х-хромосомами. Интересно, что с этими паттернами элиминации хромосом коррелирует ацетилирование гистонов H3 и Н4 (Goday and Ruiz, 2002). Сначала, в ходе раннего развития зародышевой линии, лишь половина хромосом, а именно отцовский набор, высокоацетилированы по H3 и Н4. Как отмечают Годей и Руиц (Goday and Ruiz, 2002), «продемонстрированная здесь дифференциальная метка хромосом зародышевого пути ацетилированием гистонов согласуется с ранними данными о существовании различий в окрашивании хроматина между обоими родительскими геномами в зародышевых клетках». Исключением из этого правила является отцовская Х-хромосома, которая будет элиминирована в ходе развития зародышевой линии: она не сильно ацетилирована. На более поздних стадиях, перед началом гениальных митотических делений, все хромосомы, и материнские, и отцовские, ацетилированы в высокой степени. Интереснее всего, что в мейозе у самцов, в ходе которого утрачивается весь отцовский набор, этот отцовский набор весь недоацетилирован по H3 и Н4 по сравнению с высокоацетилированным набором хромосом, происходящим от матери. Хотя отношение этих изменений в модификации гистонов к последующим элиминационным событиям в механистических терминах остается неясным, кажется вероятным, что такие различия маркируют хромосомы и для мейотической, и для митотической элиминации.5.3. Утеря отцовских хромосом у Nasonia
У паразитической осы Nasonia vitripennis из неоплодотворенных (гаплоидных) яиц развиваются самцы, тогда как из оплодотворенных (диплоидных) яиц обычно развиваются самки (обзор см.: Beukeboom and Werren, 1993). Однако имеется сверхчисленная, или В-хромосома, известная как хромосома PSR, которая заставляет оплодотворенные яйца развиваться в самцов. Хромосома PSR выполняет эту работу по реверсии пола, вызывая сверхконденсацию и утерю всех отцовских хромосом (кроме себя самой?) в оплодотворенных яйцах (Werren et al., 1987). Хромосома PSR в основном представлена гетерохроматином и содержит тандемно повторяющиеся последовательности, не представленные в аутосомах. Попытки картировать эту хромосому с помощью делеций позволили получить нефункциональные хромосомы PSR, которые могут передаваться дочерним особям (Beukeboom and Werren, 1993). Однако в этих исследованиях не удалось идентифицировать в этой хромосоме специфический домен или класс повторов, который отвечал бы за ее способность включать деструкцию отцовского генома. Следует, однако, отметить обнаружение одного такого делеционного деривата, который ревертировал из нефункционального состояния в функциональное в пределах одной линии. Авторы (Beukeboom and Werren, 1993) предположили, что некоторый набор повторов на хромосоме PSR может функционировать как «сток» для продукта, в норме необходимого для правильного процессинга отцовских хромосом после оплодотворения. Действительное существование импринтированных «различий состояний» между отцовскими и материнскими наборами, на которые могла бы действовать хромосома PSR, позволяют предполагать исследования роли геномного импринтинга в детерминации пола у Nasonia (Dobson and Tanouye, 1998).5.4. Вздутие 10 у кукурузы — роль последовательностей, соответствующих гетерохроматиновым «вздутиям», в облегчении расхождения хромосом в мейозе I
Еще один пример гетерохроматиновых элементов, ассоциированных с мейотическим драйвом, наблюдается у растений, содержащих хромосомы с гетерохроматиновыми вставками, известными как «вздутия» (knobs), или «псевдокинетохоры»; они благоприятствуют передаче хромосомы, несущей такое вздутие, в женском мейозе. Молекулярная организация вздутий охватывает два набора тандемных повторов, каждый из которых, по-видимому, представлен в виде длинной непрерывной последовательности (Dawe and Hiatt, 2004). Функционирование гетерохроматиновых вздутий как псевдокинетохоров зависит от варианта хромосомы 10, известного как аномальная хромосома 10 (Ab10). Когда Ab10 присутствует, вздутия формируют псевдокинетохоры, которые движутся к полюсам веретена мейоза I впереди эндогенных центромер, и скорость этого движения пропорциональна величине вздутия. Однако вздутия проявляют псевдокинетохорную активность только тогда, когда они находятся в cis-конфигурации с эндогенной центромерой; они также обнаруживают только латеральные ассоциации с микротрубочками в отличие от ассоциаций «в торец», демонстрируемых полностью функциональными эндогенными кинетохорами Таким образом, несмотря на терминологическую путаницу, вздутия не являются «неоцентромерами» (см. раздел 3.3), поскольку они не способны стимулировать нормальное расхождение сами по себе, не рекрутируют белки и не обнаруживают функций, связанных с эндогенными центромерами и кинетохорами. В терминах мейотического драйва обмены в мейоцитах, гетерозиготные по данному вздутию, приводят к формированию кроссоверного продукта, несущего это вздутие только на одной из двух его хроматид (Rhoades and Dempsey, 1966). Псевдокинетохорное поведение этого вздутия направляет несущую вздутие хроматиду в один из четырех продуктов мейоза, известный как базальная мегаспора, который является одним из двух «внешних» ядер (из четырех мейотических продуктов) и который только один и имеется для оплодотворения (Rhoades and Dempsey, 1966; Yu et al., 1997). Таким образом, причина мейотического драйва в этой системе — опосредованное гетерохроматином направленное расхождение в функциональную гамету одной хроматиды за счет ее сестры. Каким образом эпигенетические механизмы регулируют поведение вздутий и псевдокинетохорную активность, в настоящее время неизвестно.6. Сайленсинг генов неспаренными ДНК в мейозе
Имеются многочисленные примеры случаев, в которых отсутствие мейотического спаривания приводит к эпигенетическому сайленсингу неспаренной ДНК. В случае Neurospora этот сайленсинг обычно ограничен неспаренными участками.6.1. Мейотический сайленсинг неспаренной ДНК в мейозе у Neurospora
Необычный пример сайленсинга генов в ходе мейоза, который называют мейотическим сайленсингом, вызываемым неспаренной ДНК (MSUD, meiotic silencing by unpaired DNA), был описан у Neurospora crassa (обзор см. Hynes and Todd, 2003). Этот процесс позволяет неспаренной копии данного гена сайленсировать и себя, и любые другие спаренные копии этого гена (рис. 14.11). Этот процесс был выявлен с помощью характеристики гетерозиготных делеций в гене ascospore maturation 1 (asm-1). Однако, чтобы инициировать сайленсинг, неспаренная последовательность должна быть достаточного размера и обладать гомологией с продуктом (иРНК) этого гена (Lee et al., 2004). Такие последовательности, однако, не должны содержать соответствующий промоторный элемент для рассматриваемого гена. Сайленсинг ограничен геном, определяемым неспаренной последовательностью, и не распространяется на соседние, спаренные гены (Kutil et al., 2003). Мутации в гене sad-1, который кодирует белок, обладающий существенной гомологией с РНК-зависимыми РНК-полимеразами (RdRP), участвующими в путях RNA1, блокируют процесс MSUD (Shiu and Metzenberg, 2002), что позволяет предположить, что «для MSUD необходимы синтез двунитевой РНК и, вероятно, амплификация РНК» (Hynes and Todd, 2003). Хотя примеры MSUD наблюдались для генов, которые в норме экспрессируются в мейозе, MSUD не был выявлен для генов, экспрессирующихся только в вегетативных клетках, что является дополнительным доводом в пользу участия RNAi (Hynes and Todd, 2003). Дальнейшая поддержка этой идеи вытекает из наблюдений, согласно которым для MSUD необходим белок, подобный Argonaute и Dicer (Leeetal., 2003). Рис. 14.11. Модели, показывающие, каким образом транскрипция неспаренной ДНК приводит к различным уровням сайленсинга в мейозе
В модели а предполагается, что одиночные транскрипционные комплексы в более крупных петлях обладают большей транскрипционной активностью, чем в более мелких, что обозначается числом красных концентрических кругов. Модель б предполагает, что более крупные петли могут содержать большее количество транскрипционных комплексов (красные шарики), чем более мелкие петли, (в) В обеих моделях не спаренная ДНК в больших петлях продуцировала бы более высокие концентрации siRNAs (показано величиной стрелок) и, таким образом, больший объем сайленсинга (адаптировано, с любезного разрешения, из Lee et al., 2004 [©Genetics Society of America])
Рис. 14.11. Модели, показывающие, каким образом транскрипция неспаренной ДНК приводит к различным уровням сайленсинга в мейозе
В модели а предполагается, что одиночные транскрипционные комплексы в более крупных петлях обладают большей транскрипционной активностью, чем в более мелких, что обозначается числом красных концентрических кругов. Модель б предполагает, что более крупные петли могут содержать большее количество транскрипционных комплексов (красные шарики), чем более мелкие петли, (в) В обеих моделях не спаренная ДНК в больших петлях продуцировала бы более высокие концентрации siRNAs (показано величиной стрелок) и, таким образом, больший объем сайленсинга (адаптировано, с любезного разрешения, из Lee et al., 2004 [©Genetics Society of America])
Предположили, что MSUD является кульминацией процесса, состоящего из двух частей: trans-узнавание [trans-sensing] и MSUD (Pratt et al., 2004). Процесс «trans-узнавания», который оказывается зависимым от метилирования ДНК. позволяет данной нуклеотидной последовательности ДНК «чувствовать» идентичность или гомологию спаренных районов в контексте мейотической профазы. Коль скоро неспаренные районы оказываются идентифицированными таким образом, вступает в действие процесс MSUD, чтобы подавить экспрессию этих последовательностей. PHК-зависимый механизм мейотического сайленсинга неспаренной ДНК был также хорошо документирован у С. elegans. ДНК, у которой в мейозе нет спаривающегося партнера, становится мишенью метилирования гистонов по H3K9 (Bean et al., 2004). Для этого механизма сайленсинга требуется РНК-зависимая РНК-полимераза (EGO-1); однако ему не нужен Dicer (Maine et al., 2005).
6.2. Сайленсинг асинапсных хромосом у мыши
Мейотический сайленсинг неспаренной ДНК был продемонстрирован и у обоих полов мыши (Baarends et al., 2005; Turner et al., 2005). А именно, неспаренные хромосомные районы в мейозе самцов или неспаренные Х-хромосомы в мейозе самок являются транскрипционно «молчащими» и маркированы убиквитинированием гистона Н2А — оба эти свойства характерны для тельца XY, в норме присутствующего в мужских мейотических клетках (Baarends et al., 2005). Сообщалось также, что неспаренная ДНК, возникающая в результате гетерозиготности по транслокациям у мышей, была сайленсирована рекрутированием киназы «контрольной точки» ATR со стороны BRCA1 примерно так же, как это наблюдается для сайленсинга X- и Y-хромосом в ходе нормального мужского мейоза (Turner et al., 2005).6.3. Дисфункция половой хромосомы у Drosophila
Эухроматиновые примеры MSUD не известны ни у того, ни у другого пола D. melanogaster. Более того, масштабное исследование эухроматиновых делеций и, что более важно, дупликаций делает крайне маловероятным, что такие гены существуют. С другой стороны, хорошо документировано, что делеции перицентромерного Х-гетерохроматина взаимодействуют с транслокациями «Y — аутосома», вызывая полную мужскую стерильность (обзор см. McKee, 1998). Эту стерильность нельзя подавить, добавив назад либо полную Y-хромосому, либо полную дупликацию Х-гетерохроматина. МакКи (McKee, 1998) предположил, что стерильность транслокаций типа «Y — аутосома» обусловлена присутствием мейотической «контрольной точки», которая детектирует неспаренные или слабоспаренные половые хромосомы. Основываясь на описанных выше примерах MSUD у разных эукариот, мы предполагаем альтернативное объяснение, заключающееся в том, что присутствие неспаренных последовательностей в X- и Y-хромосоме включает сайленсинг существенных элементов, функция которых необходима для нормальной фертильности.7. Перспективы и выводы
На эукариотические хромосомы некогда смотрели как на грузовики, полуприцепы, заполненные генами и приводимые в движение «моторами» в кинетохоре и с теломерами в роли «бамперов». Ранние работы на почкующихся дрожжах подкрепляли точку зрения, согласно которой свойства ключевых элементов этих «транспортных средств» прямо и непосредственно вытекали из нуклеотидных последовательностей их ДНК. Однако анализ таких структур, как центромеры высших организмов, привел нас к точке зрения, согласно которой элементы наследственности закодированы в большей степени как состояние хроматина, чем как просто нуклеотидная последовательность ДНК. Концепция факультативного гетерохроматина, разработанная, чтобы объяснить X-инактивацию, или распространение «инертности», чтобы объяснить мозаичность, обусловленную эффектом положения, сделались составными частями нашего понимания дупликаций генома, репарации, а также митотического и мейотического наследования иактивностей соответствующих хромосомных районов. В некоторых отношениях удивительно, что такие существенные функции кодируются эпигенетически; «прошив ка» в последовательностях ДНК кажется, на первый взгляд, более стабильным механизмом для обеспечения успешной хромосомной наследственности. Однако природа полна примерами функциональных «изменений состояния», связанных с дупликацией и расхождением хромосом, таких как неоцентромеры у млекопитающих и мух, мейотический драйв в различных системах и мириады явлений направленной утери хромосом. Многие элементы наследственности связаны с высоконестабильными повторяющимися ДНК, по причинам, которые в настоящее время неясны, и эволюция сопровождается крупно- и мелкомасштабными изменениями генома, такими как мутации и хромосомные перестройки. Возможно, удивительный объем пластичности в регуляции элементов наследственности существен для освоения изменений в нуклеотидных последовательностях ДНК и, может быть, необходим для протекания эволюции. В той мере, в какой нам дозволено бросить беглый взгляд в будущее, мы можем догадываться, что обнаруженные до сих пор системы представляют лишь верхушку эпигенетического айсберга, что хромосомные функции связаны в большей степени с хроматином, чем просто с нуклеотидными последовательностями ДНК. Мы ожидаем появления на горизонте многих новых примеров этого.Литература
Altheim B.A. and Schultz M.C., 1999. Histone modification governs the cell cycle regulation of a replication-independent chromatin assembly pathway in Saccharomyces cerevisiae. Proc. Natl. Acad. Sci. 96: 1345-1350. Amor D.J., Kalitsis P., Sumer H., and Choo K.H., 2004a. Building the centromere: From foundation proteins to 3D organization. Trends Cell Biol. 14: 359. Amor D.J., Bentley K., Ryan J., Perry J., Wong L., Slater H., and Choo K.H., 2004b. Human centromere repositioning “in progress”. Proc. Natl. Acad. Sci. 101: 6542-6547. Annunziato A.T., 2005. Split decision: What happens to nucleosomes during DNA replication? J. Biol. Chem. 280: 12065-12068. Arents G., Burlingame R.W., Wang B.C., Love W.E., and Moudrianakis E.N., 1991. The nucleosomal core histone octamer at 3.1A resolution: A tripartite protein assembly and a left-handed superhelix. Proc. Natl. Acad. Sci. 88: 10148-10152. Becker P.B. and Horz W., 2002. ATP-dependent nucleosome remodeling. Annu. Rev. Biochem. 71: 247-273. Belotserkovskaya R., Oh S., Bondarenko V.A., Orphanides G., Studitsky V.M., and Reinberg D., 2003. FACT facilitates transcription-dependent nucleosome alteration. Science 301: 1090-1093. Chadwick B.R and Willard H.R., 2001. A novel chromatin protein, distantly related to histone H2A, is largely excluded from the inactive X chromosome. J. Cell Biol. 152: 375-384. Chadwick B.R and Willard H.R., 2004. Multiple spatially distinct types of facultative heterochromatin on the human inactive X chromosome. Proc. Natl. Acad. Sci. 101: 17450-17455. Downs J.A., Allard S., Jobin-Robitaille O., Javaheri A., Auger A., Bouchard N., Kron S.J., Jackson S.P., and Cote J., 2004. Binding of chromatin-modifying activities to phosphorylated histone H2A at DNA damage sites. Mol. Cell 16: 979-990. Dryhurst D., Thambirajah A.A., and Ausio J., 2004. New twists on H2A.Z: A histone variant with a controversial structural and functional past. Biochem. Cell Biol. 82: 490-497. Fan Y., Nikitina T., Morin-Kensicki E.M., Zhao J., Magnuson T.R., WoodcockC.L., and Skoultchi A.I., 2003. HI linkerhistonesare essential for mouse development and affect nucleosome spacing in vivo. Mol. Cell Biol. 23: 4559-4572. Femandez-Capetillo O., Mahadevaiah S.K., Celeste A., Romamenko P.J., Camerini-Otero R.D., BonnerW.M., ManovaK., Burgoyne P., and Nussenzweig A., 2003. H2AX is required for chromatin remodeling and inactivation of sex chromosomes in male mouse meiosis. Dev. Cell 4: 497-508. Formosa T, Ruone S., Adams M.D., Olsen A.E., Eriksson P., Yu Y., Roades A.R., Kaufman P.D., and Stillman D.J., 2002. Defects in SPT16 or POB3 (yFACT) in Saccharomyces cerevisiae cause dependence on the Hir/Hpc pathway: Polymerase passage may degrade chromatin structure. Genetics 162: 1557-1571 Henikoff S. and Ahmad K., 2005. Assembly of variant histones into chromatin. Annu. Rev. Cell Dev. Biol. 21: 133-153. Jenuwein T., 2001. Re-SET-ting heterochromatin by histone methyltransferases. Trends Cell Biol. 11: 266-273. Jenuwein T. and Allis C.D., 2001. Translating the histone code Science 293: 1074-1080. Kamakaka R.T. and Biggins S., 2005. Histone variants: Deviants? Genes Dev., 19: 295-310. Krogan N.J., Baetz K., Keogh M.C., Datta N., Sawa C, KwokT.C., Thompson N.J., Davey M.G., Pootoolal J., Hughes T.R., et al., 2004. Regulation of chromosome stability by the histone H2A variant Htzl, the Swrl chromatin remodeling complex, and the histone acetyltransferase NuA4. Proc. Natl. Acad. Sci. 101: 13513-13518. Kurdistani S.K., Tavazoie S., and Grunstein M., 2004. Mapping global histone acetylation patterns to gene expression. Cell 117: 721-733. Ladurner A.G., 2003. Inactivating chromosomes: A macro domain that minimizes transcription. Mol. Cell 12: 1-3. Lowndes N.R. and Toh G.W., 2005. DNA repair: The importance of phosphorylating histone H2AX. Curr. Biol. 15: R99-R102. Loyola A. and Almouzni G., 2004. Histone chaperones, a supporting role in the limelight. Biochim. Biophys. Acta 1677: 3-11. Luger K., Mader A.W., Richmond R.K., Sargent D.R., and Richmond T.J., 1997. Crystal structure of the nucleosome core particle at 2.8 E resolution. Nature 389: 251-260. Malik H.S. and Henikoff S., 2003. Phylogenomics of the nucleosome. Nat. Struct. Biol. 10: 882-891. Marc F., Sandman K., Lurz R., and Reeve J.N., 2002. Archaeal histone tetramerization determines DNA affinity and the direction of DNA supercoiling. J. Biol. Chem. 277: 30879-30886. Marzluff W., Rand Duromo R.J., 2002. Histone mRNA expression: Multiple levels of cell cycle regulation and important developmental consequences. Curr. Opin. Cell Biol. 14: 692-699. Marzluff W.R., Gongidi P., Woods K.R., Jin J., and Maltais L.J., 2002. The human and mouse replication-dependent histone genes. Genomics 80: 487-498. Morrison A.J. and Shen X., 2005. DNA repair in the context of chromatin. Cell Cycle 4: 568-571. O’Neill L.P., Randall T.E., Lavender J., Spotswood H.T., Lee J.T., and Turner B.M., 2003. X-linked genes in female embryonic stem cells carry an epigenetic mark prior to the onset of X inactivation. Hum. Mol. Genet. 12: 1783-1790. Palmer D.K., O’Day K., and Margolis R.L., 1990. The centromere specific histone CENP-A is selectively retained in discrete foci in mammalian sperm nuclei. Chromosoma 100: 32-36. Palmer D.K., O’Day K., Trong H.L., Charbonneau H., and Margolis R.L., 1991. Purification of the centromere-specific protein CENP-A and demonstration that it is a distinctive histone. Proc. Natl. Acad. Sci. 88: 3734-3738. Phair R.D., Scaffidi P., Elbi C, Vecerova J., DeyA., Ozato K., Brown D.T., Hager G., Bustin M., and Misteli T., 2004. Global nature of dynamic protein-chromatin interactions in vivo: Three-dimensional genome scanning and dynamic interaction networks of chromatin proteins. Mol Cell. Biol. 24: 6393-6402. Rakyan V. and Whitelaw E., 2003. Transgenerational epigenetic inheritance. Curr. Biol. 13: R6. Sarma K. and Reinberg D., 2005. Histone variants meet their match. Nat. Rev. Mol. Cell Biol. 6: 139-149. Schubeler D., MacAlpine D.M., Scalzo D., WirbelauerC., Kooperbeig C., van Leeuwen R, Gottschling D.E., O’Neill L.P., Turner B.M., Delrow J., et al. The histone modification pattern of active genes revealed through genome-wide chromatin analysis of a higher eukaryote. Genes Dev. 18: 1263-1271. Schwartz B.E. and Ahmad K., 2005. Transcriptional activation triggers deposition and removal of the histone variant H3.3. Genes Dev., 19: 804-814. Shi Y., Lan R., Matson C., Mulligan P., Whetstine J.R., Cole P.A., Casero R.A., and Shi Y., 2004. Histone demethylation mediated by the nuclear amine oxidase homolog LSD1. Cell 119: 941-953. Sullivan B.A. and Karpen G.H., 2004. Centromeric chromatin exhibits a histone modification pattern that is distinct from both euchromatin and heterochromatin. Nat. Struct. Mol. Biol. 11: 1076-1083. Suto R.K., Clarkson M.J., Tremethick D.J., and Luger K., 2000. Crystal structure of a nucleosome core particle containing the variant histone H2A.Z. Nat. Struct. Biol. 7: 1121-1124. Talbert P.B., Bryson T.D., and Henikoff S., 2004. Adaptive evolution of centromere proteins in plants and animals. /. Biol. 3: 18. Waterborg J.H., 1993. Dynamic methylation of alfalfa histone H3. J. Biol. Chem. 268: 4918-4921. Weiler K.S. and Wakimoto B.T., 1995. Heterochromatin and gene expression in Drosophila. Annu. Rev. Genet. 29: 577-605. Wieland G., Orthaus S., Ohndorf S., Diekmann S., and Hemmerich P., 2004. Functional complementation of human centromere protein A (CENP-A) by Cse4p from Saccharomyces cerevisiae. Mol Cell. Biol. 24: 6620-6630. Witt O., Albig W., and Doenecke D., 1996. Testis-specific expression of a novel human H3 histone gene. Exp. Cell Res. 229: 301-306. Wolffe A.P., 1992. Chromatin: Structure andfunction. Academic Press, San Diego.Глава 15. Эпигенетическая регуляция Х-хромосом у С. elegans
 Susan Strome1 и William G. Kelly2
1Department of Biology, Indiana University, Bloomington, Indiana 47405 2Biology Department, Emory University, Atlanta, Georgia 30322
Susan Strome1 и William G. Kelly2
1Department of Biology, Indiana University, Bloomington, Indiana 47405 2Biology Department, Emory University, Atlanta, Georgia 30322
Общее резюме
Механизм детерминации пола у почвенной нематоды Caenorhabditis elegans базируется на соотношении Х-хромосом и наборов аутосом (отношение Х:А). Диплоидные животные с двумя Х-хромосомами (отношение Х:А равно 1) развиваются как гермафродиты, тогда как животные с одной Х-хромосомой (отношение Х:А равно 0,5) развиваются в самцов. Это различие в дозе Х-хромосом между двумя полами, если оно не модулируется, обычно ведет к разным уровням экспрессии сцепленных с X генов и к летальности у одного пола. В этой главе мы обсуждаем разные эпигенетические стратегии, используемые в соматических тканях и в зародышевом пути для модуляции экспрессии генов с Х-хромосом, находящихся в разном числе у червей двух полов, и мы сравниваем стратегии, используемые червями, со стратегиями, используемыми другими организмами для решения той же проблемы различий в дозе Х-хромосом. В соматических тканях червей выравнивание экспрессии сцепленных с X генов между двумя полами, обозначаемое как «компенсация дозы», происходит путем даун-регуляции экспрессии вдвое с обеих Х-хромосом у пола с XX. Эта даун-регуляция выполняется комплексом компенсации дозы (DCC, dosage compensation complex), который похож на комплекс конденсина. Этот последний участвует в конденсировании всех хромосом клетки для их сегрегации во время деления ядра и образования двух дочерних клеток. Таким образом, DCC может достигать репрессии сцепленных с X генов путем частичной конденсации Х-хромосом. Ключевыми моментами в компенсации дозы у червей являются вопросы о том, как оценивается соотношение Х:А, о том, каким образом DCC собирается исключительно у животных с XX, как DCC «нацеливается» на Х-хромосомы и как он осуществляет даун-регуляцию экспрессии сцепленных с X генов точно вдвое. По каждой из этих позиций в плане механизмов были достигнуты существенные успехи. Стратегия компенсации дозы, используемая червями, отличается от стратегий, применяемых млекопитающими и плодовыми мушками (Drosophila). Млекопитающие достигают компенсации дозы путем глобального сайленсинга одной из Х-хромосом у пола с XX. Плодовые мушки ап-регулируют экспрессию генов с единственной Х-хромосомы у пола с XX. Это разнообразие стратегий вероятно отражает кооптацию разных предсуществующих систем для специализированной роли уравнивания экспрессии сцепленных с X генов у животных с разным числом Х-хромосом. В ткани зародышевого пути (т.е. в репродуктивных клетках) червей происходит более глубокая модуляция экспрессии генов, сцепленных с X: единственная Х-хромосома у самцов и обе X у гермафродитов глобально сайленсируются. В зародышевых клетках обоих полов Х-хромосомы не имеют модификаций гистонов, ассоциированных с активно экспрессируемым хроматином. Это регулируется, по крайней мере отчасти, белками MES. Более того, у самцов единственная Х-хромосома в каждом зародышевом ядре приобретает модификации гистонов, ассоциированные с гетерохроматиновым сайленсингом. Этот сайленсинг зависит от неспаренного статуса Х-хромосомы в мейозе самцов. Гены, экспрессируемые в зародышевом пути, поразительным образом недопредставлены в Х-хромосоме. Распространенная точка зрения заключается в том, что сильная репрессия единственной Х-хромосомы в мужских мейотических зародышевых клетках вела к нехватке экспрессируемых генов зародышевого пути на Х-хромосоме и к необходимости сайленсинга Х-хромосомы у пола XX. Таким образом, зародышевый путь С. elegans представляет собой интересный случай для исследования того, как хромосомные дисбалансы между полами привели к эпигенетической регуляции хромосомных состояний и сформировали профиль генной экспрессии этой ткани.1. Дисбаланс половых хромосом у С. elegans
У Caenorhabditis elegans имеются два пола, которые генетически различаются по набору Х-хромосом: черви XX являются гермафродитами, а черви ХО — самцами. Никакой пол-специфичной хромосомы (такой, как Y-хромосома) нет. Гермафродиты и самцы обнаруживают многочисленные пол-специфичные анатомические особенности и обладают разными программами зародышевого пути (рис. 15.1). Эти бросающиеся в глаза различия между полами инициируются у раннего эмбриона и являются результатом подсчета числа Х-хромосом и соответствующего реагирования на эту оценку (Nigon, 1951; обзор см.: Меуег, 2000). Каким образом простая разница в числе половых хромосом или плоидности может транслироваться в такие резко различающиеся программы развития? Важный момент заключается в том, что каждая клетка С. elegans должна оценивать не только число своих Х-хромосом. но и число наборов аутосом. В действительности пол определяется именно соотношением этих двух типов хромосом, так называемым отношением X:А. Диплоидные животные с двумя Х-хромосомами (отношение Х:А равно 1) развиваются как гермафродиты, тогда как животные с одной Х-хромосомой (отношение Х:А равно 0,5) развиваются как самцы. Многие механистические детали такого надлежащего реагирования на отношение Х:А были изящно проанализированы и описываются ниже. Разница в дозе Х-хромосом между полами без ее модуляции приводила бы к разным уровням экспрессии сцепленных с X генов и к летальности у одного пола. Любопытно, что соматические клетки и зародышевые клетки выработали разные механизмы для решения этой проблемы дозы X (рис. 15.2). Зародышевый путь и соматические линии клеток полностью отделены друг от друга уже к 16—24-клеточной стадии эмбриогенеза. На стадии примерно 30 клеток соматические линии начинают процесс, обозначаемый как «компенсация дозы». Это схема, посредством которой обе Х-хромосомы у животных XX репрессируются в двукратном объеме. Напротив, млекопитающие, как это обсуждается в главах 16 и 17, осуществляют компенсацию дозы путем глобального сайленсинга одной из Х-хромосом у пола XX. а плодовые мушки выполняют компенсацию дозы путем ап-регуляции экспрессии с единственной Х-хромосомы у пола XY В ткани зародышевого пути С. elegans происходит более экстремальная модуляция экспрессии сцепленных с X генов: единственная X у самцов и обе X у гермафродитов глобально сайленсируются Предметом этой главы являются эпигенетические механизмы, осуществляющие компенсацию дозы в соме и сайленсинг Х-хромосомы в зародышевой линии.2. DDC похож на комплекс конденсина
Для понимания сборки и состава комплекса компенсации дозы (DDC, dosage compensation complex) требуется краткое введение, касающееся первых нескольких генов в пути, который регулирует как детерминацию пола, так и компенсацию дозы (обзор см.: Меуег, 1997). xol-1 (xol означает ХО-lethal), первый ген на этом пути, считается главным геном-переключателем, потому что его активность определяется отношением Х:0, а он, в свою очередь, диктует, поведет ли этот путь к развитию самца или гермафродита. XOL-1 является негативным регулятором трех sdc генов (sdc означает дефект в детерминации пола и компенсации дозы — sex determination and dosage compensation defective). Гены sdc кодируют компоненты DCC и регулируют ген детерминации пола her-1 (her означает гермафродитизацию животных ХО). У эмбрионов ХО отношение Х:А, равное 0,5, ведет к высоким уровням содержания белка XOL-1 и низким уровням белка SDC; DCC не собирается, компенсации дозы не происходит и экспрессируется ген детерминации пола her-1, что ведет к мужскому половому развитию. У эмбрионов XX отношение X: А, равное 1, приводит к низкому содержанию XOL-1 и высокому уровню содержания SDC; DCC собирается, компенсация дозы выполняется, а her-1 репрессируется, что приводит к развитию гермафродита. Особенно важным для представлений о сборке DCC является тот факт, что белки SDC экспрессируются только у эмбрионов XX, в ответ на отношение Х:А, равное 1. Рис. 15.1. Анатомия XX- и ХО-особей С. elegans
В природе у С. elegans существуют два пола, гермафродиты XX и самцы ХО. Гермафродиты и самцы демонстрируют несколько пол-специфичных анатомических особенностей, наиболее заметными из которых является хвост самца, предназначенный для спаривания, и вульва на вентральной поверхности у гермафродитов для получения спермы самца и для откладки яиц. Программы зародышевого пути у них также различаются. Двуплечая гонада у гермафродитов вначале продуцирует сперму, а затем ооциты на протяжении всей жизни взрослой особи. Одноплечая гонада самцов постоянно продуцирует сперму (адаптировано, с любезного разрешения авторов, из Hansen et al., 2004 [©Elsevier])
Рис. 15.1. Анатомия XX- и ХО-особей С. elegans
В природе у С. elegans существуют два пола, гермафродиты XX и самцы ХО. Гермафродиты и самцы демонстрируют несколько пол-специфичных анатомических особенностей, наиболее заметными из которых является хвост самца, предназначенный для спаривания, и вульва на вентральной поверхности у гермафродитов для получения спермы самца и для откладки яиц. Программы зародышевого пути у них также различаются. Двуплечая гонада у гермафродитов вначале продуцирует сперму, а затем ооциты на протяжении всей жизни взрослой особи. Одноплечая гонада самцов постоянно продуцирует сперму (адаптировано, с любезного разрешения авторов, из Hansen et al., 2004 [©Elsevier])
 Рис. 15.2. Обзор регуляции Х-хромосомы
Компенсация дозы происходит в соматических тканях исключительно у гермафродитов XX Сайленсинг Х-хромосом происходит и у самцов ХО, и у гермафродитов XX. Гермафродиты демонстрируют позднюю и частичную активацию сцепленных с X генов во время поздней пахитены оогенеза. Стрелки указывают на единственную примордиальную зародышевую клетку в эмбрионе, которая генерирует зародышевую линию во взрослой гонаде
Рис. 15.2. Обзор регуляции Х-хромосомы
Компенсация дозы происходит в соматических тканях исключительно у гермафродитов XX Сайленсинг Х-хромосом происходит и у самцов ХО, и у гермафродитов XX. Гермафродиты демонстрируют позднюю и частичную активацию сцепленных с X генов во время поздней пахитены оогенеза. Стрелки указывают на единственную примордиальную зародышевую клетку в эмбрионе, которая генерирует зародышевую линию во взрослой гонаде
В дополнение к белкам SDC (SDC-1, SDC-2 и SDC-3) DCC содержит также набор белков DPY (DPY-21, DPY-26, DPY-27, DPY-28 и DPY-30; DPY означает dumpy) и белок MIX-1 (MIX означает «связанный с митозом и Х-хромосомой» — mitosis and X-associated) (табл. 15.1) (обзор см.: Меуег, 2005). Значительное углубление понимания механизма компенсации дозы у червей было достигнуто с открытием того, что часть DCC С. elegans похожа на 13S комплекс конденсина (табл. 15.1 и рис. 15.3) (обзор см.: Меуег, 2005). Комплекс конденсина консервативен у разных видов и играет существенную роль в правильной компактизации хромосом и их сегрегации в ходе митоза и мейоза (обзор см.: Hirano, 2002). MIX-1, DPY-27, DPY-28 и DPY-26, в частности, гомологичны существенным компонентам комплекса конденсина; MIX-1 является также существенным компонентом канонического комплекса конденсина, который действует в митозе и мейозе. Белки SDC и DPY-30 не похожи на известные субъединицы конденсина. Согласно современным взглядам, комплекс DCC был приспособлен из аниестрального комплекса конденсина для специфического «нацеливания» на гены Х-хромосомы и их даун-регуляции, вероятно, путем некоторой конденсации хроматина.
Таблица 15.1. Компоненты, регулирующие экспрессию генов с Х-хромосомы
 Почему DCC собирается только у эмбрионов XX? Удивительно, что большинство компонентов DCC поставляются со стороны матери через ооцит как XX-, так и ХО-эмбрионам. Ключевым регулятором сборки DCC является SDC-2 (Dawes et al., 1999). SDC-2 не поставляется со стороны матери и производится только у эмбрионов XX (рис. 15.4), где он, наряду с SDC-3 и DPY-30, рекрутирует остальные субъединицы DCC к Х-хромосомам. Действительно, включения экспрессии SDC-2 у эмбрионов ХО достаточно, чтобы вызвать сборку DCC на единственной Х-хромосоме и включить компенсацию дозы, которая убивает эти эмбрионы. SDC-2, таким образом, направляет специфическое рекрутирование других компонентов DCC, большинство из которых играет другие роли в клетке, и кооптирует их активности для компенсации дозы и детерминации пола.
Почему DCC собирается только у эмбрионов XX? Удивительно, что большинство компонентов DCC поставляются со стороны матери через ооцит как XX-, так и ХО-эмбрионам. Ключевым регулятором сборки DCC является SDC-2 (Dawes et al., 1999). SDC-2 не поставляется со стороны матери и производится только у эмбрионов XX (рис. 15.4), где он, наряду с SDC-3 и DPY-30, рекрутирует остальные субъединицы DCC к Х-хромосомам. Действительно, включения экспрессии SDC-2 у эмбрионов ХО достаточно, чтобы вызвать сборку DCC на единственной Х-хромосоме и включить компенсацию дозы, которая убивает эти эмбрионы. SDC-2, таким образом, направляет специфическое рекрутирование других компонентов DCC, большинство из которых играет другие роли в клетке, и кооптирует их активности для компенсации дозы и детерминации пола.
3. Оценка отношения Х:А
Как клетки червя считают Х-хромосомы и аутосомы и выполняют компенсацию дозы, когда отношение Х:А равно 1? Удалось идентифицировать четыре небольших участка Х-хромосомы, обозначаемые как сигнальные элементы X (XSEs), которые вносят вклад в числитель отношения X: A [contributing to the numerator portion of the X:A ratio]. В двух из этих четырех районов были идентифицированы ответственные за это гены: sex-1 и fox-1 (sex означает «сигнальный элемент на X» — signal element on X;fox означает «феминизирующий ген на X» — feminizing geneonX) (Carmietal., 1998; Skipper etal., 1999). Продукты обоих генов подавляют экспрессию xol-1 — гена, наиболее удаленного «выше по течению» в пути детерминации пола и компенсации дозы, — в критическом «окне» эмбрионального развития (рис. 15.4). Поскольку эмбрионы XX продуцируют приблизительно вдвое больше SEX-1 и FOX-1, чем эмбрионы ХО, экспрессия xol-1 гораздо ниже у эмбрионов XX, чем у ХО. SEX-1 является ядерным рецептором гормона, который репрессирует транскрипцию xol-1 (Carmi et al., 1998). FOX-1 является связывающимся с РНК белком, который снижает уровень иРНК xol-1 с помощью посттранскрипционного механизма (Skipper et al., 1999). Доза Х-хромосом, следовательно, эквивалентна дозе сцепленных с X факторов, экспрессируемых с XSEs, которые действуют, подавляя экспрессию xol-1. До сих пор лишь один аутосомный сигнальный элемент (ASE) был идентифицирован как вносящий вклад в знаменатель отношения Х:А (Powell et al., 2005). Этот идентифицированный ген, sea-1, кодирует фактор транскрипции Т-бокса, который активирует транскрипцию xol-1. Доза аутосом (доза ASE), следовательно, уравновешивает эффекты дозы X (дозы XSE) путем антагонистического действия на главный ген-переключатель, xol-1 (рис. 15.4). Рис. 15.3. Комплекс компенсации дозы (DCC) и комплекс конденсина
DCC червей похож на комплекс конденсина, функционирующий в конденсации хромосом, когда они проходят через ядерное деление. В частности, DCC содержит несколько субъединиц, которые похожи на субъединицы ХСАР (ХСАР означает «полипептид, связанный с хромосомами, у Xenopus» — Xenopus chromosome-associated polypeptide) в 138-комплексе конденсина, первоначально охарактеризованном у Xenopus. Нативный комплекс конденсина у червей обнаруживает общее сходство с гомологичным функциональным 138-комплексом у Xenopus. Белки SDC и DPY-30 непохожи на известные субъединицы конденсина; вместо этого функционируют в локализации комплекса DCC на Х-хромосоме (Видоизменено из Meyer, 2005)
Рис. 15.3. Комплекс компенсации дозы (DCC) и комплекс конденсина
DCC червей похож на комплекс конденсина, функционирующий в конденсации хромосом, когда они проходят через ядерное деление. В частности, DCC содержит несколько субъединиц, которые похожи на субъединицы ХСАР (ХСАР означает «полипептид, связанный с хромосомами, у Xenopus» — Xenopus chromosome-associated polypeptide) в 138-комплексе конденсина, первоначально охарактеризованном у Xenopus. Нативный комплекс конденсина у червей обнаруживает общее сходство с гомологичным функциональным 138-комплексом у Xenopus. Белки SDC и DPY-30 непохожи на известные субъединицы конденсина; вместо этого функционируют в локализации комплекса DCC на Х-хромосоме (Видоизменено из Meyer, 2005)
Рабочая гипотеза относительно того, как это разворачивается у обоих полов, заключается в следующем: диплоидные эмбрионы XX вырабатывают двойную дозу XSE-репрессоров xol-1, которые аннулируют активирующее влияние ASEs. Это удерживает XOL-1 на низком уровне и ведет к развитию гермафродита и осуществлению компенсации дозы. Наоборот, диплоидные эмбрионы ХО продуцируют единичную дозу репрессоров XSE, которая недостаточна для противодействия активирующему влиянию ASEs. Высокие уровни содержания XOL-1 приводят к развитию самца и к невозможности выполнить компенсацию дозы. XSEs и ASEs транслируют сдвиг в отношении Х:А от 0,5 к 1 в переключение пола и в решение, осуществлять ли компенсацию дозы или нет.
 Рис. 15.4. Путь детерминации пола и компенсации дозы у С. elegans
Этот рисунок освещает предполагаемые роли сигнальных элементов X (XSEs) и аутосомных сигнальных элементов (ASEs) в регулировании уровней XOL-1 и последующей половой дифференцировке и сборке комплекса компенсации дозы (DCC), который у гермафродитов XX подавляет экспрессию сцепленных с X генов примерно вдвое
Рис. 15.4. Путь детерминации пола и компенсации дозы у С. elegans
Этот рисунок освещает предполагаемые роли сигнальных элементов X (XSEs) и аутосомных сигнальных элементов (ASEs) в регулировании уровней XOL-1 и последующей половой дифференцировке и сборке комплекса компенсации дозы (DCC), который у гермафродитов XX подавляет экспрессию сцепленных с X генов примерно вдвое
4. Рекрутирование и распространение DCC
Исследования были сконцентрированы на идентификации особенностей Х-хромосомы, участвующей в рекрутировании DCC. Интересно отметить, что у млекопитающих и плодовой мушки эквивалент DCC «нацеливается» на Х-хромосому комбинацией Х-специфичных не кодирующих РНК и элементов нуклеотидной последовательности Х-хромосомы (см. главы 16 и 17). На сегодняшний день нет данных о том, что некодирующие РНК играют какую-нибудь роль в компенсации дозы у С. elegans. Изящный подход был использован для исследования вопроса о том, рекрутируется ли DCC червей независимо ко многим сайтам или же только к одному или немногим сайтам, после чего комплексы распространяются в примыкающие хромосомные районы (Csankovszki et al., 2004; Meyer, 2005). Черви из штаммов, содержащих дупликации различных участков Х-хромосомы, были окрашены на компоненты DCC. Согласно предложенной интерпретации, ассоциация DCC с дупликацией означает, что дупликация и соответствующий район интактной Х-хромосомы содержат сайт рекрутирования DCC. Отсутствие ассоциации DCC с дупликацией, но связь DCC с соответствующим участком интактной Х-хромосомы, согласно этой трактовке, означают, что участок, включенный в Х-дупликацию, не имеет сайта рекрутирования DCC и, вместо этого, приобретает DCC за счет распространения из соседних районов. Эти эксперименты позволили идентифицировать по крайней мере 13 участков, которые могут независимо рекрутировать DCC, и доказали, что DCC распространяется по Х-хромосоме (рис. 15.5) (Csankovszki et al., 2004). Рис. 15.5. Опосредованная DCC даун-регуляция Х-хромосом и локуса her-1
В соматических тканях гермафродита DCC уменьшает экспрессию X наполовину и подавляет экспрессию her-1 в 20 раз. DCC собирается у животных XX. Он рекрутируется к узнающим элементам и распространяется по обеим Х-хромосомам, уменьшая экспрессию многочисленных сцепленных с X генов вдвое. Он также связывается с участком аутосомного гена her-1, находящимся «вверх по течению», и уменьшает экспрессию в 20 раз (обозначается DCCH, чтобы показать, что комплекс, связывающийся с her-1, не имеет белка DPY-21) (видоизменено, с любезного разрешения авторов, из Alekseyenko and Kuroda, 2004; иллюстрация Kathenne Sutliff[©AAAS])
Рис. 15.5. Опосредованная DCC даун-регуляция Х-хромосом и локуса her-1
В соматических тканях гермафродита DCC уменьшает экспрессию X наполовину и подавляет экспрессию her-1 в 20 раз. DCC собирается у животных XX. Он рекрутируется к узнающим элементам и распространяется по обеим Х-хромосомам, уменьшая экспрессию многочисленных сцепленных с X генов вдвое. Он также связывается с участком аутосомного гена her-1, находящимся «вверх по течению», и уменьшает экспрессию в 20 раз (обозначается DCCH, чтобы показать, что комплекс, связывающийся с her-1, не имеет белка DPY-21) (видоизменено, с любезного разрешения авторов, из Alekseyenko and Kuroda, 2004; иллюстрация Kathenne Sutliff[©AAAS])
Некоторые из этих участков рекрутируют в сильной степени, другие — в слабой, заставляя предполагать либо присутствие варьирующего числа сайтов рекрутирования, либо присутствие сайтов с варьирующей способностью рекрутировать и (или) стимулировать распространение вдоль Х-хромосомы. Тестирование все более мелких участков сузило сайт рекрутирования DCC одного участка до 33 п.о. (Меуег, 2005). Эта последовательность длиной 33 п.о. является уникальной в геноме. Определение других минимальных сайтов рекрутирования — дело первостепенной важности. Другая важнейшая задача — выяснить, каким образом происходит распространение DCC из первоначальных сайтов рекрутирования. Распространение может быть опосредовано кооперативными взаимодействиями между DCCs или же локальными видоизменениями хроматина в структуру, облегчающую связывание все бОлыиих количеств DCC в петле с положительной обратной связью, как это было показано для распространения гетерохроматина у Schizosaccharomyces pombe (глава 8).
5. Эффекты DCC: даун-регуляция сцепленных с X генов и аутосомного гена her-1
Регулирование структуры хроматина для достижения скромного двукратного изменения экспрессии сцепленных с X генов, как это происходит у червей и плодовых мушек, представляется, с механистической точки зрения, весьма интересным. У плодовых мушек модуляция экспрессии генов связана с определенными модификациями гистонов и с утратой линкерного гистона из Х-хромосомы (см. Главу 16). В соматических клетках червей-гермафродитов не было отмечено никаких явных различий ни в уровне, ни в спектре модификаций гистонов на двух Х-хромосомах с компенсацией дозы по сравнению с аутосомами. Млекопитающие, плодовые мушки и черви, по-видимому, приспособили разные предсуществовавшие системы для специализированной роли модуляторов экспрессии генов на Х-хромосоме. Млекопитающие адаптировали основанный на гетерохроматине сайленсинг для инактивации одной из двух Х-хромосом у ХХ-пола. Плодовые мушки приспособили модифицирующую хроматин машинерию для изменения состояния единственной Х-хромосомы у животных XY, что приводит к ап-регуляции экспрессии генов. С. elegans адаптировали механизм конденсации хромосом, используемый в митозе и мейозе, для даун-регуляции обеих Х-хромосом у ХХ-пола. Важнейшими вопросами являются механизм даун-регуляции у червей и то. каким образом она ограничена двукратными изменениями. При сходстве DCC и 13S комплекса конденсина вероятный механизм даун-регуляции экспрессии генов заключается в опосредованной DCC конденсации хроматина. Это может ограничивать доступ РНК полимеразы и (или) транскрипционных факторов к промоторным районам, мешать продвижению РНК-полимеразы через транскрипционные единицы и (или) замедлять реинициацию транскрипции в каждом гене. Ключи к механизму репрессии могут оказаться в единственном аутосомном локусе her-1, который является единственной известной аутосомной мишенью DCC и который демонстрирует более экстремальную, 20-кратную даун-регуляцию экспрессии генов, опосредованную DCC (рис. 15.6) (Dawes etal., 1999; Chuetal., 2002). Репрессия her-1 стимулирует половое развитие по гермафродитному типу (рис. 15.4). Следовательно, DCC способен достигать в 10 раз большей репрессии в her-1, чем он достигает на Х-хромосомах. Одним известным различием между DCC, связанным с Х-хромосомами, и комплексом, связанным с her-1, является DPY-21. DPY-21 присутствует на Х-хромосомах, но не в локусе her-1 (Yonker and Меуег, 2003). 135-комплекс конденсина нужен для регулирования структуры хромосом в масштабах всего генома, чтобы облегчить сегрегацию хромосом. Адаптация и модификация комплекса конденсина для формирования ВВС делают его эффекты более тонкими и сужают его регуляцию до (преимущественно) одной хромосомы. DCC с DPY-21 слабо репрессирует транскрипцию многих генов на Х-хромосоме, тогда как DCC без DPY-21 каким-то образом сильно подавляет транскрипцию в локусе her-1. В будущем было бы крайне интересно проанализировать, каким образом разные комплексы конденсин/ DCC осуществляют свои различающиеся функции.6. Регулирование Х-хромосом в зародышевом пути
У С. elegans для регулирования экспрессии с Х-хромосом в зародышевом пути используются другие стратегии, чем в соматических тканях, поскольку соматический способ регуляции Х-хромосом (т.е. с помощью DCC) не действует в зародышевых клетках. Некоторые существенные компоненты соматического DCC не экспрессируются в зародышевой линии (например, SDC-2); другие же экспрессируются в зародышевых клетках, но обнаруживаются на всех хромосомах (например, MIX-1, DPY-26 и DPY-28). У С. elegans MIX-1, как упоминалось выше, является компонентом и DCC, и канонического комплекса конденсина. Согласно современным взглядам, конденсиноподобный комплекс был приспособлен к тому, чтобы играть специализированную специфичную для Х-хромосомы роль, но эта роль, по-видимому, осуществлялась лишь в соматических тканях. В зародышевом пути те белки DCC, которые экспрессируются, заняты, вероятно, на более общих ролях в митотической и мейотической организации и сегрегации хромосом. Отсутствие членов DCC в зародышевой линии ставит вопрос о том, действует ли в этой ткани какой-нибудь способ компенсации дозы. Напомним, что функция компенсации дозы заключается в том, чтобы достичь эквивалентной экспрессии сцепленных с X генов у обоих полов и обеспечить тем самым жизнеспособность и нормальное развитие. Современные данные позволяют предположить, что, в противоположность двукратной даун-регуляции обеих Х-хромосом в соматических клетках XX, Х-хромосомы глобально сайленсируются на большинстве стадий развития зародышевой линии как у животных XX, так и у животных ХО (рис. 15.6). Отсутствие транскрипции с Х-хромосом в зародышевых клетках обоих полов, казалось бы, делает не нужной пол-специфическую регуляцию этой хромосомы. Тем не менее, существуют специфические механизмы, регулирующие Х-хромосомы в зародышевых клетках и, как подозревают, эти механизмы мало похожи по форме и функциям на соматические механизмы, уже описанные в этой главе.7. Развитие зародышевого пути и сайленсинг Х-хромосомы
У С. elegans взрослые гонады обоих полов содержат упорядоченный ряд последовательных стадий развития зародышевых клеток. Зародышевые клетки пролиферируют в дистальном участке, вступают в мейоз в средней части и завершают гаметогенез в проксимальном районе (рис. 15.1 и 15.7) (обзор см.: Schedl, 1997). У самцов ХО эта прогрессия имеет место в единственном тубулярном семеннике, который постоянно производит сперму. У гермафродитов XX два тубулярных плеча гонады вначале, на поздней личиночной стадии, производят сперму, а затем, во взрослом состоянии, переключаются на производство оопитов. Зрелые ооциты выталкиваются в сперматеки и оплодотворяются спермой, находясь здесь до последующей экструзии в матку. Таким образом, производство некоторого количества спермы червями XX делает возможным гермафродитный способ размножения взрослой особи. Однако яичник и некоторые другие соматические ткани у взрослых животных XX могут считаться по существу женскими по своей идентичности и функции. Х-хромосомы в зародышевой линии сайленсируются и у гермафродитов XX. и у самцов ХО. Этот сайленсинг характеризуется такими репрессивными гистоновыми метками, как метилирование H3K27; Х-хромосомы в зародышевых клетках гермафродита особенно обогащены H3K27me3 (Bender et al., 2004). Имеет место также отсутствие ацетилирования гистонов, обычно связанное с активным хроматином, и метилирование H3K4, которое, как показывает иммунофлуоресцентный анализ (рис. 15.7), коррелирует с активно транскрибируемыми районами (Kelly et al., 2002). Сайленсинг Х-хромосомы в зародышевой линии С. elegans достигается преимущественно с помощью двух механизмов, обсуждаемых ниже (рис. 15.6). Первый работает посредством мейотического сайленсинга неспаренной ДНК (MSUD), который включает единственную Х-хромосому у животных ХО. Второй механизм работает посредством модификаций гистонов, опосредованных белками MES; этот механизм сайленсинга наиболее интенсивно изучался у животных XX, но, вероятно, действует и у животных ХО. У ранних эмбрионов сайленсинг отцовской Х-хромосомы сохраняется на протяжении нескольких клеточных циклов после оплодотворения и обозначается как сайленсинг импринтированной Х-хромосомы (imprinted X silencing) (рис. 15.6). Рис. 15.6. Регуляция Х-хромосом в жизненном цикле гермафродита XX
Этот рисунок иллюстрирует, что Х-хромосомы регулируются разными механизмами на разных стадиях и в разных тканях: инактивация импринтированной X (I) отцовской Х-хромосомы у раннего эмбриона, компенсация дозы (DC) в соматических тканях эмбрионов и червей 30-клеточной и более поздних стадий и опосредованный MES сайленсинг в зародышевом пути. Мейотический сайленсинг неспаренной ДНК (MSUD) также происходит в зародышевой линии; это сайленсирует единственную Х-хромосому у самцов ХО
Рис. 15.6. Регуляция Х-хромосом в жизненном цикле гермафродита XX
Этот рисунок иллюстрирует, что Х-хромосомы регулируются разными механизмами на разных стадиях и в разных тканях: инактивация импринтированной X (I) отцовской Х-хромосомы у раннего эмбриона, компенсация дозы (DC) в соматических тканях эмбрионов и червей 30-клеточной и более поздних стадий и опосредованный MES сайленсинг в зародышевом пути. Мейотический сайленсинг неспаренной ДНК (MSUD) также происходит в зародышевой линии; это сайленсирует единственную Х-хромосому у самцов ХО
8. Единственная Х-хромосома у самцов обнаруживает метки гетерохроматина
Самое раннее предположение, что в зародышевой линии Х-хромосома отличается от аутосом, вытекает из цитологических наблюдений. Единственная Х-хромосома у червей-самцов приобретает характерную структуру во время пахитены в мейотической профазе — она гиперконденсируется, формируя шаровидную структуру, напоминающую «половое тельце» XY, видимое во время мужского мейоза у млекопитающих (Goldstein and Slaton, 1982; Handel, 2004). Аутосомы конденсируются позже в мейотической профазе, близко к началу сперматогенеза. Преждевременная конденсация Х-хромосомы также видна во время мужского мейоза у гермафродитов XX и у сексуально трансформированных самцов XX; это позволяет предполагать, что преждевременная конденсация Х-хромосомы происходит в ответ на пол зародышевой клетки, а не на статус плоидности или спаренности Х-хромосомы. Соответственно, у гермафродитов XX зародышевые клетки, предназначенные для оогенеза, не обнаруживают преждевременной конденсации Х-хромосомы. В дополнение к преждевременной конденсации единственная Х-хромосома у самцов ХО временно аккумулирует заметные количества H3K9me2, которые появляются во время пахитены и исчезают в диплотене (рис. 15.7) (Kelly et al., 2002). Это обогащение H3K9me2 не происходит в ходе сперматогенеза XX, как у гермафродитов, так и у трансформированных самцов XX. Однако обогащение Х-хромосомы H3K9me2 наблюдается в оогониях, проходящих стадию пахитены у трансформированных по полу гермафродитов ХО, причем динамика этого процесса сходна с таковой у самцов ХО (Bean et al., 2004). Специфичное приобретение метки гетерохроматина на Х-хромосоме в мейозе ХО оказывается, таким образом, следствием ее неспаренного статуса, а не пола данной зародышевой линии, через которую она проходит. «Нацеливание» H3K9me2 на неспаренную ДНК не ограничивается нуклеотидными последовательностями Х-хромосомы; оно обнаруживается также на неспаренных аутосомных фрагментах и транслокациях (Bean et al., 2004). Такая «нацеливаемая» репрессия неспаренной ДНК в мейозе имеет место не только у С. elegans. Подобное распознавание и репрессия неспаренной ДНК происходят во время мейоза и у других организмов, в том числе у Neurospora и мыши. Это явление обозначается как MSUD (meiotic silencing of unpaired DNA — мейотический сайленсинг неспаренной ДНК) (Shiu et al., 2001; Baarends et al., 2005; Turner, 2005; Turner et al., 2005). У мышей, например, «половое тельце» XY со слабым синапсом во время мужского мейоза аналогичным образом обогащено H3K9me2, и это является следствием его неспаренного состояния (Cowell et al., 2002; Turner et al., 2005). Мейотический сайленсинг у Neurospora требует активности белков с консервативными ролями в РНК-интерференции (RNAi). В их число входят РНК-направляемая РНК-полимераза (RdRP), белок, родственный белку Argonaute (консервативный компонент инуцируемых РНК сайленсирующих комплексов, RISCs) и нуклеаза Dicer (обзор см. Nakayashiki, 2005; см. главу 8). У С. elegans обогащение H3K9me2 на неспаренной ДНК нуждается в EGO-1, RdRP, которая ограничена зародышевой линией, но не требует Dicer (Maine et al., 2005). Это заставляет предполагать, что в то время как имеет место консерватизм мейотического сайленсинга (репрессии неспаренной ДНК), механизм, с помощью которого это достигается, мог по-разному развиваться у разных организмов. Рис. 15.7. Эпигенетическая регуляция Х-хромосом во время развития зародышевых клеток
У обоих полов зародышевые клетки проходят митоз (слева), вступают в мейоз в переходной зоне и проходят профазу мейоза I. У обоих полов клетки, предназначенные для формирования спермы, завершают мейотические деления в гонаде. У гермафродитов клетки, предназначенные для формирования ооцитов, проходят через мейотическую профазу в гонаде и завершают мейотические деления после овуляции и оплодотворения. Присутствие разнообразных модификаций гистонов на Х-хромосоме (Х-хромосомах) в зародышевых клетках показано красными (для репрессивных модификаций) и зелеными (для активирующих модификаций) полосками. Как показано на врезках справа, антитела к конкретным модификациям гистонов показывают, что Х-хромосомы в зародышевых ядрах маркируются иначе, чем аутосомы, и сайленсированы. H3K4me2 (зеленый цвет), метка активно экспрессируемого хроматина, отсутствует в Х-хромосомах пахитенных ядер XX. H3K9me2 (зеленый цвет), метка гетерохроматина, сконцентрирован на Х-хромосоме в пахитенных ядрах ХО. ДНК окрашивается красным цветом. Стрелки указывают репрезентативные Х-хромосомы на каждом изображении
Рис. 15.7. Эпигенетическая регуляция Х-хромосом во время развития зародышевых клеток
У обоих полов зародышевые клетки проходят митоз (слева), вступают в мейоз в переходной зоне и проходят профазу мейоза I. У обоих полов клетки, предназначенные для формирования спермы, завершают мейотические деления в гонаде. У гермафродитов клетки, предназначенные для формирования ооцитов, проходят через мейотическую профазу в гонаде и завершают мейотические деления после овуляции и оплодотворения. Присутствие разнообразных модификаций гистонов на Х-хромосоме (Х-хромосомах) в зародышевых клетках показано красными (для репрессивных модификаций) и зелеными (для активирующих модификаций) полосками. Как показано на врезках справа, антитела к конкретным модификациям гистонов показывают, что Х-хромосомы в зародышевых ядрах маркируются иначе, чем аутосомы, и сайленсированы. H3K4me2 (зеленый цвет), метка активно экспрессируемого хроматина, отсутствует в Х-хромосомах пахитенных ядер XX. H3K9me2 (зеленый цвет), метка гетерохроматина, сконцентрирован на Х-хромосоме в пахитенных ядрах ХО. ДНК окрашивается красным цветом. Стрелки указывают репрезентативные Х-хромосомы на каждом изображении
В противоположность тому, что происходит в мейозе самцов ХО, Х-хромосомы либо в сперматогониях XX, либо в оогониях XX не накапливают H3K9me2 в сколько-нибудь заметных количествах. Это различие обусловлено, вероятно, полным синапсисом Х-хромосом в мейозе гермафродитов. Почему сайленсинг неспаренных ДНК обычно оказывается консервативной чертой полового воспроизведения? У многих организмов спаривание гомологов ограничено исключительно мейозом, и во время синапсиса новые вставки, уникальные для одного из гомологов, экспонировались бы как участки неспаренной ДНК. Предположили, что распознавание и сайленсинг неспаренных последовательностей во время мейоза обеспечивают механизм для самосканирования (self-scanning) диплоидного генома и могли бы обеспечить защиту против инвазии (или экспансии) перемещаемых элементов. Как еще одно следствие, следует отметить, что гены, экспрессируемые во время мейоза, сталкивались бы с сильным отбором против нахождения их на неспаренной хромосоме (такой, как Х-хромосома самца). Такой отбор приводил бы к формированию уникального генетического профиля Х-хромосомы, наблюдаемого у С. elegans. Интересно пофантазировать на тему о том, что геномная война между транспозонами и их хозяевами и эпигенетические механизмы, развившиеся как оружие в этой битве, сформировали геномы и привели к генетической изменчивости. Эта генетическая изменчивость, в свою очередь, могла создать дефекты спаривания, достаточные для включения мейотического сайленсинга существенных локусов и, отсюда, мейотической несовместимости. Таким путем эпигенетический сайленсинг во время мейоза теоретически мог внести свой вклад в репродуктивную изоляцию и видообразование.
9. Влияние MSUD на паттерны экспрессии генов в зародышевом пути
Исследования транскрипции в зародышевой линии в масштабах экспрессии всего генома показали, что имеется замечательная разница в профилях накопления иРНК с генов, картирующихся на Х-хромосоме, по сравнению с генами аутосом (Reinke et al., 2000, 2004). Гены, необходимые для сперматогенеза, а также общие, или «внутренние» («intrinsic») гены, экспрессируемые в зародышевой линии, явно «недопредставлены» в Х-хромосоме. Гены с увеличенной экспрессией в зародышевых линиях оогенеза также «недопредставлены» в Х-хромосоме, но не до такой степени, как гены сперматогенеза или «внутренние» гены зародышевой линии. Другими словами, гены, которые необходимы для жизнеспособности и функционирования зародышевых клеток, по большей части в Х-хромосоме отсутствуют. Действительно, большинство генов, связанных с оогенезом и находящихся в Х-хромосоме, демонстрируют экспрессию на поздних стадиях мейоза, что коррелирует с активацией Х-хромосомы (рис. 15.6и15.7).0 поздней мейотической активации свидетельствует накопление «активирующих» модификаций гистонов к концу пахитены, в том числе ацетилирование H3 и Н4 и метилирование H3K4Ю до уровней, сравнимых с уровнями, которые наблюдаются в аутосомах (Kelly et al., 2002). Это позволяет предполагать, что тенденция к тому, чтобы гены не локализовались в Х-хромосоме, наиболее выражена для тех из них, которые функционируют на ранних стадиях развития зародышевых клеток, общих для обоих полов. Кроме того, идентифицировали ряд дупликаций генов с паралогами Х/аутосома, в которых аутосомная копия однозначно требовалась для функционирования зародышевых клеток. В этих примерах сцепленная с X копия функционирует в соматических линиях, но не требуется в зародышевых клетках, в которых активна аутосомная копия (Maciejowski et al., 2005). В совокупности вышеописанные данные позволяют предполагать, что Х-хромосома является недружелюбной средой для генов с функциями, существенными для ранних зародышевых клеток у обоих полов. Гены, которые требуются лишь во время позднего оогенеза (т.е. требующиеся только в женских зародышевых клетках поздних стадий; рис. 15.2), были бы иммунными к давлению отбора, вызываемому асинапсисом в мужских зародышевых клетках, и таким образом их сцепление с X было бы возможным. Гены С. elegans с функциями, существенными для ранних стадий зародышевой линии, очевидно были исключены из Х-хромосомы. были утеряны из Х-хромосомы или подверглись дупликации, после чего зародышевая линия зависела уже от аутосомной копии. Последнее предполагает возможный путь для эволюции уникального генетического профиля Х-хромосомы. Аналогичные силы, по-видимому, действуют на сцепленные с X гены и у других видов, в том числе у плодовой мушки и у млекопитающих (Wu and Xu, 2003). Однако в настоящее время мы не понимаем механизмы, удаляющие гены зародышевой линии из Х-хромосомы.10. Регуляция сайленсинга Х-хромосомы модификаторами гистонов MES
В предыдущем разделе описывалась репрессия посредством формирования гетерохроматина, специфичная для единственной Х-хромосомы у самцов ХО и ограниченная стадией пахитены мейоза благодаря MSUD. Каким образом Х-хромосомы поддерживаются в репрессированном состоянии хроматина на протяжении других стадий развития зародышевой линии и у гермафродитов XX? Генетический скрининг мутантов со стерильностью, обусловленной материнским эффектом (mes — matemal-effect sterile), выявил группу из четырех генов mes, которые участвуют в сайленсинге Х-хромосомы у животных XX, а также, вероятно, и у животных ХО. Совместное применение генетического и молекулярного анализа показало, что кодируемые белки MES влияют на сайленсинг, регулируя часть спектрамодификаций гистонов, обнаруживаемого на Х-хромосомах в зародышевых клетках. Их функции существенны для выживания и развития зародышевых клеток. Три белка MES — MES-2, MES-3 и MES-6 — функционируют вместе в составе комплекса, похожего на Репрессивный Комплекс Polycomb (PRC2 у плодовой мушки и позвоночных (см. Xu et al., 2001; Bender et al., 2004; Keteletal., 2005; глава 11). MES-2 и MES-6 червей — это ортологи двух субъединиц PRC2, E(Z) (Enhancer of zeste) и ESC (Extra sex combs) (табл. 15.1). E(Z) и ESC, во взаимодействии по крайней мере с двумя другими партнерами, катализируют метилирование H3K27 гистона, которое, как упомянуто выше, является репрессивной модификацией гистонов. Аналогично этому, MES-2 и MES-6, в комплексе с новым белком MES-3, опосредуют метилирование H3K27 (рис. 15.8). Домен SET белка MES-2 ответствен за метилтрансферазную (НКМТ) активность в отношении лизинов гистонов, тогда как MES-6 и MES-3 оказываются необходимыми либо для связывания с субстратом, либо для усиления каталитической активности. MES-2, MES-3 и MES-6 ответственны за все выявляемое ди- и триметилирование по H3K27 (H3K27me2 и H3K27me3) в большинстве районов зародышевой линии и у ранних эмбрионов, но еще одна НКМТ катализирует это метилирование в соматических тканях. Важно отметить, что в пределах зародышевой линии содержание полностью репрессивной метки, H3K27me3, в Х-хромосомах повышено (рис. 15.8) (Bender et al., 2004). Одним из последствий уничтожения метилирования H3K27 в зародышевой линии является активация генов на Х-хромосоме; у мутантов mes-2, mes-З или mes-6 Х-хромосомы в зародышевой линии гермафродитов не имеют H3K27me, приобретают метки активного хроматина (например, H3K4me и Н4К12ас) и декорируются транскрипционно активной формой РНК-полимеразы (Fong et al., 2002; Bender et al., 2004). Эти данные позволяют предположить, что комплекс MES-2/3/6 участвует, возможно даже непосредственно, в сайленсинге Х-хромосом в зародышевой линии червей. Действительно, предполагается, что десайленсинг Х-хромосом является причиной дегенерации зародышевой линии, наблюдаемой у гермафродитов мутантов mes. Аналогично участию MES-2 и MES-6 в сайленсинге Х-хромосом зародышевой линии гомологи MES-2 и MES-6 у позвоночных участвуют в инактивации соматической Х-хромосомы у животных XX (главы 11 и 17). Рис. 15.8. Модель, показывающая, каким образом MES-2/3/6 и MES-4 участвуют в сайленсинге Х-хромосомы в зародышевой линии
Комплекс MES-2/3/6 концентрирует метку репрессивного хроматина (H3K27me3) на Х-хромосомах и отталкивает MES-4 от Х-хромосом. MES-4 концентрирует другую метку хроматина (H3K36me2) на аутосомах и, как предполагается, отталкивает неизвестный репрессор (желтый шестиугольник), помогая тем самым сфокусировать действие этого репрессора на Х-хромосомах. Результатом оказывается сайленсинг Х-хромосом в результате совместного действия репрессора «желтый шестиугольник» и катализируемого MES-2/3/6 репрессивного метилирования гистонов
Рис. 15.8. Модель, показывающая, каким образом MES-2/3/6 и MES-4 участвуют в сайленсинге Х-хромосомы в зародышевой линии
Комплекс MES-2/3/6 концентрирует метку репрессивного хроматина (H3K27me3) на Х-хромосомах и отталкивает MES-4 от Х-хромосом. MES-4 концентрирует другую метку хроматина (H3K36me2) на аутосомах и, как предполагается, отталкивает неизвестный репрессор (желтый шестиугольник), помогая тем самым сфокусировать действие этого репрессора на Х-хромосомах. Результатом оказывается сайленсинг Х-хромосом в результате совместного действия репрессора «желтый шестиугольник» и катализируемого MES-2/3/6 репрессивного метилирования гистонов
Каким образом комплекс MES-2/3/6 «нацеливается» на участки ДНК, предназначенные для репрессирования, и как метилирование H3K27 подавляет экспрессию генов? Ответы на эти вопросы мы получаем на Drosophila (глава 11). У мух комплекс E(Z)/ESC рекрутируется связывающимся с ДНК белком РНО к определенным сайтам, называемым элементами ответа Polycomb (PREs — Polycomb Response Elements) (Wang et al., 2004). После того как этот комплекс локально метилирует H3K27, репрессия генов опосредуется, по крайней мере частично, рекрутированием репрессивного комплекса Polycomb 1 (PRC1) к H3K27me (Wang et al., 2004). Удивительно, что геном С. elegans не содержит явных гомологов pho или большинства генов, кодирующих PRC1. Поэтому «нацеливание» комплекса MES-2/3/6 и то, как он достигает репрессии, связано, вероятно, со стратегиями, отличающимися от тех, что используются у Drosophila. Четвертым белком MES, участвующим в репрессии Х-хромосомы в зародышевой линии, является MES-4. Его распределение является нестандартным для связанных с хромосомой белков и полностью противоположно тому, что можно было бы ожидать. В противоположность другим белкам MES, MES-4 связывается с пятью аутосомами, в виде бэндов, и совершенно отсутствует на большей части длины Х-хромосомы (рис. 15.8) (Fong et al., 2004). MES-4, подобно MES-2, содержит домен SET и тоже обладает активностью НКМТ (Bender et al., 2006). Он отвечает за большую часть выявляемого диметилирования H3K36 (H3K36me2) в зародышевой линии и у ранних эмбрионов. Как позволяет предсказать связь MES-4 с аутосомами, H3K36me2 заметно концентрируется на аутосомах. В соматических тканях и у эмбрионов на поздних стадиях развития за метилирование H3K36 отвечает другая НКМТ. Эта последняя активность оказывается связанной с транскрипционной элонгацией, как и в случае дрожжей. Опосредованное MES-4 метилирование H3K36 на аутосомах не зависит от транскрипции и, вероятно, играет другую, нужную для зародышевой лини, эпигенетическую роль (Bender et al., 2006). Ключевые нерешенные моменты определяют, каким образом MES-4 «нацеливается» на аутосомы и какую роль он там играет. Интересно, что исключение MES-4 из Х-хромосом требует MES-2, MES-3 и MES-6 (рис. 15.8); в отсутствие любого из этих белков MES MES-4 распространяется на X (Fong et al., 2002). Полагают, что нормальная концентрация MES-4 на аутосомах участвует в сайленсировании генов на X. Одна из моделей заключается в том, что MES-4 и (или) его метальная метка (H3R36me2) отталкивает глобальные репрессоры хроматина (желтые шестиугольники на рис. 15.8) с аутосом и таким образом фокусирует действие репрессоров на Х-хромосомах (Fong et al., 2002). Утрата MES-4 вытитровывала бы эти репрессоры с Х-хромосомы на аутосомные районы, и это приводило бы к десаиленсингу X. Комплекс MES-2/3/6 является логическим кандидатом на роль отталкиваемого MES-4 репрессора Однако распределение метилирования H3K27, катализируемого MES-2/3/6, не изменяется видимым образом у мутантов mes-4. Поэтому продолжаются поиски других репрессоров, которые могут принимать в этом участие. Эта модель действия MES-4 сходна с моделью «приобретения специфичности через предотвращение неоднородности» («gaining specificity by preventing promiscuity»), предложенной для Dot1 Saccharomyces cerevisiae (van Leeuwen and Gottschling, 2002). Полагают, что опосредованное Dot1 метилирование H3K79 по хромосомам отталкивает репрессоры Sir и помогает сфокусировать их действие на теломерах. Утрата Dot1 делает возможным распространение Sirs от теломер и приводит к десайленсингу теломер. Фенотип mes представляет собой превосходный пример эпигенетического феномена с прямой связью с модификациями гистонов. Мутация, связанная с материнским эффектом, определяется как такая мутация, мутантный фенотип которой не выявляется у гомозиготных мутантов первого поколения, но зато обнаруживается у их потомства. В случае мутантов mes/mes первого поколения присутствие некоторых количеств продукта MES дикого типа, продуцируемых матерью mes/+ и упакованных в ооцит, достаточно для должной экспансии двух примордиальных клеток в более чем тысячу полностью функциональных зародышевых клеток. Однако зародышевые клетки у этих фертильных червей mes/mes не могут продуцировать функциональный продукт MES для своего потомства. В результате у этого потомства примордиальные зародышевые клетки претерпевают незначительную пролиферацию и дегенерируют. Активности НКМТ, кодируемые mes-2 и mes-4, должны устанавливать наследуемое состояние хроматина, которое соответствующим образом поддерживается в многочисленных потомках двух первоначальных примордиальных зародышевых клеток. Современная модель функционирования белка MES (рис. 15.8) сводится к тому, что MES-2, MES-3 и MES-6 действуют в комплексе и концентрируют репрессивную модификацию хроматина (H3K27me) на Х-хромосомах в зародышевой линии и непосредственно участвуют в сайленсинге Х-хромосомы. Их активность отталкивает также MES-4 от X. В результате MES-4 покрывает аутосомы H3K36me и модифицирует их — предполагается, что их активность отталкивает репрессивную активность и помогает сфокусировать ее на X. Полагают, что эта система MES действует эпигенетически в зародышевой линии матери и в ранних эмбрионах и устанавливает домены хроматина, которые должным образом маркированы для последующей экспрессии (аутосомные районы) или сайленсинга (Х-хромосомы) в ходе развития зародышевой линии у личинок (см. рис. 15.6). Утрата этой системы MES ведет к гибели зародышевой линии и стерильности, вероятно благодаря, по крайней мере отчасти, десайленсингу Х-хромосом.
11. Х-хромосома спермия импринтирована
Геномы, привнесенные разными гаметами, поступают в зиготу с весьма различными эпигенетическими историями (рис. 15.6). Хотя Х-хромосома неактивна на ранних стадиях зародышевых клеток у обоих полов, в оогенезе эта X становится функционально активной (Fong et al., 2002; Kelly et al., 2002). Напротив, в ходе мужского мейоза Х-хромосома никогда не активируется, подвержена преждевременной конденсации и в мейозе особей ХО дополнительно обогащена H3K9me2 (рис. 15.7) (Kelly et al., 2002; Bean et al., 2004). Во время сперматогенеза модификации гистонов прогрессивно утрачиваются со всех хромосом по мере того, как они вступают в мейотические деления и становятся гиперконденсированными для упаковки в сперматиды (рис. 15.7). Предполагают, что гиперконденсация обусловлена замещением гистонов специализированными, сильно основными белками, называемыми протаминами, как это происходит и у других организмов, хотя еще и не показано у червей. Таким образом, геном спермия поступает в яйцеклетку в основном лишенным модификаций гистонов (и, вероятно, лишенным самих гистонов). Это контрастирует с хроматином ооцита, который продолжает демонстрировать значительные уровни большинства активирующих модификаций гистонов даже во время конденсации хромосом в диакинезе (рис. 15.7). Важно отметить, что РНК-полимераза отсутствует на ДНК во время созревания ооцитов и, следовательно, модификации гистонов, сохраняемые хроматином, могут отражать скорее транскрипционный «потенциал», чем транскрипционную активность. Таким образом, зигота наследует два эпигенетически различных генома и, в частности, две Х-хромосомы с очень разными транскрипционными историями — недавно активную, происходящую из ооцита Хт, и происходящую от спермия Хр с незначительной или вовсе никакой транскрипционной активностью в недавнем прошлом. Отметим, что благодаря гермафродитному способу воспроизведения С. elegans и способности гермафродитов спариваться с самцами потомки XX могут унаследовать Хр от своего родителя XX или от родителя ХО. Вскоре после вхождения в ооцит ДНК спермия одновременно накапливает модификации гистонов и начинает деконденсироваться, образуя мужской пронуклеус. У эмбрионов XX хроматин Хр, в отличие от аутосом, не накапливает во время деконденсации ацетилирование гистона H3 или H3K4me2 (рис. 15.6) (Bean et al., 2004). Однако между Хр и аутосомами нет различий в модификациях гистона Н4. В пронуклеусе ооцита все хромосомы, включая Хт, модифицированы сходным образом и остаются такими в ходе всего эмбриогенеза. Удивительно, что специфичное для Хр отсутствие модификаций H3 поддерживается после репликации ДНК и переживает множественные циклы клеточных делений, а потому было названо «эпигенетическим импринтом». Однако постепенно этот импринт утрачивается; иначе говоря, на Хр все более и более начинают выявляться специфичные для H3 модификации, пока не исчезнут какие-либо явные различия между Хр и другими хромосомами в уровне H3K4me2 (рис. 15.6). Природа этого импринта пока еще не известна, но его постепенная реверсия на протяжении нескольких циклов клеточных делений согласуется с разбавлением этой метки, связанным с репликацией. Поскольку отсутствие модификаций ограничено специфичными для гистона H3 добавками, можно предположить, что то, что замещается, является специфичной для Хр (или более многочисленной в Хр) молекулой, подобной H3, которая либо не модифицирована, либо не способна к модификации; например, это мог бы быть вариант гистона H3. Состав и структура хроматина во время сперматогенеза в настоящее время исследуются. Этот импринт Хр у эмбрионов XX выявляется как у потомства от скрещиваний (когда сперма происходит от родителя ХО), так и в потомстве от самооплодотворения (когда сперма происходит от родителя XX). Статус спаривания Х-хромосомы в ходе сперматогенеза и, таким образом, «нацеливание» H3K9me2 на Х-хромосому и ее обогащение этой модификацией не играют, следовательно, явной роли в установлении импринта Хр. Однако стабильность этого импринта — то есть число клеточных делений, после которых его все еще можно легко наблюдать — существенно увеличивается в потомстве от спермы, происходящей от родителя ХО, по сравнению со спермой, происходящей от родителя XX (Bean et al., 2004). Следовательно, сборка гетерохроматина на неспаренной ДНК во время мейоза имеет последствия, которые сохраняются на протяжении ранних эмбриональных стадий. Важно отметить, что у млекопитающих наблюдается консерватизм как базирующегося на спаривании мейотического сайленсинга, так и инактивации импринтированной Хр, как это обсуждается в главе 17. Биохимическая основа этого импринта и его эффектов неизвестна. В противоположность тому, что имеет место у млекопитающих, последствия унаследования обеих Х-хромосом с таким импринтом или без него у червей не очевидны. В самом деле, давно считалось, что генетический импринтинг per se (детально рассмотренный в главе 19) у С. elegans отсутствует, поскольку однородительское наследование любой хромосомы не имеет никаких явных последствий для развития и жизнеспособности. Сообщалось, однако, что Хр предпочтительно и часто теряется в ходе раннего развития в условиях стресса (Prahlad et al., 2003), хотя нет никаких данных о механизме, который мог бы вызывать столь необычное хромосомное поведение. У многих организмов обнаруживается предпочтительная утеря унаследованных от отца хромосом, а в крайних случаях во время эмбрионального развития утрачивается весь отцовский геном (Goday and Esteban, 2001). Описание таких резких различий в регулировании генома, основанных исключительно на поле родителя, от которого происходит данный генетический вклад, дало начало оригинальной концепции генетического импринтинга (обзор см.: Hernck and Seger, 1999). Имеет ли это отношение к эпигенетическому импринтингу, наблюдаемому у С. elegans, предстоит еще выяснить. Хр оказывается неактивной в ранних эмбрионах XX, тем не менее никогда не сообщалось о каких-либо вредных последствиях патроклинного наследования X (т.е. у животных ХрХр; Haack and Hodgkin, 1991). Уникальный генетический состав Х-хромосомы может помочь объяснить, почему однородительское наследование у С. elegans не является явно вредным. Кроме малого количества спермы и экспрессируемых только в зародышевой линии локусов на Х-хромосоме гены, кодирующие ранние зиготические транскрипты, и гены, требующиеся для раннего эмбрионального развития, также резко «недопредставлены» на Х-хромосоме (Piano et al., 2000; Baugh et al., 2003). Таким образом, большинство генов, продукты которых являются существенными для самых ранних стадий, на протяжении которых Хр является неактивной, вряд ли находятся на X, тем самым оставляя Х-специфичное однородительское наследование без последствий в генетических тестах. Однако инактивация Хр позволяет понять, почему активация соматической компенсации дозы не полностью задействована у ранних эмбрионов. Сборка компонентов DCC на Х-хромосомах у эмбрионов XX не выявляется с помощью окраски антителами приблизительно до 30-клеточной стадии. Это происходит вскоре после того, как Хр становится полностью декорированной модификациями H3 и, таким образом, предположительно является полностью активированной. Активация соматической компенсации дозы чувствительна к уровням содержания сцепленных с X продуктов, называемых сигнальными элементами Х-хромосомы (XSEs — X signal elements), составляющей часть X соотношения Х:А. Полная или частичная репрессия этих элементов на Хр может сделать ранний эмбрион функционально ХО (т.е. отношение Х:А интерпретируется как равное 0,5). По мере того как Хр реактивируется в ходе все возрастающего числа клеточных делений, уровень транскрипции Х-хромосомы может, наконец, достичь критического порога, при котором ощущается доза, равная двум Х-хромосомам, и X: А равняется 1, включая каскад компенсации дозы. Можно рассматривать это как переключение с материнского/отцовского контроля компенсации дозы на зиготический контроль.12. Заключительные замечания
В этой точке мы прошли полный круг в отношении специализированного регулирования сцепленных с X локусов у С. elegans. Предполагается, что специальная регуляция дозы этой хромосомы в соматических клетках возникла из различия в плоидности Х-хромосомы между двумя полами, как это произошло и у других видов. Интересно, что зародышевая линия и сома у червей развили различные механизмы, чтобы справиться с этим различием в плоидности X, что может отражать различные требования к экспрессии генов Х-хромосомы в этих тканях. В соматических линиях консервативный комплекс, который в норме используется для конденсации и сегрегации хроматина в митозе и мейозе, оказывается кооптированным и приспособленным для замечательно специфичной двукратной репрессии обеих Х-хромосом у животных XX. Хотя и привлекательно, в концептуальном отношении, представить себе дело так, что «неэффективный» комплекс конденсина мог бы послужить для снижения транскрипционной эффективности вдвое, в настоящее время непонятно, каким образом эта репрессия ограничивается двукратным снижением. В зародышевой линии Х-хромосомы глобально сайленсированы на ранних стадиях развития зародышевых клеток у животных XX и на всех стадиях развития зародышевых клеток у животных ХО. Система модификаторов хроматина MES участвует в этом сайленсинге у животных XX и, возможно, у животных ХО. Такой сайленсинг допускается отчасти потому, что Х-хромосомы «недонаселены» генами, экспрессируемыми в зародышевой линии. Полагают, что эта малочисленность сцепленных с X генов, существенных для мейоза у обоих полов, возникла в результате отсутствия партнера по спариванию для Х-хромосомы в ходе мужского мейоза и как следствие репрессивных механизмов защиты генома, которые «нацеливают» неспаренные хромосомные сегменты. Следствием глобального сайленсинга Х-хромосомы в зародышевой линии является то, что разница в плоидности X между полами имеет мало значения для этой ткани. Если каким-то сцепленным с X генам, которые работают у обоих полов, фактически удается избежать сайленсинга, тогда возникает вопрос о том, действительно ли зародышевая линия уравнивает свою экспрессию у животных XX в сопоставлении с животными ХО. Ответ на этот вопрос неизвестен. Выравнивание в зародышевой линии было бы связано, вероятно, с иным, чем DCC, механизмом, который действует в соматических тканях. Зародышевая линия и сома различаются во многих фундаментальных отношениях, и в этой главе освещена различная регуляция Х-хромосомы в них. Одной из возникших интересных тем является кооптация различных предсуществовавших механизмов, таких как использование комплекса, родственного конденсину, для тонкой даун-регуляции экспрессии Х-хромосомы в соме в сравнении с использованием комплекса, родственного PRC2, для сайленсирования Х-хромосом в зародышевой линии. Полагают, что гетерохроматинизация единственной Х-хромосомы у самцов резко изменила «представленность» генов на Х-хромосоме, так что гены, необходимые для общих функций зародышевой линии и раннего эмбрионального развития, существенно «недопредставлены» на этой хромосоме. Х-хромосома и ее регулирование у С. elegans представляют, таким образом, интересный срез эпигенетической регуляции целых хромосом, ее влияния на эволюцию генома и реакций на эту эволюцию.Литература
Ahmad K. and Golic K.G., 1998. The transmission of fragmented chromosomes in Drosophila melanogaster. Genetics 148: 775-792. Ahmad K. and Henikoff S., 2001. Centromeres are specialized replication domains in heterochromatin. /. Cell Biol 153: 101-110. Ahmad K. and Henikoff S., 2002. The histone variant H3.3 marks active chromatin by replication-independent nucleosome assembly. Mol Cell 9: 1191-1200. Aladjem M.I. and Fanning E., 2004. The replicon revisited: An old model learns new tricks in metazoan chromosomes. EMBO Rep. 5: 686-691. Amor D.J. and Choo K.H., 2002. Neocentromeres: Role in human disease, evolution, and centromere study. Am. J. Hum. Genet. 71: 695-714. Baarends W.M., Wassenaar E., van der Laan R., Hoogerbrugge J., Sleddens-Linkels E., Hoeijmakers J.H., de Boer P., and Grootegoed J.A., 2005. Silencing of unpaired chromatin and histone H2A ubiquitination in mammalian meiosis. Mol. Cell. Biol. 25: 1041-1053. Bassing C.H., Chua K.F., Sekiguchi J., Suh H., Whitlow S.R., Fleming J.C., Monroe B.C., Ciccone D.N., Yan C., et al., 2002. Increased ionizing radiation sensitivity and genomic instability in the absence of histone H2AX. Proc. Natl Acad. Sci. 99: 8173-8178. Baum M., Ngan V., and Clarke L., 1994. The centromeric K-type repeat and the central core are together sufficient to establish a functional Schizosaccharomyces pombe centromere. Mol Biol. Cell 5: 747-761. Bean C.J., Schaner C.E., and Kelly W.G., 2004. Meiotic pairing and imprinted X chromatin assembly in Caenorhabditis elegans. Nat. Genet. 36: 100-105. Bennett M.D., Dover G.A., and Riley R., 1974. Meiotic duration in wheat genotypes with or without homoeologous meiotic chromo some pairing. Proc. R. Soc. Lond. B Biol. Sci. 187: 191-207. Beukeboom L.W. and Werren J.H., 1993. Deletion analysis of the selfish B chromosome, Paternal Sex Ratio (PSR), in the parasitic wasp Nasonia vitripennis. Genetics 133: 637-648. Biessmann H. and Mason J.M., 2003. Telomerase-independent mechanisms of telomere elongation. Cell. Mol. Life Sci. 60: 2325-2333. Black B.E., Foltz D.R., Chakravarthy S., Luger K., Wbods V.L., Jr., and Cleveland D.W., 2004. Structural determinants for generating centromeric chromatin. Nature 430: 578-582. Blasco M.A., 2005. Telomeres and human disease: Ageing, cancer and beyond. Nat. Rev. Genet. 6: 611-622. Bloom K., Hill A., Kenna M., and Saunders M., 1989. The structure of a primitive kinetochore Trends Biochem. Sci. 14: 223-227. Blower M.D. and Karpen G.H., 2001. The role of Drosophila CID in kinetochore formation, cell-cycle progression and heterochromatin interactions. Nat. Cell Biol. 3: 730-739. Blower M.D., Sullivan B.A., and Karpen G.H., 2002. Conserved organization of centromeric chromatin in flies and humans. Dev. Cell 2: 319-330. Carroll C.W. and Straight A.F., 2006. Centromere formation: From epigenetics to self-assembly. Trends Cell Biol. 16: 70-78. Celeste A., Petersen S., Romanienko P.J., Femandez-Capetillo O., Chen H.T., SedelnikovaO.A., Reina-San-Martin B., CoppolaV., Meffre E., Difilippantonio M.J.. et al., 2002. Genomic instability in mice lacking histone H2AX. Science 296: 922-927. Cenci G., Siriaco G., Raffa G.D., Kellum R., and Gatti M., 2003. The Drosophila HOAP protein is required for telomere capping. Nat. Cell Biol. 5: 82-84. Clarke L., Amstutz H., Fishel B., and Carbon J., 1986. Analysis of centromeric DNA in the fission yeast Schizosaccharomyces pombe. Proc. Natl. Acad. Sci. 83: 8253-8257. Cleveland D.W., Mao Y., and Sullivan K.F., 2003. Centromeres and kinetochores: From epigenetics to mitotic checkpoint signaling. Cell 112: 407-421. Collins K.A., Furuyama S., and Biggins S., 2004. Proteolysis contributes to the exclusive centromere localization of the yeast Cse4/ CENP-A histone H3 variant. Curr. Biol. 14: 1968-1972. Cryderman D. E., Morris E., Biessmann H., Elgin S.C., and Will rath L.L., 1999. Silencing at Drosophila telomeres: Nuclear organization and chromatin structure play critical roles. EMBO J. 18: 3724-3735. Cullen C.F., Brittle A.L., Ito T., and Ohkura H., 2005. The conserved kinase NHK-1 is essential for mitotic progression and unifying acentrosomal meiotic spindles in Drosophila melanogaster. J. Cell Biol. 171: 593-602. Dawe R.K. and Hiatt E.N., 2004. Plant neocentromeres: Fast, focused, and driven. Chromosome Res. 12: 655-669. De La Fuente R., 2006. Chromatin modifications in the germinal vesicle (GV) of mammalian oocytes. Dev. Biol. 292: 1-12. de Saint Phalle B. and Sullivan W., 1996. Incomplete sister chromatid separation is the mechanism of programmed chromosome elimination during early Sciara coprophila embiyogenesis. Development 122: 3775-3784. DemburgA.F., 2001. Here, there, and everywhere: Kinetochore function on holocentric chromosomes. J. Cell Biol. 153: F33-38. Demburg A.F., Sedat J.W., and Hawley R.S., 1996. Direct evidence of a role for heterochromatin in meiotic chromosome segregation. Cell 86: 135-146. Dobson S.L. and Tanouye M.A., 1998. Evidence for a genomic imprinting sex determination mechanism in Nasonia vitripennis (Hymenoptera; Chalcidoidea). Genetics 149: 233-242. Donaldson KM., Lui A., and Karpen G.H., 2002. Modifiers of terminal deficiency-associated position effect variegation in Drosophila. Genetics 160: 995-1009. Dvorak J. and Lukaszewski A.J., 2000. Centromere association is an unlikely mechanism by which the wheat Phi locus regulates metaphase I chromosome pairing between homoeologous chromosomes. Chromosoma 109: 410-414 Fanti L., Giovinazzo G., Berloco M., and Pimpinelli S., 1998. The heterochromatin protein 1 prevents telomere fusions in Drosophila. Mol. Cell 2: 527-538. Ferguson B.M. and Fangman W.L., 1992. A position effect on the time of replication origin activation in yeast. Cell 68: 333-339. Femandez-Capetillo O., Lee A., Nussenzweig M., and Nussenzweig A., 2004. H2AX: The histone guardian of the genome. DNA Repair 3: 959-967. Ferreri G.C., Lise insky D.M., Mack J.A., Eldridge M.D., and O’Neill R.J., 2005. Retention of latent centromeres in the mammalian genome. J. Hered. 96: 217-224. Fnedberg E., Walker G.. and Siede W.. 1995. DNA repair and mutagenesis. ASM Press, Washington D.C. Ganetzky B., 1977. On the components of segregation distortion in Drosophila melanogaster. Genetics 86: 321-355. Garcia-Cao M., O’Sullivan R., Peters A. H., Jenuwein T., and Blasco M.A., 2004. Epigenetic regulation of telomere length in mammalian cells by the Suv39hl and Suv39h2 histone methyltransferases. Nat. Genet. 36: 94-99. Goday C. and Ruiz M.F., 2002. Differential acetylation of histones H3 and H4 in paternal and maternal germline chromosomes during development of sciarid flies. J. Cell Sci. 115: 4765-4775. Grell R.F., 1976. Distributive pairing. In The genetics and biology of Drosophila (ed. E. Novitski and M. Ashbumer), pp. 436-483. Academic Press, New York. Griffiths S., Sharp R., Foote T.N., Bertin I., Wanous M., Reader S., Colas I., and Moore G., 2006. Molecular characterization of Ph 1 as a major chromosome pairing locus in polyploid wheat. Nature 439: 749-752. Hall A.E., Kettler G.C., and Preuss D., 2006. Dynamic evolution at pericentromeres. Genome Res. 16: 355-364. Hassa P.O. and Hottiger M.O., 2005. An epigenetic code for DNA damage repair pathways? Biochem. Cell Biol. 83: 270-285. Hawley R.S., Irick H., Zitron A.E., Haddox D.A., Lohe A., New C, Whitley M.D., Arbel T., Jang J., McKim K., and Childs G., 1993. There are two mechanisms of achiasmate segregation in Drosophda females, one of which requires heterochromatic homology. Dev. Genet. 13: 440-467 Heun P., Erhardt S., Blower M.D., Weiss S., Skora A.D., and Karpen G.H., 2006. Mislocalization of the Drosophila centromere-specific histone CID promotes formation of functional ectopic kinetochores. Dev. Cell 10: 303-315. Huyen Y., Zgheib O., Ditullio R.A., Jr., Gorgoulis V.G., Zacharatos P., Petty T.J., Sheston E.A., Mellert H.S., Stavridi E.S., and Halazonetis T.D., 2004. Methylated lysine 79 of histone H3 targets 53BP1 to DNA double-strand breaks. Nature 432: 406-411. Hynes M.J. and Todd R.B., 2003. Detection of unpaired DNA at meiosis results in RNA-mediated silencing. Bioessays 25: 99-103. Ivanovska I., Khandan T., Ito X, and Orr-Weaver T.L., 2005. A histone code in meiosis: The histone kinase, NHK-1, is required for proper chromosomal architecture in Drosophila oocytes. Genes Dev., 19: 2571-2582. Joseph I., Jia D., and Lustig A.J., 2005. Ndjlp-dependent epigenetic resetting of telomere size in yeast meiosis. Curr. Biol. 15: 231-237. Karpen G.H. and Spradling A.C., 1992. Analysis of subtelomeric heterochromatin in the Drosophila minichromosome Dpi 187 by single P element insertional mutagenesis. Genetics 132: 737-753. Karpen G.H., Le M.H., and Le H., 1996. Centric heterochromatin and the efficiency of achiasmate disjunction in Drosophila female meiosis. Science 213: 118-122. Kemp B., Boumil R.M., Stewart M.N., and Dawson D.S., 2004. A role for centromere pairing in meiotic chromosome segregation. Genes Dev. 18: 1946-1951. Kusano A., Staber C., Chan H.Y., and Ganetzky B., 2003. Closing the (Ran)GAP on segregation distortion in Drosophila. Bioessays 25: 108-115. Kuril B.L., Seong K.Y., and Aramayo R., 2003. Unpaired genes do not silence their paired neighbors. Curr. Genet. 43: 425-432. Lai S.R., Phipps S.M., Liu L., Andrews L.G., and Tollefsbol T.O., 2005. Epigenetic control of telomerase and modes of telomere maintenance in aging and abnormal systems. Front. Biosci. 10: 1779-1796. Lam A.L., Boivin C.D., Bonney C.F., Rudd M.K., and Sullivan B.A., 2006. Human centromeric chromatin is a dynamic chromosomal domain that can spread over noncentromeric DNA. Proc. Natl. Acad. Sci. 103: 4186-4191. Lee D.W., Pratt R.J., McLaughlin M., and Aramayo R., 2003. An aigonaute-like protein is required for meiotic silencing. Genetics 164: 821-828. Lee D.W., Seong K.Y., Pratt R.J., Baker K., and Aramayo R., 2004. Properties of unpaired DNA required for efficient silencing in Neurospora crassa. Genetics 167: 131-150. Lo A.W., Magliano D.J., Sibson M.C., Kalitsis P., Craig J.M., and Choo K.H., 2001. A novel chromatin immunoprecipitation and array (CIA) analysis identifies a 460-kb CENP-A-binding neocentromere DNA. Genome Res. 11: 448-457. Louis EJ. and Vershinin A.V., 2005. Chromosome ends: Different sequences may provide conserved functions. Bioessays 21: 685-697 Lue N.F., 2004. Adding to the ends: What makes telomerase proces-sive and how important is it? Bioessays 26: 955-962. Luo M.C., Dubcovsky J., and Dvorak J., 1996. Recognition of homeology by the wheat Phi locus. Genetics 144: 1195-1203. Maggert K.A. and Karpen G.H., 2001. Neocentromere formation occurs by an activation mechanism that requires proximity to a functional centromere. Genetics 158: 1615-1628. Maine E.M., Hauth J.. RatliffX Vought V.E., SheX,, and Kelly W.G., 2005. EGO-1, a putative RNA-dependent RNA polymerase, is required for heterochromatin assembly on unpaired dna during C. elegans meiosis. Curr. Biol. 15: 1972-1978. Malik H.S. and Henikoff S., 2002. Conflict begets complexity: The evolution of centromeres. Curr. Opin. Genet. Dev. 12: 711-718. McKee B.D., 1998. Pairing sites and the role of chromosome pairing in meiosis and spermatogenesis in male Drosophila. Curr. Top. Dev. Biol. 31: 77-115. Mellone B.G. and Allshire R.C., 2003. Stretching it: Putting the CEN(P-A) in centromere. Curr. Opin. Genet. Dev. 13: 191-198. Miller K.M. and Cooper J.P., 2003. The telomere protein Tazl is required to prevent and repair genomic DNA breaks. Mol. Cell 11: 303-313. Nakaseko Y., Kinoshita N., and Yanagida M., 1987. Anovel sequence common to the centromere regions of Schizosaccharomyces pombe chromosomes. Nucleic Acids Res. 15: 4705-4715. Nakatani Y., Ray-Gallet D., Quivy J.R, Tagami H., and Almouzni G., 2004. Two distinct nucleosome assembly pathways: Dependent or independent of DNA synthesis promoted by histone H3.1 and H3.3 complexes. Cold Spring Harbor Symp. Quant. Biol. 69: 273-280. Nimmo E.R., Pidoux A.L., Perry P.E., and Allshire R.C., 1998. Defective meiosis in telomere-silencing mutants of Schizosaccharomyces pombe. Nature 392: 825-828. Nonaka N., Kitajima X, Yokobayashi S., Xiao G., Yamamoto M., Grewal S.I., and Watanabe Y, 2002. Recruitment of cohesin to heterochromatic regions by Swi6/HPl in fission yeast. Nat. Cell Biol. 4: 89-93. Ogino K., Elirota K., Matsumoto S., TakedaX., Ohta K., Arai K.I., and Masai H., 2006. Hskl kinase is required for induction of meiotic dsDNA breaks without involving checkpoint kinases in fission yeast. Proc. Natl. Acad. Sci. 103: 8131-8136. Pasero P., Bensimon A., and Schwob E., 2002. Single-molecule analysis reveals clustering and epigenetic regulation of replication ongins at the yeast rDNA locus. Genes Dev. 16: 2479-2484. Perrini B., Piacentini L., Fanti L., Altieri F., Chichiarelli S., Berloco M., Turano C., Ferraro A., and Pimpinelli S., 2004. HP1 controls telomere capping, telomere elongation, and telomere silencing by two different mechanisms in Drosophila. Mol. Cell 15: 467-476. Pidoux A.L. and Allshire R.C., 2004. Kinetochore and heterochromatin domains of the fission yeast centromere. Chromosome Res. 12: 52N534. Prasanth S.G., Mendez J., Prasanth K.V., and Stillman B., 2004. Dynamics of pre-replication complex proteins during the cell division cycle. Philos. Trans. R. Soc. Lond. B Biol. Sci. 359: 7-16. Pratt R.J., Lee D.W., and Aramaya R., 2004. DNA methylation affects meiotic trans-sensing, not meiotic silencing, in Neurospora. Genetics 168: 1925-1935. Reddy K.C. and Villeneuve A.M., 2004. C. elegans HIM-17 links chromatin modification and competence for initiation of meiotic recombination. Cell 118: 439-452. Rhoades M.M. and Dempsey E., 1966. The effect of abnormal chromosome 10 on preferential segregation and crossing over in maize. Genetics 53: 989-1020. Rudd M.K., Mays R.W., Schwartz S., and Willard H.F., 2003. Human artificial chromosomes with alpha satellite-based de novo centromeres show increased frequency of nondisjunction and anaphase lag. Mol. Cell Biol. 23: 7689-7697. Sadaie M., Naito X., and Ishikawa E., 2003. Stable inheritance of telomere chromatin structure and function in the absence of telomenc repeats. Genes Dev. 17: 2271-2282. Sandler L. and Hiraizumi Y., 1959. Meiotic drive in natural populations of Drosophila melanogaster. II. Genetic variation at the Segregation-distorter locus. Proc. Natl. Acad. Sci. 45: 1412-1422. Sharp J.A., Franco A.A., Osley M.A., and Kaufman P.D., 2002. Chromatin assembly factor I and Hir proteins contribute to building functional kinetochores in S. cerevisiae. Genes Dev. 16: 85-100. Shelby R.D., Monier K., and Sullivan K.E, 2000 Chromatin assembly at kinetochores is uncoupled from DNA replication. J. Cell Biol. 151: 1113-1118. Shiu P.K. and Metzenberg R.L., 2002. Meiotic silencing by unpaired DNA: Properties, regulation and suppression. Genetics 161: 1483-1495. Steiner N.L. and Clarke L., 1994. A novel epigenetic effect can alter centromere function in fission yeast. Cell 79: 865-874. Sullivan B. and Karpen G., 2001. Centromere identity in Drosophila is not determined in vivo by replication timing. J. Cell Biol. 154: 683-690. Sullivan B.A. and Karpen G.H., 2004. Centromeric chromatin exhibits a histone modification pattern that is distinct from both euchromatin and heterochromatin. Nat. Struct. Mol. Biol. 11. 1076-1083. Sullivan B.A. and Willard H.F., 1998. Stable dicentric X chromosomes with two functional centromeres. Nat. Genet., 20: 227-228. Tsubouchi T. and Roeder G.S., 2005. A synaptonemal complex protein promotes homology-independent centromere coupling. Science 308: 870-873. Turner J.M., Mahadevaiah S.K., Femandez-Capetillo O., Nussenzweig A., XuX., Deng C.X., and Buigoyne P.S., 2005. Silencing of unsynapsed meiotic chromosomes in the mouse. Nat. Genet. 37: 41-47. Watanabe Y., 2005. Sister chromatid cohesion along arms and at centromeres. Trends Genet. 21: 405-412. Weinreich M., Palacios DeBeer M.A., and Fox C.A., 2004. The activities of eukaryotic replication origins in chromatin. Biochim. Biophys.Acta 1677: 142-157. Werren J.H., Nur U., and Eickbush D., 1987. An extrachromosomal factor causing loss of paternal chromosomes. Nature 327: 75-76. Wu H.Y. and Burgess S.M., 2006. Ndjl, a telomere-associated protein, promotes meiotic recombination in budding yeast. Mol. Cell Biol. 26: 3683-3694. Yan H., Jin W., Nagaki K., Tian S., Ouyang S., Buell C.R., Talbert P.B., Henikoff S., and Jiang J., 2005. Transcription and histone modifications in the recombination-free region spanning a rice centromere. Plant Cell 17: 3227-3238. Yoda K., Ando S., Monshita S., Houmura K., Hashimoto K., Takeyasu K., and Okazaki X, 2000. Human centromere protein A (CENP-A) can replace histone H3 in nucleosome reconstitution in vitro. Proc. Natl. Acad. Sci. 97: 7266-7271. Yu H.G., Hiatt E.N., Chan A., Sweeney M., and Dawe R.K., 1997. Neocentromere-mediated chromosome movement in maize. J. Cell Biol. 139: 831-840. Alekseyenko A.A. and Kuroda M.I., 2004. Filling gaps in genome organization. Science 303: 1148-1149. Baarends W.M., Wassenaar E., van der Laan R., Hoogerbrugge J., Sleddens-Linkels E., Hoeijmakers J.H., de Boer P., and Grootegoed J.A., 2005. Silencing of unpaired chromatin and histone H2A ubiquitination in mammalian meiosis. Mol. Cell. Biol. 25: 1041-1053. Baugh L.R.. Hill A.A., Slonim D.K., Brown E.L., and Hunter C.R, 2003. Composition and dynamics of the Caenorhabditis elegans early embryonic transcriptome. Development 130: 889-900. Bean C.J., Schaner C.E., and Kelly W.G., 2004. Meiotic pairing and imprinted X chromatin assembly in Caenorhabditis elegans. Nat. Genet. 36: 100-105. Bender L.B., Cao R., Zhang Y., and Strome S., 2004. The MES-2/ MES-3/MES-6 complex and regulation of histone H3 methylation in C. elegans. Curr. Biol 14: 1639-1643. Bender L.B., Suth J.. Carroll C.R.. Fong Y., Fingerman I.M.. Cao R., Zhang Y., Briggs S.D., Reinke V., and Strome S., 2006. MES-4, an autosome-associated histone methyltransferase that participates in silencing the X chromosomes in the C. elegans germ line. Development. (In press.) Carmi I., Kopczynski J.B., and Meyer B.J., 1998. The nuclear hormone receptor SEX-1 is an X-chromosome signal that determines nematode sex. Nature 396: 168-173. Chu D.S., Dawes H.E., Lieb J.D., Chan R.C., Kuo A.F., and Meyer B.J., 2002. A molecular link between gene-specific and chromosome-wide transcriptional repression. Genes Dev. 16: 796-805. Cowell I.G., Aucott R., Mahadevaiah S.K., Burgoyne P.S., Huskisson N., Bongiomi S., Prantera G., Fanti L., Pimpinelli S., Wu R., et al., 2002. Heterochromatin, HP1 and methylation at lysine 9 of histone H3 in animals. Chromosoma 111: 22-36. Csankovszki G., McDonel P., and Meyer B.J.. 2004. Recruitment and spreading of the C elegans dosage compensation complex along X chromosomes. Science 303: 1182-1185. Dawes H.E., Berlin D.S., Lapidus D.M., Nusbaum C, Davis T.L., and Meyer B.J., 1999. Dosage compensation proteins targeted to X chromosomes by a determinant of hermaphrodite fate. Science 284: 1800-1804. Fong Y., Bender L., Wang W., and Strome S., 2002. Regulation of the different chromatin states of autosomes and X chromosomes in the germline of C. elegans. Science 296: 2235-2238. Goday C. and Esteban M.R., 2001. Chromosome elimination in sciarid flies. BioEssays 23: 242-250. Goldstein P. and Slaton D.E., 1982. The synaptonemal complexes of Caenorhabditis elegans: Comparison of wild-type and mutant strains and pachytene karyotype analysis of wild-type. Chromosoma 84: 585-597. Haack H. and Hodgkin J., 1991. Tests for parental imprinting in the nematode Caenorhabditis elegans. Mol. Gen. Genet. 228: 482-485. Handel M.A., 2004. The XYbody: a specialized meiotic chromatin domain. Exp. Cell Res. 296: 57-63. Hansen D., Hubbard E.J.A., and Schedl T., 2004. Multi-pathway control of the proliferation versus meiotic development decision in the Caenorhabditis elegans germline. Dev. Biol. 268: 342-357. Herrick G. and Seger J., 1999. Imprinting and paternal genome elimination in insects. Results Probl. Cell Differ. 25: 41-71. Hirano T., 2002. The ABCs of SMC proteins: Two-armed ATPases for chromosome condensation, cohesion, and repair. Genes Dev. 16: 399-414. Kelly W.G., Schaner C.E., Demburg A.F., Ho-Lee M., Kim S.K., Villeneuve A.M., and Reinke V., 2002. X-chromosome silencing in the germline of C. elegans. Development 129: 479-492. Ketel C.S., Andersen E.F., Vargas M.L., Suh J., Strome S., and Simon J.A., 2005. Subunit contributions to histone methyltransferase activities of fly and worm polycomb group complexes. Mol. Cell. Biol. 25: 6857-6868. Maciejowski J., Ahn J.H., Cipriani P.G., Killian D.J., Chaudhary A.L., Lee J.I., Voutev R., Johnsen R.C., Baillie D.L., Gunsalus K.C., et al., 2005. Autosomal genes of autosomal/X-linked duplicated gene pairs and germ-line proliferation in Caenorhabditis elegans. Genetics 169: 1997-2011. Maine E.M., Hauth J., Ratliff T., Vought V.E., She X., and Kelly W.G., 2005. EGO-1, a putative RNA-dependent RNA polymerase, is required for heterochromatin assembly on unpaired DNA during C. elegans meiosis. Curr. Biol. 15: 1972-1978. Meyer B.J., 1997. Sex determination and X chromosome dosage compensation. In C. elegans II (ed. D.L. Riddle et al.), pp., 209-240. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York. Meyer B.J., 2000. Sex in the worm counting and compensating X-chromosome dose. Trends Genet. 16: 247-53. Meyer B.J., 2005. X-chromosome dosage compensation. In Worm-Book, http://www.wormbook.org/chapters/www_dosagecomp/dosage-comp.html. Nakayashiki H., 2005. RNA silencing in fungi: Mechanisms and applications. FEBS lett. 579: 5950-5957. Nigon V., 1951. Polyploidie experimentale chez un nematode libre, Rhaditis elegans maupas. Bull. Biol. Fr. Belg. 85: 187-255. Piano F., Schetter A.J., Mangone M., Stein L., and Kemphues K.J., 2000. RNAi analysis of genes expressed in the ovary of Caenorhabditis elegans. Curr. Biol. 10: 1619-1622. Powell J.R., Jow M.M., and Meyer B.J., 2005. The T-box transcription factor SEA-1 is an autosomal element of the X:A signal that determines C. elegans sex. Dev. Cell 9: 339-349. Prahlad V., Pilgrim D., and Goodwin E.B., 2003. Roles for mating and environment in C. elegans sex determination. Science 302: 1046-1049. Reinke V., Gil I.S., Ward S., and Kazmer K., 2004. Genome-wide germline-enriched and sex-biased expression profiles in Caenorhabditis elegans. Development 131: 311-323. Reinke V., Smith H.E., Nance J., Wang J., Van Doren C., Begley R., Jones S.J.M., Davis E.B., Scherer S., Ward S., and Kim S.K., 2000. A global profile of germ line gene expression in C. elegans. Mol. Cell 6: 605-616. Schedl T., 1997. Developmental genetics of the germ line. In C. elegans //(ed. D.L. Riddle et al.), pp. 241-269. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York. Shiu P.K., Raju N.B., Zickler D., and Metzenberg R.L., 2001. Meiotic silencing by unpaired DNA. Cell 107: 905-916. Skipper M., Milne C.A., and Hodgkin J., 1999. Genetic and molecular analysis offox-1, a numerator element involved in Caenorhabditis elegans primary sex determination. Genetics 151: 617-631. Turner J.M., 2005. Sex chromosomes make their mark. Chromosoma 114: 300-306. Turner J.M., Mahadevaiah S.K., Femandez-Capetillo O., Nussenzweig A., Xu X., Deng C.X., and Burgoyne P.S., 2005. Silencing of unsynapsed meiotic chromosomes in the mouse. Nat. Genet. 37: 41-47. van Leeuwen F. and Gottschling D.E., 2002. Genome-wide histone modifications: gaining specificity by preventing promiscuity. Curr. Opin. Cell Biol. 14: 756-762. Wang L., Brown J.L., Cao R., Zhang Y., Kassis J.A., and Jones R.S., 2004. Hierarchical recruitment of polycomb group silencing complexes. Mol. Cell 14: 637 646. Wu C.I. and Xu Y., 2003. Sexual antagonism and X inactivation — The SAXI hypothesis. Trends Genet., 19: 243-247. Xu L., Fong Y., and Strome S., 2001. The Caenorhabditis elegans matemal-effect sterile proteins, MES-2, MES- 3, and MES-6, are associated in a complex in embryos. Proc. Natl. Acad. Sci. 98: 5061-5066. Yonker S.A., and Meyer B.J., 2003. Recruitment of C. elegans dosage compensation proteins for gene-specific versus chromosome-wide repression. Development 130: 6519-6532.Глава 16. Компенсация дозы у Drosophila
 John С. Lucchesi1 и Mitzi I. Kuroda2
1Department of Biology, Graduate Division of Biological and Biomedical Sciences, Emory University, Atlanta, Georgia 30322
2Harvard Partners Center for Genetics & Genomics, Brigham & Women’s Hospital, Department of Genetics, Harvard Medical School, Boston, Massachusetts 02446
John С. Lucchesi1 и Mitzi I. Kuroda2
1Department of Biology, Graduate Division of Biological and Biomedical Sciences, Emory University, Atlanta, Georgia 30322
2Harvard Partners Center for Genetics & Genomics, Brigham & Women’s Hospital, Department of Genetics, Harvard Medical School, Boston, Massachusetts 02446
Общее резюме
Механизм, ответственный за транскрипцию генетической информации, т. е. за синтез информационных РНК, изучен в весьма значительной степени. Идентифицированы факторы, участвующие в активации индивидуальных генов, в поддержании активного состояния и в прекращении активности, когда она больше не нужна. Коль скоро они были открыты, были изучены и все еще являются предметом интенсивных исследований взаимодействия этих факторов с регуляторными и кодирующими частями генов. В последние годы долго существовавшая догма, согласно которой клеточная дифференцировка и развитие требуют скоординированной регуляции различных наборов генов во времени и в пространстве, привела к поискам регуляторных сигналов, которые влияли бы на активность групп функционально связанных генов. Задолго до того, как эти исследования были начаты, пример скоординированной регуляции был описан у Drosophila. В этом конкретном случае группа генов, активность которых регулировалась в унисон, не были связаны по функции, а скорее имели общую локализацию в генетическом материале: все они находились на одной из половых хромосом, Х-хромосоме. Цель этого регулирования — обеспечить, чтобы самки с двумя Х-хромосомами и самцы с одной только Х-хромосомой имели бы равные уровни генных продуктов; другими словами, цель — компенсировать различия между полами в дозах сцепленных с X генов. В исследованиях этого уровня регуляции вопрос «Каким образом группы неродственных генов скоординировано регулируются?» превратился в вопрос «Каковы механизмы, которые могут регулировать активность целой хромосомы?». Изучение компенсации дозы у Drosophila — механизма, усиливающего транскрипцию большинства генов на единственной Х-хромосоме у самцов, — выявляет участие сайт-специфичного ацетилирования гистонов, специфические некодирующие РНК (называемые roX1 и roХ2) и «нацеливание», в масштабах целой хромосомы, эволюционно консервативной машины, модифицирующей гистоны, которая, как показано на фотографии в начале этой главы, локализуется на Х-хромосоме1 Явление компенсации дозы было открыто у Drosophila
Кариотипы (т. е. ансамбль хромосом) многих организмов включают пару половых хромосом. У Drosophila самки имеют две половые хромосомы, называемые Х-хромосомами, которые идентичны по форме и генетическому содержанию; обе Х-хромосомы активны во всех соматических клетках. Самцы имеют одну Х-хромосому и хромосому, отличающуюся от X по морфологии и генетической информации, содержащейся в ней, — Y-хромосому (рис. 16.1). На этих половых хромосомах находятся гены, отвечающие за детерминацию пола и половую дифференцировку. Кроме того, — и это особенно справедливо для Х-хромосомы — имеется много генов, участвующих в базовых клеточных функциях «домашнего хозяйства» или в развитии. Самки с двумя Х-хромосомами имеют вдвое больше этих генов; самцы с одной X имеют только одну их дозу. Тем не менее, уровень содержания продуктов большинства этих генов одинаков у двух полов. В начале 1930-х годов этот парадокс был впервые отмечен у Drosophila Меллером (H.J. Muller), когда он изучал содержание глазного пигмента у особей, несущих сцепленные с X мутации частичной утраты функции (рис. 16.2). Меллер рассудил, что должен быть регуляторный механизм, который помогает мухам компенсировать различие между двумя полами в дозе сцепленных с X генов у самцов и самок путем уравнивания уровня продуктов генов, сцепленных с X. Он назвал этот гипотетический регуляторный механизм «компенсацией дозы». Первое доказательство, что компенсация дозы достигается путем регулирования транскрипции сцепленных с X генов, было получено через 30 с лишним лет Мухерджи и Беерманом (A.S. Mukheijee and W. Beermann). Используя транскрипционную ауторадиографию [transcriptional autoradigraphy] гигантских политенных хромосом из слюнных желез личинок — молекулярную технику, представляющую методический уровень того времени — эти авторы наблюдали, что уровень включения рН]уридина единственной Х-хромосомой у самцов и обеими Х-хромосомами у самок был одинаков. Получалось, таким образом, что скорость синтеза РНК единственной Х-хромосомой у самцов была приблизительно вдвое большей, чем скорость синтеза каждой из двух Х-хромосом у самок. Следующий экспериментальный прорыв состоял в том, что Белоте и Лучези (J. Belote and J Lucchesi) генетически идентифицировали четыре гена с мутациями типа «утраты функции», которые не имели никаких последствий у самок, но были летальными у самцов; последние обнаруживали приблизительно половину нормального уровня включения [3Н]уридина в свою Х-хромосому. Более того, эта Х-хромосома утрачивала свой нормальный более бледный и несколько «раздутый» [puffed] вид, что было истолковано как указание на повышенный уровень транскрипционной активности по отношению к каждой из двух Х-хромосом у самок. Эти результаты заставляли предполагать, что уравнивание продуктов генов, сцепленных с X, достигается удвоением (в среднем) транскрипционной активности Х-хромосомы у самцов, а не снижением вдвое транскрипционной активности каждой Х-хромосомы у самок. Из этих четырех генов два были открыты заново (male-specific lethal I, msll; и male-specific lethal 2, msl2), тогда как другие два (maleless, mle; и male-specific lethal 3, msl3) были прежде идентифицированы другими исследователями в природных популяциях (конкретные ссылки, относящиеся к этой ранней фазе исследования компенсации дозы, можно найти у Lucchesi and Manning, 1987). Все генные продукты, идентифицированные до сих пор на основе специфичного для самцов летального фенотипа соответствующих мутаций типа «утраты функции», для того чтобы было легче ссылаться на них, называются MSLs (male-specific lethal phenotype). Рис. 16.1. Сделанный с помощью рисовального аппарата рисунок женской (слева) и мужской (справа) метафазнои пластинки Drosophila melanogaster
Обратите внимание на то. что Х-хромосома составляет - 20 % кариотипов (перепечатка, с любезного разрешения, из Morgan, 1932)
Рис. 16.1. Сделанный с помощью рисовального аппарата рисунок женской (слева) и мужской (справа) метафазнои пластинки Drosophila melanogaster
Обратите внимание на то. что Х-хромосома составляет - 20 % кариотипов (перепечатка, с любезного разрешения, из Morgan, 1932)
Следующая фаза в исследовании компенсации дозы началась с клонирования mle, за чем вскоре последовало клонирование трех генов msl в лабораториях Бейкера, Курода и Лучези (В. baker, М. Kuroda and J. Lucchesi). С помощью цитоиммунофлуоресценции обнаружили, что четыре генных продукта связаны идентичным образом в многочисленных сайтах по всей длине политенной Х-хромосомы самцов (Palmer et al., 1993; Bone et al., 1994; Gorman et al., 1995; Kelley et al., 1995; Gu et al., 1998; см. рис. в начале главы). Это наблюдение и взаимозависимость разных генных продуктов в связывании с Х-хромосомой заставляли предполагать, что они образуют комплекс (рис. 16.3).
2. Компенсация дозы связана с модификациями хроматина
Присутствие комплекса MSL на Х-хромосоме у самцов коррелирует с присутствием специфической изоформы гистона Н4, ацетилированной по лизину 16 ((Tumer et al., 1992; Bone et al., 1994). У дрожжей было показано, что эта конкретная ковалентная модификация гистона Н играет ключевую роль в поддержании границы между «молчащим» хроматином и активным хроматином: утрата функции Sas2, ацетилтрансферазы гистонов (HAT), отвечающей за H4K16ас, делает возможным распространение теломерного гетерохроматина в соседний субтеломерный хроматин (Suka et al., 2002; дополнительные детали см. в главе 4). Обнаружили, что у DrosophilaХ-хромосома по своей длине сильно обогащена H4K16ас. Недавние структурные исследования показали, что ключевое межнуклеосомное взаимодействие может происходить между кислотным «пятном» (patch) гистонового димера H2A-H2B на одной нуклеосоме и положительно заряженным сегментом «хвоста» гистона Н4 (остатки 16–26), отходящего от соседней нуклеосомы (Schalch et al., 2005). Когда лизин 16 специфически ацетилирован, его положительный заряд становится нейтральным, позволяя предполагать, что ослабление репрессивной межнуклеосомной структуры могло бы играть ключевую роль в компенсации дозы.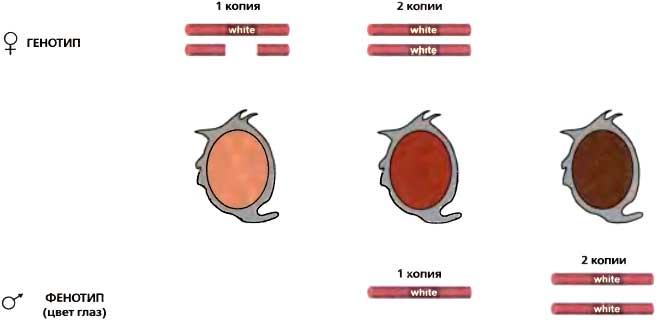 Рис. 16.2. Схематическое изображение результатов, которые привели Г. Дж. Меллера к формулировке гипотезы о компенсации дозы
Мутантная аллель (wa) сцепленного с X гена white является гипоморфом и делает возможным лишь частичный синтез глазного пигмента; ее присутствие на Х-хромосомах показано более темным прямоугольником. Уровень пигментации прямо пропорционален дозе аллели wa у каждого пола; тем не менее, самцы с одной дозой и самки с двумя дозами имеют сравнимые количества пигмента благодаря компенсации дозы
Рис. 16.2. Схематическое изображение результатов, которые привели Г. Дж. Меллера к формулировке гипотезы о компенсации дозы
Мутантная аллель (wa) сцепленного с X гена white является гипоморфом и делает возможным лишь частичный синтез глазного пигмента; ее присутствие на Х-хромосомах показано более темным прямоугольником. Уровень пигментации прямо пропорционален дозе аллели wa у каждого пола; тем не менее, самцы с одной дозой и самки с двумя дозами имеют сравнимые количества пигмента благодаря компенсации дозы
Ни один из первоначально идентифицированных факторов, участвующих в компенсации дозы, не обнаруживал характерных признаков HAT. Поскольку все предшествовавшие поиски мутантов были сконцентрированы на скрининге главных аутосом, был проведен новый поиск сцепленных с X специфичных для самцов летальных мутаций, и был идентифицирован новый ген, males absent on the first (mof) (Hilfiker et al., 1997). Рекомбинантный белок, кодируемый mofi является HAT, специфически ацетилирующей гистон Н4 по лизину 16 (Akhtar and Becker, 2000); он является интегральной частью комплекса MSL и однозначно отвечает за эту изоформу Н4 на Х-хромосоме самцов (Smith et al., 2000). MOF является членом подсемейства в семействе HATs, обозначаемом как MYST. Это подсемейство, характеризующееся присутствием хромодомена, можно далее подразделить на ферменты, которые специфически аиетилируют H4K16 in vivo (MOF и MOF человека; Smith et al., 2005) и такие ферменты, как Esal (essential SAS-related acetyltransferase 1 protein) у дрожжей, которые ацетилируют все четыре терминальных лизина в Н4 (Smith et al., 1998). Еще один член семейства MYST, SAS2, специфически ацетилирует H4K16 у дрожжей, но не имеет хромодомена. В то же самое время, когда был открыт и охарактеризован MOF, были установлены каталитические свойства MLE, другой субъединицы с предполагаемой ферментативной активностью. Оказалось, что MLE обнаруживает in vitro активности РНК/ДНК-геликазы, аденозинтрифосфатазы (АТФазы) и связывания с однонитевой HYR|ssDNA (Lee et al., 1997), предрекая потенциальную роль РНК в функции MSL. Некоторые мультибелковые комплексы, взаимодействующие с хроматином для контроля скорости транскрипции эухроматиновых генов, используют гидролиз АТФ для изменения нуклеосомной конформации. За гидролиз АТФ отвечает семейство белков, содержащих геликазный домен (Sif, 2004); хотя это семейство может и не выполнять ту же самую функцию в комплексе MSL, оно представлено MLE. Ортологи MLE, в число которых входит РНК-геликаза А человека (RHA), принадлежат к подсемейству РНК-геликаз DEXH и характеризуются приобретением новых доменов (Kuroda et al., 1991) и консервативного аминотерминального участка длиной ~350 аминокислот (Pannuti and Lucchesi, 2000). MLE может осуществлять свою функцию в компенсации дозы скорее путем изменения структуры РНК, а не помогая в ремоделинге хроматина.
 Рис. 16.3. Схема, иллюстррующая различные компоненты комплекса MSL
В число известных функций компонентов MSL входит ацетилирование гистона по H4K16 с помощью MOF, MLE обладает АТФазной и РНК/ДНК-геликазной активностью, a JIL-1 фосфорилирует гистон H3. Неясно, является ли JIL-1 субъединицей этого комплекса
Рис. 16.3. Схема, иллюстррующая различные компоненты комплекса MSL
В число известных функций компонентов MSL входит ацетилирование гистона по H4K16 с помощью MOF, MLE обладает АТФазной и РНК/ДНК-геликазной активностью, a JIL-1 фосфорилирует гистон H3. Неясно, является ли JIL-1 субъединицей этого комплекса
Специфическая роль остальных компонентов комплекса MSL не вполне понятна. MSL3, субъединица комплекса MSL, характеризующаяся присутствием неканонического хромодомена и домена «chromoshadow» (Aasland and Stewart, 1995; Koonin et al., 1995), является членом семейства белков, которые могли совместно эволюировать с HATs, несущими хромодомен (Pannuti and Lucchesi, 2000). У дрожжей член этого семейства, Eaf3 (Esal-associated factor-3 protein), обнаружен в комплексе NuA4 с энзимом Esal группы MYST (Eisen et al., 2001). У Drosophila мультибелковый комплекс Tip60 включает MRG15, паралог MSL3 (Kusch et al., 2004). У человека MRG15 связан с MOF в комплексе MAF2 (Pardo et al., 2002). Особый интерес представляет существование у человека еще одного комплекса, родственного комплексу MSL и включающего человеческие гомологи MOF, MSL1, MSL2 и MSL3. Этот комплекс, специфически ацетилирующий H4K16 гистонов и отвечающий за большую часть этой изоформы гистонов в клетках человека, может включать одну из трех разных версий дрозофил иного гомолога MSL3, кодируемого двумя разными генами (Smith et al., 2005). У Drosophila MSL1 и MSL2, как оказалось, опосредуют связывание комплекса MSL с хроматином (Kelley et al., 1995; Copps et al., 1998; Gu et al., 1998). Ни один из этих белков не содержит какой-либо поддающийся идентификации домен, связывающийся с ДНК, и «нацеливание» на хроматин, как оказалось, требует их ассоциации. MSL1 взаимодействует с доменом «RING finger» VSL2 через аминотерминальный домен типа coiled-coil (Copps et al., 1998; Scott et al., 2000) и с MSL3 и MOF через соседние консервативные карбокситерминальные домены (Morales et al., 2004). Ассоциация MSL2 с Х-хромосомой оказывается замечательно стабильной (Straub et al., 2005с). О гомологах MSL1 и MSL2 у человека сообщил Мартин (Martin, 2003). Поскольку у Drosophila MSL1 и MSL2 отвечают за ассоциацию комплекса MSL с Х-хромосомой, есть смысл пофантазировать, что hMSLl и hMSL2 могут играть роль в «нацеливании» комплекса MSL человека на сайты его действия. Вполне вероятно, что кроме специфичных для самца факторов некоторые общие факторы, участвующие в организации хроматина и транскрипции у обоих полов, участвуют и в компенсации дозы JIL-1, тандемная киназа, обнаруживается на всех хромосомах и у самцов, и у самок, но ее концентрация выше на Х-хромосоме самцов. Эта повышенная концентрация зависит от комплекса MSL. JIL-1 опосредует фосфорилирование гистона H3 и поддерживает открытую структуру хроматина в транскрипционно активных районах генома (Jin et al., 1999; Wang et al., 2001); тем не менее, еще предстоит определить, играет ли он специфическую или общую роль в компенсации дозы. Недавно было обнаружено, что ядерные белки, в том числе нуклеопорины и субъединицы экзосомного комплекса иммунопреципитируются совместно с некоторыми MSL (Mendjou et al, 2006). Роль, которую эти белки могут играть в компенсации дозы, не определена. Активность этого комплекса, должно быть, развилась для контроля предсуществовавших групп генов, каждая с их собственными специфическими регуляторными сигналами и внутренне присущими уровнями экспрессии. В пользу того, что комплекс MSL может «нацеливаться» на активные гены, говорит следующее наблюдение: связывание эктопического MSL появляется в регулируемых трансгенах, вставленных в X, только после индукции экспрессии (рис. 16.4) (Sass et al., 2003). На каком этапе общая транскрипция могла бы увеличиваться (be up-regulated) до двукратного уровня? У самцов Drosophila H4K16ас не ограничен промоторным участком компенсированных генов, сцепленных с X; скорее, он обнаруживается по всей длине сцепленных с X транскрипционных единиц, на которые «нацелен» комплекс MSL, с относительно скромными уровнями ацетилирования в промоторных участках и высокими уровнями в средних участках и (или) 3’-концах (Smith et al., 2001). Такое распределение ацетилирования заставляет предполагать, что комплекс MSL функционирует, чтобы увеличить экспрессию сцепленных с X генов, путем облегчения транскрипционной элонгации и, возможно, рециклирования РНК-полимеразы, а не непосредственного увеличения доступности промотора.
 Рис. 16.4. Комплекс MSL «нацеливается» на активированные гены
Конструкт, содержащий промотор под контролем trans-активатора GAL4 был вставлен в сайт, в норме лишенный комплекса MSL в хромосомах личиночной слюнной железы (правая часть рисунка). Когда ген, экспрессирующий GAL4, вводится в геном (левая часть рисунка), trans-активатор связывается с конструктом (красный цвет) и рекрутирует комплекс MSL (зеленый цвет) (перепечатано, с любезного разрешения, из: Sass et al., 2003 [©National Academy of Sciences]
Рис. 16.4. Комплекс MSL «нацеливается» на активированные гены
Конструкт, содержащий промотор под контролем trans-активатора GAL4 был вставлен в сайт, в норме лишенный комплекса MSL в хромосомах личиночной слюнной железы (правая часть рисунка). Когда ген, экспрессирующий GAL4, вводится в геном (левая часть рисунка), trans-активатор связывается с конструктом (красный цвет) и рекрутирует комплекс MSL (зеленый цвет) (перепечатано, с любезного разрешения, из: Sass et al., 2003 [©National Academy of Sciences]
Для объяснения функции комплекса MSL была предложена альтернативная гипотеза (Birchler et al., 2003). Эта гипотеза основывается на представлении, что у самок активность всех хромосом устанавливается, наряду с другими факторами, однородным распределением MOF. У самцов, в силу отсутствия одной Х-хромосомы, для аутосом и для единственной Х-хромосомы доступна более высокая концентрация MOF и неизвестных факторов, что приводит к более высоким уровням их активности; комплекс MSL образуется и рекрутируется к Х-хромосоме для того, чтобы изолировать факторы гипертранскрипции, в том числе MOF, от аутосом. В этой модели главная роль комплекса MSL заключается в том, чтобы даун-регулировать аутосомные гены, а не в том, чтобы ап-регулировать гены, сцепленные с X. Однако этой гипотезе противоречат два независимых исследования; в них показано, что утрата «нацеливания» комплекса MSL клетках культуры ткани самца уменьшали транскрипцию генов на Х-хромосоме, в то время как уровень экспрессии аутосомных генов не изменялся (Hamada et al., 2005; Straub et al., 2005b). Аналогичные результаты были недавно опубликованы относительно экспрессии сцепленного с X гена в мужской зародышевой линии (Gupta et al., 2006). Сборка хроматина недавно была подразделена на связанную с репликацией и не зависимую от репликации откладку [deposition] нуклеосом. Последняя происходит в транскрипционно активных районах хроматина и включает замещение гистона H3 вариантом H3.З (глава 13). С этим наблюдением согласуется тот факт, что скорость включения гистона H3.З в Х-хромосому в клетках самца повышена по отношению к аутосомам (Mito et al., 2005).
3. Регулирование компенсации дозы начинается с измерения отношения Х:аутосомы
Каждый эмбрион должен сосчитать свои Х-хромосомы, чтобы принять критическое решение, выполнять ли компенсацию дозы или нет. Неправильное решение, например, неспособность ап-регулировать единственную Х-хромосому самца или аберрантная ап-регуляция обеих Х-хромосом самки, приводит к летальности. У Drosophila процесс счета Х-хромосом скоординирован с решением о детерминации пола (обзор см. Cline and Meyer, 1996). Фенотипический пол определяется числом Х-хромосом на ядро, так что эмбрионы XX являются самками, а эмбрионы XY — самцами. Y-хромосома необходима для фертильности, но, в отличие от млекопитающих, она не играет никакой роли в контроле фенотипического пола. Формально и пол, и компенсация дозы контролируются отношением Х: аутосомы, поскольку механизм счета Х-хромосом чувствителен к числу наборов аутосом. Это становится очевидным на триплоидах 2Х: ЗА, которые характеризуются отношением Х: А, промежуточным между самцами XY2A и самками XX: 2А. Триплоиды 2Х: ЗА дифференцируются как интерсексы со смесью мужских и женских клеток. Отношение Х: А контролирует как детерминацию пола, так и компенсацию дозы, регулируя критический ген бинарного переключателя, Sex lethal (Sxl). Sxl кодирует специфичный для самок белок, связывающийся с РНК, который регулирует сплайсинг и трансляцию ключевых иРНК в путях детерминации пола и компенсации дозы, соответственно (рис. 16.5). Sex lethal кодируется Х-хромосомой и позитивно регулируется транскрипционными факторами, кодируемыми X, так что эмбрионы с двумя Х-хромосомами способны инициировать экспрессию Sxl с раннего, регулируемого промотора, Ре, тогда как эмбрионы с одной Х-хромосомой на ядро не могут экспрессировать Sxl с Ре. Это первоначальное временное различие в активации Sxl у ранних эмбрионов стабилизируется авторегуляторной петлей, в которой белок SXL позитивно регулирует сплайсинг своей собственной иРНК с поддерживающего промотора [maintenance promoter], который экспрессируется конститутивно. Sxl инициирует дифференцировку по женскому типу, регулируя сплайсинг гена transformer (tra) пол-специфичным образом. В свою очередь продукт этого гена (вместе с продуктом еще одного гена, transformed (tra2), представленного у обоих полов) направляет сплайсинг первичного транскрипта гена doublesex (dsx) на выработку регуляторного белка, который репрессирует специфичные для самцов гены-реализаторы, достигая таким образом женской половой дифференцировки. У мужских эмбрионов альтернативный способ сплайсинга транскриптов dsx происходит «по умолчанию» и ведет к выработке продукта, который репрессирует специфичные для самок гены-реализаторы, результатом чего является мужская половая дифференцировка. Ключевой мишенью SXL в пути компенсации дозы является иРНК msl2 (Bashaw and Baker, 1997; Kelley et al., 1997). Связывающие SXL сайты локализованы и в 5’-, и в 3’-UTRs иРНК msl2. SXL в норме присутствует только у самок, у которых он репрессирует трансляцию иРНК msl2 путем ассоциации с ее UTRs (см. рис. 16.5). Если у самок SXL отсутствует, аберрантно включается [is turned on] компенсация дозы, и эти самки погибают. Наоборот, если SXL эктопически экспрессируется у самцов, компенсация дозы выключается, и самцы погибают. Эктопическая экспрессия MSL2 у самок достаточна для того, чтобы собрать комплексы MSL на обеих Х-хромосомах самки, показывая тем самым, что все другие компоненты MSL либо включены, либо стабилизированы экспрессией MSL2. Например, MSL1 и MSL2 в норме экспрессируются у самок, но нестабильны в отсутствие белка MSL2. MLE и MOF стабильны у самок, но не обнаруживают никакого специфического сродства к Х-хромосоме в отсутствие MSL2. Суммируя все сказанное, можно сказать, что компенсация дозы должна реагировать на число Х-хромосом в ядре, и эти хромосомы подсчитываются на ранних стадиях эмбрионального развития. Самцы экспрессируют белок MSL2 (и, таким образом, комплекс MSL) «по умолчанию», тогда как самки репрессируют трансляцию MSL2, предотвращая несоответствующую компенсацию дозы, когда присутствуют две Х-хромосомы. Рис. 16.5. Схема контроля детерминации пола и компенсации дозы
Если отношение Х/А равно I, регуляторный каскад ведет к женскому половому развитию. У самок присутствие продукта гена Sxl предотвращает трансляцию информации msl2 и сборку комплекса MSL. Если же отношение Х/А равно лишь 0,5, отсутствие каскада приводит «по умолчанию» к мужскому половому развитию и к формированию комплекса MSL
Рис. 16.5. Схема контроля детерминации пола и компенсации дозы
Если отношение Х/А равно I, регуляторный каскад ведет к женскому половому развитию. У самок присутствие продукта гена Sxl предотвращает трансляцию информации msl2 и сборку комплекса MSL. Если же отношение Х/А равно лишь 0,5, отсутствие каскада приводит «по умолчанию» к мужскому половому развитию и к формированию комплекса MSL
4. Некодирующие РНК roX облегчают сборку и «нацеливание» комплекса MSL на Х-хромосому
Одним из самых интригующих и таинственных аспектов компенсации дозы и у млекопитающих, и у Drosophila является роль некодирующих РНК в «нацеливании» компенсации на правильную хромосому (обзор см.: Gilfillan et al., 2004; Kelley, 2004; Straub et al., 2005a; см. также главу 17). У Drosophila две некодирующие РНК, называемые «RNA on X» (roX), не похожи друг на друга по размерам и последовательности и, тем не менее, функционируют, дублируя друг друга и «нацеливая» комплекс MSL на Х-хромосому самца (Meller and Rattner, 2002). Традиционный скрининг мутантов обычно не выявляет существование генов, кодирующих продукты с дублирующими функциями, такие как РНК roX. Скорее, РНК roX были открыты интуитивно как специфичные для самцов РНК в мозге взрослых особей (Amrein and Axel, 1997; Meller et al., 1997). При более близком рассмотрении у обеих РНК обнаруживается отсутствие существенных открытых рамок считывания и ко-локализация с комплексом MSL по длине Х-хромосомы. Функция РНК roX оставалась неизвестной, пока не были выделены мутанты и по roX1, и по roX2. Двойные мутанты-самцы погибали, демонстрируя совершенно неправильную локализацию комплексов MSL, тогда как одиночные мутанты-самцы не обладают известным фенотипом (Meller and Rattner, 2002). Это удивительно в свете того факта, что эти две РНК roX очень различны по величине (3.7 т. о. vs. 0.5–1.4 т. о.) и имеют мало сходства по нуклеотидным последовательностям Сверхэкспрессия белков MSL может частично преодолеть отсутствие РНК roX, что позволяет предположить, что эти белки обладают всеми существенными функциями компенсации дозы, но нуждаются в этих РНК для облегчения сборки или локализации (Oh et al., 2003). РНК roX были выделены после совместной иммунопреципитации белков MSL, демонстрируя тем самым физическую ассоциацию этих РНК с данным комплексом (Meller et al., 2000; Smith et al., 2000). Неизвестно, сосуществуют ли РНК roX или же образуют два отдельных типа MSL. Серия делеций roX1 показала, что нет ни одного сегмента длиной 300 нуклеотидов, который был бы абсолютно существенным для функции, что заставляет предполагать внутреннюю избыточность (Stickenholz et al., 2003). HYR roX демонстрируют удивительный уровень гибкости; это позволяет думать, что они, скорее, могут декорировать поверхность комплекса MSL, чем образуют в нем какую-то высокоинвариантную структуру Частичная очистка комплекса позволяет предполагать наличие плотного кора, состоящего из белков MSL1, MSL2, MSL3 и MOF, причем РНК roX и геликаза MLE сохраняются лишь при очень низких концентрациях солей (Smith et al., 2000) Этот минимальный белковый коровый комплекс, лишенный РНК roX, все еще может in vitro специфически ацетилировать в нуклеосомах гистон Н4 по лизину 16 (Morales et al., 2004), что согласуется с идеей, что РНК roX участвуют в сборке или «нацеливании» компенсации дозы, а не играют прямую роль в регуляции генов. Как комплекс MSL связывается с Х-хромосомой и что он распознает? В отсутствие обеих РНК roX или же либо MLE, MSL3, либо MOF частичные комплексы MSL связываются с подгруппой из 35—70 сайтов (рис. 16.6). Эти «высокоаффинные» сайты сравнили у мутантов mle, msl3 и mof и нашли, что на цитологическом уровне они в большой мере одинаковы, но их молекулярная идентичность пока еще неизвестна. Ключевым дефектом у мутантов mle может быть их неспособность инкорпорировать РНК roX в частичные комплексы, поскольку эти РНК ко-локализуются вместе с частичными комплексами в отсутствие MSL3 или MOF, но не в отсутствие MLE (Meller et al., 2000). В отсутствие либо MSL1, либо MSL2 ни один из остальных белков MSL или РНК roX не сохраняет способность распознавать Х-хромосому, что приводит к предположению, что MSL1 и MSL2 совместно обеспечивают по крайней мере первоначальную специфичность «нацеливания» на X. Тем не менее, ни один из этих белков не несет известный ДНК-связывающий мотив, и связывание с ДНК in vitro не было продемонстрировано. Рис. 16.6. «Высокоаффинные» сайты
Препараты хромосом слюнных желез из личинок, несущих аллель типа «утраты функции» гена msl3 (а, б), или из контрольных личинок дикого типа (в. г). На а и г показаны изображения, полученные с фазовым контрастом, тогда как на б и в показаны те же хромосомы с иммуноокрашиванием на присутствие комплекса. На б комплекс (зеленый цвет) обнаруживается в меньшем числе сайтов, чем на в (перепечатано, с любезного разрешения, из: Demakova et al., 2003 [©Springer]
Рис. 16.6. «Высокоаффинные» сайты
Препараты хромосом слюнных желез из личинок, несущих аллель типа «утраты функции» гена msl3 (а, б), или из контрольных личинок дикого типа (в. г). На а и г показаны изображения, полученные с фазовым контрастом, тогда как на б и в показаны те же хромосомы с иммуноокрашиванием на присутствие комплекса. На б комплекс (зеленый цвет) обнаруживается в меньшем числе сайтов, чем на в (перепечатано, с любезного разрешения, из: Demakova et al., 2003 [©Springer]
Что же могло бы быть сигналом специфичности на Х-хромосоме, что привлекало бы этот комплекс? Можно представить себе две очень общие модели регулирования целой хромосомы. Одиночный сайт или ограниченное число сайтов могли бы контролировать хромосому в cis-конфигурации, как это имеет место в случае Х-инактивации у млекопитающих (глава 17). Этот механизм требует либо компартментализации комплекса в специфическом месте ядра, либо регулирования на очень больших расстояниях посредством распространения факторов из центрального района на остальные части хромосомы. В соответствии с другим крайним вариантом, хромосома могла бы иметь уникальные идентифицирующие последовательности, разбросанные по всей ее длине. В этом случае любой сегмент хромосомы мог бы регулироваться автономно. Между этими двумя моделями находится целый спектр возможностей, включая комбинацию центральных контрольных районов с диспергированными последовательностями, которые облегчают регуляцию на больших расстояниях. РНК roX в норме кодируются Х-хромосомой: ген roX1 находится возле ее конца, а ген roX2 — около середины эухроматической части Х-хромосомы. Подобно гену Xist у млекопитающих гены roX могут находиться на Х-хромосоме для того, чтобы «нацеливать» сборку комплекса MSL на эту хромосому. Когда гены roX перемещаются на аутосомы как трансгены, они энергично привлекают белки MSL к новым сайтам, в которые произошла вставка (рис. 16.7), где этот комплекс, по-видимому, распространяется в cis-конфигурации на разные расстояния во фланкирующие последовательности (Kelley et al., 1999; Kageyama et al., 2001). В специфических генетических условиях, например когда на Х-хромосоме нет конкурирующих эндогенных генов roX, неизменно наблюдается экстенсивное распространение с аутосомных трансгенов roX (рис. 16.7) (Park et al., 2002). Это экстенсивное распространение усиливается сверхэкспрессией MSL1 и MSL2, ключевых лимитирующих белков MSL, и уменьшается сверхэкспрессией РНК roX с конкурирующих трансгенов, позволяя предполагать, что успешная ко-транскрипционная сборка комплексов MSI может управлять локальным распространением (Oh et al., 2003). Эффективная сборка функциональных комплексов MSL в ядре может быть первичной функцией РНК roX. Первоначальная сборка в генах roX на Х-хромосоме должна, вероятно, усиливать эффективность «нацеливания» на Х-хромосому, но очевидно не является существенной для окончательного «нацеливания», поскольку гены roX могут функционировать в trans-конфигурации (Meller and Rattner, 2002)
 Рис. 16.7. Распространение комплекса MSL от аутосомного трансгена пропорционально ослаблению функции эндогенных, сцепленных с X, генов roХb
Максимальное аутосомное распространение достигается тогда, когда трансген является единственным источником РНК гоХ в клетке, (а) Хромосомы от самца с X дикого типа; присутствие аутосомного трансгена показывает узкая полоска MSL (красный цвет), (б) Самец с одним только активным сцепленным с X геном roХ. Комплекс MSL распространяется несколько больше, чем у дикого типа, (в, г) Экстенсивное распространение у самцов, несущих два разных трансгена и Х-хромосому с делецией обоих генов гоХ (перепечатано, с любезного разрешения, из: Park et al., 2002 [©AAAS])
Рис. 16.7. Распространение комплекса MSL от аутосомного трансгена пропорционально ослаблению функции эндогенных, сцепленных с X, генов roХb
Максимальное аутосомное распространение достигается тогда, когда трансген является единственным источником РНК гоХ в клетке, (а) Хромосомы от самца с X дикого типа; присутствие аутосомного трансгена показывает узкая полоска MSL (красный цвет), (б) Самец с одним только активным сцепленным с X геном roХ. Комплекс MSL распространяется несколько больше, чем у дикого типа, (в, г) Экстенсивное распространение у самцов, несущих два разных трансгена и Х-хромосому с делецией обоих генов гоХ (перепечатано, с любезного разрешения, из: Park et al., 2002 [©AAAS])
Помимо высокоаффинных сайтов, упоминавшихся выше, очевидно, что этот комплекс обнаруживает разные степени сродства к большому числу дополнительных сайтов вдоль всей Х-хромосомы (Demakova et al., 2003). В стабильных транслокационных штаммах распространение комплексов MSL с Х-хромосомы в смежные аутосомные последовательности не является очевидным (Fagegaltier and Baker, 2004). Следовательно, даже если распространение комплексов MSL является главным механизмом покрытия [covering] Х-хромосомы, весьма вероятно, что имеется некая дополнительная характеристика Х-хромосомы, являющаяся причиной того, что комплекс MSL очень благоприятствует связыванию с X, а не с аутосомами. Действительно, в результате исследования транслокаций Х: А и ограниченного набора полученных из X трансгенов оказывается, что большинство сегментов Х-хромосомы длиной — 30 т. о. обладают способностью привлекать комплекс MSL; более мелкие сегменты дают менее постоянные результаты (Oh et al., 2004). Каким образом эти разнообразные наблюдения можно согласовать с моделью «нацеливания» комплекса MSL на Х-хромосому? Модель узнавания Х-хромосомы, лучше всего согласующаяся с существующими данными, изображена на рис. 16.8. В этой модели комплексы MSL собираются в сайтах транскрипции РНК roX и впоследствии получают доступ к фланкирующим и удаленным сайтам на Х-хромосоме на основе их относительного сродства к комплексу MSL. Происходит ли некоторая или даже основная часть «нацеливания» в норме исключительно в trans-конфигурации или же путем некоторого варианта локального распространения в cis-конфигурации — неизвестно. Однако ясно, что комплекс MSL явно предпочитает связываться с сегментами Х-хромосомы, а не с аутосомами. Хотя на сегодняшний день не известно, чтобы какая-то простая нуклеотидная последовательность однозначно определяла Х-хромосому, возможно, будет обнаружена некая вырожденная последовательность, когда целые геномы многочисленных видов Drosophila станут доступными для сравнения.
5. Балансировка между антагонистическими активностями ремоделинга хроматина
Политенная Х-хромосома самцов обнаруживает особую чувствительность к изменениям в дозе или активности нескольких регуляторов хроматина, которые, как полагают, являются общими, хромосома-неспецифичными факторами. Например, выяснить функциональное взаимодействие между комплексами, несущими ISWI, и комплексом MSL позволило наблюдение, что мутации гена Iswi типа «утраты функции» приводят у самцов к глобальному структурному эффекту в отношении Х-хромосомы: на препаратах слюнных желез эта хромосома выглядит чрезвычайно укороченной и толстой (рис. 16.9), причем комплекс MSL и H4K16ас располагаются внешне непрерывно, а не в виде тонких бэндов (Deuring et al., 2000). Молекулярная основа этого цитологического фенотипа неизвестна, но он совместим с моделью, в которой организация хроматина в отдельные домены была утрачена. Нормальные политенные хромосомы демонстрируют характерный паттерн относительно конденсированных дисков и деконденсированных междисковых участков и пуфов, и эта организация оказывается полностью отсутствующей в Х-хромосоме мутантных самцов Iswi. Короткая длина этой X может быть обусловлена утратой структуры и конденсацией, результатом чего является аномальное увеличение толщины за счет длины. ISWI (imitation switch protein) — это АТФаза, обнаруженная у Drosophila в трех комплексах ремоделинга хроматина: NURF (nucleosome remodeling factor), ACF (ATP-dependent chromatin assembly and remodeling factor) и CHRAC (chromatin accessibility complex) (Smith and Peterson, 2005). Исследования in vitro показали, что ACF и CHRAC устанавливают регулярно упорядоченные цепочки нуклеосом, тогда как NURF нарушает периодичность нуклеосом. In vivo ACF и CHRAC ведут себя как факторы сборки хроматина, способствующие формированию хроматина в целом и репрессивных состояний хроматина в частности. Напротив, NURF изменяет положение нуклеосом на промоторе hsp 70, реконструированном in vitro, и его ремоделирующая активность существенно усиливается, если нуклеосомы сначала гиперацетилируются. Несмотря на очевидную биохимическую активность NURF в том отношении, что он делает хроматин более доступным, мутанты по nurf301 также обнаруживают аномально деконденсированную Х-хромосому у самцов, наблюдаемую у мутантов Iswi (Badenhorst et al., 2002). Рис. 16.8. Модель «нацеливания» комплекса MSL на Х-хромосому
Комплекс собирается в сайте транскрипции генов roХ и получает доступ к различным сайтам по всей Х-хромосоме, сродство к которым у него варьирует от очень высокого до относительно низкого. Обратите внимание на то, что эта модель приложима к аутосомному распространению комплекса от эктопического гена roХ
Рис. 16.8. Модель «нацеливания» комплекса MSL на Х-хромосому
Комплекс собирается в сайте транскрипции генов roХ и получает доступ к различным сайтам по всей Х-хромосоме, сродство к которым у него варьирует от очень высокого до относительно низкого. Обратите внимание на то, что эта модель приложима к аутосомному распространению комплекса от эктопического гена roХ
Дефект Х-хромосомы, наблюдаемый в слюнных железах мутантов Iswi и nurf. можно видеть у трансгенных самок, где было индуцировано присутствие комплекса MSL; этот дефект не возникает в присутствии неактивного комплекса MSL у самцов, т. е. в отсутствие H4K16ас. Более того, исследования методом конкурирующего связывания in vitro [in vitro competition studies] с очищенным ISWI позволяют предполагать, что его способность взаимодействовать с изолированными нуклеосомами снижается ацетилированием «хвоста» гистона Н4 по лизину 16 (Corona et al., 2002). Согласно выдвинутому этими авторами спекулятивному предположению, активность MOF изменяет экспрессию сцепленных с X генов, уменьшая способности ISWI стимулировать формирование регулярных нуклеосомных последовательностей (Corona et al., 2002).
 Рис. 16.9. Гипоморфные мутации гена Iswi затрагивают преимущественно структурную организацию Х-хромосомы у самцов
У самцов дикого типа Х-хромосома по своему общему виду сходна с плечом аутосомы (перепечатано, с любезного разрешения, из. Deuring et al., 2000 [©Elsevier])
Рис. 16.9. Гипоморфные мутации гена Iswi затрагивают преимущественно структурную организацию Х-хромосомы у самцов
У самцов дикого типа Х-хромосома по своему общему виду сходна с плечом аутосомы (перепечатано, с любезного разрешения, из. Deuring et al., 2000 [©Elsevier])
Совершенно иной хромосомный фенотип наблюдается тогда, когда имеет место сверхэкспрессия белка гетерохроматина, SU(VAR)3—7 (Delattre et al., 2004). Белок SU(VAR)3—7 является структурным компонентом гетерохроматина, который ко-локализуется с НР1 (heterochromatin protein 1) и с метилтрансферазой лизина гистонов (НКМТ) SU(VAR)3-9 (глава 5). Хотя сверхэкспрессия Su(var)3—7 вызывает морфологические эффекты в хромосомах и самцов, и самок, Х-хромосома самцов затрагивается в наибольшей степени, поскольку она приобретает очень маленькие размеры и высоко-компактизированный вид. Странно, что политенная Х-хромосома самцов более чувствительна, чем другие хромосомы, к изменениям в балансе компонентов хроматина с положительными либо отрицательными эффектами. Важным механизмом поддержания наследуемых состояний хроматина может быть конкуренция за повторную сборку [reassembly] факторов после синтеза ДНК. Возможно, гиперактивная политенная Х-хромосома самцов, в силу ее открытого в норме состояния, действует как ведущий индикатор, когда изменяется естественный баланс ключевых факторов, модулирующих хроматин (Lucchesi et al., 2005).
6. Перспективы
С ростом использования технологий микрочипов [microarray technologies] мы начинаем определять точный паттерн связывания комплекса MSL в масштабах всего генома и отличительные особенности генов, которые он регулирует (Alekseyenko et al., 2006; Gilfillan et al., 2006; Legube et al., 2006). Эти сведения несомненно приведут к лучшему пониманию того, каким образом этот комплекс «нацеливается» на Х-хромосому Понимание такого «нацеливания» должно, в свою очередь, помочь нам идентифицировать механизмы, с помощью которых комплекс MSL увеличивает экспрессию генов. Недавно полученные результаты показали, что кодирующие районы генов, а не регуляторные районы «вверх по течению», связываются комплексом MSL, что видно по H4K16ас на избранных генах. В этих результатах находит ключевую поддержку модель, согласно которой компенсация дозы происходит путем регулирования скорости транскрипционной элонгации и рециклирования РНК (Smith et al., 2001). Полное выяснение молекулярного механизмка, ответственного за компенсацию дозы, потребует точного определения влияния комплекса MSL на общий механизм транскрипции. Белки MSL и РНК roX, по-видимому, предназначены для компенсации дозы, поскольку ни один из этих компонентов не требуется для жизнеспособности самок. Тем не менее, возможно, что многие дополнительные факторы способствуют компенсации дозы, но являются существенными и у самцов, и у самок в силу их общих ядерных, хромосомных или транскрипционных функций (Mendjan et al., 2006). В предстоящие годы идентификация этих факторов будет иметь очень большое значение для понимания биохимических основ двукратного увеличения экспрессии сцепленных с Х-хромосомой генов, наблюдаемого у самцов Drosophila. В конечном счете, понимание компенсации дозы даст ключевую информацию относительно организации хроматина в транскрипционные домены у высших организмов и позволит глубже проникнуть в молекулярные механизмы тонкой настройки наследуемой экспрессии генов в точных пределах.Литература
Aasland R. and Stewart A.F., 1995. The chromo shadow domain, a second chromo domain in heterochromatin-binding protein 1, HP1. Nucleic Acids Res. 23: 3168–3173. Akhtar A. and Becker P.B., 2000. Activation of transcription through histone H4 acetylation by MOF, an acetyltransferase essential for dosage compensation in Drosophila. Mol. Cell 5: 367–375. Alekseyenko A.A., Larschan E., Lai W.R., Park P.J., and Kuroda M.I., 2006. High-resolution ChlP-chip analysis reveals that the Drosophila MSL complex selectively identifies active genes on the male X chromosome. Genes Dev., 20: 848–857. Amrein H. and Axel R., 1997. Genes expressed in neurons of adult male Drosophila. Cell 88: 459–469. Badenhorst P., Voas M.. Rebay I., and Wu C., 2002. Biological functions of the ISWI chromatin remodeling complex NURF. Genes Dev. 16: 3186–3198. Bashaw G.J. and Baker B.S., 1997. The regulation of the Drosophila msl-2 gene reveals a function for sex-lethal in translational control. Cell 89: 789–798. Birchler J.A., Pal-Bhadra M., and Bhadra U., 2003. Dosage dependent gene regulation and the compensation of the X chromosome in Drosophila males. Genetica 117: 179–190. Bone J.R., Lavender J.. Richman R.. Palmer M.J.. Turner B.M., and Kuroda M.I., 1994. Acetylated histone H4 on the male X chromosome is associated with dosage compensation in Drosophila. Genes Dev. 8: 96-104. Cline T.W. and Meyer B.J., 1996. Vive la difference: Males vs females in flies vs worms. Annu. Rev. Genet. 30: 637–702. Copps K., Richman R., Lyman L.M., Chang K.A., Rampersad-Ammons J., and Kuroda M.I., 1998. Complex formation by the Drosophila MSL proteins: Role of the MSL2 RING finger in protein complex assembly. EMBO J. 17: 5409–5417. Corona D.F., Clapier C.R., Becker P.B., and Tamkun J.W., 2002. Modulation of ISWI function by site-specific histone acetylation. EMBORep. 3: 242–247. Delattre M., Spierer A., Jaquet Y., and Spierer P., 2004. Increased expression of Drosophila Su(var)3-7 triggers Su(var) 3-9-dependent hete-rochromatin formation. J. Cell Sci. 117: 6239–6247. Demakova O.V., Kotlikova I.V., Gordadze PR., Alekseyenko A.A., Kuroda M.I., and Zhimulev I.F., 2003. The MSL complex levels are critical for its correct targeting to the chromosomes in Drosophila melanogaster. Chromosoma 112: 103–115. Deuring R., Fanti L., Armstrong J.A., Sarte M., Papoulas O., Prestel M., Daubresse G., Verardo M., Moseley S.L., Berloco M., et al., 2000. The ISWI chromatin-remodeling protein is required for gene expression and the maintenance of higher order chromatin structure in vivo. Mol. Cell 5: 355–365. Eisen A., Utley R.T., Nourani A., Allard S., Schmidt P., Lane W.S., Lucchesi J.C., and Cote J., 2001. The yeast NuA4 and Drosophila MSL complexes contain homologous subunits important for transcription regulation. J. Biol. Chem. 276: 3484–3491. Fagegaltier D. and Baker B.S., 2004. X chromosome sites autonomously recruit the dosage compensation complex in Drosophila males. PLoS Biol. 2: e341. Gilfillan G.D., Dahlsveen I.K., and Becker P.B., 2004. Lifting a chromosome: Dosage compensation in Drosophila melanogaster. FEBS Lett. 567: 8-14. Gilfillan G.D., StraubT., de Wit E., Greil E., Lamm R., van Steensel B., and Becker P.B., 2006. Chromosome-wide gene-specific targeting of the Drosophila dosage compensation complex. Genes Dev., 20: 858–870. Gorman M., Franke A., and Baker B.S., 1995. Molecular characterization of the male-specific lethal-3 gene and investigations of the regulation of dosage compensation in Drosophila Development 121: 463–475. Gu W., Szauter P., and Lucchesi J.C., 1998. Targeting of MOF, a putative histone acetyl transferase, to the X chromosome of Drosophila melanogaster. Dev. Genet. 22: 56–64. Hamada F.N., Park P.J., Gordadze P.R., and Kuroda M.I., 2005. Global regulation of X chromosomal genes by the MSL complex in Drosophila melanogaster. Genes Dev., 19: 2289–2294. HilfikerA., Hilfiker-Kleiner D., PannutiA., and Lucchesi J.C., 1997. mof, a putative acetyl transferase gene related to the Tlp60 and MOZ human genes and to the SAS genes of yeast, is required for dosage compensation in Drosophila. EMBO J. 16: 2054–2060. Jin Y., Wang Y, Walker D.L., Dong H., Conley C, Johansen J, and Johansen K.M., 1999. JIL-1: A novel chromosomal tandem kinase implicated in transcriptional regulation in Drosophila. Mol. Cell 4: 129–135. Kageyama Y., Mengus G., Gilfillan G., Kennedy H.G., Stucken-holz C., Kelley R.L., and Kuroda M.I., 2001. Association and spreading of the Drosophila dosage compensation complex from a discrete roX1 chromatin entry site. EMBO J., 20: 2236–2245. Kelley R.L., 2004. Path to equality strewn with roX. Dev. Biol. 269: 18–25. Kelley R.L., Wang J., Bell L., and Kuroda M.I., 1997. Sex lethal controls dosage compensation in Drosophila by a non-splicing mechanism. Nature 387: 195–199. Kelley R.L., Meller V.H., Gordadze P.R., Roman G., Davis R.L., and Kuroda M.I., 1999. Epigenetic spreading of the Drosophila dosage compensation complex from roX RNA genes into flanking chromatin. Cell 98: 513–522. Kelley R.L., Solovyeva I., Lyman L.M., Richman R., Solovyev V., and Kuroda M.I., 1995. Expression of msl-2 causes assembly of dosage compensation regulators on the X chromosomes and female lethality in Drosophila. Cell 81: 867–877. Koonin E.V., Zhou S., and Lucchesi J.C., 1995. The chromo superfamily: New members, duplication of the chromo domain and possible role in delivering transcription regulators to chromatin. Nucleic Acids Res. 23: 4229–4233. Kuroda M.I., Keman M.J., KreberR., Ganetzky B., and Baker B.S., 1991. The maleless protein associates with the X chromosome to regulate dosage compensation in Drosophila. Cell 66: 935–947. KuschT., Florens L., Macdonald W.H., Swanson S.K., Glaser R.L., Yates J.R., III, Abmayr S.M., Washburn M.R, and Workman J.L., 2004. Acetylation by Tip60 is required for selective histone variant exchange at DNA lesions. Science 306: 2084–2087. Lee C.C., Chang K.A., Kurtoda M.I., and Hurwitz J., 1997. The NTPase/helicase activities of Drosophila maleless, an essential factor in dosage compensation. EMBO J. 16: 2671–2681. Legube G., McWeeney S.K., Lercher M.J., and Akhtar A., 2006. X-chromosome-wide profiling of MSL-1 distribution and dosage compensation in Drosophila. Genes Dev., 20: 871–883. Lucchesi J.C. and Manning J.E., 1987. Gene dosage compensation in Drosophila melanogaster. Adv. Genet. 24: 371–429. Lucchesi J.C., Kelly W.G., and Panning B., 2005. Chromatin remodeling in dosage compensation. Annu. Rev. Genet. 39: 615–651. Marin I., 2003. Evolution of chromatin-remodeling complexes: Comparative genomics reveals the ancient origin of “novel” compensasome genes. J. Mol. Evol. 56: 527–539. Meller V.H. and Rattner B.P., 2002. The roXgenes encode redundant male-specific lethal transcripts required for targeting of the MSL complex. EMBO J. 21: 1084–1091. Meller V.H., Wu K.H., Roman G., Kuroda M.L., and Davis R.L., 1997. roX1 RNA paints the X chromosome of male Drosophila and is regulated by the dosage compensation system. Cell 88: 445–457. Meller V.H., Gordadze PR., Park Y., ChuX., Stuckenholz C., Kelley R.L., and Kuroda M.L., 2000. Ordered assembly of roX RNAs into MSL complexes on the dosage-compensated X chromosome in Drosophila. Curr. Biol. 10: 136–143. Mendjan S., Taipale M., Kind J., Holz H., Gebhardt P., Schelder M., Verfneulen M., Buscaino A., Duncan K., Mueller J., et al., 20(56. Nuclear pore components are involved in the transcriptional regulation of dosage compensation in Drosophila. Mol. Cell 21: 811–823. Mlito Y., Henikoff J.G., and Henikoff S., 2005. Genome-scale profiling of histone H3 3 replacement patterns. Nat. Genet. 37: 1090–1097. Morales V., Straub X, Neumann M.F., Mengus G., Akhtar A., and Becker P.B., 2004. Functional integration of the histone acetyl-transferase MOF into the dosage compensation complex. EMBO J. 23: 2258–2268. Morgan T.H., 1932. The scientific basis of evolution. Norton, New York, p. 80. Oh H., Bone J.R., and Kuroda M.I., 2004. Multiple classes of MSL binding sites target dosage compensation to the X chromosome of Drosophila. Curr. Biol. 14: 481–487. Oh H., Park Y., and Kuroda M.L, 2003. Local spreading of MSL complexes from roX genes on the Drosophda X chromosome. Genes Dev. 17: 1334–1339. Palmer M.J., MergnerVA., Richman R., Manning J.E., Kuroda M.L, and Lucchesi J. C., 1993. The male-specific lethal-one (msi-1) gene of Drosophila melanogaster encodes a novel protein that associates with the X chromosome in males. Genetics 134: 545–557. Pannuti A and Lucchesi J.C., 2000. Recycling to remodel: Evolution ofdos-age-compensation complexes. Curr. Opm. Genet. Dev. 10: 644–650. Pardo P.S., Leung J.K., Lucchesi J.C., and Pereira-Smith O.M., 2002. MRG15, a novel chromodomain protein, is present in two distinct multiprotein complexes involved in transcriptional activation. J. Biol. Chem. 277: 50860-50866. Park Y., Kelley R.L., Oh H., Kuroda M.L., and Meller V.H., 2002. Extent of chromatin spreading determined by roX RNA recruitment of MSL proteins. Science 298: 1620-1623 Sass G.L., Pannuti A., and Lucchesi J.C.. 2003. Male-specific lethal complex of Drosophila targets activated regions ofthe X chromosome for chromatin remodeling. Proc. Natl. Acad. Sci. 100: 8287–8291. Schalch T., Duda S., Sargent D.F., and Richmond T.J., 2005. X-ray structure of a tetranucleosome and its implications for the chromatin fibre. Nature 436: 138–141. Scott M.J., Pan L.L., Cleland S.B., Knox A.L., and Heinrich J., 2000. MS LI plays a central role in assembly of the MSL complex, essential for dosage compensation in Drosophila. EMBO J.. 19: 144–155. Sif S., 2004. ATP-dependent nucleosome remodeling complexes: Enzymes tailored to deal with chromatin. J. Cell Biochem. 91: 1087–1098. Smith C.L. and Peterson C.L., 2005. ATP-dependent chromatin remodeling. Curr. Top. Dev. Biol. 65: 115–148. Smith E.R., Allis C.D., and Lucchesi J.C., 2001. Linking global histone acetylation to the transcription enhancement of X-chromosomal genes in Drosophila males. J. Biol.Chem. 276: 31483-31486. Smith E.R., Cayrou G., Huang R., Lane W.S., Cote J., and Lucchesi J.C., 2005. A human protein complex homologous to the Drosophila MSL complex is responsible for the majority of histone H4 acety-lation at lysine 16. Mol. Cell. Biol. 25: 9175–9188. Smith E.R., Pannuti A., GuW., SteumagelA., Cook R.G., Allis C.D., and Lucchesi J.C., 2000. The Drosophila MSL complex acetylates histone H4 at lysine 16, a chromatin modification linked to dosage compensation. Mol. Cell. Biol., 20: 312-318 Smith E.R., Eisen A., GuW., Sattah M., Pannuti A., Zhou J., Cook R.G., Lucchesi J.C., and Allis C.D., 1998. ESA1 is a histone acetyltransferase that is essential for growth in yeast. Proc. Natl. Acad. Scl 95: 3561–3565. Straub T., Dahlsveen I.K., and Becker P.B., 2005a. Dosage compensation in flies: Mechanism, models, mystery. FEBS Lett. 579: 3258–3263. Straub T., Gilfillan C.D., Maier V.K., and Becker P.B., 2005b. The Drosophila MSL complex activates the transcription of target genes. Genes Dev., 19: 2284–2288. Straub T., Neumann M.F., Prestel M., Kremmer E., Kaether C, Haass C, and Becker P.B., 2005c. Stable chromosomal association of MSL2 defines a dosage-compensated nuclear compartment. Chromosoma 114: 352–364. Stuckenholz C, Meller V.H., and Kuroda M.L, 2003. Functional redundancy within roX1, a noncoding RNA involved in dosage compensation in Drosophila melanogaster. Genetics 164: 1003–1014. Suka N., Luo K., and Grunstein M., 2002. Sir2p and Sas2p opposingly regulate acetylation of yeast histone H4 lysinel6 and spreading of heterochromatin. Nat. Genet. 32: 378–383. Turner B.M., Birley A.J., and Lavender J., 1992. Histone H4 isoforms acetylated at specific lysine residues define individual chromosomes and chromatin domains in Drosophila polytene nuclei. Cell 69: 375–384. Wang Y., Zhang W., Jin Y., Johansen J., and Johansen K.M., 2001. The JIL-1 tandem kinase mediates histone H3 phosphorylation and is required for maintenance of chromatin structure in Drosophila. Cell 105: 433–443.Глава 17. Компенсация дозы у млекопитающих
 Neil Brockdorff1 и Bryan М. Turner2
1Х Inactivation Group (Developmental Epigenetics Group), MRC Clinical Sciences Centre, ISCM Hammersmith Campus, London W12 0NN, United Kingdom
2Chromatin and Gene Expression Group, Institute of Biomedical Research, University of Birmingham Medical School, Birmingham B15 2TT, United Kingdom
Neil Brockdorff1 и Bryan М. Turner2
1Х Inactivation Group (Developmental Epigenetics Group), MRC Clinical Sciences Centre, ISCM Hammersmith Campus, London W12 0NN, United Kingdom
2Chromatin and Gene Expression Group, Institute of Biomedical Research, University of Birmingham Medical School, Birmingham B15 2TT, United Kingdom
Общее резюме
ДНК человека упакована в 23 пары хромосом разного размера. Одна хромосома из каждой пары унаследована от наших отцов (отцовский гомолог), а другая — от наших матерей (материнский гомолог). Двадцать две пары, в совокупности называемые аутосомами и пронумерованные числами 1—22 в порядке убывающей величины, одинаковы у самцов и самок, тогда как одна пара, половые хромосомы, различается между полами. Самки обладают двумя копиями хромосомы среднего размера, обозначаемой как Х-хромосома, в то время как самцы имеют одну Х-хромосому и одну копию более мелкой, бедной генами хромосомы, обозначаемой Y. У самцов Х-хромосома всегда наследуется от матери, а Y-хромосома — от отца, тогда как у самок одна Х-хромосома — материнская (Xm), а другая — отцовская (Хр). Это хромосомное различие между полами является обычным у млекопитающих и многих других организмов и представляет собой часть биологического механизма, посредством которого определяется пол. Однако для организма это связано с радом эволюционных проблем, в том отношении, что два пола различаются по числу сцепленных с X генов, которые они имеют; самки обладают вдвое большим их количеством, чем самцы. Это может приводить к дисбалансу в количестве генных продуктов (РНК и белков), который, в свою очередь, требовал бы различий в контроле метаболизма и других клеточных процессов. Чтобы избежать этого, возникли механизмы компенсации дозы генов, уравновешивающие уровни продуктов сцепленных с X генов у обоих полов. У млекопитающих механизм компенсации дозы связан с выключением (сайленсированием) большинства генов только на одной из двух Х-хромосом, так что у самок, как и у самцов, имеется только одна активная хромосома. Это радикальное решение, обычно называемое инактивацией Х-хромосомы, впервые было предложено в 1961 году Мэри Лайон для того чтобы объяснить паттерны экспрессии сцепленных с X генов окраски меха у мышей, сходные с паттерном окраски меха у кошки «calico», изображенной в начале этой главы. С тех пор более 40 лет интенсивных исследований было посвящено попыткам разобраться в этих интригующих и сложных механизмах, осуществляющих этот процесс. Мы знаем, что инактивация X происходит на ранних этапах развития, но сложным образом. Очень рано, когда эмбрион состоит всего лишь из нескольких клеток, отцовская Х-хромосома избирательно инактивируется во всех клетках. Хр должна быть как-то маркирована, «импринтирована» для инактивации. Позднее, на стадии бластоцисты (непосредственно перед имплантацией), когда зародыш состоит из 50—100 клеток, в тех клетках, которые в дальнейшем сформируют сам эмбрион (локализованных во внутренней клеточной массе [ICM]), Хр вновь активируется, так что, говоря коротко, у самок имеются две активные Х-хромосомы. Затем либо Хр, либо Xm случайно выбирается для инактивации, и гены на ней сайленсируются. Любопытно, что в тех клетках бластоцисты, которые в дальнейшем формируют экстраэмбриональные ткани (плаценту и желточный мешок), Хр остается «молчашей». Вопрос о том, каким образом для инактивации «выбирается» одна из X в ICM, остается пока что без ответа. Х-хромосома, выбранная для инактивации, остается «молчащей» на протяжении всех последующих клеточных генераций. Это одна из наиболее стабильных форм сайленсинга генов, которая нам известна, и попытки экспериментально добиться ее реверсии неизменно оказывались безуспешными. Однако ооциты (женские зародышевые клетки) способны ревертировать этот процесс инактивации, так что они обладают двумя активными X в мейозе, иединственная Х-хромосома в зрелом, гаплоидном яйце также активна. Исследования процесса инактивации X выявили новые молекулярные механизмы сайленсинга генов. Инициацию сайленсинга вызывает повышенная экспрессия некодирующей РНК, транскрибируемой с гена, обозначенного XISTс одной только из двух женских Х-хромосом. Эта РНК покрывает Х-хромосому, содержащую ген XIST, которая включается, что выглядит как участок зеленой окраски на фотографии клеточного ядра, изображенной в начале этой главы. Этим далее инициируется сайленсинг генов по всей этой хромосоме. Сам XIST остается включенным После покрытия XIST неактивная, «молчащая» X претерпевает рад изменений. Главные белки, упаковывающие ДНК, гистоны, подвергаются химическим модификациям в функционально важных сайтах. Например, уровни ацетилирования избранных остатков лизина катастрофически падают, тогда как метилирование других лизинов увеличивается. Вслед за этими изменениями происходит метилирование избранных участков на неактивной Х-хромосоме, Xi, — процесс, часто связанный с долговременным сайленсингом генов. Все эти и другие изменения придают неактивной Х-хромосоме очень характерную структуру, которая нередко описывается как конденсированная и которая видна в клеточном ядре как отчетливая глыбка плотной ДНК, известная как тельце Бара. На протяжении последних лет исследования инактивации Х-хромосомы позволили проникнуть в фундаментальные эпигенетические механизмы сайленсинга генов и в то, каким образом паттерны экспрессии генов регулируются в ходе развития. Можно с уверенностью предсказать, что так будет и дальше.1. Введение
1.1. Преимущества полового воспроизведения
Половое воспроизведение обычно у эукариот. Даже растения, которые вполне могут размножаться отводками или побегами, часто обладают альтернативным половым способом воспроизведения. Как нередко бывает, эволюция дает возможное объяснение этого, показывая, что половое воспроизведение дает огромное увеличение генетической изменчивости, с которой может работать естественный отбор, создавая эволюционные изменения. Перетасовка аллелей, происходящая в каждом половом поколении, могла бы таким образом создавать популяцию, способную справляться со сдвигами во внешней среде более эффективно, чем относительно гомогенная популяция, возникающая в результате бесполых способов воспроизедения. Однако у высших эукариот пол усложнен, поскольку нуждается в развитии, ведущем к образованию мужских и женских половых органов, а также физиологического и биохимического аппарата, необходимого для мейоза, созревания зародышевых клеток, привлечения партнеров и спаривания (дальнейшее обсуждение этих тем см.: Marshall Graves and Shetty, 2001 и помещенные там ссылки). Критический момент и определенная мера эволюционного успеха заключаются в том, что изменчивые популяции способны лучше избегать конечной катастрофы, связанной с вымиранием.1.2. Способы определения пола
Генетические механизмы определения пола варьируют в значительной степени от одного организма к другому. Простейшая система включает один локус, который гомозиготен у одного пола (гомогаметныи пол) и гетерозиготен у другого (гетерогаметный пол) (рис. 17.1). Эта простая система развивалась различными путями, достигнув разной степени сложности у разных организмов. У некоторых из них возникли механизмы, подавляющие мейотическую рекомбинацию (кроссинговер) определяющих пол аллелей у гетерогаметного пола (рис. 17.1) — шаг, помогающий предотвратить возникновение смесей аллелей, ведущих к интерсексуальным состояниям. Во многих случаях неспособность к рекомбинации распространилась на часть или даже на всю хромосому, что сопровождалось утратой генетической информации. Эволюционное давление, обусловившее эту дегенерацию хромосомы, все еще остается непонятным, но конечный результат у многих видов заключается в том, что два пола обнаруживают различия не просто по аллелям в одном или нескольких локусов, но по целым хромосомам. Это изображено в виде простой диаграммы на рис. 17.1. У большинства видов, включая наш собственный, такую дегенерировавшую хромосому несут самцы, хотя бывают и исключения. Рис. 17.1. Эволюция Y-хромосомы
На ранних этапах эволюции два пола могли различаться лишь по одному, аутосомному локусу, когда один пол (обозначаемый как протомужской) гетерозиготен по этому локусу, а другой пол (протоженский) гомозиготен. «Аллель, детерминирующая мужской пол», показана желтым цветом. Если для спаривания необходима одна особь каждого пола, тогда особи, гомозиготные по аллели, детерминирующей мужской пол, не могут возникать. На этой ранней стадии физиологические различия между полами будут еще слабыми, сравнимыми с различиями между двумя типами спаривания у дрожжей. Для предотвращения образования интерсексуальных состояний кроссинговер в локусе, определяющем мужской пол, и вокруг него будет подавлен (эти подавленные области показаны темным цветом) В пределах этого района будут накапливаться мутации, потому что подавление кроссинговера уменьшит их способность распространяться по популяции и, отсюда, давление отбора против них. Район дегенерации, в котором кроссинговер подавлен, будет постепенно расширяться («храповик Меллера»), пока эта хромосома не утратит большую часть своих активных, функциональных генов. Должен остаться небольшой, активный участок, гомологичный Х-хромосоме, для того, чтобы разрешить спаривание и кроссинговер при мейозе. Это псевдоаутосомный район (PAR, pseudoautosomal region). Аутосома, первоначально гомологичная будущей Y («А» на диаграмме), будет сама эволюировать в основном путем транслокаций с других аутосом. в конечном счете формируя отличающуюся Х-хромосому. Эта Х-хромосома, подобно другим хромосомам, представляет собой мозаику из фрагментов ДНК, помещенных на место в разные периоды на протяжении эволюции; некоторые из них являются древними, а некоторые относительно недавние. Это иллюстрируется по-разному расположенными пэтчами на прото-Х- и Х-хромосомах На Х-хромосоме человека более недавние участки обогащены генами, избежавшими инактивации X
Рис. 17.1. Эволюция Y-хромосомы
На ранних этапах эволюции два пола могли различаться лишь по одному, аутосомному локусу, когда один пол (обозначаемый как протомужской) гетерозиготен по этому локусу, а другой пол (протоженский) гомозиготен. «Аллель, детерминирующая мужской пол», показана желтым цветом. Если для спаривания необходима одна особь каждого пола, тогда особи, гомозиготные по аллели, детерминирующей мужской пол, не могут возникать. На этой ранней стадии физиологические различия между полами будут еще слабыми, сравнимыми с различиями между двумя типами спаривания у дрожжей. Для предотвращения образования интерсексуальных состояний кроссинговер в локусе, определяющем мужской пол, и вокруг него будет подавлен (эти подавленные области показаны темным цветом) В пределах этого района будут накапливаться мутации, потому что подавление кроссинговера уменьшит их способность распространяться по популяции и, отсюда, давление отбора против них. Район дегенерации, в котором кроссинговер подавлен, будет постепенно расширяться («храповик Меллера»), пока эта хромосома не утратит большую часть своих активных, функциональных генов. Должен остаться небольшой, активный участок, гомологичный Х-хромосоме, для того, чтобы разрешить спаривание и кроссинговер при мейозе. Это псевдоаутосомный район (PAR, pseudoautosomal region). Аутосома, первоначально гомологичная будущей Y («А» на диаграмме), будет сама эволюировать в основном путем транслокаций с других аутосом. в конечном счете формируя отличающуюся Х-хромосому. Эта Х-хромосома, подобно другим хромосомам, представляет собой мозаику из фрагментов ДНК, помещенных на место в разные периоды на протяжении эволюции; некоторые из них являются древними, а некоторые относительно недавние. Это иллюстрируется по-разному расположенными пэтчами на прото-Х- и Х-хромосомах На Х-хромосоме человека более недавние участки обогащены генами, избежавшими инактивации X
Половая дифференцировка обычно запускается включением или выключением одного или небольшого числа генов в ходе развития. Продукты этих генов инициируют каскад регуляторных событий, опосредующих дальнейшее продвижение по тому или иному пути детерминации пола (см. детали для Caenorhabditis elegans в главе 15 и для Drosophila в главе 16). У человека существует белковый продукт гена SRYна Y-хромосоме, который запускает ранний зародыш по мужскому пути полового развития (обзор см.: McElrevey et al., 1995). Механизм такого типа не нуждается в крупных хромосомных различиях для того чтобы успешно работать; почему же тогда такие различия возникали так часто? Возможно, что они произошли как побочный продукт супрессии кроссинговера, необходимой для предотвращения интерсексуальных состояний (рис. 17.1). Математический анализ факторов, влияющих на распротстранение аллелей в популяциях, показывает, что супрессия кроссинговера неизбежно приведет к постепенному накоплению вредных мутаций (возможно даже, мутаций, вызывающих дальнейшее подавление кроссинговера). Это приведет к прогрессивной дегенерации одной из двух исходно гомологичных хромосом (рис 17.1). Этот процесс был назван «"храповиком" Меллера» в память генетика, впервые предложившего этот механизм. Для этого случая не существует отбора, он просто происходит как следствие начального принятия стратегии двух полов для воспроизведения (обсуждение см.: Charlesworth, 1996 и помещенные там ссылки). Какая бы эволюционная тенденция ни стояла за дегенерацией хромосомы, тот факт, что она произошла (и, возможно, еще продолжается), требует коэволюции механизмов, чтобы справиться с крупными хромосомными различиями между членами одного и того же вида. Для этого предназначены механизмы дозовой компенсации.
1.3 Хромосомные способы детерминации пола создают необходимость в компенсации дозы
И у млекопитающих, и у Drosophila самцы имеют одну копию каждой половой хромосомы, X и Y, тогда как самки обладают двумя копиями X. В обеих группах организмов Y бедна генами и в основном гетерохроматична. Она содержит всего несколько генов, необходимых для мужского развития или фертильности. Напротив, X является крупной, богатой генами хромосомой. Двукратная разница в числе копий, если ее не скорректировать, привела бы к двукратному различию во внутриклеточных концентрациях продуктов нескольких тысяч генов между полами. Поэтому не удивительно, что эволюция не может терпеть такое крупное различие между членами одного и того же вида. Вместо этого она выработала способы устранения этого различия с помощью механизмов компенсации дозы. Говоря в общих словах, существуют только три способа уравнивания количеств транскриптов генов, сцепленных с Х-хромосомой, между гетерогаметным и гомогаметным полами. Это (1) выключение генов на одной из двух женских Х-хромосом, (2) удвоение скорости транскрипции генов на единственной мужской Х-хромосоме и (3) снижение наполовину скорости транскрипции на каждой из двух женских Х-хромосом. Конечный результат как (2), так и (3) один и тот же в том отношении, что гены на единственной мужской Х-хромосоме транскрибируются вдвое быстрее, чем эквивалентные гены на двух женских Х-хромосомах, но пути для достижения этого состояния фундаментально различны. Были найдены примеры всех трех механизмов. Млекопитающие используют первый способ, Drosophila — второй (глава 16), а червь-нематода С. elegans — третий (глава 15). Тот факт, что получили развитие — и по-видимому, независимо — три очень разных механизма компенсации дозы, подтверждает важность конечной цели, а именно, уравнивания между полами уровней продуктов генов, сцепленных с X (обзор см.: Marin et al., 2000). Как следствие этого, мутации, нарушающие компенсацию дозы у любого из этих трех организмов, летальны у затронутого такой мутацией пола.1.4. Идентификация неактивной Х-хромосомы у самок млекопитающих
В 1949 году Барр и Бертрам описали тельце полового хроматина — структуру, видную в световой микроскоп в ядрах клеток самки (но не самца) разных видов млекопитающих (см. рисунок на титульной странице главы). Эта структура оказалась полезной в исследованиях половых аномалий, но лишь в 1959 году Оно и коллеги (см. Ohno, 1967) показали, что эта структура происходит из одной из двух Х-хромосом самки. В 1961 году Мэри Лайон описала генетические эксперименты по экспрессии сцепленных с X генов окраски меха у самок мышей. Чтобы объяснить паттерны наследования этой изменчивой пятнистости (мозаичности) окраски меха у индивидуальной самки мыши, Лайон высказала гипотезу, что в каждой женской клетке одна из двух женских Х-хромосом стабильно инактивируется на ранних стадиях развития (Lyon, 1961). Тельце полового хроматина, известное теперь как тельце Барра, является, таким образом, цитологическим проявлением неактивной Х-хромосомы. Элегантные эксперименты с использованием фибробластов кожи от самок, гетерозиготных по полиморфизму сцепленному с X ферменту глюкоза-6-фосфатдегидрогеназе (G6PD), показали, что только одна из двух возможных аллелей экспрессировалась в колониях, выращенных из индивидуальных клеток (клонах), демонстрируя тем самым наследуемость неактивного состояния от одного клеточного поколения следующему (Davidson et al., 1963) и подтверждая инактивацию Х-хромосомы у женщин (Beutler et al., 1962). Дальнейшие исследования инактивации Х-хромосомы у женщин с множественными копиями X (с такими кариотипами, как 47ХХХ или 48ХХХХ) показали, что все Х-хромосомы сверх одной были инактивированы. Это было обобщено в виде «правила «—1», гласящего, что если особь имеет п Х-хромосом, тогда п— 1 из них будут инактивированы (Ohno et al., 1967). Это правило объясняет замечательно легкие клинические симптомы, связанные с анеуплоидиями по Х-хромосоме. Гипотеза инактивации Х-хромосомы продолжала служить объяснением особенностей экспрессии генов, сцепленных с X в клетках самок, и оставалась практически без изменений с тех пор, как она была впервые предложена. Последние 40 лет или около того прошли в попытках разработать молекулярные механизмы, лежащие в основе этого явления.2. Ключевые концепции
2.1. Инактивация X регулируется в ходе развития
Инактивация Х-хромосомы у самок млекопитающих регулируется в ходе развития. В ранней зиготе активны обе Х-хромосомы (Epstein et al, 1978), а затем инактивация протекает согласованно с клеточной дифференцировкой В норме существует равная вероятность того, что клетки инактивируют Х-хромосому, полученную ими от матери либо от отца (Xm и Хр, соответственно). Исключением из этого является инактивация импринтированной Х-хромосомы, которая происходит у всех сумчатых и в ранних предимплантационных эмбрионах мышей, где всегда инактивируется Хр. В последнем случае инактивация импринтированной Хр поддерживается в первых клеточных линиях, подлежащих дифференцировке, а именно в клетках экстраэмбриональной троходермы (ТЕ) и примитивной эндодермы (РЕ), но в клетках внутренней клеточной массы (ICM), дающей начало эмбриону, эта неактивная Х-хромосома реактивируется. Реверсия инактивации X происходит также в развивающихся примордиальных зародышевых клетках (PGCs), что обеспечивает вновь активность этой Х-хромосомы в гамете. Рис. 17.2 иллюстрирует цикл инактивации и реактивации X у самок мышей.2.2. Сайленсинг хромосомы включает множественные уровни эпигенетической модификации
На уровне структуры хроматина сайленсинг Х-хромосомы достигается путем модификации гистоновых «хвостов», включения или исключения вариантных гистонов и метилирования ДНК в богатых CpG «островках»; все это вносит вклад в стабильную структуру гетерохроматина. Слои эпигенетической модификации устанавливаются прогрессивно в ходе онтогенеза, что в деталях описано в разделе 4.4. Все вместе они обеспечивают стабильное воспроизведение неактивной Х-хромосомы в ходе многочисленных раундов клеточных делений. Вклад отдельных модификаций варьирует как во времени, так и в разных линиях клеток. Например, в соматических клетках высокие уровни H3K27me3 (три-метилирования гистона H3 по лизину 27) требуются на Xi во время раннего развития, но не позже. Напротив, метилирование «островков» CpG необходимо лишь в позднем развитии или не требуется вовсе в клетках трофэктод ермы.2.3. Некоторые гены избегают Х-инактивации
Х-инактивация затрагивает большую часть Х-хромосомы, но некоторые гены ускользают от сайленсинга. К ним относятся гены в небольшом районе Х-хромосомы, который спаривается с Y-хромосомой в ходе мейоза у самцов и известен как псевдоаутосомный район (PAR), или район спаривания XY (рис. 17.1). Гены, локализованные в этом районе, не требуют компенсации дозы, потому что и у самцов, и у самок присутствуют две копии. Были охарактеризованы и другие гены-«беглецы» [«дезертиры»], как имеющие сцепленных с Y гомологов, так и не имеющие их. Недавнее исследование показало, что приблизительно 15 % генов на Х-хромосоме человека избегают Х-инактивации (Carrel and Willard, 2005). Интересно, что многие из этих генов лежат в коротком плече хромосомы (обозначаемом как Хр), который относительно недавно приобретен Х-хромосомой в ходе эволюции. Исследования на мышах показывают, что «беглецы» могут быть в раннем онтогенезе инактивированы, а в ходе дальнейшего развития прогрессивно реактивируются (раздел 4.6). У сумчатых большинство изученных генов оказалось в той или иной степени избегающими Х-инактивацию. Это может быть отражением неспособности поддерживать сайленсинг в ходе онтогенеза, которая, возможно, связана с утратой метилирования «островков» CpG на Xi у этих видов (дополнительные детали см. в Разделе 4.7).2.4. Х-инактивация регулируется главным локусом-переключателем — центром Х-инактивации
Классические генетические исследования продемонстрировали, что Х-инактивация опосредуется одним cis-действуюшим главным локусом-переключателем [master switch locus], называемым «центр Х-инактивации (Xic)». Было показано, что Xic требуется для сайленсинга Х-хромосомы в cis-конфигурации и для обеспечения корректной и надлежащей инициации случайной Х-инактивации. В более поздних исследованиях Xic был охарактеризован на молекулярном уровне. Этот локус производит большую некодирующую РНК, называемую Xist (Xznactive specific transcript), которая обладает уникальным свойством связываться в cis-конфигурации и накапливаться по всей длине хромосомы, с которой она транскрибируется (см. рис. 17.3) (Brown et al., 1991, 1992; Brockdorff et al., 1992). Покрытие этой хромосомы Xist-PHK создает переключатель для сайленсинга Х-хромосомы (Lee et al., 1996; Penny et al., 1996; Wutz and Jaenisch, 2000). Проведенные до сегодняшнего дня исследования показывают, что это происходит, по крайней мере отчасти, благодаря опосредованному Xist рекрутированию комплексов, модифицирующих хроматин (рис. 17.3). Вторая некодирующая РНК, Tsixy также локализуется в участке Xic (Lee et al., 1999) и играет ключевую роль в регуляции экспрессии Xist Tsix перекрывается с геном Xist, но транскрибируется в антисмысловом направлении — отсюда его название, соответствующее Xistf прочтенному наоборот!3. Инициация Х-инактивации
3.1. Импринтированная versus случайная Х-инактивация
Решение инактивировать Х-хромосому должно жестко регулироваться. Мужские клетки должны избежать сайленсинга своей единственной Х-хромосомы, а женские клетки должны избежать сайленсинга обеих Х-хромосом или сохранения обеих Х-хромосом в активном состоянии. Было показано, что здесь используются два разных способа регуляции. Импринтированный способ Х-инактивации обеспечивает сайленсинг Х-хромосомы, полученной от отца. При случайном способе каждая клетка имеет равную вероятность инактивации либо материнской, либо отцовской Х-хромосомы. Млекопитающие-метатерии (сумчатые) используют только импринтированный способ. Млекопитающие-эутерии (плацентарные), по крайней мере в некоторых случаях, используют импринтированный способ в экстраэмбриональных клеточных линиях, но случайный способ в собственно эмбрионе (рис. 17.2). Имеются некоторые указания на то, что у человека используется только случайная Х-инактивация, но это остается не выясненным окончательно. Рис. 17.2. Цикл Х-инактивации и Х-реактивации
Х-хромосома в ходе развития проходит цикл Х-инактивации и Х-реактивации. Красные стрелки указывают на этапы Х-инактивации, а зеленые — на этапы Х-реактивации. Инактивация вначале происходит в ранних предимплантационных эмбрионах (импринтированная Х-инактивация), а впоследствии — в клетках эпибласта во время гаструляции (случайная Х-инактивация). Неактивная Х-хромосома реактивируется в клетках внутренней клеточной массы (ICM). когда они впервые обособляются на стадии бластоцисты, а также в развивающихся зародышевых клетках
Рис. 17.2. Цикл Х-инактивации и Х-реактивации
Х-хромосома в ходе развития проходит цикл Х-инактивации и Х-реактивации. Красные стрелки указывают на этапы Х-инактивации, а зеленые — на этапы Х-реактивации. Инактивация вначале происходит в ранних предимплантационных эмбрионах (импринтированная Х-инактивация), а впоследствии — в клетках эпибласта во время гаструляции (случайная Х-инактивация). Неактивная Х-хромосома реактивируется в клетках внутренней клеточной массы (ICM). когда они впервые обособляются на стадии бластоцисты, а также в развивающихся зародышевых клетках
3.2. Регуляция импринтированной Х-инактивации
Отцовски импринтированную Х-инактивацию впервые наблюдали у сумчатого (Sharman, 1971). Впоследствии Такаги и Сасаки (Takagi and Sasaki, 1975) продемонстрировали импринтированную Х-инактивацию в экстра-эмбриональных клеточных линиях ТЕ и РЕ мышиных эмбрионов. Именно происхождение Х-хромосомы от того или другого родителя управляет ее статусом; другими словами, инактивируются отцовские, но не материнские Х-хромосомы, независимо оттого, сколько Х-хромосом или хромосомных наборов присутствуют в клетке. Обратите внимание на то, что единственная Х-хромосома у самцов XYвсегда происходит от матери и, следовательно, не инактивируется в импринтированных тканях. Какова же тогда природа импринта? Исследования экспрессии Xist, регулирующего Х-инактивацию в cis-конфигурации, показывают, что у мышиных эмбрионов имеется репрессивный импринт на аллели, локализованной в Xm (рис. 17.4). Этот импринт препятствует экспрессии Xist, удерживая Х-хромосому в активном состоянии. Опыты с пересадкой ядер показали, что этот репрессивный А75/-импринт устанавливается во время созревания ооцитов (Tada et al., 2000). Молекулярная основа этого импринта неизвестна, но метилирования ДНК не требуется, в отличие от многих других импринтированных генов (см. детали геномного импринтинга в главе 19). Одна из теорий предпочтительной инактивации Хр в зиготе заключается в том, что имеет место перенос сайленсинга бивалента XY, который устанавливается на стадии пахитены мейоза у самцов (meiotic sex chromosome /motivation, MSCI) (Huynh and Lee, 2003). Недавние исследования говорят против этого. Во-первых, было показано, что MSCI — отдельный и не зависимый от Xist механизм, включаемый в пахитене присутствием неспаренных участков хромосом, как на половых хромосомах, так и на аутосомах (Turner et al., 2005 и помещенные там ссылки). Во-вторых, анализ экспрессии ряда сцепленных с X генов в ранних зиготах показал, что сайленсинг Хр возникает de novo в ответ на экспрессию Xist зиготической Хр (Okamoto et al., 2005 и помещенные там ссылки). Экспрессия отцовского Xist (и получающийся в результате этого сайленсинг Хр), начинающаяся в начале зиготической активации гена (на 2—4-клеточной стадии), показывает, что аллель Xist хромосомы Хр готова к экспрессии (рис. 17.4). Однако в мужских соматических тканях Xist всегда репрессирована, откуда следует, что мужские зародышевые клетки должны каким-то образом ремоделировать локус Xist. В соответствии с этим, имеет место специфичное в отношении района деметилирование сайтов CpG в промоторе Xist во время сперматогенеза (Norris et al., 1994). Рис. 17.3. Прогрессивная гетерохроматинизация всей хромосомы, индуцируемая Xist-РНК
(а) Когда ген Xist экспрессируется, синтезируемая РНК связывается с Х-хромосомой, с которой она транскрибируется, и покрывает ее (зеленая прерывистая линия). Считается, что Xist-РНК включает сайленсинг этой хромосомы, рекрутируя активности, модифицирующие хроматин (красные и желтые кружки). Эта первоначальная волна сайленсинга, в свою очередь, приводит к рекрутированию дополнительных слоев эпигенетической модификации (серые кружки), еще более стабилизируя структуру гетерохроматина. Установление этих различных уровней эпигенетического сайленсинга достигается поэтапно в ходе всего развития и онтогенеза. (б) Локализацию Xist-PHК по всем Х-хромосомам показывает гибридизация in situ как в интерфазе, так и в метафазе
Рис. 17.3. Прогрессивная гетерохроматинизация всей хромосомы, индуцируемая Xist-РНК
(а) Когда ген Xist экспрессируется, синтезируемая РНК связывается с Х-хромосомой, с которой она транскрибируется, и покрывает ее (зеленая прерывистая линия). Считается, что Xist-РНК включает сайленсинг этой хромосомы, рекрутируя активности, модифицирующие хроматин (красные и желтые кружки). Эта первоначальная волна сайленсинга, в свою очередь, приводит к рекрутированию дополнительных слоев эпигенетической модификации (серые кружки), еще более стабилизируя структуру гетерохроматина. Установление этих различных уровней эпигенетического сайленсинга достигается поэтапно в ходе всего развития и онтогенеза. (б) Локализацию Xist-PHК по всем Х-хромосомам показывает гибридизация in situ как в интерфазе, так и в метафазе
У эмбрионов с анеуплоидией по Х-хромосоме результатом родительских импринтов, управляющих экспрессией Xist, оказываются неправильные паттерны Х-инактивации на ранних этапах развития. Так же обстоит дело у андрогенетических и гиногенетических (или партеногенетических) эмбрионов, у которых оба хромосомных набора происходят, соответственно, либо от отца, либо от матери. Хотя это обычно снижает жизнеспособность эмбриона, некоторые эмбрионы выживают, очевидно исправляя несоответствующие паттерны Х-инактивации, чтобы обеспечить наличие одной активной Х-хромосомы во всех клетках. Полагают, что это связано с преодолением импринта с помощью механизма, в норме регулирующего случайную Х-инактивацию (см. ниже). Ген Tsix, антисмысловой регулятор Xist, необходим для импринтированной Х-инактивации, поскольку делеция главного промотора приводит к ранней эмбриональной летальности, когда передается материнской, но не отцовской гаметой (Lee, 2000). Летальность, по-видимому, можно приписать несоответствующей экспрессии Xist хромосомы Xm, т. е. неспособности сохранить активную Х-хромосому у эмбрионов как XmY, так и ХгпХр. В настоящее время неясно, является ли экспрессия Tsix-РНК первичным импринтом или же функционирует позже для поддержания импринта.
3.3. Регуляция случайной Х-инактивации — счет
При случайном способе Х-инактивации клетки пользуются правилом п— 1, при котором на каждый диплоидный! хромосомный набор инактивируются все Х-хромосомы кроме одной. Выбор X, которая будет сайленсирована (или сохранится активной) по существу является случайным, хотя некоторые факторы могут влиять на него (см. раздел 3.4). Регуляция Xist при случайной инактивации строго контролируется Исследования показали, что одиночные эмбриональные стволовые (ES) клетки XX при дифференцировке экспрессируют только лишь одну аллель Xist, тогда как клетки XY никогда не инициируют экспрессию. Рис. 17.4. Регуляция гена Xist в раннем развитии
Рисунок иллюстрирует современные знания и модели импринтированной и случайной регуляции Xist у ранних мышиных эмбрионов XX. Аллель Xm гена Xist приходит в зиготу с репрессивным импринтом, возможно опосредованным антисмысловым локусом Tsix (черный квадратик). Аллель Хр готова к тому, чтобы быть активной, и экспрессируется как только на 2-клеточной стадии происходит активация эмбрионального гена. Со стадии 2 клеток до стадии морулы Хр Xist экспрессируется во всех клетках (экспрессия показана открытым прямоугольником и стрелкой на 5’-конце). Этот паттерн поддерживается на стадии ранней бластоцисты и впоследствии в клетках ТЕ и РЕ и производных от них полностью дифференцированных тканей. В ICM поздней бластоцисты экспрессия Xist прекращается, возможно с помощью ICM-специфичного репрессорного фактора (голубой треугольник). Впоследствии экспрессия Xist начинается во время гаструляции. Здесь блокирующий фактор (черный ромб) гарантирует, чтобы экспрессия Xist не могла происходить на одной из двух аллелей (счет)
Рис. 17.4. Регуляция гена Xist в раннем развитии
Рисунок иллюстрирует современные знания и модели импринтированной и случайной регуляции Xist у ранних мышиных эмбрионов XX. Аллель Xm гена Xist приходит в зиготу с репрессивным импринтом, возможно опосредованным антисмысловым локусом Tsix (черный квадратик). Аллель Хр готова к тому, чтобы быть активной, и экспрессируется как только на 2-клеточной стадии происходит активация эмбрионального гена. Со стадии 2 клеток до стадии морулы Хр Xist экспрессируется во всех клетках (экспрессия показана открытым прямоугольником и стрелкой на 5’-конце). Этот паттерн поддерживается на стадии ранней бластоцисты и впоследствии в клетках ТЕ и РЕ и производных от них полностью дифференцированных тканей. В ICM поздней бластоцисты экспрессия Xist прекращается, возможно с помощью ICM-специфичного репрессорного фактора (голубой треугольник). Впоследствии экспрессия Xist начинается во время гаструляции. Здесь блокирующий фактор (черный ромб) гарантирует, чтобы экспрессия Xist не могла происходить на одной из двух аллелей (счет)
У анеуплоидных или полиплоидных по Х-хромосоме мышиных эмбрионов результат случайной и импринтированной Х-инактивации различен. Простую иллюстрацию этого дают эмбрионы ХО. При импринтированной Х-инактивации эмбрионы XmО являются нормальными, но развитие эмбрионов ХрО замедлено, поскольку клетки пытаются инактивировать свою единственную Х-хромосому, нарушая тем самым развитие экстраэмбриональных тканей. При случайной Х-инактивации клетки считают число своих Х-хромосом (подчиняясь правилу п—1) и таким образом поддерживают единственную Х-хромосому активной, независимо от того, является ли она Xm или Хр. и поэтому не страдают. Случайный способ Х-инактивации требует, чтобы клетки обладали средствами для определения числа присутствующих Х-хромосом, нередко называемого «счетом» Популярной моделью для объяснения счета является модель блокирующего фактора, предложенная Растаном (Rastan, 1983). Она предполагает, что единственный Xic (аллель Xist) блокирован во всех клетках, обозначая тем самым активную Х-хромосому. Дополнительные Xic (аллели Xist), там где они имеются, экспрессируются, индуцируя таким образом Х-инактивацию (рис. 17.5). Модель Растана предполагает, что Х-инактивация есть состояние «по умолчанию», заключающееся в том, чтобы сохранять одну Х-хромосому активной. Хотя может показаться, что модель противоречит интуиции, она обладает важным достоинством, объясняя большинство сделанных до сегодняшнего времени экспериментальных наблюдений. Природа блокирующего фактора остается, однако, неизвестной. Наше понимание механизмов, регулирующих экспрессию Xist и инициацию Х-инактивации, очень выиграло от использования клеток ES, культивируемых in vitro. Клетки ES получаются из мышиных эмбрионов на стадии бластоцисты, говоря конкретнее, из ICM (рис. 17.4). Они остаются недифференцированными при культивировании в сыворотке с добавкой лейкемического ингибиторного фактора (LIF, leukemia inhibitory factor). Дифференцировку in vitro можно включить удалением LIF из культуральной среды и пересевом клеток на чашки, изготовленные из неадгезивного пластика. В этих условиях они округляются, агрегируют и формируют эмбриоидные тела, внутри которых они дифференцируются, на протяжении всего нескольких дней, во много разных соматических клеточных типов В недифференцированном состоянии ES-клетки XX обладают двумя активными Х-хромосомами. Когда индуцируют дифференцировку этих клеток, большинство клеток эмбриоидного тела претерпевают случайную Х-инактивацию. Напротив, в дифференцированных ES-клетках XY экспрессия Xist и Х-инактивация не происходят Таким образом, ES-клетки представляют собой ценную модельную систему, потому что они поддаются генетическому манипулированию с использованием «нацеливания» на гены, и, таким образом, на них можно изучать различные этапы процесса Х-инактивации. Ключевым экспериментом явилась демонстрация того, что делеция участка длиной 65 т. п.н., локализованного непосредственно «вниз по течению» от Xist, приводит к экспрессии Xist этой аллелью (и, как следствие, к инактивации) даже в дифференцирующихся ES-клетках XY (Clerc and Avner, 1998). Это означает, что делетированные последовательности необходимы для связывания предполагаемого блокирующего фактора. Дальнейшая характеристика участка, ответственного за это, была достигнута с помошью стратегий «замещения — нацеливания», позволяющих получать делеции более мелких участков в пределах этих 65 т. п.н. (рис. 17.6). Определение ключевых элементов и идентификация связывающихся с ними факторов являются главными целями будущих исследований.
 Рис. 17.5. Модель блокирующего фактора для случайной инактивации Х-хромосомы
Модель блокирующего фактора предполагает, что имеется некий фактор (желтый кружок), который во всех клетках блокирует единственную аллель Xist (зеленый прямоугольник), так что в начале Х-инактивации эта хромосома защищена от идущей Х-инактивации. В мужских клетках (а) присутствует только одна аллель, и блокирующий фактор всегда связывается с нею. В женских клетках (б) существует равная вероятность, что блокирующий фактор свяжется либо с аллелью XmXist (красный цвет), либо с аллелью Хр Xist (синий цвет). В начале Х-инактивации только незаблокированная аллель будет экспрессировать Xist — РНК (зеленая прерывистая линия). Разные алели цетра Х-инактивации могут иметь большее или меньшее сродство к блокирующему фактору, так что у гетерозиготных самок этот фактор предпочтительно связывается с одной Х-хромосомой. В некоторых случаях это может лежать в основе отклонений от первичной неслучайной X-инактивации (рис. 17.7)
Рис. 17.5. Модель блокирующего фактора для случайной инактивации Х-хромосомы
Модель блокирующего фактора предполагает, что имеется некий фактор (желтый кружок), который во всех клетках блокирует единственную аллель Xist (зеленый прямоугольник), так что в начале Х-инактивации эта хромосома защищена от идущей Х-инактивации. В мужских клетках (а) присутствует только одна аллель, и блокирующий фактор всегда связывается с нею. В женских клетках (б) существует равная вероятность, что блокирующий фактор свяжется либо с аллелью XmXist (красный цвет), либо с аллелью Хр Xist (синий цвет). В начале Х-инактивации только незаблокированная аллель будет экспрессировать Xist — РНК (зеленая прерывистая линия). Разные алели цетра Х-инактивации могут иметь большее или меньшее сродство к блокирующему фактору, так что у гетерозиготных самок этот фактор предпочтительно связывается с одной Х-хромосомой. В некоторых случаях это может лежать в основе отклонений от первичной неслучайной X-инактивации (рис. 17.7)
3.4. Регуляция случайной Х-инактивации — выбор
При некоторых обстоятельствах могут иметь место отклонения от случайной Х-инактивации. Это происходит либо в результате нарушений в первоначальном выборе Х-хромосомы для инактивации («первичная неслучайная инактивация), либо в результате отбора против клеток, поддерживающих конкретную Х-хромосому в активном состоянии («вторичная» неслучайная Х-инактивация) (рис. 17.7). При первичной неслучайной Х-инактивации на выбор влияют вариации cis-действующих последовательностей или мутации, влияющие на вероятность того, что данная Х-хромосома будет выбрана у гетерозиготных животных как активная или неактивная X. Согласно предложенной Растаном модели блокирующего фактора, эти вариации могут проявлять свое влияние, изменяя вероятность связывания блокирующего фактора с данной аллелью. Примером первичной неслучайной Х-инактивации является контролирующий Х-хромосому элемент (Хее, X controlling element) у мышей. Хее — классическим образом определенный локус, где разные аллели оказались влияющими на вероятность того, что несущая этот локус Х-хромосома будет активной X у гетерозигот XX (Cattanach and Isaacson, 1967). Опыты по генетическому картированию помещают Хее непосредственно «вниз по течению» от Xist (рис. 17.6) и, следовательно, в правильном положении для того, чтобы влиять на связывание блокирующего фактора, как определяется делецией 65 т. п.н. Лежащую в основе этого изменчивость последовательностей остается идентифицировать. Второй элемент, который у мышей может влиять на выбор, — это антисмысловой регулятор Tsix (Lee and Lu, 1999). Полагают, что он опосредуется антисмысловой РНК Tsix, которая транскрибируется через локус Xist перед инициацией случайной Х-инактивации (рис. 17.6). Хромосома, несущая делецию промотора Tsix, в клетках XX, претерпевающих случайную Х-инактивацию, инактивируется предпочтительно. Более слабые отклонения наблюдаются у клеток с мутациями в энхансерных элементах (Xite-элементах), которые могут управлять уровнями экспрессии Tsix. Хотя промотор Tsix лежит в пределах района, определяющего предполагаемый сайт связывания блокирующего фактора, опыты с «прицельными» делециями не активируют Xist «по умолчанию» в ES-клетках XY. Это позволяет предположить, что эти локусы не синонимичны, но что делеция промотора Tsix оставляет интактными сайты связывания для блокирующего фактора. Транскрипция Tsix сопровождается транскрипцией Xist, идущей на низком уровне, перед инициацией случайной Х-инактивации, позволяя предполагать, что влияние на выбор может быть опосредовано двунитевой РНК (т. е. гибридными нитями Tsix: Xist). В согласии с этим повышение уровня смысловой транскрипции через промоторы Xist находится в противоречии с репрессивным эффектом Tsix и дает в результате аллель с меньшей вероятностью стать активной X в гетерозиготной клетке XX (Nesterova et al., 2003). Подытоживая этот материал, можно сказать, что на рис. 17.6 показаны все различные Xic-элементы, о которых известно, что они влияют на инициацию случайной и импринтированной Х-инактивации, и которые часто описываются с точки зрения их способности влиять на функции счета и (или) выбора. Рис. 17.6. Гены и регуляторные элементы в районе центра Х-инактивации
Ключевой район, регулирующим Х-инактивацию, изображен зеленым цветом. Фланкирующие гены показаны серым цветом Стрелки указывают на промоторы генов Xist (смысловой) и Tsix (антисмысловой). Протяженность соответствующих некодируюших РНК изображена прерывистыми зелеными линиями. Регуляторные элементы, контролирующие экспрессию Tsix, Xite и DXPas34, показаны черным. Районы и локусы, участвующие в выборе Х-хромосомы и счете Х-хромосом, показаны в верхней части рисунка
Рис. 17.6. Гены и регуляторные элементы в районе центра Х-инактивации
Ключевой район, регулирующим Х-инактивацию, изображен зеленым цветом. Фланкирующие гены показаны серым цветом Стрелки указывают на промоторы генов Xist (смысловой) и Tsix (антисмысловой). Протяженность соответствующих некодируюших РНК изображена прерывистыми зелеными линиями. Регуляторные элементы, контролирующие экспрессию Tsix, Xite и DXPas34, показаны черным. Районы и локусы, участвующие в выборе Х-хромосомы и счете Х-хромосом, показаны в верхней части рисунка
3.5. Способы переключения инактивации в раннем эмбриогенезе
Каким образом ранние эмбрионы мыши осуществляют переключение с импринтированного на случайный способ регуляции? До недавнего времени думали, что в обоих случаях инициация Х-инактивации сцеплена с клеточной дифференцировкой (Monk and Harper, 1979). Так, полагали, что линии трофэктодермы и примитивной эндодермы инактивируют Хр в ответ на родительские импринты на Xist, когда они впервые дифференцируются на стадии бластоцисты, в то время как клетки ICM, дающие начало собственно эмбриону, сначала, как думали, стирают импринт Xist, а потом претерпевают случайную Х-инактивацию, когда они дифференцируются в три зародышевые линии на стадии гаструляции. Однако более свежие данные показывают, что инактивация ХР происходит до начала клеточной дифференцировки на стадии дробления зародышей и что она происходит во всех клетках, включая предшественников ICM (Мак et al., 2004; Okamoto et al., 2004). Таким образом, импринтированная Х-инактивация в трофэктодерме и примитивной эндодерме представляет собой реликт паттерна Х-инактивации, устанавливаемого у эмбрионов на стадии раннего дробления. Клетки ICM должны, таким образом, запускать программу для реверсии этой начальной волны импринтированной Х-инактивации (см. рис. 17.4). База для реверсии инактивации Хр неизвестна, но может включать в себя специфичную для ICM программу, которая репрессирует экспрессию Xist на Хр (см. раздел 5).4. Воспроизведение и поддержание неактивного состояния
4.1. Xist-PHK, сайленсинг генов и сборка гетерохроматина
Так что же делает ген Xist? Имеются убедительные данные, что ген Xist и его продукт, РНК, обеспечивают как переключатель, инициирующий Х-инактивацию в cis-конфигурации, так и средство распространения сайленсинга по хромосоме. Данные показывают, что (1) Xist уникален в том отношении, что он экспрессируется только с Xi, (2) уровни Xist-РНК резко возрастают у предимплантационных эмбрионов во время Х-инактивации, (3) ап-регуляция Xist предшествует Х-инактивации и, по-видимому, является абсолютно необходимой для нее, (4) Xist-РНК колокализуется с Xi в интерфазных ядрах и распределяется по одной из двух метафазных Х-хромосом (см. рис. 17.3) и (5) содержащие Xist трансгены, будучи вставлены в аутосомы, могут индуцировать по крайней мере некоторые свойства неактивного хроматина. В результате (сверх)экспрессии аутосома в cis-конфигуpaции покрывается продуктом, и параллельно возникает подобная гетерохроматину, транскрипционно «молчащая» структура хроматина (Heard et al., 1999 и помещенные там ссылки). Эти открытия заставляют предположить, что Xist-РНК и необходима, и достаточна для включения формирования гетерохроматина и транскрипционного сайленсинга. Однако продолжающаяся экспрессия Xist не требуется для поддержания Х-инактивации. Например, у гибридов соматических клеток человека и грызуна, где экспрессия Xist утрачена на Xi-хромосоме человека, которая сохраняется на фоне хромосом грызуна, поддерживается сайленсинг генов, сцепленных с Х-хромосомой (Brown and Willard, 1994). Эта тема обсуждается далее, в разделе 5. Важно отметить, что ассоциация Xist-PHK с Xi избирательна. Она не обнаруживается вдоль PAR (которое остается активным и эухроматиновым) или в конститутивном (центрическом) гетерохроматине. Более того, анализ метафазных хромосом демонстрирует локализацию в виде бэндов, которая, по-видимому, коррелируете G-светлыми полосами (бэндами), обогащенными генами (см. рис. 17.3) (Duthie et al., 1999). Эти наблюдения показывают, что Xist-РНК покрывает лишь определенные районы хроматина (обсуждается далее в разделе 4.5) Механизм (механизмы), посредством которого Xist-PHK осуществляет изменения в структуре хроматина и связанный с ним сайленсинг генов в деталях остаются все еще непонятными. Мы знаем, что разные участки молекулы Xist-PHК ответственны за сайленсинг генов и распространение вдоль Х-хромосомы. Эксперименты с системой индуцибельной экспрессии Xist в мышиных ES-клетках, в которой можно было протестировать функции молекул Xist, несущих определенные делеции, показали, что сайленсинг можно приписать консервативной повторяющейся последовательности на 5’-конце этой молекулы, тогда как покрытие Х-хромосомы опосредуется последовательностями, разбросанными по всей остальной части молекулы (Wutz et al., 2002).4.2. Гетерохроматиновая структура неактивной Х-хромосомы
Со времени самых ранних светомикроскопических исследований вполне осознавали, что Xi обладает свойствами, общими с гетерохроматином. Подобно конститутивному гетерохроматину, обнаруживаемому в центромерах и вокруг них, Xi остается видимой и, вероятно, конденсированной на протяжении всей интерфазы (в виде тельца Барра), и ее ДНК обычно реплицируется в поздней фазе S. Говорится, что Xi состоит из факультативного гетерохроматина. Однако важно помнить, что ДНК конститутивного гетерохроматина обычно обогащена специфическими, повторяющимися сателлитными последовательностями, которые ответственны, по крайней мере частично, за его характерные свойства. ДНК Х-хромосомы не обнаруживает подобной обогащенности, хотя и демонстрирует более слабые различия в специфических повторяющихся элементах, которые могут играть роль в процессе инактивации (см. раздел 4.5). Кроме того, хотя хроматин Xi часто описывается как «конденсированный», тщательный микроскопический анализ и ЗБ-реконструкция хромосом Ха и Xi, помеченных специфичным к ДНК Х-хромосомы зондом, позволяют предполагать, что различие между ними является в большей мере вопросом формы, чем количества хроматина на единицу объема (Eils et al., 1996). Дальнейшие параллели между Xi и конститутивным гетерохроматином последовали в результате использования непрямой иммунофлуоресцентной микроскопии для изучения распределения модификаций и вариантов гистонов по метафазным хромосомам и в интерфазных ядрах. Факультативный гетерохроматин неактивной Х-хромосомы и в клетках человека, и в клетках мыши обеднен ацетилированным гистоном Н4 (Jeppesen and Turner, 1993) и в этом отношении напоминает конститутивный, центрический гетерохроматин. Это явилось первой демонстрацией того, что неактивная Х-хромосома маркирована модификацией гистонов специфического типа. Последующие эксперименты, проведенные в нескольких лабораториях, подтвердили эти наблюдения и показали далее, что ацетилированные изоформы всех четырех коровых гистонов (H2A, H2B, H3 и Н4) обеднены и конститутивным, и факультативным гетерохроматином в интерфазных и метафазных клетках (O’Neill et al., 2003 и помещенные там ссылки). В частности, и центрический гетерохроматин, и Xi обеднены H3, ди- и три-метилированным по К4 (H3K4me2 и H3K4me3). Обычно полагают, что эти последние, как и ацетилирование, являются маркерами транскрипционно активного (или потенциально активного) хроматина. Ситуация становится сложнее, когда рассматривается появление меток, ассоциированных с транскрипционным сайленсингом, а не изчезновение меток, связанных с транскрипционной активностью. Например, гистоны H3, ди- и триметилированные по К9 (H3K9me2/3), — характерные метки транскрипционно «активных» генов, и с помощью иммунофлуоресцентной микроскопии нередко можно видеть, что они обогащены центическим гетерохроматином (Lachner et al., 2003). Однако по ряду технических и биологических причин, обогащенность ими Xi выглядела неопределенной. По этой причине, следует подчеркнуть значение специфичности антител для получения надежных результатов иммунофлуоресценции Например, лизины 9 и 27 в H3 оба являются частью тетрапептидного ARKS, и антитела, полученные против одного, могут давать перекрестную реакцию с другим. Такие перекрестные реакции должны быть тщательно исключены, прежде чем полученные результаты можно будет надежно интерпретировать. Кроме того, использованная процедура иммунизации и использованный иммуноген могут влиять на тонкуюспецифичность антисывороток. Например, антисыворотки к H3K9me3, полученные с поперечносшитыми [cross-linked] пептидами, сильнее связываются с этим модифицированным гистоном, когда он находится в гетерохроматиновом районе, чем когда он в эухроматине (Maison et al., 2002). Антисыворотки, полученные таким образом, являются ценными реагентами ддя исследований по гетерохроматину, но не идеальными ддя количественных сравнений гетерохроматина и эухроматина. Наконец, было отмечено, что усиленное иммунофлуоресцентное окрашивание в интерфазе может быть просто результатом более высокой плотности нуклеосом в гетерохроматине (Perche et al., 2000). Тщательный анализ распределения модификаций гистонов по Xi в культивируемых клетках человека позволил глубже проникнуть в сложность этой системы (Chadwick and Willard, 2004). Определенные и неперекрывающиеся районы в Xi обогащены H3K9me3 и H3K27me3. Таким образом, в отличие от утраты ацетилирования, обогащенность этими модификациями является региональным, а не общим свойством Xi. Любопытно, что районы, обогащенные H3K27me3, оказываются также обогащенными Xist-РНК и вариантным гистоном макроH2A1.2 (Costanzi and Pehrson, 1998). Каким образом макроH2A1.2 мог бы ассоциироваться с Xi и какова его возможная роль в процессе инактивации — эти вопросы обсуждаются далее, в разделе 4.4. Напротив, те районы Xi, которые обогащены H3K9me3, показывают также повышенные уровни гетерохроматинового белка НР1 (о котором известно, что он связывается с метилированными H3K9) и H4K20me3 (метка, также ассоциированная с конститутивным, центрическим гетерохроматином). Важно отметить, что иммуноокрашивание тельца Барра в интерфазных клетках показало такие же паттерны совместного окрашивания, что заставляет предполагать, что различные домены сохраняются на протяжении всего клеточного цикла. Рис. 17.7. Модели неслучайной Х-инактивации
Первичной неслучайной X-инактивацией обозначают отклонения в первоначальном выборе Х-хромосомы, которая будет инактивирована. Теоретически это могло бы происходить у гетерозиготных самок, где имеется отклонение в вероятности двух аллелей, связывающихся с блокирующим фактором. При вторичной неслучайной Х-инактивации выбор Х-хромосомы, которая будет инактивирована, является случайным, но события клеточного отбора приводят к прогрессивной утрате клеток, инактивирующих одну из двух Х-хромосом. Например, там, где на одной Х-хромосоме имеется вредная мутация, клетки, инактивирующие другую Х-хромосому, хромосому дикого типа, будут предпочтительно теряться
Рис. 17.7. Модели неслучайной Х-инактивации
Первичной неслучайной X-инактивацией обозначают отклонения в первоначальном выборе Х-хромосомы, которая будет инактивирована. Теоретически это могло бы происходить у гетерозиготных самок, где имеется отклонение в вероятности двух аллелей, связывающихся с блокирующим фактором. При вторичной неслучайной Х-инактивации выбор Х-хромосомы, которая будет инактивирована, является случайным, но события клеточного отбора приводят к прогрессивной утрате клеток, инактивирующих одну из двух Х-хромосом. Например, там, где на одной Х-хромосоме имеется вредная мутация, клетки, инактивирующие другую Х-хромосому, хромосому дикого типа, будут предпочтительно теряться
Возникающая картина — это картина сочетания модификаций гистонов, вариантов гистонов, негистоновых белков и Xist-PHK, взаимодействие которых формирует хроматин с его отличительными свойствами транскрипционного «молчания», репликации в поздней S-фазе, конденсированным внешним обликом и (возможно) ядерной локализацией, которые характерны для Xi. Однако точное функциональное значение отдельных хроматиновых доменов на Xi еще предстоит установить. Важное и беспокоящее наблюдение заключается в том, что частота наблюдаемых доменов широко варьирует от одной клеточной линии человека к другой (Chadwick and Willard, 2004). Это может быть не более, чем подтверждением известной избыточности в системе Х-инактивации (например, как отмечалось ранее, в зрелых клетках сайленсинг поддерживается даже тогда, когда Xist-PHK утрачивается), но это также и предупреждение, что культивируемые клеточные линии, особенно иммортализованные. не всегда являются надежным проводником в том, что происходит в первичных тканях, и уж точно не на ранних стадиях развития. Модификации гистонов, ассоциированные с эухроматином и факультативным, и конститутивным гетерохроматином, суммированы в табл. 17.1. До сих пор лишь Xi, но не конститутивный гетерохроматин, оказалась обогащенной метилированием H3K27 и убиквитинированием гистона H2A по лизину 119 (H2AK119ub) (Plath et al., 2003; Silva et al., 2003; de Napoles et al., 2004; Smith et al., 2004). Все модификации, перечисленные в табл. 17.1, ассоциированы с общей, гетерохроматиновой конформацией неактивной Х-хромосомы и были идентифицированы с помощью иммунофлуоресцентного анализа либо метафазных хромосом, либо тельца Барра в интерфазных клетках. Однако локальные изменения в модификациях гистонов могут также играть важную роль на различных этапах процесса Х-инактивации. Такие изменения могут быть идентифицированы с помощью микроскопии высокого разрешения или с помощью иммунопреципитации хроматина (СЫР) для того, чтобы картировать модификации, которые объяснялись в главе 10, внутри или по соседству с критичным районом Xic. Например, в недифференцированных ES-клетках крупный домен, простирающийся более чем на 340 т. п.н. в 5’-направлении от гена Xist, характеризуется гиперметилированием H3K9. Гиперметилирование уменьшается по мере того, как клетки дифференцируются и продолжается Х-инактивация (Heard et al., 2004). В женских ES-клетках тот же общий район хроматина обогащен метилированными H3K27 (Rougeulle et al., 2004), а сайты внутри него обогащены ацетилированными H3 и Н4 (O’Neill et al., 1999). Проводимые в настоящее время исследования должны показать, в какой мере эти локальные модификации гистонов в районе Xic являются ранними каузативными событиями, приводящими в действие процесс Х-инактивации, и в какой степени — событиями, совершающимися «вниз по течению» и являющимися (возможно, существенными) компонентами идущего процесса ремоделинга хроматина.
Таблица 17.1. Модификации гистонов. характерные для конститутивного и факультативного гетерохроматина
 Указаны модификации гистонов, которыми обогащен (+) или обеднен (-) конститутивный и факультативный гетерохроматин по сравнению с эухроматином. Символ «означает, что уровень модификации неотличим сколько-нибудь от эухроматина. (me) — метилирование. Относится ко всем способным ацетилироваться лизинам. Обогащение в локальных «горячих пятнах», но не повсюду. Временное обогащение в некоторых клеточных типах.
Указаны модификации гистонов, которыми обогащен (+) или обеднен (-) конститутивный и факультативный гетерохроматин по сравнению с эухроматином. Символ «означает, что уровень модификации неотличим сколько-нибудь от эухроматина. (me) — метилирование. Относится ко всем способным ацетилироваться лизинам. Обогащение в локальных «горячих пятнах», но не повсюду. Временное обогащение в некоторых клеточных типах.
Конститутивный центрический гетерохроматин обогащен метилированной ДНК, прежде всего 5’-метилцитозином в димерах CpG (глава 18). Это согласуется с его низким уровнем транскрипционной активности Как это, возможно, ни удивительно, уровень метилирования CpG на Xi в целом не является существенно более высоким, чем в остальном геноме. Однако специфические «островки» CpG, ассоциированные с «молчащими» генами, в высокой степени метилированы, и экспериментальные данные позволяют предполагать, что метилирование ДНК играет важную роль в стабилизации неактивного состояния. Так, мыши, у которых отсутствуют ферменты, которые либо метилируют немодифицированные до этого CpG (de novo метилтрансферазы ДНК, Dnmta и Dnmtb), либо поддерживают модификацию прежде модифицированных остатков (поддерживающий энзим, Dnmtl), инициируют и осуществляют случайную Х-инактивацию нормальным образом (Sado et al., 2000, 2004). Однако гены на гипометилированной Xi у этих мутантных мышей реактивируются легче, чем Xi у животных дикого типа с нормальными уровнями метилирования (Sado et al., 2000).
4.3. Энзимология модификаций гистонов на Хi
Ферменты, отвечающие за ацетилирование коровых гистонов (HDACs) во время Х-инактивации или за деметилирование H3K4, пока неизвестны. Поскольку ингибитор деацетилазы трихостатин A (TSA, trichostatin А) может предотвращать или, по крайней мере, задерживать появление деацетилированной X в дифференцирующихся женских ES-клетках, есть основания предположить участие HDACs (O’Neill et al., 1999). Однако мы не знаем, какие из 11 HDACs класса I и II отвечают за это вероятнее всего (энзимы класса III не подавляются TSA). Мы не знаем также механизм, ответственный за удаление метилирования H3K4. Ферменты, способные удалять метальные группы с H3K4, находящихся в моно- или диметилированном состоянии, были идентифицированы только недавно, а ферменты, способные деметилировать H3K4 в триметилированном состоянии, еще предстоит открыть. На этом этапе мы не можем исключить, что метилирование H3K4 и (или) деапетилирование гистонов удаляются с Xi путем замещения гистонов или же пассивным образом в ходе репликации ДНК. В настоящее время мы больше знаем об энзимах, ответственных за помещение модификаций гистонов в нужное место. Метилирование H3K27 выполняется Ezh2/Enxl — гомологом белка группы polycomb (PcG) у Drosophila, энхансером zeste (E(Z)) (Silva et al., 2003) (E(Z)) является метилтрансферазой гистонов (HKTM), функционирующей в комплексе PRC2 PcG (глава 11). PRC2 рекрутируется к Xi во время дифференцировки ES-клеток с такой же кинетикой, что и метилирование H3K27. Интересно, что белки PcG участвуют также в убиквитинизации H2A по лизину 119 на Xi. В частности, белок RinglA/RinglB, коровый компонент комплекса PRC2 PcG, функционирует как лигаза ЕЗ для убиквитинирования H2A. Делеция и Ring 1 А, и Ring 1В приводит к потере убиквитинирования H2A как на Xi, так и по всему геному (de Napoles et al., 2004).4.4. Последовательность событий, приводящих к Х-инактивации; ES-клетки как модельная система
Мышиные ES-клетки оказались бесценной модельной системой для исследования динамики инактивации Х-хромосомы. Повышенные уровни Xist-РНК и то, как она покрывает одну из Х-хромосом, впервые обнаруживаются в большой доле клеток спустя 1–2 дня дифференцировки. Имеются данные о том, что в ап-регуляции Xist играют роль как транскрипционные, так и посттранскрипционные механизмы (Panning et al., 1997; Sheardown et al., 1997; Rougeulle et al., 2004). Однако в недифференцированных женских ES-клетках Xist транскрибируется с обеих Х-хромосом, а в мужских — с единственной X, но продукт транскрипции, РНК, быстро деградирует, и лишь небольшие его количества выявляются по соседству с локусом Xist. Были представлены данные о том. что по мере дифференцировки имеет место стабилизация Xist-PHK на одной из двух Х-хромосом женских клеток (Panning et al., 1997; Sheardown et al., 1997). Механизм, лежащий в основе этого этапа избирательной стабилизации РНК, остается неизвестным, как и его вклад в общее увеличение содержания Xist-РНК и в покрытие ею хромосомы в cis-конфигурации. Было обнаружено, что ряд этапов Х-инактивации совпадает с началом аккумуляции Xist-PHК в дифференцирующихся ES-клетках XX. В их число входят рекрутирование белков PcG и ассоциированное с этим метилирование H3K27, моноубиквитинирование H2A, деацетилирование H3K9 и утрата метилирования в H3K4 (Heard et al., 2001; Silva et al., 2003; de Napoles et al., 2004; Rougeulle et al., 2004). Глобальное деацетилирование гистонов — относительно позднее событие, происходящее в большинстве клеток на 3—5-й день; поэтому весьма вероятно, что оно участвует в поддержании и (или) стабилизации неактивного состояния, а не в его инициации (Keohane et al., 1996). Такая трактовка предполагает, что паттерны ацетилирования в промоторах отдельных генов, претерпевающих инактивацию, отражают паттерны, определяемые с помощью иммунофлуоресцентного анализа целой хромосомы или крупных доменов. Первоначальные исследования с использованием ChIP, заставляют предполагать, что это действительно так, однако необходимы дальнейшие эксперименты с вовлечением большего числа генов (O’Neill et al., 2003). Аккумуляция вариантного гистона macroH2A1.2 на Xi происходит в ходе дифференцировки ES-клеток XX гораздо позже (Mermoud et al., 1999). Этот вариантный гистон имеет более 200 дополнительных аминокислотных остатков в своем карбокситерминальном конце и несколько аминокислотных замен по всей молекуле. Интересно, что в соматических клетках экспрессия Xist-PHK требуется для того, чтобы сохранить macroH2A на Xi (Csankovski et al., 1999), но ее недостаточно, чтобы рекрутировать macroH2A на ранних этапах дифференцировки (Mermoud et al., 1999; Wutz et al., 2002). Избирательное метилирование ДНК на Xi — еще более позднее событие в ES-клетках, Динуклеотиды CpG, о которых известно, что они высокометилированы HaXi во взрослых клетках, не становятся метилированными в женских ES-клетках до гораздо более поздних стадий дифференцировки, 14—21-го дня (Keohane et al., 1996). Это согласуется с результатами в самом развивающемся эмбрионе (Lock et al., 1987) и с идеей, согласно которой метилирование ДНК отвечает за стабилизацию, или фиксацию неактивного состояния, а не участует в инициации и распространении. Таким образом, возникающая картина — это картина скоординированной и тщательно регулируемой последовательности событий, посредством которых изменения хроматина на Xi помещаются на место по мере развития (суммировано на рис. 17.8). Замечательно, что некоторые из этих изменений, например деацетилирование гистонов и метилирование ДНК, происходят после того, как клетки начали продвигаться по различным дифференцировочным путям. Создается впечатление, что программа, отвечающая за завершение [completion] Х-инактивации, выполняется независимо от других программ клеточной дифференцировки. Важно, однако, отметить, что в некоторых аспектах случайная Х-инактивация может происходить только после того, как дифференцировка началась. Например, включение экспрессии Xist-трансгенов в недифференцированных ES-клетках переключает различные модификации гистонов, ассоциированные с гетерохроматинизацией, а также переход к репликации в поздней S-фазе (Wutz and Jaenisch, 2000), но сколько-нибудь заметное включение macroH2A отсутствует; только после того как индуцирована дифференцировка клеток, macroH2A ко-локализуется с Xist-РНК на хромосоме, содержащей трансген Xist (Rasmussen et al., 2001). Ассоциация macroH2A с хроматином, покрытым Xist, зависит от постоянного присутствия Xist-РНК (Csankovszki et al., 1999), но не требует транскрипционного сайленсинга, поскольку она видна также в хромосомах, покрытых мутантной Xist-РНК, лишенной районов, необходимых для сайленсинга (Wutz et al., 2002). Таким образом, Х-инактивация может рассматриваться как конечный результат серии параллельных процессов, из которых лишь некоторые являются взаимозависимыми. Рис. 17.8. Слои эпигенетического сайленсинга накапливаются на Xi в ходе дифференцировки
Диаграмма показывает, как пять разных эпигенетических изменений, связанных с транскрипционным сайленсингом. размещаются на неактивной Х-хромосоме на разных стадиях развития и дифференцировки как у развивающегося эмбриона, так и в клетках ES в культуре. В некоторых клеточных типах метилирование H3K27 является временным, преходящим, обнаруживаемым лишь на ранних стадиях дифференцировки, но не у зрелых клеток
Рис. 17.8. Слои эпигенетического сайленсинга накапливаются на Xi в ходе дифференцировки
Диаграмма показывает, как пять разных эпигенетических изменений, связанных с транскрипционным сайленсингом. размещаются на неактивной Х-хромосоме на разных стадиях развития и дифференцировки как у развивающегося эмбриона, так и в клетках ES в культуре. В некоторых клеточных типах метилирование H3K27 является временным, преходящим, обнаруживаемым лишь на ранних стадиях дифференцировки, но не у зрелых клеток
Важно подчеркнуть, что конкретные энзиматические комплексы или модификации гистонов могут играть критическую роль на определенных этапах процесса Х-инактивации, но могут становиться менее важными или избыточными позднее, возможно, после того, как более постоянные механизмы сайленсинга, основанные на метилировании ДНК. будут помешены в нужное место. Например, метилирование H3K27, катализируемое PRC2, является существенным для успешной Х-инактивации на ранних этапах онтогенеза, но необязательным в более поздние сроки. Следует также отметить, что в ходе установления импринтированной Х-инактивации у предимплантационных эмбрионов может иметь место иной порядок событий. В частности, обогащение H3K27me3 не обнаруживается до 16-клеточной стадии, значительно позже начала экспрессии Xist (стадия 24 клеток) (Мак et al., 2004; Okamoto et al., 2004). Это может указывать на потребность в специфических, регулируемых в развитии кофакторов для рекрутирования комплекса PRC2 PcG kXL
4.5. Распространение «молчащего» хроматина
XIC является существенным для Х-инактивации, и было высказано предположение, что сайленсинг распространяется с XIC; при этом проксимальные гены сайленсируются раньше, чем более дистальные. Одним из объяснений этого могло бы быть, что Xist-РНК распространяется прогрессивно по хромосоме, начиная с сайта своего синтеза. Это согласовывалось бы с результатами экспериментов, в которых трансгены Xist вставлялись в аутосомы и где покрытие такой аутосомы Xist-РНК приводило к сайленсингу генов и изменениям хроматина (см. выше). Распространение неактивного состояния от XIC широко исследовалось в естественно случающихся транслокациях Х;аутосома. Действительно, такие транслокации прекрасно демонстрируют существование XIC (Rastan, 1983). Было показано, что хроматин, несущий характерные маркеры факультативного гетерохроматина (например, утрата ацетилирования гистонов, поздняя репликация и транскрипционный сайленсинг), распространяется от Xi в аутосомную часть гибридной хромосомы (White et al., 1998; Duthie et al., 1999; Sharp et al., 2002). Этим устанавливается важный принцип, согласно которому факультативный гетерохроматин не является исключительным для Х-хромосомы, что согласуется с результатами, полученными с трансгенами Xist, экспрессируемыми на аутосомах. Однако распространение «молчащего» хроматина по аутосомному плечу хромосомы варьирует между транслокациями и ограничено по масштабам. Существуют две модели, объясняющие ограниченное распространение сайленсинга в cis-сцепленные аутосомы. Во-первых, аутосомы могут сопротивляться начальному распространению Xist-РНК и связанного с этим сайленсинга генов в начале Х-инактивации. В качестве альтернативы можно предположить, что первоначальное распространение на аутосомы могло бы быть эффективным, но сайленсинг может плохо поддерживаться в онтогенезе, что обозначается как «распространение и отступление» [«spread and retreat»]. На сегодняшний день данные говорят в пользу «распространения и отступления», но эти две модели не исключают друг друга, и требуются дальнейшие исследования. Следует заметить, что в раннем развитии против тех клеток, в которых происходит обширный сайленсинг аутосомы, может действовать отбор из-за утраты экспрессии критичных аутосомных генов. В некоторых транслокациях Х;аутосома распространение является прерывистым, как будто бы перескакивает через определенные районы и оставляет транскрипционно активными эухроматиновые районы, окруженные «молчащими», гетерохроматиновыми районами (Sharp et al., 2002). Распространение конститутивного гетерохроматина в соседние эухроматиновые районы, приводящее к эффекту положения мозаичного типа у Drosophila (глава 5), может обнаруживать сходное поведение. Такие наблюдения легче согласовать с механизмом раннего клеточного отбора, основанным на распространении и отступлении сайленсинга, чем с непрерывным распространением стабильного сайленсинга. Предположили, что есть элементы, распределенные вдоль Х-хромосомы, называемые «путевыми станциями» [«way stations»], которые служат пунктами сборки гетерохроматина и тем самым усиливают распространение и (или) поддержание Х-инактивации (описано в: Gartler and Riggs, 1983). Эти элементы должны были бы быть менее обычными или, по крайней мере, менее регулярно распределенными на аутосомах. Было высказано предположение, что семейство обычных диспергированных повторов, длинные перемежающиеся повторы (LINES) являются хорошими кандидатами на роль «путевых станций» (Lyon, 1998, 2003). Эти повторяющиеся последовательности обычны в геномах человека и мыши, но особенно часты вдоль Х-хромосомы Более того, элементы LINE наиболее обычны в более конденсированных, бедных генами, G-бэндированных районах геномов человека и мыши, позволяя предположить, что они могут каким-то образом благоприятствовать конформации хроматина, ассоциированной с транскрипционным сайленсингом Недавнее завершение определения нуклеотидной последовательности ДНК Х-хромосомы человека выявило такое распределение элементов LINE, которое в целом согласуется с возможной ролью «путевых станций», но эта идея остается недоказанной.4.6. Уход от инактивации Х-хромосомы
Как обсуждалось ранее, известно, что ряд генов избегают инактивации. Если использовать механистические термины, уход от Х-инактивации приписали редкости «путевых станций» по соседству с этими генами или присутствию граничных элементов, блокирующих распространение Xist-PHK и (или) других компонентов сайленсинга. Имеются некоторые данные о том, что гены, избегающие инактивации, в раннем развитии являются «молчащими», по крайней мере до некоторой степени. Например, в случае гена Smcx мыши уход от инактивации варьирует в зависимости от стадии развития и от типа ткани (Sheardown et al., 1996). Это, следовательно, в большей мере согласуется с обсужденной выше идеей распространения и отступления в контексте сайленсинга аутосомных генов в транслокациях Х;А.4.7. Х-инактивация у сумчатых млекопитающих
Эутерии и сумчатые млекопитающие разошлись около 130 миллионов лет тому назад. Сумчатые, как и эутерии, используют систему детерминации пола XY (самец):ХХ (самка) и механизм компенсации дозы, в котором одна из двух женских Х-хромосом инактивирована. Как упоминалось ранее, эта неактивная X у сумчатых всегда представлена гомологом, полученным от отца (Хр). Следующее отличие сумчатых от плацентарных млекопитающих заключается в том, что степень сайленсинга генов в отдельных локусах часто варьирует в разных тканях. Имеются также некоторые данные, что нестабильность сайленсинга возрастает в ходе развития и онтогенеза. Это опять-таки напоминает модель распространения и отступления, предложенную для сайленсинга аутосомных локусов у плацентарных млекопитающих. Интересно, что обогащенность элементами LINE на Х-хромосоме возникла после расхождения эутерий и метатерий, так что возможно, что нестабильность сайленсинга на Х-хромосоме сумчатых также связывается с идеей «путевых станций». Более того, отсутствие у сумчатых метилирования в островках CpG, ассоциированных с генами, сцепленными с X, могло бы вносить дополнительный вклад в нестабильность Xi. Относительно мало известно о молекулярном механизме Х-инактивации у сумчатых и пока еще не идентифицирован у сумчатых гомолог Xist. Отсутствие гомолога Xist не исключает, конечно, существования негомологичной РНК, выполняющей ту же функцию, что и инициатор Х-инактивации, но пока ничего подобного не было найдено. Единственные два свойства, однозначно общие для неактивной X у эутерий и сумчатых млекопитающих, — поздняя репликация в фазе S и маркировка низкими уровнями ацетилирования гистона Н4 (Wakefield et al., 1997). Ввиду мужской летальности по мутациям, нарушающим компенсацию дозы у других организмов, в том числе у других млекопитающих, удивительно, что сумчатые толерантны к неполной компенсации дозы. Одно из возможных объяснений вытекает из того факта, что Х-хромосома сумчатых несет меньше генов, чем ее гомолог у плацентарных млекопитающих (Graves, 1996; Marshall Graves and Shetty, 2001). Лишь гены, находящиеся на длинном плече Х-хромосомы эутерий, присутствуют на Х-хромосоме сумчатых. Гены, находящиеся на коротком плече, у сумчатых распределены по аутосомам. Большая часть X сумчатых является, таким образом, обедненной генами и конститутивно гетерохроматиновой. Возможно, эта редукция числа генов сделала возможной толерантность некоторых типов клеток к ослаблению компенсации дозы; в то же время это ослабление недостаточно велико, чтобы организм вообще мог обходиться без компенсации. Кроме того сумчатые могут сайленсировать Xi более эффективно в раннем онтогенезе, когда различия в дозах являются, вероятно, наиболее критичными, аналогично тому, что имеет место для импринтированных локусов. Эти два объяснения могут оба играть свою роль5. Реактивация и репрограммирование Х-хромосомы
5.1. Стабильность Х-инактивации в соматических клетках
Множественные слои эпигенетических модификаций вносят свой вклад в сайленсинг неактивной Х-хромосомы, и в результате репрессированное состояние обычно очень стабильно. Иллюстрацию этого мы находим в ранних экспериментах, где прослеживали способность 5-азацитидина (5azaC), ингибитора метилирования ДНК, вызывать реверсию сайленсинга Х-хромосомы в линиях клеток XX (Mohandas et al., 1981). Наблюдали, что с низкой частотой происходит спорадическая реактивация отдельных генов. Однако анализ клеточных линий, в которых данный ген реактивировался, показал, что другие гены обычно оставались неактивными, как и вся хромосома, если судить о ней на цитогенетическом уровне. Аналогичные данные были получены с использованием TSA в качестве ингибитора деацетилаз гистонов I типа (Csankovszki et al., 2001). Спорадическая реактивация отдельных сцепленных с X генов наблюдалась также при старении у мышей. Еще резче это выражено у сумчатых, где Х-инактивация не столь стабильна и где в ходе онтогенеза происходит прогрессивная реактивация. Что можно сказать о роли Xist-РНК? Данные, полученные с использованием клеточных линий человека, продемонстрировали, что утрата района Х-хромосомы, включающей Xist, не приводит к сколько-нибудь заметной реактивации X (Brown and Willard, 1994). Эти результаты удалось подтвердить на линиях мышиных фибробластов, используя условно-нокаутную аллель Xist (Csankovszki et al., 1999). Здесь было показано, что утрата Xist приводит к делокализации вариантного гистона macroH2A с Xi. Более недавние исследования показали, что модификации гистонов, катализируемые комплексами PcG, триметилирование H3 лизина 27 и убиквитинирование H2A также утрачиваются в условно-нокаутных по Xist линиях фибробластов (Plath et al., 2004). Была выявлена редкая спорадическая реактивация отдельных генов, которая была усилена воздействием 5azaC или TSA Однако, опять-таки, не наблюдалось никакой явной реактивации всей хромосомы. Таким образом, удаление множественных эпигенетических меток сайленсинга еще не достаточно для реверсии сайленсинга всей хромосомы. Избыточность механизмов сайленсинга Xi в соматических клетках часто называют системой «сдержек и противовесов» [«belts and braces»]. Предполагается, что индивидуальные уровни эпигенетического сайленсинга являются и самоподдерживаюшимися, и поддерживаемыми с помощью механизмов положительной обратной связи. Аналогичные механизмы положительной обратной связи наблюдали и в других эпигенетических системах; например, связь поддержания метилирования гистонов и метилирования ДНК в перицентрическом гетерохроматине (главы 9 и 18).5.2. Реактивация Х-хромосомы в нормальном развитии
В то время как Х-инактивация в соматических клетках очень стабильна, существуют обстоятельства в ходе нормального развития, при которых вся Х-хромосома реактивируется. Лучше всего изученный пример — реверсия Х-инактивации в развивающихся примордиальных зародышевых клетках (PGSs, primordial germ cells). У мышей PGCs специфицируются примерно на 7—8-й день развития, вскоре после гаструляции В это время клетки эмбриона уже претерпели случайную Х-инактивацию. Впоследствии развивающиеся PGCs мигрируют вдоль района задней кишки эмбриона и приходят в генитальные гребни, структуры, дающие начало взрослым гонадам. Именно в это время PGCs реактивируют свою Xi (Monk and McLaren, 1981). Это событие совпадает во времени с более общим эпигенетическим репрограммированием, включающим стирание родительских импринтов и деметилирование ДНК по всему геному (дополнительные детали см. главу 20). Реактивация X в PGCs может указывать на специализированный механизм для ревертирования многослойной структуры гетерохроматина. Наблюдали, что исчезновение экспрессии Xist-PHК коррелирует с реактивацией X, но при условии, что сайленсинг в соматических клетках XX не зависит от Xist, не вполне очевидно, что причина в этом. Возможно, что PGCs не могут установить все метки, ассоциированные с сайленсингом, и поэтому более чувствительны к реактивации. В соответствии с этим находятся данные о том, что в развивающихся PGCs у мышей метилирование островков CpG на Xi не происходит (Grant et al., 1992). Второй пример реактивации X — это реверсия инактивации импринтированной Хр во время размещения линии ICM эмбрионов на стадии бластоцисты, обсуждавшаяся в разделе 3.5, которая, опять-таки, ассоциирована с более широким кругом явлений репрограммирования генома. Эта реактивация также коррелирует с исчезновением X/S/-PHK и утратой многих эпигенетических меток, связанных с сайленсингом.5.3. Реактивация Х-хромосомы в ходе экспериментального репрограммирования
Реактивацию X наблюдали также в специальных экспериментальных условиях. Она происходит при пересадке соматических ядер в неоплод отворенные ооциты (Eggan et al., 2000) и после слияния соматических клеток с такими тотипотентными клетками, как ES, эмбриональные зародышевые (EG) клетки или клетки эмбриональной карциномы (ЕС) (см., например, Tada et al., 2001). Эмбрионы, полученные в результате пересадки ядер, представляют особенно интересный пример. Эксперименты на мышах (Eggan et al., 2000) продемонстрировали быструю реактивацию маркерного гена на Xi у эмбрионов-трансплантатов на стадии дробления. Несмотря на это, ядро сохраняло некоторую память о том, которая X была неактивной, поскольку у клонированных эмбрионов на стадии плода Xi клетки-донора была также Xi в клетках трофэктодермы плаценты. Напротив, клетки собственно эмбриона обнаруживали случайную инактивацию X (рис. 17.9). Предположительно реактивация и репрограммирование X, происходящие в развивающихся ICM, дают эмбриону еще один шанс перенастроить эпигенетическую информацию от донорского ядра. Реактивация X в продуктах слияния соматических клеток XX и плюрипотентных эмбриональных клеток изучена хуже. Предполагается, что она происходит также в результате воздействия на соматический геном факторов, присутствующих в клетках ЕС, ES или EG Было продемонстрировано, что реактивация происходит относительно быстро, в пределах примерно 5 суток после слияния, и происходящая на высоком уровне экспрессия Xist исчезает в слившихся клетках после длительного культивирования. Причинная связь этих событий не была показана5.4. Уроки из опытов с индуцибельными трансгенами Xist
Серия экспериментов с использованием индуцибельных трансгенов Xist в клетках ES очень углубила наше понимание стабильности versus реверсибельности Х-инактивации. Во-первых, было показано, что Xist-РНК может установить Х-инактивацию в недиффернцированных клетках ES и на очень ранних стадиях дифференцировки, но не в более позднее время (Wutz and Jaenisch, 2000). Это называется «окном возможности» [«window of opportunity»]. Оказалось, что эта способность клеток реагировать на Xist-РНК в общих чертах коррелирует с обратимостью Х-инактивации. Так, сайленсинг ревертировал, когда трансген выключался в клетках ES или на ранних стадиях дифференцировки, но не на более поздних этапах дифференцировки и не в соматических клетках. Рис. 17.9. Регуляция Х-инактивации у клонированных эмбрионов мыши
Рисунок иллюстрирует донорскую клетку XX с инактивированной Х-хромосомой (А), покрытой Xist-PHК (зеленая линия) В этой модели транскрипция с донорского ядра, включая Xist-PHK, репрессирована факторами ооцита до 2-клеточной стадии, приводя к реактивации X. Затем, на 2-клеточной стадии экспрессия Xist возобновляется. Затем Xist реэкспрессируется вновь с аллели неактивной X от донорской клетки. Это можно было бы приписать сохранению такой метки, как метилирование ДНК в промоторе Xist Этот паттерн поддерживается в клетках, относящихся к линиям ТЕ и РЕ, но не в плюрипотентном эпибласте, где экспрессия Xist вновь прекращается, приводя ко второму событию реактивации. В ICM стирание эпигенетических меток, управляющих экспрессией донорского Xist, делает возможной последующую случайную Х-инактивацию в собственно эмбрионе
Рис. 17.9. Регуляция Х-инактивации у клонированных эмбрионов мыши
Рисунок иллюстрирует донорскую клетку XX с инактивированной Х-хромосомой (А), покрытой Xist-PHК (зеленая линия) В этой модели транскрипция с донорского ядра, включая Xist-PHK, репрессирована факторами ооцита до 2-клеточной стадии, приводя к реактивации X. Затем, на 2-клеточной стадии экспрессия Xist возобновляется. Затем Xist реэкспрессируется вновь с аллели неактивной X от донорской клетки. Это можно было бы приписать сохранению такой метки, как метилирование ДНК в промоторе Xist Этот паттерн поддерживается в клетках, относящихся к линиям ТЕ и РЕ, но не в плюрипотентном эпибласте, где экспрессия Xist вновь прекращается, приводя ко второму событию реактивации. В ICM стирание эпигенетических меток, управляющих экспрессией донорского Xist, делает возможной последующую случайную Х-инактивацию в собственно эмбрионе
Возвращаясь к реактивации и репрограммированию X, можно сказать, что данные по индуцибельным трансгенам означают, что в определенных клеточных условиях, а именно, в недифференцированных клетках ES. инактивация X произойдет, когда исчезает экспрессия Xist-РНК. Если мы посчитаем, что те клетки, для которых документально доказано, что в них происходит реактивация X (т. е. клетки PGCs, ICM, клетки EG и ЕС), все сходны с клетками ES в отношении плюритпотентности и пластичности, тогда прекращение экспрессии Xist может во всех случаях лежать в основе реактивации X.
6. Резюме и направления будущих исследований
В последние годы имел место значительный прогресс в нашем понимании молекулярного механизма Х-инактивации. До сегодняшнего дня этот прогресс подпитывался успехами в смежных областях эпигенетических исследований и, в свою очередь, стимулировал успехи в других областях. Примером последнего может служить растущее количество данных о том, что некоторые кластеры импринтированных генов регулируются cis-активными некодирующими РНК во многом так же, как Xist регулирует Х-хромосому (глава 19). Имеются все основания думать, что этот взаимодополняющий прогресс продолжится. Однако многие вопросы остаются без ответа, и замечательно, что несмотря на более чем 40-летние исследования мы все еще не понимаем, даже в общих чертах, механизмы, участвующие в «счете» и «выборе». Гипотеза блокирующего фактора, которой уже больше 20 лет, представляет собой привлекательное концептуальное руководство к действию, но природа самого блокирующего фактора, если он существует, остается неизвестной. Прогресс был достигнут в определении cis-действующих последовательностей и trans-действующих факторов, регулирующих счет, и их дальнейшая расшифровка является стимулирующим вызовом. Аналогичным образом, хотя мы и знаем сейчас кое-что о модифицирующих хроматин комплексах, участвующих в поддержании Х-инактивации — например, комплексах группы Polycomb, — сигнал для установления сайленсинга по всей хромосоме, включаемый Xist-РНК, остается неизвестным. Возможно в связи с этим нам необходимо понять механизм деацетилирования и деметилирования гистонов на неактивной Х-хромосоме. Необходимо найти ответы и на другие ключевые вопросы: как сайленсинг распространяется по хромосоме и какую роль в этом процессе и в стабилизации — поддержании «молчащего» состояния — играют (если играют) «путевые станции» (возможно, элементы LINE). Это может иметь отношение к интригующему вопросу о том, каким образом Х-инактивация ревертирует в некоторых типах клеток и на некоторых стадиях развития, но оказывается по существу необратимой в других случаях. Этот последний вопрос имеет отношение к более широкой и критически важной теме, связанной с пониманием пластичности генома и репрограммирования в ходе развития.Литература
Beutler Е., Yeh М. and Fairbanks V.F., 1962. The normal human female as a mosaic of X-chromosome activity: Studies using the gene for glucose-6-phosphate dehydrogenase deficiency as a marker. Proc. Natl. Acad. Sci. 48: 9-16. Brockdorff N., Ashworth A., Kay G.F., McCabe V.M., Norris D.P., Cooper P.J., Swift S., and Rastan S., 1992. The product of the mouse Xist gene is a 15 kb inactive X-specific transcript containing no conserved ORF and located in the nucleus. Cell 71: 515–526. Brown C.J. and Willard H.F., 1994. The human X-inactivation centre is not required for maintenance of X-chromosome inactivation. Nature 368: 154–156. Brown C.J., Ballabio A., Rupert J.L., Tafreniere R.G., Grompe M., Tonlorenzi R., and Willard H.F., 1991. A gene from the region of the human X inactivation centre is expressed exclusively from the inactive X chromosome. Nature 349: 38–44. Beutler E., Yeh M. and Fairbanks V.F., 1962. The normal human female as a mosaic of X-chromosome activity: Studies using the gene for glucose-6-phosphate dehydrogenase deficiency as a marker. Proc. Natl. Acad. Sci. 48: 9-16. Brockdorff N., Ashworth A., Kay G.F., McCabe V.M., Norris D.P., Cooper P.J., Swift S., and Rastan S., 1992. The product of the mouse Xist gene is a 15 kb inactive X-specific transcript containing no conserved ORF and located in the nucleus Cell 71: 515–526. Brown C.J. and Willard H.F., 1994. The human X-inactivation centre is not required for maintenance of X-chromosome inactivation. Nature 368: 154–156. Brown C.J., Hendnch B.D., Rupert J.L., Lafreniere R.G., Xing Y., Lawrence J., and Willard H.E., 1992. The human XISTgene: Analysis of a 17 kb inactive X-specific RNA that contains conserved repeats and is highly localized within the nucleus. Cell 71: 527–542. Carrel L. and Willard H.E, 2005. X-inactivation profile reveals extensive variability in X-linked gene expression in females. Nature 434: 400–404. Cattanach B.M., and Isaacson J.H., 1967. Controlling elements in the mouse X chromosome. Genetics 57: 331–346. Chadwick B.R and Willard H.E, 2004. Multiple spatially distinct types of facultative heterochromatin on the human inactive X chromosome. Proc. Natl. Acad. Sci. 101: 17450-17455. Clerc R and Avner P., 1998. Role of the region 3’ to Xist exon 6 in the counting process ofX-chromosome inactivation. Nat. Genet., 19: 249–253. Charlesworth B., 1996. The evolution of chromosomal sex determination and dosage compensation. Curr. Biol. 6: 149–162. Costanzi C. and Pehrson J.R., 1998. Histone macroH2A is concentrated in the inactive X chromosome of female mammals. Nature 393: 599–601. Csankovszki G., Nagy A., and Jaenisch R., 2001. Synergism of Xist RNA, DNA methylation, and histone hypoacetylation in maintaining X chromosome inactivation. J. Cell Biol. 153: 773–784. Csankovszki G., Panning B., Bates B., Pehrson J.R., and Jaenisch R., 1999. Conditional deletion of Xist disrupts histone macroH2A localization but not maintenance of X inactivation. Nat. Genet. 22: 323-324 Davidson R.G., Nitowsky H.M., and Childs B., 1963. Demonstration of two populations of cells in the human female heterozygous for glucoses-phosphate dehydrogenase variants. Proc. Natl. Acad. Sci. 50: 481–485. de Napoles M.. Mermoud J.E., Wakao R., Tang Y.A., Endoh M., Appanah R., Nesterova T.B., Silva J., Otte A.P., Vidal M., et al. Polycomb group proteins RinglA/B link ubiquitylation of histone H2A to heritable gene silencing and X inactivation. Dev. Cell 1: 663–676. Duthie S.M., Nesterova T.B., Formstone E.J., Keohane A.M., Turner B.M., Zakian S.M., and Brockdorf F.N., 1999. Xist RNA exhibits a banded localization on the inactive X chromosome and is excluded from autosomal material in cis. Hum. Mot Genet. 8: 195–204. Eggan K.,Akutsu H.. Hochedlinger K., Rideout W., III. Yanagimachi R., and Jaenisch R., 2000. X-chromosome inactivation in cloned mouse embryos. Science 290: 1578–1581. Eils R., Dietzel S., Bertin E., Schrock E., and Speicher M.R., 1996. Three dimensional reconstruction of painted human interphase chromosomes: Active and inactive X chromosome territories have similar volumes but differ in shape and surface structure. J. Cell. Biol. 135: 1427–1440. Epstein C.J., Smith S., Travis B., and Tucker G., 1978. BothX chromosomes function before visible X-chromosome inactivation in female mouse embryos. Nature 274: 500–502. Gartler S.M. and Riggs A.D., 1983. Mammalian X-chromosome inactivation. Annu. Rev. Genet. 17: 155–190. Grant M., Zuccotti M., and Monk M., 1992. Methylation of CpG sites of two X-linked genes coincides with X-inactivation in the female mouse embryo but not in the germ line. Nat. Genet. 2: 161–166. Graves J.A., 1996. Mammals that break the rules: Genetics of marsupials and monotremes. Annu. Rev. Genet. 30: 233–260. Heard E., Mongelard E., Arnauld D., Chureau C., Vourch C., and Avner P., 1999. Human XIST yeast artificial chromosome transgenes show partial X inactivation center function in mouse embryonic stem cells. Proc. Natl. Acad. Sci. 96: 6841–6846. Heard E., Rougeulle C., Amaud D., Avner P., Allis C.D., and Spector D.L., 2001. Methylation of histone H3 at lys-9 is an early mark on the X chromosome during X inactivation. Cell 107: 727–738. Huynh K.D. and Lee J.T, 2003. Inheritance of a pre-inactivated paternal X chromosome in early mouse embryos. Nature 426: 857–862. Jeppesen P. and Turner B.M., 1993. The inactive X chromosome in female mammals is distinguished by a lack of histone H4 acetylation: A cytogenetic marker for gene expression. Cell 74: 281–289. Keohane A.M., Belyaev N.D., Lavender J.S., O’Neill L.P., and Turner B.M., 1996. X-inactivation and H4 acetylation in embryonic stem cells. Dev. Biol. 180: 618–630. LachnerM., O’Sullivan R.J., andJenuwein T., 2003. An epigenetic road map for histone lysine methylation. J. Cell Sci. 116: 2117–2124. Lee J.T., 2000. Disruption of imprinted X inactivation by parent-of-origin effects at Tsix. Cell 103: 17–27. Lee J.T. and Lu N.E., 1999. Targeted mutagenesis of Tsix leads to nonrandom X inactivation. Cell 99: 47–57. Lee J.T., DavidowL.S., andWarshawsky D., 1999. Tsix, a gene antisense to Xist at the X-inactivation centre. Nat. Genet. 21: 400–404. Lee J.T., Strauss W.M., Dausman J.A., and Jaenisch R., 1996. A 450 kb transgene displays properties of the mammalian X-inactivation center. Cell 86: 83–94. Lock L.E., Takagi N., and Martin G.R., 1987. Methylation of the Hprt gene on the inactive X occurs after chromosome inactivation. Cell 48: 39–46. Lyon M.F., 1961. Gene action in the X-chromosome of the mouse (Mus musculus L.). Nature, 190: 372–373. Lyon M.F., 1998. X-chromosome inactivation: A repeat hypothesis. Cytogenet. Cell Genet. 80: 133–137. Lyon M.F., 2003. The Lyon and the LINE hypothesis. Semin. Cell Dev. Biol. 14: 313–318. Maison C., Bailly D., Peters A.H., Quivy J.P., Roche D., Taddei A., Lachner M., Jenuwein T., and Almouzni G., 2002. Higher-order structure in pericentric heterochromatin involves a distinct pattern of histone modification and an RNA component. Nat. Genet. 30: 329–334. Mak W., Nesterova T.B., de Napoles M., Appanah R., Yamanaka S., Otte A. P., and Brockdorff N., 2004. Reactivation of the paternal X chromosome in early mouse embryos. Science 303: 666–669. Marin I., Siegal M.L., and Baker B.S., 2000. The evolution of dosage-compensation mechanisms. BioEssays 22: 1106–1114. Marshall Graves J.A. and Shetty S., 2001. Sex from W to Z: Evolution of vertebrate sex chromosomes and sex determining genes. J. Exp. Zool. 290: 449–462. McElreavey K., Barbaux S., Ion A., and Fellous M., 1995. The genetic basis of murine and human sex determination: A review. Heredity 75: 599–611. Mermoud J.E., Costanzi C., Pehrson J.R., and Brockdorff N., 1999. Histone MacroH2A1.2 relocates to the inactive X chromosome after initiation and propagation of X-inactivation. J. Cell Biol. 147: 1399–1408. Mohandas T., Sparkes R.S., and Shapiro L.J., 1981. Reactivation of an inactive human X chromosome: Evidence for X inactivation by DNA methylation. Science 211: 393–396. Monk M. and Harper M.I., 1979. Sequential X chromosome inactivation coupled with cellular differentiation in early mouse embryos. Nature 281: 311–313. Monk M. and McLaren A., 1981. X-chromosome activity in foetal germ cells of the mouse. J. Embryol. Exp. Morphol. 63: 75–84. Nesterova T.B., Johnston C.M., Appanah R., Newall A.E.T., Godwin J., Alexiou M., and Brockdorff N., 2003. Skewing X chromosome choice by modulating sense transcription across the Xist locus. Genes Dev. 17: 2177–2190. Norris D.R, Patel D., Kay G.F., Penny G.D., Brockdorff N., Sheardown S.A., and Rastan S., 1994. Evidence that random and imprinted Xist expression is controlled by preemptive methylation. Cell 77: 41–51. Ohno S., 1967. Sex chromosomes and sex-linked genes. Springer-Verlag, Berlin pp. 1-140. Okamoto I., Otte A.P., Allis C.D., Reinberg D., and Heard E., 2004. Epigenetic dynamics of imprinted X inactivation during early mouse development. Science 303: 644–649. Okamoto I., Arnaud D., Le Baccon P., Otte A.P., Disteche C.M., Avner P., and Heard E., 2005. Evidence for de novo imprinted X-chromosome inactivation independent of meiotic inactivation in mice. Nature 438: 297–298. O’Neill L.P., Randall T.E., Lavender J., Spotswood H.T., Lee J.T., and Turner B.M., 2003. X-linked genes in female embryonic stem cells carry an epigenetic mark prior to the onset of X inactivation. Hum. Mol. Genet. 12: 1783–1790. O’Neill L.P., Keohane A.M., Lavender J.S., McCabe V., Heard E., Avner P., Brockdorff N., and Turner B.M., 1999. A developmental switch in H4 acetylation upstream of Xist plays a role in X chromosome inactivation. EMBO J. 18: 2897–2907. Panning B., Dausman J. and Jaenisch R., 1997. X chromosome inactivation is mediated by Xist RNA stabilization. Cell 90: 907–916. Penny G.D., Kay G.F., Sheardown S.A., Rastan S., and Brockdorff N., 1996. Requirement for Xist in X chromosome inactivation. Nature 379: 131–137. Perche P.Y., Vourc’h C., Konecny L., Souchier C., Robert-Nicoud M., Dimitrov S., and Khochbin S., 2000. Higher concentrations of histone macroH2A in the Barr body are correlated with higher nucleosome density. Curr Biol. 10: 1531–1534. Plath K., Talbot D., Harrier K.M., Otte A.P., Yang T.P., Jaenisch R., and Panning B., 2004. Developmentally regulated alterations in Polycomb repressive complex 1 proteins on the inactive X chromosome. J. Cell Biol 167: 1025–1035. Plath K., Fang J., Mlynarczyk-Evans S.K., Cao R., Worringer K.A., Wang H., de la Cruz C.C., Otte A.P., Panning B., and Zhang Y., 2003. Role of histone H3 lysine 27 methylation in X inactivation. Science 300: 131–135. Rasmussen T.P., Wutz A.P., Pehrson J.R., and Jaenisch R.R., 2001. Expression of Xist RNA is sufficient to initiate macrochromatin body formation. Chromosoma 110: 411–420. Rastan S., 1983. Non-random inactivation in mouse X-autosome translocation embryos — Location of the inactivation centre. J. Embryol. Exp. Morphol. 78: 1-22. Rougeulle C., Chaumeil J., Sarma K., Allis C.D., Reinberg D., Avner P., and Heard E., 2004. Differential histone H3 Lys-9 and Lys-27 methylation profiles on the X chromosome. Mol. Cell. Biol. 24: 5475-5484 Sado T., Okano M., Li E., and Sasaki H., 2004. De novo DNA methylation is dispensable for the initiation and propagation of X chromosome inactivation. Development 131: 975–982. Sado T., Fenner M.H., Tan S.S., Tam P., Shioda T., and Li E., 2000. X inactivation in the mouse embryo deficient for Dnmtl: Distinct effect of hypomethylation on imprinted and random X inactivation. Dev. Biol. 225: 294–303. Sharman G. B., 1971. Late DNA replication in the paternally derived X chromosome of female Kangaroos. Nature 230: 231–232. Sharp A.J., Spotswood H.T., Robinson D.O., Turner B.M., and Jacobs P.A., 2002. Molecular and cytogenetic analysis of the spreading of X inactivation in X;autosome translocations. Hum. Mol. Genet. 11: 3145–3156. Sheardown S., Norris D., Fisher A., and Brockdorff N., 1996. The mouse Smcx gene exhibits developmental and tissue specific variation in degreee of escape from X inactivation. Hum. Mol. Genet. 5: 1355–1360. Sheardown S.A., Duthie S.M., Johnston C.M., Newall A.E.T., Form-stone E.J., Arkell R.M., Nesterova T.B., Alghisi G.-C., Rastan S., and Brockdorff N., 1997. Stabilization of Xist RNA mediates initiation of X chromosome inactivation. Cell 91: 99-107. Silva J., Mak W., Zvetkova 1., Appanah R., Nesterova T.B., Webster Z., Peters A. H.F.M.. Jenuwein T.. Otte A.P., and Brockdorff N., 2003. Establishment of histone H3 methylation on the inactive X chromosome requires transient recruitment of Eed-Enxl polycomb group complexes. Dev. Cell 4: 481–495. Smith K.P., Byron M., Clemson C.M., and Lawrence J.B., 2004. Ubiquitinated proteins including uH2A on the human and mouse inactive X chromosome: Enrichment in gene rich bands. Chromosoma 113: 324–335. Tada M., Takahama Y., Abe K., Nakatsuji N., and Tada T., 2001. Nuclear reprogramming of somatic cells by in vitro hybridization with ES cells. Curr. Biol. 11: 1553–1558. Tada T., Obata Y., Tada M., Goto Y., Nakatsuji N., Tan S.S., Kono T., and Takagi N., 2000. Imprint switching for non-random X-chromosome inactivation during mouse oocyte growth. Development 127: 3101–3105. Takagi N. and Sasaki M., 1975. Preferential inactivation of the paternally derived X chromosome in the extraembryonic membranes of the mouse. Nature 256: 640–642. Turner J.M., Mahadevaiah S.K., Femandez-Capetillo O., Nussenzweig A., XuX., Deng C.X., and Burgoyne P.S., 2005. Silencing of unsynapsed meiotic chromosomes in the mouse. Nat. Genet. 37: 41–47. Wakefield M.J., Keohane A.M., Turner B.M., and Marshall Graves J.A., 1997. Histone underacetylation is an ancient component of mammalian X chromosome inactivation. Proc. Natl. Acad. Sci. 94: 9665–9668. White W.M., Willard H.F., Van Dyke D.L., and Wolff D.J., 1998. The spreading of X inactivation into autosomal material of an X; auto-some translocation: Evidence for a difference between autosomal and X chromosomal DNA. Am. J. Hum. Genet. 63: 20–28. Wutz A. and Jaenisch R., 2000. A shift from reversible to irreversible X inactivation is triggered during ES cell differentiation Mol. Cell 5: 695–705. Wutz A., Rasmussen T.P., and Jaenisch R., 2002 Chromosomal silencing and localization are mediated by different domains of Xist RNA. Nat. Genet. 30: 167–174.Глава 18. Метилирование ДНК у млекопитающих
 En Li1 и Adrian Bird2
1Novartis Institutes for BioMedical Research, Inc., Cambridge, Massachusetts 02139
2The Wellcome Trust Centre for Cell Biology, University of Edinburgh, Edinburgh, EH93JR, United Kingdom
En Li1 и Adrian Bird2
1Novartis Institutes for BioMedical Research, Inc., Cambridge, Massachusetts 02139
2The Wellcome Trust Centre for Cell Biology, University of Edinburgh, Edinburgh, EH93JR, United Kingdom
Общее резюме
ДНК позвоночных животных ковалентно модифицируется метилированием цитозина (основания) в динуклеотидной последовательности 5’CpG3. CpG — это сокращение для цитозина и гуанина, разделенных фосфатом, связывающим эти два нуклеотида вместе в ДНК. У млекопитающих паттерны метилирования устанавливаются в ходе эмбрионального развития и поддерживаются механизмом копирования при делении клеток. Наследуемость паттернов метилирования ДНК делает эпигенетическую маркировку стабильной в ряду многих клеточных делений и, следовательно, составляет одну из форм клеточной памяти. Молекулярные и генетические исследования показали, что метилирование цитозина в ДНК связано с сайленсингом гена и играет важную роль в процессах развития, таких как инактивация Х-хромосомы и геномный импринтинг. Метальная часть метилцитозина находится в большой бороздке спирали ДНК, где многие связывающиеся с ДНК белки могут контактировать с ДНК; она осуществляет свое влияние путем притягивания или отталкивания связывающихся с ДНК белков. Было показано, что семейство белков, способных связываться с ДНК, содержащей метилированные динуклеотиды CpG и известных как метил-CpG-связывающиеся белки, рекрутирует репрессорные комплексы к метилированным промоторным участкам и тем самым вносит определенный вклад в транскрипционный сайленсинг. Некоторые транскрипционные факторы связываются с содержащими CpG нуклеотидными последовательностями ДНК только тогда, когда они не метилированы. В этих случаях метилирование CpG может препятствовать связыванию белка и влияет на транскрипцию. Удаление генетическими методами генов, кодирующих ДНК-метилтрансферазы или белки, связывающиеся с метил-CpG, дало возможность выявить разнообразные функции метилирования ДНК в развитии млекопитающих. Установление нормальных паттернов метилирования генома играет существенную роль в эмбриональном развитии. Метилирование ДНК необходимо для поддержания дифференциальной экспрессии отцовской и материнской копий генов, подверженных геномному импринтингу, и для стабильного сайленсинга генов на неактивной Х-хромосоме. Кроме того, от метилирования ДНК зависят стабильная транскрипционная репрессия провирусных геномов и эндогенных ретротранспозонов. Мы знаем примеры участия метилирования ДНК в установлении и поддержании тканеспецифичных паттернов экспрессии генов в ходе развития. Имеются также данные о том, что отсутствие метилирования ДНК уменьшает надежность поддержания числа хромосом, что приводит к повышенной частоте их утери. Значение метилирования ДНК для клиники впервые стало очевидным в связи с раковыми заболеваниями. Пониженные уровни метилирования ДНК, достигнутые либо благодаря генетическим манипуляциям, либо воздействием ингибиторов ДНК-метилтрансферазы, приводят к подавлению некоторых форм опухолей у мышей. Напротив, образование других типов опухолей усиливается при низких уровнях метилирования ДНК Несколько других заболеваний человека удалось связать с мутациями генов, кодирующих критичные компоненты механизма метилирования ДНК. Мутации ДНК-метилтрансферазы Dnmt3b приводят к иммунодефициту, а мутации белка МеСР2, связывющегося с метил-CpG, вызывают серьезное нейрологическое расстройство, известное как синдром Ретта. Совершенно очевидно, что целостность системы метилирования ДНК имеет первостепенное значение для здоровья млекопитающих. Хотя паттерны метилирования ДНК могут передаваться от клетки к клетке, они не являются постоянными. В действительности на пртяжении жизни особи могут происходить изменения в паттернах метилирования ДНК. Некоторые изменения могут быть физиологической реакцией на изменения внешней среды, тогда как другие могут быть связаны с патологическим процессом, например онкогенной трансформацией или клеточным старением. Однако внутренние и внешние факторы, индуцирующие изменения в метилировании ДНК, остаются, в основном, неизвестными. Исследование метилирования ДНК при заболеваниях человека представляет новую важную область медицины и несомненно внесет свой вклад в наше понимание влияния эпигенетических модификаций на жизнь человека.1. Механизм клеточной памяти
1.1. Гипотеза
В клетках млекопитающих метилирование цитозина происходит преимущественно в динуклеотидах CpG (рис. 18.1). Мысль о том, что метилирование ДНК у животных могло бы представлять механизм клеточной памяти, возникла независимо в двух лабораториях (Holliday and Pugh, 1975; Riggs, 1975). Отдавая себе отчет в том, что динуклеотид CpG является самокомплементарным, обе группы предположили, что паттерны метилированных и неметилированных CpG могли бы копироваться при делении клеток. Сразу же после репликации ДНК родительская нить ДНК сохраняла бы свой паттерн модифицированных цитозинов, но вновь синтезированная нить была бы немодифицированной. Для того чтобы обеспечить копирование родительского паттерна на эту дочернюю нить, они постулировали существование «поддерживающей метилтрансферазы», которая метилировала бы исключительно те CpG, которые спарены основаниями с метилированным родительским CpG. Неметилированные CpG не являлись бы субстратом для поддерживающей метилтрансферазы (рис. 18.2). Следствием работы этого простого механизма была бы полуконсерватавная репликация паттернов метилирования ДНК, подобно нуклеотидной последовательности самой ДНК1.2. Данные о наследуемых паттернах метилирования
Паттерн метилирования ДНК в единичном геномном локусе первоначально был установлен с помощью рестрикционных эндонуклеаз, чувствительных к метилированию ДНК. Рис. 18.1. Метилирование цитозинов в ДНК
(а) добавление метильной группы (красный цвет) в положении 5 пиримидинового кольца цитозина (черная стрелка) стерически не интерферирует со спариванием оснований ПС (голубые линии). ДНК-метилтрансферазы ковалентно связываются с углеродом в положении 6 (зеленая стрелка) во время переноса метильной группы (б) Модель В-формы ДНК, метилированной по цитозинам в двух самокомплементарных последовательносях CpG. Спаренные метальные части (пурпурный и желтый цвета) лежат в большой бороздке двойной спирали
Рис. 18.1. Метилирование цитозинов в ДНК
(а) добавление метильной группы (красный цвет) в положении 5 пиримидинового кольца цитозина (черная стрелка) стерически не интерферирует со спариванием оснований ПС (голубые линии). ДНК-метилтрансферазы ковалентно связываются с углеродом в положении 6 (зеленая стрелка) во время переноса метильной группы (б) Модель В-формы ДНК, метилированной по цитозинам в двух самокомплементарных последовательносях CpG. Спаренные метальные части (пурпурный и желтый цвета) лежат в большой бороздке двойной спирали
Многие из этих ферментов не могут расщеплять сходные распознаваемые ими последовательности в ДНК, если имеет место метилирование специфического основания. Паттерн метилированных и неметилированных сайтов был картирован в генах рибосомной РНК Xenopus laevis с помощью таких энзимов, о которых известно, что они расщепляют ДНК по сайтам, содержащим CpG, но блокированы метилированием цитозинов (Bird and Southern, 1978). Нашли, что на конкретной нити ДНК большинство CpG метилированы, но что неметилированные сайты распределены случайным образом. Существенно, что эти сайты были всегда симметричными. Другими словами, либо оба CpG в комплементарной паре были метилированы, либо ни один из них не был метилирован (Bird, 1978). Это открытие вполне соответствовало предсказаниям, сделанным на основе модели поддержания (Holliday and Pugh, 1975; Riggs, 1975). Более прямая проверка наследуемости паттернов метилирования Д Н К стала возможной при использовании трансфекции искусственно метилированной ДНК в культивируемые клетки (Wigler, 1981). Неметилированные плазмиды обычно не становятся метилированными, даже после многих клеточных поколений. Однако плазмиды, которые были метилированы по сайтам CCGG метилтрансферазой M.Hpall, сохраняют свой метилированный статус на протяжении многих поколений, хотя надежность этого процесса, по крайней мере у культивируемых клеток, меньше 100 %.
1.3. Поддерживающая ДНК-метилтрансфераза млекопитающих
Прогресс в понимании любого биологического процесса на молекулярном уровне зависит от выделения ключевых игроков. Активность ДНК-метилтрансферазы была довольно рано обнаружена в грубых клеточных экстрактах, но в конечном счете ее удалось очистить как белок с массой, 200 кД (Bestor and Ingram, 1983). Фермент Dnmtl специфичен для CpG и обладает значительной активностью против неметилированной ДНК. Однако предпочтительным ДНК-субстратом для него является ДНК, метилированная по CpG только на одной нити (так называемая полуметилированная ДНК), в силу этого свойства казалось возможным, что это поддерживающая ДНК-метилтрансфераза. Последующие исследования существенно подкрепили этот взгляд, поскольку инактивация Dnmtl в эмбриональных стволовых клетках мыши (табл. 18.1) ведет к утрате метилирования CpG по всему геному (Li et al., 1992). Имеющиеся данные согласуются с точкой зрения, согласно которой Dnmtl поддерживает метилирование ДНК по CpG, завершая метилирование полуметилированных сайтов, как постулировали Риггс с Холлидеем и Пью (рис. 18.2).2. Происхождение паттернов метилирования ДНК
2.1. De novo метилирование ДНК у ранних эмбрионов
Нам необходимо понять не только то, каким образом паттерны метилирования ДНК стабильно поддерживаются, но и то, как они вообще возникают Ранние эксперименты по трансфекции клеток показали, что неметилированная ДНК, введенная в культивируемые соматические клетки, имеет тенденцию оставаться в неметилированном состоянии спустя много клеточных делений. С другой стороны, ретровирусные провирусы и другие трансгены, введенные мышиным предимплантапионным эмбрионам, становятся стабильно метилированными в клетках животного (Jahner et al., 1982). Это позволяло предполагать, что процесс de novo метилирования ДНК ограничен тотипотентными стадиями эмбриогенеза. Эта идея была проверена с помощью клеток эмбриональной карциномы (ЕС) мышей и, впоследствии, эмбриональных стволовых (ES) клеток в качестве модельной системы. Ретровирусная ДНК была неинфекционной, будучи введенной в эти клетки, в противоположность соматическим клеткам, которые поддерживали инфекционный цикл вируса (Stewart et al., 1982). Кроме того, провирусная ДНК становилась метилированной по динуклеотидам CpG, а уменьшение метилирования путем клонирования их метилированных геномов в бактериях (и тем самым стирание метилирования ДНК) восстанавливало способность к экспрессии вирусного гена. Эти результаты показывали, что метилирование ДНК может сайленсировать экспрессию вирусного генома in vivo, а также что эмбриональные клетки действительно обладают способностью метилировать ДНК de novo. Первоначально была известна только одна ДНК-метилтрансфераза, Dnmt 1, и поэтому считалось, что этот фермент способен de novo метилировать ДНК на этих стадиях развития. Делеция гена Dnmtl, однако, не интерферирует с de novo метилированием провирусной ДНК в ES-клетках (Lei et al., 1996), доказывая, что работают другие ДНК-метилтрансферазы.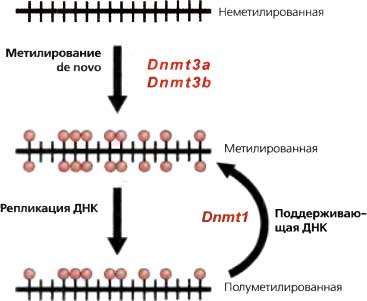 Рис. 18.2. Метилирование de novo и поддерживающее метилирование ДНК
Отрезок геномной ДНК показан как линия с самокомплементарными парами CpG, маркированными как вертикальные штрихи. Неметилированная ДНК (верхняя часть рисунка) становится метилированной “de novo” благодаря Dnmt3a и Dnmt3b и дает в результате симметричное метилирование в определенных парах CpG. После полуконсервативной репликации ДНК дочерняя нить ДНК спарена основаниями с одной из метилированных родительских нитей (другой продукт репликации не показан). Симметрия восстанавливается поддерживающей ДНК-метилтрансферазой Dnmtl, которая завершает метилирование полуметилированных сайтов, но не метилирует немодифицированные CpG
Рис. 18.2. Метилирование de novo и поддерживающее метилирование ДНК
Отрезок геномной ДНК показан как линия с самокомплементарными парами CpG, маркированными как вертикальные штрихи. Неметилированная ДНК (верхняя часть рисунка) становится метилированной “de novo” благодаря Dnmt3a и Dnmt3b и дает в результате симметричное метилирование в определенных парах CpG. После полуконсервативной репликации ДНК дочерняя нить ДНК спарена основаниями с одной из метилированных родительских нитей (другой продукт репликации не показан). Симметрия восстанавливается поддерживающей ДНК-метилтрансферазой Dnmtl, которая завершает метилирование полуметилированных сайтов, но не метилирует немодифицированные CpG
2.2. Открытие de novo метилтрансфераз
Все известные прокариотические цитозиновые ДНК-метилтрансферазы обладают общим набором диагностических белковых мотивов (Postfai et al., 1989). Эти особенности были обнаружены и у поддерживающей ДНК-метилтрансферазы Dnmtl. Поиски в базах данных по тегам экспрессируемых последовательностей (EST) выявили три транскрипта, которые потенциально могли кодировать дополнительные ДНК-метилтрансферазы (рис. 18.3). Один из кандидатов, белок Dnmt2, обладает миниальной ДНК-метилтрансферазной активностью in vitro и его отсутствие не оказывает никакого заметного влияния на уровни метилирования ДНК. Другие два кандидата, Dnmt3a и Dnmt3b, кодировали родственные каталитически активные полипептиды, которые, в отличие от Dnmtl, in vitro не проявляли никакого предпочтения в отношении метилирования полуметилированной ДНК (Okano et al., 1998). Дизрупция генов, кодирующих Dnmt3a и Dnmt3b у мышей, подтвердила, что эти белки представляют собой недостающие de novo метилтрансферазы (табл. 18.1), поскольку ES-клетки и эмбрионы, лишенные этих белков, были неспособны к метилированию de novo провирусных геномов и повторяющихся элементов (Okano et al., 1999). Более того, мужские и женские зародышевые клетки, лишенные белка Dnmt3a или ассоциированного регуляторного фактора, Dnmt3L, не могли установить отличающиеся паттерны метилирования в импринтированных генах (табл. 18.1) (Hata et al., 2002; Kaneda et al., 2004). В то время как инактивация и Dnmt3a, и Dnmt3b приводила к ранней эмбриональной летальности, утрата любого из этих генов вызывала серьезные дефекты, приводящие к постнатальной (Dnmt3a) или эмбриональной (Dnmt3b) летальности. Доказательства аналогичной роли у человека появились с открытием, согласно которому синдром ICF, редкое состояние, характеризующееся иммунодефицитом, центромерной нестабильностью и лицевыми аномалиями, связан с мутациями в гене, кодирующем Dnmt3b (Ehrlich, 2003). Анализ геномной ДНК лимфобластоидных клеток, взятых от больных ICF, показало пониженный уровень метилирования генома, особенно в повторяющихся последовательностях ДНК, ассоциированных с перицентромерными районами хромосом.2.3. Островки CpG и паттерны метилирования ДНК
ДНК из соматических тканей млекопитающих метилирована в 70 % всех сайтов CpG (Ehrlich, 1982). Исследования по картированию (см. врезку на с. 338) показывают, что в число высокометилированных последовательностей входят сателлитные ДНК, повторяющиеся элементы, в том числе транспозоны и их инертные остатки, неповторяющаяся межгенная ДНК и экзоны генов. Среди этих категорий нуклеотидных последовательностей ДНК при метилировании, по-видимому, нет очевидного предпочтения последовательностей какого-то одного типа по сравнению с другим. CpG в сателлитных ДНК метилируются в общем в той же степени, что и CpG в перемещающихся элементах или экзонах. Таким образом, большинство последовательностей метилируются в соответствии с частотой находящихся в них динуклеотидов CpG, которая обычно отражает состав их оснований. Ключевыми исключениями из этого глобального метилирования являются островки CpG. Островки CpG были выявлены как фракция ДНК позвоночных, которая необычно часто расщепляется рестрикционными ферментами, чувствительными к метилированию ДНК (Cooper et al., 1983). Клонирование этих так называемых «крохотных HpaII-фрагементов» показало, что они происходят из последовательностей, обогащенных CpG и имеющих длину около 1 т. п.н., которые не метилированы в зародышевых клетках, у ранних эмбрионов и обычно также во всех соматических тканях (Bird et al.. 1985). Островки CpG (рис. 18.4) являются поэтому исключением из «глобального» метилирования CpG, преобладающего в большей части генома млекопитающих. Ранние работы по картированию промоторов индивидуальных генов выявили районы, обогащенные GC, вблизи промоторов генов (McKeon et al., 1982), и сейчас очевидно, что большинство (если не все) островки CpG маркируют промоторы и 5’-домены генов. Приблизительно 60 % генов человека имеют промоторы с островками CpG.Таблица 18.1. Функции ДНК-метилтрансфераз млекопитающих

2.4. Динамические изменения в паттернах метилирования ДНК в ходе развития
Паттерны метилирования ДНК обнаруживают видимое общее постоянство при исследовании разных типов соматических клеток, хотя локальные изменения в специфических последовательностях ДНК очевидны. Например, островки CpG на одной Х-хромосоме в большом числе становятся de novo метилированными в ходе эмбрионального процесса инактивации Х-хромосомы у самок плацентарных млекопитающих (Wolf et al., 1984). Этот процесс имеет существенное значение для надежного сайленсинга генов на инактивированной хромосоме (рис. 18.4), потому что дефектные по метилированию ДНК мыши или клетки обнаруживают частую транскрипционную реактивацию генов, сцепленных с Х-хромосомой. В транскрипционную активацию некоторых генов во время дифференцировки также вовлечена запрограммированная утрата метилирования ДНК. Например, ген interleukin-2 утрачивает метилирование CpG в своем промоторном районе по мере того, как этот ген становится экспрессируемым в ходе дифференцировки Т-клеток (Bruniquel and Schwartz, 2003). Это деметилирование оказывается существенным предварительным условием для активации гена и является поэтому ключевой частью программы дифференцировки Т-клеток. Рис. 18.3. Метилтрансферазы ДНК у млекопитающих
Каталитические домены членов семейства Dnmtl, Dnmt2 и Втье3 консервативны (сигнатурные мотивы, I, IV, VI, IX и X, наиболее консервативны во всех нитозиновых метилтрансферазах), но между их аминотерминальными регуляторными доменами сходства мало. (PCNA) взаимодействующий с PCNA домен; (NLS) сигнал ядерной локализации; (RFT) домен, «нацеливающий» на фокусы репликации; (СХХС) богатый цистеином домен, который, как предполагается, связывается с последовательностями ДНК, содержащими динуклеотиды CpG; (ВАН) домен «bromo-adjacent homology», участвующий в белок-белковых взаимодействиях; (PWWP) домен, содержащий высококонсервативный мотив «пролин-триптофан-триптофан-пролин». участвующий в ассоциации с гетерохроматином; (ATRX) родственный ATRX богатый цистеином район, содержащий «цинковый палец» С2-С2 и атипичный домен PHD, участвующий в белок-белковых взаимодействиях
Рис. 18.3. Метилтрансферазы ДНК у млекопитающих
Каталитические домены членов семейства Dnmtl, Dnmt2 и Втье3 консервативны (сигнатурные мотивы, I, IV, VI, IX и X, наиболее консервативны во всех нитозиновых метилтрансферазах), но между их аминотерминальными регуляторными доменами сходства мало. (PCNA) взаимодействующий с PCNA домен; (NLS) сигнал ядерной локализации; (RFT) домен, «нацеливающий» на фокусы репликации; (СХХС) богатый цистеином домен, который, как предполагается, связывается с последовательностями ДНК, содержащими динуклеотиды CpG; (ВАН) домен «bromo-adjacent homology», участвующий в белок-белковых взаимодействиях; (PWWP) домен, содержащий высококонсервативный мотив «пролин-триптофан-триптофан-пролин». участвующий в ассоциации с гетерохроматином; (ATRX) родственный ATRX богатый цистеином район, содержащий «цинковый палец» С2-С2 и атипичный домен PHD, участвующий в белок-белковых взаимодействиях
Картирование метилирования ДНК Чтобы понять функции метилирования ДНК, необходимо сначала выяснить, где оно происходит в геноме. Для этого существуют несколько методов, каждый из которых имеет свои преимущества и недостатки. ¦ Поскольку метилирование ограничено в основном последовательностями CpG, для картирования широко использовали расщепление рестрикционными ферментами, распознающими содержащие CpG нуклеотидные последовательности ДНК (Bird and Southern, 1978). Преимущество этого метода заключается в том, что можно протестировать большие участки генома, но он ограничен динуклеотидами CpG, которые обнаруживаются в сайтах рестрикционных ферментов. ¦ Надежный метод тестирования всех цитозинов в данном участке включает бисульфитную модификацию однонитевой ДНК (Frommer et al., 1992). Это приводит к дезаминированию немодифицированных цитозинов, но 5-метилцитозин остается защищенным. В результате цитозины, сохраняющиеся после обработки бисульфитом, идентифицируются как метилированные. Благодаря своей высокой разрешающей способности и позитивной идентификации метилированных цитозинов этот метод является предпочтительным для анализа паттернов метилирования ДНК, хотя детальный анализ больших участков занимает много времени. ¦ Несколько методов, базирующихся на ПЦР, которые зависят от предшествующей бисульфитной обработки, были разработаны для того, чтобы ускорить анализ интересующих исследователя районов (см., например, Herman et al., 1996). Эти методы очень удобны, но, фокусируясь на нескольких немногих сайтах CpG, они жертвуют детальной информацией, которая была бы получена при бисульфитном секвенировании. ¦ Недавно для картирования метилирования ДНК были использованы микрочипы (microarrays). Например, ДНК, устойчивая к деградации специфичной к 5-метилцитозину нуклеазой МсгВС, может быть использована как зонд для работы с последовательностями геномной ДНК методом tiled arrays, чтобы получить общую картину уровня метилирования в специфическом участке (Martienssen et al., 2005). Можно также провести иммунопреципитацию зондов для tiled arrays, используя специфичные к 5-метилцитозину антитела, что позволяет получить общую картину уровней метилирования ДНК (Weber et al., 2005).
2.5. Активное деметилирование зиготического отцовского генома
Помимо этих локальных изменений в метилировании ДНК имеет место значительное изменение уровней глобального метилирования ДНК в оплодотворенном яйце. Анализ уровней метилирования хромосомной ДНК с использованием анти-5-метилцитозиновых антител первоначально показал, что один хромосомный набор на ранних стадиях эмбрионального дробления удивительным образом дефектен в отношении метилирования ДНК (Rougier et al., 1998). Происхождение этого различия обнаружили, изучая зиготу до слияния материнского и отцовского пронуклеусов и используя для этого иммуноокрашивание 5-метилцитозина (Mayer et al., 2000). Вначале и материнский, и отцовский пронуклеусы демонстрировали равное окрашивание, что позволяло предполагать, что геномы яйцеклетки и спермия имели, грубо говоря, эквивалентные уровни метилирования цитозинов. Однако через несколько часов после оплодотворения наблюдали резкую утерю 5-метилцитозинов исключительно из отцовского генома. Бисульфитное секвенирование подтвердило, что один из двух геномов действительно деметилирован. Механизм утраты метилирования ДНК неизвестен, но он должен включать «активное» удаление этой модификации, поскольку в этот период нет никакой репликации ДНК. Интересно, что материнский геном тоже теряет метилирование ДНК в раннем эмбриогенезе, но в этом случае процесс является «пассивным» благодаря отсутствию поддерживающего метилирования ДНК во время ранних делений дробления. В целом предполагается, что в этот период удаляется более половины всего геномного метилирования. Затем, при имплантации происходит реметилирование, зависящее от Dnmt3a и Dnmt3b. Об активном деметилировании ДНК сообщалось и в нескольких других случаях. Например, деметилирование промотора гена interleukin-2 в дифференцирующихся Т-хэлперных клетках (см. выше и: Bruniquel and Schwartz, 2003) происходит быстро и в отсутствие репликации ДНК. Сравнимый эффект был воспроизведен искусственно в системе ооцита лягушки, где сайленсированный, метилированный ген Oct-4 млекопитающего можно было транскрипционно реактивировать посредством процесса, зависящего от предшествующего деметилирования этого гена (Simonsson and Gurdon, 2004) Эта стадия, по-видимому, установлена для изоляции самой деметилазы. Рис. 18.4. Островки CpG
Островки CpG — это участки высокой плотности CpG, лишенные метилирования CpG, обнаруживаемого на промоторах большинства генов человека Долговременный сайленсинг гена может быть обеспечен метилированием района островков CpG. Например, таким путем сайленсированы гены на неактивной Х-хромосоме и некоторые импринтированные гены. Кроме того, некоторые гены в раковых клетках аберрантно сайленсированы метилированием островков CpG
Рис. 18.4. Островки CpG
Островки CpG — это участки высокой плотности CpG, лишенные метилирования CpG, обнаруживаемого на промоторах большинства генов человека Долговременный сайленсинг гена может быть обеспечен метилированием района островков CpG. Например, таким путем сайленсированы гены на неактивной Х-хромосоме и некоторые импринтированные гены. Кроме того, некоторые гены в раковых клетках аберрантно сайленсированы метилированием островков CpG
2.6. Что защищает островки CpG от метилирования ДНК?
Исследования паттернов метилирования ДНК оказались сфокусированными на вопросе о том, каким образом островки CpG у млекопитающих в норме остаются иммунными к метилированию ДНК, в остальном глобальному. Простейшее возможное объяснение заключается в том, что (1) островки CpG внутренне не способны к метилированию de novo метилтрансферазами ДНК, но это кажется невероятным, поскольку они становятся плотно метилированными на неактивной Х-хромосоме, тогда как островки на активной Х-хромосоме в той же клетке являются резистентными. Кроме того, в раковых клетках и клеточных линиях многие в норме неметилированные островки CpG поддаются метилированию. Поэтому были приняты во внимание несколько альтернативных (не обязательно взаимоисключающих!) объяснений паттерна метилирования ДНК у млекопитающих; (2) островки CpG защищены от метилирования связыванием факторов, каким-то образом исключающих Dnmt. Имеются доказательства, что связывающиеся факторы действительно исключают метилирование ДНК, но «футпринтинг» [footprinting, метод определения участков нуклеиновых кислот, образующих комплексы с белками] и тесты на чувствительность к нуклеазам показывают, что островки CpG (Lin et al., 2000) в ядре в высокой степени доступны; (3) островки CpG поддерживаются в свободном от метилирования состоянии с помощью ДНК-деметилаз, которые активно удаляют метил-CpG (Frank etal., 1991). Несмотря на несколько сообщений о деметилирующих активностях, все современные кандидатуры на роль ДНК-деметилаз не получили подтверждения. Однако этот сценарий нельзя исключить; (4) атипичный состав оснований и отсутствие метилирования отражают аномальный метаболизм ДНК в этих островках CpG. Например, имеются данные о том, что островки CpG являются ориджинами репликации [точками начала репликации], и на них>южет влиять структура интермедиата инициации репликации (Antequera and Bird, 1999). В качестве альтернативы можно предположить, что в этих сайтах может концентрироваться рекомбинация и (или) репарация, что приводит к высоким уровням обновления ДНК. Каким образом эти предполагаемые актвности могли бы исключать Dnmt — неясно. (5) Ранняя эмбриональная транскрипция с промотора островка CpG необходима для того, чтобы гарантировать, что метилирование ДНК исключено. В тестах с трансгенозом мутации промотора провоцируют метилирование островков CpG (Brandeis et al., 1994; MacLeod et al., 1994), и у ранних эмбрионов промоторы островков CpG в высокой степени тканеспецифичных генов обычно экспрессируются, но формальные доказательства того, что транскрипция исключает метилирование CpG, отсутствуют.2.7. Переключается ли метилирование ДНК структурой хроматина?
Вышеописанные сценарии предполагают, что метилирование CpG является состоянием генома «по умолчанию» и что островки CpG поэтому возникают посредством исключения глобальной метилирующей активности. Недавно был предложен несколько иной взгляд: (6) паттерны метилирования ДНК определяются состоянием модификации лежащего в основе хроматина. В этом случае метилирование ДНК или его отсутствие включалось бы более ранним решением определенным образом модифицировать гистоновые белки. У гриба Neurospora crassa и растения Arabidopsis thaliana получены серъезные данные в пользу этой идеи (главы 6 и 9). Метилирование в этих системах не ограничено сайтами CpG и, как было показано, зависит от наличия метилирования гистона H3 по лизину 9 (H3K9me) (Tamaru and Selker, 2001; Jackson et al., 2002). У растений оказалось, что РНК-интерференция (RNAi) может служить «прицельным» механизмом для модификации хроматина, сайленсинга генов и метилирования ДНК (см.: Aufsatz et al., 2002; глава 8). Хотя у млекопитающих, у которых метилирование CpG преобладает, эти отношения были установлены хуже, отсутствие двух метилтрансфераз, метилирующих лизины гистонов (HKMTs) и специфичных к остаткам H3K9, как было показано, уменьшает метилирование CpG в повторяющихся последовательностях гетерохроматина (Lehnertz et al., 2003). Кроме того, было показано, что уменьшение содержания белка EZH2 из группы Polycomb (PcG), НКМТ, специфичной к остаткам H3K27, вызывает утрату метилирования CpG промоторов, являющихся мишенями для EZH2 (Vire et al., 2006). Имеются также убедительные данные о том, что у млекопитающих анти-смысловая транскрипция включает метилирование ДНК. Хиггс и сотрудники (Tufarelli et al., 2003) показали, что проведение [driving] антисмыслового транскрипта через ген ?-глобина в дифференцирующихся клетках мышиного эмбриона обеспечивает метилирование островков CpG-Механизм, лежащий в основе этого эффекта, остается неясным, но высказывались спекулятивные соображения, что здесь играет роль RNAi, подобно тому, что имеет место при некоторых событиях de novo метилирования у растений (Zilberman et al., 2003). Сообщалось о de novo метилировании, включаемом RNAi, в культивируемых клетках млекопитающих (Kawasaki and Taira, 2004), но современные данные заставляют считать, что этот феномен менее ясен, чем у растений или грибов2.8. Роль SWI/SNF-подобных белков ремоделинга хроматина
Данные о том, что для обеспечения соответствующего метилирования необходимы также вспомогательные факторы хроматина, первоначально были получены на растениях, где было показано, что для полного метилирования генома A. thaliana существенное значение имеет SNF2-подобный белок DDM1 (Jeddeloh et al., 1999). Аналогичная зависимость наблюдается и у животных, поскольку мутации в генах ATRX человека (Gibbons et al., 2000) и Lsh2 мыши (Dennis et al., 2001), которые оба кодируют белки, родственные белку ремоделинга хроматина, SNF2, существенно влияют на паттерны глобального метилирования ДНК. В частности, утрата белка LSH2 соответствует фенотипу мутации DDM1 у Arabidopsis, поскольку оба мутанта утрачивают метилирование высокоповторяющихся последовательностей ДНК, но сохраняют некоторое метилирование в других местах генома. Возможно, эффективное глобальное метилирование генома требует изменений структуры хроматина этими ремоделируюшими хроматин белками, чтобы DNMTs могли получить доступ к ДНК. «Сотрудничество» между DNMTs и факторами хроматина, позволяющее им получить доступ к специализированным участкам хромосом, может иметь особенно важное значение в районах, являющихся «гетерохроматиновыми» и недоступными.3. Регуляция экспрессии генов метилированием ДНК
3.1. Ранние данные
Влияние метилирования ДНК на экспрессию генов было протестировано несколькими способами, В репортерном гене аденовируса искусственное метилирование подгруппы сайтов CpG с помощью М.НраН предотвращало экспрессию этого гена, когда его инъецировали в ядра ооцитов лягушки (Vardimon et al., 1982). Аналогичным образом ген аденинфосфорибозилтрансферазы (Stein et al., 1982) был сайленсирован метилированием CpG при трансфекции в культуральные клетки млекопитающих Исследования эффектов метилирования ДНК в природной геномной ДНК стали возможными с открытием того, что химический агент 5-азацитидин может подавлять метилирование ДНК в живых клетках (Jones and Taylor, 1980). Этот аналог нуклеозида включается в ДНК вместо цитидина и формирует ковалентный адцукт с ДНК-метилтрансферазами, изымая их из круговорота и предотвращая дальнейшее метилирование ДНК. Ранее было показано, что сайленсинг нескольких генов, включая вирусные геномы (Harbers et al., 1981) и гены на неактивной Х-хромосоме (Wolf et al., 1984), коррелирует с их метилированием. Способность воздействия 5-аза-цитидином восстанавливать их экспрессию (Mohandas et al., 1981) свидетельствовала о том, что это метилирование ДНК играет причинную роль в их репрессии. То, что этот эффект действительно был обусловлен изменениями в метилировании ДНК, а не каким-то другим влиянием этого вещества, было продемонстрировано с помощью тестирования очищенной ДНК, выделенной из клеток, обработанных агентом. ДНК из клеток, обработанных 5-азацитидином, будучи трансфецированной в клетки, была способна к активной экспрессии «молчащего» гена гипоксантинфосфорибозилтрансферазы, сцепленного с Х-хромосомой, тогда как ДНК из необработанных контрольных клеток не могла обеспечить экспрессию (Venoliaet al., 1982).3.2. Интерференция со связыванием транскрипционного фактора
Каким образом метилирование ДНК интерферирует с экспрессией генов? Одна очевидная возможность заключается в том, что присутствие метильных групп в большой бороздке (рис. 18.1) интерферирует со связыванием транскрипционных факторов, активирующих транскрипцию со специфического гена. Ряд транскрипционных факторов распознает мотивы обогащенных GC последовательностей, которые могут содержать GC-последовательности. Некоторые из них не способны связываться с ДНК, когда последовательность GC метилирована (Watt and Molloy, 1988). Доказательства участия этого механизма в регуляции генов поступают из исследований роли белка CTCF в импринтинге в локусе H19/Igf2 у мышей (Bell and Felsenfeld, 2000). CTCF ассоциирован с границами транскрипционного домена (Bell et al. 1999) и может изолировать промотор от влияния удаленных энхансеров. Полученная от матери копия гена Igf2 является «молчащей» из-за связывания CTCF между его промотором и энхансером, находящимся «вниз по течению». Однако в отцовском локусе богатые CpG сайты связывания CTCF метилированы, что предотвращает связывание CTCF и тем самым позволяет энхансеру, находящемуся «вниз по течению», активировать экспрессию Igf2 Хотя имеются данные о том, что импринтинг H19/Igf2 включает дополнительные процессы, роль CTCF представляет собою яркий пример транскрипционного регулирования посредством метилирования ДНК (детали см. в главе 19).3.3. Притяжение белков, связывающихся с метил-CpG
Второй способ репрессии противоположен первому, поскольку он связан с белками, которые притягиваются, а не отталкиваются метил-CpG (рис. 18.5 и табл. 18.2). Этот способ репрессии вначале был обнаружен в экстрактах из клеток млекопитающих, которые были способны поддерживать транскрипцию добавленных генов. Добавление следовых количеств ДНК-матрицы сделало возможной транскрипцию с неметилированных репортерных генов, тогда как метилированные репортеры были репрессированы (Boyes and Bird, 1991). Увеличение количества добавляемой ДНК вызывало транскрипцию метилированных и неметилированных матриц на эквивалентных уровнях, что заставляло предполагать, что лимитирующие количества транскрипционного ингибитора, специфичного к метилированию ДНК, раститровывались [were being titrated out]. В соответствии с этой интерпретацией находящаяся в избытке метилированная неспецифическая конкурентная ДНК [excess methylated nonspecific competitor DNA] снимала репрессию метилированных генов в этих экстрактах. Доказательства непрямого подавления транскрипции также поступили из опытов, в которых метилированная ДНК, введенная в клетки млекопитающих и ооциты лягушки, сделала возможной транскрипцию генов только в начале (Buschhausen et al., 1987; Kass et al., 1997). Сайленсинг происходил несколькими часами позже, заставляя предполагать, что сайленсинг может зависеть от сборки хроматина Для того чтобы обнаружить белки, которые могли бы специфически связываться с метилированными генами и обусловливать наблюдаемую репрессию, были применен метод задержки в электрофорезном геле [bandshift assay] с использованием случайных метилированных последовательностей ДНК в качестве зондов. Комплекс ДНК — белок, специфичный к метилированной ДНК (MeCP1), наблюдали в ряде клеточных типов у млекопитающих (Meehan et al., 1989). Индивидуальный связывающийся с метил-CpG белок, МеСР2, был, однако, первым белком, подлежащим очистке и клонированию. Белки с мотивами связывания с ДНК, родственными мотивам МеСР2, были идентифицированы в результате поисков в базах данных и обозначены как семейство метил-CpG-связывающих доменов, охватывающее МеСР2, MBD1, MBD2, MBD3 и MBD4 (табл. 18.2) (Bird and Wolffe. 1999). Один из этих белков (MBD2) является связывающимся с ДНК компонентом комплекса MeCP1 (см. выше). Рис. 18.5. Белки, связывающиеся с метил-CpG
Пять членов белкового семейства MDB, выравненные по их MBD-доменам (пурпурный цвет). Обозначены и другие домены, в том числе домены репрессии транскрипции (TRD, transcriptional repression domains); домены СХХС, «цинковые пальцы» (предполагается участие некоторых из них в связывании неметилированных CpG); повторы GR с неизвестной функцией; гликозилазный домен с неправильным спариванием оснований T:G, участвующий в репарации дезаминирования 5-метилцитозина. Белок Kaiso не имеет домена MDB, но связывается с метилированной ДНК через «цинковые пальцы» (оранжевый цвет) и обладает доменом РОВ/ВТВ, общим с другими транскрипционными репрессорами
Рис. 18.5. Белки, связывающиеся с метил-CpG
Пять членов белкового семейства MDB, выравненные по их MBD-доменам (пурпурный цвет). Обозначены и другие домены, в том числе домены репрессии транскрипции (TRD, transcriptional repression domains); домены СХХС, «цинковые пальцы» (предполагается участие некоторых из них в связывании неметилированных CpG); повторы GR с неизвестной функцией; гликозилазный домен с неправильным спариванием оснований T:G, участвующий в репарации дезаминирования 5-метилцитозина. Белок Kaiso не имеет домена MDB, но связывается с метилированной ДНК через «цинковые пальцы» (оранжевый цвет) и обладает доменом РОВ/ВТВ, общим с другими транскрипционными репрессорами
Из белков MBD три — MBD1, MBD2 и МеСР2 — участвуют, как предположили, в зависимой от метилирования репрессии транскрипции (Bird and Wolffe, 1999). Как было показано, неродственный белок, Kaiso, тоже связывается с метилированной ДНК и осуществляет зависящую от метилирования репрессию в модельных системах (табл. 18.2) (Prokhortchouk et aL, 2001; Yoon et al., 2003). Понимание механизма репрессии пришло вместе с осознанием, что МеСР2 связывается корепрессорным комплексом mSin3a и зависит в своем действии от деацетилирования гистонов (Jones et al., 1998; Nan et al., 1998). Это открытие показало, что метилирование ДНК может «считываться» МеСР2 и служить сигналом к изменению структуры хроматина (рис. 18.6). С тех пор было показано, что каждый из этих четырех связывающихся с метил-CpG белков ассоциирован с отдельным корепрессорным комплексом. Особый интерес представляет MBD1, который связывается с метилтрансферазой лизина гистонов, SETDB1, лишь в ходе репликации ДНК (Sarraf and Stancheva, 2004). Продолжающееся метилирование H3K9 гистонов в последовательностях-«мишенях» хромосомной MBD1 и стабильный сайленсинг ассоциированных генов зависят от периодического рекрутирования этой активности, модифицирующей хроматин.
Таблица 18.2. Функции белков, связывающихся с метил-CpG
 Знание сайтов-«мишеней» MBD в геноме является предпосылкой для понимания его биологической роли. Можно было бы ожидать, что они конкурируют друг с другом за доступ к метилированным сайтам в силу их перекрывающейся специфичности нуклеотидной последовательности ДНК. Удивительно, что связывающиеся с MBD сайты в геноме в основном не перекрывались, когда их исследовали, используя клетки первичной клеточной линии человека; это позволяет предполагать, что каждый белок, связвающийся с метил-CpG, становится «мишенью» независимым образом (Klose et al., 2005). Это соответствует появляющимся данным, показывающим, что связывание MBD обнаруживает специфичность к нуклеотидной последовательности ДНК (см. табл. 18.2). Например, МеСР2 обнаруживает сильное предпочтение к сайтам mCpG. которые фланкируются цепочкой ДНК, обогащенной AT (Klose et al., 2005). Более того, MBD1 обладает дополнительным связывающимся с ДНК доменом, специфичным к неметилированным CpG, a Kaiso узнает пару соседних мотивов mCpG (Prokhortchouk et al., 2001). Пока что лишь MBD2, по-видимому, обладает эксклюзивным сродством к mCpG.
Знание сайтов-«мишеней» MBD в геноме является предпосылкой для понимания его биологической роли. Можно было бы ожидать, что они конкурируют друг с другом за доступ к метилированным сайтам в силу их перекрывающейся специфичности нуклеотидной последовательности ДНК. Удивительно, что связывающиеся с MBD сайты в геноме в основном не перекрывались, когда их исследовали, используя клетки первичной клеточной линии человека; это позволяет предполагать, что каждый белок, связвающийся с метил-CpG, становится «мишенью» независимым образом (Klose et al., 2005). Это соответствует появляющимся данным, показывающим, что связывание MBD обнаруживает специфичность к нуклеотидной последовательности ДНК (см. табл. 18.2). Например, МеСР2 обнаруживает сильное предпочтение к сайтам mCpG. которые фланкируются цепочкой ДНК, обогащенной AT (Klose et al., 2005). Более того, MBD1 обладает дополнительным связывающимся с ДНК доменом, специфичным к неметилированным CpG, a Kaiso узнает пару соседних мотивов mCpG (Prokhortchouk et al., 2001). Пока что лишь MBD2, по-видимому, обладает эксклюзивным сродством к mCpG.
3.4 МеСР2 и синдром Ретта
Существование множественных связывающихся с метил-CpG белков с репрессивными свойствами говорит о том, что эти белки могут быть важными медиаторами сигнала метилирования. Это наиболее поразительным образом иллюстрируется тем, что мутации в гене МЕСР2 человека оказываются ответственными за серьезное нейрологическое нарушение, называемое синдромом Ретга (Rett syndrome, RTT). RTT поражает женщин, гетерозиготных по новым мутациям в сцепленном с Х-хромосомой гене МЕСР2(табл. 18.2) (Amir et al., 1999). Благодаря инактивации случайной Х-хромосомы больные оказываются мозаиками по экспрессии либо мутантного гена, либо гена дикого типа (wt). Пораженные синдромом девочки развиваются внешне нормально 6—18 месяцев, после чего у них наступает кризис, после которого они остаются с сильно нарушенными моторными навыками, повторяющимися движениями рук, аномальным дыханием, микроцефалией и другими симптомами (табл. 18.2). Мужчины, гемизиготные по таким же мутациям, не выживают. Лишенные Меср2мыиш рождаются и развиваются нормально на протяжении нескольких недель, но в возрасте 6 недель приобретают ряд нейрологических симптомов, которые в возрасте приблизительно 10 недель приводят их к гибели. Несколько особенностей этого задержанного фенотипа, который полностью пенетрантен, напоминают синдром Ретга у человека (Amir et al., 1999). Условная делеция гена Меср2, затрагивающая только мозг мыши, вызывает те же симптомы, что и делеция Меср2 в целой мыши (табл. 18.2) (Chen et al., 2001; Guy et al., 2001). Следовательно, хотя MeCP2 экспрессируется клетках такой мыши повсеместно, «нулевой» по Меср2 фенотип, по-видимому, полностью обусловлен его отсутствием в мозге. В соответствии с этим открытием, биохимические и иммуноцитохимические исследования позволили установить, что самые высокие уровни экспрессии МеСР2 — в мозге, особенно в нейронах. Существенно, что экспрессия МеСР2 в одних только нейронах предотвращает появление этого мышиного фенотипа (Luikenhuis et al., 2004). С учетом роли МеСР2 как транскрипционного репрессора привлекательная гипотеза, объясняющая это заболевание, заключается в том, что гены в мозге, которые должны быть сайленсированы МеСР2, в его отсутствие избегают репрессии, и это приводит к аберрантной функции нейронов. Первый идентифицированный ген млекопитающих, служащий «мишенью» для МеСР2, кодирует нейротрофный фактор мозга (Bdnf) (Chen et al., 2003; Martinowich et al., 2003). Bdnf принадлежит к группе белков, синтезируемых в ответ на активность нейронов; полагают, он важен для превращения временных стимулов в долговременные изменения в активности мозга. Поэтому можно предполагать, что его неправильная регуляция играет роль в патологии RTT. Сообщалось об измененной экспрессии нескольких других генов у мышей, но масштабы этих эффектов невелики (менее чем трехкратные). Тем не менее, возможно, что одно или несколько этих изменений также вносят вклад в фенотип RTT.3.5. MBD2 опосредует зависящую от метилирования репрессию транскрипции
MBD2 является связывающимся с ДНК компонентом MeCP1 (см. табл. 18.2), который, рассматривался вначале как репрессор транскрипции в клеточных экстрактах (Meehan et al., 1989; Boyes and Bird, 1991). MeCP1— крупный мультибелковый комплекс, включающий корепрессорный комплекс NuRD (или Mi-2) и MBD2 (Wade et al., 1999). В состав NuRD входят деацетилазы гистонов (HDAC) и крупный белок ремоделинга хроматина (Mi-2). NuRD может рекрутироваться к ДНК несколькими связывающимися с ДНК белками помимо MBD2. (Интересно, что MBD3, который похож на MBD2, но не связывается с метилированной ДНК, является компонентом комплекса NuRD.) Клетки, не имеющие MBD2, не способны эффективно репрессировать метилированные репортерные конструкты, несмотря на присутствие в этих клетках других связывающихся с метил-CpG белков; это говорит о том, что это важный компонент системы репрессии (Hendrich et al., 2001). Недостаточные по MBD2 мыши жизнеспособны и фертильны, хотя и обнаруживают дефекты в материнском поведении (Hendrich et al., 2001), а тщательное исследование позволило обнаружить отклонения в тканеспецифичной экспрессии генов. Экспрессия генов interleukin-4 и interferon-? в ходе дифференцировки Т-хелперных клеток существенно нарушена (Hutchins et al., 2002). Например, значительное число клеток Thl, которые должны были бы экспрессировать только interferon-?, экспрессировали также interleukin-4 (табл. 18.2). Поскольку было обнаружено, что MBD2 связан с геном interleukin-4, вполне вероятно, что его отсутствие ослабляет репрессию этого гена в клетках Thl.4. Метилирование ДНК, мутации и стабильность хромосом
4.1. Метилирование ДНК и мутации
Преимуществам метилирования ДНК как эпигенетической системы клеточной памяти противостоит недостаток, связанный с мутабильностью 5-метилцитозина. Цитозин (С) дезаминируется спонтанно, давая урацил (U), который затем неправильно спаривается с гуанином (Lindahl, 1974). Эта потенциальная мутация распознается урациловыми ДНК-гликозилазами, которые эффективно удаляют несоответствующее основание и инициируют репарацию, чтобы восстановить С на месте U. Однако, когда дезаминируется 5-метилцитозин, образуется тимин (Т). Результатом этого также оказывается неправильное спаривание, но тот факт, что Т, в отличие от U, является природным основанием ДНК, по-видимому, интерферирует с эффективным устранением повреждения. В результате мутантное тиминовое основание может сохраняться при репликации ДНК и передается дочерним клеткам как мутация типа транзиции С к Т. Мутации этого рода являются, по-видимому, одной из наиболее частых единичных причин генетического заболевания у людей, поскольку приблизительно одна треть всех точечных мутаций являются транзициями С к Т в последовательностях CpG (Cooper and Youssoufian, 1988). Эту нестабильность CpG в эволюционных масштабах демонстрирует далее 4—5-кратная недостача CpG в геноме млекопитающих (Bird, 1980). Единственным исключением оказываются островки CpG, в которых CpG не метилированы и поэтому стабильны. Среди белков, связывающихся с метил-CpG, MBD4 остается пока уникальным в том отношении, что он обладает ферментативной активностью. Карбокситерминальный домен MBD4 является ДНК-гликозилазой, которая может in vitro избирательно удалять Т из неправильно спаренных Т—G (Hendrich et al., 1999). Эту активность можно было бы ожидать от системы репарации ДНК, которая исправляет дезаминирование 5-метилнитозина. В подтверждение этой гипотезы мыши, лишенные MBD4, обнаруживают повышенную мутабельность метилированных остатков цитозина в хромосомной репортерной последовательности (Millar et al., 2002). Кроме того, мыши, лишенные Mbd4, приобретают мутации типа транзиций С к Т в гене аденоматозного полипоза coli (АРС) и обладают повышенной частотой кишечных новообразований (табл. 18.2). Стоит отметить, что несмотря на существование специальной системы репарации, сайты метилирования цитозина сохраняются как «горячие точки» для мутаций. Рис. 18.6. Гипотетический переход между активным, неметилированным генным промотором и репрессированным промотором, «молчание» которого обусловлено метилированием ДНК, опосредованным МеСР2
Эта переходная фаза представляет собой промежуточный этап, во время которого транскрипция сайленсирована и происходит метилирование ДНК. Предполагается, что МеСР2 рекрутирует комплекс деацетилазы гистонов (HDAC) Sin3A и активность метилтрансферазы лизинов гистонов (НКМТ) к метилированным сайтам. Кроме того, имеются некоторые данные о том, что МеСР2 может прямо репрессировать транскрипцию путем контакта с комплексом инициации транскрипции (DR). Другие связывающиеся с метил-CpG белки взаимодействуют с разными корепрессорами, включающими активность НКМТ и (или) HDAC, и потенциально рекрутируют их
Рис. 18.6. Гипотетический переход между активным, неметилированным генным промотором и репрессированным промотором, «молчание» которого обусловлено метилированием ДНК, опосредованным МеСР2
Эта переходная фаза представляет собой промежуточный этап, во время которого транскрипция сайленсирована и происходит метилирование ДНК. Предполагается, что МеСР2 рекрутирует комплекс деацетилазы гистонов (HDAC) Sin3A и активность метилтрансферазы лизинов гистонов (НКМТ) к метилированным сайтам. Кроме того, имеются некоторые данные о том, что МеСР2 может прямо репрессировать транскрипцию путем контакта с комплексом инициации транскрипции (DR). Другие связывающиеся с метил-CpG белки взаимодействуют с разными корепрессорами, включающими активность НКМТ и (или) HDAC, и потенциально рекрутируют их
4.2. Метилирование ДНК и нестабильность хромосом
Хотя метилирование ДНК является явно мутагенным, имеются данные, что его наличие выгодно в отношении стабильности хромосом. Мыши, обладающие примерно 10 % от нормального уровня метилирования ДНК благодаря гипоморфной мутации Dnmtl, приобретают агрессивные Т-клеточные лимфомы, которые нередко демонстрируют трисомию по хромосоме 15 (Gaudet et al., 2003). Мутации DNMT3B у пациентов с синдромом ICF или инактивация Dnmt3b у мышей приводят к различным хромосомным аберрациям, в том числе слиянию хромосом, разрывам и анеуплоидии (Ehrlich, 2003; Dodge et al., 2005). Эти результаты представляют интерес потому, что рак часто обнаруживает пониженные уровни метилирования ДНК, что может вносить свой вклад в инициацию или прогрессию опухолей. Одно возможное объяснение этих результатов заключается в том, что метилирование ДНК вносит вклад в точное расхождение хромосом и в его отсутствие чаще имеет место нерасхождение, приводящее к хромосомным нарушениям. Альтернативная возможность состоит в том, что метилирование ДНК может подавлять экспрессию и рекомбинацию ретротранспозонов в геноме млекопитающих, тем самым защищая хромосомы от вредоносной рекомбинации. Действительно, было показано, что метилирование ДНК играет критическую роль в сайленсировании транскрипции ретротранспозонов во время эмбрионального развития и сперматогенеза (Walsh et al., 1998; Bourc’his and Bestor, 2004).5. Будущие направления исследований
Наше понимание биологических функций метилирования ДНК у млекопитающих постоянно растет, но еще далеко не является полным. Например, в отличие от генетических мутаций мы очень мало знаем о скорости изменений в метилировании CpG у млекопитающих и о внутренних и внешних факторах, индуцирующих изменения в паттернах метилирования ДНК. Накапливающиеся данные указывают на то, что изменения в метилировании ДНК и модификации гистонов могут вносить свой вклад в патогенез многих комплексных заболеваний. Таким образом, модуляция эпигенетических состояний обладает определенным потенциалом, чтобы стать новым терапевтическим подходом для лечения этих заболеваний. В будущем мы ожидаем больших успехов в этих важных областях исследования.5.1. Факторы внешней среды, индуцирующие эпигенетические изменения
Твердо установлено, что паттерны метилирования ДНК генома млекопитающих в высокой степени регулируются в ходе развития. Каким образом факторы внешней среды могут влиять на метилирование ДНК и экспрессию генов — понятно в гораздо меньшей мере. Некоторые исследования последнего времени начинают проливать свет на то, как факторы внешней среды могут индуцировать эпигенетические изменения, которые могут иметь длительные биологические эффекты. Одним таким примером может служить наблюдение, что материнское поведение у крыс производит стабильные изменения в метилировании ДНК у потомства. Уивер и сотрудники сообщили, что крысята, получающие разные уровни материнской заботы, обладают различным метилированием ДНК в промоторном участке гена рецептора глюкокортикоида (GR), обнаруживающим обратную корреляцию с экспрессией GR, и эти различия сохраняются вплоть до взрослого состояния (Weaver et al., 2004). Другим примером является сообщение о том, что диета взрослой самки мыши может изменять метилирование ДНК у потомков. У мышей agouti является доминантным признаком, придающим меху коричневатую (агути) окраску. Несколько аллелей agouti viable yellow возникают спонтанно благодаря вставке перемещаемого ретровирусного элемента в этот ген. У мышей с такой аллелью экспрессия agouti контролируется длинным терминальным повтором (LTR) этого ретровирусного элемента. Окраска меха у этих мышей, варьирующая от желтой или пятнистой до агути дикого типа, определяется состояниями метилирования промотора LTR. Таким образом, в этой системе окраска меха может служить показателем метилирования ДНК. Когда беременные самки содержатся на диете, содержащей такие доноры метильной группы, как фолат, холин и бетаин, их потомство демонстрирует сдвиг окраски меха в сторону агути, что коррелирует с увеличенным метилированием промотора LTR (Cooney et al., 2002; Waterland and Jirtle, 2003). Эти результаты заставляют предполагать, что внешние факторы могут индуцировать стабильные изменения эпигенетических состояний, обеспечивая механизм, посредством которого факторы внешней среды могут вызывать долговременные биологические эффекты. Необходимы дальнейшие исследования, чтобы определить, в какой степени эпигенетические механизмы вовлечены в во взаимодействия генов и среды у млекопитающих и как факторы внешней среды могут преобразовываться в эпигенетические состояния.5.2. Эпигенетическая нестабильность и комплексные заболевания
Многие комплексные заболевания, такие как диабет II типа, шизофрения, аутоиммунные болезни и рак, обнаруживают наследуемый компонент, но не проявляют четкого менделевского паттерна наследования. Динамический эпигенетический механизм позволяет дать альтернативное объяснение некоторых особенностей комплексных заболеваний, в том числе позднего начала, гендерных эффектов, эффектов, связанных с происхождением от того или иного родителя, дискордантности монозиготных близнецов, и флуктуации симптомов при комплексных заболеваниях (Petronis, 2001). Хотя все увеличивающееся количество данных позволило связать аберрантное метилирование ДНК и модификации гистонов с раком, роль эпигенетических механизмов в этиологии многих других комплексных заболеваний в основном неизвестна. Сравнительные исследования общегеномных паттернов метилирования ДНК в популяциях здоровых и больных могут позволить проникнуть в эпигенетические основы разных комплексных заболеваний, при которых трудно выявить генетические мутации.5.3. Модуляция обратимых эпигенетических состояний
Большинство, если не все эпигенетические модификации являются обратимыми, что делает модуляцию эпигенетических состояний новой потенциальной терапевтической альтернативой для рака и других заболеваний Ряд агентов, изменяющих паттерны метилирования ДНК или подавляющих HDACs, испытываются в настоящее время в клинике (Egger et al., 2004). Некоторые из них продемонстрировали многообещающие противоопухолевые эффекты. Действительно, деметилируюший агент 5-азацитидин был недавно одобрен U.S. Food and Drug Administration для лечения миелодиспластического синдрома — гетерогенного заболевания, характеризующегося морфологической дисплазией гематопоэтических клеток. Клиническое использование 5-азацитидина и других аналогов нуклеозидов ограничивается их токсичностью, отчасти потому что эти соединения включаются в ДНК Это вдохновило на поиски агентов, которые могут подавлять метилтрансферазы непосредственно или «нацеливать» другие эпигенетические регуляторы. Поскольку метилирование ДНК является всего лишь одним из компонентов сложной эпигенетической регуляторной сети, одним из подходов к тому чтобы максимизировать терапевтические эффекты и минимизировать токсичность, является комбинационная терапия, использующая ингибиторы ДНК-метилтрансфераз или HDAC в сочетании с другими противораковыми терапевтическими средствами (детали см. в главе 24).Литература
Amir R.E., Van den Veyver LB., Wan M., Tran C.Q., Francke U., and Zoghbi H.Y., 1999. Rett syndrome is caused by mutations in X-linked MECP2, encoding methyl-CpG-binding protein 2. Nat. Genet. 23: 185–188. Antequera F. and Bird A., 1999. CpG islands as genomic footprints of promoters that are associated with replication origins. Curr. Biol. 9: R661-667. Aufsatz W., Mette M.F., van derWinden J., Matzke A.J., and Matzke M., 2002. RNA-directed DNA methylation in Arabidopsis. Proc. Natl. Acad. Sci. 99: 16499-16506. Bell A.C. and Felsenfeld G., 2000. Methylation of a CTCF-dependent boundary controls imprinted expression of the Igf2 gene. Nature 405: 482–485. Bell A.C., West A.G., and Felsenfeld G., 1999. The protein CTCF is required for the enhancer blocking activity of vertebrate insulators. Cell 98: 387–396. Bestor T.H. and Ingram V.M., 1983. Two DNA methyltransferases from murine erythroleukemia cells: Purification, sequence specificity, and mode of interaction with DNA. Proc. Natl. Acad. Sci. 80: 5559–5563. Bird A.R., 1978. Use of restriction enzymes to study eukaryotic DNA methylation. II. The symmetry of methylated sites supports semi-conservative copying of the methylation pattern. J. Mol. Biol. 118: 48–60. Bird A.R., 1980. DNA methylation and the frequency of CpG in animal DNA. Nucleic Acids Res. 8: 1499–1594. Bird A.P. and Southern E.M., 1978. Use of restriction enzymes to study eukaryotic DNA methylation. I. The methylation pattern in ribosomal DNA from Xenopus laevis. J. Mol. Biol. 118: 27–47. Bird A.P and Wolffe A.P., 1999. Methylation-induced repression — Belts, braces and chromatin. Cell 99: 451–454. Bird A., Taggart M., Frommer M., Miller O.J., and Macleod D., 1985 A fraction of the mouse genome that is derived from islands of non-methylated, CpG-rich DNA. Cell 40: 91–99. Bourc’his D. and Bestor T.H., 2004. Meiotic catastrophe and retrotrans-poson reactivation in male germ cells lacking Dnmt3L. Nature 431: 96–99. Boyes J. and Bird A., 1991. DNA methylation inhibits transcription indirectly via a methyl-CpG-binding protein. Cell 64: 1123–1134. Brandeis M., Frank D., Keshet I., Siegried Z., Mendelsohn M., Nemes A., TemperV.,RazinA., and Cedar H., 1994. Spl elements protect a CpG island from de novo methylation. Nature 371: 435–438. Bruniquel D. and Schwartz R.H., 2003. Selective, stable demethylation of the interleukin-2 gene enhances transcription by an active process. Nat. Immunol. 4: 235–240. Buschhausen G., Wittig B., Graessmann M., and Graessmann A., 1987. Chromatin structure is required to block transcription of the methylated herpes simplex virus thymidine kinase gene. Proc. Natl. Acad. Sci. 84: 1177–1181. Chen R.Z., Akbarian S., Tudor M., and Jaenisch R., 2001. Deficiency of methyl-CpG-binding protein-2 in CNS neurons results in a Rett-like phenotype in mice. Nat. Genet. 27: 327–331. Chen W.G., Chang Q., Lin Y., Meissner A., West A.E., Griffith E.C., Jaenisch R., and Greenberg M.E., 2003. Derepression of BDNF transcription involves calcium-dependent phosphorylation of MeCP2. Science 302: 885–889. Cooney C.A., Dave A.A., and Wolff G.L., 2002. Maternal methyl supplements in mice affect epigenetic variation and DNA methylation of offspring. J. Nutr. 132: 2393S-2400S. Cooper D.N. and Youssoufian H., 1988. The CpG dinucleotide and human genetic disease. Hum. Genet. 78: 151–155. Cooper D.N., Taggart M.H., and Bird A.P., 1983. Unmethylated domains invertebrate DNA. Nucleic Acids Res. 11: 647–658. Dennis K., Fan T., Geiman T., Yan Q., and Muegge K., 2001. Lsh. a member of the SNF2 family, is required for genome-wide methylation. Genes Dev. 15: 2940–2944. Dodge J.E., Okano M., Dick R., Tsujimoto N., Chen T., Wang S., Ueda Y., Dyson N., and Li E., 2005. Inactivation of Dnmt3b in mouse embryonic fibroblasts results in DNA hypomethylation, chromosomal instability, and spontaneous immortalization. J. Biol. Chem. 280: 17986-17991. Egger G., Liang G., Aparicio A., and Jones P.A., 2004. Epigenetics in human disease and prospects for epigenetic therapy. Nature 429: 457–463. Ehrlich M., 1982. Amount and distribution of 5-methycytosine in human DNA from different types of tissues or cells. Nucleic Acids Res. 10: 2709–2721. Ehrlich M., 2003. The ICF syndrome, a DNA methyltransferase 3B deficiency and immunodeficiency disease. Clin. Immunol. 109: 17–28. Frank D., Keshet I., Shani M., Levine A., Razin A., and Cedar H., 1991. Demethylation of CpG islands in embryonic cells. Nature 351: 239–241. Frommer M., McDonald L.E., Millar D.S., Collis C.M., Watt J., Grigg G.W., Molloy P.L., and Paul C.L., 1992. A genomic sequencing protocol that yields a positive display of 5-methyl-cytosine residues in individual DNA strands. Proc. Natl. Acad. Sci. 89: 1827–1831. Gaudet E., Hodgson J.G., Eden A., Jackson-Grusby L., Dausman J., Gray J.W., Leonhardt H., and Jaenisch R., 2003. Induction of tumors in mice by genomic hypomethylation. Science 300: 489–492. Gibbons R.J., McDowell XL., Raman S., O’Rourke D.M., Garrick D., Ayyub H., and Higgs D.R., 2000. Mutations in ATRX, encoding a SWI/SNF-like protein, cause diverse changes in the pattern of DNA methylation. Nat. Genet. 24: 368–371. Guy J., Hendrich B., Holmes M., Martin J.E., and Bird A., 2001. A mouse Mecp2-null mutation causes neurological symptoms that mimic Rett syndrome. Nat. Genet. 27: 322–326. Harbers K., Schnieke H., Stuhlmann H., Jahner D., and Jaenisch B., 1981. DNA methylation and gene expression; endogenous retroviral genome becomes infectious after molecular cloning. Proc. Natl. Acad. Sci. 78: 7609–7613. Hata K., Okano M., Lei H., and Li E., 2002. Dnmt3L cooperates with the Dnmt3 family of de novo DNA methyltransferases to establish maternal imprints in mice. Development 129: 1983–1993. Hendrich B., Guy J., Ramsahoye B., Wilson V. A., and Bird A., 2001. Closely related proteins Mbd2 and Mbd3 play distinctive but interacting roles in mouse development. Genes Dev. 15: 710–723. Hendrich B., Hardeland U., Ng H.-H., Jiricny J., and Bird A., 1999. The thymine glycosylase MBD4 can bind to the product of deamination at methylated CpG sites. Nature 401: 301–304. Herman J.G., Graff J.R., Myohanen S., Nelkin B.D., and Baylin S.B., 1996. Methylation-specific PCR: A novel PCR assay for methylation status of CpG islands. Proc. Natl. Acad. Sci. 93: 9821–9826. Holliday R. and Pugh J.E., 1975. DNA modification mechanisms and gene activity during development. Science 186: 226–232. Hutchins A., Mullen A., Lee H., Barner K., High E, Hendrich B., Bird A., and Reiner S., 2002. Gene silencing quantitatively controls the function of a developmental trans-activator. Mol. Cell 10: 81–91. Jackson J.P., Lindroth A.M., Cao X., and Jacobsen S.E., 2002. Control of CpNpG DNA methylation by the KRYPTONITE histone H3 methyltransferase. Nature 416: 556–560. Jahner D., Stuhlmann H., Stewart C.L., Harbers K., Lohler J., Simon I., and Jaenisch R., 1982. De novo methylation and expression of retroviral genomes during mouse embryogenesis. Nature 298: 623–628. Jeddeloh J.A., Stokes T.L., and Richards E.J., 1999. Maintenance of genomic methylation requires a SW12/SNF2-like protein. Nat. Genet. 22: 94–97. Jones P.A. and Taylor S.M., 1980. Cellular differentiation, cytidine analogues and DNA methylation. Cell, 20: 85–93. Jones P.L., Veenstra G.J., Wade P.A., Vermaak D., Kass S.U., Landsberger N., Strouboulis J., and Wolffe A.P., 1998. Methylated DNA and MeCP2 recruit histone deacetylase to repress transcription. Nat. Genet., 19: 187–191. Kaneda M., Sado T., Hata K., Okano M., Tsujimoto N., Li E., and Sasaki H., 2004. Role of de novo DNA methyltransferases in initiation of genomic imprinting and X-chromosome inactivation. Cold Spring Harbor Symp. Quant. Biol. 69: 125–129. Kass S. U., LandsbergerN., and Wolffe A.P., 1997. DNA methylation directs a time-dependent repression of transcription initiation. Curr.Biol. 7: 157–165. Kawasaki H. and Taira K., 2004. Induction of DNA methylation and gene silencing by short interfering RNAs in human cells. Nature 431: 211–217. Klose R.J., Sarraf S.A., Schmiedeberg L., McDermott S.M., Stancheva 1., and Bird A.P., 2005. DNA binding specificity of MeCP2 due to a requirement for A/T sequences adjacent to methyl-CpG. Mol. Cell, 19: 667–678. Lehnertz B., Ueda Y., Derijck A.A., Braunschweig U., Perez-Burgos L., Kubicek S., Chen T., Li E., Jenuwein T., and Peters A.H., 2003. Suv39h-mediated histone H3 lysine 9 methylation directs DNA methylation to major satellite repeats at pericentric heterochromatin. Curr. Biol. 13: 1192–1200. Lei H., Oh S.P., Okano M., Juttermann R., Gos K.A., Jaenisch R., and Li E., 1996. De novo DNA cytosine methyltransferase activities in mouse embryonic stem cells. Development 122: 3195–3205. Li E., Bestor T.H., and Jaenisch R., 1992. Targeted mutation of the DNA methyltransferase gene results in embryonic lethality. Cell 69: 915–926. Lin I.G., Tomzynski T.J., Ou Q., and Hsieh C.L., 2000. Modulation of DNA binding protein affinity directly affects target site demethylation. Mol. Cell. Biol., 20: 2343–2349. Lindahl T., 1974. An N-glycosidase from Escherichia coli that releases free uracil from DNA containing deaminated cytosine residues. Proc. Natl. Acad. Sci. 71: 3649–3653. Luikenhuis S., Giacometti E., Beard C.F., and Jaenisch R., 2004. Expression of MeCP2 in postmitotic neurons rescues Rett syndrome in mice. Proc. Natl. Acad. Sci. 101: 6033–6038. MacLeod D., Charlton J., Mullins J., and Bird A.P., 1994. Spl sites in the mouse aprt gene promoter are required to prevent methylation of the CpG island. Genes Dev. 8: 2282–2292. Martienssen R.A., Doerge R.W., and Colot V., 2005. Epigenomic mapping in Arabidopsis using tiling microarrays. Chromosome Res. 13: 299–308. Martinowich K., Hattori D., Wu H., Fouse S., He F., Hu Y., Fan G., and Sun Y.E., 2003. DNA methylation-related chromatin remodeling in activity-dependent BDNF gene regulation Science 302: 890–893. Mayer W., Niveleau A., Walter J., Fundele R., and Haaf T., 2000. Demethylation of the zygotic paternal genome. Nature 403: 501–502. McKeon C., Ohkubo H., Pastan I., and de Crombrugghe B., 1982. Unusual methylation pattern of the alpha 2(1) collagen gene. Cell 29: 203–210. Meehan R.R., Lewis J.D., McKay S., Kleiner E.L., and Bird A.P., 1989. Identification of a mammalian protein that binds specifically to DNA containing methylated CpGs. Cell 58: 499–507. Millar C.B., Guy J., Sansom O.J., Selfridge J., MacDougall E., Hendrich B., Keightley P. D., Bishop S.M., Clarke A.R., and Bird A., 2002. Enhanced CpG mutability and tumorigenesis in MBD4-deficient mice. Science 297: 403–405. Mohandas T., Sparkes R.S., and Shapiro L.J., 1981. Reactivation of an inactive human X-chromosome: Evidence for X-inactivation by DNA methylation. Science 211: 393–396. Nan X., Ng H.-H., Johnson C.A., Laherty C.D., Turner B.M., Eisenman R.N., and Bird A., 1998. Xranscriptional repression by the methyl-CpG-binding protein MeCP2 involves a histone deacetylase complex. Nature 393: 386–389. Okano M., Xie S., and Li E., 1998. Cloning and characterization of a family of novel mammalian DNA (cytosine-5) methyltransferases. Nat. Genet., 19: 219–220. Okano M., Bell D.W, Haber D.A., and Li E., 1999. DNA methyltransferases Dnmt3a and Dnmt3b are essential for de novo methylation and mammalian development. Cell 99: 247–257. Petronis A., 2001. Human morbid genetics revisited: Relevance of epigenetics. Trends Genet. 17: 142–146. Posfai J., Bhagwat A.S., Posfai G., and Roberts R.J., 1989. Predictive motifs derived from cytosine methyltransferases. Nucleic Acids Res. 17: 2421–2435. Prokhortchouk A., Hendrich B., Jorgensen H., Ruzov A., Wilm M., Georgiev G., Bird A., and Prokhortchouk E., 2001. The pl20 catenin partner Kaiso is a DNA methylation-dependent transcriptional repressor. Genes Dev.: 1613–1618. Riggs A.D., 1975. X-inactivation, differentiation and DNAmethylation. Cytogenet. Cell Genet. 14: 9-25. Rougier N., Bourc’his D., Gomes D.M., Niveleau A., Plachot M., Paldi A., and Viegas-Pequignot E., 1998. Chromosome methylation patterns during mammalian preimplantation development. Genes Dev. 12: 2108–2113. Sarraf S.A. and Stancheva I., 2004. Methyl-CpG-binding protein MBD1 couples histone H3 methylation at lysine 9 by SEXDB1 to DNA replication and chromatin assembly. Mol. Cell 15: 595–605. Simonsson S. and Gurdon J., 2004. DNA demethylation is necessary for the epigenetic reprogramming of somatic cell nuclei. Nat. Cell Biol. 6: 984–990. Stein R., Razin A., and Cedar H., 1982. In vitro methylation of the hamster adenine phosphorybosy transferase gene inhibits its expression in mouse L cells. Proc. Natl. Acad. Sci. 79: 4418–3422. Stewart C.L., Stuhlmann H., Jahner D., and Jaenisch R., 1982. De novo methylation and infectivity of retroviral genomes introduced into embryonal carcinoma cells. Proc. Natl. Acad. Sci. 79: 4098–4102. Tamaru H. and Selker E.U., 2001. A histone H3 methyltransferase controls DNA methylation in Neurospora crassa. Nature 414: 277–283. Tufarelli C., Stanley J.A., Garrick D., Sharpe J.A., Ayyub H., Wood W.G., and Higgs D.R., 2003. Transcription of antisense RNA leading to gene silencing and methylation as a novel cause of human genetic disease. Nat. Genet. 34: 157–165. Vardimon L., Kressmann A., Cedar H., Maechler M., and Doerfler W., 1982. Expression of a cloned adenovirus gene is inhibited by in vitro methylation. Proc. Natl. Acad. Sci. 79: 1073–1077. Venolia L., Gartler S.M.. Wasserman E.R., Yen R, Mohandas X., and Shapiro L.J., 1982. Xransformation with DNA from 5 azacytidine-reactivated X chromosomes. Proc. Natl. Acad. Sci. 79: 2352–2354. Vire E., Brenner C., Deplus R., Blanchon L., Fraga M., Didelot C., Morey L., Van Eynde A., Bernard D., Vanderwinden J.M., et al., 2006. The Polycomb group protein EZH2 directly controls DNA methylation. Nature 439: 871–874. Wade P.A., Gegonne A., Jones P.L., Ballestar E., Aubry R., and Wolffe A.P., 1999. Mi-2 complex couples DNA methylation to chromatin remodeling and histone deacetylation. Nat. Genet. 23: 62–66. Walsh C.P., Chaillet J.R., and BestorX.H., 1998. Transcription of IAP endogenous retroviruses is constrained by cytosine methylation. Nat. Genet., 20: 116–117. Waterland R.A. and Jirtle R.L., 2003. Transposable elements: Targets for early nutritional effects on epigenetic gene regulation. Mol Cell. Biol. 23: 5293–5300. Watt F. and Molloy P.L., 1988. Cytosine methylation prevents binding to DNA of a HeLa cell transcription factor required for optimal expression of the adenovirus late promoter. Genes Dev. 2: 1136–1143. Weaver I.C., Cervoni N., Champagne F.A., D’Alessio A.C., Sharma S., Seckl J.R., Dymov S., Szyf M., and Meaney M.J., 2004. Epigenetic programming by maternal behavior. Nat. Neurosci. 7: 847–854. Weber M., Davies J.J., Wittig D., Oakeley E.J., Haase M., LamW.L., and Schubeler D.. 2005. Chromosome-wide and promoter-specific analyses identify sites of differential DNA methylation in normal and transformed human cells. Nat. Genet. 37: 853–862. Wigler M.H., 1981. The inheritance of methylation patterns in vertebrates. Cell 24: 285–286. Wolf S.E., Jolly D.J., Lunnen K.D., Friedman T., and Migeon B.R., 1984. Methylation of the hypoxanthine phosphoribosyltransferase locus on the human X-chromosome: Implications for X-chromosome inactivation. Proc. Natl. Acad. Sci. 81: 2806–2810. Yoon H.G.. Chan D.W., Reynolds A.B.. Qin J.. and Wong J.. 2003. N-CoR mediates DNA methylation-dependent repression through a methyl CpG-binding protein Kaiso. Mol. Cell 12: 723–734. Zilberman D., Cao X., and Jacobsen S.E., 2003. ARGONAUTE4 control of locus-specific siRNA accumulation and DNA and histone methylation. Science 299: 716–719.Глава 19. Геномный импринтинг у млекопитающих
 Denise P. Barlow1 и Marisa S. Bartolomei2
1СеММ Research Center for Molecular Medicine of the Austrian Academy of Sciences, Institute of Genetics, Max Perutz Laboratories, A-1030 Vienna, Austria
2Departament of Cell & Developmental Biology, University of Pennsylvania School of Medicine, Philadelphia, Pennsylvania, 19104-6148
Denise P. Barlow1 и Marisa S. Bartolomei2
1СеММ Research Center for Molecular Medicine of the Austrian Academy of Sciences, Institute of Genetics, Max Perutz Laboratories, A-1030 Vienna, Austria
2Departament of Cell & Developmental Biology, University of Pennsylvania School of Medicine, Philadelphia, Pennsylvania, 19104-6148
Общее резюме
Млекопитающие являются диплоидными организмами, чьи клетки обладают двумя совмещенными [matched] наборами хромосом, один из которых унаследован от матери, а другой — от отца. Таким образом, млекопитающие обладают двумя копиями каждого гена. В норме и материнская, и отцовская копии каждого гена имеют одну и ту же возможность быть активной в любой клетке. Геномный импринтинг — это эпигенетический механизм, который изменяет эту потенцию, потому что он ограничивает экспрессию гена одной из двух родительских хромосом. Это явление демонстрируют лишь несколько сотен из примерно 25 ООО генов в нашем геноме, а большинство экспрессируются в равной степени, будучи унаследованы от любого из родителей. Геномный импринтинг затрагивает и мужское, и женское потомство и поэтому является следствием родительского наследования, а не пола. Как пример того, что под этим подразумевается, можно сказать, что импринтированный ген, активный на хромосоме, унаследованной от матери, будет активным на материнской хромосоме и «молчащим» на отцовской хромосоме у всех самцов и самок. Определение геномного импринтинга ограничено здесь «специфичной, в отношении родителя, экспрессией генов в диплоидных клетках». Таким образом, диплоидные клетки, содержащие по две родительские копии всех генов, будут экспрессировать только одну родительскую копию импринтированного гена и сайленсировать другую родительскую копию. Напротив, неимпринтированные гены будут экспрессироваться в диплоидной клетке обеими родительскими копиями. Для понимания концепции импринтированных генов важно различать импринтированные гены и гены, демонстрирующие кажущуюся специфичную в отношении родителя экспрессию из-за неравного родительского генетического вклада в зародыш. Примерами неравного родительского генетического вклада являются гены, сцепленные с Y-хромосомой и присутствующие только у самцов, гены, избежавшие Х-инактивации у самок, митохондриальные гены, привносимые в основном матерью, и иРНК и белки, присутствующие в цитоплазме только спермия или только яйцеклетки. Многие особенности геномного импринтинга у млекопитающих делают его весьма привлекательной биологической проблемой в постгеномную эпоху Например, он дает ключ к пониманию возможной эволюционной реакции на родительский конфликт, к адаптации материнского родителя к внутренней воспроизводительной системе; возможно, он дает также хотя бы некоторое представление о способах, которыми геном млекопитающих защищает себя от вторжения [чужеродных] нуклеотидных последовательностей ДНК. Геномный импринтинг — явление, бросающее вызов интеллекту не в последнюю очередь потому, что он ставит вопрос о том, почему у диплоидного организма развивается система сайленсинга, отвергающая преимущества диплоидного состояния. Возможно, самым интригующим является то обстоятельство, что выборка генов, подверженных геномному импринтингу, в основном кодирует факторы, регулирующие эмбриональный и неонатальный рост. Таким образом, кажется весьма вероятным, что геномный импринтинг развился для того, чтобы играть специфическую роль в репродукции млекопитающих. На этом этапе наших знаний геномный импринтинг не выглядит широкораспространенным в четырех эукариотных царствах, включающих протистов, грибы, растения и животных. Однако он существует, возможно в родственной форме, у двух групп беспозвоночных — у членистоногих Coccidae и Sciaridae, а также в эндосперме некоторых семенных растений, таких как кукуруза и Arabidopsis. Такое распределение показывает, что геномный импринтинг возникал независимо по меньшей мере трижды в эволюции живого. Удивительно, что, несмотря на эту предсказываемую независимую эволюцию геномного импринтинга, вырисовываются некоторые черты сходства в механизмах импринтинга. Весьма вероятно, что это отражает консерватизм базовых эпигенетических регуляторных механизмов, лежащих в основе как геномного импринтинга, так и нормального регулирования генов.1. Исторический обзор
Наличие геномного импринтинга у млекопитающих имеет существенное медицинское, социальное и интеллектуальное значение в плане (1) клиники генетических признаков и заболеваний, (2) возможности контролировать репродукцию человека и животных с помощью вспомогательных репродуктивных технологий и (3) прогресса биотехнологии и постгеномных медицинских исследований. При любом современном обсуждении генетических проблем, будь то исследования или медицина, обязательно необходимо считаться с тем, обнаруживает ли данный ген двуродительский (т. е. диплоидный) характер экспрессии или же подвержен геномному импринтингу и демонстрирует специфичную в отношении родителя (т. е. гаплоидную) экспрессию. Как это ни удивительно, после того как было однозначно показано, что три гена у мышей обнаруживают специфичную в отношении родителя экспрессию, широкого признания существование и значение геномного импринтинга не получили вплоть до начала 1990-х годов, несмотря на его важность для здоровья и благополучия человека. Однако специфичное в отношении родителя поведение целых хромосом уже наблюдали в цитогенетических исследованиях хромосом у членистоногих еще в 1930-е годы (Chandra and Nanjundiah, 1990). Интересно, что термин «хромосомный импринтинг» впервые был предложен для описания элиминации хромосом отцовского происхождения у некоторых видов артропод (Crouse et al., 1971). Был также замечен хромосомный импринтинг Х-хромосомы млекопитающих, который приводит к инактивации одной из двух Х-хромосом, а именно хромосомы отцовского происхождения, во всех клетках самок сумчатых и в экстраэмбриональных тканях мыши (Cooper et al., 1971). В тот же самый период классические генетики получали у мышей мутантов с хромосомными транслокациями, которые заложили фундамент для наблюдений экспрессии импринтированных генов. Некоторые из этих «транслокационных» мышей, первоначально использовавшихся для картирования генов на хромосомах, демонстрировали специфичный в отношении родителя фенотип, когда определенные хромосомные участки были унаследованы как дупликации хромосомы одного родителя в отсутствие хромосомы другого родителя (что известно как однородительскя дисомия, или UPD, рис. 19.1). Эти результаты указывали на возможность того, «что для нормального развития мыши важна гаплоидная экспрессия определенных материнских или отцовских генов» (Searle and Beechey, 1978) В то же самое время другие генетики использовали необычного мутанта мыши, известного как “Hairpin-tail”, который имел большую делецию хромосомы 17, для того чтобы однозначно опровергнуть основной принцип генетики, согласно которому «организмы, гетерозиготные по данному локусу фенотипически идентичны независимо от того, какая гамета внесла в генотип ту или иную аллель» (Johnson, 1974). Вместо этого потомство, получившее делецию Hairpin-tail от матери, имело увеличенные размеры и погибало в середине эмбрионального развития, тогда как передача генетически идентичной хромосомы от отца давала жизнеспособных и фертильных мышей (рис. 19.1). В ретроспективном плане можно отметить, что несмотря на существование инактивации импринтированной Х-хромосомы у млекопитающих пользовавшаяся наибольшим вниманием трактовка этих экспериментов с генетическими транслокациями и делениями сводилась к тому, что гены на этих аутосомах в гаплоидном яйце или спермии действовали главным образом, чтобы модифицировать белки, используемые позже в эмбриональном развитии. Рис. 19.1. Модели (мышь) для исследования геномного импринтинга, позволяющие различать материнскую и отцовскую хромосомы
Млекопитающие являются диплоидными и наследуют полный хромосомный набор от матери и от отца. Однако можно создать мышей, которые (1) наследуют обе копии хромосомной пары от одного родителя и ни одной от другого (явление, известное как однородительская дисомия, или UPD); (2) наследуют частичную хромосомную делецию от одного родителя и хромосому дикого типа от другого; (3) наследуют хромосомы, несущие однонуклеотидные полиморфизмы (известные как SNPs) от одного родителя и хромосому дикого типа от другого. Потомки с UDPs или делениями склонны обнаруживать летальные фенотипы, тогда как SNPs обычно обеспечивают получение жизнеспособного потомства: (mat) — материнский; (запрещающий знак) — импринт
Рис. 19.1. Модели (мышь) для исследования геномного импринтинга, позволяющие различать материнскую и отцовскую хромосомы
Млекопитающие являются диплоидными и наследуют полный хромосомный набор от матери и от отца. Однако можно создать мышей, которые (1) наследуют обе копии хромосомной пары от одного родителя и ни одной от другого (явление, известное как однородительская дисомия, или UPD); (2) наследуют частичную хромосомную делецию от одного родителя и хромосому дикого типа от другого; (3) наследуют хромосомы, несущие однонуклеотидные полиморфизмы (известные как SNPs) от одного родителя и хромосому дикого типа от другого. Потомки с UDPs или делениями склонны обнаруживать летальные фенотипы, тогда как SNPs обычно обеспечивают получение жизнеспособного потомства: (mat) — материнский; (запрещающий знак) — импринт
Несмотря на это концепция дифференциального функционирования материнского и отцовского геномов обретала почву, и было выдвинуто предположение, что «материнский геном мог бы быть в норме активным в хромосомном участке Hairpin-tail, в то время как его отцовский партнер преимущественно инактивирован» (McLaren, 1979). Важный шаг к установлению существования геномного импринтинга у млекопитающих был сделан несколькими годами позже с разработкой улучшенной технологии ядерных пересадок, с помощью которой тестировалась возможность получения диплоидных однородительских эмбрионов с использованием исключительно ядер из мышиных яйцеклеток. С помощью техники ядерных пересадок донорский мужской или женский пронуклеус извлекали из только что оплодотворенной яйцеклетки и тонкой микропипеткой переносили его внутрь оплодотворенной яйцеклетки хозяина, из которой был предварительно удален материнский или отцовский пронуклеус. Таким путем воссоздавались диплоидные эмбрионы, с той лишь разницей, что они обладали двумя материнскими или двумя отцовскими геномами (известные, соответственно, как гиногенетические и андрогенетические эмбрионы) (рис. 19.2). Эта техника была вначале использована для того, чтобы показать, что ядра от оплодотворенных мутантных эмбрионов Hairpin-tail нельзя было «спасти», пересадив их в хозяйскую яйцеклетку дикого типа. Это доказывало, что именно геном эмбриона, а не цитоплазма ооцита, несет дефект Hairpin-tail. Это также подтверждало предположение о том, что гены на материнской и отцовской копиях хромосомы 17 функционируют по-разному в ходе эмбрионального развития (McGrath and Solter, 1984b). Впоследствии ядерные пересадки были использованы, чтобы продемонстрировать, что эмбрионы, реконструированные из двух материнских пронуклеусов (известные как гиногенетические эмбрионы) или двух отцовских пронуклеусов (андрогенетические эмбрионы), были нежизнеспособными; только эмбрионы, реконструированные из одного материнского и одного отцовского пронуклеуса давали жизнеспособное и фертильное потомство (McGrath and Solter, 1984а; Surani et al., 1984). Эта работа опровергла предшествующее мнение, что однородительские мыши могут развиваться до взрослого состояния (Hoppe and Illmensee, 1982). Гиногинетические эмбрионы в момент гибели были дефектными по экстраэмбриональным тканям, которые входят в состав плаценты, а андрогенетические эмбрионы были дефектными по эмбриональным тканям Это привело к гипотезе о том, что для эмбрионального развития требуются импринтированные гены, экспрессируемые с материнского генома, тогда как отцовский геном экспрессирует импринтированные гены, необходимые для экстраэмбрионального развития (Barton et al., 1984). Последующая идентификация импринтированных генов у мыши не подтвердила такое смещение в функционировании импринтированных генов, показывая, что наблюдаемые различия между гиногенетическими и андрогенетическими эмбрионами можно объяснить доминантным эффектом одного или нескольких импринтированных генов. Эксперименты с пересадкой ядер, в сочетании с подкрепляющими данными генетики мышей, дали убедительное доказательство того, что для эмбриогенеза у мышей требуются оба родительских генома, и заложили прочный фундамент для существования геномного импринтинга у млекопитающих (рис. 19.2). Широкий обзор вкладов родительских хромосом в эмбриональное развитие с использованием «транслокационных» мышей для создания UPD-хромосом (рис. 19.1) позволили идентифицировать у мыши два участка на хромосомах 2 и 11, которые демонстрировали противоположные фенотипы, когда присутствовали в виде двух материнских либо двух отцовских копий. Это еще более усилило доводы в пользу экспрессии специфичных в отношении родителя генов у млекопитающих (Cattanach and Kirk, 1985).
 Рис. 19.2. Для репродукции млекопитающих нужны материнский и отцовский геномы
Техника ядерных пересадок использовала микропипетки и микроскопы с большим увеличением для удаления мужского или женского ядра из только что оплодотворенной яйцеклетки и введения их в разных комбинациях во вторую оплодотворенную яйцеклетку («хозяна»), которая уже была денуклеирована; тем самым создавались снова диплоидные эмбрионы с двумя материнскими (гиногенетические) или двумя отцовскими (андрогенетические) геномами или двуродительским геномом (дикий тип). Гиногенетические и андрогенетические эмбрионы были летальными на ранних эмбриональных стадиях. Лишь те реконструированные эмбрионы, которые получили и материнское, и отцовское ядро (дикий тип), выживали и давали живых мышат Эти эксперименты показывают, что при воспроизведении млекопитающих необходимы и материнский, и отцовский геномы и что эти два родительских генома экспрессируют разные наборы генов, нужных для полного эмбрионального развития
Рис. 19.2. Для репродукции млекопитающих нужны материнский и отцовский геномы
Техника ядерных пересадок использовала микропипетки и микроскопы с большим увеличением для удаления мужского или женского ядра из только что оплодотворенной яйцеклетки и введения их в разных комбинациях во вторую оплодотворенную яйцеклетку («хозяна»), которая уже была денуклеирована; тем самым создавались снова диплоидные эмбрионы с двумя материнскими (гиногенетические) или двумя отцовскими (андрогенетические) геномами или двуродительским геномом (дикий тип). Гиногенетические и андрогенетические эмбрионы были летальными на ранних эмбриональных стадиях. Лишь те реконструированные эмбрионы, которые получили и материнское, и отцовское ядро (дикий тип), выживали и давали живых мышат Эти эксперименты показывают, что при воспроизведении млекопитающих необходимы и материнский, и отцовский геномы и что эти два родительских генома экспрессируют разные наборы генов, нужных для полного эмбрионального развития
Кроме того, накапливались клинические данные по генетике человека, которые убедительно свидетельствовали о том, что некоторые генетические состояния, в особенности синдром Прадера — Уилли (Prader-Willi), который, по-видимому, возникает исключительно путем передачи от отца, лучше всего объясняются экспрессией генов, специфичных в отношении родителя (Reik, 1989). Дальнейшие ключевые данные были получены в результате применения вновь разработанной технологии получения трансгенных мышей путем микроинъекции генных последовательностей в оплодотворенные яйцеклетки мышей. Этому нередко препятствовала проблема метилирования ДНК, неожиданно вызывающего сайленсинг трансгена в соматических тканях. Эта «проблема», однако, придала вес аргументам в пользу того, что родительские хромосомы ведут себя различно, когда было показано, что некоторые трансгены обнаруживают специфичные в отношении родителя различия по их способности приобретать метилирование ДНК. Обычно трансгены, переданные матерью [matemal-transmitted transgenes], метилировались, тогда как трансгены, переданные отцом, — нет. Однако лишь в нескольких случаях различия в метилировании ДНК коррелировали со специфичной в отношении родителя экспрессией. Хотя позднее было обнаружено, что существуют многочисленные черты сходства между импринтингом метилирования «трансгена» и геномным импринтингом эндогенных генов у мышей, по некоторым признакам они различаются (Reik et al., 1990). К их числу относятся высокая чувствительность к эффектам фона, что в большинстве случаев требует смешанного генетического фона для выявления импринтированного поведения, неспособность поддерживать импринтированную экспрессию в разных сайтах интеграции хромосом и потребность в чужеродных нуклеотидных последовательностях ДНК для производства импринтированного эффекта (Chaillet et al., 1995). Несмотря на обилие данных в пользу существования геномного импринтинга у млекопитающих его окончательное доказательство зависело от идентификации генов, демонстрирующих специфичную в отношении родителя экспрессию. Это случилось в 1991 году, когда были описаны три импринтированных гена мыши. Первый из них, lgf2r (Insulin-like growth factor type 2 receptor, то есть рецептор-«мусорщик» [«scavenger» receptor] для ростового гормона /g/2), был идентифицирован как матерински экспрессируемый импринтированный ген. Позднее было показано, что этот ген объясняет фенотип чрезмерного роста мутанта Hairpin-tail у мышей (Barlow et al., 1991). Спустя несколько месяцев ген Igf2 (Insulin-like growth factor type 2), о котором было известно, что он функционирует как гормон роста, был идентифицирован как отцовски экспрессируемый импринтированный ген (DeChiara et al., 1991; Ferguson-Smith et al., 1991). Наконец, впоследствии было показано, что ген Н19 (клон № 19 сДНК, выделенный из библиотеки фетальной печени), необычная некодирующая РНК (ncRNA), является матерински экспрессируемым импринтированным геном (Bartolomei et al., 1991). Чтобы идентифицировать эти три импринтированных гена, были использованы разнообразные стратегии, каждая из которых зависела от новых технологий, появляющихся в генетике мыши. Что касается Igf2,r было использовано позиционное клонирование [positional cloning], чтобы идентифицировать гены, которые картировались в делеции Hairpin-tail на хромосоме 17, и мыши, унаследовавшие эту делецию от одного родителя, были использованы для идентификации генов, обнаруживающих матерински-специфичную экспрессию (рис. 19.1). Что касается Igf2, физиологическую роль этого ростового фактора в эмбриональном развитии тестировали методом инсерционного мутагенеза. Удивительно, что мыши, несущие мутантную нефункциональную аллель, демонстрировали характерный фенотип после передачи от отца, но не обнаруживали его после передачи от матери. В свете ранее полученных данных о том. что нуклеотидные последовательности чужеродной ДНК могут индуцировать импринтированную экспрессию мышиных генов, отцовски-специфичную экспрессию Igf2 с немодифицированных хромосом дикого типа удалось подтвердить также, используя мышей, несущих реципрокные родительские дупликации и нехватки в хромосоме 7 (рис. 19.1). ncRNA HI9 была идентифицирована как импринтированный ген в ходе проверки гипотезы о том, что импринтированные гены могут быть собраны в кластеры, после того как этот ген был картирован вблизи локуса Igf2 на хромосоме 7 Хотя все эти стратегии должны были оказаться полезными в последующих попытках идентифицировать импринтированные гены, демонстрация того, что импринтированные гены собраны в плотные кластеры, оказалась центральным открытием для нашего понимания механизма, контролирующего геномный импринтинг у млекопитающих.
2. Геномный импринтинг — эпигенетическая система регуляции генов
Определяющей характеристикой геномного импринтинга является то, что он действует в cis-конфигурации (см. врезку внизу). Таким образом механизм импринтинга действует только на одну хромосому. Это контрастирует с /гая5-действуюишми механизмами регуляции генов, которые могут воздействовать на любую хромосому в ядре. Две родительские хромосомы в норме обычно содержат многочисленные однонуклеотидные различия (известные как однонуклеотидные полиморфизмы, SNPs), если данная популяция является аутбредной, но они могут быть генетически идентичны, если используются инбредные линии мышей. Поскольку геномный импринтинг наблюдается у инбредных мышей, имеющих идентичные родительские хромосомы, этот процесс должен использовать некий эпигенетический механизм, чтобы модифицировать информацию, содержащуюся в нуклеотидной последовательности ДНК и создать различие в экспрессии между двумя родительскими копиями гена. Эти наблюдения показывают также, что работает cis-действующий механизм сайленсинга, который ограничен одной хромосомой, так что факторы сайленсинга не могут свободно диффундировать в ядре и достигать активную копию гена. Хотя импринтированные гены репрессированы на одной родительской хромосоме и активны на другой, мы не знаем a priori, что геномный импринтинг — это только механизм сайленсинга. Наоборот, мы должны также иметь в виду, что он может быть неким активирующим механизмом, направленным на ген, который «по умолчанию» является сайленсированным в геноме млекопитающих. Стартовая точка для геномного импринтинга должна, следовательно, зависеть от эпигенетической системы, которая модифицирует, или «импринтирует» одну из двух родительских хромосом (рис. 19.3). Мы можем приводить доводы в пользу того, что этот импринт впоследствии используется для привлечения или отталкивания транскрипционных факторов и, таким образом, для изменения экспрессии импринтированного гена на одной родительской хромосоме. Поскольку мы знаем, что инбредные мыши с генетически идентичными хромосомами также обнаруживают геномный импринтинг, мы можем говорить, что родительские импринты не могут быть приобретены после того, как эмбрион становится диплоидным, потому что у эпигенетической машинерии клетки не было бы способа различить идентичные родительские копии генов. Таким образом, родительские импринты должны быть приобретены,когда два родительских хромосомных набора разделены, а это имеет место только во время формирования гамет и в течение примерно 12 часов после оплодотворения (рис. 19.3). Наиболее вероятный сценарий заключается в том, что гаметические импринты накладываются на отцовски-импринтированные гены во время образования спермиев и на матерински-импринтированные гены во время формирования яйцеклетки. Ключевая особенность «импринтированой» последовательности ДНК заключается в том, чтобы она была бы модифицирована только в одной из двух родительских гамет; таким образом, требуются системы узнавания двух типов, одна спермий-специфичная, а другая ооцит-специфичная, и каждая была бы направлена на другую нуклеотидную последовательность ДНК. Для импринта требуются еще несколько особенностей. Во-первых, будучи однажды установлен, он должен оставаться на той же самой родительской хромосоме после оплодотворения, когда эмбрион становится диплоидным. Во-вторых, этот импринт должен наследоваться той же родительской хромосомой после каждого клеточного деления у эмбриона и взрослого животного. Наконец, он должен «стираться». Последнее необходимо, потому что эмбрион примерно с середины своего развития последует либо по мужскому, либо по женскому пути развития, и его гонадам нужно будет производить только один тип импринтированных гаплоидных родительских гамет. Поскольку зародышевые клетки возникают из эмбриональных диплоидных клеток (рис. 19.3), они должны сперва потерять унаследованные ими материнские и отцовские импринты, прежде чем они приобретут импринты гамет. Ключевые особенности геномного импринтинга у млекопитающих ¦ cis-действуютий механизм ¦ Результат особенностей наследования, а не пола. ¦ Импринты являются эпигенетическими модификациями, приобретаемыми одной родительской гаметой ¦ Импринтированные гены в основном собраны в кластеры вместе с некодирующей РНК. ¦ Импринты могут модифицировать удаленные регуляторные элементы, которые действуют на множественные гены. ¦ Импринтированные гены играют роль в развитии млекопитающих Рис. 19.3. Приобретение и стирание импринтов в ходе развития млекопитающих
Импринты приобретаются гаметами; таким образом, ооциты и спермин уже несут импринтированные хромосомы (импринты 1-й генерации). После оплодотворения, когда эмбрион становится диплоидным, данный импринт поддерживается на той же самой родительской хромосоме после каждого клеточного деления в клетках эмбриона, оболочках, плаценте, а также у взрослого животного. Зародышевые клетки формируются в эмбриональной гонаде, и импринты стираются только в этих клетках до детерминации пола. Коль скоро эмбрион развивается в самца, гонады дифференцируются в семенники, продуцирующие гаплоидные сперматозоиды, которые приобретают отцовский импринт на своих хромосомах. Аналогичным образом, у развивающихся самок хромосомы в яичниках приобретают материнские импринты (импринты 2-й генерации)
Рис. 19.3. Приобретение и стирание импринтов в ходе развития млекопитающих
Импринты приобретаются гаметами; таким образом, ооциты и спермин уже несут импринтированные хромосомы (импринты 1-й генерации). После оплодотворения, когда эмбрион становится диплоидным, данный импринт поддерживается на той же самой родительской хромосоме после каждого клеточного деления в клетках эмбриона, оболочках, плаценте, а также у взрослого животного. Зародышевые клетки формируются в эмбриональной гонаде, и импринты стираются только в этих клетках до детерминации пола. Коль скоро эмбрион развивается в самца, гонады дифференцируются в семенники, продуцирующие гаплоидные сперматозоиды, которые приобретают отцовский импринт на своих хромосомах. Аналогичным образом, у развивающихся самок хромосомы в яичниках приобретают материнские импринты (импринты 2-й генерации)
Каким образом идентифицируются гаметические импринты? Не слишком вдаваясь в семантику, импринт можно определить как эпигенетическую модификацию, отличающую материнскую копию гена от отцовской копии гена Импринт, будучи однажды сформирован, должен также позволять транскрипционной машине по-разному обрабатывать материнскую и отцовскую копии гена, находящиеся в одном и том же ядре. Можно предсказать, что гаметический импринт будет непрерывно присутствовать на всех стадиях развития (рис. 19.3); таким образом, импринты можно обнаружить, сравнивая эпигенетические модификации на материнских и отцовских хромосомах в эмбриональных или взрослых тканях (с использованием стратегий, изображенных на рис. 19.1) и прослеживая их в развитии обратно, до одной из двух гамет. Гаметические импринты могли бы быть модификациями ДНК или гистоновых белков, которые упаковывают ДНК в хромосомы. Хотя у млекопитающих известен лишь один тип эпигенетических модификаций ДНК, а именно метилирование ДНК (глава 18), гистоны могут нести множественные типы модификаций, в том числе метилирование, ацетилирование, фосфорилирование. сумоилирование и убиквитилирование (дополнительные детали см. в главе 10). Они могут также замещаться вариантными гистонами со специфическими функциями (главы 3 и 13). Любые из этих эпигенетических модификаций можно было бы теоретически квалифицировать как импринт. Мы можем считать, что ферменты, ответственные за эти эпигенетические модификации, могли бы экспрессироваться в одной из двух гамет и специфически ассоциироваться с одной родительской хромосомой, чтобы скопировать данную модификацию, когда клетка делится. Однако, как описывается в разделе 3, лишь метилирование ДНК было четко продемонстрировано в качестве гаметического импринта для импринтированных генов у млекопитающих и, на сегодняшний день, является единственной наследуемой модификацией. Каким образом действует гаметический импринт, чтобы контролировать импринтированную экспрессию? Как обсуждалось выше, нам необходимо «быть открытыми» в вопросе о том, ведет ли импринт к активации или же к репрессии одной родительской копии импринтированного гена. Чтобы понять, как действует импринт, нам нужна информация по трем вопросам: какая родительская хромосома несет данный импринт, какая родительская хромосома несет экспрессируемую аллель импринтированного гена и каково положение импринтированной последовательности по отношению к экспрессируемой или «молчащей» аллели импринтированного гена. Используя подходы этого типа, мы теперь знаем, что гаметические импринты могут действовать на целые кластеры генов сразу. Эти импринтированные кластеры содержат от 3 до 10 импринтированных генов и имеют протяженность от 100 т. п.н. до 3000 т. п.н. геномной ДНК (дополнительные детали см. http://www.mgu.har.mrc.ас.uk/research/imprinting/). Большинство генов в любом одном кластере — это импринтированные гены иРНК, кодирующих белки; однако по меньшей мере один из них — всегда ген импринтированной ncRNA (некодирующей РНК). Из-за расположения импринтированных генов в виде кластеров, при том что некоторые гены экспрессируются с одной родительской хромосомы, а некоторые с другой, не всегда просто определить, как действует импринт. Можно исследовать влияние импринта на единичные гены в кластере, но может оказаться более информативным изучать влияние импринта на весь кластер. Более детально это описывается в разделе 3. Одно, тем не менее, очевидно. Природа не выбрала самую простую модель, по которой импринт направляется к промотору, чтобы преимущественно [preemptively] сайленсировать импринтированный ген в одной гамете. Вместо этого оказывается, что импринты, в целом, направляются к удаленным cis-действующим репрессорам, которые влияют на экспрессию множественных генов, локализованных на больших расстояниях на той же хромосоме.
3. Ключевые открытия в области геномного импринтинга
3.1. Импринтированные гены контролируют эмбриональный и неонатальный рост
Какова же функция геномного импринтинга у млекопитающих? Одним из способов ответить на этот вопрос было бы определение функции известных импринтированных генов in vivo. Современные технологии позволяют сейчас определять функционирование генов у мышей путем индукции мутаций в нуклеотидной последовательности гена, чтобы нарушить его функцию. С помощью этой техники «гомологичной рекомбинации» были определены функции 26 из 78 известных импринтированных генов (оригинальные ссылки см. по адресу http://www.mgu.har.mrc.ac.uk/research/imprinting/function.html). В табл. 19.1 эти гены перечисляются соответственно их функции в развитии мышей и их экспрессии с материнской или отцовской аллели. Самая большая категория на сегодня охватывает импринтированные гены, которые влияют на рост эмбриона, или плаценту, или на новорожденного, полностью зависящего от материнского молока. В этой категории приблизительно половина — это отцовски-экспрессируемые импринтированные гены, которые функционируют как ростовые промоторы (как показывает задержка роста у эмбрионов, дефектных по этому гену). Другая половина — это матерински — экспрессируемые импринтированные гены, которые функционируют как ростовые репрессоры (что демонстрируется усилением роста у эмбрионов, дефектных по этому гену). Следующая по величине категория включает гены, не вызывающие никаких очевидных дефектов в эмбриональном развитии; за нею следует категория с поведенческими или нейрологическими дефектами. Остающиеся три испытанных гена обладают разнообразными, внешне не связанными дефектами. Эти результаты являются, на одном уровне, разочаровывающими, поскольку они не не позволили идентифицировать одну какую-нибудь функцию для всех импринтированных генов. Однако все же может быть свет в конце туннеля, потому что эти результаты говорят нам, что более чем 50 % импринтированных генов функционируют как регуляторы эмбрионального или неонатального роста. Более интересно, что способность регулировать рост оказывается четко разделенной: матерински-экспрессируемые регулирующие рост гены действуют как репрессоры роста потомства, тогда как отцовски-экспрессируемые гены в этой категории действуют, усиливая рост, 20 % протестированных импринтированных генов являются активными в нейрологических процессах, некоторые из них влияют на скорость неонатального роста, меняя материнское поведение. Наиболее загадочной категорией, принимая во внимание попытки идентифицировать селективную силу, направляющую приобретение экспрессии импринтированных генов у всех ныне живущих млекопитающих, является категория импринтированных генов, не имеющих никаких очевидных биологических функций в эмбриональном развитии, и эта категория содержит 25 % протестированных импринтированных генов.3.2. Функция геномного импринтинга у млекопитающих
Могут ли анализы функции гена помочь нам понять, почему гены импринтированы у млекопитающих? Взгляд на геномный импринтинг у разных типов млекопитающих проливает некоторый свет на эту проблему. Плацентарные млекопитающие, такие как мыши и человек, и сумчатые, такие как опоссум и валлаби, демонстрируют геномный импринтинг. Яйцекладущие млекопитающие, такие как утконос и ехидна, по-видимому, не имеют импринтированных генов, хотя экстенсивные исследования все еще не были проведены. Плацентарные млекопитающие и сумчатые различаются в отношении их репродуктивной стратегии, которая позволяет зародышу непосредственно влиять ца объем материнских ресурсов, используемых для его собственного роста. Напротив, эмбрионы, развивающиеся в яйце, не способны прямо влиять на материнские ресурсы. Большинство беспозвоночных и позвоночных используют репродуктивную стратегию, связанную с откладкой яиц. Важно отметить, что они могут также претерпевать партеногенез — форму репродукции, при которой женская гамета развивается в новую диплоидную особь без оплодотворения мужской гаметой (обратите внимание на то, что партеногенетические эмбрионы возникают в результате дупликации одного и того же материнского генома, тогда как гиногенетические эмбрионы, изображенные на рис. 19.3, возникают из двух разных материнских геномов). Эта способность проходить партеногенез, вероятнее всего, указывает на полное отсутствие геномного импринтинга, поскольку она показывает, что без отцовского генома можно обойтись. У млекопитающих, однако, прямым следствием экспрессии импринтированного гена, контролирующего рост плода, является невозможность партеногенеза. Для того чтобы произвести жизнеспособное потомство, необходимы и мать, и отец, что делает млекопитающих в этом деле полностью зависимыми от полового воспроизведения (рис. 19.4). У млекопитающих партеногенез пока еще не наблюдался, несмотря на противоположные заявления, хотя редкие мыши с диплоидным материнским геномом недавно были созданы путем манипулирования с экспрессией импринтированного кластера Igf2 (Kono et al., 2004). Рис. 19.4. Импринтированные гены играют роль в репродукции млекопитающих
Млекопитающие диплоидны, и репродукция требует оплодотворения гаплоидной женской яйцеклетки гаплоидным мужским сперматозоидом для того, чтобы воссоздать диплоидный эмбрион. Только самки анатомически приспособлены для воспроизведения, но они не могут использовать для этого партеногенез, поскольку существенные импринтированные гены, необходимые для роста плода, импринтированы и сайленсированы на материнских хромосомах. Эти гены экспрессируются только с отцовских хромосом; таким образом, у млекопитающих для репродукции необходимы обе родительские хромосомы. Партеногенез — это образование диплоидного потомства из двух копий одного и того же материнского генома
Рис. 19.4. Импринтированные гены играют роль в репродукции млекопитающих
Млекопитающие диплоидны, и репродукция требует оплодотворения гаплоидной женской яйцеклетки гаплоидным мужским сперматозоидом для того, чтобы воссоздать диплоидный эмбрион. Только самки анатомически приспособлены для воспроизведения, но они не могут использовать для этого партеногенез, поскольку существенные импринтированные гены, необходимые для роста плода, импринтированы и сайленсированы на материнских хромосомах. Эти гены экспрессируются только с отцовских хромосом; таким образом, у млекопитающих для репродукции необходимы обе родительские хромосомы. Партеногенез — это образование диплоидного потомства из двух копий одного и того же материнского генома
Почему геномный импринтинг развился лишь у некоторых млекопитающих, но не у позвоночных в целом? Три особенности геномного импринтинга — функция регуляции роста у многих импринтированных генов, ограничение импринтированных генов плацентарными и сумчатыми млекопитающими и, наконец, необходимость отцовского генома для развития плода — могут соответствовать двум в равной мере привлекательным гипотезам. Первая гипотеза предполагает, что геномный импринтинг развился в ответ на ситуацию «родительского конфликта» (Moore and Haig, 1991). Эта ситуация возникает в силу противоположных интересов материнского и отцовского геномов: эмбриональный рост зависит от одного родителя, но на него влияет эмбрион, чей геном происходит от двух родителей. Предполагается, что отцовски-экспрессируемые гены стимулируют эмбриональный рост, тем самым максимизируя конкуретноспособность индивидуального потомка, несущего конкретный отцовский геном. Матерински-экспрессируемые импринтированные гены, как предполагается, подавляют рост плода. Это могло бы сделать возможным более равномерное распределение материнских ресурсов между всеми потомками и увеличивало бы шансы на передачу материнского генома более многочисленным потомкам, которые могут иметь разные отцовские геномы. Вторая гипотеза называется «трофобластная защита» (Varmuza and Mann, 1994). Она предполагает, что материнский геном находится в условиях повышенного риска вследствие того, что мать анатомически приспособлена к внутриутробному воспроизведению; этот риск возникает, если спонтанная активация ооцита приводит к полному эмбриональному развитию. Поскольку у самцов отсутствуют необходимые анатомические предпосылки для внутриутробного воспроизведения, они не рискуют в той же мере, если происходит спонтанная активация сперматозоидов. Таким образом, предполагается, что импринтинг либо сайленсирует гены на материнской хромосоме, стимулирующие развитие плаценты, либо активирует гены, лимитирующие этот процесс. Те гены, которые необходимы для формирования плаценты, экспрессировались бы, следовательно, только с отцовского генома, после того как произошло оплодотворение. Если хотя бы одна из этих гипотез является правильным объяснением эволюции геномного импринтинга у млекопитающих, го какая из них? Обе гипотезы указывают на роль импринтированных генов в регулировании развития и функции плаценты; однако ни модель родительского конфликта, ни модель трофобластной защиты не могут полностью объяснить все имеющиеся данные (Wilkins and Haig, 2003). Интересно отметить, что импринтированные гены были также идентифицированы в эндосперме растений — ткани, которую сравнивали с плацентой эмбрионов у млекопитающих, поскольку она переносит пищевые ресурсы от родительского растения к зародышу (более подробно о геномном импринтинге у растений см. в главе 11). Это открытие делает более сильными доводы в пользу того, что геномный импринтинг развился как средство регулирования переноса питательных веществ между родителем и потомством, но не объясняет, почему. Более полные или альтернативные объяснения функции геномного импринтинга у млекопитающих могли бы быть получены из двух источников. Первым таким источником могло бы быть исследование функции «импринтинга» по всему генному кластеру per se — в противоположность изучению фенотипа мышей, лишенных продукта какого-то одного импринтированного гена. Это потребовало бы умения ревертировать импринт и генерировать двуродительскую экспрессию генов по всему импринтированному кластеру. Второй подход заключается в том, чтобы узнать в деталях, как гены импринтируются. Возможно, что не все гены в кластере являются предумышленной мишенью для механизма импринтинга и что некоторые из них могут быть просто «безучастными свидетелями» процесса, так что их функция мало что говорила бы о роли геномного импринтинга. Существование генов — «безучастных наблюдателей», затрагиваемых механизмом импринтинга, может удовлетворительно объяснить странное обилие импринтированных генов без какой-либо очевидной биологической функции в развитии (табл. 19.1).
Таблица 19.1. Функция импринтированных генов, определяемая путем инактивации генов
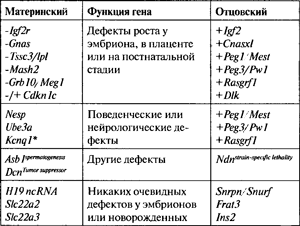 (Материнский) — матерински-экспрессированный импринтированный ген, (отцовский) — отцовски-экспрессированные импринтированные гены. (+) — стимулирующее рост влияние, (-) — подавляющее рост влияние, (-/+) — дефект в дифференцировке, но регуляторный статус роста неясен, (*) дополнительный дефект дифференцировки (ссылки на первичные данные можно найти по адресу http://www.mgu.harтгс. ас.uk/research/imprinting/function.html
(Материнский) — матерински-экспрессированный импринтированный ген, (отцовский) — отцовски-экспрессированные импринтированные гены. (+) — стимулирующее рост влияние, (-) — подавляющее рост влияние, (-/+) — дефект в дифференцировке, но регуляторный статус роста неясен, (*) дополнительный дефект дифференцировки (ссылки на первичные данные можно найти по адресу http://www.mgu.harтгс. ас.uk/research/imprinting/function.html
3.3. Импринтированные гены собраны в кластеры и контролируются импринтными контрольными элементами
На сегодня около 80 импринтированных генов картированы в десяти хромосомах мыши, и оказалось, что большинство из них собраны в кластеры (Verona et al., 2003). Одиннадцать кластеров импринтированных генов были приписаны к восьми хромосомам (номера 2,6,7,9, 11,12,15 и 17), тогда как одиночные импринтированные гены были идентифицированы лишь на трех хромосомах (номера 2, 14 и 18). Существование кластеров импринтированных генов — сильный аргумент в пользу того, что некий общий ДНК-элемент может регулировать импринтированную экспрессию множественных генов в cis-конфигурации. На сегодняшний день хорошо охарактеризованы только шесть импринтированных кластеров и они перечислены в табл. 19.2 по имени основного импринтированного гена иРНК в кластере (т. е. кластеры импринтированных генов Igf2r; Igf2, Kcnq1. Gnas. Dlk1) или по ассоциации с тем или иным заболеванием (кластер Pws — синдром Прадера — Вилли, более детально обсуждаемый в главе 23). Эти шесть кластеров содержат от трех до десяти импринтированных генов и простираются на более чем 100—3000 т. п.н. ДНК. На рис. 19.5 изображен специфичный в отношении родителя паттерн экспрессии в типичном кластере импринтированных генов. Общей чертой этих шести кластеров является присутствие нуклеотидной последовательности ДНК, несущей гаметический импринт метилирования, который известен как гаметический DMR (Differentially DNA-Metylated Region). Гаметический импринт метилирования определяется как импринт метилирования, устанавливаемый в одной гамете и поддерживаемый в диплоидных клетках эмбриона только на одной родительской хромосоме. В четырех кластерах (Igf2r; Kcnq1, Gnas и Pws) гаметический DMR имеет материнский импринт метилирования, приобретенный в оогенезе, тогда как в двух кластерах (Igf2 и Dlk1) он имеет отцовский импринт метилирования, приобретенный во время сперматогенеза. Во всех шести примерах было показано, что гаметический DMR контролирует импринтированную экспрессию всего кластера или его части и поэтому обозначается как элемент контроля импринта (ICE, imprint control element) для этого кластера (Spahn and Barlow, 2003). Табл. 19.2 показывает, что каждый кластер импринтированных генов содержит множественные иРНК и по меньшей мере одну ncRNA. Четыре кластера (Igf2r, Kcnq1, lgf2 и Dlk1) демонстрируют простой паттерн, в котором хромосома, несущая метилированный гаметический DMR, экспрессирует множественные иРНК, но не экспрессирует ncRNA (как показано на рис. 19.5 для материнского гаметического DMR). Хромосома, несущая неметилированный гаметический DMR, обнаруживает реципрокный паттерн экспрессии: репрессию множественных и PHК и экспрессию ncRNA. Остальные два кластера (Gnas и Pws) обладают сложным паттерном, где импринтированные иРНК экспрессируются с обеих хромосом, тогда как импринтированная ncRNA экспрессируется только с хромосомы, несущей неметилированный гаметический DMR. Табл. 19.2 показывает, что в трех кластерах (Igrf2r, Kcnq1 и Gnas) промотор ncRNA расположен в интроне одной из импринтированных иРНК, в то время как в остальных кластерах промотор ncRNA отделен от импринтированных генов и PHК, хотя и лежит близко к ним. Это тесное перемешивание активных и «молчащих» генов в импринтированном кластере показывает, что механизмы сайленсинга и активации, влияющие на импринтированные гены, не распространяют свое действие и могут быть ограничены затрагиваемым геном. В частности, тот факт, что промотор «молчащей» ncRNA может находиться в интроне активно транскрибируемого гена, показывает, что механизмы сайленсинга, могут даже не распространять свое действие на всю длину гена, но могут быть ограничены лишь регуляторными элементами. Какова же роль гаметического DMR? Несмотря на тот факт, что гаметические DMR могут матерински или отцовски метилироваться, эксперименты по удалению этих элементов дали в целом сходные результаты, хотя и за несколькими исключениями (рис. 19.6). Что касается трех кластеров (Igf2r, Kcnq1, Dlk1), экспериментальная делеция метилированного гаметического DMR не дала никакого эффекта. Однако делеция неметилированного гаметического DMR полностью ревертировала картину специфичной в отношении родителя экспрессии, так что экспрессия ncRNA была утрачена, а биаллельная экспрессия и PHК была приобретена (Lin et al., 1995; Zwart et al., 2001; Fitzpatnck et al., 2002). Два кластера (Gnas и Pws), оказывается, содержат более одного гаметического DMR и демонстрируют более ложное поведение, которое все еще обнаруживает некоторое сходство с этим паттерном (Williamson et al., 2006). Кластер Igf2, однако, ведет себя иначе: делеция и метилированного, и неметилированного гаметического DMR вызывает изменения в экспрессии иРНК и ncRNA в cis-конфигурации (Thorvaldsen et al., 1998).Таблица 19.2. Особенности кластеров импринтированных генов в геноме мыши

3.4. Кластеры импринтированных генов содержат по меньшей мере одну ncRNAb
Из 12 известных кластеров импринтированных генов восемь ассоциированы с ncRNA (O’Neill, 2005). Раньше считалось, что ncRNAs, за исключением тех, которые участвуют в процессинге и трансляции РНК, т. е. таких как РНК сплайсинга, траспортные и рибосомные, являются раритетом в геноме млекопитающих. Теперь, благодаря доступности нуклеотидных последовательностей геномов мыши и человека, может быть выполнен анализ транскриптома, дающий перечень всех РНК-транскриптов в данной клеточной популяции. Уже показано, что большая часть транскриптома млекопитающих (не считая ncRNAs, связанные с процессингом и трансляцией) в основном, как это ни удивительно, состоит из ncRNAs, а не и PHК, кодирующих белки. Большой объем транскрипции ncRNAs в геноме млекопитающих и тот факт, что большое число ncRNAs перекрываются с известным кодирующим белок геном, показывают, что это не может рассматриваться как «транскрипционный шум», но представляет, вероятно, новую, до сих пор неизвестную систему регуляции генов (Mattick, 2005). Был создан Web-сайт, названный NON CODE, чтобы собирать данные о функциональных ncRNAs по всем организмам (http://noncode.bioinfo.org.cn/). Имеются несколько типов ncRNAs млекопитающих, которые, как было показано, обладают регуляторными функциями по отношению к генам, в том числе «короткие» ncRNAs от 21 до 30 п.о., участвующие в путях РНК-интерференции (глава 8), «межгенные» непроцессируемые транскрипты, регулирующие локальную активность хроматина (Haussecker and Proudfoot, 2005), и «длинные» процессируемые ncRNAs, такие как Xist, которая участвует в инактивации Х-хромосомы (глава 17).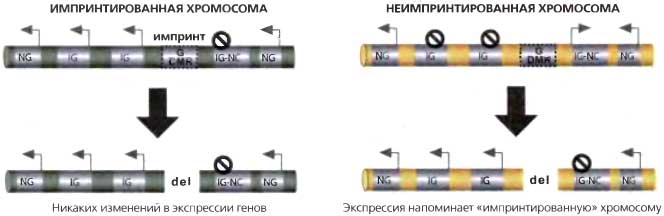 Рис. 19.6. Импринтированная экспрессия регулируется гаметическими DMR
На левой части рисунка показан эффект делегирования гаметического DMR из импринтированной хромосомы (зеленый цвет). Правая часть демонстрирует эффект делегирования гаметического DMR из неимпринтированной хромосомы (желтый цвет). Во многих импринтированных кластерах (например, lgf2r, Kcnq1 и Dlk1) экспериментальная делеция G-DMR влияет лишь на хромосому, несущую неимпринтированныйОМЯ. Результатом этого является утрата репрессии импринтированных генов иРНК, кодирующих белки (IG) и приобретение репрессии импринтированного гена ncRNA (IG-NC). Следует обратить внимание на то, что в некоторых импринтированных кластерах (Igf2 и Pws). которые здесь не изображены, метилированный G-DMR оказывается также необходимым для экспрессии некоторых из импринтированных иРНК в cis-конфигурации: (del) — делегированная ДНК, (G-DMR) — гаметический диффернциально ДНК-метилированный район, (NG) — неимпринтированный ген. (стрелка) — экспрессируемая аллель (черный запрещающий знак) — репрессированная аллель, (IMPRINT) — эпигенетическая модификация, ведущая к изменению экспрессии гена в cis-конфигурации
Рис. 19.6. Импринтированная экспрессия регулируется гаметическими DMR
На левой части рисунка показан эффект делегирования гаметического DMR из импринтированной хромосомы (зеленый цвет). Правая часть демонстрирует эффект делегирования гаметического DMR из неимпринтированной хромосомы (желтый цвет). Во многих импринтированных кластерах (например, lgf2r, Kcnq1 и Dlk1) экспериментальная делеция G-DMR влияет лишь на хромосому, несущую неимпринтированныйОМЯ. Результатом этого является утрата репрессии импринтированных генов иРНК, кодирующих белки (IG) и приобретение репрессии импринтированного гена ncRNA (IG-NC). Следует обратить внимание на то, что в некоторых импринтированных кластерах (Igf2 и Pws). которые здесь не изображены, метилированный G-DMR оказывается также необходимым для экспрессии некоторых из импринтированных иРНК в cis-конфигурации: (del) — делегированная ДНК, (G-DMR) — гаметический диффернциально ДНК-метилированный район, (NG) — неимпринтированный ген. (стрелка) — экспрессируемая аллель (черный запрещающий знак) — репрессированная аллель, (IMPRINT) — эпигенетическая модификация, ведущая к изменению экспрессии гена в cis-конфигурации
Какие типы ncRNAs связаны с кластерами импринтированных генов? Анализ ncRNAs, ассоциирующихся с шестью хорошо охарактеризованными импринтированными кластерами, перечисленными в табл. 19.2, все еще неполон, выявляя некоторые черты сходства, но и некоторые различия. Три импринтированные ncRNAs являются необычно длинными зрелыми РНК: Air имеет длину 108 т. о. (Lyle et al., 2000), Kcnq1ot1 — по крайней мере 60 т. о., но окончательный размер еще не определен (Mitsuya et al., 1999), a Ube3aas может превышать 1000 т. о. (Landers et al., 2004). Напротив, ncRNA Н19 имеет длину всего 2.3 т. о. (Brannan et al., 1990). ncRNA Gtl2 содержит множественные альтернативно сплайсированные транскрипты; однако была отмечена также межгенная транскрипция «вниз по течению», позволяя предполагать, что вероятны и более длинные транскрипционные единицы (Tierling et al., 2005). ncRNa Nespas крупнее, чем можно определить на РНК-блотах, и ее полный размер неизвестен (Wroe et al., 2000). Все эти импринтированные ncRNAs бедны интронами, имеют низкое отношение «интрон — экзон» или не сплайсированы как зрелые транскрипты. Ранее предполагалось, что все импринтированные гены бедны интронами; однако это может быть верно лишь для импринтированных ncRNAs (Hurst et al., 1996). Еще одной особенностью является то, что две импринтированные ncRNAs (Ube3aas и Gtl2-mpancKpunmbi «вниз по течению») действуют как хозяйские транскрипты для snoRNAs (малых ядрышковых РНК, которые направляют модификации к рРНК, snRNAs и, возможно, иРНК, действуя тем самым как посттранскрипционные регуляторы). snoRNAs не направляются к импринтированным генам иРНК в кластере, и вполне вероятно, что они не играют никакой роли в самом механизме импринтинга (Seitz et al., 2004). Аналогичным образом, miRNAs в кластере Dlk1 участвуют в посттранскрипционной репрессии одного из генов и РНК в кластере, но их роль в регулировании импринтированной экспрессии кластера еще не проверена (Davis et al., 2005). Две особенности импринтированных ncRNAs показывают, что они могут играть роль в сайленсинге импринтированных генов иРНК (т. е. генов, кодирующих белки) в кластере. Первая заключается в том. что ncRNA обычно обнаруживает реципрокную специфичную в отношении родителя экспрессию по сравнению с импринтированными генами иРНК (табл. 19.2). Во-вторых, DMR, несущий гаметический импринт метилирования, который контролирует импринтированную экспрессию целого кластера, перекрывается с промотором ncRNA в трех случаях (Air, Kcnq1otl, Gnas Exon la). Это могло бы служить указанием на то, что эти импринты возникли для регуляции ncRNA в каждом импринтированном кластере В пользу такой интерпретации свидетельствуют эксперименты, в которых делетировали неметилированную последовательность, несущую гаметический DMR, вызывая тем самым утрату экспрессии ncRNA одновременно с приобретением экспрессии импринтированных генов иРНК (рис. 19.6), как было проверено в кластерах Igf2r, Kcnq1, Gnas, Pws и Dlk1 (Wutz et al., 1997; Bielinska et al., 2000; Fitzpatrick et al., 2002; Lin et al., 2003; Williamson et al., 2006). Кластер Igf2 представляет собой исключение, потому что оказывается, что неметилированный гаметический DMR не является непосредственным регулятором ncRNA Н19 (Thorvaldsen et al., 1998). Эксперименты, в которых прямо тестируется роль самой ncRNA, были проведены сейчас для двух ncRNAs из кластеров импринтированных генов типа I (Air и Kcnq1otl) и одной ncRNA (Н19) из кластера типа II. Укорочение ncRNA>4/r длиной 108 т. о. до 3 т. о. показало, что сама ncRNA необходима для сайленсирования всех трех генов иРНК в кластере Igf2r, указывая тем самым на четкую регуляторную роль этой ncRNA (Sleutels et al., 2002). Кроме того, укорочение ncRNA Kcnq1otl, имеющей длину 60 т. о., до 1.5 т. о. также показало, что эта ncRNA прямо нужна для сайленсирования всех десяти генов иРНК в более крупном кластере Kcnq1 (Mancini-DiNardo, 2006). Напротив, точная делеция ncRNA Н19 и промотора не оказала никакого влияния на импринтинг в кластере lgf2 в тканях эндосперма, хотя в мезодермальной ткани наблюдалась некоторая потеря импринтинга (Schmidt et al., 1999). Таким образом, два из матерински-импринтированных кластеров типа I имеют общий механизм сайленсинга, зависящий от ncRNA, тогда как единственный отцовски-импринтированный кластер типа II, изученный до настоящего времени, использует другую модель, зависящую от инсулятора. Мы с нетерпением ждем результаты по другим импринтированным кластерам, чтобы посмотреть, указывает ли все это на существование только двух типов базовых механизмов импринтинга у млекопитающих — один для отцовски-импринтированных кластеров, а другой для матерински-импринтированных кластеров.
3.5. Роль метилирования ДНК в геномном импринтинге
Идентификация первых трех эндогенных импринтированных генов в 1991 году позволила исследователям изучить, каким образом эпигенетическая машинерия клетки маркирует импринтированный ген в отношении его родительской идентичности. Первым и наиболее легко тестируемым кандидатом было метилирование ДНК — модификация у млекопитающих, ковалентно добавляющая метильную группу к остатку цитозина в любом динуклеотиде CpG. Метилирование ДНК достигается благодаря действию de novo метилтрансфераз и сохраняется in situ каждый раз, когда клетка делится, действием поддерживающих метилтрансфераз (описано в главе 18). Следовательно, эта модификация удовлетворяет критериям, очерченным на рис. 19.3 для метки родительской идентичности, или «импринта», поскольку (1) она может быть установлена либо в спермии, либо в ооците de novo метилтрансферазами, которые действуют лишь в одной гамете, (2) она может стабильно воспроизводиться при каждом делении эмбриональной клетки с помощью поддерживающей метилтрансферазы и (3) она может быть стерта в зародышевой линии для перезагрузки импринта в следующем поколении либо путем пассивного деметилирования, либо, возможно, действием деметилазы. Метилирование ДНК потенциально могло бы выполнять две функции в геномном импринтинге. Оно могло бы действовать как импринтирующая метка, будучи приобретаемой de novo только хромосомами одной гаметы. Оно могло бы также служить для сайленсинга одной из родительских аллелей, поскольку метилирование ДНК связано с репрессией гена. Чтобы определить, какой же функцией оно обладает, необходимо сначала показать, что метилирование ДНК присутствует только на одной родительской хромосоме (т. е., что оно является DMR). Во-вторых, необходимо идентифицировать, какой импринтированный ген в кластере и какая часть регуляторного аппарата этого гена маркированы метилированием ДНК. Локализация меток метилирования на промоторе или на удаленных позитивных или негативных регуляторных элементах будет иметь разные последствия для экспрессии гена. Наконец, необходимо идентифицировать, когда в ходе развития формируется DMR. Если он формируется во время гаметогенеза и стабильно поддерживается в соматических клетках (что известно как гаметический DMR), он может служить маркером импринтинга. Если, однако, он помещается на ген после того как эмбрион стал диплоидным, когда обе родительские хромосомы находятся в одной и той же клетке (известно как соматический DMR), он вряд ли служит в качестве метки идентичности, но может служить для поддержания специфичного в отношении родителя сайленсинга. Родительское аллель-специфичное метилирование ДНК обнаружено в большинстве импринтированных изученных кластеров. Например, кластер Igf2 имеет гаметический DMR, расположенный в 2 т. о. «вверх по течению» от промотора ncRNA Н19, который метилирован только в родительской гамете и поддерживается после этого во всех соматических тканях (Bartolomei et al., 1993; Ferguson-Smith et al., 1993). Был идентифицирован похожий гаметический DMR, который покрывал промотор ncRNA Air, присутствовал только на «молчащей» материнской копии гена и был приобретен в женской гамете (Stoger et al., 1993). Удивительно, что гаметические DMRs не были идентифицированы в промоторах главных импринтированных кодирующих белок генов в этих кластерах (соответственно, lgf2 и lgf2r). Вместо этого сайленсированный промотор Igf2 оказался свободным от метилирования ДНК, тогда как сайленсированный промотор Igf2r лежит внутри соматического DMR (Sasaki et al., 1992; Stoger et al., 1993). Подобные находки гаметических DMRs, метилированных на хромосоме, несущей «молчащую» копию импринтированной ncRNA, были сделаны для четырех других хорошо изученных кластеров импринтированных генов, Pws, Kcnq1, Gnas и Dlk1 (Shemer et al., 1997; Liu et al., 2000; Takada et al., 2002; Yatsuki et al., 2002). Соматические DMRs возникают реже и были описаны лишь на нескольких импринтированных кодирующих белки генах в каждом кластере, что указывает на то, что метилирование ДНК может играть лишь ограниченную роль в поддержании экспрессии импринтированного гена (Stoger et al., 1993; Moore et al., 1997; Yatsuki et al., 2002). Делеции гаметических DMRs у мышей приводят к полной утрате импринтинга для множественных генов, доказывая тем самым, что этот класс DMRs служит также как основной ICE для всего кластера (рис. 19.6) (Wutz et al., 1997; Thorvaldsen et al., 1998; Bielinska et al., 2000; Fitzpatrick et al., 2002; Lin et al., 2003; Williamson et al., 2006). Напротив, делеция соматических DMRs влияет на экспрессию связанного импринтированного гена, кодирующего белок, но импринтированная экспрессия поддерживается другими генами в кластере (Constancia et al.; Sleutels et al., 2003). Нехватка метилирования ДНК по всему геному, вызываемая мутациями в генах семейства Dnmt, подчеркивает его существенную роль в регулировании экспрессии импринтированного гена. Мутации в de novo метилазе Dmnt3a, в факторе Dmnt3L, стимулирующем метилазу, или в поддерживающей метилазе Dmnt1 дают дефектных по метилированию ДНК эмбрионов, все из которых обнаруживают изменения в экспрессии импринтированных генов (глава 18). Нарушения того типа, который был показан для четырех импринтированных кластеров (Igf2, Igf2r, Kcnq1 и Dlk1), показывает, что метилирование ДНК обычно действует, супрессируя действие гаметического DMR на той же родительской хромосоме, которая экспрессирует собранные в кластер гены и РНК. Таким образом, в отсутствие метилирования ДНК гаметический DMR не может функционировать должным образом. Вследствие этого несколько импринтированных генов, кодирующих белки, в том числе Igf2, Igf2r, Kcnq1 и Dlk1, становятся репрессированными на обеих родительских хромосомах. Это показывает, что эти гены и РНК в геноме млекопитающих сайленсированы «по умолчанию» и требуют активации для своей экспрессии. Примечательно, что ncRNA Н19, которая в норме экспрессируется лишь на хромосоме, несущей неметилированный гаметический DMR, становится экспрессируемой на обеих родительских хромосомах (глава 18) Некоторые исключения из этого общего правила сообщались для генов, демонстрирующих импринтированную экспрессию только в плаценте (Lewis tu al., 2004). Используются ли другие типы эпигенетических модификаций в качестве гаметических импринтов? При явном изобилии эпигенетических механизмов, действие которых модифицирует генетическую информацию в геноме млекопитающих (описаны в главе 3), маловероятно, чтобы метилирование ДНК было единственным импринтирующим механизмом. Модификации гистонов, влияющие на состояния активности хроматина, также являются вероятными кандидатами на роль родительских импринтов, поскольку они могли бы выполнять многие условия, показанные на рис. 3. На сегодняшний день, однако, показано, что лишь белок — компонент группы Polycomb, известный как Eed (который облегчает метилирование лизина 27 гистона H3), влияет на несколько отцовски-репрессированных генов. Однако влияние Eed на геномный импринтинг довольно незначительно по сравнению с метилированием ДНК, и это может служить лишь функцией поддержания (Mager et al., 2003). Каким образом DMRs выбираются механизмом гаметического метилирования? Сравнение известных гаметических DMRs по нуклеотидным последовательностям не выявляет сколько-нибудь явного консерватизма последовательностей, хотя сообщалось, что некоторые из них содержат ряд прямых повторов, которые могут приобретать вторичную структуру, привлекающую метилирование ДНК (Neumann et al., 1995). Нуклеотидная последовательность DMRs заметно богаче CpG, чем остальной геном, и напоминает последовательность островков CpG, связанную с промоторами более чем половины генов в геноме млекопитающих (глава 18). Поразительно, что ключевой особенностью промоторов с островками CpG является то, что в норме в них отсутствует метилирование ДНК и что в ранних эмбриональных клетках существуют механизмы для поддержания островков CpG промотора свободными от метилирования (Antequera, 2003). Однако в опухолях и при старении островки CpG могут становиться метилированными. Два наблюдения пролили свет на то, каким образом метилирование ДНК могло бы «нацеливать» последовательности DMR. Первое наблюдение заключается в том, что отцовская специфичность метилирования в гаметическом DMR Н19 зависит от предотвращения метилирования «по умолчанию» в этом районе в материнской гамете с помощью белка CTFC (Fedoriw et al., 2004; смотри также раздел 3.6). Это может указывать на отсутствие сиквенс-специфичности системы метилирования ДНК. Второе наблюдение заключается в том, что вспомогательный белок метилирования, Dnmt3L, играет разные роли в мужских и женских гаметах. В мужских гаметах Dnmt3L играет главную роль в метилировании и сайленсинге ретротранспозонов и незначительную роль в метилировании DMR. Напротив, в ооцитах Dnmt3L играет основную роль в метилировании DMR и не играет никакой роли в метилировании ретротранспозонов (Bourc’his and Bestor, 2006). Ретро-транспозоны являются мобильными генетическими элементами, присутствующими в очень большом числе в геноме млекопитающих и могут копироваться посредством промежуточных РНК и вставляться в новые геномные сайты (Kazazian, 2004). Обнаружение того факта, что тот же самый белок, который направляет метилирование, чтобы сайленсировать ретротранспозоны, может также направлять метилирование DMR, показывает, что механизмы, нужные для защиты генома от чужеродных ДНК, были использованы, чтобы делать импринты в материнской зародышевой линии (Barlow, 1993).3.6. Два типа cis-действующего сайленсинга, идентифицированного в кластерах импринтированных генов
В настоящее время предполагается, что импринтингом в разных кластерах управляют два класса cis-действующих механизмов сайленсинга: это модель инсулятора, приложимая к кластеру Igf2, и модель опосредованного ncRNA сайленсинга, приложимая к кластерам Igf2r и Kcnq1. Хотя это еще не полностью определено, большинство кластеров, перечисленных в табл. 19.2, демонстрируют те или иные аспекты одной из двух моделей. Прорывом, приведшим к определению модели инсулятора в локусе Igf2, была делеция гаметического DMR, который локализован на расстоянии 2 т. о. «вверх по течению» от старта транскрипции Н19 и на расстоянии 80 т. о. «вниз по течению» от Igf2 (рис. 19.7) (Thorvaldsen et al., 1998). Будучи делетированы, Н19 и lgf2 обнаруживали утрату импринтинга безотносительно к тому, наследовалась ли эта делеция от матери или от отца, что позволяло идентифицировать этот DMR как ICE. Впоследствии было показано, что этот ICE связывается с CTCF — белком, который, как было показано, опосредует активность инсулятора в локусе beta-globin, и что сам ICE фунционирует как инсулятор (Bell and Felsenfeld, 2000; Hark et al., 2000). В этом контексте инсулятор определяется как элемент, который блокирует взаимодействия промотора и энхансера, будучи помешен между ними Таким образом, модель экспрессии импринтированного гена в этом локусе следующая: на материнской аллели CTCF связывается с ICE и блокирует доступ lgf2 и Ins2 к энхансерам, общим с ncRNA Н19, которые расположены «вниз по течению» от этих трех генов. Тем самым это предоставляет Н19 исключительный доступ к энхансерам (рис. 19.7). На отцовской аллели ICE приобретает метилирование ДНК в мужской зародышевой линии, предотвращая связывание CTCF с ним. Таким образом, на отцовской хромосоме Igf2 и Ins2 взаимодействуют с энхансерами и экспрессируются с этой хромосомы. Присутствие метилирования ДНК на отцовском ICE ведет ко вторичному метилированию промотора Н19 с помощью неизвестного механизма, и он становится сайленсированным на отцовской хромосоме. Участие CTCF в модели инсулятора привело к идентификации сайтов связывания CTCF в других импринтированных генах, таких как Rasgrfl, GrblOw Kcnq1otl, показывая тем самым, что модель инсулятора может работать в других импринтированных кластерах. Рис. 7. Два cis-действующих механизма сайленсинга в кластерах импринтированных генов
(а) Модель инсулятора для кластера Igf2. Показан паттерн экспрессии для эндодермы. На материнской хромосоме неметилированный ICE связывается с белком CTFC и формирует инсулятор, который не дает общим энхансерам эндодермы (Е) активировать Igf2 и Ins2. Вместо этого эти энхансеры активируют близлежащий промотор ncRNA Н19. На отцовской хромосоме метилированный ICE не может связываться с СТСЕ и инсулятор не образуется, вследствие чего гены иРНК Igf2 и Ins2 экспрессируются только на этой хромосоме. ncRNA Н19 метилируется, скорее всего, из-за распространения с удаленного на 2 т.о.метилированного ICE и является «молчащей», (б) модель ncRNA для кластера Igf2r. Показанпаттерн экспрессии для плаценты. На материнской хромосоме метилированный ICE содержит промотор ncRNA Air, который прямо сайленсирован импринтом метилирования ДНК. Гены иРНК Igf2r, Slc22a2 и Slc22a3 экспрессируются только на этой хромосоме. Mas1 и Slc22a1 в плаценте не экспрессируются. На отцовской хромосоме промотор ncRNA Air, лежащий в неметилированном [СЕ, экспрессируется и сайленсирует Igf2r, Slc22a2 и Slc22a3 в cis. Заметьте, что в обеих моделях импринт метилирования ДНК сайленсирует ncRNA и делает возможной экспрессию иРНК: (ICE) — элемент контроля импринта (серый прямоугольник) — импринтированный ген иРНК, (ген-NC) — импринтированный ген ncRNA, (стрелка) экспрессированная аллель импринтированного гена, (черный запрещающий знак) — репрессированная аллель импринтированного гена, (заполненный ромб) — тканеспецифичныи ген, сайленсированныи на обеих родительских хромосомах, (серые стрелки) — удаленный эффект в cis-конфигурации
Рис. 7. Два cis-действующих механизма сайленсинга в кластерах импринтированных генов
(а) Модель инсулятора для кластера Igf2. Показан паттерн экспрессии для эндодермы. На материнской хромосоме неметилированный ICE связывается с белком CTFC и формирует инсулятор, который не дает общим энхансерам эндодермы (Е) активировать Igf2 и Ins2. Вместо этого эти энхансеры активируют близлежащий промотор ncRNA Н19. На отцовской хромосоме метилированный ICE не может связываться с СТСЕ и инсулятор не образуется, вследствие чего гены иРНК Igf2 и Ins2 экспрессируются только на этой хромосоме. ncRNA Н19 метилируется, скорее всего, из-за распространения с удаленного на 2 т.о.метилированного ICE и является «молчащей», (б) модель ncRNA для кластера Igf2r. Показанпаттерн экспрессии для плаценты. На материнской хромосоме метилированный ICE содержит промотор ncRNA Air, который прямо сайленсирован импринтом метилирования ДНК. Гены иРНК Igf2r, Slc22a2 и Slc22a3 экспрессируются только на этой хромосоме. Mas1 и Slc22a1 в плаценте не экспрессируются. На отцовской хромосоме промотор ncRNA Air, лежащий в неметилированном [СЕ, экспрессируется и сайленсирует Igf2r, Slc22a2 и Slc22a3 в cis. Заметьте, что в обеих моделях импринт метилирования ДНК сайленсирует ncRNA и делает возможной экспрессию иРНК: (ICE) — элемент контроля импринта (серый прямоугольник) — импринтированный ген иРНК, (ген-NC) — импринтированный ген ncRNA, (стрелка) экспрессированная аллель импринтированного гена, (черный запрещающий знак) — репрессированная аллель импринтированного гена, (заполненный ромб) — тканеспецифичныи ген, сайленсированныи на обеих родительских хромосомах, (серые стрелки) — удаленный эффект в cis-конфигурации
ncRNA-класс моделей импринтинга может, однако, быть более обычным. Прорывом, приведшим к идентификации функциональных ncRNAs в импринтированных кластерах, явился эксперимент с укорочением ncRNA Air, имеющей длину 108 т. о., до 3 т. о. (Sleutels et al., 2002). Эта укороченная ncRNA сохраняла импринтированную экспрессию, и промотор Air сохранял импринтированное метилирование ДНК — тем не менее, сайленсинг всех трех генов иРНК в кластере Igf2r был утрачен (рис. 19.7). Сейчас было показано, что сайленсинг, опосредованный ncRNA, действует также в кластере Kcnq1 (Mancini-DiNardo. 2006) В настоящее время неизвестно, каким образом ncRNA Air или Kcnq1ot1 сайленсируют гены в соответсвующих импринтированных кластерах. Возможны многие модели, применимые к обоим кластерам. Две возможности возникают из факта перекрывания смысловой и антисмысловой последовательности иРНК и ncRNA, имеющего место в каждом кластере. Первая возможность заключается в том, что между иРНК и ncRNA может образовываться двунитевая РНК и индуцировать РНК-интерференцию (RNAi) (глава 8). Вторая возможность состоит в том, что это перекрывание смысловой и антисмысловой последовательности становится причиной одной из форм транскрипционной интерференции между двумя промоторами, которая затрагивает лишь транскрипцию с промотора иРНК. В обоих этих случаях первым событием был бы посттранскрипционный сайленсинг перекрывающейся иРНК, сопровождаемый накоплением репрессивного хроматина, способного распространяться и индуцировать транскрипционный сайленсинг генов во всем кластере. Однако возможно также, что импринтированные ncRNAs действуют, покрывая локальный участок хромосомы и непосредственно рекрутируя репрессивные белки хроматина к репрессированному кластеру примерно таким же образом, как это описано для действия ncRNA Xist в инактивации Х-хромосомы (глава 17). Имеет место большое сходство между сайленсингом, опосредуемым импринтированной ncRNA, и сайленсингом, опосредуемым ncRNA Xist. Наиболее существенно, что оба эти случая представляют cis-действующие эпигенетические механизмы сайленсинга и оба демонстрируют положительную корреляцию между экспрессией ncRNA и сайленсингом множественных генов иРНК. Предположили также, что геномный импринтинг и Х-инактивация развились из общего эпигенетического механизма (Reik and Lewis, 2005). Если бы это было так, можно было бы предсказать, что импринтированные ncRNAs могут сайленсировать гены путем «нацеливания» репрессивного хроматина на кластер импринтированных генов Однако у нас все еще нет четкой информации относительно того, как импринтированные ncRNAs осуществляют свою сайленсирующую функцию. И мы все еще не знаем, сколько других импринтированных ncRNAs также играют функциональную роль в сайленсинге генов.
4. Геномный импринтинг — модель эпигенетической регуляции у млекопитающих
Геномный импринтинг имеет преимущество перед другими моделями эпигенетического регулирования генов у млекопитающих, поскольку и активная, и неактивная родительские аллели расположены в одном и том же ядре и находятся в одной и той же транскрипционной среде. В результате любое эпигенетическое различие между этими двумя родительскими аллелями должно с большей вероятностью коррелировать с их транскрипционным состоянием в противоположность эпигенетическим системам типа «до и после» [«before and after» epigenetic systems], где эпигенетические изменения могут также отражать измененное состояние дифференцировки клетки. Присутствие и активной, и «молчащей» родительской аллели в одном и том же ядре делает геномный импринтинг идеальной системой для изучения эпигенетической регуляции генов, но и создает некоторые трудности, поскольку необходимо сначала отличить одну из родительских аллелей, чтобы идентифицировать специфические особенности, связанные с активностью и сайленсингом генов. Эти трудности были в основном преодолены у мышей в связи с разработкой модельных систем, позволяющих различать материнские и отцовские хромосомы (рис. 19.1). Несмотря на тот факт, что пути эпигенетической регуляции генов весьма консервативны в эволюции, для каждого организма должны, вероятно, существовать отличия, связанные с типом организации генома. Геном млекопитающих демонстрирует необычную организацию. где гены чередуются [intersperse] с высококопииными повторами (известными также как перемещаемые элементы). Это существенно увеличивает длину большинства генов, как и расстояние между соседними генами Kazazian, 2004). Это контрастирует с другими модельными организмами, такими как дрожжи, инфузории, грибы, нематоды, растения и Drosophila, геномы которых обнаруживают тенденцию оставаться свободными от повторов или, по крайней мере, отделять повторы от генов (Rabinovicz et al., 2003). Было замечено, что у многих организмов высоко-копийные повторы привлекают метилирование ДНК и репрессивные модификации гистонов. Полагали, что это является, главным образом, защитной адаптацией против вторжения нуклеотидных последовательностей чужеродной ДНК (т. е., ретропозонов, транспозонов и вирусов). При обсуждении того, каким образом эпигенетические механизмы действуют у млекопитающих необходимо, следовательно, принимать во внимание эту «перемежающуюся» природу повторов и генов (Goll and Bestor, 2005). Примечательно, что то обстоятельство, что интроны млекопитающих богаты повторами и, тем не менее, гены способны весьма интенсивно транскрибироваться, делает менее вероятным, что геном млекопитающих организован в крупные блоки «молчащего» гетерохроматина или активного эухроматина. Этот взгляд получает некоторую поддержку при анализе паттернов хроматина у человека в масштабах всего генома, который показывает, что активные модификации гистонов обычно ограничены промоторами или короткими участками, предположительно являющимися регуляторными элементами (Kim et al., 2005). Расположение импринтированных генов кластерами, которые содержат реципрокно экспрессируемые перекрывающиеся гены, а также гены, вовсе избегающие импринтинга, говорит в пользу возникающего в последнее время представления о том, что модификации хроматина в геноме млекопитающих могут не распространяться сколько-нибудь далеко. Что может дать геномный импринтинг для понимания эпигенетики млекопитающих? Хотя характеристика кластеров импринтированных генов далека от завершения, они явно могут дать информацию о том, как гены контролируются в локальных участках или доменах. На сегодняшний день кластеры импринтированных генов уже дали примеры сА-действующих нуклеотидных последовательностей ДНК, которые регулируются метилированием ДНК; генов, которые сайленсируются «по умолчанию» в геноме млекопитающих и требуют эпигенетической инактивации для своей экспрессии; удаленных регуляторных элементов, которые могут действовать как инсуляторы, и необычных ncRNAs, которые сайленсируют крупные домены генов в cis-конфигурации. Время покажет, являются ли эти типы эпигенетических регуляторных механизмов уникальными для импринтированных кластеров или же можно обнаружить, что они регулируют экспрессию неимпринтированных генов в геноме млекопитающих.5. Направления будущих исследований
Геномный импринтинг вызвал острый интерес со времени открытия первых импринтированных генов у млекопитающих в 1991 году. Некоторые вопросы все еще ожидают окончательных ответов, в особенности те из них, которые касаются того, почему среди позвоночных только млекопитающие используют импринтированные гены для регуляции эмбрионального и неонатального роста Это контрастирует со значительным прогрессом на протяжении последних 15 лет по выяснению эпигенетических механизмов, контролирующих импринтированную экспрессию у млекопитающих. Исходя из этой информации, мы думаем, что понимаем общие принципы того, как механизм импринтинга действует в кластерах импринтированных генов, хотя все детали этого все еще неясны. На этом этапе мы знаем, что геномный импринтинг использует нормальные эпигенетические механизмы [machinery] клетки для регуляции специфичной в отношении родителя экспрессии и что все приводится в действие путем ограничения этой машинерии в гамете только одной родительской аллелью. Мы знаем, что имеется общее сходство в механизме, контролирующем импринтированную экспрессию разных кластеров генов, но мы все еще не понимаем, сколько вариантов этого механизма существует в геноме млекопитающих. В будущем мы очень хотели бы знать, в какой степени неимпринтированные гены контролируются эпигенетическими механизмами, описанными для кластеров импринтированных генов. Наконец, нам хотелось бы знать, можем ли мы переносить эти знания на человека для целей терапии; например, индуцируя реэкспрессию «молчащих» генов иРНК у пациентов с синдромом Прадера—Вили и Энгельмана, обнаруживающих дефекты поведения и роста, благодаря делеции хромосомы, несущей экспрессируемые аллели импринтированных генов иРНК (Jiang et al., 2004). Понимание путей, которыми клетка контролирует эпигенетическую информацию, приобретает все более важное значение в свете осознания того, что эпигенетическая регуляция может быть нарушена и при раковых заболеваниях (глава 24), при использовании вспомогательных репродуктивных технологий (глава 22) и в процессах старения (Egger et al., 2004). Мы ожидаем, что лучшее понимание геномного импринтинга и далее послужит важной моделью для исследования того, как геном млекопитающих использует эпигенетические механизмы для регуляции экспрессии генов.Благодарности
Мы благодарны бывшим и нынешним сотрудникам лабораторий Барлоу и Бартоломеи (Barlow and Bartolomei) за обсуждение представленных здесь идей. Мы приносим извинения за то, что ограничения числа ссылок не позволили процитировать все оригинальные данные. Наконец, мы очень благодарны Mane-Laure Caparros, Anne Ferguson-Smith, Thomas Jenuwein, Davor Solter и Shirley Tilghman за их замечания к рукописи.Литература
Antequera E, 2003. Structure, function and evolution of CpG island promoters. Cell Mol. Life Sci. 60: 1647–1658. Barlow D.R, 1993. Methylation and imprinting: From host defense to gene regulation? Science 260: 309–310. Barlow D.R, Stoger R., Herrmann B.G., Saito K., and Schweifer N., 1991. The mouse insulin-like growth factor type-2 receptor is imprinted and closely linked to the Tme locus. Nature 349: 84–87. Bartolomei M.S., Zemel S., and Tilghman S.M., 1991. Parental imprinting of the mouse H19 gene. Nature 351: 153–155. Bartolomei M.S., Webber A.L., Brunkow M.E., and Tilghman S.M., 1993. Epigenetic mechanisms underlying the imprinting of the mouse H19 gene. Genes Dev. 7: 1663–1673. Barton S.C., Surani M.A., and Norris M.L., 1984. Role of paternal and maternal genomes in mouse development. Nature 311: 374–376. Bell A.C. and Felsenfeld G., 2000. Methylation of a CTCF-dependent boundary controls imprinted expression of the Igf2 gene. Nature 405: 482–485. Bielinska B., Blaydes S.M., Buiting K., Yang T., Krajewska-Walasek M., Horsthemke B., and Brannan C.I., 2000. De novo deletions of SNRPN exon 1 in early human and mouse embryos result in a paternal to maternal imprint switch. Nat. Genet. 25: 74–78. Bourc’his D. and Bestor T.H., 2006. Origins of extreme sexual dimorphism in genomic imprinting. Cytogenet. Genome Res. 113: 36–40. Brannan C.I., Dees E.C., Ingram R.S., and Tilghman S.M., 1990. The product of the H19 gene may function as an RNA. Mol. Cell Biol. 10: 28–36. Cattanach B.M. and Kirk M., 1985. Differential activity of maternally and paternally derived chromosome regions in mice Nature 315: 496–498. Chaillet J. R., Bader D. S., and Leder P., 1995. Regulation of genomic imprinting by gametic and embryonic processes. Genes Dev. 9: 1177–1187. Chandra H.S. and Nanjundiah V., 1990. The evolution of genomic imprinting. Dev. Suppl, 1990: 47–53. Constancia M., Dean W., Lopes S., Moore T., Kelsey G., and Reik W., 2000. Deletion of a silencer element in Igf2 results in loss of imprinting independent of HI9. Nat. Genet. 26: 203–206. Cooper D.W., VandeBerg J.L., Sharman G.B., and Poole W.E., 1971. Phosphoglycerate kinase polymorphism in kangaroos provides further evidence for paternal X inactivation. Nat New Biol. 230: 155–157. Crouse H.V., Brown A., and Mumford B.C., 1971 Chromosome inheritance and the problem of chromosome “imprinting” in Sciara (Sciaridae, Diptera). Chromosoma 34: 324–398. Davis E., Caiment E., Tordoir X., Cavaille J., Ferguson-Smith A., CockettN., Georges M., and ChariierC.. 2005. RNAi-mediated allelic trans-interaction at the imprinted Rtl 1/Peg 11 locus. Curr. Biol. 15: 743–739. DeChiaraT.M., Robertson E.J., and Efstratiadis A., 1991. Parental imprinting of the mouse insulin-like growth factor II gene. Cell 64: 849–859. Egger G., Liang G., Aparicio A., and Jones P.A., 2004. Epigenetics in human disease and prospects for epigenetic therapy. Nature 429: 457–463. Fedoriw A.M., Stein P., Svoboda P., Schultz R.M., and Bartolomei M.S., 2004. Transgenic RNAi reveals essential function for CTCF in H19 gene imprinting. Science 303: 238–240. Ferguson-Smith A.C., Sasaki H., Cattanach B.M., and Suram M.A., 1993. Parental-origin-specific epigenetic modification of the mouse H19 gene. Nature 362: 751–755. Ferguson-Smith A.C., Cattanach B.M., Barton S.C., Beechey C.V., and Surani M.A., 1991. Embryological and molecular investigations of parental imprinting on mouse chromosome 7. Nature 351: 667–670. Fitzpatrick G.V., Soloway P.D., and Higgins M.J., 2002. Regional loss of imprinting and growth deficiency in mice with a targeted deletion of KvDMRl. Nat. Genet. 32: 426–431. Goll M.G. and Bestor T.H., 2005. Eukaryotic cytosine methyltransferases. Annu. Rev. Biochem. 74: 481–514. Hark A.T., Schoenherr C.J., Katz D.J., Ingram R.S., Levorse J.M., and Tilghman S.M., 2000. CTCF mediates methylation-sensitive enhancer-blocking activity at the H19/Igf2 locus. Nature 405: 486–489. Haussecker D. and Proudfoot N.J., 2005. Dicer-dependent turnover of intergenic transcripts from the human y-globin gene cluster. Mol Cell Biol. 25: 9724–9733. Hoppe P.C. and Illmensee K., 1982. Full-term development after transplantation of parthenogenetic embryonic nuclei into fertilized mouse eggs. Proc. Natl. Acad. Sci., 19: 1912–1916. Hurst L.D., McVean C, and Moore T., 1996. Imprinted genes have few and small introns. Nat. Genet. 12: 234–237. Jiang Y.H., Bressler J., and Beaudet A.L., 2004. Epigenetics and human disease. Annu. Rev. Genomics Hum. Genet. 5: 479–510. Johnson D.R., 1974. Hairpin-tail: A case of post-reductional gene action in the mouse egg. Genetics 76: 795–805. Kazazian H.H., Jr., 2004. Mobile elements: Drivers of genome evolution. Science 303: 1626–1632. KimT.H., Barrera L.O., Zheng M., Qu C., Singer M.A., Richmond T.A., Wu Y., Green R.D., and Ren B., 2005. A high-resolution map of active promoters in the human genome. Nature 436: 876–880. Kono T.. Obata Y., Wu Q., Niwa K., Ono Y., Yamamoto Y., Park E.S., Seo J.S., and Ogawa H., 2004. Birth of parthenogenetic mice that can develop to adulthood. Nature 428: 860–864. Landers M., Bancescu D.L., Le Meur E., Rougeulle C., Glatt-Deeley H., Brannan C., Muscatelli F. and Lalande M., 2004. Regulation of the large (-1000 kb) imprinted murine Ube3a antisense transcript by alternative exons upstream of Snurf/Snrpn. Nucleic Acids Res. 32: 3480–3492. Lewis A., Mitsuya K., Umlauf D., Smith P., Dean W., Walter J., Higgins M., Feil R. and Reik W, 2004. Imprinting on distal chromosome 7 in the placenta involves repressive histone methylation independent of DNA methylation. Nat. Genet. 36: 1291–1295. Lin M.S., Zhang A., and Fujimoto A., 1995. Asynchronous DNA replication between 15ql 1.2ql 2 homologs: Cytogenetic evidence for maternal imprinting and delayed replication. Hum. Genet. 96: 572–576. Lin S.P., Youngson N., Takada S., Seitz H., Reik W., Paulsen M., Cavaille J, and Ferguson-Smith A.C., 2003. Asymmetnc regulation of imprinting on the maternal and paternal chromosomes at the Dlk1-Gtl2 imprinted cluster on mouse chromosome 12. Nat. Genet. 35: 97-102. Liu J., Litman D., Rosenberg M.J., Yu S., Biesecker L.G., and Weinstein L.S., 2000. A GNAS1 imprinting defect in pseudohypoparathyroidism type IB. J. Clin. Invest. 106: 1167–1174. Lyle R., Watanabe D., te Vruchte D., Lerchner W., Smrzka O.W., Wutz A., Schageman J., HahnerL., Davies C., and Barlow D.R., 2000. The imprinted antisense RNA at the Igf2r locus overlaps but does not imprint Mas I. Nat. Genet. 25: 19–21. Mager J., Montgomery N.D., de Villena F.P.. and Magnuson T., 2003. Genome imprinting regulated by the mouse Polycomb group protein Eed. Nat. Genet. 33: 502–507. Mancini-DiNardo D.S., Levorse J,M., Ingram R.S., and Tilghman S.M., 2006. Elongation of the Kcnqotl transcript is required for genomic imprinting of neighboring genes. Genes Dev., 20: 1268–1282. Mattick J.S., 2005. The functional genomics of noncoding RNA. Science 309: 1527–1528. McGrath J. and Solter D., 1984a. Completion of mouse embry0genesis requires both the maternal and paternal genomes. Cell 37: 179–183. McGrath J. and Solter D., 1984b. Maternal Thp lethality in the mouse is a nuclear, not cytoplasmic, defect. Nature 308: 550–551. McLaren A., 1979. Maternal effects in development: The fourth symposium of the British Society for Developmental Biology (ed. D.R. Newth and M. Balls). Cambridge University Press, Cambridge, United Kingdom. Mitsuya K., Meguro M., Lee M.P.. Katoh M., Schulz T.C., Kugoh H., Yoshida M.A., Niikawa N., Feinberg A.P., and Oshimura M., 1999. LIT1, an imprinted antisense RNA in the human KvLQTl locus identified by screening for differentially expressed transcripts using monochromosomal hybrids. Hum. Mol. Genet. 8: 1209–1217. Moore T. and Haig D., 1991. Genomic imprinting in mammalian development: A parental tug-of-war. Trends Genet. 7: 45–49. Moore T., Constancia M., Zubair M., Bailleul B., Feil R., Sasaki H., and ReikW., 1997. Multiple imprinted sense and antisense transcripts, differential methylation and tandem repeats in a putative imprinting control region upstream of mouse Igf2. Proc Natl. Acad. Sci. 94: 12509-12514. Neumann B., Kubicka P., and Barlow D.P., 1995. Characteristics of imprinted genes. Nat. Genet. 9: 12–13. O’Neill M.J., 2005. The influence of non-coding RNAs on allele-specific gene expression in mammals. Hum. Mol. Genet. 14: R113-120 Rabinowicz P.D., Palmer L.E., May B.P., Hemann M.T., Lowe S.W.. McCombie W.R., and Martienssen R.A., 2003. Genes and transposons are differentially methylated in plants, but not in mammals. Genome Res. 13: 2658–2664. Regha K.. Latos P.A., and Spahn L., 2006. The imprinted mouse Igf2r/Air cluster — A model maternal imprinting system. Cytogenet. Genome Res. 113: 165–177. Reik W., 1989. Genomic imprinting and genetic disorders in man Trends Genet 5: 331–336. Reik W. and Lewis A.. 2005. Co-evolution of X-chromosome inactivation and imprinting in mammals. Nat. Rev. Genet. 6: 403–410. ReikW., Howlett S.K., and Surani M.A., 1990. Imprinting by DNA methylation: From transgenes to endogenous gene sequences. Dev. Suppl., 1990: 99-106. Sasaki E.L., Jones P.A., Chaillet J.R., Ferguson-Smith A.C., Barton S.C., Reik W., and Surani M.A., 1992. Parental imprinting: Potentially active chromatin of the repressed maternal allele of the mouse insulin-like growth factor II (Igf2) gene. Genes Dev. 6: 1843–1856. Schmidt J.V., Levorse J.M., and Tilghman S.M., 1999. Enhancer competition between H19 and Igf2 does not mediate their imprinting. Proc. Natl. Acad. Sci. 96: 9733–9738. Searle A.G. and Beechey C.V., 1978. Complementation studies with mouse translocations. Cytogenet. Cell Genet., 20: 282–303. Seitz E.L., Royo E.L., Lin S.P., Youngson N., Ferguson-Smith A.C., and Cavaille J., 2004. Imprinted small RNA genes. Biol. Chem. 385: 905–911. Shemer R., Birger Y., Riggs A.D., and Razin A., 1997. Structure of the imprinted mouse Snrpn gene and establishment of its parental-specific methylation pattern. Proc. Natl. Acad. Sci. 94: 10267-10272. Sleutels F., Zwart R., and Barlow D.P., 2002. The non-coding Air RNA is required for silencing autosomal imprinted genes. Nature 415: 810–813. Sleutels E, Tjon G., Ludwig T, and Barlow D.P., 2003. Imprinted silencing of Slc22a2 and Slc22a3 does not need transcriptional overlap between lgf2r and Air. EMBO J. 22: 3696–3704. Spahn L. and Barlow D.P., 2003. An ICE pattern crystallizes. Nat. Genet. 35: 11–12. Stoger R., Kubicka P., Liu C.G., Kafri T., Razin A., Cedar H., and Barlow D.P., 1993. Maternal-specific methylation of the imprinted mouse Igf2r locus identifies the expressed locus as carrying the imprinting signal. Cell 73: 61–71. Surani M.A., Barton S.C., and Norris M.L., 1984. Development of reconstituted mouse eggs suggests imprinting of the genome during gametogenesis. Nature 308: 548–550. Takada S., Paulsen M., Tevendale M., Tsai C.E., Kelsey G., Cattanach B.M., and Ferguson-Smith A.C., 2002. Epigenetic analysis of the Dlk1-Gtl2 imprinted domain on mouse chromosome 12: Implications for imprinting control from comparison with Igf2-H19. Hum. Mol. Genet. 11: 77–86. Thorvaldsen J.L., Duran K.L., and Bartolomei M.S., 1998. Deletion of the H19 differentially methylated domain results in loss of imprinted expression of H19 and lgf2. Genes Dev. 12: 3693–3702. Tierling S., Dalbert S., Schoppenhorst S., Tsai C.E., Oliger S., Ferguson-Smith A.C., Paulsen M., and Walter J., 2005. High-resolution map and imprinting analysis of the Gtl2-Dnchcl domain on mouse chromosome 12. Genomics. 87: 225–235. Varmuza S. and Mann M., 1994. Genomic imprinting — Defusing the ovarian time bomb. Trends Genet. 10: 118–123. Verona R.E., Mann M.R., and Bartolomei M.S., 2003. Genomic imprinting: Intricacies of epigenetic regulation in clusters. Annu. Rev. Cell Dev. Biol, 19: 237–259. Wilkins J.F. and Haig D., 2003. What good is genomic imprinting: The function of parent-specific gene expression. Nat. Rev. Genet. 4: 359–368. Williamson CM., Turner M.D., Ball S.T., Nottingham W.T., Glenister P., Fray M., Tymowska-Lalanne Z., Plagge A., Powles-Glover N., Kelsey C., et al., 2006. Identification of an imprinting control region affecting the expression of all transcripts in the Gnas cluster. Nat. Genet. 38: 350–355. Wroe S.T., Kelsey C., Skinner J.A., Bodle D., Ball S.T., Beechey C.V., Peters J., and Williamson C.M., 2000. An imprinted transcript, antisense to Nesp, adds complexity to the cluster of imprinted genes at the mouse Gnas locus. Proc. Natl. Acad. Sci. 97: 3342–3346. Wutz A., Smrzka O.W., Schweifer N., Schellander K., Wagner E.F., and Barlow D.P., 1997. Imprinted expression of the lgf2r gene depends on an intronic CpG island. Nature 389: 745–749. Yatsuki H., Joh K., Higashimoto K., Soejima H., Arai Y.. Wang Y., Hatada E., Obata Y., Morisaki H., Zhang Z., et al., 2002. Domain regulation of imprinting cluster in Kip2/Litl subdomain on mouse chromosome 7F4/F5: Large-scale DNA methylation analysis reveals that DMR-Litl is a putative imprinting control region. Genome Res. 12: 1860–1870. Zwart R., Sleutels E, Wutz A., Schinkel A.H., and Barlow D.P., 2001. Bidirectional action of the lgf2r imprint control element on upstream and downstream imprinted genes. Genes Dev. 15: 2361–2366.WWW-ресурсы
Beechey C. V., Cattanach B.M., Blake A., and Peters J., 2005. MRC Mammalian Genetics Unit, Harwell, Oxfordshire. World Wide Web Site — Mouse Imprinting data and references (http://www.mgu.har.mrc.ac.uk/research/imprinting/). http://nocode.bioinfo.org.cn/ NONCODE — the database of non-coding RNA.Глава 20. Зародышевая линия и плюрипотентные стволовые клетки
 М. Azim Surani1 и Wolf Reik2
1Wellcome Trust Cancer Research UR Gurdon Institute, University of Cambridge, Cambridge CB2 1QN, United Kingdom 2The Babraham Institute, Babraham Research Campus, Cambridge CB2 4AT, United Kingdom
М. Azim Surani1 и Wolf Reik2
1Wellcome Trust Cancer Research UR Gurdon Institute, University of Cambridge, Cambridge CB2 1QN, United Kingdom 2The Babraham Institute, Babraham Research Campus, Cambridge CB2 4AT, United Kingdom
Общее резюме
Яйцо, или ооцит, представляет особую клетку, поскольку является единственной клеткой, потенциально способной к развитию в целый организм. Вильям Харвей был первым, кто осознал это в 1651 году, когда заметил «Ех Ovo Omni» или «все происходит из яйца». Он считал, что яйцо, возможно, прогрессивно развивается в организм. Такая точка зрения оказалась важной для концепции эпигенеза или прогрессивного развития. Это, в конце концов, привело к преформатинисткому взгляду на развитие — теории, предполагающей, что индивидуумы развиваются за счет увеличения крошечных, полностью сформированных организмов (так называемых гомункулусов), которые находятся в половых клетках. Конрад Уодцингтон позднее отобразил эту концепцию в своей знаменитой иллюстрации как «эпигенетический ландшафт», символическое представление последовательного развития из яйца. Развитие целого организма из яйца без участия мужского начала у некоторых организмов возможно и называется партеногенезом. Однако у млекопитающих это не происходит благодаря явлению генетического импринтинга, когда оплодотворение яйца спермой является обязательным для развития взрослого организма. У большинства организмов развитие начинается после слияния спермы с ооцитом и образования зиготы. Это дает не только нового индивидуума, но и, по крайней мере, теоретически бесконечной серии генераций. Таким образом, половые клетки обеспечивают стойкую связь между всеми поколениями. Вновь оплодотворенное яйцо, или зигота, является уникальной клеткой, поскольку никакая другая клетка не имеет потенции к развитию полностью нового организма Это свойство называют тотипотентностью. Как передатчики генетической и эпигенетической информации следующим поколениям половые клетки являются уникальными. Для того чтобы реализовать этот потенциал, эти клетки обладают многими особыми свойствами. Ооцит обладает также удивительным свойством передавать тотипотентность ядрам соматических клеток, например нервным клеткам, при трансплантации их в яйцо, процесс, который называют клонированием или ядерным репрограммированием. В процессе развития зиготы происходит прогрессивное уменьшение тотипотентности вновь образующихся делящихся клеток. У млекопитающих продукты только очень ранних делений сохраняют тотипотентность, когда каждая клетка в отдельности в принципе способна генерировать целый организм. Ранним этапом развития эмбриона млекопитающих является бластоциста (левый рисунок в заголовке), структура, у которой наружный слой клеток трофэктодермы в будущем формирует плаценту, а внутренняя группа клеток дает начало всему зародышу и, в конце концов, новому организму. Внутренние клетки будут, следовательно, дифференцироваться во все известные 200 (или около того) специализированные соматические клетки, найденные у взрослых организмов, и поэтому относятся к плюрипотентным клеткам. Эти плюрипотентные клетки могут быть изолированы из ранних эмбрионов и при определенных условиях культивирования могут постоянно расти in vitro, сохраняя способность дифференцироваться в любые специализированные клеточные типы, найденные у эмбрионов и взрослых организмов, включая спермин и яйцеклетки. Такие клетки были получены из эмбрионов человека и мыши и называются плюрипотентными эмбриональными стволовыми клетками или ES-клетками. Способность генерировать плюрипотентные стволовые клетки быстро теряется после имплантации >мбриона и начала программы эмбрионального развития Одними из наиболее ранних клеточных типов, закладывающимися во время эмбрионального развития, являются предшественники спермиев и яйцеклеток, называемые примордиальными половыми клетками (PGC), видимые как зеленые клетки на правом рисунке заголовка. Это событие гарантирует, чтобы клетки, которые впоследствии дадут начало последующим поколениям развивающегося эмбриона, возникали первыми. Примордиальные половые клетки являются высокоспециализированными клетками, которые впоследствии развиваются в зрелые спермии или яйцеклетки во взрослом организме, таким образом, повторяя цикл, в то время как остальные клетки тела, в конце концов, погибают. PGC, таким образом, являются особыми клетками. Они также могут быть использованы для получения плюрипотентных клеток, называемых эмбриональными половыми клетками или EG. Стволовые клетки присутствуют и во взрослом организме. Например, взрослые стволовые клетки образуют миллиарды различных клеток крови, которые происходят из стволовых клеток крови костного мозга. Наши клетки кожи или желудочно-кишечного тракта постоянно обновляются за счет дифференцировки соответствующих стволовых клеток. Взрослые стволовые клетки нормально способны генерировать клетки специализированных тканей, а не различные клеточные типы, которые могут быть получены из плюрипотентных стволовьгх клеток. Очень важно понимать сходство и различия между плюрипотентными ES и взрослыми стволовыми клетками, включая эпигенетические механизмы, которые регулируют эти свойства Понимание эпигенетических свойств половых клеток и плюрипотентных стволовых клеток поможет нам выработать новые подходы для терапии, особенно для регенеративной медицины.1. Введение. Жизнь млекопитающих: генетическая и эпигенетическая непрерывность
Генетическая информация, закодированная в геноме индивидуума, закладывается в момент оплодотворения и не изменяется при развитии, за исключением мутаций и направленных изменений последовательностей, происходящих, например, в иммунной системе. Яйцеклетка, или ооцит, женский вклад в оплодотворенную зиготу, вносит три типа наследственной информации в развивающийся эмбрион (рис. 20.1). Она вносит половину генетический информации, дополняемой гаплоидным геномом спермия. Кроме того, поскольку она является основой развивающегося эмбриона, определенные ранние этапы развития контролируются материнской наследственностью через материнские РНК и белки. Наконец, есть эпигенетическая информация, содержащаяся в ооците, которая оказывает влияние на регуляцию генома в развитии. Эпигенетическая информация кодируется метилированием ДНК, модификацией гистонов, вариантами гистонов, негистоновыми белками хроматина и подвергается большим изменениям во время развития и дифференцировки. Главной чертой эпигенетических меток является их способность наследоваться от одного клеточного поколения к другому и регулировать экспрессию генов. Считается, что эпигенетическая информация является наиболее важной для детерминации и поддержания определенной и стабильной программы экспрессии генов, которая определяет решение клеточной судьбы во время развития. Предполагается, что в тотипотентных и плюрипотентных клетках эпигенетические метки менее стабильны и более пластичны. Однако в процессе развития клеточные потенции становятся все более и более ограниченными, а эпигенетические метки все более устойчивыми и ограничительными. Тотипотентные и плюрипотентные клетки, такие как половые клетки и эмбриональные стволовые клетки (рис. 20.16), обладают уникальной способностью репрограммировать геном и удалять эпигенетические метки. Эта способность, воз можно, лежит в основе их пластичности в развитии. Взаимозависимость решений в развитии и эпигенетической генной регуляции устанавливает непрерывность генетических и эпигенетических событий у млекопитающих. Это происходит потому, что события, происходящие в развитии, например, сигналинг между клетками, приводят к появлению специфической программы экспрессии генов, которые могут фиксироваться эпигенетически. Кроме того, они могут устанавливать новые эпигенетические события (например, метилирование или деметилирование импринтных генов в половых клетках). Установление или удаление эпигенетических меток, в свою очередь, определяет новую генетическую программу и, следовательно, влияет на то, как клетки индивидуума отвечают на команды во время развития. Возникающая непрерывность развития и эпигенетических событий особенно поразительна, когда включает линии половых клеток, потому что это передается следующему поколению, а может быть и дальше. Действительно ли жизнь начинается с оплодотворения? Действительно, новый индивидуум генетически может быть идентифицирован во время оплодотворения яйцеклетки спермием. В этот момент гаплоидный набор хромосом матери соединяется с отцовским гаплоидным набором хромосом; образуется диплоидный геном потомка. Однако, в гаметах присутствует также эпигенетическая информация, которая будет передана потомству. Например, гены импринтинга несут метилированные ДНК метки, которые отличают женские и мужские половые клетки и эти предсуществующие паттерны наследуются потомством (глава 9). Эти эпигенетические метки включаются в геномы половых клеток во время эмбрионального или раннего постнатального развития родителей. Рис. 20.1. Яйцеклетка и зигота млекопитающих
(а) Ооцит млекопитающих содержит материнские РНК и белки (материнская наследственность), которые могут определять раннее развитие, генетическую (материнские хромосомы) и эпигенетическую информацию (ДНК метилирование и хроматиновые метки). (б) Из зиготы получается бластоциста, внутренняя масса которой дает начало ES клеткам (в культуре), все соматические клетки и примордиальные половые клетки (PGC). из которых получаются EG клетки в культуре
Рис. 20.1. Яйцеклетка и зигота млекопитающих
(а) Ооцит млекопитающих содержит материнские РНК и белки (материнская наследственность), которые могут определять раннее развитие, генетическую (материнские хромосомы) и эпигенетическую информацию (ДНК метилирование и хроматиновые метки). (б) Из зиготы получается бластоциста, внутренняя масса которой дает начало ES клеткам (в культуре), все соматические клетки и примордиальные половые клетки (PGC). из которых получаются EG клетки в культуре
Программа эпигенетических модификаций зависит от генетической детерминации закладки и развития половых клеток в ранних постимплантационных зародышах. Самые ранние предшественники половых клеток возникают из небольшой группы клеток в ранних постимплантационных эмбрионах в результате получения сигнальных молекул из другой части зародыша, экстра-эмбриональных линий, включая плаценту. Развитие половых клеток после их выделения регулируется генетически, определяя их эпигенетическую программу таким образом, что генные продукты, необходимые в соматических клетках, в половых клетках репрессированы. С другой стороны, половые клетки нуждаются в специальных генетически управляемых функциях, например, таких как эпигенетическое репрограммирование, установление импринтинга, хромосомная рекомбинация во время мейоза и редукционные деления для формирования гаплоидных гамет. До начала развития половых клеток в эмбрионе происходит установление наиболее ранних линий. Плюрипотентные клетки эпибласта ранних постимплантационных эмбрионов являются источником всех соматических клеток, а также примордиальных половых клеток. Дифференцировка соматических тканей в три первичные клеточные линии (эктодерма, мезодерма и эндодерма) начинается в ответ на сигналы экстра-эмбриональных тканей. В это же время примордиальные половые клетки также возникают из специального набора клеток, локализованных в проксимальной части эпибласта. Трофэктодерма (ТЕ) бластоцисты возникает раньше и является первым событием выделения линии в эмбрионах млекопитающих, которая в будущем дает плаценту (рис. 20.2). Из ICM развивается весь взрослый организм; плюрипотентные стволовые клетки (ES) происходят из клеток внутренней клеточной массы (ICM). Эта группа клеток возникает в развитии эмбриона на стадии морулы перед имплантацией, когда ICM клетки и слой трофэктодермы (ТЕ) разделены и формируют бластоцисту, которая затем имплантируется в матку. Эпигенетическая регуляция экстраэмбриональных (ТЕ) и эмбриональных (ICM) линий существенно различается. Например, общий уровень метилирования ДНК в экстраэмбриональных тканях ниже. Могут отличаться поддержание импринтинга и инактивация импринтной X хромосомы с импринтингом. ICM и ТЕ-клетки, так же как примордиальные половые клетки (PGC) детерминируются генетической программой, включая транскрипционные факторы и плюрипотентные гены.
 Рис. 20.2. Цикл эпигенетического репрограммирования в развитии млекопитающих
Сразу после оплодотворения упаковка отцовского пронуклеуса (PN) в зиготе происходит без Н3K9me2 и Н3K27me3, в то время как материнский хроматин содержит эти метки. Отцовский PN быстро теряет также 5-метилцитозин (5МеС) в разных участках гена, в то время как в материнском геноме этого не происходит. Пассивная утрата 5МеС происходит во время преимплантационного развития до стадии бластоцисты, когда клетки внутренней массы (ICM) начинают приобретать высокий уровень Н3K9me2 и Н3K27me3. Плацента, которая происходит в основном из трофэктодермы (ТЕ) бластоцисты, остается относительно гипометилированной. Примордиальные половые клетки (PGC) подвергаются деметилированию 5МеС и Н3K9me2 перед и после вхождения в гонады. De novo ДНК метилирование, включая родитель-специфический импринтинг, происходит на более поздних стадиях развития половых клеток
Рис. 20.2. Цикл эпигенетического репрограммирования в развитии млекопитающих
Сразу после оплодотворения упаковка отцовского пронуклеуса (PN) в зиготе происходит без Н3K9me2 и Н3K27me3, в то время как материнский хроматин содержит эти метки. Отцовский PN быстро теряет также 5-метилцитозин (5МеС) в разных участках гена, в то время как в материнском геноме этого не происходит. Пассивная утрата 5МеС происходит во время преимплантационного развития до стадии бластоцисты, когда клетки внутренней массы (ICM) начинают приобретать высокий уровень Н3K9me2 и Н3K27me3. Плацента, которая происходит в основном из трофэктодермы (ТЕ) бластоцисты, остается относительно гипометилированной. Примордиальные половые клетки (PGC) подвергаются деметилированию 5МеС и Н3K9me2 перед и после вхождения в гонады. De novo ДНК метилирование, включая родитель-специфический импринтинг, происходит на более поздних стадиях развития половых клеток
Как эти различные генетические программы впервые возникают в ранних эмбрионах и какой вклад вносят в установление этих программ межклеточные взаимодействия, эпигенетические модификации или цитоплазматические факторы яйцеклеток, пока неясно. В дополнение к эпигенетической информации, которая переносится генами при импринтинге из гамет в эмбрион, в момент оплодотворения происходят другие важные эпигенетические события. В оплодотворенной зиготе геном спермия быстро теряет метилирование ДНК, а затем приобретает модификации ДНК и гистонов при последующих клеточных делениях (рис. 20.2). Материнский геном устойчив к зиготическому ДНК деметилированию и подвергается более растянутому деметилированию во время дробления ранних эмбрионов. Хотя эти в какой-то степени противоположные и разные эпигенетические программы приводят к общей потере эпигенетической информации в гаметах, вероятно, такое динамическое репрограммирование событий взаимодействует с клеточными и генетическими процессами, которые определяют ранние процессы клеточного разделения в ICM и ТЕ линиях, соответственно. Таким образом, эпигенетический жизненный цикл никогда не заканчивается и никогда не начинается, а постоянно взаимодействует с генетической программой, которая определяет развитие ICM и ТЕ, плюрипотентных стволовых клеток, половых клеток и, возможно, других линий.
2. Генетические и эпигенетические механизмы, регулирующие спецификацию половых клеток (от раннего эмбриона к половым клеткам)
2.1. Принципы развития половых клеток в различных группах животных
У животных спецификация половых клеток, сегрегация половых клеток от соматических клеток, является одним из наиболее ранних событий в развитии (Surani et al., 2004). Половые клетки приобретают тотипотентное состояние. Существует два основных способа закладки линии половых клеток, относящихся к преформации (этот термин от старого использования слова преформизм) и эпигенезу (Extravour and Akam, 2003). Первый включает наследование предсуществующих детерминант половых клеток специфическими клетками так, как это происходит у Caenorhabditis elegans и Drosophyla melanogaster (Leatherman and Jongens, 2003; Blackwell, 2004). В противоположность этому эпигенетический способ спецификации половых клеток является процессом, в котором потенциально эквивалентная группа плюрипотентных клеток приобретает способность стать половыми клетками в ответ на индуктивные сигналы, в то время как оставшиеся клетки становятся в будущем соматическими клетками (Lawson and Hage, 1994; Mclaren, 2003). Такой механизм спецификации половых клеток действует у мышей и, возможно, у других млекопитающих, включая человека.2.2. Раннее развитие линии половых клеток у млекопитающих
Примордиальные половые клетки у мышей впервые обнаруживаются на стадии Е7.5 (на стадии раннего зачатка, ЕВ) как скопление примерно 40 клеток, которые являются основателями популяции линии половых клеток (Lawson and Hage, 1994; Mclaren, 2003). Эти клетки позитивны по щелочной фосфатазе и локализуются в пределах экстраэмбриональной мезодермы у основания аллантоиса (рис. 20.4, правая панель). Клональный анализ показал, что проксимальные клетки эпибласта на стадии Е6.0-Е6.5, стадии преполоски (PS) и первичной полоски (ES) дают начало PGC, а также тканям экстраэмбриональной мезодермы (Lawson and Hage, 1994). PGC формируются под влиянием сигнальных молекул, продуцируемым экстраэмбриональной эктодермой и первичной эндодермой (рис. 20.3). Втр4 и Втр8Ь являются сигнальными молекулами, которые регулируют компетентность и спецификацию половых клеток (Lawson etal., 1999). Чтобы понять генетическую программу спецификации PGC, из единичных клеток PGC-основателей и окружающих их соматических клеток была получена кДНК (Saitou et al., 2002). Для того чтобы различить PGC и соматические клетки был использован ряд маркеров. При таком скрининге сначала был идентифицирован fragilis, новый белок семейства интерферониндуцируемых трансмембранных белков, и Stella, ядерно-цитоплазматический белок. Дальнейшие исследования показали, что fragilis экспрессируется в проксимальных клетках эпибласта на стадии Е6.25 (рис. 20.3), когда они становятся компетентными для образования как PGC, так и окружающих их клеток экстраэмбриональной мезодермы Fragilis-позитивные клетки во время гаструляции перемещаются в задний проксимальный район. Впоследствии среди этой популяции клеток обнаруживается популяция основателей PGC, экспрессирующих stella. Одновременно в основателях PGC обнаруживается экспрессия плюрипотентных генов, включая Sox2 и Oct4, что дает основание полагать, что PGC проявляют плюрипотентность, которая утрачивается соседними соматическими клетками. Напротив, в основателях PGC ряд генов репрессированы, включая Нахb1 и Haxa1, экспрессия которых в этот период значительно повышается в соседних соматических клетках. Репрессия Нах генов является частью механизма, который лежит в основе репрессии соматической судьбы основателей PGC (Saitou et al., 2002). Рис. 20.3. Ранняя детерминация половых клеток у мыши
Плюрипотентные проксимальные клетки эпибласта (синий), которые происходят из ICM (см. рис. 20.1 и 20.2) получают экстраклеточный сигнал В MP4 и становятся компетентными к развитию половых клеток (розовый). Активация Blimp1 коммутирует эти клетки к развитию в линию примордиальных половых клеток (красный), в то время как остальные клетки становятся соматическими
Рис. 20.3. Ранняя детерминация половых клеток у мыши
Плюрипотентные проксимальные клетки эпибласта (синий), которые происходят из ICM (см. рис. 20.1 и 20.2) получают экстраклеточный сигнал В MP4 и становятся компетентными к развитию половых клеток (розовый). Активация Blimp1 коммутирует эти клетки к развитию в линию примордиальных половых клеток (красный), в то время как остальные клетки становятся соматическими
Основываясь на анализе выхода основателей ППК, очевидно, что так же как и у других организмов, репрессия соматической программы является основной особенностью специализации PGC у мышей (Seydoux and Strome, 1999; Blackwell, 2004; Surani et al., 2004). Для определения кандидатов генной репрессии были проанализированы гистон лизин метилтрансферазы (НКМТ) с целью выяснить, существуют ли различия в их экспрессии в PGC и соседних соматических клетках. Экспрессия некоторых их этих генов, G9a, Pfm1, Set1 и EZh2 была выявлена как в PGC-основателях, так и в соматических клетках. Однако один ген, Blimp 1(В-lymphocyte maturation-induced protein 1), кодирующий белок, индуцирующий созревание лимфоцитов, экспрессировался только в основателях PGC, но не в соседних соматических клетках на стадии Е7 (Obinata et al., 2005). Blimp1 является репрессором транскрипции, содержит SET/PR домен, пролин-богатый район, который может рекрутировать Groucho и HDAC26, пять С2Н2 цинковых пальца, формирующих комплекс с G9a и кислым концом (Shaffer et al., 2002; Shapiro-Shelef et al., 2003; Gyori et al., 2004; Sciammas and Davis, 2004). Blimp1 впервые был идентифицирован, благодаря его роли при специализации плазматических клеток после репрессии В-клеточной программы в клетках-предшественниках (Turner et al., 1994). Blimp1 активно экспрессируется во время развития мыши (Chang et al., 2002). Детальный анализ Blimp 1 в ранних эмбрионах мыши привел к неожиданным открытиям. Было установлено, что Blimp 1 начинает экспрессироваться в проксимальных клетках эпибласта на стадии Е6.25 в начале гаструляции, сначала только в 4–6 клетках, которые находятся в непосредственном контакте с клетками экстраэмбриональной эктодермы (рис. 20.3) (Obinata et al., 2005). Экспрессия Blimp 1 обнаруживается на одном конце короткой оси в участке, в котором будет сформирован задний проксимальный район. Число прогрессивно увеличивается, так что на стадии средней полоски их число достигает примерно 20; они формируют плотное скопление в заднем проксимальном районе на стадии Е6.75. На стадии Е7.5, раннего зачатка (ES), число Blimp 1-позитивных клеток увеличивается примерно до 40 (рис. 20.4). Эти клетки являются основателями PGC, экспрессируют классический PGC-маркер, щелочную фосфатазу, и в них начинается синтез stella (рис. 20.3). Эксперименты по генетическому прослеживанию линии подтвердили, что все Blimp 1-позитивные клетки, происходящие из эпибласта на стадии Е6.25 и далее, действительно являются клетками-предшественниками линии PGC. Эти данные находятся в противоречии с ранее существовавшей гипотезой, основанной на клональном анализе, согласно которой проксимальные клетки эпибласта на стадии Е6.0-Е6.5 не являются линиями ограниченными, дающими только PGC, поскольку клональные потомки индивидуальных клеток могут давать начало как соматическим, так и половым клеткам (Lawson and Hage, 1994; McLaren and Lawson, 2005). Это противоречие, вероятно, объясняется тем, что при клональном анализе маркированные клетки исходно могут быть Blimp 1-негативными, но при последующих делениях возникают позитивные клетки, которые дают PGC-клетки, в то время как дочерняя клетка дает соматических потомков. Механизм, который регулирует увеличение Blimp 1-позитивных клеток, пока неизвестен.
 Рис. 20.4. Развитие половых клеток у разных видов животных
У С. elegans специализация линии половых клеток (красный) начинается после первого деления зиготы с экспрессией Pie 1, которая приводит к транскрипционному покою Другая клетка (синий) дает начало соматическим клеткам. У D. melanogaster предшественниками половых клеток являются так называемые полюсные клетки, находящиеся на одной стороне зиготного синцития (многоядерного); транскрипционный покой в этих клетках зависит от локализации РНК гена Pgc У Mus musculus самые ранние предшественники половых клеток видны по экспрессии Blimp1 в основании аллантоиса. Blimp1 инициирует транскрипционный покой в этих клетках
Рис. 20.4. Развитие половых клеток у разных видов животных
У С. elegans специализация линии половых клеток (красный) начинается после первого деления зиготы с экспрессией Pie 1, которая приводит к транскрипционному покою Другая клетка (синий) дает начало соматическим клеткам. У D. melanogaster предшественниками половых клеток являются так называемые полюсные клетки, находящиеся на одной стороне зиготного синцития (многоядерного); транскрипционный покой в этих клетках зависит от локализации РНК гена Pgc У Mus musculus самые ранние предшественники половых клеток видны по экспрессии Blimp1 в основании аллантоиса. Blimp1 инициирует транскрипционный покой в этих клетках
2.3. Роль Blimp 1 в спецификации PGC
Дальнейший анализ роли Blimp 1 в спецификации PGC помог пониманию механизмов, лежащих в основе спецификации половых клетоку мышей. Утрата функции Blimp 1 показала, что она является решающим фактором PGC спецификации у мышей (Ohinata et al., 2005; Vincent et al., 2005). У Blimp 1 мутантов эмбрионы на стадии Е7.5 содержат аберрантный кластер почти PGC-подобных клеток, в то время как в контрольных эмбрионах PGC продолжают пролиферировать и начинают мигрировать из кластера. Более того, число аберрантных PGC-подобных клеток на стадии Е8.5 не увеличивается (Obinata et al., 2005). Одноклеточный анализ мутантных PGC-клеток показал отсутствие репрессии Нох генов. Следовательно, Blimp 1, вероятно, играет роль в репрессии соматической программы в основателях PGC. У мутантов наблюдалось также нарушение в регуляции активации PGC специфических генов, таких как stella и Nanos3, а также некоторых плюрипотентных генов, таких как Sox2. Эти данные свидетельствуют, что Blimp 1 играет важную роль как транскрипционный регулятор в процессе спецификации PGC и препятствует приобретению соматической программы в этих клетках. Исследования на В-клетках показали, что Blimp 1 индуцирует их дифференцировку в плазматические клетки, репрессируя основные молекулы, необходимые для их поддержания (Turner et al., 1994; Shaffer et al., 2002; Shapiro-Shelef et al., 2003; Sciammas and davis, 2004; более детально, см. гл. 21). Это происходит через образование Grouch и HDAC2 репрессорного комплекса (Ren et al., 1999). По-видимому, их «цинковые пальцы» также важны для образования комплекса с G9a (Gyory et al., 2004), являющейся НКМТ, которая необходима для H3K9me2. Однако функционирует ли Blimp 1 в процессе спецификации PGC через образование нового комплекса, по-прежнему неясно, поскольку нет данных о НКМТ активности домена Blimp 1SET/PR. Blimp 1 является эволюционно консервативным геном как у позвоночных, так и у беспозвоночных животных и обладает различными функциями. Например, он играет роль в развитии разных линий у позвоночных, таких как рыба-зебра и шпорцевая лягушка (de Souza et al., 199; Roy and Ng, 2004; Hernandez-Lagunas et al., 2005), хотя и не является высоко специфичным для развития половых клеток. Это означает, что этот ген приобрел новую функцию в спецификации PGC у мышей и, возможно, у всех млекопитающих. Это предполагает. что для этого крайне консервативного гена должны были эволюционировать дополнительные контролирующие элементы, чтобы регулировать его экспрессию в PGC-предшественниках и клетках-основателях.2.4. Репрессия соматической программы в половых клетках — явление, эволюционно консервативное
Механизм спецификации половых клеток не является эволюционно консервативным, что становится очевидным при сравнении его у мышей и двух других хорошо исследованных видов, D. melanogaster и С. elegans (Seydoux and Strome, 1999). Различия в механизмах спецификации половых клеток сначала объясняли различиями в ранних этапах развития у разных организмов, а также дополнительными сложностями, возникающими в результате феномена геномного импринтинга у млекопитающих. Важно отметить, что репрессия программы экспрессии соматических генов во время спецификации половых клеток является общим феноменом для разных организмов, хотя их молекулярные механизмы могут различаться (Seydoux and Strome, 1999; Leatherman and Jongens, 2003; Saitou et al., 2003; Blackwell, 2004). У С. elegans первое клеточное деление зиготы является ассиметричным. В результате него появляется соматическая клетка (АВ); вторая клетка (Р1) отделяется и дает начало линии половых клеток (рис. 20.4). Действительно, каждая из этих PI, Р2 и РЗ клеток при делении дает соматические клетки; последние начинают транскрипцию и дифференцировку. Клетки Р1—РЗ, которые дадут линию половых клеток, остаются транскрипционно неактивными. Транскрипционная активность подавляется цинк-пальцевым белком PIE-1, который ингибирует элонгацию транскрипции за счет конкуренции за фосфорилирование Ser-2 карбокситерминального домена (CTD) РНК-полимеразы И (pol II) (Van Doren et al., 1998; Seydoux and Strome, 1999: Zhang et al., 2003; детали см. гл. 10). Однако и соматические, и половые бластомеры имеют транскрипционно пермиссивное состояние хроматина, что было показано высоким уровнем H3K4те в геноме. Позднее, когда бластомер Р4 делится и образует две клетки половой линии, Z2 и Z3, репрессивное состояние хроматина становится выраженным, утрачивается H3K4те и выявляется высокий уровень репрессивного H3K9me (Schaner et al., 2003). Таким образом, в процессе становления линии половых клеток у С. elegans хроматин из транскрипционно пермиссивного состояния меняется в неактивное состояние. Становление линии половых клеток у D. melanogaster отличается от того, что наблюдается у мышей и червя. Предшественники линии половых клеток, которые называются полюсными клетками, выявляются до начала эмбрионального развития в оплодотворенном многоядерном яйце (рис. 20.4). Они тоже являются транскрипционно неактивными из-за отсутствия фосфорилирования pol II CTD, так же как это наблюдается у С. elegans (Seydoux and Dunn, 1997; Van Doren et al., 1998; Schaner et al., 2003). Хотя транскрипционный сайленсинг связан также и с репрессивной модификацией хроматина с помощью H3K9те, полярные клетки будут формировать только половые клетки. Таким образом, эти клетки подобны Z2 и Z3 клеткам С. elegans, которые предназначены только для образования линии половых клеток. Кроме того, транскрипционный сайленсинг в полярных клетках, по-видимому, регулируется геном полярного гранулярного компонента pgc (polar granule component), поскольку потеря pgc приводит к утрате репрессии, хотя полярные клетки по-прежнему обнаруживаются. В мутантных полярных клетках происходит фосфорилирование pol II CTD по Ser-2 (Deshpande et al., 2004; Martinho et al., 2004). Предполагается, что pgc может блокировать ключевой компонент, необходимый для фосфорилирования pol II CTD, ингибируя таким образом переход от комплекса преинициации к комплексу элонгации. Анализ cпецификации половых клеток во время развития у мышей, мух и червей четко показывает, что репрессия транскрипции, которая, по-видимому, необходима для подавления программы соматических клеток, выявлена во всех трех организмах, хотя механизмы, с помощью которых это достигается, существенно различаются. Это, очевидно, объясняется различиями в ранних этапах развития разных видов.2.5. Регуляция эпигенетической программы у мышей после спецификации PGC
Активное эпигенетическое программирование и репрограммирование в линии половых клеток продолжается после спецификации PGC (Seki et al., 2005). Этот период развития отмечен стиранием некоторых репрессивных эпигенетических модификаций, что позволяет клеткам половой линии приобрести плюрипотентные характеристики, которые, возможно, являются предпосылкой последующей тотипотентности. Основными наблюдаемыми изменениями являются исчезновение H3K9me2 на стадии Е8.0 и уменьшение уровня HP 1а на стадии Е 9.0 в эухроматиновых и перицентрических гетерохроматиновых районах (Seki et al., 2005). Вместе с тем в PGC, начиная со стадии Е8.0 и далее, происходит уменьшение общего уровня метилирования ДНК. В то время как происходит уменьшение H3K9me2 и ДНК метилирования, наблюдается прогрессивное увеличение H3K27me3, репрессивной модификации, опосредованной Ezh-белком группы polycomb в, Ezh (рис. 20.5). Потеря ДНК метилирования сопровождается репрессией de novo ДНК-метилтрансфераз Dnmt За и Dnmt3b, а также временным уменьшением Dnmtl. Следует заметить, что потеря ДНК метилирования H3K9me2 также совпадает с возобновлением экспрессии гена Nanog, который является ключевым геном, связанным с плюрипотентностью (Yamaguchi et al., 2005). Nanog впервые экспрессируется во внутренних клетках на стадии поздней морулы и в клетках внутренней массы бластописты. Однако экспрессия этого гена быстро уменьшается после имплантации и возобновляется только после спецификации PGC. Вместе с экспрессией других плюрипотентных генов, включая Oct4, Sox2 и Esgl, это показывает, что половые клетки приобретают плюрипотентные свойства (рис. 20.5). Дополнительные события интенсивного эпигенетического программирования происходят после попадания PGC в развивающиеся гонады (Surani et al., 2004). Во-первых, происходит увеличение метилирования H3K4 и ацетилирования H3K9, что является характерным для пермиссивного состояния хроматина, исключающего H3K9те. Кроме того, происходит повсеместное геномное деметилирование ДНК (рис. 20.5), включающее стирание родительских импринтов и метилирования в единичных копиях генов В женских эмбрионах в это время происходит реактивация неактивной Х-хромосомы. Хотя существует эффективный механизм стирания «приобретенных» эпигенетических модификаций, не все эпигенетические метки полностью удаляются во время развития половых клеток. Например, метилирование ДНК семейства транспозонов IAP репрограммируется только частично (Lane et al., 2003). Неполное удаление эпигенетических меток, очевидно, может привести к эпигенетическому наследованию через линию половых клеток. И этому имеется ряд примеров у млекопитающих (Chong and Whitelaw, 2004) Чтобы понять, насколько широко этот феномен распространен и сколько генов могут быть в него вовлечены, нужны дальнейшие исследования. Рис. 20.5. Ранние эпигенетические события во время спецификации половых клеток
Экспрессия Blimp1 в потомках эпибластных клеток приводит к подавлению экспрессии соматической генной программы (красный). За этим следует экспрессия Stella, Nanog и Esgl, увеличение H3K27me3, H3K4me3 и H3K9ас, утрата H3K9me2 и 5МеС. Примордиальные половые клетки входят в гонады, после чего происходит дальнейшее эпигенетическое репрограммирование
Рис. 20.5. Ранние эпигенетические события во время спецификации половых клеток
Экспрессия Blimp1 в потомках эпибластных клеток приводит к подавлению экспрессии соматической генной программы (красный). За этим следует экспрессия Stella, Nanog и Esgl, увеличение H3K27me3, H3K4me3 и H3K9ас, утрата H3K9me2 и 5МеС. Примордиальные половые клетки входят в гонады, после чего происходит дальнейшее эпигенетическое репрограммирование
2.6. Линия половых клеток и стволовые клетки — обратимый фенотип
Половые и ICM-клетки являются теми клетками, из которых происходят плюрипотентные клетки в культуре. При культивировании в присутствии FGF2 PGC подвергаются изменениям и становятся плюрипотентными эмбриональными половыми (EG) клетками (Matsui et al., 1992; Resnick etal., 1992). Они во многих отношениях сходны с плюрипотентными ES-клетками, за исключением того, что в EG-клетках в процессе их получения происходит интенсивное стирание родительских импринтов (Tada et al., 1998). Поскольку PGC проявляют свойства плюрипотентности, можно предположить, что существуют механизмы, позволяющие PGC сохранять специфические характеристики разных линий Каким образом это достигается, пока неясно. Возможно, что функция Blimp1 сохраняется после PGC спецификации для ее гарантии. Предполагается, что при получении EG-клеток это ограничение ослабляется и PGC приобретают явные плюрипотентные свойства, в том чисде способность дифференцироваться в разные клеточные типы, что редко происходит с половыми клетками in vivo. Следует заметить, что получение EG становится прогрессивно менее эффективным при использовании PGC со стадий Е11.5 и Е12.5, что также свидетельствует о том, что свойства этих клеток изменяются со стадии Е11.5, когда они начинают дифференцироваться в дефинитивные мужские и женские половые клетки.2.7. Развитие половых клеток из плюрипотентных ES клеток
Плюрипотентные стволовые клетки, полученные из бластоцист, могут дифференцироваться во все типы соматических тканей, включая половые клетки (рис. 20.7). Большие усилия прилагаются для эффективного получения из ES-клеток в культуре разных тканей. Недавно было показано, что из культивируемых ES-клеток можно получить PGC и, возможно, спермий- и ооцит-подобные структуры (Hubner et al., 2003; Toyooka et al., 2003; Geijsen et al., 2004). Следовательно, с углублением знаний о генетической программе спецификации PGC и гамет механизм спецификации половых клеток может быть изучен in vitro. Это, возможно, позволит создать модельную систему для изучения эпигенетического репрограммирования в этой линии клеток. Такой подход, в конечном итоге, поможет пониманию того, что происходит с линией половых клеток у человека Более того, если станет возможной направленная дифференцировка культивируемых ES-клеток человека в ооциты, их можно будет использовать для «терапевтического» клонирования, и, таким образом, отпадет необходимость в донорских ооцитах, которые трудно получать. Эти ооциты могут быть использованы для трансплантации ядер соматических клеток и получения бластоцист, а затем ES-клеток. Ядра соматических клеток, перенесенные в ооциты, подвергаются репрограммированию в тотипотентное состояние (подробно о трансплантации ядер и репрограммировании см. главу 22). Такая процедура, вероятно, окажет огромное влияние на биомедицину, так как позволит создавать «персонифицированные» ES-клетки от больных. Кроме того, она позволит иметь большое разнообразие ES-клеток от больных со специфическими заболеваниями. Такие ES-клетки, в свою очередь, открывают возможность исследовать причины, лежащие в основе заболеваний человека. Они могут быть использованы, например, для тестирования терапевтических препаратов, купирующих болезнь. Использование человеческих эмбрионов и ES-клеток в исследованиях и терапии поднимает много этических проблем. В различных странах существуют законодательства и руководства для исследований в этой области. Если получение жизнеспособных гамет из ES-клеток человека станет возможным и они будут способны к оплодотворению и дальнейшему развитию, это поднимет новые этические вопросы о том, может ли такой подход быть использован в медицине и каким образом.2.8. От примордиальных половых клеток к гаметам
Следующим этапом в развитии линии половых клеток является начало гаметогенеза и вступление половых клеток в мейоз. Соматическое окружение в гонадах регулирует время этого события. У самок половые клетки останавливаются в мейотической профазе, в то время как у самцов половые клетки останавливаются в митозе. Многие сигналы окружающей среды диктуют, войдут ли половые клетки в мейоз или нет. Недавно был идентифицирован новый ген Meisetz и было показано, что он играет важную роль в инициации мейоза (Hayasshi et al., 2005). Этот ген также содержит SET/PR и многочисленные «цинковые пальцы», которые, как было установлено, каталитически активны по отношению к H3K4те. Экспрессия Meisetz специфична для половых клеток и обнаруживается во время входа их в мейотическую профазу у самок на стадии Е13.5 и в постнатальных семенниках. Мутация в гене Meisetz приводит к стерильности и самцов, и самок, что свидетельствует о его важной роли в половых клетках. В мутантных половых клетках наблюдается заметное нарушение в репарации двухнитевых разрывов ДНК и спаривании гомологичных хромосом во время мейоза. Эти исследования демонстрируют важную роль эпигенетических механизмов в половых клетках во время мейоза. Обширные эпигенетические изменения продолжаются во время гаметогенеза и, в конце концов, соматические линкерные гистоны заменяются вариантами, специфичными для семенников (Kimmins and Sassone-Corsi, 2005), а затем происходит замена большинства гистонов на протамины. Исследования показали, что в репрессию генов и хромосомное спаривание вовлечены Suv39 и H3K9 метилтрансфераза. Кроме того, два белка, Suv39hln Suv39h2, имеющие SET-домен, имеют важное значение для мужских половых клеток, причем последний экспрессируется преимущественно в семеннике, накапливаясь в половом тельце. Мутации в Suv39hln Suv39h2 приводят к стерильности, поскольку происходит остановка спемаююниальных клеток (Peters et al., 2001). В мужских половых клетках присутствует также хроматоидное тельце, облакоподобная цитоплазматическая структура. Она является цитоплазматической органеллой, специфичной для половых клеток, которая взаимодействует с ядром, содержит компактную мРНК и является РНК-процессинговым тельцем, содержащим белки Dicer и Argonaute и микроРНК. В самообновление стволовых клеток половой линии вовлечены некодирующие РНК в сперматогенезе, роль которых, возможно, опосредована механизмом интерференции РНК (и PHК) и гистон метилтрансферазами (НМТазы). Сообщалось, что члены семейства Piwi/Argonaute (у мышей они называются М/м) играют роль в явлении иРНК. Утрата Miwi-подобных белков (Mili) приводит к стерильности у мышей (Kuramochi-Miyagawa et al., 2004), вызывая высокий уровень транскриптов ретротранспозонов IAP и Linel Однако напрямую вовлечение Miwi-подобных белков в их репрессию показано не было. Недавние исследования продемонстрировали возможность получения плюрипотентных стволовых клеток из спематогониальных стволовых клеток семенников новорожденных и даже взрослых животных (Kanatsu-Shinohara et al, 2004; Guan et al., 2006). Такие клетки можно постоянно поддерживать в культуре, но в отличие от ES-клеток они имеют родительский (андрогенный) импринт. Эти клетки способны дифференцироваться в разные соматические клетки in vitro и in vivo и являются жизнеспособными половыми клетками in vivo. Такие клетки должны стать важным объектом для изучения разных аспектов сперматогенеза и роли эпигенетических механизмов, которые регулируют их свойства как стволовых клеток и дифференцировку в мужские половые гаметы Стирание импринтов в ранних половых клетках делает родительские хромосомы эпигенетически эквивалентными, что происходит в первый и последний раз в жизни млекопитающих. Трансплантация таких «свободных от импринтов» ядер непосредственно в ооциты приводит в развитию аберрантных эмбрионов, которые погибают на ранних эмбриональных стадиях, вероятно вследствие того, что из-за отсутствия соответствующих эпигенетических модификаций происходит нарушение экспрессии генов, которые в норме подвергаются импринтингу. Этот эксперимент также показывает, что импринты не могут приобретаться ядрами без импринтов при их трансплантации непосредственно в ооцит. ДНК метилирование импринтов начинается после рождения в процессе роста ооцитов из женских половых клеток. В мужских половых клетках это происходит на более поздних стадиях эмбриогенеза. В этом процессе важную роль играют de novo Dnmt3a метилтрансфераза и ее кофактор Dnm3L (детали см. в главе 19). Импринтинг является главным барьером партеногенетического развития у млекопитающих. Попытки манипулировать эпигенотипом женских гамет, возможно, позволят получать у млекопитающих эмбрионы полностью материнского происхождения.3. От ооцитов к раннему эмбриону
В предыдущих разделах мы рассмотрели, как зрелые спермии и ооциты приобретают различные специфические эпигенетические метки во время гаметогенеза. Некоторые из этих различий, такие как родительские импринты, точно поддерживаются в эмбрионах после оплодотворения. Многие другие репрограммируются, поскольку геном эмбрионов приобретает тотипотентность. Важно знать, какую роль играют эпигенетические метки, унаследованные от родительских гамет, на самых ранних этапах дифференцировки эмбрионов. Если вы начинаете жизнь с одной клетки (оплодотворенная зигота) с полным геномом, которая затем делится, как вы достигаете различий в генной экспрессии и программах развития в дочерних клетках?3. 1. Материнская наследственность и потенциальное асимметричное распределение?
У организмов (таких как дрозофила, шпорцевая лягушка, цыпленок), у которых яйцеклетка имеет большой размер, некоторые материнские белки и РНК располагаются в яйце ассиметрично Они наследуются только некоторыми клеточными потомками, которые впоследствии имеют особую судьбу, в то время как другие потомки, не унаследовавшие эти детерминанты, развиваются по-другому (Huynh and St Johnston, 2004). Такая стратегия возможна для относительно больших яйцеклеток (таких, как у дрозофилы), но затруднительна для млекопитающих с более мелкими яйцеклетками. Однако программа развития может диктоваться не только размерами яйцеклеток, но, что более важно, необходимостью формировать бластоцисту у млекопитающих, которая должна имплантироваться и образовывать плаценту для поддержания эмбриона. С точки зрения развития, ICM можно считать эквивалентной ооциту дрозофилы, поскольку их онтогенетичекое разнообразие на начальных этапах развития регулируется сигналами из экстраэмбриональной соматической ткани. Хотя недавно появились предположения, которые связывают симметрию оплодотворенной зиготы с симметрией бластоцисты и даже постимплантационных эмбрионов (Gardner et al., 1997; Weber et al., 1999), никаких детерминант дифференцировки, ассиметрично расположенных в яйцеклетке, у млекопитающих пока не найдено. Более того, эмбрионы млекопитающих обладают удивительной способностью «регулировать» развитие, т. е. если удалить или нарушить клетки, компенсаторный рост или клеточные движения позволяют поддерживать нормальное развитие эмбриона (Kelly, 1977). Тем не менее, небольшие различия в предрасположенности индивидуальных клеток (бластомеров) развиваться в ICM и ТЕ линии, вероятно, существуют уже на четырехклеточной стадии (Fujimori et al., 2003; Piotrowska-Nitsche et al., 2005).3.2. Эпигенетические события при оплодотворении
Во время развития и дифференцировки клетки соматических линий приобретают специфическое и специализированное ДНК метилирование и модифицирование гистонов. Эти модификации, по-видимому, трудно стереть или обратить при пересадке соматических ядер в ооциты (глава 22). Эпигенетические метки в ооцитах и спермиях также специализированы, но они репрограммируются при оплодотворении таким образом, что геном эмбриона приобретает новую функцию, а именно становится тотипотентным (Reik et al., 2001; Surani, 2001). Известен ряд характеристик эпигенетического рисунка гамет и генетического репрограммирования после оплодотворения (рис. 20.2). Геномы и спермиев, и ооцитов имеют высокий уровень метилирования ДНК. Как пример особого класса последовательностей можно привести семейство ретротранспозонов, внутринистерные А частицы (intracistemal A particles, IAP), число копий которых в мышином геноме составляет около 1000 и которые имеют высокий уровень метилирования и в ооцитах, и в спермиях (Lane et al., 2003). Однако имеются определенные последовательности, особенно дифференциально метилированные районы (differentially methylated regions, DMR) в импринтных генах, которые являются метилированными только в ооцитах или спермиях (глава 19). Геном ооцитов имеет высокий уровень модификаций гистонов, как активных (например, H3K9 ацетилирование, H3K4 метилирование), так и репрессивных (H3K9, H3K27 метилирование) (Morgan et al., 2005). Перед оплодотворением геном ооцита транскрипционно неактивен. Однако в ооците содержатся транскрипты и белки, необходимые для первых нескольких делений дробления, в том числе те, которые имеют важное значение для репрограммирования (рис. 20.1а). Геном спермия высоко специализирован, поскольку большинство гистонов во время сперматогенеза заменилось на протамины, способствующие, по-видимому, упаковке ДНК в компактную головку спермия (McLay and Clarke, 2003). В настоящее время неизвестно, какие модификации есть в оставшемся хроматине и где они раположены, что создает трудности для изучения этих немногочисленных районов хроматина. Вскоре после оплодотворения в геноме спермия происходит четко отрегулированное репрограммирование. Протамины замещаются гистонами. Вероятно, будучи независимым от репликации (RI, replication independent), это состоит во включении гистонового варианта H3.З гистоновым шапероном HIRA (van der Heijden et al, 2005; см. гл 13). В то время в мужском пронуклеусе происходит обширное ДНК метилирование, затрагивающее как однокопийные последовательности, так и повторы, но не мужские метилированные импринтные гены (Olek and Walter, 1997; Mayer et al., 200; Oswald et al., 2000; Dean et al., 2001; Santos et al., 2002; Lane et al., 2003). В мужском пронуклеусе перед репликацией ДНК H3 и Н4 гистоны ацетилированы, H3K4 метилирован; быстро появляются H3K9те и H3K27mel (Amey et al, 2002; Santos et al.. 2002; Lepikov and Walter, 2004). Однако H3K9me2/3 и H3K27me2/Зпоявляются только после репликации ДНК, по всей видимости, вместе с включением коровою гистона Н3.1 вместо H3.З (Santos et al., 2005). Во время первого митоза большинство проанализированных к настоящему времени гистоновых меток в женских и мужских хромосомах становятся очень схожими, по крайней мере, на низком уровне разрешения с использованием иммунофлуоресцентного окрашивания (Santos et al., 2005). Ферментативная активность, ответственная за ранние этапы репрограммирования, вероятно, уже присутствует в ооците в виде белков или молекул РНК, которые могут быстро транслироваться. Мы уже упоминали HIRA, но после репликации ДНК участвует CAF-1, который необходим для включения зависимого от репликации (RD, replication dependent) Н3.1. Su (var) ферменты метилируют H3K9, a Ezh2 вместе с его кофактором Eed метилируют H3K27 (Eehardt et al. 2003; Santos et al, 2005). Вероятно, существенное деметилирование ДНК мужского генома вызывается процессом «активного деметилирования», для которого предложены различные механизмы, однако определенного фермента (ферментов) пока не изолировано (Morgan et al, 2005). Возможным кандидатом для участия в механизме деметилирования является семейство ферментов Aid/ Apobec, способных дезаминировать 5-метилцитозин в ДНК, превратив его в тимидин. Возникающее T: G несоответствие может репарироваться за счет механизма репарации с помощью эксцизии оснований (Morgan et al., 2004). У растений процесс деметилирования также включает зксцизионную репарацию, которая инициируется ДНК гликозилазой Demeter (Gerhing et at, 2006). Подобные деметилазы могут присутствовать и в цитоплазме ооцита при оплодотворении. Отсюда возникает вопрос, почему материнский геном не деметилируется одновременно с отцовским? Материнский хроматин или пронуклеус должны обладать неким механизмом специфической протекции; колокализация метилированной ДНК в материнском пронуклеусе вместе с H3K9me2 дает основание предполагать, что эта модификация гистона и есть кандидат для протекции (Amey et al., 2002; Santos et al., 2002, 2005). Хотя имеющиеся данные предполагают, главным образом, приобретение гистонами модификаций, а не их утрату на глобальном уровне в этот период, возможно, что метилирование гистонов по аргинину является более динамичным. Действительно, в ооцитах присутствует Padi4, кандидат на вырезание метилированных аргининов в гистонах с помошью «леаминирования» (Sacramento et al., 2004). Представляется, что основной результат быстрых изменений хроматина при оплодотворении заключается в том, что на двухклеточной стадии отцовский геном становится схожим с материнским. Это исключает метилирование ДНК, которое значительно отличается у двух геномов, в основном вследствие деметилирования генома спермиев. Кроме того, проведенный анализ не исключает, что на этой стадии устанавливается геноспецифические различия в модификации гистонов.3.3 От зиготы к бластоцисте
Дальнейшее репрограммирование, в частности ДНК метилирование по всему геному, продолжается от двухклеточной стадии через стадию дробления преимплантационного развития до достижения эмбрионом стадии бластоцисты (Monk et al. 1987; Howlett and Reik, 191; Rougier et al., 1998). Точная динамика модификаций гистонов у мышей пока не описана, однако метилирование ДНК постепенно уменьшается с каждым клеточным делением до стадии 16-клеточной морулы. Причина заключатся в том, что Dnmtl, метилтрансфераза, которая полуконсервативно поддерживает метилирование CpG динуклекотидов во время репликации ДНК, исключается из ядра (Carlson et al., 1992). Следовательно, при каждом делении теряется 50 % всей геномной метилированной ДНК. Единственным, хорошо документированным исключением из этого являются DMR в импринтных генах. Не ясно, поддерживается ли их метилирование в этот период неизвестной Dnmt или за счет небольшого количества Dnmtl, способной попадать в ядро и специфически узнавать DMR. Примечательно, что на 8-клеточной стадии Dnmtl белок, по-видимому, появляется в ядре на один клеточный цикл. Если этот Dnmtl белок удалить (с помощью генетического элиминирования в ооците, который обеспечивает большую часть, если не целиком, этого белка, деления дробления), метилирование DMR, действительно, уменьшается на 50 %, что согласуется с представлением о его необходимости для поддержания метилирования в течение только одного цикла репликации (Howell et al., 2001). На стадии 8—16 клеток наружные клетки морулы уплощаются и становятся эпителиальными. Это явление называют компактизацией и оно является первым внешним признаком дифференцировки эмбрионов млекопитающих. В течение последующих 2–3 делений в моруле происходит кавитация (например, образуется полость) и бластоциста становится различимой по своей внутренней массе (ICM) и наружной трофэктодерме (ТЕ). Клетки ICM формируют все линии эмбриона и плода, в то время как ТЕ клетки дают начало большинству (но не всем) линиям плаценты (экстраэмбриональные линии). Вскоре после этой стадии на поверхности ICM образуется еще один слой эпителиальных клеток, которые являются примитивной энтодермой, клетки которой тоже вносят вклад в развитие плаценты и желточного мешка, но не эмбриона. Известно несколько генетических детерминант распределения этих ранних событий: Oct4, Nanog и Sox2 важны для поддержания клеток ICM, в то время как Cdx2 необходим для детерминации или поддержания ТЕ клеток (Nichols et al.2003; Avilion et al., 2003; Chambers et al., 2003; Mitsui et al., 2003; Niwa et al., 2005). В какой степени материнский белок (присутствующий в ооците) или эпигенетическая регуляция этих генов могут вносить вклад в решение судьбы этих ранних клеток, пока не известно (Ferguson-Smith, 2001). Однако большинство эпигенетических программных событий происходят как раз на этой стадии развития. Клетки ICM приобретают высокий уровень метилирования ДНК, по крайней мере, на основании данных иммунофлуоресценции (красные клетки внутри бластоцисты на левом рисунке титульной страницы), который возникает de novo с помощью метилтрансферазы Dnmt3b (Santos et. al., 2002). Это сопровождается усилением метилирования H3K9 и H3K27 гистонов с помощью G9a, Eset и Ezh2, соответственно (Erhardt et al., 2003). Хотя метилирование ДНК de novo не является критичным для начального этапа становления ICM клеток, метилирование гистонов с помощьюEzh2 и Eset является необходимым: при нокауте любого из этих генов развитие клеток ICM нарушается (CFCarroll et al., 2001; Dodge et al., 2004). В противоположность увеличению эпигенетических модификаций в ДНК ICM, в ДНК в ТЕ, так же, как и в большинстве клеточных линий поздней плаценты, в основном остается гипометилированной (Chapman et al., 1984; Santos et al., 2002). Считается, что клетки плацентарного типа меньше нуждаются в эпигенетической стабильности, поскольку время их жизни более ограничено по сравнению с плодом, который развивается во взрослый организм. Помимо этих крупномасштабных эпигенетических событий по всему геному, на этих стадиях также происходит репрограммирование более локус-специфическое. В женских эмбрионах XX на стадии дробления X хромосома, унаследованная от отца, инактивируется и в этом состоянии остается в экстраэмбриональных тканях, т. е. в ТЕ и плаценте (Huynh and Lee, 2003; Okamoto et al., 2005). Однако в ICM инактивированная X хромосома реактивируется, а затем после дифференцировки ICM в различные линии происходит случайная инактивация одной из X хромосом (Мак et al., 2004; более детально см. рис. 17.4). Механистически, импринтная X инактивация в преимплантационном эмбрионе связана с экспрессией некодирующей Xist РНК родительской хромосомы, чье «покрытие» хромосомы, как предполагают, приводит к сайленсингу генов и установлению репрессивных эпигенетических модификаций (Heard, 2004). Во вновь образующихся клетках ICM Xist транскрипция подавляется, репрессивные гистоновые модификации, в конце концов, утрачиваются, и хромосома реактивируется (Мак et al, 2004; Okato et al., 2004). Вскоре после этого происходит случайная X инактивация в клетках эпибласта. В следующем разделе мы покажем, что ES клетки «заморожены» на стадии реактивации X хромосомы и поэтому женские ES клетки содержат две активные X хромосомы.4. От плюрипотентных клеток к соматическим клеткам и обратно к половым клеткам
4.1. Получение плюрипотентных стволовых клеток
В предыдущей главе мы выяснили, что в зиготе, а затем на стадии дробления и в бластоцисте происходят важные эпигенетические события, в результате чего эпигенетический рисунок в ICM и ТЕ отличается Сейчас мы рассмотрим генетические и эпигенетические свойства культивируемых ранних стволовых клеток, полученных из бластоцисты и более поздних линий, таких как эмбриональные стволовые клетки (Smith, 2001), трофобластные стволовые клетки (TS) (Rossant, 2001), эндодермальные клетки (XEN) (Kunath et al., 2005), эмбриональные половые клетки (EG) (Matsui et al, 1992). Общим для этих клеточных типов является то, что их можно изолировать из интактных эмбрионов и получить из них культуру при определенных условиях культивирования. Такие культуры можно поддерживать длительное время и в них отсутствуют признаки старения. С ними можно осуществлять генетические манипуляции, затем вводить в живые эмбрионы, где они участвуют в развитии разных линий. Одним из наиболее важных открытий в эмбриологии млекопитающих в 1980-е годы было развитие методов получения плюрипотентных эмбриональных стволовых клеток (ES) из ICM. ES-клетки, эксплантированные из мышиных бластоцист в культуры, могут поддерживаться длительное время, а затем снова вводиться с помощью микроинъекпий в бластоиисты. Они колонизируют все эмбриональные линии, формируя таким образом химеры (рис. 20.6; Evans and Kaufman, 1981; Martin, 1981). Наиболее удивительным оказалось то, что потомки ES клеток могут колонизировать линию половых клеток и давать нормальное потомство, которое целиком происходит из генотипа ES-клеток. Это, а также возможность генетической манипуляции с геномом ES клеток с помощью гомологичной рекомбинации (что приводит к генному нокауту) произвело революцию в генетике мыши и сделало мышь генетической моделью организма. ES-клетки имеют сходные свойства с клетками IСМ/эпибласта, однако имеются и существенные различия, что указывает на то, что они являются «синтетическим» клеточным типом, который, вероятно, не существует в нормальном эмбрионе (по-видимому, это относится и к другим плюрипотентным клеткам) (Smith, 2001). Рис. 20.6. Получение Es и Ts клеток из бластоцисты
ES-клетки получают из клеток внутренней массы (ICM) и они могут поддерживаться в культуре без дифференцировки. Культивируемые клетки могут подвергаться генетическому манипулированию. ES-клетки могут быть введены в бластоцисты и колонизировать все ткани эмбриона, в том числе линию половых клеток, за исключением трофобластных клеток плаценты. TS-клетки получают из клеток трофэктодермы бластоцисты и при введении их в бластоцисты они вносят вклад в развитие клеток плацентарного типа
Рис. 20.6. Получение Es и Ts клеток из бластоцисты
ES-клетки получают из клеток внутренней массы (ICM) и они могут поддерживаться в культуре без дифференцировки. Культивируемые клетки могут подвергаться генетическому манипулированию. ES-клетки могут быть введены в бластоцисты и колонизировать все ткани эмбриона, в том числе линию половых клеток, за исключением трофобластных клеток плаценты. TS-клетки получают из клеток трофэктодермы бластоцисты и при введении их в бластоцисты они вносят вклад в развитие клеток плацентарного типа
Например, для самообновление мышиных ES-клеток требуется Lif/gp130/Stat3 сигналинг, однако эмбрионы с мутацией этого сигнального пути развивают нормальную ICM (Smith, 2001). Вероятно, при получении и поддержании ES из ICM происходят эпигенетические изменения, которые, возможно, являются необходимыми. ICM клетки, растущие в культуре, довольно быстро теряют экспрессию Oct4 и только единственный штамм мышей, 129Sv, из которого относительно легко получить ES-клетки, сохраняет экспрессию Oct4 при культивировании (Buer et al., 2003). Сообщалось также об эпигенетических изменениях в импринтных генах в ES-клетках мыши и макаки; в мышиных клетках это может приводить к нарушению развития клеток в химерах (Dean et al., 1998; Humphreys et al., 2001; Fujimoto et al, 2005).
4.2. Эпигенетические свойства плюрипотентных стволовых клеток
ES-клетки могут дифференцироваться в разные клеточные линии (рис. 20.7). В какой мере эпигенетические механизмы поддерживают клетки в дифференцированном или недифференцированном состоянии? Очевидно, что существуют эпигеномные различия между недифференцированными ES-клетками, дифференцированными ES-клетками и соматическими клетками. Плюрипотентные клетки частично характеризуются гипердинамической пластичностью хроматина (Meshorer et al, 2006). Делеция в ES-клетках Parp (poly-ADP ribosylase, поли-АДФ рибозилаза), которая участвует в контроле изменения гистоновых меток, приводит с низкой частотой ктрансдифференцировке в клетки трофобласта. Это предполагает, что гистоновые маркеры необходимы для поддержания идентичности ES-клеток (Hemberger et al., 2003). Для этого необходимо также ДНК метилирование, поскольку сильная потеря ДНК метилирования приводит к частичному блокированию способности ES-клеток к дифференцировке, а те, которые дифференцируются, экспрессируют маркеры ткани трофэктодермы (Jackson et al., 2004). Поддержание плюрипотентности ES-клеток зависит от транскрипционных факторов Oct4, Nanog и Sox2 (Boyer et al., 2005; Loh et al., 2006). Дифференцировка ES клеток in vitro характеризуется подавлением транскрипции плюрипотентных генов, которые репрессированы во всех соматических тканях. Для их молчания важное значение имеют эпигенетические механизмы: промотор Oct4, например, накапливает при дифференцировке репрессивные гистоновые модификации и ДНК метилирование (Feldman et al., 2006). Утрата ДНК метилирования, например, в эмбрионах с нокаутом Dnmtl приводит к репрессии Oct4 при дифференцировке (Feldman et al., 2006). ES-клетки и их дифференцированные производные служат моделью эпигенетической регуляции инактивации X хромосомы. В женских ES-клетках и ICM Xist ген инактивирован и имеются две активные X хромосомы. При дифференцировке in vitro Xist на одной из X хромосом активируется, Xist РНК начинает «покрывать» эту хромосому в положении cis, в результате чего на сопутствующей хромосоме происходит «молчание» генов, аккумуляция репрессивных гистоновых модификаций и метилирование ДНК (Heard, 2004). Рис. 20.7. Дифференцировка ES-клеток в различные клеточные типы in vitro
ES-клетки при определенных условиях культивирования мо гут дифференцироваться в различные типы клеток, такие как нейроны, мышечные клетки и даже половые клетки (ооциты) На вставке показаны нейроглиальные клетки, полученные из ES-клеток в культуре
Рис. 20.7. Дифференцировка ES-клеток в различные клеточные типы in vitro
ES-клетки при определенных условиях культивирования мо гут дифференцироваться в различные типы клеток, такие как нейроны, мышечные клетки и даже половые клетки (ооциты) На вставке показаны нейроглиальные клетки, полученные из ES-клеток в культуре
Другие плюрипотентные клетки тоже могут быть переведены в культуру, но их эпигенетические свойства охарактеризованы меньше, чем у ES-клеток. Однако из исследований эпигенетической инактивации X хромосомы известно, что в женских TS-клетках имеется отцовская инактивированная X хромосома, содержащая репрессивные гистоновые метки (Hyynh and Lee, 2003). Женские XEN-клетки тоже имеют отцовскую X хромосому, которая инактивирована (Kunath et al., 2005). Плюрипотентные клеточные линии получают также из примордиальных половых клеток (PGG) либо в период их миграции в эмбрионе (Е8-Е10.5), либо после того, как они оказываются в эмбриональных гонадах (Е11.5-Е13.5) (рис. 20.8) (Matsuietal, 1992). PGG на стадии развития Е8.5-12.5 подвергаются обширному эпигенетическому репрограммированию, включая ДНК метилирование импринтных генов и других последовательностей в геноме (Haikova et al., 2002; Lee et al., 2002). Большинство EG линий подвергается стиранию метилирования ДНК в импринтных генах и других последовательностях и это изменяет их потенциал развития, что обнаруживается при образовании химер (Tada et al., 1998). Пока неясно, имеются ли эпигенетические различия между эндогенными PGG и культивируемыми in vitro EG клетками, подобные тем, которые, как предполагается, сушествуют между ICM и ES-клетками.
4.3. Способность стволовых клеток к репрограммированию
Постоянное поддержание плюрипотентности в культуре без признаков старения вполне возможно требует постоянного эпигенетического репрограммирования стволовых клеток. То, что эти клетки имеют репрограммирующую активность, было показано в экспериментах по слиянию EG или ES-клеток с дифференцированными соматическими клетками (Tada et al., 1997, 2001; Cowan et al., 2005). Было установлено, что в тетраплоидных клеточных линиях, получившихся в результате слияния, соматический эпигенотип был репрограммирован (рис. 20.9). При слиянии EG и соматических клеток соматический геном утрачивал ДНК метилирование импринтных генов, а также других последовательностей в геноме (Tada et al., 1997). Напротив, при слиянии ES-клеток с соматическими ДНК метилирование импринтных генов сохранялось, но инактивированная X хромосома (в женских клетках) реактивировалась, промотор гена Oct4 становился ДНК деметилированным, что приводило к реэкспрессии Oct4 (Tada et al., 2001; Cowan et al., 2005; Surani, 2005). Рис. 20.8. Связь между развитием половых клеток и плюрипотентностью
Ооцит и зигота, а также клетки морулы до определенной стадии являются тотипотентными (ооцит имеет ограничения, налагаемые родительским импринтингом). Плюрипотентные клетки можно получить из клеток внутренней клеточной массы (ICM), примордиальных половых клеток (PGC) и сперматогониальных стволовых клеток (SS) новорожденных и взрослых семенников. Таким образом, существует тесная связь между половыми клетками в процессе развития и плюрипотентностью
Рис. 20.8. Связь между развитием половых клеток и плюрипотентностью
Ооцит и зигота, а также клетки морулы до определенной стадии являются тотипотентными (ооцит имеет ограничения, налагаемые родительским импринтингом). Плюрипотентные клетки можно получить из клеток внутренней клеточной массы (ICM), примордиальных половых клеток (PGC) и сперматогониальных стволовых клеток (SS) новорожденных и взрослых семенников. Таким образом, существует тесная связь между половыми клетками в процессе развития и плюрипотентностью
 Рис. 20.9. Плюрипотентные клетки обладают способностью репрограммировать соматические клетки ES- или EG-клетки могут сливаться с соматическими клетками с образованием тетраплоидных клеток. Это приводит к эпигенетическому репрограммированию соматических ядер, в которых происходят изменения, например, в 5шеС, H3ас, Н4ас и H3K4me. Тетраплоидные ядра в результате слияния и репрограммирования приобретают плюрипотентный фенотип: при инъекции в бластоцисты они вносят вклад в различные клеточные типы эмбриона
Рис. 20.9. Плюрипотентные клетки обладают способностью репрограммировать соматические клетки ES- или EG-клетки могут сливаться с соматическими клетками с образованием тетраплоидных клеток. Это приводит к эпигенетическому репрограммированию соматических ядер, в которых происходят изменения, например, в 5шеС, H3ас, Н4ас и H3K4me. Тетраплоидные ядра в результате слияния и репрограммирования приобретают плюрипотентный фенотип: при инъекции в бластоцисты они вносят вклад в различные клеточные типы эмбриона
Факторы репрограммирования, влияющие на ДНК метилирование и модификацию гистонов в этих гибридах, пока неизвестны. Например, неясно, требует ли деметилирование в EG или ES клетках активности ДНК деметилазы или репликация ДНК происходит в отсутствие Dnmtl, в результате чего происходит пассивное деметилирование. Тем не менее, ES- и EG-клетки должны рассматриваться как важный источник для выделения и характеристики эпигенетических факторов репрограммирования.
5. Перспективы
В ближайшие несколько лет мы станем свидетелями убедительных успехов в понимании генетических и эпигенетических факторов, которые определяют тотипотентность и плюрипотентность половых и стволовых клеток. Становятся доступными высокопроизводительные и чувствительные методы определения различных уровней эпигенетической информации. Будут идентифицированы факторы, которые регулируют эпигенетическую информацию, особенно те, которые требуются для репрограммирования эпигенетических меток в соматических клетках в те, которые обнаружены в плюрипотентных клетках. Необходимо также развивать методы селективного и безопасного манипулирования эпигенетического состояния in vivo. Плюрипотентные стволовые клетки представляют много удивительных возможностей как для фундаментальных исследований, так и для их потенциального применения в биомедицине. Что касается фундаментальных исследований, уникальностьплюрипотентного состояния дает возможность проникнуть в механизмы, которые регулируют решение клеточной судьбы. Способность дифференцироваться в разнообразные клеточные типы дает возможность создавать заместительные клетки для восстановления поврежденной ткани. Они могут быть также использованы для моделирования болезней, чтобы исследовать, как развиваются различные заболевания у человека, вызванные специфическими мутациями или эпимутациями (т. е., мутациями, вызванными изменениями ДНК метилирования или хроматиновых матриц без изменений последовательностей ДНК), что в свою очередь может способствовать развитию новых лекарств для лечения и даже предотвращения болезней. При использовании плюрипотентных стволовых клеток человека возникли критические этические проблемы, которые обсуждаются широкой общественностью. Очень важно установить адекватные этические рамки и правила использования стволовых клеток для исследований и биомедицинского применения, поскольку получение плюрипотентных стволовых клеток связано с использованием ранних эмбрионов. Более глубокое познание эпигенетических механизмов, которые регулируют плюрипотентность и репрограммирование генома, когда-нибудь позволят получать плюрипотентные стволовые клетки непосредственно из взрослых стволовых клеток и даже из дифференцированных клеток без использования эмбрионов[1] Это один из аспектов, когда успехи в понимании эпигенетических механизмов могут оказаться решающими для развития медицины в будущем.Благодарности
М.А.С. благодарит всех членов лаборатории, нынешних и в прошлом, за их работу, которая финансировалась Wellcome Trust, BBSRC, EU, DTI и CellCentric. B.P. благодарит всех своих коллег в лаборатории, особенно Wendy Dean, за их вклад в работу и идеи, обсуждаемые в этой главе. Работа в лаборатории В.Р. финансово поддерживалась BBSRC, MRC, EU, DTI и CellCentric.Литература
Amey K.L., Bao S., Bannister A.J., KouzaridesT., and Surani M.A., 2002. Histone methylation defines epigenetic asymmetry in the mouse zygote. Int. J. Dev. Biol. 46: 317–320. Avilion A.A., Nicolis S.K., Pevny L.H., Perez L., Vivian N., and Lovell-Badge R., 2003. Multipotent cell lineages in early mouse development depend on SOX2 function. Genes Dev. 17: 126-MO. Blackwell T.K., 2004. Germ cells: Finding programs of mass repression. Curr. Biol. 14: R229-230. Boyer L.A., Lee T.L., Cole M.F., Johnstone S.E., Levine S.S., Zucker J.P., Guenther M.G., Kumar R.M., Murray H.L., Jenner R.G., et al., 2005. Core transcriptional regulatory circuitry in human embryonic stem cells. Cell 122: 947–956. BuehrM., Nichols J., Stenhouse F., Mountford P., GreenhalghC.J., Kantachuvesiri S., BrookerG., Mullins J., and Smith A.G., 2003. Rapid loss of Oct-4 and pluripotency in cultured rodent blastocysts and derivative cell lines. Biol. Reprod. 68: 222–229. Carlson L.L., Page A.W., and Bestor T.H., 1992. Properties and localization of DNA methyltransferase in preimplantation mouse embryos: Implications for genomic imprinting. Genes Dev. 6: 2536–2541. Chambers L., Colby D., Robertson M., Nichols J., Lee S., Xweedie S., and Smith A., 2003. Functional expression cloning of Nanog, a pluripotency sustaining factor in embryonic stem cells. Cell 113: 643–655. Chang D.H., Cattoretti C., and Calame K.L., 2002. The dynamic expression pattern of B lymphocyte induced maturation protein-1 (Blimp-1) during mouse embryonic development. Mech. Dev. 117: 305–309. Chapman V., Forrester L., Sanford J., Hastie N., and Rossant J., 1984. Cell lineage-specific undermethylation of mouse repetitive DNA. Nature 307: 284–286. Chong S. and Whitelaw E., 2004. Epigenetic germline inheritance. Curr. Opin. Genet. Dev. 14: 692–696. Cowan C.A., Atienza J., Melton D.A., and Eggan K., 2005. Nuclear reprogramming of somatic cells after fusion with human embryonic stem cells. Science 309: 1369–1373. Dean W. and Ferguson-Smith A., 2001. Genomic imprinting: Mother maintains methylation marks. Curr. Biol. 11: R527-530. Dean W., Santos E., Stojkovic M., Zakhartchenko V., Walter J., Wolf E., and ReikW., 2001. Conservation of methylation reprogramming in mammalian development: Aberrant reprogramming in cloned embryos. Proc. Natl. Acad. Sci. 98: 13734-13738. Dean W., Bowden L., Aitchison A., Klose J., Moore X., Meneses J.J., Reik W., and Feil R., 1998. Altered imprinted gene methylation and expression in completely ES cell-derived mouse fetuses: Association with aberrant phenotypes. Development 125: 2273–2282. Deshpande G., Calhoun G., and Schedl R, 2004. Overlapping mechanisms function to establish transcriptional quiescence in the embryonic Drosophila germline. Development 131: 1247–1257. de Souza F.S., Gawantka V., Gomez A.P., Delius EL, Ang S.L., and Niehrs C., 1999. The zinc finger gene Xblimpl controls anterior endomesodermal cell fate in Spemann’s organizer. EMBO J. 18: 6062–6072. Dodge J.E., Kang Y.K., Beppu E.L., Lei E.L., and Li E., 2004. Histone H3-K9 methyltransferase ESET is essential for early development. Mol. Cell. Biol. 24: 2478–2486. Erhardt S., Su I.H., Schneider R., Barton S., Bannister A.J., Perez-Burgos L., Jenuwein T., Kouzarides X, Tarakhovsky A., and Surani M.A., 2003. Consequences of the depletion of zygotic and embryonic enhancer of zeste 2 during preimplantation mouse development. Development 130: 4235–4248. Evans M.J: and Kaufman M.H., 1981. Establishment in culture of pluripotential cells from mouse embryos. Nature 292: 154–156. Extavour C.G. and Akam M., 2003. Mechanisms of germ cell specification across the metazoans: Epigenesis and preformation. Development 130: 5869–5884. Feldman N.T., Gerson A., Fang J., Li E., Zhang Y., Shinkai Y., Cedar H., and Bergman Y., 2006. G9a-mediated irreversible epigenetic inactivation of Oct-3/4 during early embryogenesis. Nat. Cell. Biol. 8: 188–194. Fujimori T., Kurotaki Y., Miyazaki J., and Nabeshima Y., 2003. Analysis of cell lineage in two- and four-cell mouse embryos. Development 130: 5113–5122. Fujimoto A., Mitalipov S.M., Kuo H.C., and Wolf D.P., 2005. Aberrant genomic imprinting in rhesus monkey ES cells. Stem Cells 24: 595–603. Gardner R.L., 1985. Clonal analysis of early mammalian development. Philos. Trans. R. Soc. Land. B Biol. Sci. 312: 163–178. Gardner R.L., 1997. The early blastocyst is bilaterally symmetrical and its axis of symmetry is aligned with the animal-vegetal axis of the zygote in the mouse. Development 124: 289–301. Gehring M., Huh J.H., Hsieh T.F., Penterman J., Choi Y., Harada J.J., Goldberg R.B., and Fischer R.L., 2006. DEMETER DNA glycosylase establishes MEDEA polycomb gene self-imprinting by allele-specific demethylation. Cell 124: 495–506. GeijsenN., HoroschakM., KimK., Gribnau J., Eggan K., and Daley G.Q., 2004. Derivation of embryonic germ cells and male gametes from embryonic stem cells. Nature 427: 148–154. Guan K., Nayemia K., Maier L.S., Wagner S., Dressel R., Lee J.H., Nolte J., Wolf E., Li M., Engel W., and Hasenfuss G., 2006. Pluripotency of spermatogonial stem cells from adult mouse testis. Nature 440: 1199–1203. Gyory 1., Wu J., FejerG., Seto E., and Wright K.L., 2004. PRDI-BF1 recruits the histone H3 methyltransferase G9a in transcriptional silencing. Nat. Immunol. 5: 299–308. Hajkova P., Erhardt S., Lane N., HaafX., El-Maarri O., ReikW., Walter J., and Surani M.A., 2002. Epigenetic reprogramming in mouse primordial germ cells. Mech. Dev. 117: 15–23. Hayashi K., Yoshida K., and Matsui Y., 2005. A histone H3 methyltransferase controls epigenetic events required for meiotic prophase. Nature 438: 374–378. Heard E., 2004. Recent advances in X-chromosome inactivation. Curr. Opin. Cell Biol. 16: 247–255. Hemberger M., Nozaki T., Winterhager E., Yamamoto E.L., Nakagama H., Kamada N., Suzuki F.L., Ohta T., Ohki M., Masutani M., and Cross J.C., 2003. Parp1-deficiency induces differentiation of ES cells into trophoblast derivatives. Dev. Biol. 257: 371–381. Hernandez-Lagunas L., Choi I.F., Kaji T., Simpson P., Hershey C., Zhou Y., Zon L., Mercola M., and Artinger K. B., 2005. Zebrafish narrow-minded disrupts the transcription factor prdml and is required for neural crest and sensory neuron specification. Dev. Biol. 278: 347–357. Howell C.Y., Bestor T.H., Ding E., Latham K.E., Mertineit C., Trasler J.M., and Chaillet J.R., 2001. Genomic imprinting disrupted by a maternal effect mutation in the Dnmtl gene. Cell 104: 829–838. Howlett S.K. and ReikW., 1991. Methylation levels of maternal and paternal genomes during preimplantation development. Development 115: 119–127. Hubner K., Fuhrmann G., Chnstenson L.K., Kehler J., Reinbold R., De La Fuente R., Wood J., Strauss J.F., III, Boiani M., and Scholer H.R., 2003. Derivation of oocytes from mouse embryonic stem cells. Science 300: 1251–1256. Humpherys D., Eggan K., Akutsu P.L., Hochedlinger K., Rideout W.M., III, Biniszkiewicz D., Yanagimachi R., and Jaenisch R., 2001. Epigenetic instability in ES cells and cloned mice. Science 293: 95–97. Huynh J.R. and St Johnston D., 2004. The origin of asymmetry: Early polarisation of the Drosophila germline cyst and oocyte. Curr. Biol. 14: R438-449. Huynh K.D. and Lee J.T., 2003. Inheritance of a pre-inactivated paternal X chromosome in early mouse embryos. Nature 426: 857–862. Jackson M., Krassowska A., Gilbert N., Chevassut T., Forrester L., Ansell J., and Ramsahoye B., 2004. Severe global DNA hypomethylation blocks differentiation and induces histone hyperacety-lation in embryonic stem cells. Mol. Cell. Biol. 24: 8862–8871. Kanatsu-Shinohara M., Inoue K., Lee J., Yoshimoto M., Ogonuki N., Miki H., Baba S., Kato T., Kazuki Y., Toyokuni S., et al., 2004. Generation of pluripotent stem cells from neonatal mouse testis. Cell 119: 1001–1012. Kelly S.J., 1977. Studies of the developmental potential of 4- and 8-cell stage mouse blastomeres. J. Exp. Zool., 200: 365–376. Kimmins S. and Sassone-Corsi P., 2005. Chromatin remodelling and epigenetic features of germ cells. Nature 434: 583-589 KunathT., Amaud D., Uy G.D., Okamoto I., Chureau C., Yamanaka Y., Heard E., Gardner R.L., Avner P., and Rossant J., 2005. Imprinted X-inactivation in extra-embryonic endoderm cell lines from mouse blastocysts. Development 132: 1649–1661. Kuramochi-Miyagawa S., Kimura T.. Ijiri T.W., Isobe T., Asada N., Fujita Y., Ikawa M., Iwai N., Okabe M., Deng W., et al., 2004. Mill, a mammalian member of piwi family gene, is essential for spermatogenesis. Development 131: 839–849. Lane N., Dean W., Erhardt S., Hajkova P., Surani A., Walter J., and Reik W., 2003. Resistance of IAPs to methylation reprogramming may provide a mechanism for epigenetic inheritance in the mouse. Genesis 35: 88–93. Lawson K.A. and Hage W.J., 1994. Clonal analysis of the origin of primordial germ cells in the mouse. CIBA Found. Symp. 182: 68–84. Lawson K.A., DunnN.R., Roelen B.A., Zeinstra L.M., Davis A.M., Wright C.V., Korving J.R., and Hogan B.L., 1999. Bmp4 is required for the generation of primordial germ cells in the mouse embryo. Genes Dev. 13: 424–436. Leatherman J.L. and Jongens T.A., 2003. Transcriptional silencing and translational control: Key features of early germline development. Bioessays 25: 326–335. Lee J., Inoue K., Ono R., Ogonuki N., Kohda T., Kaneko-Ishino T., Ogura A., and Ishino F., 2002. Erasing genomic imprinting memory in mouse clone embryos produced from day 11.5 primordial germ cells. Development 129: 1807–1817. Lepikhov K. and Walter J., 2004. Differential dynamics of histone H3 methylation at positions K4 and K9 in the mouse zygote. BMC Dev. Biol. 4: 12. Loh Y.H., Wu Q., Chew J.L., Vega V.B., Zhang W., ChenX., Bourque G., George J., Leong B., Liu J., et al., 2006. The Oct4 and Nanog transcription network regulates pluripotency in mouse embryonic stem cells. Nat. Genet. 38: 431–440. Mak W., Nesterova T.B., de Napoles M., Appanah R., Yamanaka S.. Otte A. P., and Brockdorff N., 2004. Reactivation of the paternal X chromosome in early mouse embryos. Science 303: 666–669. Martin G.R., 1981. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarci-noma stem cells. Proc. Natl. Acad. Sci. 78: 7634–7638. Martinho R.G., Kunwar P.S., Casanova J., and Lehmann R., 2004. A noncoding RNA is required for the repression of RNApolII-dependent transcription in primordial germ cells. Curr. Biol. 14: 159–165. Matsui Y., Zsebo K., and Hogan B.L., 1992. Derivation of plurip0tential embryonic stem cells from murine primordial germ cells in culture. Cell 70, 841–847. Mayer W., Niveleau A., Walter J., Fundele R., and Haaf T., 2000. Demethylation of the zygotic paternal genome. Nature 403: 501–502. McLaren A., 2003. Primordial germ cells in the mouse. Dev. Biol. 262: 1-15. McLaren A. and Lawson K.A., 2005. How is the mouse germ-cell lineage established? Differentiation 73: 435–437. McLay D.W. and Clarke H.J., 2003. Remodelling the paternal chromatin at fertilization in mammals. Reproduction 125: 625–633. Meshorer E., Yellajoshula D.. George E., Scambjer P.J., Brown D.T., and Misteli T., 2006. Hyperdynamic plasticity of chromatin proteins in pluripotent embryonic stem cells. Dev. Cell. 10: 105–116. Mitsui K., Tokuzawa Y., Itoh H., Segawa K., Murakami M., Takahashi K., Maruyama M., Maeda M., and Yamanaka S., 2003. The homeoprotein Nanog is required for maintenance of pluripotency in mouse epiblast and ES cells. Cell 113: 631–642. Monk M., Boubelik M., and Lehnert S., 1987. Temporal and regional changes in DNA methylation in the embryonic, extraembryonic and germ cell lineages during mouse embryo development. Development 99: 371–382. Morgan H.D., DeanW., CokerH.A., ReikW., and Petersen-Mahrt S.K., 2004. Activation-induced cytidine deaminase deaminates 5-methylcytosine in DNA and is expressed in pluripotent tissues. Implications for epigenetic reprogramming. J. Biol. Chem. 279: 52353-52360. Morgan H.D., Santos E., Green K., Dean W., and ReikW., 2005. Epigenetic reprogramming in mammals. Hum. Mol. Genet. 14: R47-58 Nichols J., Zevnik B., Anastassiadis K., Niwa H., Klewe-Nebenius D., Chambers I., Scholer H., and Smith A., 1998. Formation of pluripotent stem cells in the mammalian embryo depends on the POU transcription factor Oct4. Cell 95: 379–391. Niwa H., Toyooka Y., Shimosato D., Strumpf D., Takahashi K., Yagi R., and Rossant J., 2005. Interaction between Oct3/4 and Cdx2 determines trophectoderm differentiation. Cell 123: 917–929. O’CarroU D., Erhardt S., Pagani M., Barton S.C., Surani M.A., and Jenuwein T., 2001. The polycomb-group gene Ezh2 is required for early mouse development Mol. Cell. Biol. 21: 4330–4336. OhinataY., Payer B., O’Carroll D., Ancelin K., Ono Y., Sano M., Barton S.C., ObukhanychT., Nussenzweig M., Tarakhovsky A., et al., 2005. Blimp 1 is a critical determinant of the germ cell lineage in mice. Nature 436: 207–213. Okamoto I., Otte A.P., Allis C.D., Reinberg D., and Heard E., 2004. Epigenetic dynamics of imprinted X inactivation during early mouse development. Science 303: 644–649. Okamoto I., Amaud D., Le Baccon P., Otte A.P., Disteche CM., Avner P., and Heard E., 2005. Evidence for de novo imprinted X-chromosome inactivation independent of meiotic inactivation in mice. Nature 438: 369–373. Olek A. and Walter J., 1997. The pre-implantation ontogeny of the H19 methylation imprint. Nat. Genet. 17: 275–276. Oswald J., Engemann S., Lane N., Mayer W., Olek A., Fundele R., Dean W., Reik W., and Walter J., 2000. Active demethylation of the paternal genome in the mouse zygote. Curr. Biol. 10: 475–478. Peters A.H., O’Carroll D., Scherthan H., Mechtler K., Sauer S., Schofer C., Weipoltshammer K., Pagani M., Lachner M., Kohlmaier A., et al., 2001. Loss of the Suv39h histone methyltransferases impairs mammalian heterochromatin and genome stability. Cell 107: 323–337. Piotrowska-Nitsche K., Perea-Gomez A., Haraguchi S., and Zernicka-Goetz M., 2005. Four-cell stage mouse blastomeres have different developmental properties. Development 132: 479–490. ReikW., Dean W., and Walter J., 2001. Epigenetic reprogramming in mammalian development. Science 293: 1089–1093. Ren B., Chee K.J., Kim T.H., and Maniatis T., 1999. PRD1-BF1/ Blimp-1 repression is mediated by corepressors of the Groucho family of proteins. Genes Dev. 13: 125–137. Resnick J.L., Bixler L.S., Cheng L., and Donovan P.J., 1992. Longterm proliferation of mouse primordial germ cells in culture. Nature 359: 550–551. Rossant J., 2001. Stem cells from the mammalian blastocyst. Stem Cells, 19: 477–482. Rougier N., Bourc’his D., Gomes D.M., Niveleau A., Plachot M., Paldi A., and Viegas-Pequignot E., 1998. Chromosome methylation patterns during mammalian preimplantation development. Genes Dev. 12: 2108–2113. Roy S. and Ng T., 2004. Blimp-1 specifies neural crest and sensory neuron progenitors in the zebrafish embryo. Curr. Biol. 14: 1772–1777. Saitou M., Barton S.C., and Surani M.A., 2002. A molecular program for the specification of germ cell fate in mice. Nature 418: 293–300. Saitou M., Payer B., Lange U.C., Erhardt S., Barton S.C, and Surani M.A., 2003. Specification of germ cell fate in mice. Philos. Trans. R. Soc. Lond. B Biol. Sci. 358: 1363–1370. Santos R., Hendrich B., Reik W., and Dean W., 2002. Dynamic reprogramming of DNA methylation in the early mouse embryo. Dev. Biol. 241: 172–182. Santos E., Peters A.H., Otte A.P., ReikW., and Dean W., 2005. Dynamic chromatin modifications characterise the first cell cycle in mouse embryos. Dev. Biol. 280: 225–236. Sarmento O.F., Digilio L.C., Wang Y., Perlin J., Herr J.C., Allis C.D., and Coonrod S.A., 2004. Dynamic alterations of specific histone modifications during early murine development. J. Cell Sci. 117: 4449–4459. Schaner C.E., Deshpande G., Schedl P.D., and Kelly W.G., 2003. A conserved chromatin architecture marks and maintains the restricted germ cell lineage in worms and flies. Dev. Cell 5: 747–757. Sciammas R. and Davis M.M., 2004. Modular nature of Blimp-1 in the regulation of gene expression during B cell maturation. J. Immunol. 172: 5427–5440. Seki Y., Hayashi K., Itoh K., Mizugaki M., Saitou M., and Matsui Y., 2005. Extensive and orderly reprogramming of genome-wide chromatin modifications associated with specification and early development of germ cells in mice. Dev. Biol. 278: 440–458. Seydoux G. and Dunn M.A., 1997. Transcriptionally repressed germ cells lack a subpopulation of phosphorylated RNA polymerase II in early embryos of Caenorhabditis elegans and Drosophila melanogaster. Development 124: 2191–2201. Seydoux G. and Strome S., 1999. Launching the germline in Caenorhabditis elegans: Regulation of gene expression in early germ cells. Development 126: 3275–3283. Shaffer A.L., Lin K.I., Kuo T.C., Yu X., Hurt E.M., Rosenwald A., Giltnane J.M., Yang L., Zhao H., Calame K., and Staudt L.M., 2002. Blimp-1 orchestrates plasma cell differentiation by extinguishing the mature B cell gene expression program. Immunity 17: 51–62. Shapiro-Shelef M., Lin K.I., McHeyzer-Williams L.J., Liao J., McHeyzer-Williams M.G., and Calame K., 2003. Blimp-1 is required for the formation of immunoglobulin secreting plasma cells and pre-plasma memory B cells. Immunity, 19: 607–620. Short R.V., 2000. Where do babies come from? Nature 403: 705. Smith A.G., 2001. Embryo-derived stem cells: Of mice and men. Annu. Rev. Cell Dev. Biol. 17: 435–462. Surani M.A., 2001. Reprogramming of genome function through epigenetic inheritance. Nature 414: 122–128. Surani M.A., 2005. Nuclear reprogramming by human embryonic stem cells. Cell 122: 653–654. Surani M.A., Ancelin K., Hajkova R, Lange U.C., Payer B., Western P., and Saitou M., 2004. Mechanism of mouse germ cell specification: A genetic program regulating epigenetic reprogramming. Cold Spring Harbor Symp. Quant. Biol. 69: 1–9. Tada M., TadaT., Lefebvre L., Barton S.C., and Surani M.A., 1997. Embryonic germ cells induce epigenetic reprogramming of somatic nucleus in hybrid cells. EMBO J. 16: 6510–6520. Tada M., Takahama Y., Abe K., Nakatsuji N., and Tada T., 2001. Nuclear reprogramming of somatic cells by in vitro hybridization with ES cells. Curr. Biol. 11: 1553–1558. Tada T., Tada M., Hilton K., Barton S.C., Sado T., Takagi N., and Surani M.A., 1998. Epigenotype switching of imprintable loci in embryonic germ cells. Dev. Genes Evol., 207: 551–561. Toyooka Y., Tsunekawa N., Akasu R., and Noce T., 2003. Embryonic stem cells can form germ cells in vitro. Proc. Natl. Acad. Sci. 100: 11457-11462. Turner C.A., Jr., Mack D.H., and Davis M.M., 1994. Blimp-1, a novel zinc finger-containing protein that can drive the maturation of B lymphocytes into immunoglobulin-secreting cells. Cell 77: 297–306. van der Heijden G.W., Dieker J.W., Derrick A.A., Muller S., Berden J.H., Braat D.D., van der Vlag J., and de Boer P., 2005. Asymmetry in histone H3 variants and lysine methylation between paternal and maternal chromatin of the early mouse zygote. Mech. Dev. 122: 1008–1022. Van Doren M., Williamson A.L., and Lehmann R., 1998. Regulation of zygotic gene expression in Drosophila primordial germ cells. Curr. Biol. 8: 243–246. Vincent S.D., Dunn N.R., Sciammas R., Shapiro-Shalef M., Davis M.M., Calame K., Bikoff E.K., and Robertson E.J., 2005. The zinc finger transcriptional repressor Blimp 1/Prdm1 is dispensable for early axis formation but is required for specification of primordial germ cells in the mouse. Development 132: 1315–1325. Waddington C., 1956. Principles of embryology Allen & Unwin, London, United Kingdom. Weber R.J., Pedersen R.A., Wianny E., Evans M.J., and Zemicka-Goetz M., 1999. Polarity of the mouse embryo is anticipated before implantation. Development 126: 5591–5598. Yamaguchi S., Kimura H., Tada M., Nakatsuji N., and TadaT., 2005. Nanog expression in mouse germ cell development. Gene Expr. Patterns 5: 639–646. Zhang E., Barboric M., Blackwell T.K., and Peterlin B.M., 2003. A model of repression: CTD analogs and PIE-1 inhibit transcriptional elongation by P-TEFb. Genes Dev. 17: 748–758.Глава 21. Эпигенетическое регулирование лимфоцитопоэза
 Meinrad Busslinger1 и Alexander Tarakhovsky2
1Research Institute of Molecular Pathology, Vienna Biocenter, A-1030 Vienna, Austria
2Laboratory of Lymphocyte Signaling, The Rockefeller University, New York, New York 10021
Meinrad Busslinger1 и Alexander Tarakhovsky2
1Research Institute of Molecular Pathology, Vienna Biocenter, A-1030 Vienna, Austria
2Laboratory of Lymphocyte Signaling, The Rockefeller University, New York, New York 10021
Общее резюме
Каждый иммунолог знает простую истину — для изучения любого загадочного биологического процесса нет лучшего объекта, чем лимфоциты. Этому правилу следуют эпигенетические механизмы, задействованные в регуляции клетки. Обычный предшественник лимфоцита на раннем этапе развития выбирает, стать («boring») В-клеткой или («terrific») Т-клеткой. Для тех, кто интересуется физиологией эпигенетики, развивающиеся лимфоциты предоставляют широкие возможности для наиболее четкого выделения дискретных стадий развития Благодаря высокой эффективности методов сортировки клеток, даже минимальная субпопуляция развивающихся и зрелых клеток может быть выделена в количестве, достаточном для наиболее требовательных технологий. Таким образом, лимфоциты дают возможность идентифицировать те гены и их регуляторы, которые принимают участие в перепрограммировании стволовых клеток в зрелые. Решающую роль в этом выборе играют транскрипционные факторы, но к ним быстро присоединяются «писатели» и «читатели» «кода модификации гистонов». В ходе развития В- и Т- клеток, каждый развивающийся лимфоцит должен продекларировать свою «социальную» идентичность, т. е. антигенную специфичность. Экспрессия рецептора какого-то уникального антигена развивающимися В- или Т-клетками крайне важна для их последующего отбора против опасных аутореактивных клеток, и она облегчает развитие клеток с четкими рецепторами, которые распознают неограниченное количество внешних антигенов. Для того чтобы достичь такой удивительной специфичности, каждая В-или Т-клетка проходит процесс рекомбинации гена иммуноглобулина или рецептора Т-клетки. Для того чтобы этот процесс стал возможным, локусы иммуноглобулина или рецепторов Т-клетки, охраняемые хроматином, становятся доступны механизму генной рекомбинации. Генные сегменты, разделенные количеством ДНК до 3 млн о., сближаются и лигируются, образуя уникальный ген рецептора антигенов. Процесс рекомбинации генов иммуноглобулина характеризуется всеми возможными особенностями, взывающими к ветеранам (истокам?) эпигенетики. Тот факт, что локусы иммуноглобулинов должны быть транскрибированы перед рекомбинацией, очевидным образом напоминает транскрипцию гена Xist, который индуцирует эпигенетические изменения, ведущие к инактивации Х-хромосомы. В поддержку этой точки зрения можно сказать, что метилтрансфераза гистонов Ezh2, участвующая в инактивации Х-хромосомы, также играет важную роль и в рекомбинации генов иммуноглобулинов. Для тех, кто увлечен малыми РНК, отметим, что развивающиеся В клетки обнаруживают двунаправленную транскрипцию в пределах локуса иммуноглобулина; таким образом появляется возможность вырабатывать дуплексы малых РНК, которые могут работать как направляющие РНК, маркируя хроматин метками, пермиссивными для рекомбинации. Однажды появившись, В- и Т-клетки должны оставаться живыми достаточно долго, чтобы получить уорхоловские 15 минут славы. В мире иммунных клеток это означает встречу с антигеном и ответ на него. Для достижения этой благородной цели В- и Т-клетки используют все возможные средства, от транскрипционных факторов до ферментов, модифицирующих гистоны. После активации антигеном В- и Т-клетки следуют очень различными путями. Активированные Т-клетки дифференцируются в эффекторные клетки, которые продуцируют набор цитокинов, в свою очередь либо помогающих другим иммунным клеткам выполнять свои функции, либо содействующих прямому поражению мишеней. В отличие от Т-клеток, которые сохраняют свою линейную идентичность до смерти, конечная цель В-клеток — потерять свою идентичность и стать источником высокоспецифичных растворимых антител, нейтрализующих патогены. Для достижения этой цели, активированные В-клетки вступают на путь оптимизации антител и гены иммуноглобулинов в них претерпевают мутации, повышающие сродство рецепторов к антигенам. Этот процесс выполняет индуцированная активацией дезаминаза (AID), но механизм, который нацеливает такой мощный «мутатор» на крошечный сегмент двухметровой геномной ДНК, неизвестен и, вероятнее всего, контролируется эпигенетически. В-клетки, которые экспрессируют высокоаффинные рецепторы антигенов, вступают в следующий раунд AID-зависимого удара по ДНК, результатом чего является переключение класса иммуноглобулинов и выработка антител других изотипов, обладающих другими возможностями защиты организма. Любопытные эпигенетики несомненно найдут, что в этой, так называемой, рекомбинации-переключателе класса иммуноглобулинов много такого, что напоминает явления, которые имеют место при элиминации ДНК у Tetrahymena, теломерном сайленсинге у дрожжей и инактивации Х-хромосомы у млекопитающих. Рано или поздно В-клетки, которые исчерпали возможность улучшение антител, встретят антиген. Это событие ведет к значительному перепрограммированию генома, что лишает В-клетки их идентичности и приводит к генерации плазматических клеток, продуцирующих антитела. Хотя транскрипционный контроль этого жизненно важного процесса хорошо известен, механизм массовой дедифференцировки В-клеток представляет большой интерес для тех, кто ищет способы по желанию изменять идентичность клетки. Трудно переоценить практическое значение изучения эпигенетических механизмов, лежащих в основе дифференцировки и функционирования лимфоцитов. При многих лимфоидных раках происходит избыточная экспрессия различных метилтрансфераз гистонов, и их таргетинг специфическими ингибиторами может помочь остановить рост и распространение раковых клеток. Имея обширные знания о факторах, контролирующих дифференцировку лимфоцитов из стволовых клеток, можно ожидать, что лимфоциты будут в числе первых клеток, которые будут перепрограммированы из стволовых клеток для терапевтических целей. Итак, волнения, связанные с наукой полезно для иммунитета, и эта важная истина делает эпигенетику лучшим иммуностимулятором.1. Введение
Тканеспецифичные стволовые клетки ответственны за развитие и регенерацию целых органов, таких как кожа, кишечник и кровеносная система, в течение всей жизни. Для этого стволовые клетки снабжены двумя уникальными свойствами. Во-первых, они обладают мощным потенциалом самообновления и поэтому могут воспроизводиться в своем некоммитированном состоянии. Во-вторых, они плюрипотентны и поэтому служат источником клеток всех типов данного органа путем дифференцировки в мультипотентные прогениторные клетки с постепенно сокращающимся потенциалом развития (рис. 21.1). Эти прогениторные клетки последовательно проходят коммитирование по одной из нескольких линий, а затем дифференцируются по выбранному пути в функционально специализированные типы клеток этого органа (рис. 21.1). То, каким образом линейное коммитирование мультипотентных прогениторов регулируется на молекулярном уровне, является важным вопросом биологии развития. Важную роль в этом процессе играют транскрипционные факторы, так как они способны к репрограммированию экспрессии больших групп генов. С этой целью они используют множественные механизмы активации или репрессии транскрипции генов в ответ на внеклеточные сигналы (рис. 21.2) (Fisher, 2002). Они могут косвенно влиять на программы экспрессии генов, противодействуя другим транскрипционным факторам через белок-белковые взаимодействия. Чаще транскрипционные факторы регулируют транскрипцию генов непосредственно, рекрутируя к регуляторным элементам ДНК коактиваторы или корепрессоры, обладающие активностью модификации гистонов или ремоделинга хроматина (рис. 21.2). Экспрессия генов определяется не только наличием совокупности транскрипционных факторов, но и хроматиновым контекстом, который отражает онтогенетическую предысторию клетки. В частности, на активность гена влияют локальный рисунок метилирования ДНК, ситуация с модификацией гистонов хроматина, позиция гена по отношению к репрессивным гетерохроматиновым доменам в ядре и архитектура локуса данного гена (рис. 21.2) (Fisher, 2002). Рис. 21.1. Схема развития органов из одной стволовой клетки
Развитие органа инициируется тканеспецифичными стволовыми клетками, которые обладают мощным потенциалом самообновления и являются плюрипотентными и дают начало всем типам клеток этого органа. Стволовые клетки сначала дифференцируются в мультипотентные прогениторы (известные также как переходные делящиеся клетки) с нарастающим ограничением потенциала развития. Эти прогениторы впоследствии претерпевают коммитирование в один из нескольких клонов и затем дифференцируются по выбранному пути в функционально специализированный тип клеток данного органа
Рис. 21.1. Схема развития органов из одной стволовой клетки
Развитие органа инициируется тканеспецифичными стволовыми клетками, которые обладают мощным потенциалом самообновления и являются плюрипотентными и дают начало всем типам клеток этого органа. Стволовые клетки сначала дифференцируются в мультипотентные прогениторы (известные также как переходные делящиеся клетки) с нарастающим ограничением потенциала развития. Эти прогениторы впоследствии претерпевают коммитирование в один из нескольких клонов и затем дифференцируются по выбранному пути в функционально специализированный тип клеток данного органа
Система гематопоэза, а особенно развитие лимфоцитов, хорошо подходит для изучения эпигенетических механизмов, контролирующих линейное коммитирование и дифференцировку, по следующим причинам. Линейная диаграмма гемопоэтической системы в значительной степени была прояснена по мере того, как были охарактеризованы различные стадии развития между гемопоэтической стволовой клеткой (ГСК) и различными зрелыми клетками крови разных типов (рис. 21.3) (Akashi et al, 2000; Busslinger, 2004). Как следствие, клетки на разных стадиях развития можно изолировать из гемопоэтических органов путем сортировки с помощью клеточного сортера с возбуждением флуоресценции (FACS), культивировать in vitro, исследовать на молекулярном уровне, модифицировать вирусными системами экспрессии и снова инъецировать мышам-реципиентам для выяснения функциональных последствий генетических манипуляций in vivo. Несмотря на то, что эпигенетические механизмы, лежащие в основе гемопоэтического развития, еще только начали изучать, большая часть наших знаний об эпигенетическом регулировании в настоящее время относится к В-лимфопоэзу.
 Рис. 21.2. Центральная роль транскрипционных факторов в эпигенетическом контроле генов
Транскрипционные факторы (TF), которые часто регулируются в ответ на внеклеточные сигналы, отвечают за активацию генов, транскрипционную репрессию, перемещение генов в пределах компартментов ядра и за архитектонику хроматина генного локуса. Транскрипционные факторы выполняют эти разнообразные функции посредством взаимодействия с коактиваторами (включая ацетилтрансферазы гистонов [HATs]), с корепрессорами (включая деацетилазы гистонов [HDACs]), с аппаратом ремоделинга хроматина и с белковыми комплексами Polycomb
Рис. 21.2. Центральная роль транскрипционных факторов в эпигенетическом контроле генов
Транскрипционные факторы (TF), которые часто регулируются в ответ на внеклеточные сигналы, отвечают за активацию генов, транскрипционную репрессию, перемещение генов в пределах компартментов ядра и за архитектонику хроматина генного локуса. Транскрипционные факторы выполняют эти разнообразные функции посредством взаимодействия с коактиваторами (включая ацетилтрансферазы гистонов [HATs]), с корепрессорами (включая деацетилазы гистонов [HDACs]), с аппаратом ремоделинга хроматина и с белковыми комплексами Polycomb
Развитие В-клеток может быть грубо разделено на три фазы, характеризуемые (1) входом прогениторов в линию при коммитировании В-клеток, (2) выработкой разнообразных рецепторов антигенов путем соматической рекомбинации (V(D)J) и (3) терминальной дифференцировкой зрелых В-клеток в секретирующие иммуноглобулин плазматические клетки (рис. 3). В этой главе мы обсуждаем эпигенетические механизмы, контролирующие эти три аспекта развития, которые выявили основные принципы с возможностью применения их и для других систем развития.
2. Коммитирование линий в раннем лимфопоэзе
2.1. Внеклеточные сигналы
Гемопоэтическое развитие инициируется в костном мозге взрослой мыши путем решения гемопоэтических стволовых клеток (HSCs) дифференцироваться в общие миелоидные прогениторы (CMP) (Akashi et al., 2000) или в лимфоид-праймированные мультипотентные прогениторы (LMPP) (Adolfsson et al., 2005). Клетки эритроидных типов возникают только из СМР, в то время как миелоидные клетки могут происходить как из СМР, так и из LMPP. Активация лимфоидных генов RAG1 или RAG2 в клетках LMPP характеризует появление самых ранних прогениторов лимфоцитов (ELP), которые дифференцируются в обычные лимфоидные прогениторы (CLP) с характерным для них В-, Т-, и NK-клеточным потенциалом развития (рис. 21.3) (Busslinger, 2004). Как внеклеточные сигналы, так и транскрипционные факторы существенны для дифференцировки HSCs в CLPs и в ранние прогениторы В-клеток (про-В-клетки) в костном мозге. Выработка лимфоидных прогениторов и В-лимфоцитов зависит от сигнала с рецепторов c-Kit, Flt3, и IL-7 (Waskow et al., 2002; Vosshenrich et al., 2003). В частности, мышь с двойным дефицитом по Flt3 и IL совершенно не может вырабатывать про-В клетки (Vosshenrich et al., 2003). Сигналы от Flt3 и IL-7R активируют близко родственные транскрипционные факторы Stat5a и Stat5b, которые, в свою очередь, облегчают дифференцировку лимфоидных прогениторов до стадии про-В-клеток (рис. 21.4) (Zhang et al, 2000; Kovanen и Leonard, 2004). Развитие В-клеток чем дальше, тем больше зависит от факторов транскрипции с доменами типа «цинковые пальцы», Ikaros, и Ets-домена белка PU.1, так как CLP с характерной для них экспрессией IL-7R отсутствуют в костном мозге мутантных мышей Ikaros и PU.I (рис. 21.4) (Ariman et al., 2003; Dakic et al., 2005).2.2. Транскрипционные факторы
Вступление лимфоидных прогениторов на путь В-клеток зависит от транскрипционного фактора Е2А (Tcfe2a) типа «спираль-петля-спираль», раннего фактора В-клеток EBF1 и от белка Рах5 (BSAP), имеющего парный (спаренный) домен (paired domain protein) (рис. 21.4). Е2Аи EBF1 координированно активируют экспрессию генов, специфичных для В-клеток, которые важны для выработки ранних про-В-клеток (Busslinger, 2004). Тем не менее, активация транскрипционной программы, специфичной для В-клеток, недостаточна для коммутирования ранних прогениторов к В-лимфоидной линии в отсутствие Рах5. В костном мозге гомозиготная мутация Рах5 останавливает развитие В-клеток на стадии ранней про-В-клетки (Nutt et al., 1997). Pax5-/ про-В-клетки сохраняют мощный потенциал самообновления и развития, характерный для некоммитированных лимфоидных прогениторов (Nutt et al., 1999). Интересно, что эктопическая экспрессия миелоидных факторов транскрипции эффективно индуцирует переключение линии с лимфоиднои на миелоидную дифференциацию в прогениторах Рах5-/-, показывая, что про-В-клетки Рах5-/- in vitro являются клонируемыми лимфоидными прогениторами с латентным потенциалом миелоидной дифференцировки (Busslinger, 2004). Важно, что восстановление экспрессии Рах5 подавляет этот мультилинейный потенциал про-В-клеток Рах5-/- одновременно стимулируя их развитие в зрелые В-клетки (Nutt et al., 1999). Эти эксперименты позволяют определить Рах5 как критичный фактор коммутирования В-линии, который ограничивает возможности развития лимфоидных прогениторов только путем развития В-клеток. Рис. 21.3. Схема развития В-клеток
Гематопоэтические стволовые клетки (HSC) дифференцируются через обозначенные стадии развития в секретирующие иммуноглобулин плазматические клетки: LMPP — лимфоид-праймированные мультипотентные прогениторы; СМР — общий миелоидный прогенитор; ELP — самые ранние прогениторы лимфоцитов: CLP — общий лимфоидный прогенитор. Части 1-111, указанные внизу рисунка, обозначают стадии лимфопоэтического развития, эпигенетические механизмы которых были исследованы и которые обсуждаются в этой главе
Рис. 21.3. Схема развития В-клеток
Гематопоэтические стволовые клетки (HSC) дифференцируются через обозначенные стадии развития в секретирующие иммуноглобулин плазматические клетки: LMPP — лимфоид-праймированные мультипотентные прогениторы; СМР — общий миелоидный прогенитор; ELP — самые ранние прогениторы лимфоцитов: CLP — общий лимфоидный прогенитор. Части 1-111, указанные внизу рисунка, обозначают стадии лимфопоэтического развития, эпигенетические механизмы которых были исследованы и которые обсуждаются в этой главе
 Рис. 21.4. Транскрипционный контроль раннего лимфопоэза
Прогениторы естественных киллеров (NK), линий В- и Т-клеток развиваются из гемопоэтических стволовых клеток (HSC) под контролем обозначенных факторов транскрипции. Детальное описание см. Bussinger (2004)
Рис. 21.4. Транскрипционный контроль раннего лимфопоэза
Прогениторы естественных киллеров (NK), линий В- и Т-клеток развиваются из гемопоэтических стволовых клеток (HSC) под контролем обозначенных факторов транскрипции. Детальное описание см. Bussinger (2004)
Некоммитированные гематопоэтические прогениторы беспорядочно экспрессируют гены с различными программами посредством процесса, который известен как «праймирование линии» (Miyamoto et al., 2002). В соответствии с этим открытием, про-В-клетки Рах5-/- экспрессируют не только гены, характерные для про-В-клеток, но и гены программ, специфичных для других линий (Nutt et al., 1999). При линейном коммитировани Рах5 выполняет двойную роль, активируя специфичные для В-клеток гены и одновременно подавляя гены, не подходящие для линии (рис. 21.5) (Nutt et al., 1999). Рах5 активирует несколько генов-мишеней, кодирующих существенные компоненты сигнального пути, связанного с рецептором пре-В-клеток (BCR), такие, как трансдуцирующая сигнал цепь Ig? (mb-1, Cd79a), стимулирующие корецепторы CD, 19 и CD1, а также центральный адаптерный белок BLNK (рис. 21.5) (Busslinger). Таким образом, функция трансактивации Рах5 облегчает передачу сигнала от pre-BCR и BCR, образуя важные контрольные точки в развитии В-клеток. С другой стороны, гены, репрессированные Рах5, кодируют избыток выделенных белков, молекулы клеточной адгезии, передатчики сигналов и белков ядра, которые экспрессируются в эритроидных, миелоидных и (или) Т-лимфоидных клетках (рис. 21.5) (Delogu et al., 2006). Среди них — гены Csflr (М-CSFR) и Notchl. что является хорошим примером того, как их Рах5-зависимая даун-регуляция делает коммутированные В-клетки больше не реагирующими на миелоидный цитокин M-CSF (Nutt et al., 1999) или на Notch лиганды, индуцирующие Т-клетки (Busslinger, 2004). Следовательно, репрессивная функция Рах5 содействует коммитированию В-клеток, прекращая работу ненужных сигнальных систем. Взаимодействуя с ко-репрессорами белкового семейсва Groucho, Pax5 может рекрутировать деацетилазы гистонов (HDACs) к регуляторным элементам, результатом чего является репрессия генов (Linderson et al., 2004).
 Рис. 21.5. Двойная роль Рах5 в развитии В-клеток
Рах5 активирует гены, специфичные для В-клеток, участвующие в (пре)ВСВ-сигналинге и подавляет неприемлемые для линии гены, необходимые для трансдукции сигнала в миелоидных (FcRy, Csfr) или Т-лимфоидных (Notchl, CD28, Grap2)
Рис. 21.5. Двойная роль Рах5 в развитии В-клеток
Рах5 активирует гены, специфичные для В-клеток, участвующие в (пре)ВСВ-сигналинге и подавляет неприемлемые для линии гены, необходимые для трансдукции сигнала в миелоидных (FcRy, Csfr) или Т-лимфоидных (Notchl, CD28, Grap2)
Е2А, EBF1 и их гены-мишени обычно экспрессируются в Pax-/- про-В-клетках, указывая, что Рах5 в развитии В-клеток функционирует «вниз по течению» от Е2А и EBFT1 (Nutt et al., 1997; Busslinger, 2004). Согласно этим наблюдениям, транскрипты Рах5 отсутствуют и в прогениторах E2A-/- или EBFI-- (Ikawa et al., 2004; Medina et al., 2004). Прогениторы E2A-/- экспрессируют EBF1 на низком уровне, в то время как Е2А нормально транскрибируются в прогениторах EBF1- (Medina et. al., 2004). Более того, ретровирусное восстановление экспрессии EBF1 в прогениторах Е2А-- активирует транскрипцию Рах5 и таким образом инициирует дифференцировку про-В-клеток (Seet et al., 2004). Отсюда следует, что эти три транскрипционных фактора стимулируют раннее развитие В-клеток в генетической иерархии E2A-EBF1-Pax5. Тем не менее, в пределах В-лимфоидной линии экспрессия EBFI поддерживается благодаря регуляции белком Рах5, основанной на обратной связи (рис. 21.4) (Horher et al., 2001; Fuxa et al., 2004).
2.3. Эпигенетический контроль экспрессии генов
В любой клетке многоклеточного эукариотного организма большая часть генов транскрипционно подавлена и избирательно активируется только в специфичных путях развития. Репрессия генов опосредуется многочисленными слоями эпигенетических механизмов, включая метилирование ДНК, модификации гистонов, позиционирование нуклеосом и структуру хроматина более высокого порядка (Smale, 2003). Первое проникновение в то, как снимается репрессия генов в начале развития В-клеток, было обеспечено анализом специфичного для В-клеток гена Cd79а (mb-1, Igw, Maier et al., 2004) Промотор гена Cd79a содержит функциональные узнающие последовательности для трех транскрипционных факторов Е2А, EBF1 и Рах5, в дополнение к Ets и Runx-связывающим сайтам (рис. 21.6) (Maier etal., 2004). Этот участок транскрипционного контроля метилирован по динуклеотидам CpG в HSCs, частично деметилирован в CLPs и полностью деметилирован в коммитированых про-В-клетках (Maier et al., 2004). Промотор Cd79a также полностью метилирован в прогениторах Е2А-/- или EBF1, но может быть деметилирован синергическим действием EBF1 и Runxl, что вместе с Рах5 ведет к транскрипционной активации гена mb-1 в коммитированныхпро-В-клетках (рис. 21.6) (Maieretal., 2004). Таким образом, в раннем развитии В-клеток EBF1 и, возможно. Е2А функционируют как «пионерские» факторы, инициируя эпигенетические изменения, необходимые для активации генов в процессе дифференцировки ранних прогениторов в коммитированные про-В-клетки. Несмотря на то, что изменения в модификации гистонов и структуре хроматина еще не были исследованы, вполне вероятно, что Е2А и Рах5 вносят вклад в локальное образование открытого ацетилированного хроматина путем их взаимодействия с комплексами ацетилтрансфераз гистонов (HAT) SAGA и p300/CBR (Massari et al., 1999; Bariev et al., 2003). Puc. 21.6. Эпигенетическая активация гена Cd79a в раннем лимфопоэзе
На схеме промотор Cd79a(mb-1, Iga) показан вместе с паттерном метилирования (me) CpG и последующим связыванием с различными факторами транскрипции в процессе перехода HSCs в коммитированные про-В-клетки (Maier et al., 2003)
Puc. 21.6. Эпигенетическая активация гена Cd79a в раннем лимфопоэзе
На схеме промотор Cd79a(mb-1, Iga) показан вместе с паттерном метилирования (me) CpG и последующим связыванием с различными факторами транскрипции в процессе перехода HSCs в коммитированные про-В-клетки (Maier et al., 2003)
3. Эпигенетический контроль разнообразия рецепторов антигенов
3.1. Регуляция перестроек генов рецепторов антигенов в процессе развития
Ведущий принцип в системе приобретенного иммунитета заключается в том, что каждый вновь образованный лимфоцит узнает уникальный антиген и что общее разнообразие лимфоцитов достаточно велико, чтобы нейтрализовать любой возможный антиген С этой целью, В- и Т-клетки экспрессируют специфичные для данной клеточной линии рецепторы антигенов, опосредующие зависимый от антител гуморальный или клеточный иммунитет. BCR состоит из тяжелой цепи иммуноглобулина (IgH) и легкой цепи (IgL) типа Ig? или Ig?. Т-клетки линии ??, составляющие у мыши и у человека большинство Т лимфоцитов, экспрессируют рецептор Т-клеток (TCR, T-cell receptor) — ?-полипептид, связанный с TCRa, тогда как функционально отличающиеся Т-клетки уб содержат на своей поверхности TCRy, спаренный с TCR5. Эти белки-рецепторы антигенов кодируются большими генными локусами, содержащими дискретные генные сегменты: V (variable), D (diversity) и J (joining), которые в процессе развития лимфоцита собираются посредством V(D)J-рекомбинации в функциональный ген. Многообразие генных сегментов D, J и особенно V, в сочетании с случайным характером их рекомбинации, отвечает за практически неограниченное разнообразие иммунного репертуара (Bassing et al., 2002). Механика V(D)J-рекомбинации на уровне ДНК довольно проста. Все V, D и J генные сегменты фланкированы рекомбинационными сигнальными последовательностями (RSSs), которые состоят из относительно консервативных гептамерных и нонамерных элементов, разделенных спэйсерами либо из 12, либо из 23 пар нуклеотидов. Лимфоид-спепифичные белки-рекомбиназы RAG1 и RAG2 при помощи белков группы высокой мобильности собирают 12 и 23 нуклеотидные RSSs в синаптический комплекс и затем производят двухцепочечные разрывы ДНК между RSSs и кодирующими сегментами. Эти разрывы ДНК впоследствии обрабатываются и вновь связываются вездесущими факторами репарации, относящимися к механизму негомологичного соединения концов с образованием кодирующих и сигнальных соединений (Bassing et al., 2002). Простота процесса V(D)J-рекомбинации на уровне матрицы ДНК выдвигает логистические проблемы в отношении сборки различных рецепторов антигенов, потому что белки RAG экспрессируются во всех незрелых В- и Т-лимфоцитах. Следовательно, должна иметь место строгая регуляция, чтобы ограничить доступ белков RAG только к специфичным подгруппам всех субстратов рекомбинации (Yancopoulos and Alt, 1985; Stan-hope-Bakeret al., 1996). V(D)J-рекомбинация строго контролируется специфичным для клеточной линии и стадии развития образом. В пределах В-лимфоидной линии локус IgH в про-В-клетках реорганизуется до рекомбинации генов Ig? and Ig? в пре-В-клетках, тогда как гены TCR? и TCR? перестраиваются, соответственно, в про-Т-и пре-Т-клетках. Более того, V(D)J-рекомбинация гена IgH осуществляется в определенном временном порядке с перестройками DH-JH, предшествующими Ун-01н-рекомбинации Перестройки локуса TCRp в ходе развития про-Т-клетки происходят в таком же порядке (D?-J? перед V?-DJ?). Таким образом, должны существовать контрольные механизмы, чтобы защитить все гены от опосредованного RAG-расщепления в ходе D-J-рекомбинации и облегчить перестройку лишь одного из сотни генов У во время y-DJ-рекомбинации Следовательно, процесс производства рецептора антигена полностью зависит от точной регуляции доступности RSSs для действия рекомбиназы RAG S. Успешная V-DJ-peкомбинация гена IgH или TCR? ведет к экспрессии белка Ig? или TCR? как части пре-BCR- или пре-TCR-комплекса, который работает как важная контрольная точка, чтобы ингибировать V-DJ-рекомбинацию второй DJ-реорганизованной аллели и стимулировать развитие пре-В или пре-Т-клеток, инициирующее перестройки в генах IgL или TCR?, соответственно. Наконец, экспрессия BCR или TCR, компетентных к сигналингу, полностью блокирует V(D)J-рекомбинацию с помощью транскрипционной репрессии генов RAG S в незрелых В- или Т-клетках (Jankovic et al., 2004). Сигналинг ауто реактивного BCR может, однако, возобновить перестройку гена легкой цепи иммуноглобулина, что приводит к производству BCR с новой антигенной специфичностью (редактирование рецептора; Jankovic et al., 2004). Более того, сигналинг цитокина IL-7 необходим для стимулирования рекомбинации гена TCR? в про-Т-клетках (Schlissel et al., 2000). Следовательно, V(D)J-рекомбинация контролируется не только изнутри (ядерными механизмами, специфичными к типу клеточной линии и стадии развития), но также и извне (сигналами, образуемыми на поверхности клетки). Ограничения V(D)J-рекомбинации, специфичные для данных стадии развития и локуса, в шачительной степени накладываются на эпигенетическом уровне (Krangel, 2003). В нелимфоидных клетках гены Ig и TCR присутствуют в недоступном хроматине, так как в клетках почек белки RAG, экспрессирующиеся экзогенно, без труда расщепляют субстраты рекомбинации, привнесенные с трансфецированной эписомой, но не эндогенные гены рецепторов антигена (Romanow et al., 2000). Более того, рекомбинантные белки RAG, добавленные к изолированным ядрам лимфоцитов, могут расщеплять только ген Ig или TCR, который активно подвергается V(D)J-рекомбинации на стадии развития, используемой для подготовки ядра (Stanhope-Baker et al., 1996). Следовательно, линейная специфичность и временное упорядочение перегруппировки генов вызывается последовательным открыванием локального хроматина, что делает специфичные RSSs доступными для V(D) J-рекомбиназы. Способность хроматина как защищать RSSs, так и управлять их расщеплением, предполагает существование «хроматинового кода», который маркирует сайты рекомбинации и (или) облегчает опосредованное RAG расщепление. Ацетилирование гистонов на лизиновых остатках является не только характерной чертой открытого хроматина, но также играет важную роль в определении доступности хроматина локусов Ig и TCR, так как оно разделяет домены рекомбинационно-компетентных сегментов генов (McMurry and Krangel, 2000; Chowdhury and Sen, 2001). Анализ состояния ацетилирования гистонов выявил ступенчатую активацию дискретных доменов хроматина в локусе IgH (Chowdhury and Sen, 2001). Перед рекомбинацией V(D)J первым гиперацетилируется геномный участок длиной 120 тыс. пар нуклеотидов, окружающий генные сегменты DH, JH и С. Вслед за этим перестройки DH-JH индуцируют ацетилирование гистонов и перестройки генов VH, проксимальных по отношению к DH (Chowdhury and Sen, 2001). Наконец, дистальный домен длиной 2 млн. пар нуклеотидов, содержащий большинство генов VH, оказывается активированным сигналом IL-7 (Chowdhury and Sen, 2001). Детальный анализ локуса TCRa/b в развивающихся Т-клетках также выявил полное перекрывание участков, характеризующихся гиперацетилированием гистона H3 и доступностью для рекомбиназы V(D)J (McMurry and Krangel, 2000). Следовательно, ацетилирование гистонов оказывается существеннойчастью паттерна модификации хроматина, который контролирует инициацию и (или) развитие рекомбинации (Krangel, 2003). Однако самого по себе ацетилирования недостаточно для того, чтобы облегчить рекомбинацию, поскольку ингибиторы деацетилаз гистонов имеют слабое влияние на рекомбинацию V(D)J in vivo (McBlane and Boyes, 2000). Более того, в про-В-клетках наблюдалось поражающее несоответствие между высоким уровнем ацетилирования гистона H3 и слабой рекомбинацией H3 (Hesslein et al., 2003; Suetal., 2003). Нормальные уровни ацетилирования гистонов в кластере генов VH, дистальных по отношению к DH, не поддерживают дистальную рекомбинацию VM-DJH в про-В-клетках без метилтрансферазы гистоновых лизинов (НКМТ) Ezh2, которая триметилирует гистон H3 по лизину 27 (H3K27me3) (Su et al., 2003). Тот факт, что более высокие уровни H3K27me3 ассоциируются с дистальными, а не проксимальными генами VH, предполагает домен-специфическую роль метилирования H3K27 в рекомбинации генов VH (Su et al., 2003). Избирательность регуляции, осуществляемой Ezh2 для локуса IgH, подчеркивается равной эффективностью рекомбинации гена TCRp у дикого типа и у дефицитных по Ezh2 про-Т-клеток (Su et al., 2005). Следовательно, дополнительные модификации хроматина, вероятно, участвуют в контроле V(D)J-рекомбинации проксимальных генов Vhb про-В-клетках и TCRp-перестроек в про-Т-клетках. Диметилирование гистона H3 по лизину 4 (H3K4me2) — это активная гистоновая метка, которая также коррелирует с доступным состоянием сегментов генов IgH и TCRft (Morshead et al., 2003). Напротив, диметилирование H3 по лизину 9 (H3K9me2) — это репрессивная хроматиновая метка, которая обнаруживает отрицательную корреляцию с V(D)J — рекомбинацией сегментов генов IgH и TCRp (Morshead et al., 2003). Важная роль H3K9me2 в подавлении рекомбинации была недавно продемонстрирована путем таргетинга H3K9 НКМТ G9a на PDp 1 — промотор зародышевой линии (минилокус TCRp), что предотвратило перестройки V(D)J посредством перевода локального хроматина в недоступное состояние (Osipovich et al., 2004). Паттерн модификации гистонов, облегчающий доступ V(D)J-рекомбиназе, должен быть установлен с помощью процессов, которые происходят в пределах локусов рецептора антигена до перестройки. Прежде чем картирование модификаций гистонов стало экспериментально осуществимым, уже было известно, что в зародышевой линии транскрипция короткой смысловой РНК с сегмента неперестроенного гена предшествует рекомбинации V(D)J (Yancopoulos and Alt, 1985). Возможная роль транскрипции в контролировании доступности локуса была в дальнейшем подтверждена рядом открытий, демонстрирующим, что энхансеры и промоторы, расположенные в пределах локусов рецептора антигена, необходимы для того, чтобы осуществилась рекомбинация V(D)J. Делеция эндогенных энхансеров и промоторов уменьшает или аннулирует рекомбинацию V(D) J локусов рецептора антигена, тогда как вставка дополнительных энхансеров, специфичных для линии, ведет к новому паттерну рекомбинации V(D)J (Bassing et al., 2002; Krangel, 2003). Многочисленные промоторы, ассоциированные с сегментами V, D и J, контролируют перестройки последовательностей, проксимальных по отношению к промотору, в пределах относительно коротких расстояний, тогда как энхансеры приводят в действие контроль над рекомбинацией V(D)J на больших расстояниях (Bassing et al., 2002; Krangel, 2003). Сборка на промоторе комплекса пре-инициации может локально разрушить нуклеосомы и таким образом облегчить доступ ферментам рекомбинации, даже в отсутствие изменений в модификации гистонов. Более вероятно, однако, что промоторы активно принимают участие в установлении хроматиновой структуры, разрешающей рекомбинацию, так как элонгирующий комплекс РНК-полимеразы 11 несет свою собственную гистоновую ацетилтрансферазу, которая может способствовать распространению ацетилирования гистонов вдоль транскрибируемых участков (Orphanides and Reinberg, 2000). Транскрипция генов также приводит к локальному обмену зависимого от репликации гистона H3 на замещающий его вариант H3.З, который предположительно поддерживает доступное состояние хроматина транскрибируемых участков (Chow et al., 2005; Mito et al., 2005). Как было упомянуто выше, каждый локус рецептора антигена содержит сотни RSSs, хотя лишь немногие из них будут расщеплены в индивидуальном лимфоците на определенной стадии развития. Таким образом, потенциально возможно, что вариации в последовательности нуклеотидов ДНК индивидуальных сайтов RSS также могут вносить свой вклад в эффективность их расшепления. Анализ искусственных субстратов V(D)J-рекомбинации в самом деле продемонстрировал, что встречающиеся в естественных условиях различия в элементах гептамера и нонамера RSS, так же как и в менее консервативном спэйсере и во фланкирующих кодирующих последовательностях, влияют на частоту рекомбинации и таким образом вносят свой вклад в дифференциальное использование конкретных — V, D и J-сегментов гена в первичном ассортименте рецептора антигена (Lee et al., 2003). В рамках модели «гистонового кода» избирательность расщепления должна определяться процессом, который транслировал бы уникальные свойства индивидуальных RSS или соседних последовательностей в специфический паттерн модификации гистонов, маркирующий сайт для растепления, осуществляемого RAG. Этот код может быть установлен с помощью антисмысловых транскриптов. Конечно, антисмысловая межгенная транскрипция по всему кластеру гена VH предваряет рекомбинацию VH-DJH локуса IgH в про-В-клетках (Bolland et al., 2004). Эти длинные антисмысловые транскрипты могут направлять ремоделинг хроматина таким образом, чтобы открыть большой домен гена VH перед рекомбинацией. В качестве альтернативы эти антисмысловые транскрипты могли бы сформировать двухцепочечные гибриды РНК с короткими смысловыми транскриптами VH зародышевой линии и затем быть подвергнутыми процессингу с помощью механизма РНК-интерференции, чтобы произвести микроРНК, которые рекрутируют HKMTs к сайтам рекомбинации (Bolland et al., 2004, см. о деталях аппарата RNAi в главе 8). В развитие этой гипотезы мы допускаем, что специфическая смысловая транскрипция определенного сайта RSS зародышевой линии может генерировать двухцепочечную РНК. которая могла бы «нацеливать» ферменты, модифицирующие гистоны, на эту, но не на все другие последовательности RSS. Если это будет подтверждено экспериментально, данный гипотетический механизм мог бы объяснить точность и избирательность расщепления индивидуальных сайтов RSS, осуществляемое RAG. Интересно, что недавно было показано, что белок RAG2 непосредственно взаимодействует с гистонами и может, таким образом, играть важную роль в считывании специфического паттерна модификации гистонов на индивидуальных последовательностях нуклеотидов RSS (West et al., 2005).3.2. Субъядерное перемещение генов иммуноглобулинов
Периферическое пространство ядра и перицентромерный гетерохроматин — это два главных репрессивных компартмента в ядре, которые важны для воспроизведения и для неактивного состояния генов в гематопоэтических клетках (Brown et al., 1997; Baxter et al., 2002). В зависимости от степени своей активности, гены перемещаются между этими репрессивными компартментами и центральными позициями в ядре, что облегчает транскрипцию генов. Интересно, что локусы IgHw Ig? «по умолчанию» расположены на периферии ядра во всех не-В клетках, включая некоммитированные лимфоидные прогениторы (Kosak et al., 2002). Таким образом, локус IgH заякорен через дистальные гены VH на периферии ядра и сориентирован проксимальным доменом IgH по направлению к центру ядра, что облегчает перестройки DH-JH в лимфоидных прогениторах (Fuxa et al., 2004). Начальный этап активации локуса IgH состоит из перемещения локусов IgH и Ig? с периферии ядра в более центральную позицию внутри ядра в начале развития В-клеток (Kosak et al., 2002). Эта субъядерная передислокация, по-видимому, облегчает открывание хроматина и транскрипцию, характерную для зародышевой линии, ведущих к проксимальным перестройкам VH-DJH. Косвенные доказательства предполагают, что EBF1 и Рах5 играют определенную роль в центральном перемешении локусов IgH и Ig?, соответственно (Fuxa et al., 2004; Sato et al., 2004). Хотя в про-В-клетках обе аллели локусов IgH и Ig? перемещаются в центральные позиции ядра (Kosak et al., 2002; Fuxa et al., 2004) совместно, эти две аллели ведут себя по-разному после успешной рекомбинации V(D)J в зрелых В-клетках (Skok et al., 2001). Вслед за активацией В-клеток продуктивно реорганизованные аллели Ig остаются расположенными вдали от центромерных кластеров, усиливая, таким образом, их экспрессию (Skok et al., 2001). В то же время нефункциональные аллели IgH и Ig? после активации В-клеток перемещены в центромерный хроматин и таким образом засайленсированы там. Интересно, что центромерное рекрутирование нефункциональных локусов IgH и Ig? происходит через дистальный участок их гена V, что предполагает, что те же самые последовательности ДНК участвуют в рекрутировании «молчащих» локусов Ig либо на периферию ядра, либо в центромерный гетерохроматин (Roldan et al., 2005).3.3. Сокращение локуса генов иммуноглобулина
Приблизительно 200 генов VH локуса IgH распространены по участку длиной более 2,4 миллионов пар нуклеотидов и могут быть разделены на 15 дистальных, центральных или проксимальных семейств генов VH в соответствии со сходством их последовательности и позицией относительно проксимальных сегментов DH. В не-В-лимфоидных клетках и лимфоидных прогениторах две аллели IgH присутствуют в удлиненной конформации на периферии ядра (Kosak et al., 2002). Напротив, в коммитированных про-В-клетках локус IgH подвергается сокращению, что сближает дистальные гены VH с перестроенным проксимальным доменом DJH, облегчая таким образом перестройки VH-DJH (рис. 21.7) (Kosak et al., 2002; Fuxa et al., 2004). Локус Ig? с его примерно 140 генами VK также растягивается по участку длиной более 3 млн. о. и, таким образом, является таким же большим, как локус IgH. Так же, как и ген IgH в про-В-клетках, локус Ig? подвергается сокращению в малых пре-В- и незрелых В-клетках, демонстрируя, что оба локуса Ig в перестраивающихся клетках находятся в состоянии сокращения (Roldan et al., 2005). Более того, анализ с помощью флуоресцентной гибридизации in situ (FISH) с зондами к дистальным, центральным и проксимальным генам показал, что выпетливание отдельных субдоменов Ig отвечает за протяженное сокращение локусов IgH и Ig? (рис. 21.7) (Roldan et al., 2005). Дистальные перестройки VH-DJH не имеют места в про-В-клетках Рах5! (Nutt et al., 1997), несмотря на тот факт, что в гиперацетилированном состоянии хроматина гены VH доступны на всем протяжении кластера генов VH, включая наиболее дистальное семейство VHJ558 (Hessleinetal., 2003). Отсутствие перестроек дистального VH — D J коррелирует с отсутствием сокращения локуса IgH (рис. 21.7), которое, однако, может быть восстановлено посредством экспрессии ретровирусного Рах5 в про-В-клетках Рах5-/- (Fuxa et al., 2004). Следовательно, Рах5 — это ключевой регулятор сокращения локуса IgH в про-В-клетках. Метилтрансфераза гистонов Ezh2 предположительно также участвует в сокращении локуса IgH, так как условная активация Ezh2 в HSCs приводит к редукции дистальных перестроек VH- DJH, несмотря на полную доступность хроматина дистальных генов VH в про-В-клетках, дефектных по Ezh2 (Su et al., 2003). Интересно, что между Рах5 and Ezh2 не имеется генетической связи, несмотря на сходный фенотип IgH-перестройки соответствующих мутантных про-В-клеток (Fuxa et al., 2004). Поэтому, возможно, что Рах5 функционирует как сиквенс-специфичный фактор «нацеливания», чтобы рекрутировать Ezh2-содержащий репрессивный комплекс Polycomb 2 (PRC2) к избранным участкам на локусе IgH. Возникающее метилирование локального хроматина в гистоне H3 на лизине 27 (H3K27me3) может привлекать комплекс PRC1, чтобы индуцировать сжатие хроматина целевых участков (Francis et al., 2004; обсуждается в главе 11), приводя, таким образом, к выпетливанию и к сокращению локуса IgH. В качестве альтернативы сокращение локуса может не зависеть от модификации гистонов в ядре, но предпочтительнее требует метилирования лизина сигнальных белков цитоплазматическим Ezh2-содержащим метилтрансферазным комплексом, про который известно, что он регулирует полимеризацию актина путем присоединения к фактору обмена GTP/GDP, Vavl, (Su et al., 2005).3.4. Контроль аллельного исключения в локусах IgH и Ig?
Аллельное исключение обеспечивает продуктивную перестройку только одной из двух аллелей Ig, что приводит в В-клетках к экспрессии одиночной молекулы антитела с уникальной антигенной специфичностью. Процесс аллельного исключения может быть разделен на два отдельных этапа. В течение фазы инициации одна из двух аллелей Ig выбирается посредством дифференциального эпигенетического маркирования, чтобы быть реорганизованной в первую очередь, что препятствует одновременной рекомбинации в двух аллелях. Экспрессия продуктивно реорганизованной аллели впоследствии предотвращает рекомбинацию во второй аллели посредством ингибирования по типу обратной связи, таким образом поддерживая аллельное исключение. Процесс аллельного исключения уже инициирован на ранних стадиях развития во время имплантации, когда две аллели гена рецептора антигена начинают асинхронно реплицироваться в каждой клетке. Отцовский или материнский ген Ig, который стохастически выбирается для ранней репликации посредством пока не известной хромосомной метки, почти всегда представляет собой ту первую аллель, которая претерпевает перестройки в незрелых В-лимфоцитах (Mostoslavsky et al., 2001). Вторая Vн-DJн-реорганизация локуса IgH является, таким образом, регулируемым этапом, так как DH-JH-рекомбинация осуществляется в обеих аллелях IgH в процессе развития про-В-клеток (Bassing et al., 2002). Однако пока так ничего и неизвестно про то, как эта аллель-специфичная эпигенетическая метка, установленная на ранних стадиях развития зародыша, транслируется в последовательную активацию Vн-DJн-рекомбинации на двух аллелях IgH. Успешная перестройка одной аллели IgH ведет к экспрессии на поверхности клеток белка Ig? как части рецептора пре-В-клетки. Этот рецептор функционирует как важная контрольная точка, чтобы просигналить относительно пролиферативной экспансии больших пре-В-клеток, индуцировать последующую дифференцировку в малые пре-В-клетки и поддержать аллельное исключение в аллели IgH, реорганизованной по типу DJH (Kitamura and Rajewsky, 1992; Bassing et al., 2002). Экспрессия белка RAG быстро утрачивается под воздействием сигнала пре-BCR (рис. 21.8), который останавливает всю дальнейшую рекомбинацию V(D)J и подготавливает почву для установки аллельного исключения в больших пре-В-клетках (Grawunder et al., 1995). Сигнал пре-BCR также ведет к деацетилированию гистонов и, таким образом, к пониженной доступности генов VH в малых пре-В-клетках, что может быть механизмом обратной связи, лежащим в основе аллельного исключения (Chowdhury and Sen, 2003). Однако более правдоподобный механизм осуществляется быстрой реверсией сокращения локуса IgH в ответ на сигнал пре-BCR, что физйчески отделяет гены VH от проксимального домена IgH (рис. 21.8), предотвращая, таким образом, перестройку типа VH-DJH на второй аллели IgH, реорганизованной по типу DTH (Roldan et al., 2005).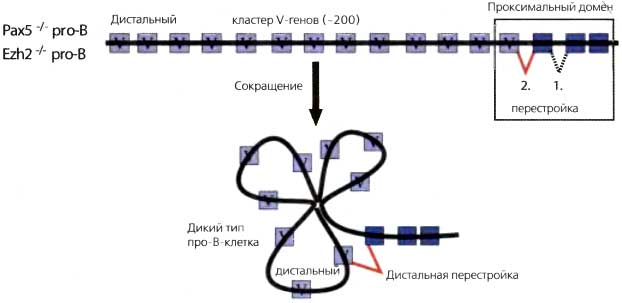 Рис. 21.7. Сокращение локуса тяжелой цепи иммуноглобулина в про-В-клетках
Локус IgH состоит из проксимального домена, содержащего следующие генные сегменты: разнообразия (diversity, D), соединительные (joining, J) и константные (constant, С), а также большой кластер вариабельных (variable, V) генов с ~200 генами V, расположенными на участке длиной более 2,4 млн. о. Локус IgH находится в растянутой конфигурации в про-В-клетках Pax5-/- или Ezh2-/-, что позволяет V(0)1-рекомбинации осуществиться только в проксимальном домене. В про-В-клетках дикого типа все гены VН участвуют в перестройках VН-DH благодаря сокращению локуса IgH путем выпетливания
Рис. 21.7. Сокращение локуса тяжелой цепи иммуноглобулина в про-В-клетках
Локус IgH состоит из проксимального домена, содержащего следующие генные сегменты: разнообразия (diversity, D), соединительные (joining, J) и константные (constant, С), а также большой кластер вариабельных (variable, V) генов с ~200 генами V, расположенными на участке длиной более 2,4 млн. о. Локус IgH находится в растянутой конфигурации в про-В-клетках Pax5-/- или Ezh2-/-, что позволяет V(0)1-рекомбинации осуществиться только в проксимальном домене. В про-В-клетках дикого типа все гены VН участвуют в перестройках VН-DH благодаря сокращению локуса IgH путем выпетливания
Более того, пре-BCR сигнал ведет к быстрому перемещению нефункционирующей аллели IgH к репрессивным центромерным доменам (Roldan et al., 2005). Следовательно, утрата сокращения локуса и центромерное рекрутирование изменяют реорганизованную по типу DJH аллель IgH во время образования свободного от RAG окна пре-В-сигнала таким образом, что она не может более подвергаться перестройкам типа VH-DJH после последующей реэкспрессии белков RAG в малых пре-В-клетках (рис. 21.8).
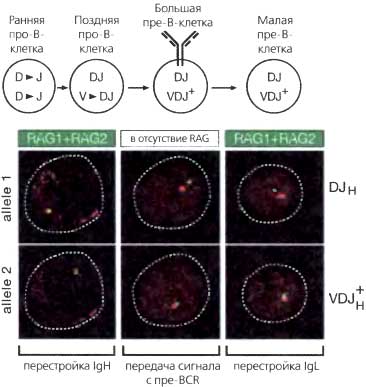 Рис. 21.8. Аллельное исключение путем устранения сокращения локуса IgH в пре-В-клетках
В ранних про-В-клетках реорганизации типа DH-JH происходят одновременно в обеих аллелях IgH, тогда как в поздних про-В-клетках только одна аллель в это время подвергается рекомбинации по типу VH-DJH. Ядра рассортированных про-В- и пре-В-клеток были проанализированы трехмерным DNA-FISH с флуоресцентными зондами из дистального (красный) и проксимального (зеленый) участков локуса IgH. Две аллели IgH одной и той же клетки показаны на двух репрезентативных конфокальных срезах. Пре-BCR сигнал приводит не только к быстрой потере белка RAG, но и к устранению сокращения локуса IgH. Хотя обе аллели не находятся в состоянии сокращения, локус IgH полностью растянут только в случае не окончательно DJH-перестроенной аллели. Эти два сигнала функционально перестроенной аллели (VDJ+) разделены более коротким расстоянием благодаря делеиии внедренной последовательности ДНК. Данные по FISH взяты из Roldan et al. (2005)
Инициация аллельного исключения в локусе Ig? изучалась, в значительной степени, посредством исследования паттерна метилирования ДНК с помощью рестрикционных ферментов, чувствительных к метилу (Mostoslavsky et al., 1998; Goldmit et al., 2002;, 2005), и, наряду с этим, посредством анализа гетерозиготных по репортеру ?°-GFP мышей, содержащих вставку гена GFP в элементе J?1 эндогенного локуса Ig? (Liang et al., 2004). Локус Ig? сильно метилирован в динуклеотидах CpG во всех не-В и про-В-клетках, но становится специфически деметилирован только на одной аллели в пре-В-клетках (рис. 21.9) (Mostoslavsky et al., 1998; Liang et al., 2004). Это моноаллельное деметилирование предваряет перестройку и зависит от активности как интронных, так и 3’ к — энхансеров (Mostoslavsky et al., 1998). Эта деметилированная аллель находится в доступном хроматине, так как он чувствителен к ДНКазе I, гиперацетилирован по гистонам H3 и Н4 и расположен в пре-В-клетках вдали от центромерного хроматина (рис. 21.9) (Goldmit et al., 2002, 2005). Как следствие, только неметилированная аллель Ig? инициирует транскрипцию зародышевой линии и перестройки типа V?-J? (Goldmit et al., 2002; Liang et al., 2004), тогда как в малых пре-В-клетках обе аллели подвергаются сокращению локуса (рис. 21.9) (Roldan et al., 2005). На удивление, в пре-В-клетках вторая аллель Ig? перемещается в центромерный гетерохроматин (Goldmit et al., 2005), аналогично локусу IgH (Roldan et al., 2005).
Это моноаллельное центромерное рекрутирование (рис. 21.9) может объяснить, почему для аллели с метилированной ДНК характерно пониженное ацетилирование гистонов и почему она связана с белками НР1у и Ikaros, которыми наряду с комлексами деацетилазы гистонов обогащен центромерный хроматин (Goldmit et al., 2005). Интересно, что именно поздно реплицирующаяся аллель Ig? перемещается в центромерные кластеры (Goldmit et al., 2005) в соответствии с тем, что паттерн асинхронной репликации, уже установленный на ранних стадиях развития эмбриона, коррелирует с моноаллельной инициацией перестроек Ig? в пре-В-клетках (Mostoslavsky et al., 2001). Удивительно, что только очень малая доля (5 %) всех пре-В-клеток подвергается активации локуса Ig? у мышей ?°-GFP (Liang et al., 2004).
Рис. 21.8. Аллельное исключение путем устранения сокращения локуса IgH в пре-В-клетках
В ранних про-В-клетках реорганизации типа DH-JH происходят одновременно в обеих аллелях IgH, тогда как в поздних про-В-клетках только одна аллель в это время подвергается рекомбинации по типу VH-DJH. Ядра рассортированных про-В- и пре-В-клеток были проанализированы трехмерным DNA-FISH с флуоресцентными зондами из дистального (красный) и проксимального (зеленый) участков локуса IgH. Две аллели IgH одной и той же клетки показаны на двух репрезентативных конфокальных срезах. Пре-BCR сигнал приводит не только к быстрой потере белка RAG, но и к устранению сокращения локуса IgH. Хотя обе аллели не находятся в состоянии сокращения, локус IgH полностью растянут только в случае не окончательно DJH-перестроенной аллели. Эти два сигнала функционально перестроенной аллели (VDJ+) разделены более коротким расстоянием благодаря делеиии внедренной последовательности ДНК. Данные по FISH взяты из Roldan et al. (2005)
Инициация аллельного исключения в локусе Ig? изучалась, в значительной степени, посредством исследования паттерна метилирования ДНК с помощью рестрикционных ферментов, чувствительных к метилу (Mostoslavsky et al., 1998; Goldmit et al., 2002;, 2005), и, наряду с этим, посредством анализа гетерозиготных по репортеру ?°-GFP мышей, содержащих вставку гена GFP в элементе J?1 эндогенного локуса Ig? (Liang et al., 2004). Локус Ig? сильно метилирован в динуклеотидах CpG во всех не-В и про-В-клетках, но становится специфически деметилирован только на одной аллели в пре-В-клетках (рис. 21.9) (Mostoslavsky et al., 1998; Liang et al., 2004). Это моноаллельное деметилирование предваряет перестройку и зависит от активности как интронных, так и 3’ к — энхансеров (Mostoslavsky et al., 1998). Эта деметилированная аллель находится в доступном хроматине, так как он чувствителен к ДНКазе I, гиперацетилирован по гистонам H3 и Н4 и расположен в пре-В-клетках вдали от центромерного хроматина (рис. 21.9) (Goldmit et al., 2002, 2005). Как следствие, только неметилированная аллель Ig? инициирует транскрипцию зародышевой линии и перестройки типа V?-J? (Goldmit et al., 2002; Liang et al., 2004), тогда как в малых пре-В-клетках обе аллели подвергаются сокращению локуса (рис. 21.9) (Roldan et al., 2005). На удивление, в пре-В-клетках вторая аллель Ig? перемещается в центромерный гетерохроматин (Goldmit et al., 2005), аналогично локусу IgH (Roldan et al., 2005).
Это моноаллельное центромерное рекрутирование (рис. 21.9) может объяснить, почему для аллели с метилированной ДНК характерно пониженное ацетилирование гистонов и почему она связана с белками НР1у и Ikaros, которыми наряду с комлексами деацетилазы гистонов обогащен центромерный хроматин (Goldmit et al., 2005). Интересно, что именно поздно реплицирующаяся аллель Ig? перемещается в центромерные кластеры (Goldmit et al., 2005) в соответствии с тем, что паттерн асинхронной репликации, уже установленный на ранних стадиях развития эмбриона, коррелирует с моноаллельной инициацией перестроек Ig? в пре-В-клетках (Mostoslavsky et al., 2001). Удивительно, что только очень малая доля (5 %) всех пре-В-клеток подвергается активации локуса Ig? у мышей ?°-GFP (Liang et al., 2004).
 Рис. 21.9. Механизмы, контролирующие аллельное исключение в локусе Ig?
В пре-В-клетках субъядерное перемещение, деметилирование ДНК и ацетилирование гистонов вносят свой вклад в выбор одной аллели Ig? для VK-JK-рекомбинации. Для детального объяснения см. текст. Обозначены: дистальный участок VK (красный) и проксимальный домен JK-CK (зеленый) локуса IgK, и их расположение относительно репрессивного компартментов на периферии ядра (серый) и центромерным хроматином (синий). У этих двух аллелей состояния сокращения локуса, метилирования ДНК (me) и ацетилирования гистонов (ас) схематично показаны для разных стадий развития, включая активированные зрелые В-клетки
Рис. 21.9. Механизмы, контролирующие аллельное исключение в локусе Ig?
В пре-В-клетках субъядерное перемещение, деметилирование ДНК и ацетилирование гистонов вносят свой вклад в выбор одной аллели Ig? для VK-JK-рекомбинации. Для детального объяснения см. текст. Обозначены: дистальный участок VK (красный) и проксимальный домен JK-CK (зеленый) локуса IgK, и их расположение относительно репрессивного компартментов на периферии ядра (серый) и центромерным хроматином (синий). У этих двух аллелей состояния сокращения локуса, метилирования ДНК (me) и ацетилирования гистонов (ас) схематично показаны для разных стадий развития, включая активированные зрелые В-клетки
На основании этого результата была выдвинута гипотеза, что в пре-В-клетках определенные транскрипционные факторы, присоединяющиеся к cis-регуляторным элементам локуса Ig?, присутствуют в лимитирующих количествах и что совместное присоединение таких факторов к энхансерам Ig? является редким событием, происходящим стохастически только в одной аллели. Следовательно, стохастическая активация энхансера посредством аллельной конкуренции за лимитирующие транскрипционные факторы может внести свой вклад в аллельное исключение в локусе Ig? (Liang et al., 2004). Успешная перестройка одной аллели Ig? ведет к экспрессии BCR на поверхности клетки, которая впоследствии поддерживает аллельное исключение во второй аллели Ig? посредством подавления экспрессии рекомбиназы RAG 1/2 (Jankovic et al.. 2004).
4. Конечная дифференцировка зрелых В-клеток
4.1. Дифференцировка плазматических клеток
Завершение рекомбинации V(D) J и экспрессия рецептора иммуноглобулина (Ig) на поверхности В-клетки маркируют конец антиген-независимой фазы В-лимфопоэза. Начиная с этой точки отсчета, судьба В-клеток начинает зависеть от сигнала рецептора, индуцированного антигеном (Rajewsky, 1996). В отсутствие антигена периферические В-клетки поддерживаются в покоящемся состоянии, где их выживание обеспечивается тонизирующими сигналами с BCR клеточной поверхности (Kraus et al., 2004). Сравнение организации хроматина в покоящихся и активированных В-клетках показывает, что покой В-клеток характеризуется низкими уровнями общего метилирования гистонов (Baxter et al., 2004). Относительно высокие уровни ацетилирования гистонов в покоящихся В-клетках остаются стабильными в процессе активации клеток (Baxter et al., 2004). Общее снижение метилирования лизинов гистонов, включая возможное отсутствие метилирования гистона H3K9, коррелирует с отсутствием других признаков конститутивного хроматина, таких как ассоциация Ikaros и связывание НР1 в покоящихся В-клетках (Baxter et al., 2004). Активация В-клеток восстанавливает метилирование гистонов, которое приводит к увеличению активной метки H3K4me3 на генах, требующихся для функционирования В-клетки (Рах5), и к одновременному повышению репрессивной модификации H3K9me2 на «молчащих» генах (Dntt) (Baxter et al., 2004). Реорганизация хроматина, индуцированная активацией, может поддерживать идентичность В-клетки в течение иммунного ответа. Однако геном В-клетки должен оставаться подверженным перепрограммированию, вызванному антигеном, так как активированные В-клетки после первой встречи с антигеном способны дифференцироваться прямо в плазматические клетки, продуцирующие антитела (Calame et al., 2003). Как альтернатива, антигенная стимуляция может инициировать реакцию зародышевого центра. В процессе этой реакции зрелые IgMlow IgDhlgh В-клетки включают свои иммуноглобулиновые изотипы и производят мутации в своих генах Ig с помощью цитидиндеаминазы, индуцированной активированием (AID; Honjo et al., 2004). Белки Ig, возникшие в результате этих процессов, идеально подходят для дифференцировки и поддержки В-клеток памяти, или для развития плазматических клеток, которые продуцируют антитела с высоким сродством к определенному антигену (Honjo et al., 2004). Время реакций зародышевого центра и превращение В-клеток в плазматические клетки регулируются двумя взаимоисключающими репрессорами транскрипции — Вс16 и Blimp 1 (рис. 21.10) (Turner et al., 1994; Ye et al., 1997). Bcl6 экспрессируется на низком уровне в зрелых наивных В-клетках, но быстро ап-регулируется в некоторых В-клетках после антигенной стимуляции (Fukuda et al., 1997). Клетки, которые не ап-регулируют Вс16, после встречи с антигеном дифференцируются в плазматические клетки, которые служат начальным источником антител с низкой аффинностью (Fukuda et aL, 1997). Наоборот, В-клетки, которые ап-регулируют Вс16, входят в реакцию зародышевого центра (Fukuda et al., 1997) и поддерживаются как В-клетки за счет Вс16-опосредованной репрессии генов, которые контролируют дифференцировку плазматических клеток (Shaffer et al., 2000). Одной из ключевых мишеней Вс16 является ген Prdm1, кодирующий транскрипционный фактор Blimp1 (рис. 21.10). Интересно, что, оказывается, Рах5 помогает Вс16 в репрессии гена Blimp1 (Prdm1) (рис. 21.10) (Delogu et al., 2006). Однако, начав однажды экспрессироваться, Blimp 1 аннулирует транскрипционную программу В-клеток, включая экспрессию Вс16 и Рах5, и одновременно вызывает транскрипцию генов, специфичных для плазматических клеток (Shaffer et al., 2002; Calame et al., 2003). Bcl6 и Blimp 1 используют широкий арсенал репрессивных механизмов для инактивации транскрипции генов. Один характерный аспект Вс16 — это использование ацетилирования лизина за рамками модификации гистонов, чтобы контролировать репрессию генов (Bereshchenko et al., 2002). Вс16 взаимодействует с МТАЗ, субъединицей корепрессорного комплекса Mi-2/NuRD, который в высокой степени экспрессируется в В-клетках зародышевого центра (Fujita et al., 2004). Ассоциация Вс16 с комплексом Mi-2/ NuRD, содержащим МТАЗ, необходима для репрессии гена, так как истощение МТАЗ, опосредованное RNAi, ведет к реактивации репрессированных Вс16 генов-мишеней в В-клетках (Fujita et al., 2004). Функция репрессии комплекса Вс16/МТАЗ/ Mi-2/NuRD зависит от статуса ацетилирования остатков лизина как в Вс16, так и в гистонах, связанных с локусом репрессированного гена. Для осуществления взаимодействия центрального домена Вс16 с МТАЗ он должен быть деацетилирован, тогда как репрессия гена посредством комплекса МТАЗ/ Mi-2/NuRD зависит от деацетилаз гистонов HDAC1 и HDAC2 класса I (Fujita et al., 2004). Рис. 21.10. Транскрипционная репрессия определяет судьбу В-клеток зародышевого центра и плазматических клеток
Рах5 и Вс16 (вместе с МТАЗ) регулируют программу экспрессии генов В-клеток и поддерживают судьбу В-клеток зародышевого центра (GC) посредством транскрипционной репрессии Blimp 1 — регулятора плазматических клеток. Сильный сигнал BCR в конце развития В-клеток GC ведет к деградации белка Вс16 и сопровождающей ее экспрессии Blimp 1, которая впоследствии репрессирует Вс16 и Рах5 и вместе с ХВР1 индуцирует программу транскрипции, характерную для плазматических клеток. Наиболее вероятно, что Blimp1 активирует экспрессию ХВР1 косвенно как часть реакции на развернутый белок, посредством индукции экспрессии секретируемых иммуноглобулинов. Детальное описание см. в тексте
Рис. 21.10. Транскрипционная репрессия определяет судьбу В-клеток зародышевого центра и плазматических клеток
Рах5 и Вс16 (вместе с МТАЗ) регулируют программу экспрессии генов В-клеток и поддерживают судьбу В-клеток зародышевого центра (GC) посредством транскрипционной репрессии Blimp 1 — регулятора плазматических клеток. Сильный сигнал BCR в конце развития В-клеток GC ведет к деградации белка Вс16 и сопровождающей ее экспрессии Blimp 1, которая впоследствии репрессирует Вс16 и Рах5 и вместе с ХВР1 индуцирует программу транскрипции, характерную для плазматических клеток. Наиболее вероятно, что Blimp1 активирует экспрессию ХВР1 косвенно как часть реакции на развернутый белок, посредством индукции экспрессии секретируемых иммуноглобулинов. Детальное описание см. в тексте
Вс16 далее связывается через свой амино-концевой домен POZ с тремя корепрессорами SMRT, NCoR и BCoR взаимоисключающим образом (Huynh and Bardwell, 1998; Huynh et al., 2000). Эти три корепрессора, которые дополнительно взаимодействуют с ферментом класса II — HDAC3 (Huynh et al., 2000), могут усиливать репрессию, опосредованную МТАЗ, тех же генов, служащих мишенями для Вс16, или сайленсировать другой набор генов в В-клетках зародышевого центра. Антигенная стимуляция высокоаффинных рецепторов Ig на В-клетках зародышевого центра сопровождается редукцией уровня белка Вс16. Активация рецептора, таким образом, ведет к фосфорилированию Вс16, индуцированному МАР-киназой, которое включает быструю деградацию белка Вс16 по убиквитин-протеосомному пути (Niu et al., 1998). Падение уровня Вс16 смягчает репрессию гена Prdm1l, что приводит к увеличению экспрессии белка Blimp 1 и последующему развитию в плазматические клетки (рис. 21.10) (Shaffer et al., 2000; Calame et al., 2003). Blimp 1 контролирует множество аспектов дифференцировки плазматических клеток. Во-первых, Blimp 1 нацеливает глубинную транскрипционную программу дифференцировки В-клеток с помощью репрессирующего Рах5 (рис. 10) (Shaffer et al., 2002), который необходим для поддержания функции и идентичности В-клеток (Horcher et al., 2001; Mikkola et al., 2002). Во-вторых, с помощью даун-регуляции экспрессии других транскрипционных факторов (таких как Spi-B, EBF1, СИТА, Id3, Oct2, и OBF1) Blimp 1 косвенно заканчивает транскрипцию генов, которые кодируют белки, необходимые для сигналинга с рецептора антигена и для презентации антигена (Shaffer et al., 2002). В-третьих, чтобы обеспечить покоящееся состояние плазматических клеток, Blimp 1 напрямую репрессирует транскрипцию с-тус (Shaffer et al., 2002). В-четвертых, гены, несоответствующие линии, зарепрессированные в В-клетках при помоши Рах5, реактивируются после того, как в плазматических клетках произошла опосредованная Blimp 1 даун-регуляция экспрессии Рах5 (Delogu et al.,2006). Следовательно, подавляя остальные репрессоры, Blimp 1 может косвенно активировать экспрессию дополнительных генов с важными для плазматических клеток функциями. В-пятых, Blimp1 необходим для экспрессии секретируемых иммуноглобулинов (Calame et al., 2003), которые накапливаются в эндоплазматическом ретикулуме, активируя тем самым экспрессию ХВР1, как часть реакции на развернутый белок. Транскрипционный фактор ХВР1 регулирует секрецию антител, и, таким образом, он важен для дифференцировки плазматических клеток (Reimold et al., 2001; Shaffer et al., 2004). Интересно, что Blimp 1 также является ключевым детерминантом спецификации примордиальных зародышевых клеток на ранних стадиях эмбриогенеза, как это обсуждается в главе 20. Механизм Blimp 1-опосредованной репрессии в развивающихся примордиальных зародышевых и плазматических клетках в основном неясен. Похоже, однако, что Blimp 1 использует в плазматических клетках те же принципы репрессии, что и в фибробластах, где PRDI-BF1, человеческий ортолог мышиного Blimp 1, участвует в постиндукционной репрессии гена p-интерферона (IFNB1) во время вирусной инфекции (Keller and Maniatis, 1991). Несколько механизмов отвечают за репрессию гена IFNB1, опосредованную PRDI-BF1. Присоединение PRDI-BF1 способно переместить активаторы транскрипции с промотора IFNB1(Keller and Maniatis, 1991). Кроме того, PRDI-BF1 взаимодействует с корепрессорами белкового семейства Groucho, которое использует деацетилазы гистонов как часть своего репрессионного механизма (Ren et al., 1999). Дальнейший сайленсинг достигается через ассоциацию PRDI-BF1 с белком G9a (Gyory et al., 2004), который принадлежит подсемейству метилтрансфераз гистонов со специфичностью к лизину 9 гистона H3 (Tachibana et al., 2002). В отличие от Suv39hl, который использует H3K9me3 для построения транскипционно репрессивной среды в центромерном гетерохроматине (Peters et al., 2001), G9a вносит свой вклад в H3K9me2 и генный сайленсинг в эухроматиновых участках (Tachibana et al., 2002). Каталитическая активность G9a требуется для подавления функции PRDI-BF1, так как каталитически неактивный белок G9a аннулирует ингибирующее влияние PRDI-BF1 на транскрипцию IFNB1 (Gyory et al., 2004). Далее делеция домена, взаимодействующего с G9a, предотвращает метилирование H3K9 и транскрипционный сайленсинг посредством PRDI-BF1 (Gyory et al., 2004). В свете этих данных вероятно, что метилирование гистонов, опосредованное G9a, является необходимым механизмом, с помощью которого Blimp 1 генерирует стабильный паттерн экспрессии генов в плазматических клетках. Интересно, что белок Blimp 1 также содержит домен SET подсемейства PR (RIZ). Предположили, что домен SET родственного белка RIZ1 (Prdm2) участвует в супрессии опухоли и метилировании гистона H3 по лизину 9 (Kim et al., 2003). Следовательно, остается проверить, вносит ли также домен SET белка Blimp 1 свой вклад в репрессию гена в процессе дифференцировки плазматических клеток.
4.2. Пластичность зрелых В-клеток в процессе развития
Возникновение плазматических клеток обычно считается конечной стадией развития В-клетки, так как экспрессия генов иммуноглобулина — это необходимая функция как В-клеток, так и плазматических клеток. Интересно, что в клетках обоих типов гены иммуноглобулина экспрессируются под комбинированным контролем убиквитных, а не В-лимфоидных транскрипционных факторов. Однако, помимо генов иммуноглобулина, В-клетки и плазматические клетки радикально различаются по своим паттернам генной экспрессии (Shaffer et al., 2002, 2004). Что касается функции Рах5, плазматические клетки даже как бы дают «задний ход», так как специфический для плазматических клеток сайленсинг экспрессии Рах5 ведет к реактивации генов, нехарактерных для В-линии, которые в норме репрессированы при помощи Рах5 в начале развития В-клеток (Delogu et al., 2006). Эти данные по генной экспрессии поддерживают, таким образом, альтернативный взгляд, что дифференцировка В-клеток, простимулированных антигеном, в плазматические клетки — это действительно «линейный» переключатель. Эта гипотеза предсказывает, что потенциал развития зрелой В-клетки не должен быть ограничен судьбой В-лимфоцита, но должен быть более пластичным, что подтверждается следующими данными. Эктопическая экспрессия транскрипционного фактора Вс16 В-клетки и его корепрессора МТАЗ в установившихся линиях плазматических клеток ведет к репрессии генов, специфических для плазматических клеток, в том числе регуляторных генов Blimp1 и ХВР1 (Fujita et al., 2004). В то же время реактивируются множественные гены, специфичные для В-клеток, включая гены-мишени для Рах5 (СИТА and BLNK). и сам ген Рах5(Fujita et al., 2004). Следовательно, белка Вс16 и его партнера — белка МТАЗ достаточно, чтобы перепрограммировать плазматические клетки в клетки с судьбой В-клеток, по меньшей мере в проанализированных условиях культивирования in vitro (рис. 21.11). Транскрипционный фактор С/Е В Ра, который необходим для развития гранулоцитов, экспрессируется исключительно в миелоидных прогениторах и их дифференцированных потомках (Akashi et al., 2000). Принудительная экспрессия С/ЕВРа в В-лимфоцитах из костного мозга или селезенки ведет к эффективной трансдифференцировке инфицированных В-клеток в функциональные макрофаги в течение 5 дней (Xie et al., 2004). Таким образом, С/ЕВРа активирует миелоидную генную программу и параллельно репрессирует гены, специфичные для В-клеток, интерферируя с транскрипционной активностью Рах5 (Xie et al., 2004). Следовательно, потеря функции Рах5, по-видимому, облегчает превращение В-клеток, присущее миелоидной клеточной линии в ответ на эктопическую экспрессию С/ЕВРа (рис. 21.11). Условная инактивация гена однозначно указывает на решающую роль Рах5 в контроле идентичности В-клеток в процессе В-лимфопоэза. Cre-опосредованная генная делеция в коммитированных про-В-клетках показывает, что Рах5 необходим не только для того, чтобы инициировать свою В-лимфоидную программу транскрипции, но и для поддержания ее на ранних этапах развития В-клетки (Mikkola et al., 2002). Как следствие инактивации Рах5, ранее коммитированые про-В-клетки восстанавливают способность дифференцироваться в макрофаги in vitro и возрождать развитие Т-клеток in vivo (рис. 21.11) (Mikkola et al., 2002). Условная) делеция Рах5 в зрелых В-клетках также ведет к утрате Рах5-зависимой программы экспрессии гена (Horcher et al., 2001; Delogu et al., 2006). Однако более удивительно то, что зрелые В-клетки с делецией Рах5 все время ретродифференцируются in vivo в мутантные по Рах5 прогениторы после того, как их инъецируют в мышей, дефектных по RAG2. Эти мутантные по Рах5 прогениторы возвращаются в костный мозг, из которого они заселяют тимус и полностью восстанавливают развитие Т-клеток в RAG2-дефицитном хозяине (рис. 21.11) Рис. 21.11. Пластичность В-лимфоцитов на разных этапах развития
Эктопическая экспрессия Вс16 и МТАЗ в установившихся линиях клеток плазмы сайленсирует транскрипцию генов, специфических для плазматических клеток, и одновременно реактивирует программу экспрессии В-клеток (оранжевая стрелка) (Fujita et al., 2004). CD19+ В лимфоциты, которые не были далее охарактеризованы относительно их стадии развития, подвергаются стремительной трансдифференцировке в макрофаги in vitro в ответ на принудительную экспрессию С/ЕВРа (красная стрелка) (Xie et al., 2004). Условная делеция Рах5 позволяет коммитированным про-В-клеткам и даже зрелым В-клеткам ретродифференцироваться in vivo в некоммитированные прогениторы, которые затем развиваются в остальные типы гематопоэтических клеток в костном мозге или в Т-клетки в тимусе (черные стрелки) (Mikkola et al., 2002; С. Cobaleda и М. Busslinger, неопубликованные данные). Синий цвет означает экспрессию Рах5 во время развития В-клетки
Рис. 21.11. Пластичность В-лимфоцитов на разных этапах развития
Эктопическая экспрессия Вс16 и МТАЗ в установившихся линиях клеток плазмы сайленсирует транскрипцию генов, специфических для плазматических клеток, и одновременно реактивирует программу экспрессии В-клеток (оранжевая стрелка) (Fujita et al., 2004). CD19+ В лимфоциты, которые не были далее охарактеризованы относительно их стадии развития, подвергаются стремительной трансдифференцировке в макрофаги in vitro в ответ на принудительную экспрессию С/ЕВРа (красная стрелка) (Xie et al., 2004). Условная делеция Рах5 позволяет коммитированным про-В-клеткам и даже зрелым В-клеткам ретродифференцироваться in vivo в некоммитированные прогениторы, которые затем развиваются в остальные типы гематопоэтических клеток в костном мозге или в Т-клетки в тимусе (черные стрелки) (Mikkola et al., 2002; С. Cobaleda и М. Busslinger, неопубликованные данные). Синий цвет означает экспрессию Рах5 во время развития В-клетки
Тот факт, что соответствующие дважды-позитивные тимоциты CD4+CD8+ несут IgH и Ig? и перестройки TCRa and TCRfi, однозначно демонстрирует, что зрелые В-клетки после потери Рах5 могут быть превращены в Т-клетки через ретродифференцировку в стадию некоммитированной клетки-прогенитора (С. Cobaleda and М. Busslinger, неопубл.). Следовательно, экспрессия Рах5 постоянно требуется для поддержания идентичности В-лимфоцитов от стадии про-В-клетки до стадии зрелой В-клетки. На основании анализа других систем развития у мух и позвоночных животных, предполагается, что транскрипционные факторы инициируют «решение» о той или иной судьбе клетки посредством изменения паттернов экспрессии генов, тогда как транскрипционное состояние коммитированных клеток впоследствии поддерживается эпигенетическими факторами, кодируемыми группами генов Polycomb и Trithorax (Ringrose and Раю, 2004; обсуждается подробнее в главах 11 и 12). Постоянная потребность в транскрипционном факторе Рах5 могла бы свидетельствовать против важной роли этих систем эпигенетической памяти в развитии В-клеток. Однако более вероятно, что Рах5 может поддерживать идентичность В-клеток, выступая ключевым фактором рекрутирования, чтобы нацелить белковые комплексы Polycomb или Trithorax на регуляторные элементы генов.
5. Заключительные замечания
Резюмируя вышеизложенное, заметим, что в регуляции и направлении развития лимфоцита участвуют разнообразные эпигенетические механизмы. Из всех различных эпигенетических регуляторов мы в настоящее время больше всего знаем о роли транскрипционных факторов, которые контролируют общие паттерны генной экспрессии, рекрутируя модифицирующие хроматин активности (такие, как ацетилтрансферазы гистонов или деацетилазы гистонов) к регуляторным элементам генов. Меньше известно про контроль над генной экспрессией метилтрансферазами гистонов, белками групп Trithorax и Polycomb или путями microRNA и siRNA. Расшифровка роли этих регуляторных систем потребует экспериментально сконструированной условной инактивации гена, потому что метилтрансферазы гистонов, белки Trithorax и Polycomb так же, как и компоненты аппарата RNAi, являются фундаментально важными не только для лимфопоэза, но также и для эмбрионального развития. Более того, развитие и доступность методов иммунопреципитации хроматина на микрочипе (ChlP-on-chip) позволят с высоким разрешением картировать эпигенетические модификации в целых хромосомах и сложных локусах (таких, как локусы рецепторов антигенов) на разных стадиях лимфопоэза. Эти недавние достижения, по-видимому, обеспечат новое понимание механизмов эпигенетического контроля, лежащих в основе развития лимфоцитов.Литература
Adolfsson J., Mansson R., Buza-Vidas N., Hultquist A., Liuba K., Jensen C.T., Bryder D., Yang L., Borge O.J., Thoren L.A.M., et al., 2005. Identification of Flt3+ lymph0myeloid stem cells lacking erythromegakaryocytic potential: A revised road map for adult blood lineage commitment. Cell 121: 295–306. Akashi K., Traver D., Miyamoto T., and Weissman I.L., 2000. A clono-genic common myeloid progenitor that gives rise to all myeloid lineages. Nature 404: 193–197. Allman D., Sambandam A., Kim S., Miller J.P., Pagan A., Well D., Meraz A., and Bhandoola A., 2003. Thymopoiesis independent of common lymphoid progenitors. Nature Immunol. 4: 168–174. Bariev N. A., Emelyanov A. V., Castagnino P., Zegerman P., Bannister A.J., Sepulveda M.A., Robert E, Tora L., Kouzarides T., Birshtein B.K., and Berger S.L., 2003. A novel human Ada2 homologue functions with Gcn5 or Brg 1 to coactivate transcription. Mol. Cell. Biol. 23: 6944–6957. Bassing C.H., Swat W., and Alt E.W., 2002. The mechanism and regulation of chromosomal V(D)J recombination. Cell (suppl.) 109: S45-S55. Baxter J., Merkenschlager M., and Fisher A.G., 2002. Nuclear organisation and gene expression. Curr Opin. Cell Biol. 14: 372–376. Baxter J., Sauer S., Peters A., John R., Williams R., Caparros M.L., Arney K., Otte A., Jenuwein T., Merkenschlager M., and Fisher A.G., 2004. Histone hypomethylation is an indicator of epigenetic plasticity in quiescent lymphocytes. EMBO J. 23: 4462–4472. Bereshchenko O.R., Gu W., and Dalla-Favera R., 2002. Acetylation inactivates the transcriptional repressor BCL6. Nat. Genet. 32: 606–613. Borland D.J., Wood A.L., Johnston CM., Bunting S.F., Morgan G., Chakalova L., Fraser P.J. and Corcoran A.E., 2004. Antisense inter-genic transcription in V(D)J recombination. Nat. Immunol. 5: 630–637. Brown K.E., Guest S.S., Smale S.T., Hahm K., Merkenschlager M., and Fisher A.G., 1997. Association of transcriptionally silent genes with Ikaros complexes at centromeric heterochromatin. Cell 91: 845–854. Busslinger M., 2004. Transcriptional control of early B cell development. Annu- Rev. Immunol 22: 55–79. Calame K.L., Lin K.I., and Tunyaplin C., 2003. Regulatory mechanisms that determine the development and function of plasma cells. Annu. Rev. Immunol. 21: 205–230. Chow CM., Georgiou A., Szutorisz H., Maia e Silva A., Pombo A., Barahona I., Dargelos E., Canzonetta C. and Dillon N., 2005. Variant histone H3.3 marks promoters of transcriptionally active genes during mammalian cell division. EMBO Rep. 6: 354–360. Chowdhury D. and Sen R., 2001. Stepwise activation of the immunoglobulin p heavy chain gene locus. EMBO J., 20: 6394–6403. Chowdhury D. and Sen R., 2003. Transient IL-7/IL-7R signaling provides a mechanism for feedback inhibition of immunoglobulin heavy chain gene rearrangements. Immunity 18: 229–241. Dakic A., Metcalf D., Di Rago L., Mifsud S., Wu L., and Nutt S.L., 2005. PU.l regulates the commitment of adult hematopoietic progenitors and restricts granulopoiesis./. Exp. Med., 201: 1487–1502. Delogu A., Schebesta A., Sun Q., Aschenbrenner K., Perlot T., and Busslinger M., 2006 Gene repression by Pax5 in B cells is essential for blood cell homeostasis and is reversed in plasma cells. Immunity 24: 269–281. Fisher A.G., 2002. Cellular identity and lineage choice. Nat. Rev. Immunol. 2: 977–982. Francis N.J., Kingston R.E., and Woodcock C.L., 2004. Chromatin compaction by a polycomb group protein complex. Science 306: 1574–1577. Fujita N., Jaye D.L., Geigerman C., Akyildiz A., Mooney M.R., Boss J.M., and Wade P.A., 2004. MTA3 and the Mi-2/NuRD complex regulate cell fate during B lymphocyte differentiation. Cell 119: 75–86. Fukuda T., Yoshida T., Okada S., Hatano M., Miki T., Ishibashi K., Okabe S., Koseki H., Hirosawa S., Taniguchi M., et al., 1997. Disruption of the Bcl6 gene results in an impaired germinal center formation. /. Exp. Med. 186: 439–448. Fuxa M., Skok J., Souabni A., Salvagiotto G., Roldan E., and Busslinger M., 2004. Pax5 induces F-fo-Z)/rearrangements and locus contraction of the immunoglobulin heavy-chain gene. Genes Dev. 18: 411–422. Goldmit M., Ji Y., Skok J., Roldan E., Jung S., Cedar H., and Bergman Y., 2005. Epigenetic ontogeny of the Ig? locus during B cell development. Nat. Immunol. 6: 198–203. Goldmit M., Schlissel M., Cedar H., and Bergman Y., 2002. Differential accessibility at the k chain locus plays a role in allelic exclusion. EMBO 7.21: 5255–5261. Grawunder U., Leu T.M.J., Schatz D.G., Werner A., Rolink A.G., Melchers E, and Winkler T.H., 1995. Down-regulation of RAG1 and RAG2 gene expression in preB cells after functional immunoglobulin heavy chain rearrangement. Immunity 3: 601–608. Gyory I., Wu J., Fejer G., Seto E., and Wright K.L., 2004. PRDI-BF1 recruits the histone H3 methyltransferase G9a in transcriptional silencing. Nat. Immunol. 5: 299–308. Hesslein D.G.T., Pflugh D.L., Chowdhury D., Bothwell A.L.M., Sen R., and Schatz D.G., 2003. Pax5 is required for recombination of transcribed, acetylated, 5’ IgH V gene segments. Genes Dev. 17: 37–42. Honjo T., Muramatsu M., and Fagarasan S., 2004. AID: How does it aid antibody diversity? Immunity, 20: 659–668. Horcher M., Souabni A., and Busslinger M., 2001. Pax5/BSAP maintains the identity of B cells in late B lymphopoiesis. Immunity 14: 779–790. Huynh K.D. and Bardwell V.J., 1998. The BCL-6 POZdomain and other POZ domains interact with the co-repressors N-CoR and SMRT. Oncogene 17: 2473–2484. Huynh K.D., Fischle W, Verdin E., and Bardwell V.J., 2000. BCoR, a novel corepressor involved in BCL-6 repression. Genes Dev. 14: 1810–1823. Ikawa T., Kawamoto H., Wright L.Y.T., and Murre C., 2004. Longterm cultured E2A-deficient hematopoietic progenitor cells are pluripotent. Immunity, 20: 349–360. Jankovic M., Casellas R., Yannoutsos N., Wardemann H., and Nussen-zweig M.C., 2004. RAGs and regulation of autoantibodies, ytow. Rev. Immunol. 22: 485–501. Keller A.D. and Maniatis T., 1991. Identification and characterization of a novel repressor of [3-interferon gene expression. Genes Dev. 5: 868–879. Kim K.C., Geng L., and Huang S., 2003. Inactivation of a histone methyltransferase by mutations in human cancers. Cancer Res. 63: 7619–7623. Kitamura D. and Rajewsky K., 1992. Targeted disruption of p chain m?embrane exon causes loss of heavy-chain allelic exclusion. Nature 556: 154–156. Kosak S.T., Skok J.A., Medina K.L., Riblet R., Le Beau M.M., Fisher A.G., and Singh H., 2002. Subnuclear compartmentalization of immunoglobulin loci during lymphocyte development. Science 296: 158–162. Kovanen P.E. and Leonard W.J., 2004. Cytokines and immunodeficiency diseases: Critical roles of the ?c-dependent cytokines interleukins 2, 4,7,9,15, and 21, and their signaling pathways. Immunol. Rev., 202: 67–83. Krangel M.S., 2003. Gene segment selection in V(D)J recombination: Accessibility and beyond. Nat. Immunol. 4: 624–630. Kraus M., Alimzhanov M.B., Rajewsky N., and Rajewsky K., 2004. Survival of resting mature B lymphocytes depends on BCR signaling via the Iga/p heterodimer. Cell 117: 787–800. Lee A.I., Fugmann S.D., Cowell L.G., Ptaszek L.M., Kelsoe G., and Schatz D.G., 2003. A functional analysis of the spacer of V(D)J recombination signal sequences. PLoS Biol. 1: 56–69. Liang H.E., Hsu L.Y., Cado D., and Schlissel M.S., 2004. Variegated transcriptional activation of the immunoglobulin k locus in pre-B cells contnbutes to the allelic exclusion of light-chain expression. Cell 118: 19–29. Linderson Y., Eberhard D., Malin S., Johansson A., Busslinger M., and Pettersson S., 2004. Corecruitment of the Grg4 repressor by PU.l is critical for Pax5-mediated repression of B-cell-specific genes. EMBO Rep. 5: 291–296. Maier H., Colbert J., Fitzsimmons D., Clark D.R., and Hagman J., 2003. Activation of the early B-cell-specific mb-1 (Ig-a) gene by Pax-5 is dependent on an unmethylated fits binding site. Mol. Cell. Biol. 23: 1946–1960. Maier H., Ostraat R., Gao H., Fields S., Shinton S.A., Medina K.L., Ikawa T., Murre C., Singh H., Hardy R.R., and Hagman J., 2004. Early B cell factor cooperates with Runx 1 and mediates epigenetic changes associated with mb-1 transcription. Nat. Immunol. 5: 1069–1077. Massari M.E., Grant P.A., Pray-Grant M.G., Berger S.L., Workman J.L., and Murre C., 1999. A conserved motif present in a class of helix-loop-helix proteins activates transcription by direct recruitment of the SAGA complex. Mol. Cell. 4: 63–73. McBlane F. and Boyes J., 2000. StimulationofV(D)J recombination by histone acetylation. Curr. Biol. 10: 483–486. McMurry M.T. and Krangel M.S., 2000. A role for histone acetylation in the developmental regulation of V(D)J recombination. Science 287: 495–498. Medina K.L., Pongubala J.M., Reddy K.L., Lancki D.W., DeKoter R., Kieslinger M., Grosschedl R., and Singh H., 2004. Assembling a gene regulatory network for specification of the B cell fate. Dev. Cell 7: 607–617. Mikkola I., Heavey B., Horcher M., and Busslinger M., 2002. Reversion of B cell commitment upon loss of Pax5 expression. Science 297: 110–113. Mito Y., Henikoff J.G., and Henikoff S., 2005. Genome-scale profiling of histone H3.3 replacement patterns. Nat Genet. 37: 1090–1097. Miyamoto T., Iwasaki H., Reizis B., Ye M., Graf T., Weissman I.L., and Akashi K., 2002. Myeloid or lymphoid promiscuity as a critical step in hematopoietic lineage commitment. Dev. Cell 3: 137–147. Morshead K.B., Ciccone D.N., Taverna S.D., Allis C.D., and Oettinger M.A., 2003. Antigen receptor loci poised for V(D)J rearrangement are broadly associated with BRG1 and flanked by peaks of histone H3 dimethylated at lysine 4. Proc. Natl. Acad. Sci. USA 100: 11577-11582. Mostoslavsky R., Singh N., Kirillov A., Pelanda R., Cedar H., Chess A., and Bergman Y., 1998. K chain monoallelic demethylation and the establishment of allelic exclusion. Genes Dev. 12: 1801–1811. Mostoslavsky R., Singh N., Tenzen T., Goldmit M., Gabay C, Elizur S., Qi P., ReubinoffB.E., Chess A., Cedar H., and Bergman Y., 2001. Asynchronous replication and allelic exclusion in the immune system. Nature 414: 221–225. Niu H., Ye B.H., and Dalla-Favera R., 1998. Antigen receptor signaling induces MAP kinase-mediated phosphorylation and degradation of the BCL-6 transcription factor. Genes Dev. 12: 1953–1961. Nutt S.L., Heavey B., Rolink A.G., and Busslinger M., 1999. Commitment to the B-lymphoid lineage depends on the transcription factor Pax5 Nature 401: 556–562. Nutt S.L., Urbanek P., Rolink A., and Busslinger M., 1997. Essential functions of Pax5 (BSAP) in pro-B cell development: Difference between fetal and adult B lymphopoiesis and reduced V-to-DJ recombination at the IgH locus. Genes Dev. 11: 476–491. Orphanides G. and Reinberg D., 2000. RNA polymerase II elongation through chromatin. Nature 407: 471–475. Osipovich O., Milley R., Meade A., Tachibana M., Shinkai Y., Krangel M.S., and Oltz E.M., 2004. Targeted inhibition ofV(D) J recombination by a histone methyltransferase. Nat. Immunol. 5: 309–316. Peters A.H., O’Carroll D., Scherthan H., Mechtler K., Sauer S., Schufer C., Weipoltshammer K., Pagani M., Lachner M., Kohlmaier A., et al., 2001. Loss of the Suv39h histone methyltransferases impairs mammalian heterochromatin and genome stability. Cell 107: 323–337. Rajewsky K., 1996. Clonal selection and learning in the antibody system. Nature 381: 751–758. Reimold A.M., Iwakoshi N.N., Manis J., Vallabhajosyula P., Szomolanyl-Tsuda E., Gravallese E.M., Friend D., Grusby M.J., Alt R, and Glimcher L.H., 2001. Plasma cell differentiation requires the transcription factor XBP-1. Nature 412: 300–307. Ren B., Chee K.J., Kim T.H., and Maniatis T., 1999. PRDI-BF1/ Blimp-1 repression is mediated by corepressors of the Groucho family of proteins. Genes Dev. 13: 125–137. Ringrose L. and Paro R., 2004. Epigenetic regulation of cellular memory by the Polycomb and Trithorax group proteins. Annu. Rev. Genet. 38: 413–443. Roldan E., Fuxa M., Chong W., Martinez D., Novatchkova M., Busslinger M., and Skok J.A., 2005. Locus ‘decontraction’ and centromeric recruitment contribute to allelic exclusion of the immunoglobulin heavy-chain gene. Nat. Immunol. 6: 31–41. Romanow W.J., Langerak A.W., Goebel P., Wolvers-Tettero I.L.M., van Dongen J.J.M., Feeney A.J., and Murre C., 2000. E2A and EBF act in synergy with the V(D)J recombinase to generate a diverse immunoglobulin repertoire in nonlymphoid cells. Mol. Cell 5: 343–353. Sato H., Saito-Ohara R, Inazawa J., and Kudo A., 2004. Pax-5 is essential for k sterile transcription during Ig? chain gene rearrangement. J. Immunol. 172: 4858–4865. Schlissel M.S., Durum S.D., and Muegge K., 2000. The interleukin 7 receptor is required for T cell receptor y locus accessibility to the V(D)J recombinase. J. Exp. Med., 191: 1045–1050. Seet C.S., Brumbaugh R.L., and Kee B.L., 2004. Early B cell factor promotes B lymphopoiesis with reduced interleukin 7 responsiveness in the absence of E2A. J. Exp. Med., 199: 1689–1700. Shaffer A.L., YuX., He Y., Boldrick J., Chan E.P., and Staudt L.M., 2000. BCL-6 represses genes that function in lymphocyte differentiation, inflammation and cell cycle control. Immunity 13: 199–212. Shaffer A.L., Lin K.I., Kuo T.C., Yu X., Hurt E.M., Rosenwald A., Giltnane J.M., Yang L., Zhao H., Calame K., and Staudt L.M., 2002. Blimp-1 orchestrates plasma cell differentiation by extinguishing the mature B cell gene expression program. Immunity 17: 51–62. Shaffer A.L., Shapiro-Shelef M., Iwakoshi N.N., Lee A.-H., Qian S.B., Zhao H., Yu X., Yang L., Tan B.K., Rosenwald A., et al., 2004. XBP1, downstream of Blimp-1, expands the secretory apparatus and other organelles, and increases protein synthesis in plasma cell differentiation. Immunity 21: 81–93. Skok J.A., Brown K.E., Azuara V., Caparros M.L., Baxter J., Takacs K., Dillon N., Gray D., Perry R.P., Merkenschlager M., and Fisher A.G., 2001. Nonequivalent nuclear location of immunoglobulin alleles in B lymphocytes. Nat. Immunol. 2: 848–854. Smale S.T., 2003. The establishment and maintenance of lymphocyte identity through gene silencing. Nat Immunol. 4: 607–615. Stanhope-Baker P., Hudson KM., Shaffer A.L., Constantinescu A., and Schlissel M.S., 1996. Cell type-specific chromatin structure determines the targeting of V(D)J recombinase activity in vitro. Cell 85: 887–897. Su I.H., Basavaraj A., KrutchinskyA.N., Hobert O., Ullrich A., Chait B.T., and Tarakhovsky A., 2003. Ezh2 controls B cell development through histone H3 methylation and Igh rearrangement. Nat. Immunol. 4: 124–131. Su I.H., Dobenecker M.W., Dickinson E., Osier M., Basavaraj A., Marqueron R., Viale A., Reinberg D., Wiilfing C., and Tarakhovsky A., 2005. Polycomb group protein Ezh2 controls actin polymerization and cell signaling. Cell 121: 425–436. Tachibana M., Sugimoto K., Nozaki M., Ueda J., Ohta T., Ohki M., Fukuda M., Takeda N., Niida H., Kato H., and Shinkai Y., 2002. G9a histone methyltransferase plays a dominant role in euchromatic histone H3 lysine 9 methylation and is essential for early embryogenesis. Genes Dev. 16: 1779–1791. Turner C.A.J., Mack D.H., and Davis M.M., 1994. Blimp-1, a novel zinc finger-containing protein that can drive the maturation of B lymphocytes into immunoglobulin-secreting cells. Cell 77: 297–306. Vosshenrich C.A.J., Cumano A., Muller W., Di Santo J.P., and Vieira P., 2003. Thymic stroma-derived lymphopoietin distinguishes fetal from adult B cell development. Nat. Immunol. 4: 773–779. Waskow C, Paul S., Haller C, Gassmann M., and Rodewald H., 2002. Viable c-Kitw/w mutants reveal pivotal role for c-Kit in the maintenance of lymphopoiesis. Immunity 17: 277–288. West K.L., Singha N.C., De Ioannes P., Lacomis L., Erdjument-Bromage H., Tempst P., and Cortes P., 2005. A direct interaction between the RAG2 C terminus and the core histones is required for efficient V(D)J recombination. Immunity 23: 203–212. Xie H., Ye M., Feng R., and Graf T., 2004. Stepwise reprogramming of B cells into macrophages. Cell 117: 663–676. Yancopoulos G.D. and Alt F.W., 1985. Developmentally controlled and tissue-specific expression of unrearranged VH gene segments. Cell 40: 271–281. Ye B.H., Cattoretti C., Shen Q., Zhang J., Hawe N., de Waard R., Leung C., Nouri-Shirazi M., Orazi A., Chaganti R.S.K., et al., 1997. The BCL — 6 proto-oncogene controls germinal-centre formation and Th2-type inflammation. Nature Genet. 16: 161–170. Zhang S., Fukuda S., Lee Y., Hangoc G., Cooper S., Spolski R., Leonard W.J., and Broxmeyer H.E., 2000. Essential role of signal transducer and activator of transcription (Stat) 5a but not Stat5b for Flt3-dependent signaling. J. Exp. Med., 192: 719–728.Глава 22. Трансплантация ядер и репрограммирование генома
 Rudolf Jaenisch и John Gurdon
Whitehead Institute, and Department of Biology, Massachusetts Institute of Technology, Cambridge, Massachusetts 02142-1479
The Wellcome Trust/Cancer Research UK Gurdon Institute, The Henry Wellcome Building of Cancer and Developmental Biology, University of Cambridge, Camebridge CB2 1QN, United Kingdom
Rudolf Jaenisch и John Gurdon
Whitehead Institute, and Department of Biology, Massachusetts Institute of Technology, Cambridge, Massachusetts 02142-1479
The Wellcome Trust/Cancer Research UK Gurdon Institute, The Henry Wellcome Building of Cancer and Developmental Biology, University of Cambridge, Camebridge CB2 1QN, United Kingdom
Общее резюме
План тела животных сконструирован из сотен разных типов клеток, выполняющих различные физиологические функции организма. Ключевым вопросом, поставленным уже давно, является вопрос о механизме дифференциальной экспрессии генов, который обеспечивает активность или «молчание» генов, нужных для нормального функционирования данной дифференцированной клетки. В прежние дни, до того как удалось оценить молекулярные основы генной экспрессии, гипотетически предполагали, что основой тканеспецифичной экспрессии генов могла бы быть генетическая элиминация или перманентная инактивация «молчащих» генов из тех тканей, которые не экспрессировали «молчащие» гены, и сохранение тех генов, которые экспрессируются. Действительно, у некоторых организмов, таких как насекомое Sciara, генетический материал элиминируется из соматических тканей, и полный генетический набор сохраняется только в клетках зародышевого пути. Это ставит вопрос об «эквивалентности ядер», т. е. о том, сохраняет ли геном соматических клеток полный набор генетического материала. Самым прямым подходом к решению этого вопроса является ядерное клонирование, где возможности ядра соматической донорской клетки направлять развитие нового организма проверяются путем его трансплантации в денуклеированную яйцеклетку. В самом деле, получение клонированных животных из ядер соматических клеток доказало, вне всякого сомнения, что главные генетические изменения, не даюшие соматическому ядру генерировать все клеточные типы, не являются частью нормального процесса развития.1. История
Первый успех в трансплантации ядра одной клетки в другую у многоклеточного организма был достигнут Бриггсом и Кингом в 1952 году (Briggs and King, 1952), хотя до этого пересадка ядра была сделана у одноклеточных организмов, в том числе у амебы, инфузорий и Acetabularia (Gurdon, 1964). Бриггс и Кинг (Briggs and King, 1952) получили нормальных плавающих головастиков в результате пересадки ядер клеток бластулы в денуклеированное яйцо Ranapipiens. В этой и последующих работах с R. pipiens до 30 % пересадок ядер бластулы давали морфологически нормальные постнейральные стадии. Значение этого раннего достижения заключалось в том, что оно открыло способ протестировать, могут ли ядра дифференцированных клеток также поддерживать нормальное развитие реципиентных яйцеклеток, т. е. замещать зиготическое ядро нормально оплодотворенных яиц. В следующей важной статье Бриггса и Кинга (Briggs and King, 1957) сообщалось, что очень скоро после стадии бластулы ядра соматических клеток (в этом случае эндодермы) утрачивают способность поддерживать нормальное развитие. Действительно, к стадии хвостовой почки ядра эндодермы больше не обеспечивали нормальное развитие. Вскоре после этого сообщили об успешной пересадке ядер у Xenopus (Fischberget al., 1958). У этого вида для доказательства того, что развитие эмбрионов-трансплантатов обеспечивалось исключительно активностью пересаженного ядра без какого-либо вклада со стороны ядра яйцеклетки, которое было убито ультрафиолетовым облучением, был использован генетический маркер. У Xenopus полученные в результате трансплантации ядер эмбрионы развивались более нормально, чем у Rana, и очень быстро достигали стадии взрослого животного. Первые половозрелые взрослые клонированные животные были получены у Xenopus в результате пересадки ядер эндодермы (Gurdon et al., 1958), и большая их часть выглядела нормальной во всех отношениях. Чтобы ядерное клонирование оказалось успешным, яйцеклетка должна «репрограммировать» соматическое донорское ядро в «эмбриональное» эпигенетическое состояние, чтобы могла быть активирована генетическая программа, необходимая для эмбрионального развития. Современные исследования сфокусированы в основном на том, чтобы понять молекулярные основы репрограммирования в экспериментах с трансплантацией ядер. Поскольку эмбриональное развитие у амфибий и у млекопитающих очень различается, каждая из этих систем может обеспечить проникновение в разные аспекты проблемы репрограммирования в опытах по трансплантации ядер. Например, благодаря тому, что у амфибий легко можно получить огромное число крупных яиц, эта система особенно полезна для проведения биохимических анализов. Напротив, млекопитающие, в особенности мыши, позволяют применять, в первую очередь, тканевые культуры и генетические подходы. По этим причинам наблюдения, сделанные на амфибиях и на млекопитающих, являются взаимодополняющими и обсуждаются совместно, чтобы подчеркнуть сходства и различия этих двух систем. Прежде всего мы описываем фенотип клонированных амфибий и млекопитающих и как на него влияет состояние дифференцировки донорского ядра. За этим следует описание молекулярных механизмов, признанных важными для репрограммирования. В конце обсуждаются потенциальные возможности трансплантации ядер для терапии.2. Процедуры пересадки ядер
2.1. Амфибии
Доступность яиц Xenopus на протяжении всего года и легкость содержания этого водного животного в лаборатории обусловили то обстоятельство, что большая часть работ по пересадкам ядер у амфибий, после первоначального успеха с Rana, была предпринята на Xenopus Следует различать два рода экспериментов в соответствии с тем, инъецируются ядра в денуклеированные яйцеклетки или же в неденуклеированные ооциты (рис. 22.1). Пересадка ядра требует инъекции всей донорской клетки, плазматическую мембрану которой предварительно делают проницаемой либо физическими методами, например всасыванием этой клетки в пипетку, слишком маленькую по сравнению с размерами клетки, либо химическими методами, за счет кратковременной обработки интегрирующим мембрану веществом. Количество цитоплазмы донорской клетки, вводимое с ядром, равно приблизительно 10-5 объема яйцеклетки и никакого влияния не оказывает. Яйцеклетки, получившие пересаженное ядро, культивируются в простом непитательном солевом растворе, эквивалентном прудовой воде, и, следовательно, развиваются независимо от культурального раствора. Пересадка ядер в ооциты выглядит совершенно иначе. Полностью выросшие ооциты, взятые из яичника самки, находятся в профазе первого мейоза (рис. 22.1). Ядра примерно 50 соматических клеток, инъецированные в ядро (зародышевый пузырек) этих растущих ооцитов, не реплицируют ДНК и не делятся, но на протяжении нескольких дней становятся все более активными в отношении транскрипции. Ооциты, получившие пересаженные ядра, культивируются подобно яйцеклеткам в непитательной солевой среде и не претерпевают никаких морфологических изменений на протяжении всего периода культивирования (две недели и больше).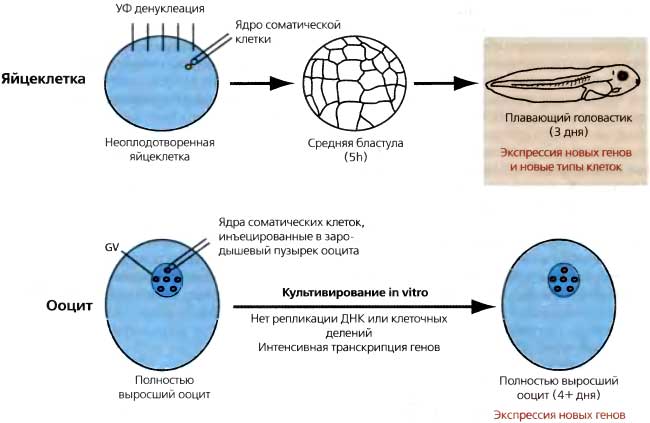 Рис. 22.1. Схема, изображающая два типа экспериментов по трансплантации ядер у Xenopus
Верхняя часть рисунка иллюстрирует пересадки одиночных ядер в яйцеклетки, денуклеированные ультрафиолетовым облучением (УФ). Спустя три дня после пересадки ядра формируется плавающий головастик Нижняя часть рисунка показывает множественные пересадки ядер в растущие ооциты на стадии первой мейотической профазы (GV) Зародышевый пузырек, или ядро ооцита. Подвергшиеся инъекции ооциты не делятся и могут культивироваться в течение многих дней. Инъецированные ядра соматических клеток претерпевают изменения в экспрессии генов на протяжении первых четырех дней культивирования
Рис. 22.1. Схема, изображающая два типа экспериментов по трансплантации ядер у Xenopus
Верхняя часть рисунка иллюстрирует пересадки одиночных ядер в яйцеклетки, денуклеированные ультрафиолетовым облучением (УФ). Спустя три дня после пересадки ядра формируется плавающий головастик Нижняя часть рисунка показывает множественные пересадки ядер в растущие ооциты на стадии первой мейотической профазы (GV) Зародышевый пузырек, или ядро ооцита. Подвергшиеся инъекции ооциты не делятся и могут культивироваться в течение многих дней. Инъецированные ядра соматических клеток претерпевают изменения в экспрессии генов на протяжении первых четырех дней культивирования
2.2. Млекопитающие
Самые ранние попытки клонировать млекопитающих были выполнены с эмбрионами кроликов. В этих экспериментах ооциты сливали с клетками, взятыми от эмбрионов на стадии морулы, и было видно, что получающиеся в результате этого триплоидные клоны проделывали несколько делений дробления (Bromhall, 1975). В 1984 году МакГрат и Солтер применили слияние с помощью вируса Сендай для эффективной пересадки донорских ядер в денуклеированные зиготы. Этот метод был использован для экспериментов двух типов: (1) получают однородительские эмбрионы, замещая мужской пронуклеус женским (что дает начало гиногенетическому зародышу) или замещая женский пронуклеус мужским (что дает начало андрогенетическому эмбриону) (McGrath and Solter, 1984а,b; Suranietal., 1984). Однородительские эмбрионы не развиваются и неизменно погибают, давая первое доказательство того, что нормальное развитие млекопитающих критическим образом зависит от родительски-специфичного геномного импринтинга (2) Клонированные эмбрионы были получены путем пересадки ядер от эмбрионов-доноров, находящихся на стадии дробления, в денуклеированные зиготы. Ни один из таких реконструированных эмбрионов не развивался дальше поздней стадии дробления, из чего следует, что тотипотентность генома в ходе раннего развития быстро утрачивается и что клонирование млекопитающих, в противоположность амфибиям, может быть невозможным (McGrath and Solter, 1984b). Однако результаты, полученные на других видах млекопитающих, вскоре поставили этот вывод под сомнение. В 1986 году Вилладсену (Willandsen) удалось клонировать живых ягнят из ядер 4—16-клеточного эмбриона и вскоре после этого последовало создание клонированных телят и свиней (Robi et al., 1987; Prather et al., 1989). Почему клонирование сельскохозяйственных животных оказалось успешным в противоположность хорошо контролируемым экспериментам по клонированию мышей (McGrath and Solter, 1984Ь)? Основное различие в развитии этих видов животных заключается в сроках перехода от материнского контроля развития (на основе запасенной матерью РНК) к зиготическому контролю развития (на основе зиготически продуцируемой РНК). Этот основной переход, по-видимому, происходит на 8—16-клеточной стадии у овец и крупного рогатого скота (Calarco and McLaren, 1976; Camous et al., 1986), но уже на 2-клеточной стадии у эмбрионов мышей (Bolton et al., 1984). Таким образом, у клонируемых эмбрионов овец или коров временные ограничения для активации донорского генома могут быть менее жесткими, чем у клонируемых эмбрионов мышей, где для того, чтобы происходило дробление, донорское ядро должно быть активировано вскоре после пересадки. Первым успешным получением клонированных животных путем пересадки ядра соматической клетки, а не пересадки ядра из клеток-доноров эмбриона на стадии дробления, было получение овцы из культивируемых фибробластов донора (Campbell et al., 1996b). За этим вскоре последовало создание «Долли» из донорского ядра клетки молочной железы (Wilmut et al., 1997); «Долли» оказалась первым млекопитающим, клонированным из донорской клетки взрослого животного. С тех пор были клонированы всего 15 видов млекопитающих, в том числе мыши, козы, свиньи, коровы, кролики, крысы, кошки и собаки (обзор см. Campbell et al., 2005). Процедура клонирования млекопитающего, как и клонирование амфибий, включает два этапа. В большинстве, если не во всех успешных экспериментах по пересадке ядра соматической клетки, донорские ядра переносились в денуклеированные ооциты ( в отличие от ранних опытов по клонированию мышей, где донорское ядро от эмбриона на стадии дробления вводилось в денуклеированную зиготу; McGrath and Solter, 1984). На первом этапе пипеткой удаляли метафазное веретено яйцеклетки-реципиента, вслед за чем в денуклеированное яйцо пересаживали донорское ядро. У большинства млекопитающих донорское ядро вводилось в яйцеклетку путем электрослияния с денуклеированным яйцом. У мышей яйцеклетки особенно легко повреждаются, и пересадка ядра у этого вида наиболее эффективна путем физического переноса донорского ядра в яйцо (Wakayama et al., 1998). Как изображено на рис. 22.2, донорское ядро вводится в денуклеированное яйцо с помошью пьезоэлемента, который облегчает проникновение через zona pellucida и цитоплазматическую мембрану (Wakayama et al., 1998). Клонированные бластоцисты либо имплантируются в матку псевдобеременной приемной матери, чтобы получить клонированных мышей, либо эксплантируются в тканевую культуры, чтобы получить эмбриональные стволовые клетки от пересадки ядра (NT-ES, nuclear transfer embryonic stem cells). Клетки NT-ES генетически идентичны донору и могут, следовательно, использоваться для «заказной» («customized») клеточной терапии, называемой также «терапевтическим клонированием» (см. ниже).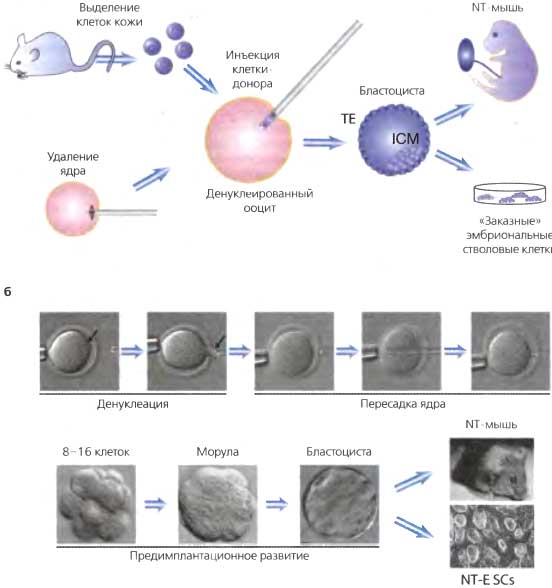 Рис. 22.2. Пересадка ядер у мышей с помощью микроинъекций
(а) Схематическое изображение процедуры ядерной пересадки. Когда бластоциста эксплантируется на облученные клетки-фидеры, внутренняя клеточная масса (ICM) дает начало клеткам ES. Будучи перенесенной в синхронизированную псевдобеременную самку, такая бластоциста может развиться в мышь. Наружные клетки бластоцисты — трофэктодерма (ТЕ) — дают начало экстра- эмбриональным тканям (плаценте), а клетки ICM генерируют эмбрион, (б) Те же этапы, что и на а, показаны с помощью световой микроскопии (воспроизведено, с любезного разрешения, из Meissner, 2006)
Рис. 22.2. Пересадка ядер у мышей с помощью микроинъекций
(а) Схематическое изображение процедуры ядерной пересадки. Когда бластоциста эксплантируется на облученные клетки-фидеры, внутренняя клеточная масса (ICM) дает начало клеткам ES. Будучи перенесенной в синхронизированную псевдобеременную самку, такая бластоциста может развиться в мышь. Наружные клетки бластоцисты — трофэктодерма (ТЕ) — дают начало экстра- эмбриональным тканям (плаценте), а клетки ICM генерируют эмбрион, (б) Те же этапы, что и на а, показаны с помощью световой микроскопии (воспроизведено, с любезного разрешения, из Meissner, 2006)
3. Фенотип клонированных животных
Получение животных путем пересадки донорских ядер соматических клеток не эффективно, и те редкие животные, которые доживают до взрослого состояния, часто обнаруживают множественные аномалии. В отличие от этого, когда в качестве доноров ядер используются эмбриональные клетки, выживаемость клонов и у амфибий, и у млекопитающих гораздо выше В следующей главе акцент делается на отношении между возрастом донорского ядра и его влиянием на выживаемость клона в сопоставлении с фенотипом клонов амфибий и млекопитающих, полученных из взрослых и эмбриональных донорских клеток.3.1. Амфибии
Когда ядра бластулы трансплантируются в хорошего качества реципиентныеяйцаЛсяо/ж?, свыше 30 % таких яиц развиваются в нормальных головастиков, и большинство этих последних можно вырастить до стадии фертильных взрослых животных. По мере того как донорские клетки дифференцируются, степень нормальности развития трансплантантных эмбрионов снижается (рис. 22.3), не столь быстро в случае эндодермальных донорских ядер, как при использовании других. У амфибий оказались информативными серийные ядерные пересадки, в которых донорские ядра берутся из бластулы, которая сама была получена в результате пересадки ядра соматической клетки (рис. 22.4). Это делается потому, что клетки эмбриона от первой пересадки часто представляют собой мозаику клеток, нормальных и ненормальных по хромосомам, из-за различий в скорости репликации ДНК между соматической клеткой и активированным яйцом; серийные трансплантации ядер демонстрируют возможности развития у ядер эмбриона от первой пересадки, которые меньше повреждены ядерной пересадкой. Несколько нормальных половозрелых, генетически маркированных лягушек, самцов и самок, были получены даже при использовании кишечного эпителия питающихся личинок (Gurdon and Uehlinger, 1966). Этот результат показывал, что процесс дифференцировки не обязательно связан с утратой способности обеспечивать нормальное развитие, и, следовательно, принцип сохранения генома по мере дифференцировки клеток не нарушается. Рис. 22.3. Выживаемотъ эмбрионов Xenopus, полученных в ре зультате пересадки ядер снижается номере того, как донорские ядра берутся из все более и более специализированных донорских клеток
Сокращения, обозначающие стадию: (В) бластула; (G) гаструла: (N) нейрула; (ТВ) стадия хвостовой почки: (НВ) стадия биения сердца; (ST) стадия плавающего головастика; (FT) стадия питающегося головастика (перепечатано, с любезного разрешения, из Gurdon, 1960)
Рис. 22.3. Выживаемотъ эмбрионов Xenopus, полученных в ре зультате пересадки ядер снижается номере того, как донорские ядра берутся из все более и более специализированных донорских клеток
Сокращения, обозначающие стадию: (В) бластула; (G) гаструла: (N) нейрула; (ТВ) стадия хвостовой почки: (НВ) стадия биения сердца; (ST) стадия плавающего головастика; (FT) стадия питающегося головастика (перепечатано, с любезного разрешения, из Gurdon, 1960)
В опытах по трансплантации ядер у амфибии оказалось невозможным получить нормальное взрослое животное из ядра другой взрослой особи. Однако морфологически нормальные головастики были получены из ядер клеток многих различных тканей взрослых особей (Laskey and Gurdon, 1970), и эти головастики имели нормальный набор функционирующих специализированных типов клеток. Следовательно, клетки, коммитированные в направлении одного пути дифференцировки, содержат, тем не менее, генетический потенциал, обеспечивающий в комбинации с цитоплазмой яйца большинство неродственных типов клеточных дифференцировок. Способность ядер одного клеточного типа обеспечивать другие типы клеточных дифференцировок можно оценить количественно, проверив, в какой степени функциональная мышечная и нервная дифференцировка, о которой можно судить по эмбрионам, совершающим плавательные движения после стимуляции, может быть достигнута при использовании ядер кишечного эпителия от плавающих головастиков. Такие эмбрионы часто могут быть получены с помощью серийных пересадок ядер от эмбрионов, полученных в результате первой пересадки, которые не совсем нормальны (см. рис. 22.4) (Gurdon, 1962). Кроме того, клетки бластулы от морфологически дефектных эмбрионов от первой пересадки могут формировать мышцы, будучи пересажены нормальным хозяевам, выращенным из оплодотворенных яиц (рис. 22.4) (Byrne et al., 2003). Этот результат показывает, что до 30 % клеток кишечного эпителия могут приводить, после пересадки ядер, к формированию функциональных аксиальных мышечных клеток (табл. 22.1). Спектр аномалий, возникающих в результате пересадки ядер у амфибий, не обнаруживает какого-либо постоянного характера, который на морфологическом уровне можно было бы соотнести с происхождением донорской клетки. Независимо от типа клеток и стадии развития донорских ядер эмбрионы, полученные в результате трансплантации ядер, погибают со сходным набором дефектов, включающим неполное дробление, неспособность к гаструляции, дефектное формирование оси и отсутствие структур головы. Внешне беспорядочная природа этих дефектов не удивительна, поскольку известно, что в клетках эмбрионов от первой пересадки часто наблюдаются крупные хромосомные аномалии (см. раздел 4.1, подраздел «Репрограммирование в клонах»).
Таблица 22.1. Эффективность ядерного репрограммирования: клетки личиночной эндодермы Xenopus

 Рис. 22.4. Серийные пересадки ядер и пересадки ткани у Xenopus
Для стандартных первых пересадок единичное ядро соматической клетки трансплантируют в денуклеированное яйцо, которое затем выращивается прямо до стадии личинки Для серийных пересадок ядер эмбрион от первой пересадки на ранней стадии развития используется как донор ядер для дальнейшей серии пересадок ядер в яйцеклетки. Эти эмбрионы, полученные в результате серийных ядерных пересадок, выращиваются до стадии головастика. Наконец, от эмбриона, полученного в результате первой пересадки, который частично дефектен, берут кусочек ткани для пересадки эмбриону-хозяину, выращенному из оплодотворенного яйца. Пересаженная ткань становится частью вырастающего головастика
Рис. 22.4. Серийные пересадки ядер и пересадки ткани у Xenopus
Для стандартных первых пересадок единичное ядро соматической клетки трансплантируют в денуклеированное яйцо, которое затем выращивается прямо до стадии личинки Для серийных пересадок ядер эмбрион от первой пересадки на ранней стадии развития используется как донор ядер для дальнейшей серии пересадок ядер в яйцеклетки. Эти эмбрионы, полученные в результате серийных ядерных пересадок, выращиваются до стадии головастика. Наконец, от эмбриона, полученного в результате первой пересадки, который частично дефектен, берут кусочек ткани для пересадки эмбриону-хозяину, выращенному из оплодотворенного яйца. Пересаженная ткань становится частью вырастающего головастика
3.2. Млекопитающие
Обычные аномалии у клонированных животных
Большинство клонированных эмбрионов млекопитающих вскоре после имплантации перестают развиваться. Те же, которые доживают до рождения, часто обнаруживают общие аномалии вне зависимости от типа донорских клеток (табл. 22.2). Например, новорожденные клоны часто оказываются «переростками» и обнаруживают увеличенную плаценту; эти симптомы называют Синдромом Крупного Потомства (Large Offspring Syndrome) (Young et al., 1998; Hill et al., 2000; Tanaka et al., 2001). Более того, новорожденные клоны часто страдают респираторным дистрессом и дефектами почек, печени, сердца и мозга. Даже особи, выживающие длительное время, могут обнаруживать аномалии на последующих стадиях жизни. Например, стареющие клонированные мыши часто становятся ожиревшими, у них развиваются серьезные проблемы с иммунитетом или они преждевременно погибают (Ogonuki et al., 2002; Tamashiro et al., 2002). Как схематически представлено на рис. 22.5, две стадии, когда большинство клонов погибают, — это стадия непосредственно после имплантации и при рождении. Эти две стадии являются критичными для развития и могут быть особо чувствительными к ошибочной экспрессии генов (см. ниже). Однако получение взрослых и внешне здоровых клонированных животных было воспринято как доказательство, что пересадка ядер может давать нормальных клонированных животных, хотя и с низкой эффективностью. Важно отметить, что серьезные аномалии у клонированных животных могут часто проявляться лишь при старении животных (Ogonuki et al., 2002; Tamashiro et al., 2002). Стохастическое возникновение заболеваний и других дефектов в более позднем возрасте у многих или даже у большинства взрослых клонов означает, что компенсаторные механизмы, позволяющие клонированным животным выжить, не гарантируют их «нормальность». Скорее, фенотип выживающих клонированных животных оказывается распределенным по широкому спектру, который включает как аномалии, вызывающие внезапную смерть в раннем постнатальном возрасте, так и более легкие аномалии, позволяющие дожить до более преклонного возраста (рис. 22.5). Эти соображения иллюстрируют сложность определения легких дефектов генной экспрессии и подчеркивают необходимость более сложных тест-критериев, таких как тесты на стресс, вызываемый внешними факторами, или поведенческие тесты.Таблица 22.2. Обратное отношение между состоянием дифференцировки клетки-донора и эффективностью репрограммирования

Эпигенетические versus генетические причины
Аномалии, характерные для клонированных животных, не наследуются потомством клонов, показывая, что их причиной являются «эпигенетические», а не генетические отклонения. Это потому, что эпигенетические изменения, в противоположность генетическим, являются обратимыми модификациями ДНК или хроматина, которые «стираются» при прохождении генома через зародышевый путь (Ogonuki et al., 2002; Tamashiro et al., 2002). Таким образом, проблемы, связанные с клонированием, обусловлены ошибочным «эпигенетическим/ геномным репрограммированием» трансплантированного донорского ядра, а не соматическими мутациями, приобретаемыми в соматических донорских клетках. Рис. 22.5. Выживаемость клонов млекопитающих
Фенотипы клонов распределяются в широком диапазоне аномалий. Большинство клонов погибают на двух определенных стадиях развития — при имплантации и при рождении. Более мелкие аномалии генной экспрессии приводят к заболеваниям и смерти в более позднем возрасте
Рис. 22.5. Выживаемость клонов млекопитающих
Фенотипы клонов распределяются в широком диапазоне аномалий. Большинство клонов погибают на двух определенных стадиях развития — при имплантации и при рождении. Более мелкие аномалии генной экспрессии приводят к заболеваниям и смерти в более позднем возрасте
3.3. Получение клонированных млекопитающих из терминально дифференцированных клеток
Состояние дифференцировки донорской клетки и эффективность репрограммирования ядра
Вопрос, уже возникавший в плодотворных экспериментах по клонированию у амфибий, заставлял предполагать наличие обратной зависимости между состоянием клеточной дифференцировки донорского ядра и его способностью направлять развитие после пересадки в яйцеклетку (см. выше и рис. 22.3). Важно было выяснить, влияет ли состояние дифференцировки донорской клетки на эффективность репрограммирования и у млекопитающих. Как показано в табл. 22.2, репрограммирование можно измерить функционально, оценив развитие клонов на нескольких разных уровнях, включая (1) скорость формирования бластоцисты после пересадки ядра в яйцо, (2) долю клонированных эмбрионов, выживающих до рождения или до взрослого состояния после имплантации в матку, и (3) частоту, с которой из клонированных бластоцист, эксплантированных в культуру, можно получить плюрипотентные эмбриональные стволовые (ES) клетки. Эффективность предимплантационного развития реконструированных ооцитов в бластоцисты особенно чувствительна к таким экспериментальным параметрам, как стадия клеточного цикла и физическое состояние пересаживаемого ядра. Например, клонирование неделящихся донорских клеток более эффективно, чем клонирование активно пролиферирующих клеток (Campbell et al., 1996а; Cibelli et al., 1998). Так, как и ожидалось из этого отношения, яйцеклетки, реконструированные с использованием донорских ядер из фибробластов, клеток Сертоли, кумулюса или клеток NKT, находящихся в фазе Gj или G0 клеточного цикла, достигают стадии бластулы с относительно высокой эффективностью в противоположность клеткам ES или клеткам эмбриональной карциномы (ЕС), которые активно делятся и большая доля которых находится в фазе S (табл. 22.2). Благодаря экспериментальной вариабельности в ходе дробления измерение доли бластоцист, полученных из реконструированных ооцитов, не является надежным критерием для количественной оценки «способности к репрограммированию». Однако, коль скоро клонированный эмбрион достиг стадии бластоцисты, после имплантации в матку его развитие до рождения зависит от состояния дифференцировки донорского ядра. Клонированные эмбрионы, полученные от таких эмбриональных доноров, как клетки ES или ЕС, развиваются до рождения с эффективностью в 10—20 раз более высокой, чем эмбрионы, полученные от донорских клеток кумулюса или фибробластов (Eggan et al., 2001; Wakayama and Yanagimachi. 2001). предположительно потому, что ядро недеференцированной клетки более склонно к репрограммированию или нуждается в нем в меньшей степени, чем ядро дифференцированной соматической клетки. Это указывает на обратное отношение между стадией дифференцировки донорской клетки и эффективностью репрограммирования. Наконец, коль скоро эмбрион достиг стадии бластоцисты, он с довольно существенной вероятностью может дать начало клеткам ES; это показывает, что получение клеток ES из эксплантированных бластоцист гораздо меньше зависит от состояния дифференцировки донорского ядра (табл. 22.2).Можно ли ядра терминально дифференцированных клеток репрограммировать до состояния тотипотентности ?
В ранних экспериментах по клонированию амфибий и млекопитающих популяции донорских клеток, используемых для трансплантации ядер, были гетерогенными, и нельзя было исключить, что начало редким выживающим клонам дали редкие взрослые стволовые клетки, присутствующие в донорской популяции, а не ядра дифференцированных клеток. Например, эпигенетическое состояние соматических стволовых клеток может походить на состояние эмбриональных стволовых клеток, легче репрограммируется и, таким образом,может предпочтительно давать выживающие клоны. Чтобы решить вопрос о том, можно ли ядро терминально дифференцированной клетки репрограммировать в достаточной мере для получения взрослого животного, требовались генетические маркеры, по которым можно было бы ретроспективно идентифицировать донорское ядро выжившего клона. Такие маркеры были использованы для однозначной демонстрации того, что ядра из зрелых иммунных клеток, из терминально дифференцированных нейронов и из злокачественных раковых клеток могут быть репрограммированы и могут дать взрослых клонированных мышей.Моноклональные мыши из зрелых иммунных клеток
Моноклональные мыши были получены с использованием ядер периферических лимфоцитов, где генетические перестройки генов иммуноглобулина (Ig) и рецептора Т-клеток (TCR) можно было использовать в качестве стабильных маркеров, позволяющих выявлять идентичность и состояние дифференцировки донорского ядра данного клона. Поскольку предшествовавшие попытки получить моноклональных мышей были безуспешными, использовали процедуру двухэтапного клонирования, чтобы сначала получить клетки ES из клонированных бластоцист, а затем, на втором этапе, моноклональных мышей из клонированных клеток ES (рис. 22.6). Животные, полученные из донорских ядер В- и Т-клеток, были жизнеспособными и несли полностью перестроенные гены иммуноглобулина или TCR во всех тканях (Hochedlinger and Jaenisch, 2002). Как и ожидалось, иммунные клетки моноклональных мышей экспрессировали только те аллели локуса Ig и TCR, которые были продуктивно перестроены в соответствующих донорских клетках, использованных для пересадки ядер, а перестройка других генов Ig или TCR была подавлена. Эти результаты однозначно показывают, что ядра из терминально дифференцированных донорских клеток могут быть репрограммированы до состояния плюрипотентности с помощь клонирования ядер. Частота непосредственно получаемых клонированных эмбрионов из зрелых В- и Т-клеток (вместо двухэтапной процедуры, использованной в наших экспериментах), хотя ее и трудно оценить, была, вероятно, существенно ниже, чем частота клонов, полученных из фибробластов или клеток кумулюса (возможно, меньше I на 2000 оперированных эмбрионов; табл. 22.2). Недавно были непосредственно клонированы терминально дифференцированные клетки NKT (Inoue et al., 2005). Клетки NKT, подобно В- и Т-клеткам, обладают генетическими перестройками, делающими возможной ретроспективную идентификацию состояния дифференцировки этих клеток. Однако, хотя Т- клетки и клетки NKT и являются частью одной и той же клеточной линии, соответствующая эффективность ядерных пересадок существенно различалась (Hochedlinger and Jaenisch, 2002; Inoue et al., 2005). Рис. 22.6. Двухэтапная процедура для получения моноклональных мышей из зрелых лимфоидных донорских клеток
(1) Ядра из клеток периферического лимфатического узла пересаживали в денуклеированные яйцеклетки и получали клонированные бластоцисты. Эти бластоцисты эксплантировали in vitro и получали клонированные клетки ES. (2) На втором этапе получали моноклональных мышей путем тетраплоидной комплементации (Eggan et al., 2001; Hochedlinger and Jaenisch, 2002)
Рис. 22.6. Двухэтапная процедура для получения моноклональных мышей из зрелых лимфоидных донорских клеток
(1) Ядра из клеток периферического лимфатического узла пересаживали в денуклеированные яйцеклетки и получали клонированные бластоцисты. Эти бластоцисты эксплантировали in vitro и получали клонированные клетки ES. (2) На втором этапе получали моноклональных мышей путем тетраплоидной комплементации (Eggan et al., 2001; Hochedlinger and Jaenisch, 2002)
Клонированные мыши из зрелых обонятельных нейронов
В противоположность В- и Т-клеткам ядра постмитотических нейронов необратимо выходят из клеточного цикла; в этом заключается часть программы их дифференцировки. Для проверки того, можно ли ядро зрелого нейрона репрограммировать до состояния тотипотентности, были получены фертильные клонированные взрослые мыши из постмитотических обонятельных нейронов с использованием такого же подхода, какой был применен для получения моноклональных мышей (см. рис. 22.6) (Eggan et al., 2004; Li et al., 2004). Как показано в табл. 22.2, эффективность получения клонированных клеток ES из обонятельных нейронов была в том же диапазоне, что и эффективность для ядер иммунных клеток. Эти наблюдения показывают, что постмитотическое нейрональное ядро может вновь вступить в клеточный цикл и его можно репрограммировать к плюрипотентности. У мыши каждая из двух миллионов клеток в обонятельном эпителии экспрессирует только один из приблизительно 1500 генов рецепторов запаха (OR, odor-ant receptor), так что функциональная идентичность нейрона определяется природой рецептора, который он экспрессирует (это аналогично моноаллельной экспрессии генов иммунного глобулина или TCR в В- или Е-клетках, которая обсуждалась в главе 21). Один из механизмов, который обеспечивал бы стохастический выбор единственного обонятельного рецептора, мог бы быть связан с перестройками ДНК. Получение мышей, клонированных из зрелых обонятельных нейронов, позволило исследовать, связан ли выбор обонятельного рецептора с необратимыми перестройками ДНК. Если выбор обонятельного рецептора связан с необратимыми перестройками ДНК, можно было бы предсказать, по аналогии с описанными выше моноклональными мышами, что мышь, клонированная из нейрона, экспрессирующего Р2, будет экспрессировать этот рецептор во всех обонятельных нейронах и репертуар экспрессии рецепторов будет изменен (это были бы моносомные мыши, которые могли бы чувствовать только один запах) (рис. 22.7). Наоборот, если выбор OR связан с обратимым эпигенетическим механизмом, клонированные животные должны демонстрировать картину экспрессии Р2, идентичную той, которую демонстрирует мышь-донор, и нормальный репертуар экспрессии рецептора. Анализ экспрессии обонятельного рецептора показал, что механизм выбора рецептора полностью обратим и не связан с генетическими изменениями, как это видно при созревании В- и Т-клеток (Eggan et al., 2004). Рис. 22.7. Клонирование ядер зрелых обонятельных нейронов
Мыши, клонированные из зрелых обонятельных нейронов имели нормальный репертуар экспрессии обонятельных рецепторов (ОЮ, в котором лишь 0,1 % нейронов экспрессируют рецептор Р2. — как и у мышей-доноров Экспрессию рецептора Р2 определяли, используя мышей-доноров, имевших ген маркера GFP, вставленный в ген рецептора Р2. Результаты этого опыта показали, что выбор экспрессии рецептора определяется не генетическими изменениями, а обратимым эпигенетическим механизмом
Рис. 22.7. Клонирование ядер зрелых обонятельных нейронов
Мыши, клонированные из зрелых обонятельных нейронов имели нормальный репертуар экспрессии обонятельных рецепторов (ОЮ, в котором лишь 0,1 % нейронов экспрессируют рецептор Р2. — как и у мышей-доноров Экспрессию рецептора Р2 определяли, используя мышей-доноров, имевших ген маркера GFP, вставленный в ген рецептора Р2. Результаты этого опыта показали, что выбор экспрессии рецептора определяется не генетическими изменениями, а обратимым эпигенетическим механизмом
Рак и реверсия злокачественного состояния с помощью трансплантации ядер
Клонирование мышей из терминально дифференцированных лимфоцитов и постмитотических нейронов продемонстрировало, что пересадка ядер дает нам в руки инструмент для избирательного репрограммирования эпигенетического состояния клеточного генома без изменения его генетического состава. Рак вызывается генетическими, а также эпигенетическими изменениями, но влияние эпигенетики на злокачественный фенотип раковой клетки не было определено. Трансплантацию ядер раковых донорских клеток использовали как прямой подход к оценке обратимости трансформированного состояния. Действительно, предыдущие эксперименты с амфибиями показали, что ядра из клеток карциномы почки можно репрограммировать, и они будут поддерживать раннее развитие до стадии головастика (McKinnell, 1962). Аналогичный результат был получен на мышах, где ядра из линии клеток медуллобластомы смогли обусловить, хотя и с низкой эффективностью, раннее развитие, в результате чего были получены эмбрионы с задержкой дальнейшего развития (Li et al., 2003). Однако эти эксперименты не были однозначной демонстрацией того, что эти клоны были получены из раковых клеток, а не из загрязняющих культуру нетрансформированных клеток. Когда ядра целого ряда опухолевых клеток, в том числе клеток лейкемии, лимфомы, рака груди и меланомы, пересадили в денуклеированные мышиные яйцеклетки, большинство из них оказались способными поддерживать предимплатационное развитие до стадии нормально выглядящих бластоцист (Hochedlinger et al., 2004). Следовательно, внутриклеточная среда ооцита смогла подавить злокачественный фенотип этих опухолевых клеток и сделать возможным внешне нормальное раннее развитие. Однако лишь геном от модельной меланомы, индуцированной RAS, дал начало линии клонированных клеток ES, способных дифференцироваться в большинство, если не во все линии соматических клеток в химерных мышах. Тем не менее, из-за генетических изменений, имевшихся в донорских клетках, у всех этих химер развивался рак. Эти результаты показывали, что раковое ядро после взаимодействия с цитоплазмой яйцеклетки обеспечивало дифференцировку всех линий, показывая тем самым, что злокачественный фенотип этих раковых клеток в основном определялся эпигенетическими изменениями. Другой вывод был сделан из экспериментов по клонированию ядер донорских клеток ЕС. В противоположность ядру соматической раковой клетки злокачественныйфенотип эмбриональных опухолей был обусловлен генетическими изменениями, поскольку его не удавалось обратить экспозицией с цитоплазмой яйцеклетки (Blelloch et al., 2004).4. Изменения, связанные с репрограммированием ядра
Стратегии, используемые в раннем развитии, у амфибий и у млекопитающих очень различаются. Например. дробление эмбриона лягушки проходит быстро, примерно по 30 минут на каждый клеточный цикл, в противоположность эмбриону млекопитающих, который проходит всего лишь одно деление дробления за 24 часа после оплодотворения. Кроме того, зиготический геном лягушки начинает экспрессироваться лишь спустя 12 митотических циклов, на переходе к средней бластуле, в противоположность геному мышиного эмбриона, активирующемуся на 2-клеточной стадии. Таким образом, можно не удивляться тому, что эти различные стратегии развития, используемые у амфибий и млекопитающих, влияют и на репрограммирование соматического донорского ядра. В этой главе эпигенетическое репрограммирование, имеющее место в нормальном развитии, сопоставляется с репрограммированием у клонов лягушек и млекопитающих. Интересный вопрос заключается в том, влияет ли эпигенетическое состояние соматического донорского ядра на картину экспрессии генов у клонированных эмбрионов. Это называется «эпигенетической памятью» и будет обсуждаться далее в этой главе.4.1. Амфибии
Репрограммирование в нормальном развитии
У амфибий ядра и хромосомы ооцитов и яйцеклеток находятся в состоянии, совершенно ином, чем ядра и хромосомы соматических клеток. Зародышевый пузырек ооцита содержит максимально расправленные [expanded] хромосомы типа ламповых щеток, очень активные в отношении транскрипции (Callan and Lloyd, 1960), что, очевидно, отражает не только высокую долю транскрибируемых генов, но и плотную упаковку РНК-полимераз на ДНК большинства генов. Это исключительное транскрипционное состояние достигается во время раннего оогенеза и вероятно продолжается в яичнике на протяжении всей жизни взрослой самки. Зрелые спермин, напротив, максимально конденсированы и полностью неактивны в отношении транскрипции. Обычные гистоны хромосом в сперме заменены протаминами, которые обмениваются в ядрах спермиев, которые входят в яйцеклетку при оплодотворении, и ядра спермиев претерпевают необычайно быструю деконденсацию приблизительно за 20 минут. У амфибий отсутствуют процессы, эквивалентные инактивации Х-хромосомы и импринтингу, которые имеют место у млекопитающих Снижение уровня метилирования ДНК имеет место в период от оплодотворения до перехода к средней бластуле (5 часов), после чего этот уровень постепенно повышается по мере развития (Meehan, 2003). Резюмируя, можно сказать, что в нормальном развитии во время гаметогенеза и в течение нескольких часов непосредственно после оплодотворения имеют место существенные события репрограммирования ядра. Наиболее очевидным изменением, которое претерпевают трансплантированные ядра у амфибий, является увеличение объема и дисперсия хроматина. В ядрах эмбриональных клеток это происходит быстрее, чем в ядрах дифференцированных илц взрослых клеток. Во всех отношениях эти трансплантированные ядра в конце концов принимают состояние ядер, присутствующих в яйцеклетках или ооцитах в норме. После трансплантации ядра наступают также изменения в синтезе нуклеиновых кислот. В ядрах неделящихся клеток, таких как клетки мозга взрослых животных, яйцеклетки быстро индуцируют синтез ДНК. Эмбрионы-трансплантаты, полученные в результате пересадок одиночных ядер в яйцеклетки, синтезируют рибосомную РНК и тРНК в такой же степени, что и эндогенные ядра эмбрионов, выращенных из оплодотворенных яиц. Картина транскрипции генов изменяется от характерной для донорских клеток к свойственной ранним эмбрионам; например, вся генная транскрипция выключается во время дробления эмбрионов-трансплантатов и затем реактивируется у выживших трансплантатов в соответствии с клеточным гипом. Мышечные гены экспрессируются в мышцах эмбрионов-трансплантатов даже в том случае, если они получены от ядер кишечника (Gurdon et al., 1984). В случае пересадок ядер в ооциты в трансплантированных ядрах имеют место обширные изменения в транскрипции без какой-либо репликации ДНК. Например, у Xenopus ядра из клеток почки подавляют гены, специфичные для почки, и активируют гены, специфичные для ооцита. Некоторые из этих заново активированных генов специфичны для эмбриона, как и в случае ядер тимуса мыши, которые экспрессируют маркерный для стволовых клеток ген Oct-4, но подавляют активность специфичного для тимуса гена Thy-1 (Byrne et al., 2003). В заключение можно сказать, что у амфибий при пересадках ядер в яйцеклетки или ооциты наблюдается обширное репрограммирование транскрипции генов, так что ядра соматических клеток (и. в случае яйцеклеток, их митотическое потомство) изменяют свою транскрипцию в соответствии с транскрипцией клетки-реципиента.Репрограммирование в клонах
С давних пор думали, что наиболее вероятное объяснение возрастающей доли связанных с развитием аномалий, наблюдаемой в экспериментах с пересадкой ядер у амфибий, связано с неполной репликацией ДНК. При нормальном развитии Xenopus пронуклеусы яйцеклетки и спермия начинают удвоение хромосом спустя 20 минут после оплодотворения, и оно завершается 20 минутами позже. В противоположность этому ядрам делящихся клеток в культуре требуется около 6 часов для завершения одного раунда репликации ДНК. Неудивительно поэтому, что часто можно наблюдать продолжение синтеза ДНК пересаженными ядрами соматических клеток гораздо дольше 40 минут после инъекции ядра — вплоть до начала конденсации хромосом для первого митоза. В результате репликция хромосом может быть неполной, и неполностью реплицированные хромосомы разрываются на части, когда трансплантированные ядра вынуждены вступать в свой первый митоз. Фрагменты разорванных хромосом наблюдали в эмбрионах, полученных в результате пересадки ядер (Di Berardino and Hoffner, 1970), и эта несовместимость между скоростью репликации ДНК и клеточного деления в зиготе по сравнению с соматическими ядрами, приводящая к анеуплоидии, по-видимому, скорее всего объясняет многие аномалии развития эмбрионов, полученных путем пересадки ядер, и в особенности высокую долю яйцеклеток, вообще неспособных пройти регулярное дробление; эти последние могут составить до 75 % всех яиц, получивших ядра от неделящихся дифференцированных клеток. Было отмечено, что серийные пересадки ядер из частично дробящихся эмбрионов, полученных в результате первой пересадки, часто дают нормальное развитие головастиков (см. выше). Это хорошо объясняется тем, что инкубация ядер соматических клеток в экстракте из яйцеклеток, находящихся в фазе митоза, значительно увеличивает число сайтов начала репликации ДНК, тем самым давая таким ядрам возможность завершить репликацию хромосом быстрее, чем это могут ядра из таких терминально дифференцированных клеток, как эритроциты (Lemaitre et al., 2005). Два других предположения могут помочь объяснить аномалии ядерных трансплантатов, которые возникают после начала зиготической транскрипции при переходе к средней бластуле. Первое связано с количественной нерегулярностью активации ранних зиготических генов (Byrne et al., 2003), а второе — с сохранением специфичной для донора экспрессии генов в некорректной зародышевой линии эмбрионов-трансплантатов (см. ниже). Однако не было показано, что эти отличия от нормальной экспрессии генов прямо отвечают за наблюдаемые аномалии развития.Механизмы репрограммирования
Большие количества и крупные размеры яиц и ооцитов амфибий вдохновили исследователей на попытки понять молекулярные основы репрограммирования. Наиболее предпочтительным путем было получение бесклеточных экстрактов, с помощью которых можно было бы воспроизвести in vitro события, происходящие после пересадки ядер в живые яйцеклетки и ооциты. Последовательное обеднение этих экстрактов могло бы позволить идентифицировать необходимые компоненты. Этот подход оказался особенно успешным при идентификации компонентов яйцеклетки, инициирующих синтез ДНК. В особенности можно отметить идентификацию нуклеоплазмина (Laskey etal., 1978; Philpott et al., 1991), присутствующего в больших количествах компонента яйцеклетки Xenopus, который может деконденсировать спермий и стимулировать обмен гистоновых белков. Такие же процессы имеют место, когда соматические ядра добавляются в экстракты из яйцеклеток (Dimitrov and Wolffe, 1996; Tamada et al., 2006). Другие компоненты экстракта яйцеклеток, возможно вносящие вклад в процесс репрограммирования ядра, включают комплекс ремоделинга ISW1 (Kikyo et al., 2000) и белки зародышевой клетки ERGY2, функция которых — обратимая разборка ядрышек (Gonda et al, 2003). Было высказано предположение, что ремоделирующий комплекс BRG-1 может играть роль в яйцеклетках и у ранних эмбрионов путем пермеабилизации и ресилинга [by permeabilizing and resealing] ядер в экстрактах (Hansis et al., 2004). Эти опыты трудно интерпретировать, потому что пока еще не известно, чтобы бесклеточные экстракты были способны инициировать транскрипцию ядер. Поэтому лучшее, что можно сделать, — это воздействовать на ядра in vitro и затем пересадить их в живой ооцит, чтобы испытать на транскрипцию (Byrne et al., 2003; Tamada et al., 2006). В настоящее время представляется, что для успешного репрограммирования ядер необходимы три этапа: (1) удаление эпигенетических меток на ДНК или белках, которые характеризуют данное дифференцированное состояние; (2) обеспечение транскрипционными факторами, необходимыми для тех генов, которые должны быть заново экспрессированы; и (3) деконденсация хроматина для того, чтобы транскрипционные факторы получили доступ к генам, на которые они действуют.4.2. Млекопитающие
Последовательное эпигенетическое репрограммирование является важным аспектом нормального развития (Rideout et al., 2001). В ходе гаметогенеза на два родительских генома последовательно накладываются изменения метилирования ДНК, а также гистонов. После оплодотворения геном эмбриона модифицируется далее в ходе дробления и после имплантации. В табл. 22.3 дается сводка данных о некоторых эпигенетических отличиях клонированных животных от нормальных, которые возникают в результате ошибочного репрограммирования. Для последующего обсуждения мы подчеркиваем эти эпигенетические различия между эмбрионами, полученными в результате нормального оплодотворения и клонирования, на разных стадиях развития. Стадии развития, указанные в табл. 22.3 и обсуждаемые по порядку, — это (1) гаметогенез, (2) дробление, (3) постимплантация и (4) постнатальное развитие.Гаметогенез
Наиболее важное эпигенетическое репрограммирование в нормальном развитии происходит во время гаметогенеза — процесса, который делает и геном спермия, и геном ооцита «эпигенетически компетентными» для последующего оплодотворения и для надежной активации генов, критичных для раннего развития (Latham et al., 1999). При клонировании этот процесс сокращается, и большинство проблем, затрагивающих «нормальность» клонированных животных, может быть связано с неадекватным репрограммированием соматического ядра после трансплантации в яйцеклетку. Поскольку плацента развивается из трофоэктодермальной линии, составляющей первый дифференцированный тип клеток эмбриона, можно было бы предположить, что у большинства клонированных животных репрограммирование и дифференцировка в эту раннюю клеточную линию нарушены. Действительно. как подытожено ниже, доля аномально экспрессируемых генов у клонированных новорожденных животных существенно выше в плаценте по сравнению с соматическими тканями.Дробление
В ходе дробления проходящая по всему геному волна деметилирования удаляет эпигенетические модификации, присутствующие в зиготе, так что ДНК бластописты в основном лишена метилирования. Между имплантацией и гаструляцией волна глобального метилирования de novo заново устанавливает общую картину метилирования, которая затем поддерживается на протяжении всей жизни в соматических клетках данного животного. У клонированных эмбрионов метилирование повторяющихся последовательностей является ненормальным (Bourc’his et al., 2001; Dean et al., 2001; Kang et al., 2003; Mann et al., 2003). Чтобы исследовать экспрессию генов, активность таких «генов плюрипотентности», как Oct-4, которые «молчат» в соматических клетках, но активны в эмбриональных клетках, была изучена у клонированных эмбрионов. Удивительно, но реактивация Oct-4 и «Oct-4-подобных» генов оказалась ошибочной и случайной у большой доли соматических клонов (Boiani et al., 2002; Bortvin et al., 2003). Поскольку эмбрионы без Oct-4 рано останавливаются в развитии, неполная реактивация «Oct-4-подобных» генов у клонов могла быть причиной частой неспособности большей части эмбрионов, полученных в результате пересадки ядер, выжить в постимплантационном периоде. Более того, в ряде исследований обнаружено аномальное метилирование ДНК у клонированных эмбрионов. Хотя остается все еще невыясненным, в какой степени эпигенетическая модификация структуры хроматина и метилирование ДНК, происходящие в нормальном развитии, должны имитироваться при ядерном клонировании, для того чтобы оно было успешным, имеющиеся данные полностью согласуются с представлением о том, что причиной аномальной экспрессии генов у клонированных животных является ошибочное эпигенетическое репрограммирование.Таблица 22.3. Нормальные versus клонированные эмбрионы

Постимплантационное развитие
После имплантации и перед гаструляцией три ключевых события формируют эпигенетическое состояние генома эмбриона: (1) волна глобального метилирования de novo заново устанавливает общую картину метилирования, характерную для взрослого животного и поддерживаемую в дальнейшем в соматических клетках на протяжении всей жизни (Dean et al., 2003); (2) у эмбрионов женского пола выполняется компенсация доз посредством случайной инактивации одной из двух Х-хромосом; (3) теломеры приобретают длину, характерную для соматических клеток. Поскольку все эти события инициируются только у постзиготического эмбриона, у клонированных животных можно ожидать мало нарушений в регуляции этих эпигенетических событий. Тем не менее, у клонированных эмбрионов коровы наблюдали более низкие уровни общего метилирования по сравнению с постнатальными телятами (Cezar et al., 2003). Инактивация Х-хромосомы была случайной и ненарушенной у здоровых, но не у аномальных клонированных эмбрионов мышей (Eggan et al., 2000; Senda et al., 2004: Nolen et al., 2005). Однако неясно, действительно ли эти нарушения являются причиной аномального развития клонов, а не просто следствием аномального репрограммирования в ходе предимплантационного развития. Напротив, коррекция длины теломер у клонированных коров и мышей надежно выполнялась (Lanza et al., 2000; Tian et al., 2000; Wakayama et al., 2000; Betts et al., 2001) и, таким образом, не могла быть причиной нарушенной жизнеспособности клонированных животных.Постнатальное развитие
Самый масштабный анализ экспрессии генов был выполнен на новорожденных клонированных мышах. Профиль экспрессии показал, что 4—5 % всего генома и 30—50 % импринтированных генов аномально экспрессируются в плацентах новорожденных клонированных мышей (Humpherys et al., 2002; Kohda et al., 2005). Это говорит о том, что развитие млекопитающих удивительно толерантно к широко распространенной дисрегуляции и что компенсаторные механизмы обеспечивают выживание некоторых клонированных особей вплоть до рождения. Однако эти результаты заставляют предполагать, что даже выживающие клоны могут иметь легкие дефекты, которые, хотя и не настолько серьезны, чтобы создавать риск для непосредственного выживания, в более позднем возрасте могут послужить причиной возникновения ненормального фенотипа.5. Эпигенетическая память
Известно, что в развитии позвоночных имеют место два рода эпигенетических модификаций генома. Это метилированный цитоцин во многих участках ДНК, где имеется CpG, и разнообразные модификации «хвостов» гистонов. Эти изменения приобретаются в ходе гаметогенеза и раннего развития и тесно связаны с активностью или неактивностью генов. Поэтому можно было ожидать, что эти эпигенетические модификации подвергнутся реверсии в результате пересадки ядра, а если нет, то могут помочь объяснить некоторые дефекты развития эмбрионов, полученных в результате трансплантации ядер. У амфибий некоторое понимание деметилирования ДНК было достигнуто в экспериментах, где ядра соматических клеток млекопитающих были инъецированы в ооциты Xenopus (Simonsson and Gurdon, 2004). Промотор Oct-4 мышей метилирован в клетках взрослого тимуса, где Oct-4 не экспрессируется. Однако, когда ядра тимуса были инъецированы в ооциты, этот промоторный район, но не энхансерный район регуляторной части этого гена, был деметилирован. Этот результат показывает избирательный характер процесса деметилирования. Когда были инъецированы целые ядра, деметилирование ДНК, по-видимому, предшествовало индуцированной транскрипции Oct-4. Весьма вероятно, что активность ДНК-деметилазы является специальным свойством ооцитов (см. выше) и что деметилирование промоторной ДНК репрессированных в развитии генов может также быть важным и необходимым этапом, когда ядра соматических клеток репрограммируются в экспериментах с пересадкой ядер в яйцеклетки. Изменения в модификациях гистонов пока еще не были исследованы в экспериментах по пересадкам ядер у амфибий. Эксперимент по пересадкам ядер у амфибий, поставленный по другой схеме, показал, что реверсия эпигенетического состояния соматических клеток никоим образом не наблюдается всегда. Ввиду невозможности получить ядерных трансплантантов у R. pipiens, даже от клеток-доноров с ранней стадии хвостовой почки (см выше), Бриггс и Кинг (Briggs and King, 1957) задались вопросом, не отражает ли морфология аномальных эмбрионов их происхождение; они описали предпочтительное выживание эндодермальных тканей у эмбрионов эндодермального ядерного происхождения и назвали это «эндодермальным синдромом». Указывалось, однако, что эндодерма дифференцируется позже, чем другие зародышевые листки, и что этим можно было бы объяснить ее лучшее выживание (Gurdon, 1963). Действительно, Симнет (Simnet, 1964) сообщил, что эмбрионы-трансплантаты нейрального происхождения также обнаруживали такое же предпочтительное выживание их эндодермы. Тот же вопрос недавно был снова исследован с использованием специфичных для клеточного типа маркерных генов. В этих опытах (Ng and Gurdon, 2005) ядра из клеток нейроэктодермы или эндодермы, уже экспрессирующих специфичные для клеточного типа маркеры Sox2 или эндодермин, соответственно, трансплантировали в денуклеированные яйцеклетки; получившиеся в результате эмбрионы-трансплантанты были разделены на нейроэктодермальную или эндодермальную части, и эти части были протестированы на те же маркеры, Sox2 или эндодермин (рис. 22.8 и табл. 22.4). Оказалось, что оба гена преимущественно экспрессировались в клетках «не своего» типа. Например, более половины эмбрионов нейроэктодермального происхождения обнаружили суперэкспрессию нейрального маркера Sox2 в своих эктодермальных клетках. У некоторых клонированных эмбрионов не было снижения уровня экспрессии гена Sox2 по сравнению с уровнем донорских клеток. Трансплантированные ядра, как и ядра нормальных эмбрионов, были совершенно неактивными в отношении транскрипции вплоть до стадии бластулы. Следовательно, как это ни удивительно, активное состояние генной транскрипции, установившееся в ходе клеточной дифференцировки, может поддерживаться в клонированных эмбрионах при полном отсутствии условий, которые индуцировали этот ген на протяжении более 12 митотических клеточных делений (от яйцеклетки до бластулы). Этот поразительный пример эпигенетической памяти наблюдается лишь у некоторых эмбрионов-трансплантатов, но полностью отсутствует у других, у которых экспрессия гена была успешно репрограммирована. Рис. 22.8. Схема эксперимента по тестированию эпигенетической памяти об экспрессии генов, специфичной для данного клеточного типа
Донорские ядра берутся из клеток эндодермы (стадия 21) или нейроэктодермы (стадия 26). Получающиеся в результате пересадки ядер эмбрионы обычно формируют частичную бластулу, нормально дробившиеся части которой разделяют на будущие нейроэктодермальные или эндодермальные участки и анализируют по экспрессии генов. См. табл. 22.4 (перепечатано, с любезного разрешения, из Ng and Gurdon, 2005)
Рис. 22.8. Схема эксперимента по тестированию эпигенетической памяти об экспрессии генов, специфичной для данного клеточного типа
Донорские ядра берутся из клеток эндодермы (стадия 21) или нейроэктодермы (стадия 26). Получающиеся в результате пересадки ядер эмбрионы обычно формируют частичную бластулу, нормально дробившиеся части которой разделяют на будущие нейроэктодермальные или эндодермальные участки и анализируют по экспрессии генов. См. табл. 22.4 (перепечатано, с любезного разрешения, из Ng and Gurdon, 2005)
Табл. 22.4. Эпигенетическая память о клеточно-специфичной экспрессии генов
 В процентах представлена доля эмбрионов, полученных путем трансплантации ядер (каждый тестировался методом RT-PCR индивидуально), экспрессирующих гены Edd и Sox2 в два и более раза интенсивней нормального (или фонового) уровня (данные из NG and Gurdon, 2005)
В процентах представлена доля эмбрионов, полученных путем трансплантации ядер (каждый тестировался методом RT-PCR индивидуально), экспрессирующих гены Edd и Sox2 в два и более раза интенсивней нормального (или фонового) уровня (данные из NG and Gurdon, 2005)
6. Значение ядерной трансплантации для медицины
Важно различать «репродуктивное клонирование» и «терапию с помощью трансплантации ядер» (называемую также SCNT, или терапевтическое клонирование). При репродуктивном клонировании путем пересадки соматического ядра в денуклеированную яйцеклетку получают эмбрион с целью создать клонированную особь. Напротив, целью терапии с помощью трансплантации ядер является получение линии эмбриональных стволовых клеток (обозначаемых как клетки ntES), «скроенных» для нужд пациента, послужившего донором ядер (Hochedlinger and Jaenisch, 2003). Клетки ntES могли бы быть использованы как источник функциональных клеток, пригодных для лечения соответствующего заболевания путем трансплантации. На рис. 22.9 сопоставляются нормальное развитие из оплодотворенного эмбриона, репродуктивное клонирование и терапевтическое клонирование.6.1. Репродуктивное клонирование
Как представлено выше, все данные, полученные в экспериментах по клонированию восьми разных видов млекопитающих, показывают, что получение нормальных особей с помощью пересадки ядер сталкивается с несколькими важными препятствиями. В общественных дебатах ключевым вопросом является вопрос о том, будет ли когда-нибудь возможно путем ядерного клонирования получить нормальную особь. Имеющиеся данные заставляют предполагать, что получение нормальных клонов может оказаться затруднительным, если не невозможным, по следующим причинам: (1) Как подытожено выше, все проанализированные клоны при рождении обнаруживают дисрегуляцию сотен генов. Тем не менее, развитие клонов до рождения и далее, несмотря на широко распространенные эпигенетические аномалии, позволяет предполагать, что развитие млекопитающих способно выдерживать дисрегуляцию многих генов. (2) Некоторые клоны выживают до взрослого состояния за счет компенсации дисрегуляции генов. Хотя эта «компенсация» обеспечивает выживание, она не может предотвратить возникновение расстройств, проявляющихся в более позднем возрасте. Следовательно, можно ожидать, что большинство клонов, если не все, будут иметь по крайней мере легкие аномалии, которые могут быть не настолько серьезными, чтобы проявиться в виде очевидного фенотипа при рождении, но вызовут серьезные проблемы в последующем, как это видно у стареющих мышей. Разные клоны могут различаться по степени аномальной экспрессии генов: если ключевые «Oct-4-подобные» гены не активируются, клоны погибают немедленно после имплантации. Если же эти гены активированы, клон может выжить до момента рождения и дольше. Эти соображения показывают, что клонированные животные, даже если при поверхностном обследовании они выглядят «нормальными», могут не быть таковыми, но обладать слабыми аномалиями, которые фенотипически проявятся лишь в более позднем возрасте (Jaenisch, 2004). Эти соображения не позволяют рассматривать этот подход как потенциальную репродуктивную технологию у человека. Рис. 22.9. Сравнение нормального развития с «репродуктивным клонированием» и «терапевтическим клонированием»
Во время нормального развития (слева) гаплоидная (In) клетка спермия оплодотворяет гаплоидный ооцит, в результате чего формируется диплоидная (2п) зигота, которая подвергается дроблению и становится зародышем-бластопистой. Бластописты, имплантированные в матку, в конечном счете дают начало новорожденным животным. В ходе «репродуктивного клонирования» (в центре) диплоидное ядро донорской клетки взрослого животного вводится в денуклеированный репипиентный ооцит. который, после искусственной активации, делится и превращается в клонированную бластоцисту. После пересадки суррогатным матерям некоторые из этих клонированных бластопист дают начало новорожденному клону. В противоположность этому, получение клеток ntES с помощью пересадки ядер (справа) требует эксплантации клонированных бластоцист в культуру для получения линии клеток ES, которая может дифференцироваться in vitro в клетки потенциально любого типа, входящие в состав тела, и использоваться для исследовательских или терапевтических целей (перепечатано, с любезного разрешения, из Hochedlinger and Jaenisch, 2003 [© Massachusetts Medical Society])
Рис. 22.9. Сравнение нормального развития с «репродуктивным клонированием» и «терапевтическим клонированием»
Во время нормального развития (слева) гаплоидная (In) клетка спермия оплодотворяет гаплоидный ооцит, в результате чего формируется диплоидная (2п) зигота, которая подвергается дроблению и становится зародышем-бластопистой. Бластописты, имплантированные в матку, в конечном счете дают начало новорожденным животным. В ходе «репродуктивного клонирования» (в центре) диплоидное ядро донорской клетки взрослого животного вводится в денуклеированный репипиентный ооцит. который, после искусственной активации, делится и превращается в клонированную бластоцисту. После пересадки суррогатным матерям некоторые из этих клонированных бластопист дают начало новорожденному клону. В противоположность этому, получение клеток ntES с помощью пересадки ядер (справа) требует эксплантации клонированных бластоцист в культуру для получения линии клеток ES, которая может дифференцироваться in vitro в клетки потенциально любого типа, входящие в состав тела, и использоваться для исследовательских или терапевтических целей (перепечатано, с любезного разрешения, из Hochedlinger and Jaenisch, 2003 [© Massachusetts Medical Society])
6.2. Применение ядерной трансплантации в терапии
Иммунное отторжение — частое осложнение при трансплантациях аллогенных органов, обусловленное иммунологической несовместимостью. Для лечения этой болезни «хозяин против прививки» реципиентам с трансплантатами обычно дают лекарства-иммунодепрессанты, что дает серьезные побочные эффекты. Эмбриональные стволовые клетки, полученные с помощью трансплантации ядер, генетически идентичны клеткам пациента, устраняя, таким образом, риск иммунной реакции и потребность в подавлении иммунитета. Что особенно важно, разрабатываются протоколы, позволяющие получать такие функциональные клетки, как нейроны, мышечные клетки и островковые клетки, которые можно использовать для лечения пациентов, страдающих такими серьезными нарушениями, как болезнь Паркинсона, сердечная недостаточность или диабет. Более того, эмбриональные стволовые клетки обеспечивают возобновляемый источник замещения тканей, позволяя проводить повторное лечение, когда это необходимо. Действительно, осуществимость терапевтического клонирования была продемонстрирована на животных моделях болезней. Для этого в качестве «пациента» был использован штамм мышей, несущих делецию гена Rag2 (Rideout et al., 2002). Мыши, мутантные по Rag2. страдали серьезной комбинированной иммунной недостаточностью (SCID) из-за мутации в гене, катализирующем перестройки иммунорецептора в лимфоцитах. У этих мышей не было зрелых В- и Т-клеток, и это состояние было похоже на заболевание у человека («bubble babies»). На рис. 22.10 суммированы этапы этого эксперимента. На первом этапе ядра соматических донорских клеток (фибробластов) из хвостов дефектных по Rag2 мышей инъецировали в денуклеированные яйцеклетки Получившиеся в результате эмбрионы культивировали до стадии бластоцисты и изолировали аутологичные клетки ES. Затем одна из мутантных аллелей Rag2 была «сделана мишенью» для восстановления нормальной структуры гена с помощью гомологичной рекомбинации в клетках ES Чтобы получить соматические клетки для лечения, эти клетки ES были дифференцированы в эмбриоидные тела (эмбриоподобные структуры, содержащие различные типы соматических клеток) и далее в предшественники гематопоэза путем экспрессии НохВ4. Получившиеся в результате предшественники гематопоэза трансплантировали облученным животным, дефектным по Rag2, для лечения заболевания. Эти клетки генерировали функциональные В- и Т-клетки, которые проделали соответствующие перестройки своих аллелей иммуноглобулина и Т-клеточного рецептора, как и сывороточных иммуноглобулинов, в трансплантных мышах Rag2. Этот эксперимент продемонстрировал, что пересадку ядер, в сочетании с генной терапией, можно использовать для лечения генетических нарушений. Следовательно, терапевтическое клонирование должно быть применимо и в случае других заболеваний с известным генетическим дефектом, таких как серповидноклеточная анемия или бета-талассемия. Нерешенным остается вопрос, будет ли трансплантация ядер у человека столь же эффективной, как у коров, или такой же неэффективной, как у мышей. Рис. 22.10. Схема терпевтического клонирования в сочетании с генной и клеточной терапией
Культивировали кусочек хвоста от мыши, гомозиготной по мутации активирующего рекомбинацию гена 2 (Rag2). Когда выросли фибробластоподобные клетки, они были использованы в качестве доноров для пересадки ядер путем прямой инъекции в денуклеированные ооциты MII с помощью микроманипулятора с пьезоэлектрическим управлением. Эмбриональные стволовые (ES) клетки, изолированные из полученных пересадкой ядер бластоцист, были генетически репарированы методом гомологичной рекомбинации. После репарации клетки ntES были дифференцированы in vitro в эмбриоидные тела (EBs), инфецированы ретровирусом HoxB4iGFP. размножены и инъецированы в хвостовую вену облученных, дефектных по Rag2 мышей (перепечатано, с любезного разрешения, из Hochedlinger and Jaenisch, 2003 [© Massachusetts Medical Society])
Рис. 22.10. Схема терпевтического клонирования в сочетании с генной и клеточной терапией
Культивировали кусочек хвоста от мыши, гомозиготной по мутации активирующего рекомбинацию гена 2 (Rag2). Когда выросли фибробластоподобные клетки, они были использованы в качестве доноров для пересадки ядер путем прямой инъекции в денуклеированные ооциты MII с помощью микроманипулятора с пьезоэлектрическим управлением. Эмбриональные стволовые (ES) клетки, изолированные из полученных пересадкой ядер бластоцист, были генетически репарированы методом гомологичной рекомбинации. После репарации клетки ntES были дифференцированы in vitro в эмбриоидные тела (EBs), инфецированы ретровирусом HoxB4iGFP. размножены и инъецированы в хвостовую вену облученных, дефектных по Rag2 мышей (перепечатано, с любезного разрешения, из Hochedlinger and Jaenisch, 2003 [© Massachusetts Medical Society])
Использование ящерного клонирования для получения «заказных» [«customized»] клеток ES для восстановления тканей вызывает противоречивые оценки, поскольку, как утверждают его противники, само получение клеток ES с необходимостью было бы связано с разрушением потенциального человеческого существа. В качестве возможного решения этой этической дилеммы была предложена измененная пересадка ядра (ANT, altered nuclear transfer) как модификация обычной процедуры пересадки ядра (Hurlbut, 2005). ANT включает инактивацию гена в соматических донорских клетках, который необходим для развития плаценты, и тем самым предотвращает образование плода, поскольку ANT-бластоциста была бы не способна к имплантации (и, таким образом, не разрушалась бы никакая потенциальная человеческая жизнь), но все еще позволяла бы получать «заказные» ES-клетки. Используя Cdx2 в качестве гена-мишени, провели эксперимент на мышах по принципиальной проверке этого подхода, ANT (Meissner and Jaenisch, 2006). Остается посмотреть, удовлетворит ли эта модификация ANT тех, кто возражает против получения клеток ES из клонированных бластоцист человека.
6.3. Репродуктивное versus терапевтическое клонирование: в чем разница?
Почемы ошибочное репрограммирование порождает столько проблем для репродуктивного клонирования, но не для терапевтических приложений? Наиболее важная причина этого кажущегося парадокса заключается в том, что, в отличие от репродуктивного клонирования, использование ядерных пересадок для целей терапии не требует формирования плода, основываясь вместо этого на прямой дифференцировке функциональных клеток в культуре. Поскольку нет потребности в развитии плода, не следует ожидать, что функциональность дифференцированных клеток, получающихся в результате этого процесса, будет затронута нарушенным импринтингом, который в значительной мере определяет неспособность клонов к развитию (Jaenisch, 2004). Поскольку клетки ES, полученные из оплодотворенных эмбрионов, способны участвовать в формировании всех нормальных эмбриональных тканей, клетки ES, полученные с помощью пересадки ядер, должны обладать такой же способностью генерировать полный спектр нормальных тканей. Действительно, все имеющиеся данные согласуются с выводом о том, что клетки ES, полученные из клонированных эмбрионов, биологически и молекулярно неотличимы от клеток ES, полученных из оплодотворенных эмбрионов (Brambrink et al., 2006). Таким образом, если человеческие клетки ES, полученные из IVF-эмбрионов, пригодны для лечения болезней, то это же относится и к «заказным» клеткам ES, полученным с помощью ядерного клонирования из клеток пациента.Литература
Betts D., Bordignon V, Hill J., Winger Q., Westhusin M., Smith L., and King W., 2001. Reprogramming of telomerase activity and rebuilding of telomere length in cloned cattle. Proc. Natl. Acad. Sci. 98: 1077-1082. Blelloch R.H., Hochedlinger K., Yamada Y., Brennan C., Kim M., Mintz B., Chin L., and Jaenisch R., 2004. Nuclear cloning of embryonal carcinoma cells. Proc. Natl. Acad. Sci. 101: 13985-13990. Boiani M., Eckardt S., Scholer H.R., and McLaughlin K.J., 2002. Oct4 distribution and level in mouse clones: Consequences for pluripotency. Genes Dev. 16: 1209-1219. Bolton V.N., Oades P.J., and Johnson M.H. 1984. The relationship between cleavage, DNA replication, and gene expression in the mouse 2-cell embryo. J. Embryol. Exp. Morphol. 79: 139-163. Bortvin A., Eggan K., Skaletsky H., Akutsu H., Berry D.L., Yanagi-machi R., Page D.C., and Jaenisch R., 2003. Incomplete reactivation of Ocr4-related genes in mouse embryos cloned from somatic nuclei. Development 130: 1673-1680. Bourc’his D., Le Bourhis D., Patin D., Niveleau A., Comizzoli P., Renard J.P., and Viegas-Pequignot E., 2001. Delayed and incomplete reprogramming of chromosome methylation patterns in bovine cloned embryos. Curr. Biol. 11: 1542-1546. Brambrink T., Hochedlinger K., Bell C., and Jaenisch R., 2006. ES cells derived from cloned and fertilized blastocysts are transcriptionally and functionally indistinguishable. Proc. Natl. Acad. Sci. 103: 933-938. Briggs R. and King T.J., 1952. Transplantation of living nuclei from blastula cells into enucleated frogs’ eggs. Proc. Natl. Acad. Sci. 38: 455-463. Briggs R. and King T.J., 1957. Changes in the nuclei of differentiating endoderm cells as revealed by nuclear transplantation. J. Morphol. 100: 269-312. Bromhall J.D.. 1975. Nuclear transplantation in the rabbit egg. Nature 258: 719-722. Byrne J.A., Simonsson S., Western P.S., and Gurdon J.B., 2003. Nuclei of adult mammalian somatic cells are directly reprogrammed to oct-4 stem cell gene expression by amphibian oocytes. Curr Biol. 13: 1206-1213. Calarco P.G. and McLaren A., 1976. Ultrastructural observations of preimplantation stages of the sheep. J. Embryol. Exp. Morphol. 36: 609-622. Callan H.G. and Lloyd L.. 1960. Lampbrush chromosomes of crested newts Triturus cristatus (Laurenti). Philos. Trans. R. Soc. Lond. B Biol. Sci. 243: 135-219. Camous S., Kopecny V., and Flechon J.E., 1986. Autoradiographic detection of the earliest stage of [3H]-uridine incorporation into the cow embryo. Biol. Cell 58: 195-200. Campbell K.H., Loi P., Otaegui P.J., and Wilmut I., 1996a. Cell cycle coordination in embryo cloning by nuclear transfer. Rev. Reprod. 1: 40-46. Campbell K.H., McWhir J., Ritchie W.A., and Wilmut I., 1996b. Sheep cloned by nuclear transfer from a cultured cell line. Nature 380: 64-66. Campbell K.H., Alberio R., Choi 1., Fisher P., Kelly R.D., Lee J.H., and Maalouf W., 2005. Cloning: Eight years after Dolly. Reprod. Domest. Anim. 40: 256-268. Cezar G.G., Bartolomei M.S., Forsberg E.J., First N.L., Bishop M.D., and Eilertsen K.J., 2003. Genome-wide epigenetic alterations in cloned bovine fetuses. Biol. Reprod. 68: 1009-1014. Cibelli J.B., Stice S.L., Golueke P.J., Kane J.J., Jerry J., Blackwell C., Ponce de Leon F.A., and Robl J.M., 1998. Cloned transgenic calves produced from nonquiescent fetal fibroblasts. Science 280: 1256-1258. Dean W., Santos R., and Reik W., 2003. Epigenetic reprogramming in early mammalian development and following somatic nuclear transfer. Semin. Cell Dev. Biol. 14: 93-100. Dean W., Santos R., Stojkovic M., Zakhartchenko V., Walter J., Wolf E., and Reik W., 2001. Conservation of methylation reprogramming in mammalian development: Aberrant reprogramming in cloned embryos. Proc. Natl. Acad. Sci. 98: 13734-13738. Di Berardino M.A. and Hoffner N., 1970. Origin of chromosomal abnormalities in nuclear transplants—A reevaluation of nuclear differentiation and nuclear equivalence in amphibians. Dev. Biol. 23: 185-209. Dimitrov S. and Wolffe A.P., 1996. Remodeling somatic nuclei inXe-nopus laevis egg extracts: Molecular mechanisms for the selective release of histones H1 and H1° from chromatin and the acquisition of transcriptional competence. EMBO J. 15: 5897-5906. Eggan K., Akutsu H., Hochedlinger K., Rideout W., Yanagimachi R., and Jaenisch R., 2000. X-Chromosome inactivation in cloned mouse embryos. Science 290: 1578-1581. Eggan K., Akutsu H., Loring J., Jackson-Grusby L., Klemm M., Rideout W.M., III, Yanagimachi R., and Jaenisch R., 2001. Hybrid vigor, fetal overgrowth, and viability of mice derived by nuclear cloning and tetraploid embryo complementation. Proc. Natl. Acad. Sci. 98: 6209-6214. Eggan K., Baldwin K., Tackett M., Osborne J., Gogos J.. Chess A., Axel R., and Jaenisch R., 2004. Mice cloned from olfactory sensory neurons. Nature 428: 44-49. Fischberg M., Gurdon J.B., and Elsdale T.R., 1958. Nuclear transplantation in Xenopus laevis. Nature 181: 424. Gonda K., Fowler J., Katoku-Kikyo N., Haroldson J., Wudel J., and Kikyo N., 2003. Reversible disassembly of somatic nucleoli by the germ cell proteins FRGY2a and FRGY2b. Nat. Cell Biol. 5: 205-210. Gurdon J.B., 1960. The developmental capacity of nuclei taken from differentiating endoderm cells of Xenopus laevis. J. Embryol. Exp. Morphol. 8: 505-526. Gurdon J.B., 1962. The developmental capacity of nuclei taken from intestinal epithelium cells offeeding tadpoles./. Embryol Exp. Morphol. 10: 622-640. Gurdon J.B., 1963. Nuclear transplantation in Amphibia and the importance of stable nuclear changes in cellular differentiation. Q. Rev.Biol. 38: 54-78. Gurdon J.B., 1964. The transplantation of living cell nuclei. Adv. Morphog. 4: 1-43. Gurdon J.B. and Uehlinger V., 1966. “Fertile” intestine nuclei. Nature 210: 1240-1241. Gurdon J.B., Elsdale T.R., and Fischberg M., 1958. Sexually mature individuals of Xenopus laevis from the transplantation of single somatic nuclei. Nature 182: 64-65 Gurdon J.B., Brennan S., Fairman S., and Mohun T.J., 1984. Transcription of muscle-specific actin genes in early Xenopus development: Nuclear transplantation and cell dissociation. Cell 38: 691-700. Hansis C., Barreto G.. Maltry N., and Niehrs C., 2004. Nuclear reprogramming of human somatic cells by Xenopus egg extract requires BRG1. Curr. Biol. 14: 1475-1480. Hill J.R., Burghardt R.C., Jones K., Long C.R., Looney C.R., Shin T., Spencer T.E., Thompson J.A., Winger Q.A., and Westhusin M.E., 2000. Evidence for placental abnormality as the major cause of mortality in first-trimester somatic cell cloned bovine fetuses. Biol. Reprod. 63: 1787-1794. Hochedlinger K. and Jaenisch R., 2002. Monoclonal mice generated by nuclear transfer from mature B and T donor cells. Nature 415: 1035-1038. Hochedlinger K. and Jaenisch R., 2003. Nuclear transplantation, embryonic stem cells, and the potential for cell therapy. N. Engl. J. Med. 349: 275-286. Hochedlinger K., Blelloch R., Brennan C., Yamada Y., Kim M., Chin L., and Jaenisch R., 2004. Reprogramming of a melanoma genome by nuclear transplantation. Genes Dev. 18: 1875-1885. Humpherys D., Eggan K., Akutsu H., Friedman A., Hochedlinger K., Yanagimachi R., Lander E., Golub T.R., and Jaenisch R., 2002. Abnormal gene expression in cloned mice derived from embryonic stem cell and cumulus cell nuclei. Proc. Natl. Acad. Sci. 99: 12889-12894. Humpherys D., Eggan K., Akutsu H., Hochedlinger K., Rideout W., Biniszkiewicz D., Yanagimachi R., and Jaenisch R., 2001. Epigenetic instability in ES cells and cloned mice. Science 293: 95-97. Hurlbut W.B., 2005. Altered nuclear transfer as a morally acceptable means for the procurement of human embryonic stem cells. Perspect. Biol. Med. 48: 211-228. Inoue K., Wakao H., Ogonuki N., Miki H., Seino K., Nambu-Wakao R., Noda S., Miyoshi H., Koseki H., Taniguchi M., and Ogura A., 2005. Generation of cloned mice by direct nuclear transfer from natural killer T cells. Curr. Biol. 15: 1114-1118. Jaenisch R., 2004 Human cloning — The science and ethics of nuclear transplantation. N. Engl. J. Med. 351: 2787-2791. Kang Y.K., Lee K.K., and Han Y.M., 2003. Reprogramming DNA methylation in the preimplantation stage: Peeping with Dolly’s eyes. Curr. Opin. Cell Biol. 15: 290-295. Kikyo N., Wade P.A., Guschin D., Ge H., and Wolffe A.P., 2000. Active remodeling of somatic nuclei in egg cytoplasm by the nucleosomal ATPase ISW1. Science 289: 2360-2362. Kohda T., Inoue K., Ogonuki N., Miki H., Naruse M., Kaneko-Ishino T., Ogura A., and Ishino P., 2005. Variation in gene expression and aberrantly regulated chromosome regions in cloned mice. Biol. Reprod. 73: 1302-1311. Lanza R., Cibelli J., Blackwell C., Cristofalo V., Francis M., Baerlocher G., Mak J., Schertzer M., Chavez E., Sawyer N., et al., 2000. Extension of cell life-span and telomere length in animals cloned from senescent somatic cells. Science 288: 665-669. Laskey R.A. and Gurdon J.B., 1970. Genetic content of adult somatic cells tested by nuclear transplantation from cultured cells Nature 228: 1332-1334. Laskey R.A., Honda B.M., Mills A.D., and Finch J.T, 1978. Nu-cleosomes are assembled by an acidic protein which binds his-tones and transfers them to DNA. Nature 275: 416-420. Latham K.E., 1999. Mechanisms and control of embryonic genome activation in mammalian embryos. Int. Rev. Cytol., 193: 71-124. Lemaitre J.M., Danis E., Pasero P., Vassetzky Y., and Mechali M., 2005. Mitotic remodeling of the replicon and chromosome structure. Cell 123: 787-801. Li J., Ishii T., Feinstein P., and Mombaerts P., 2004. Odorant receptor gene choice is reset by nuclear transfer from mouse olfactory sensory neurons. Nature 428: 393-399. Li L., Connelly M.C., Wetmore C., Curran T, and Morgan J.I., 2003. Mouse embryos cloned from brain tumors. Cancer Res. 63: 2733-2736. Mann M.R., Chung Y.G., Nolen L.D., Verona R.I., Latham K.E., and Bartolomei M.S., 2003. Disruption of imprinted gene methylation and expression in cloned preimplantation stage mouse embryos. Biol. Reprod. 69: 902-914. McGrath J. and Solter D., 1984a. Completion of mouse embryo-genesis requires both the maternal and paternal genomes. Cell 37: 179-187. McGrath J. and Solter D., 1984b. Inability of mouse blastomere nuclei transferred to enucleated zygotes to support development in vitro. Science 226: 1317-1319. McKinnell R.G., 1962. Development of Rana pipiens eggs transplanted with Lucke tumor cells. Am. Zool. 2: 430-431. Meehan R.R., 2003. DNA methylation in animal development. Semin. Cell Dev. Biol. 14: 53-65. MeissnerA., 2006. “Conditional RNA interference, altered nuclear transfer and genome-wide DNA methylation analysis.” Ph.D. thesis. University Saarland, Saarbrbcken, Germany. MeissnerA. and Jaenisch R., 2006. Generation of nuclear transfer-derived pluripotent ES cells from cloned Cdx2-deficient blastocysts. Nature 439: 212-215. Ng R.K. and Gurdon J.B., 2005. Epigenetic memory of active gene transcription is inherited through somatic cell nuclear transfer. Proc. Natl. Acad. Sci. 102: 1957-1962. Nolen L.D., Gao S., Han Z., Mann M.R., Gie Chung Y., Otte A.P., Bartolomei M.S., and Latham K.E., 2005. X chromosome reactivation and regulation in cloned embryos. Dev. Biol. 279: 525-540. Ogonuki N., Inoue K., Yamamoto Y., Noguchi Y., Tanemura K., Suzuki O., Nakayama H., Doi K., Ohtomo Y, Satoh M., et al., 2002. Early death of mice cloned from somatic cells. Nat. Genet. 30: 253-254. Ogura A., Inoue K., Ogonuki N., Noguchi A., Takano K., Nagano R., Suzuki O., Lee J., Ishino P., and Matsuda J., 2000. Production of male cloned mice from fresh, cultured, and cryopreserved immature Sertoli cells. Biol. Reprod. 62: 1579-1584. Philpott A., Leno G.H., and Laskey R.A., 1991. Sperm decondensation in Xenopus egg cytoplasm is mediated by nucleoplasmin. Cell 65: 569-578. Prather R.S., Sims M.M., and First N.L., 1989. Nuclear transplantation in early pig embryos. Biol. Reprod. 41: 414-418. Rideout W.M., III, Eggan K., and Jaenisch R., 2001. Nuclear cloning and epigenetic reprogramming of the genome. Science 293: 1093-1098. Rideout W.M., III, Hochedlinger K., Kyba M., Daley G.Q., and Jaenisch R., 2002. Correction of a genetic defect by nuclear transplantation and combined cell and gene therapy. Cell 109: 17-27. Rideout W.M., III, Wakayama T., Wutz A., Eggan K., Jackson-Grusby L., Dausman J., Yanagimachi R., and Jaenisch R., 2000. Generation of mice from wild-type and targeted ES cells by nuclear cloning. Nat. Genet. 24: 109-110. Robi J.M., Prather R., Barnes E., Eyestone W., Northey D., Gilli-gan B., and First N.L., 1987. Nuclear transplantation in bovine embryos. J. Anim. Sci. 64: 642-647. Senda S., Wakayama T., Yamazaki Y., Ohgane J., Hattori N., Tanaka S., Yanagimachi R., and Shiota K., 2004. SkewedX-inactivation in cloned mice. Biochem. Biophys. Res. Commun. 321: 38-44. Simnett J.D., 1964. The development of embryos denved from the transplantation of neural ectoderm cell nuclei in Xenopus laevis. Dev. Biol. 10: 467-486. Simonsson S. and Gurdon J., 2004. DNA demethylation is necessary for the epigenetic reprogramming of somatic cell nuclei. Nat. Cell Biol. 6: 984-990. Surani M.A., Barton S.C., and Noms M.L., 1984. Development of reconstituted mouse eggs suggests imprinting of the genome during gametogenesis. Nature 308: 548-550. Tamada E.L., Van Thuan N., Reed P., Nelson D., Katoku-Kikyo N., Wudel J., Wakayama T., and Kikyo N., 2006. Chromatin decondensation and nuclear reprogramming by nucleoplasmin. Mol. Cell. Biol. 26: 1259-1271. Tamashiro K.L., Wakayama T., Akutsu H., Yamazaki Y., Lachey J.L., Wortman M.D., Seeley R.J., D’Alessio D.A., Woods S.C., Yanagimachi R., and Sakai R.R., 2002. Cloned mice have an obese phenotype not transmitted to their offspring. Nat. Med. 8: 262-267. Tanaka S., Oda M., Toyoshima Y., WakayamaT., Tanaka M., Yoshida N., Hattori N., Ohgane J., Yanagimachi R., and Shiota K., 2001. Placentomegaly in cloned mouse concepti caused by expansion of the spongiotrophoblast layer. Biol. Reprod. 65: 1813-1821. Tian X.C., Xu J., and Yang X., 2000. Normal telomere lengths found in cloned cattle. Nat. Genet. 26: 272-273. Wakayama S., Ohta H., Kishigami S., Van Thuan N., Hikichi T., Mizutani E., Miyake M., and Wakayama T., 2005. Establishment of male and female nuclear transfer embryonic stem cell lines from different mouse strains and tissues. Biol. Reprod. 72: 932-936. Wakayama T. and Yanagimachi R., 1999. Cloning of male mice from adult tail-tip cells. Nat. Genet. 22: 127-128. Wakayama T. and Yanagimachi R., 2001. Mouse cloning with nucleus donor cells of different age and type. Mol. Reprod. Dev. 58: 376-383. Wakayama T., Perry A.C., Zuccotti M., Johnson K.R., and Yanagimachi R., 1998. Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei. Nature 394: 369-374. Wakayama T., Rodriguez 1., Perry A.C, Yanagimachi R., and Mombaerts P., 1999. Mice cloned from embryonic stem cells. Proc. Natl. Acad. Sci. 96: 14984-14989. Wakayama T., Shinkai Y., Tamashiro K.L., Niida H., Blanchard D.C., Blanchard R.J., Ogura A., Tanemura K., Tachibana M., Perry A.C., et al., 2000. Cloning of mice to six generations. Nature 407: 318-319. Wilmut I., Schnieke A.E., McWhir J., Kind A.J., and Campbell K.H., 1997. Viable offspring derived from fetal and adult mammalian cells. Nature 385: 810-813. Young L.E., Sinclair K.D., and Wilmut I., 1998. Large offspring syndrome in cattle and sheep. Rev. Reprod. 3: 155-163.Глава 23. Эпигенетика и болезни человека
 Huda Y. Zoghbi1 и Arthur L. Beaudet2
1 Howard Hughes Medical Institute и
2Department of Molecular and Human Genetics, Baylor College of Medicine, Houston, Texas 77030
Huda Y. Zoghbi1 и Arthur L. Beaudet2
1 Howard Hughes Medical Institute и
2Department of Molecular and Human Genetics, Baylor College of Medicine, Houston, Texas 77030
Общее резюме
Последние два десятилетия мы были свидетелями беспрецедентного успеха в идентификации генетических основ многих болезней человека. Изучение взаимоотношений генотипа и фенотипа бросает вызов клиницистам и исследователям, поскольку некоторые наблюдения не так просто поддаются объяснению.Например, однояйцевые близнецы, несущие мутацию, которая приводит к одному и тому же заболеванию, могут отличаться друг от друга по клиническим показателям. Мутация, передающаяся в семье, представляющей ряд поколений, может вызывать довольно сильно различающиеся заболевания, в зависимости от пола родителя, передающего эту мутацию. Изучение таких необычных случаев вскрыло роль эпигенома (измененной генетической информации, возникшей без изменения в нуклеотидной последовательности ДНК) в вопросах здоровья и болезней. Эти исследования показали, что некоторые области генома млекопитающих функционально неравноценны, в зависимости оттого, представлены ли они материнскими или отцовскими аллелями. У пациентов, наследующих обе гомологичные хромосомы (или их сегменты) от одного и того же родителя (однородительская дисомия — uniparental disomy, UPD), наблюдается потеря экспрессии некоторых генов, которые экспрессируются только в материнских аллелях ( в случае отцовской UPD), и повышение уровня экспрессии отцовских генов. Довольно скоро стало общепризнанным, что UPD, как и измененные ДНК-модификации (эпигенетические мутации, которые могут изменять метилирование ДНК), являются молекулярной основой целого ряда неврологических нарушений и нарушений развития. Интересно, что для многих нарушений такого рода либо эпигенетические, либо генетические мутации могут приводить к одному и тому же фенотипу Это часто происходит потому, что генетические мутации нарушают функцию гена, неправильно регулируемую в тех случаях, когда на данный локус влияют эпигенетические дефекты. В другом классе заболеваний, где генетические мутации вызывают утрату функций белков, участвующих в метилировании ДНК или ремоделинге хроматина, фенотипы возникают в результате изменения эпигенетических состояний в одном или нескольких локусах. Взаимоотношения между геномом и эпигеномом расширили круг типов молекулярных событий, вызывающих заболевания человека. Они могут возникать de novo или быть унаследованными, могут быть генетическими или эпигенетическими и, что особенно интересно, некоторые из них могут быть подвержены влиянию факторов внешней среды. Обнаружение того факта, что внешние факторы, такие как режим питания или «жизненный опыт», изменяют эпигеном (в частности, метилирование ДНК), вероятно дает нам механистическое понимание нарушений с генетической предрасположенностью и сильным влиянием окружающей среды. В число таких нарушений входят дефекты нервной трубки и заболевания, лежащие в сфере психиатрии. Установление внешних факторов, влияющих на эпигеном, внушает надежду на разработку медицинских вмешательств, которые смогут снизить риск нарушений развития раковых заболеваний и нервно-психических расстройств или уменьшить их тяжесть.1. Введение
У двух генетически идентичных однояйцевых близнецов мужского пола, росших в одних и тех же условиях, проявлялись очень разные неврологические функции. Оба близнеца несли одну и ту же мутацию в сцепленном с Х-хромосомой гене адренолейкодистрофии (ALD), однако у одного из близнецов наблюдались: слепота, проблемы с равновесием и утрата миелина в головном мозге — черты, типичные для прогрессирующего и летального неврологического заболевания, тогда как второй близнец оставался здоровым. Вывод исследователей, сообщавших об этой ситуации, был таков: «для разных фенотипов ADL могут быть важны какие-то негенетические факторы» (Korenke et al., 1996). Для 1996 года это был поистине очень важный вывод, при том, что внимание медицинской цитогенетики было сфокусировано на последовательности нуклеотидов ДНК. Если фенотипические вариации нельзя объяснить нуклеотидной последовательностью ДНК, то их можно объяснить внешними факторами. По аналогии с ALD-дискордантными однояйцевыми близнецами, было обнаружено множество однояйцовых близнецов, дискордантных по шизофрении, несмотря на сходные внешние условия, в которых они росли (Petronis, 2004). К счастью, исследования последнего десятилетия окончательно сфокусировали внимание на эпигенетических изменениях (модификациях генетической информации, не затрагивающих последовательность нуклеотидов в ДНК) как на потенциальном объяснении дискордантных фенотипов у однояйцовых близнецов и у индивидуумов, имеющих, по тем или иным причинам, одинаковые изменения в последовательности ДНК (Dennis, 2003; Fraga et al., 2005). Эпигенетические модификации контролируют паттерны экспрессии генов в клетке. Эти модификации стабильны и наследуемы, так что материнская клетка печени после деления, безусловно, даст начало другим клеткам печени В случае с неделящимися клетками, такими как нейроны, адаптация участков хромосомы посредством модификаций хроматина дает механизм для поддержания (сохранения) эпигенетической информации и, возможно, опосредует воспроизводимый ответ нейронов на специфические раздражители. Эпигенотип (эпигенетическое состояние геномного локуса) устанавливается на основе наличия или отсутствия метилирования ДНК, модификаций хроматина и разнообразной активности некодирующих РНК, требующей дальнейшего прояснения. У млекопитающих метилирование ДНК, являющееся наиболее хорошо изученным эпигенетическим сигналом, осуществляется преимущественно по углероду-5 симметричных динуклеотидов CpG. Состояние метилирования ДНК сохраняется после деления клетки посредством активности ДНК-метилтрансферазы 1, которая метилирует полуметилированные динуклеотиды CpG в дочерних клетках. Модификации хроматина включают ковалентные посттрансляционные модификации торчащих амино-терминальных гистоновых «хвостов» путем добавления к ним ацетильных, метильных, фосфатных, убиквитиновых или других групп. Метильные модификации могут представлять собой моно-, ди-, или три-метилирование. Эти модификации составляют потенциальный «гистоновый код», лежащий в основе специфической хроматиновой структуры, которая, в свою очередь, влияет на экспрессию соседних генов. Так как хроматин состоит из плотно упакованных цепей ДНК, завернутых вокруг гистонов, паттерн укладки ДНК в хроматин несомненно лежит в основе изменений генной активности. Хотя гистоновые коды и хроматиновые структуры могут стабильно передаваться от родительской в дочерние клетки, механизмы, лежащие в основе репликации таких структур, поняты не полностью. Эпигенотип проявляет пластичность во время эмбрионального развития и постнатально, в зависимости от факторов внешней среды и жизненного опыта (см. раздел 3.4); таким образом, не удивительно, что эпигенотипы могут вносить свой вклад не только в нарушения эмбрионального развития человека, но также в постнатальную патологию и даже заболевания взрослых людей. Обнаруженный совсем недавно класс молекул, играющих роль в эпигенетическом сигнале, — это молекулы некодирующих РНК. Многие годы класс не кодирующих белки РНК (non-protein-coding RNA — ncRNA) включал в себя только транспортные, рибосомные и сплайсосомную РНК. Недавно, благодаря тому, что стали доступны нуклеотидные последовательности геномов множества разнообразных организмов, а также благодаря молекулярно-генетическим межвидовым исследованиям (от Escherichia coli до человека), список ncRNA расширился, и это привело в результате к идентификации сотен малых ncRNAs, в том числе малой ядрышковой РНК (small nucleolar RNA - snoR-NA), микроРНК (micro RNA — miRNA), коротко-интерферирующей РНК (short-interfering RNA—siRNA) и малой двунитевой РНК Некоторые из этих молекул малых РНК регулируют модификации хроматина, импринтинг, метилирование ДНК и транскрипционный сайленсинг, что детально обсуждается в главе 8. Первое определенное свидетельство роли, которую эпигенетика играет в заболеваниях человека, имело место после того, как поняли геномный импринтинг и нашли, что некоторые гены регулируются с помощью этого механизма (Reik, 1989). Геномный импринтинг — это форма эпигенетической регуляции, при которой экспрессия гена зависит от того, унаследован ли этот ген от матери или же от отца. Таким образом, в импринтированном диплоидном локусе имеет место неравная экспрессия материнской и отцовской аллелей. В каждом поколении родительски-специфичные импринтные метки должны стираться, «перезагружаться» и поддерживаться, делая, таким образом, импринтные локусы уязвимыми по отношению к любого рода ошибкам, которые могут происходить во время этого процесса. Такие ошибки, как и мутации генов, кодирующих белки, которые участвуют в метилировании ДНК, связывании с метилированной ДНК и модификациях гистонов, — все это вместе вносит свой вклад в быстро растущий класс нарушений, влияющих на эпигеном человека (рис. 23.1).2. Исследования болезней человека вскрывают роль эпигенетики в биологии
Нет сомнений в том, что изучение модельных организмов явилось ключевым фактором для понимания многих биологических принципов, особенно в области генетики, биологии развития и нейрологии. Однако часто забывают, что, каких бы аспектов биологии мы не касались, одним из наиболее важных модельных организмов является человек. Описание тысяч болезней человека представляет собой наиболее полную картину мутаций, по сравнению с любым другим видом; и если эти фенотипы будут систематически и тщательно изучены, то, возможно, они позволят не только добиться медицинских успехов, но и проникнуть в биологическую суть заболевания. Не удивительно поэтому, что отношения между генотипом и фенотипом, которые поставили под вопрос менделевское наследование в случае «динамических мутаций», были выявлены в процессе изучения пациентов с синдромом ломкой Х-хромосомы (Pieretti et al., 1991). Нередко пациенты с уникальными особенностями и наблюдающие их врачи открывают новую область в биологии, выявляя неизвестные генетические и молекулярные механизмы. И действительно, именно таким образом и была выявлена роль эпигенетики в развитии и в заболеваниях человека. Такова история болезни одной пациентки, о которой дважды сообщалось в литературе врачами, наблюдавшими ее на протяжении более 10 лет. Когда ей было 7 лет, ее случай был упомянут в медицинской литературе в связи с тем, что она страдала циститным фиброзом (CF, cystic fibrosis) и недостаточностью гормона роста и была очень невысокого роста (Hubbard et al,, 1980). В поисках гена, отвечающего за CF, Боде (Beaudet) с сотрудниками разыскивали необычных пациентов с CF, у которых были бы при этом дополнительные особенности, в надежде идентифицировать небольшие делеции или хромосомные перестройки, которые могли бы облегчить картирование и идентификацию гена CF. Поэтому данная пациентка привлекла их внимание. В 16 лет ее рост составлял 130 см, умственное развитие соответствовало норме, но у нее явно была некоторая асимметрия тела (см. правую часть рисунка на титульной странице). Анализ ее ДНК показал, что она гомозиготна по множественным полиморфным ДНК-маркерам на хромосоме 7, включая центромерные альфоидные повторы (Spence et al., 1988). После того, как были исключены отсутствие отцовских элементов и гемизиготность, и после изучения ДНК бабушки пациентки (мать уже скончалась) Спенс (Spence) с коллегами сделали вывод, что данная пациентка унаследовала две идентичные копии центромерного района хромосомы 7 от своей бабушки по материнской линии (Spence et al., 1988). Учитывая теоретическое предположение Энгела (Engel), что однородительская дисомия (uni-parental disomy — UPD) возможна у человека (Engel, 1980), Боде (Beaudet) с коллегами сразу же догадался, что материнская UPD по хромосоме 7 выявляет рецессивную мутацию в гене CF и объясняет все дополнительные соматические особенности. Совокупность клинических характеристик пациента вместе с лабораторными оценками не только привели в результате к идентификации первого случая UPD у человека, но и проиллюстрировали тот факт, что отцовский и материнский геномы не эквивалентны в отношении по крайней мере некоторой части хромосомы 7. Таким образом был установлен новый механизм неменделевской наследственности для объяснения причин заболеваний и аномалий развития (рис. 23.2). Рис. 23.1. Генетические и эпигенетические механизмы, лежащие в основе нарушении, связанных с хроматином
Эпигенетические механизмы обычно включают изменения метилирования ДНК или изменения хроматина в импринтированных локусах, что нарушает моноаллельную экспрессию. Генетические механизмы можно разделить на два класса. 7гаш'-эффекты включают в себя потерю или дисфункцию факторов, ассоциированных с хроматином, которые, в свою очередь, могут изменять структуру хроматина и экспрессию генов в определенных участках генома, cis-эффекты представляют собой мутации в некодирующих участках, которые могут быть необходимы для регуляции. Результатом этих мутаций, которые могут включать в себя увеличение повторов ДНК, может быть изменение хроматина, влияющее на стабильность генома и экспрессию генов
Рис. 23.1. Генетические и эпигенетические механизмы, лежащие в основе нарушении, связанных с хроматином
Эпигенетические механизмы обычно включают изменения метилирования ДНК или изменения хроматина в импринтированных локусах, что нарушает моноаллельную экспрессию. Генетические механизмы можно разделить на два класса. 7гаш'-эффекты включают в себя потерю или дисфункцию факторов, ассоциированных с хроматином, которые, в свою очередь, могут изменять структуру хроматина и экспрессию генов в определенных участках генома, cis-эффекты представляют собой мутации в некодирующих участках, которые могут быть необходимы для регуляции. Результатом этих мутаций, которые могут включать в себя увеличение повторов ДНК, может быть изменение хроматина, влияющее на стабильность генома и экспрессию генов
Хотя в 1988 г. некоторые считали, что однородительская дисомия (UPD) хромосомы это редкое явление, сейчас мы знаем, что случаи UPD отмечались до сих пор практически для всех человеческих хромосом, кроме хромосом 3 и 19.
 Рис. 23.2. Последствия однородительской дисомии
Состояния метилирования ДНК островков CpG, лежащих «вверх по течению», обозначены розовыми кружками, если ДНК метилирована и пустыми кружками, если неметилирована. Состояние метилирования ДНК влияет на экспрессию гена, лежащего «вниз по течению». Аллели, наследуемые по материнской линии, дублированы (ген В); тогда как гены, которые находятся на отцовской аллели утрачены (ген А)
Рис. 23.2. Последствия однородительской дисомии
Состояния метилирования ДНК островков CpG, лежащих «вверх по течению», обозначены розовыми кружками, если ДНК метилирована и пустыми кружками, если неметилирована. Состояние метилирования ДНК влияет на экспрессию гена, лежащего «вниз по течению». Аллели, наследуемые по материнской линии, дублированы (ген В); тогда как гены, которые находятся на отцовской аллели утрачены (ген А)
Изучение необычных пациентов не только установило случаи UPD для дополнительных хромосом, но и привело в 1989 г. к предположению, что UPD вызывает заболевания благодаря изменениям в эпигенотипе и нарушению геномного импринтинга (Nicholls et al., 1989). Николс (Nicholls) с соавторами изучали пациента с синдромом Прадера-Уилли (PWS, Prader-Willi syndrome), у которого была сбалансированная робертсоновская транслокация t( 13; 15), которая также присутствовала у его матери, не имевшей симптоматики, и у родственников по материнской линии. Тот факт, что пробанд унаследовал свою вторую свободную хромосому 15 от своей матери (тогда как все индивидуумы, не имевщие симптоматики, наследовали ее от отцов), привело авторов к заключению, что материнская UPD привела к фенотипу PWS. После того, как наличие материнской UPD по хромосоме 15 подтвердилось у второго пациента с PWS и с внешне нормальным кариотипом, авторы предположили, что в этиологии PWS свою роль играет геномный импринтинг. Более того, они заключили, что либо отцовские делеции, либо материнская UPD с 15ql 1-13 обычно приводит к PWS, и они предсказали, что отцовская UPD15 точно так же, как материнские делеции данного района, может вызвать синдром Ангелмана (Angelman syndrome). Все эти предсказания оказались верными (рис. 23.3).
3. Заболевания человека
3.1. Нарушения геномного импринтинга
Открытие UPD было клинической «точкой входа» в нарушения геномного импринтинга у людей. В то время как PWS и синдром Ангелмана были первыми изученными нарушениями геномного импринтинга. синдром Беквита-Видемана (Beckwith-Wiedemann syndrome), псевдогипопаратироидизм и синдром Сильвера-Рассела (Silver-Russell syndrome) расширили этот список и поставили множество интригующих вопросов относительно того, как эпигенетические дефекты приводят к фенотипу, характерному для того или иного заболевания В следующем разделе мы даем краткий обзор клинических характеристик каждого нарушения, приводим разнообразные механизмы, ведущие к эпигенетипическим дефектам, а также описываем фенотипы и биологическую суть явлений, установленную в результате изучения этого типа нарушений (табл. 23.1).Таблица 23.1. Выборочные нарушения геномного импринтинга

Сестринские синдромы: синдром Прадера-Уилли и синдром Ангелмана
Синдром Прадера-Уилли (PWS; OMIM 176270) и синдром Ангелмана (AS; OMIM 105830) в большинстве случаев вызываются одной и той же делецией 15q11-q13, размером 5—6 млн. нуклеотидов, но их фенотипы во многом различны. Геномный импринтинг в области 15q11-q13 объясняет эти фенотипические различия, с учетом того, что PWS вызывается делециями, унаследованными по отцовской линии, тогда как при AS делеции имеют материнское происхождение (Ledbetter et al., 1981; Magenis et al., 1987; Nicholls et al., 1989). PWS, который случается с частотой примерно 1/10000, был описан почти 50 лет назад и характеризуется младенческой гипотонией, задержкой развития, невозможностью роста вследствие плохого питания, апатией, за которыми следуют гиперфагия, тяжелое ожирение, низкоросл ость, вторичный гипогонадизм с гипоплазией гениталий и ослабление познавательных способностей. Пациенты с PWS также имеют отличительные физические черты, такие как небольшой размер кистей и стоп, миндалевидные глаза и тонкая верхняя губа. Большинство пациентов с PWS имеют слабое или среднее замедление умственного развития, подавляющее большинство из них проявляет разнообразные типы навязчиво-маниакального поведения, беспокойства, и иногда они замкнуты и несчастливы (рис. 23.4а). Наоборот, пациенты с AS имеют «счастливый настрой», часто улыбаются, и подвержены необъяснимым приступам смеха. Они страдают тяжелыми задержками развития, минимальными (если вообще имеют их) речевыми навыками. проблемами с равновесием (атаксией), производят аномальные похлопывающие движения кистями, характеризуются микроцефалией, припадками и некоторыми искаженными чертами, такими как выдающаяся нижняя челюсть и широкий рот (рис. 23.4б). При обоих нарушениях могут наблюдаться гипотония, гипопигментация кожи и радужной оболочки и косоглазие. Большинство PWS и AS (-70%) вызваны отцовскими и материнскими делениями 15q11-q13, соответственно. Около 25% случаев PWS вызвано материнской UPD 15q11-q13, тогда как отцовская однородительская дисомия этого участка отвечает за 2—5% пациентов с AS (рис. 23.3). Разница в частоте однородительской дисомии между PWS и AS обычно инициируется материнским нерасхождением, поскольку на него влияет возраст матери, приводящий к зачатиям с трисомией или моносомией по хромосоме 15. Эти случаи затем подвергаются «спасению», что приводит к материнской UPD и PWS или отцовской UPD и AS, соответственно. Разница в частоте встречаемости этих двух однородительских дисомий предположительно связана с частотой образования двух аномальных яйцеклеток и с вероятностью «спасения» при обоих этих обстоятельствах. Транслокации в пределах критического PWS/AS участка отвечают менее чем за 10% таких случаев, но следует заметить, что такие транслокации связаны с высоким риском рецидива (до 50%), в зависимости от пола передающего родителя. Действительно, PWS и AS сосуществовали в некоторых семьях благодаря транслокациям или другим структурным аномалиям 15q11-q13, и фенотип при этом определялся полом передающего родителя (Hasegawa et al., 1984; Smeets et al., 1992).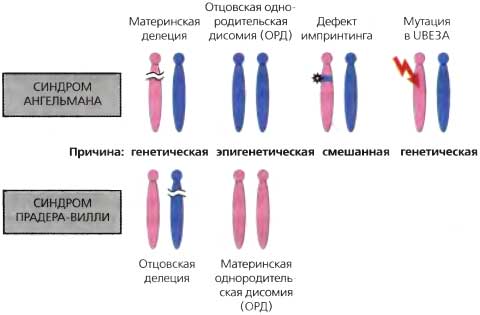 Рис. 23.3. Синдром Прадера-Вилли и синдром Ангелмана
Оба синдрома могут быть вызваны генетическими, эпигенетическими или смешанными дефектами
Рис. 23.3. Синдром Прадера-Вилли и синдром Ангелмана
Оба синдрома могут быть вызваны генетическими, эпигенетическими или смешанными дефектами
 Рис. 23.4. Пациент с синдромом Прадера-Уилли (а) и пациент с синдромом Ангелмана (б)
Эти фотографии иллюстрируют существенные различия в клинической картине нарушений, вызванных дефектами в импринтированном участке. Фотографии любезно предоставлены Д-рами Daniel J Driscoll (а) и Carlos A. Bacino (б)
Рис. 23.4. Пациент с синдромом Прадера-Уилли (а) и пациент с синдромом Ангелмана (б)
Эти фотографии иллюстрируют существенные различия в клинической картине нарушений, вызванных дефектами в импринтированном участке. Фотографии любезно предоставлены Д-рами Daniel J Driscoll (а) и Carlos A. Bacino (б)
Дефекты импринтинга представляют еще один класс мутаций, ведущих к фенотипам PWS или AS. Такие дефекты, которые включают в себя разделенный на две части центр импринтинга (1 С) в пределах 15q11-q13 (Ohtaet al., 1999), являются причиной того, что хромосома, принадлежащая по происхождению одному из родителей, имеет измененный эпигенотип, как правило, эпигенотип хромосомы, происходящей от другого родителя. Дефекты импринтинга часто включают в себя делецию 1C, но есть случаи, когда такие дефекты оказываются имеющими место благодаря эпигенетической мутации, не затрагивающей последовательность нуклеотидов ДНК. Итог таких разнообразных нарушений импринтинга один и тот же, и он включает в себя изменения в метилировании ДНК, структуре хроматина и, в конечном счете, паттерны экспрессии генов. Дефекты импринтинга объясняют 2—5% случаев PWS и AS, а делеции в 1C обычно ассоциируются с 50%-ным риском рецидива, в зависимости от пола родителя, передающего аномалию, тогда как риск рецидива в семьях без делеции в 1C невысок. Идентификация дефектов импринтинга у небольшого количества пациентов с AS, которые были зачаты после инъекции спермы в цитоплазму яйцеклетки (ICSI, intracytolasmic sperm injection), поставила вопрос о том, что, возможно, этот способ оплодотворения in vitro вызывает дефекты импринтинга (Сох et al., 2002; Orstavik et al., 2003). Обнаружение дефектов импринтинга среди случаев AS у пациентов, родившихся у субфертильных родительских пар, не прошедших процедуру ICSI (но подвергнутых гормональной стимуляции), порождает дальнейшие вопросы относительно того, имеют ли бесплодие и дефекты импринтинга общие механизмы, или действительно вспомогательные репродуктивные технологии [гормоны и (или) ICSI] имеют эпигенетические последствия (Ludwig et al., 2005). Какой конкретно ген (гены) затрагивается геномным импринтингом в 15q11-q13, известно лишь для AS, но не для PWS. Около 10—15% случаев AS вызываются мутациями потери функции в гене лигазы ЕЗ убиквитина (UBE3A), кодирующем белок, связанный с Е6 (Е6-АР, E6-associated protein) (Kishino et al., 1997; Matsuura et al., 1997). Изучение экспрессии показало, что Ube3a экспрессируется исключительно с материнской аллели в мозжечковых клетках Пуркинье и в нейронах гиппокампа. Более того, мыши Ube3a+, лишенные материнской аллели, воспроизводят черты AS (Jiang et al., 1998). Эти результаты, так же как и данные по человеку, указывают на ген UBE3A, как на первопричину AS. Отцовская UPD или материнские делеции в 15q11-q13, ведут к потере экспрессии UBE3A в клетках Пуркинье. В случае дефектов импринтинга в 1C оказывается, что потеря сайленсинга антисмыслового транскрипта ведет к подавлению экспрессии гена UBE3A (Rougeulle et al., 1998). Интересно, что около 10% случаев AS остаются без молекулярного диагноза. Оказывается, что у ряда пациентов имеются мутации в белке ремоделинга хроматина — белке 2, связывающемся с метил-CpG, — что обсуждается ниже. В случае PWS есть несколько кандидатов на роль импринтирующих генов, которые экспрессируются только с отцовской аллели, однако не ясно, которые из этих генов ответственны за фенотип PWS. Наиболее подходящими кандидатурами до сих пор являются гены в кластере некодирующих малых ядрышковых РНК (snoRNAs). Из белок-кодирующих генов наилучшими кандидатами являются SNURF-SNRPN и Necdin (NDN). Главный сайт старта транскрипции SNURF-SNRPN расположен в 1C и он кодирует малый ядерный рибонуклеопротеин (SN-RPN), который функционирует в регуляции сплайсинга. Считается, что главным сайтом дефектов импринтинга является еще один ген «рамка считывания вверх по течению от SNRPN» (или SNURF), наряду с некодирующими экзонами, расположенными «вверх по течению», потому что разрушение (дизрупция) этого гена ведет к изменению импринтинга SNRPN и других импринтированных генов 15q11-q13. Мыши с отсутствием Snrpn выглядят нормальными, а мыши с делециями, захватывающими Snrpn и другие гены, гомологичные генам в 15q11-q13, характеризуются гипотонией, задержкой роста, и погибают еще до окончания вскармливания (Tsai et al., 1999). Несколько генов малых ядрышковых РНК (snoRNA) экспрессируются с отцовской аллели и, возможно, вносят свой вклад в фенотип PWS (Meguro et al., 2001). Недавние исследования показали, что потеря отцовской аллели из одного кластера этих генов (HBI1-52) не вызывает PWS (Runte et al., 2005). Однако исследования на мышах заставляют предполагать, что утрата малой ядрышковой РНК Pwcr1/MBII-85, вероятно, отвечает за неонатальную смертность в моделях PWS, разработанной на мышах (Ding et al., 2005). Следовательно, PWS может вызываться потерей одного и более генов малых ядрышковых РНК, возможно, в сочетании с потерей других генов, экспрессирующихся в 15q11-q13 по отцовской линии. Тщательное исследование редких семей с транслокациями и делециями поддерживает мнение, что недостаточность по малым ядрышковым РНК PWCR1/HBII-85 вызывает PWS (Schulc ct al., 2005).
Синдром Беквита-Видемана
История синдрома Беквита-Видемана (BWS; OMIM 130650) представляет собой блестящий пример того, как заболевание человека вскрыло значение эпигенетики не только в нормальном развитии, но и при регуляции роста клеток и при опухолеобразовании. Синдром Беквита-Видемана характеризуется быстрым и гипертрофическим соматическим ростом, врожденными аномалиями и предрасположенностью к эмбриональным злокачественным перерождениям в детском возрасте (Weksberg et al., 2003). У пациентов с BWS в типичных случаях проявляется гигантизм, макроглоссия (увеличенный язык), гемигипертрофия разнообразные степени аномалии ушей и других органов и пупочная грыжа (выпячивание органов брюшной полости через пупок). Кроме того, многие пациенты страдают увеличенным размером внутренних органов; эмбриональными опухолями, такими как опухоль Уилмса (Wilms’ tumor), гепатобластома или рабдомиосаркома, а также гиперплазией и гипертрофией островков поджелудочной железы, часто приводящей к неонатальной гипогликемии. Большинство случаев BWS носят спорадический характер, но наличие небольшого числа семей с паттерном аутосомно-доминантного наследования (в ретроспективе, после модификации геномным импринтингом) наводит на мысль о его генетической этиологии и связи синдрома с 11р15 (Pingetal., 1989). Преимущественная потеря материнских аллелей в опухолях, связанных с BWS, избыток женщин, передающих данное заболевание при его доминантной форме, и отцовская UPD по 11р15.5 в некоторых случаях BWS, свидетельствуют в пользу того, что эпигенетика и импринтинг должны играть важную роль в этиологии BWS, и что это заболевание может быть результатом смеси генетических и эпигенетических аномалий, либо возникших de novo, либо унаследованных. Кластер импринтированных генов, связанных с BWS, картируется в 11р15.5 в участке размером приблизительно 1 млн о. и включает в себя по меньшей мере 12 импринтированных генов. Считается, что эти гены регулируются двумя центрами импринтинга, разделенными неимпринтированным участком (Weksberg et al., 2003). Предполагается, что реципрокно импринтированный Н19 и инсулиноподобный фактор роста (IGF2) и дифференциально метилированный район представляют собой один участок контроля импринтинга (ICR1 - imprinting control region) (Joyce et al., 1997; Weksberg et al., 2003). H19кодирует экспрессируемую по материнской линии некодирующую PHKpol [I, a IGF2 кодирует экспрессируемый по отцовской линии фактор роста У этих двух генов общий стандартный набор энхансеров, на доступ к которым влияют статус метилирования ICR1 и связывание с белком CTCF (белком типа «цинкового пальца») (Hark et al., 2000). Второй участок контроля импринтинга (ICR2) содержит несколько генов, экспрессирующихся по материнской линии, в том числе: ингибитор циклин-зависимой киназы (CD-KN1C, кодирующий p57kip2), компонент калиевого канала (KCNQ1) и предполагаемый переносчик катионов (SLG22A1L). Дифференциально метилированный район в ICR2 картируется в интроне KCNQlu на отцовских аллелях он не метилирован, что ведет к экспрессии КС-NQIOTI в антисмысловом направлении KCNQ1. Предполагается, что метилирование ICR2 на материнской аллели сайленсирует материнскую экспрессию KCN-QIOTI, делая возможной экспрессию KCNQ1 и CDKN1C, экспрессирующихся по материнской линии (Lee et al, 1999; Smilinichet al., 1999). Различные эпигенетические, а также генетические молекулярные дефекты дают некоторое понимание относительно того, какие гены вносят вклад в фенотип BWS. На неметилированных материнских аллелях CTCF связывается с ICR1 и устанавливает границу, посредством чего промотор IGF2 изолируется от энхансеров. Эти энхансеры могут потом получить доступ к промотору Н19 (более проксимальное положение относительно границы), разрешая транскрипцию Н19. Метилирование ICR1 на отцовских аллелях аннулирует связывание с CTCF, разрешая экспрессию IGF2 и сайленсинг Н19. Обнаружение того, что либо дупликации в 11р15.5, распространяющиеся на локус IGF, либо отцовская UPD данного участка (ожидается, что она приводит к сверхэкспрессии IGF2), в сочетании с данными, показывающими, что у трансгенных мышей со сверхэкспрессией IGF2 развиваются чрезмерно быстрый рост и увеличенный язык, подразумевает, что сверхэкспрессия IGF2 является одной из возможных причин гипертрофированного роста при BWS (Henry et al., 1991; Weksberg et al., 1993; Sun et al., 1997). Любопытно, что мутации типа потери функции в гене CDKN1C дают начало BWS, аналогично мутациям, вызываемым сверхрэкспрессией IGF2. У мышей, не имеющих Cdknlc, развиваются пупочные грыжи, но не усиленный рост. Однако, когда утрата Cdknlc сочетается с повышенной экспрессией Igf2, животные воспроизводят многие черты BWS (Caspary et al., 1999). К настоящему времени к молекулярным нарушениям, которые вызывают BWS, относятся: 1) отцовские дупликации, включающие IGF2, 2) отцовскую UPD по 11р15.5,3) мутации типа потери функции в материнской аллели CDKN1C, 4) трансляции на материнской хромосоме, нарушающие KCNQ1, влияющие на импринтинг IGF2но, как ни странно, не на ICR2, и 5) чаше всего — потеря импринтинга ICR2/KCNQiOTl, что, опять-таки, изменяет импринтинг IGF2 и предполагает некоторые регуляторные взаимодействия между ICR1 и ICR2 (Cooper et al., 2005). Некоторые эпигенетические изменения, идентифицированные при BWS, такие как дефекты метилирования в ICR1 гена Н19, также были подтверждены у пациентов с опухолью Уилмса, но не с BWS; это предполагает, что хронометраж эпигенетического дефекта может диктовать, будет ли аномальная регуляция роста затрагивать весь организм или только какой-то специфический орган. Тот факт, что аберрантное метилирование в IRC1 часто приводит к опухоли Уилмса, а в ICR2 — часто приводит к рабдомиосаркоме и гепатобластоме при BWS, предполагает, что в 11р15.5 имеется более чем один локус, обусловливающий предрасположенность к канцерогенезу (Weksberg et al., 2001; DeBaun et al., 2003; Prawitt et al., 2005).Синдром Силвера-Рассела
Синдром Силвера-Рассела (SRS, Silver-Russell syndrome; OMIM 180860) — это нарушение развития, характеризующееся замедлением роста, невысокой фигурой, часто ассиметричной, и несколько бесформенными чертами лица и черепа, а также аномалиями пальцев. Наиболее заметная характеристика — это аномалии соматического роста, другие характеристики сильно варьируют. Генетически SRS гетерогенен, но подсчитано, что около 10% случаев являются результатом материнской UPD по хромосоме 7 (Eggermann et al., 1997). Предполагается, что SRS вызывается потерей функции гена, экспрессированного у отца (возможно, того, который способствует росту); но нельзя исключить альтернативную модель, а именно, сверхэкспрессию гена, подавляющего рост и экспрессированного у матери Интересно, что у некоторых индивидуумов с SRS была обнаружена эпигенетическая мутация, вызывающая деметилирование ICR1 на хромосоме 11р15. Этот эпигенетический дефект вызывает биаллельную экспрессию Н19 и пониженную экспрессию IGF2 (Gicquel et al., 2005).Псевдогипопаратироидизм
Псевдогипопаратироидизм (РНР, pseudohypoparathyroidism) представляет собой группу фенотипов, являющихся результатом функционального гипопаратироидизма, несмотря на нормальный уровень паратироидного гормона (РТН, parathyroid hormone). Такие пациенты устойчивы к РТН (паратироидному гормону). Существует несколько клинических подтипов — la, lb, 1с, II и наследуемая остеодистрофия Олбрайта (OMIM 103580). Кроме функционального псевдогипопаратироидизма и остеодистрофии эти клинические варианты могут проявлять ряд соматических дефектов и дефектов развития. Гетерогенные с клинической точки зрения фенотипы являются результатом мутаций в гене GNAS1, кодирующем полипептид 1 (Gsa) — белок, обладающий a-стимулирующей активностью и связывающийся с гуанином. GNAS1 картируется в хромосоме 20q 13.2. Локус GNAS1 имеет три альтернативных первых экзона, расположенных «вверх по течению» (экзоны 1А, XL, и NESP55), которые сплайсированы с экзонами 2-13 и производят разные транскрипты, и в случае с NESP55 и XL этот альтернативный сплайсинг продуцирует уникальные белки Около этих экзонов имеются дифференциально метилированные участки, принуждающие NESP55 экспрессироваться исключительно с материнских аллелей, тогда как XL, экзон 1А и антисмысловой транскрипт для NESP55 экспрессируются у отца. Хотя транскрипт, кодирующий белок Gsa, экспрессирован биаллельно, в некоторых тканях, таких как проксимальные почечные канальцы, преимущественно экспрессирована материнская аллель. Сочетание геномных и тканеспецифичных импринтингов объясняет изменчивые фенотипы и эффект происхождения от одного или другого родителя даже для тех мутаций, которые имеют ясный аутосомный доминантный паттерн наследования (Hayward et al., 1998). Следует отметить, что у одного пациента с отцовской UPD участка GNAS1 развилось заболевание по типу lb (Bastepe et al., 2003). Изучение генотипов и фенотипов этих клинических нарушений показало, что за исключением SRS все остальные геномные нарушения импринтинга (PWS, AS, BWS, и РНР) могут быть вызваны смесью генетических или эпигенетических аномалий, либо возникших de novo, либо унаследованных. Трудно поверить, что такая смешанная генетическая модель заболевания будет оставаться уникальной для этого небольшого набора нарушений. Немногим более десятилетия назад UPD была лишь теоретической возможностью, но сейчас установлено, что она имеет место на многих участках хромосом и приводит к разнообразным заболеваниям и фенотипам, касающимся развития. Одна из задач исследований генетики человека — выявить, какие гены отвечают за те или иные из ассоциированных с UPD фенотипов с целью установить список болезней, которые, вероятно, являются результатом смешанных генетикоэпигенетических механизмов.3.2. Нарушения, влияющие на структуру хроматина в trans-конфигурации
Значение тонко отлаженной структуры хроматина для здоровья человека выдвинулось на первое место в связи с быстро растущим списком заболеваний человека, вызванных мутациями в генах, кодирующих белки, необходимые для структуры и ремоделинга хроматина. Сами по себе эти нарушения не являются эпигенетическими мутациями, но они изменяют состояния хроматина, являющиеся критическими компонентами эпигенотипа. Значительные различия между фенотипами, так же как тот факт, что едва уловимые изменения в уровне белка или даже консервативная аминокислотная замена могут приводить к заболеванию человека, все эти данные уже дают ключ к проблеме, касающейся строго контролируемой регуляции и взаимодействий белков ремоделинга хроматина. Нарушения, которые влияют на хроматин в trans-конфигурации, являются результатом либо нарушения функции белков, непосредственно участвующих в ремоделинге хроматина (таких, как белок, связывающийся с CREB, или СВР, ЕР300, а также белок, связывающийся с метил-CpG, или МеСР2), либо потери функции белков, участвующих в метилировании ДНК (таких, как de novo ДНК-метилтрансфераза ЗВ. DNMT3B, или метилентетрафолатредуктаза, MTHFR) (табл. 23.2). Нарушение функции любого из этих генов вызывает комплексные мультисистемные фенотипы или неоплазии, благодаря эффектам мисрегуляции экспрессии большого числа генов-мишеней, находящихся «ниже по течению». Вполне возможно, что существует множество заболеваний, которые вызываются мутациями в некодирующих РНК, действующими в trans-конфигурапии, хотя их еще предстоит обнаружить.Таблица 23.2. Выборочные генетические нарушения, влияющие на структуру хроматина в trans-конфигурации

Синдром Рубинштейна-Тайби
Синдром Рубинштейна-Тайби (RSTS, Rubinstein-Taybi syndrome; OMIM 180849) характеризуется задержкой умственного развития, широкими большими пальцами рук и ног, аномалиями лица, врожденными пороками сердца и повышенным риском образования опухолей. Высокая частота конкордантности у монозиготных близнецов, наряду с несколькими случаями передачи от матери к плоду, предполагают, что это заболевание имеет генетическую основу, и что наиболее вероятно аутосомное доминантное наследование. У некоторых пациентов с RSTS были установлены цитогенетические аномалии, включающие 16р13.3 (Tommerup et al., 1992), которые картируются в участке, содержащем ген белка, связывающегося с CREB (CREBBP, или СВР). Гетерозиготные мутации в CREBBP демонстрируют, что гапло-недостаточность СВР вызывает RSTS (Petrij et al., 1995). СВР впервые был описан как коактиватор реагирующего на с АМР белка CREB При повышении внутриклеточных уровней сАМР протеинкиназа А (РКА) перемещается в ядро и фосфорилирует CREB, что приводит к его активации и связыванию его с элементами ответа на количество сАМР (Мауг and Montminy, 2001). СВР — это крупный белок (~250 кДа) с бромодоменом, который, как показано, связывает РКА-фосфорилированный CREB (Chrivia et al., 1993). СВР, в свою очередь, активирует транскрипцию с промотора, содержащего CRE через ацетилирование всех четырех коровых гистонов в соседних нуклеосомах (Ogryzko et al, 1996). Кроме того, СВР взаимодействует непосредственно с основным транскрипционным фактором TFIIIB через участок на своем карбоксильном конце (Anas et al., 1994; Kwok et al., 1994). Функциональный анализ in vitro одной из миссенс-мутаций СВР (замена Arg-1378 на пролин), вызывающей RSTS, выявил, что эта мутация подавляет гистон-ацетилтрансферазную (HAT) активность СВР (Murata et al., 2001). Эти данные, в сочетании с тем, что мыши, гаплонедостаточные по СВР, имеют ослабленную память и обучаемость, измененную синаптическую пластичность и аномальное ацетилирование хроматина, поддерживают вывод о том, что ослабленная НАТ-активность СВР — это главная причина RSTS фенотипа (Alarcon et al., 2004). В соответствии с ролью, которую играет в заболевании понижение НАТ-активности, находится недавнее открытие того, что мутация во втором гене, рЗОО, кодирующем эффективную HAT и транскрипционный коактиватор, вызывает некоторые случаи RSTS (Roelfsema et al., 2005). Выявление того, что некоторые дефекты синаптической пластичности, как и недостатки обучаемости и памяти у СВР " мышей, могут быть ревертированы с помощью ингибиторов деацетилазы гистонов (HDAC) (Alarcon et al., 2004), вызывает вопрос о том, может ли лекарственная терапия, использующая эти реагенты, устранить некоторые ментальные проблемы при RSTS.Синдром Рэтта
Синдром Рэтта (RTT, Rett syndrome; OMIM 312750) — это доминантное сцепленное с Х-хромосомой постнатальное нарушение развития и нервной системы, характеризующееся двигательными аномалиями, атаксией, припадками, бесцельными движениями рук и речевой регрессией (Hagberg et al., 1983). RTT классифицируется no DSMIV как одно из нарушений, входящих в разряд аутизма (ASD, autistic spectrum disorder), и имеет три основные общие с ASD черты: оба заболевания проявляются постнатально, часто после периода внешне нормального развития, оба нарушают социальное и речевое развитие и оба сопровождаются необычными стереотипными движениями кистей или рук (рис. 23.5а). Хотя RTT — это в подавляющем большинстве случаев (>99%) спорадическое заболевание, обнаружение небольшого числа семей, в которых ген передается по материнской линии, предполагает, что оно имеет генетическую основу. Такие семьи, наряду с тем фактом, что RTT, как правило, наблюдается у особей женского пола, а женщины облигатные носители могут не иметь симптомов, привело к гипотезе, что RTT это доминантное нарушение, сцепленное с Х-хромосомой. С помошью метода «Ап exclusion mapping strategy» ген RTT был локализован в Xq27-qter, и анализ генов-кандидатов (candidate gene analysis) на эту роль указал на ген, кодирующий белок 2, связывающийся с метил-CpG (/МЕСР2), как на ген, вызывающий данное заболевание (Amiretal., 1999). Рис. 5. Генетические нарушения, влияющие на хроматин в cis-конфигурации
(а) Эта фотография пациента с синдромом Рэтта иллюстрирует необычные стереотипные движения рук, жевательные движения и аномальную осанку. Фото любезно предоставлено Д-ром Даниэлем Г . Глэйзом (Dr. Daniel G. Glaze), (б) Микрофотографии хромосом пациента с ICF , любезно предоставленные Д-рами Тимоти Г. Бестором, Робертом А. Роллинсом и Деборой Буркхис (Drs. Timothy Н. Bestor, Robert A. Rollins, and Deborah Bourc'his.)
Рис. 5. Генетические нарушения, влияющие на хроматин в cis-конфигурации
(а) Эта фотография пациента с синдромом Рэтта иллюстрирует необычные стереотипные движения рук, жевательные движения и аномальную осанку. Фото любезно предоставлено Д-ром Даниэлем Г . Глэйзом (Dr. Daniel G. Glaze), (б) Микрофотографии хромосом пациента с ICF , любезно предоставленные Д-рами Тимоти Г. Бестором, Робертом А. Роллинсом и Деборой Буркхис (Drs. Timothy Н. Bestor, Robert A. Rollins, and Deborah Bourc'his.)
Обнаружение того, что мутации в МЕСР2 являются основной причиной RTT, служит молекулярным свидетельством наличия связи между RTT и аутизмом. Сейчас известно, что мутации в МЕСР2 вызывают широкий спектр фенотипов у женщин, в том числе неспособность к обучению, обособленное (isolated) замедленное умственное развитие, синдром, похожий на синдром Ангелмана и ASD. Паттерны инактивации Х-хромосомы (XCI) — это главные молекулярные детерминанты данной клинической изменчивости. Женщины с мутациями в МЕСР2 и со сбалансированным паттерном XCI, как правило, страдают классическим RTT, за исключением нескольких гипоморфных аллелей. Женщины с несбалансированными паттернами XCI, благоприятствующими аллели дикого типа, в типичном случае имеют более мягкие фенотипы (Wan et al., 1999; Carney et al., 2003). Мужчины с мутациями MECP2 проявляют более широкий спектр фенотипов, чем женщины, благодаря их гемизиготности по данному локусу. Мутации, вызывающие RTT, как правило, вызывают летальность новорожденных, если только пациент мужского пола не является мозаиком по мутациям или не имеет кариотипа XXY — в этом случае все фенотипы, наблюдаемые у женщин, наблюдаются также и у таких мужчин (Zeev et al., 2002; Neul and Zoghbi, 2004). С другой стороны, у мужчин с гипоморфными аллелями, которые фенотипически едва проявляются у женщин, развиваются любые сочетания признаков, включая умственную отсталость, припадки, треморы, увеличенные семенники, маниакальную депрессию или шизофрению (Meloni et al., 2000; Couvert et al., 2001). MeCP2 был идентифицирован на основании его способности связываться с симметрично метилированными динуклеотидами CpG (Lewis et al., 1992). Он локализуется в гетерохроматине и действует как репрессор транскрипции, зависимый от метилирования (Nan et al., 1997). МеСР2 связывается с метилированной ДНК через ее метил-CpG-связывающий домен и взаимодействует с корепрессорами Sin3A и HDACs через свой домен транскрипционной репрессии. МеСР2 также ассоциируется с Brahma — компонентом комплекса SWI-SNF ремоделинга хроматина (Harikrishnan et al., 2005). Интригующей чертой RTT является отсроченное постнатальное проявление фенотипов в отсутствие нейродегенерации. Изучение распределения и распространенности МеСР2 выявило, что он определяется в зрелых нейронах, возможно, после формирования синапсов (Shahbazian et al., 2002а; Kishi and Macklis, 2004; Mullaney et al., 2004). Такое распределение предполагает, чтонейронная функция МеСР2 играет существенную роль после того, как установились созревание и активности нейронов, и что эта его функция важна для регуляции деятельности нейронов. Начинается идентификация некоторых мишеней МеСР2, но еще предстоит определить, какими именно из этих мишеней опосредуются разнообразные фенотипы RTT (Chen et al., 2003; Martinowich et al., 2003; Horike et al., 2005; Nuber et al., 2005). Исследования с применением клеточного экстракта от пациентов с RTT или экстракта мозга мышей, не имеющих функционального МеСР2, выявили измененный характер ацетилирования гистонов (Wan et al., 2001; Shahbazian et al., 2002b; Kaufmann et al., 2005), что согласуется с предполагаемой ролью данного белка в деацетилировании гистонов, учитывая его взаимодействия с HDACs. Интересно, что удвоение дозы МеСР2 у мышей и человека приводит к прогрессивным постнатальным фенотипам, которые, в сущности, более резко выражены, чем некоторые из фенотипов, обусловленных потерей функции (Collins et al., 2004; Meins et al., 2005; Van Esch et al., 2005). Остается еще проверить, приводит ли увеличение уровней МеСР2 к титрованию ключевых взаимодействующих компонентов и (или) к аберрантной экспрессии его мишеней Стремясь выявить потенциально новые функции МеСР2, Янг с коллегами обнаружили, что МеСР2 взаимодействует с белком 1, связывающимся с Y-боксом (YB-1), — белком, связывающимся с PF1K, и влияющим на сплайсинг (Young et al., 2005). МеСР2 регулирует сплайсинг РНК репортерных минигенов, но, что наиболее важно, он влияет на сплайсинг РНК in vivo, учитывая данные об изменении паттернов сплайсинга РНК в ткани мозга мышей, моделирующих RTT (Young et al., 2005). Важность МеСР2 в эпигенетической регуляции экспрессии нейрональных генов и его влияние на сплайсинг РНК, по-видимому, лежат в основе потери основных вех при развитии и при аномальной неврологической функции при RTT и родственных ему нарушениях.
Сцепленная с Х-хромосомой ?-талассемия, сопровождающаяся умственной отсталостью
Мужчины с синдромом сцепленной с Х-хромосомой ?-талассемией, сопровождающейся умственной отсталостью (ATRX; OMIM 301040), проявляют ?-талассемию, умеренную (до тяжелой) умственную отсталость, бесформенные черты лица, микроцефалию, аномалии скелета и половых органов и, обычно, неспособность к ходьбе. Гетерозиготные пациенты женского пола обычно не имеют симптомов. Мутации в vmzATRX, которые картируются в Xql3, вызывают этот синдром, так же как и совокупность дополнительных фенотипов, включающих в себя разные степени сцепленной с Х-хромосомой умственной отсталости (XLMR), тяжелую MR со спастической параплегией и благоприобретенную в связи с соматическими мутациями ?-талассемию в миело-диспластическом синдроме (ATMDS) (Gibbons et al., 1995, 2003; Villard et al., 1996; Yntemaet al., 2002). Белок ATRX содержит характерный для растений гомеодоменный (PHD-подобный) мотив «цинкового пальца», равно как и ДНК-зависимую АТФазу семейства SNF2. Это, в сочетании с локализацией в перицентромерных гетерохроматиновых доменах и ассоциацией с гетерохроматином la (HP 1а) (McDowell et al., 1999), предполагает, что данный белок играет какую-то роль в ремоделинге хроматина. Мутации в ATRX вызывают даун-регуляцию локуса ?-глобина и аномальное метилирование нескольких высокоповторяющихся последовательностей нуклеотидов, в том числе субтеломерных повторов, специфичного для Y-хромосомы саттелита и рибосомных последовательностей ДНК. Недавние исследования показали, что ATRX необходим для выживания кортикальных нейронов, и это служит намеком на то, что повышенная потеря нейронов может вносить свой вклад в развитие тяжелой умственной отсталости и мышечной спастичности, наблюдаемых у пациентов с мутациями ATRX (Berube et al., 2005). Интересно, что уровни ATRX строго регулируются и что как уменьшение, так и увеличение его количества, вызывают основные проблемы в развитии нервной системы. Например, пациенты, у которых в результате мутаций имеется 10—30% ATRX от его нормального уровня, проявляют полный фенотип, характерный для ATRX, несмотря на наличие значительного количества нормального белка ATRX (Picketts et al., 1996). Слишком большое количество ATRX, похоже, тоже является разрушительным. У трансгенных мышей с сверхэкспрессией ATRX развиваются дефекты нервной трубки, наблюдается замедление роста и гибель в процессе эмбриогенеза. У тех, кто выживает, наблюдаются краниофасциальные аномалии, непроизвольное царапанье морды и припадки. Эти характеристики напоминают клиническую картину у пациентов с мутациями ATRX типа «потери функций», что указывает на возможность того, что уровни ATRX строго регулируются для функциональной целостности белкового комплекса, внутри которого он находится.Синдром иммунодефицита, нестабильности центромерного участка и лицевых аномалий
Синдром иммунодефицита, нестабильности центромерного участка и лицевых аномалий (ICF, OMIM 242860) — это редкое аутосомное рецессивное нарушение, связанное с разрывом хромосом. Пациенты с ICF проявляют два неизменных фенотипа: иммунодефицит и цитогенетические аномалии. Высокоизменчивые и менее пенетрантные фенотипы включают в себя черепно-лицевые дефекты, такие как широкую и плоскую переносицу, складки эпикантуса, высокий лоб и низко посаженные уши, задержку психомоторного развития и кишечную дисфункцию (Smeets et al., 1994). В типичном случае иммунодефицит представлен в тяжелых формах и часто вызывает смерть в детстве, до достижения зрелого возраста, в результате респираторных или желудочно-кишечных инфекций. Наиболее обычный иммунологический дефект — это снижение уровня сывороточных иммуноглобулинов (IgG), но наблюдается также и уменьшение числа В- или Т-клеток (Ehrlich, 2003). Цитогенетические аномалии, в первую очередь затрагивающие хромосомы 1 и 16, и, в меньшей степени, 9, видны при обычном кариотипическом анализе крови и в культивируемых клетках пациентов с ICF (рис. 5b) (Tuck-Muller et al., 2000). Гипометилирование околоцентромерных повторяющихся последовательностей на хромосомах 1, 9 и 16 было обнаружено задолго до идентификации гена ICF (Jean-pierre et al., 1993). Эти хромосомы содержат наиболее крупные блоки классических сателлитных (сателлиты 2 и 3) тандемных повторов около центромеров. Тот факт, что ICF вызывается мутациями типа «потери функции» в гене ДНК метилтрансферазы (DNMT3B), метилирующей ДНК de novo, способствовало пониманию роли ослабления метилирования в центромерных сателлитах 2 и 3 (Hansen et al., 1999; Okano et al., 1999; Xu et al., 1999). Однако остается неясным, почему потеря функции у повсеместно экспрессирующейся de novo метилтрансферазы избирательно затрагивает специфические повторяющиеся последовательности. Одно из возможных объяснений связано с внутриклеточным распределением и (или) контекст-специфичным белковым взаимодействием DNMT3B (Bachman et al., 2001). Другая возможность состоит в том, что каталитическая активность DNMT3B в большей степени необходима для метилирования последовательностей нуклеотидов с высокой плотностью CpGs на больших геномных участках, как в случае с сателлитом 2 (Gowher and Jeltsch, 2002) или повторяющейся последовательностью D4Z4, что подразумевается при плече-лопаточно-лицевой миопатии (Kondo et al., 2000). Остается определить, являются ли гипометилированными дополнительные специфические последовательности, но прогнозируется, что гипометилирование ДНК ведет к изменению экспрессии генов, которые играют важную роль в развитии черепно-лицевой области, нервной и иммунной систем. Изучение экспрессии генов с использованием РНК из лимфобластоидных клеточных линий от пациентов с ICF и от здоровых контрольных людей выявило несколько изменений в генах, участвующих в созревании, миграции, активации и хоминге лимфоцитов (Ehrlich et al., 2001). Не понятно, однако, вызывает ли потеря DNMT3B дисрегуляцию таких генов, потому что паттерны метилирования в их промоторах не кажутся измененными. Притом, что единственное выявленное пока гипометилирование при ICF имеет место на саттелитной ДНК, предполагается, что некоторые из генов, измененных при ICF, могут связываться с саттелитной ДНК. Такие нуклеотидные последовательности в типичном случае, будучи метилированными, ведут себя как гетерохроматин; таким образом, при ICF имеет место разрегулированная экспрессия генов, благодаря транс-эффектам гетерохроматиновых участков, обогащенных доменами с сателлитами 2 и 3 (Bickmore and van der Maarel, 2003).Спондилоэпифизарная дисплазия Шимке
Дисплазия Шимке (SIOD, OMIM 242900) — это аутосомное рецессивное мультисистемное нарушение, характеризующееся дисплазией позвоночника и концов длинных костей, недостаточностью роста, функциональными почечными аномалиями вследствие очагового (центрального) гломерулосклероза, гипотироидизмом и дефектным Т-клеточным иммунитетом (Schimke et al., 1971; Spranger et al., 1991). SIOD вызывается мутациями в SMARCAL1 (SWl/SNF2-CBB3aHHbm, ассоциированный с матриксом; актин-зависимый регулятор хроматина, подсемейство а-like 1), который кодирует белок, регулирующий транскрипционную активность посредством ремоделинга хроматина (Boerkoel et al., 2002). Нонсенс-мутации и мутации сдвига рамки считывания вызывают тяжелые нарушения фенотипа, тогда как некоторые из миссенс-мутаций вызывают возникновение более мягких, или частично выраженных фенотипов (Boerkoel et al., 2002). Недавно у пациента с лимфомой В-клетоки с SIOD была обнаружены мутации в SMARCAL; это предполагает, что потеря функции данного белка может вызывать фатальное лимфопролиферативное расстройство (Taha et al., 2004). Остается прояснить точный механизм, посредством которого утрата SMARCAL1 вызывает фенотип SIOD.Дефицит метилентетрагидрофолатредуктазы
Метилентетрагидрофолатредуктаза (MTHFR) участвует в превращении 5, 10-метилентетрагидрофолата (5,10-MTHF) в 5-метилтетрафолат (5MTHF). Метальная группа приобретается затем от 5MTHF во время превращения гомоцистеина в метионин с помощью метионинсинтазы. Метионин далее превращается в S-аденозилметионин (SAM), основной донор метила для всех метилтрансфераз. Дефицит MTHFR вызывает редкое аутосомное рецессивное расстройство, характеризующееся умственной отсталостью (Rozen, 1996). Обычный термолабильный полиморфизм (6770Т, который изменяет аланин на валин) вызывает понижение активности MTHFR и ассоциировался, особенно у гомозоготных пациентов, в диете которых низкое содержание фолатов, с гипергомоцистеинемией (Goyette et al., 1994). Этот полиморфизм изучался как фактор риска возникновения атеросклероза, дефектов нервной трубки и рака (Ма et al., 1997; Brattstrometal., 1998; Chenetal., 1999; Bottoand Yang, 2000; Schwahn and Rozen, 2001). Мыши, гетерозиготные или гомозиготные по нулевой аллели MTHFR, имеют пониженный уровень SAM, пониженное общее метилирование ДНК. Более того, такие нуль-мутанты имеют липидные отложения на аорте и дегенерацию нейронов (Chen et al., 2001). Общее изменение метилирования ДНК, связанное с частичной или полной потерей MTHFR, позволяет предположить, что некоторые из фенотипов, ассоциирующиеся с этими дисфункциями, могут являться следствием нарушений хроматина благодаря пониженному метилированию ДНК (и, возможно, гистонов). Имеется одно сообщение о том, что дефицит MTHFR вызывает фенотип, характерный для синдрома Ангелмана (Arn et al., 1998), и имеются существенные совпадения тяжелой недостаточности по MTHFR с AS и RTT (Fattal-Valevski et al., 2000).3.3 Расстройства, влияющие на структуру хроматина в cis-конфигурации
Гены большинства менделирующих нарушений обычно идентифицируются путем обнаружения мутаций либо в экзонах, либо в сайтах сплайсинга, в результате чего продукты данного гена, РНК или белок, изменяются или не производятся. Однако для многих из этих расстройств мы нередко имеем небольшую группу пациентов, у которых мутации не могут быть идентифицированы после секвенирования кодирующих и некодирующих участков гена несмотря на сцепление со специфическим локусом. Становится все более ясно, что эпигенетические или генетические аномалии, которые влияют на экспрессию генов в сА-конфигурации, лежат в основе некоторых менделирующих нарушений и случаев отсутствия экзонных мутаций. Следующие три примера демонстрируют, как сА-сцепленные изменения в структуре хроматина приводят к заболеванию человека (табл. 23.3).???- и ??-талассемия
Талассемии — это самые обычные в мире моногенные нарушения. Они представляют собой гетерогенную группу нарушений синтеза гемоглобина, вызываемую пониженным уровнем содержания одной или нескольких глобиновых цепей гемоглобина. Дисбаланс синтеза различных глобиновых цепей ведет к аномальному эритропоэзу и тяжелой анемии (Weatherall et al., 2001). Были идентифицированы сотни кодирующих мутаций и мутаций сплайсинга, но именно делеции регуляторных повторностей заострили внимание на том, как изменения в структуре хроматина могут объяснить некоторые подтипы талассемий. Тот факт, что делеции примерно 100 т.о., которые удаляли часть гена ?-глобина, расположенную «вверх по течению» (оставляя ген интактным), вызывали ???-талассемию, помогло идентифицировать участок контроля локуса (LCR), который регулирует экспрессию Р-глобина (Kioussis et al., 1983; Forrester et al., 1990). Меньшие делеции, включающие часть LCR, вызывали ??-талассемию (Curtin etal., 1985; Driscoll etal., 1989). Эти делеции приводили к изменению состояния хроматина в локусе ?-глобина, несмотря на то, что они находились на десятки тысяч пар нуклеотидов «вверх по течению» от кодирующего участка (Grosveld, 1999).Таблица 23.3. Выборочные генетические нарушения, влияющие на структуру хроматина в cis-конфигурации

Синдром ломкой Х-хромосомы
Умственная отсталость, связанная с ломкой Х-хромосомой (OMIM 309550), — это один из наиболее обычных случаев (causes) наследуемой умственной отсталости. Более 60 лет назад Мартин и Белл описали семью, в которой было показано, что умственная отсталость расщепляется как нарушение, сцепленное с Х-хромосомой (Martin and Bell, 1943). В 1969 году Лабе сообщал о сужении на длинном плече Х-хромосомы у некоторых умственно отсталых пациентов мужского пола и у бессимптомных пациентов женского пола (Lubs, 1969). Такой хромосомный вариант был картирован в Xq27.3 и был назван ломкой Х-хромосомой (Harrison et al., 1983). Цитогенетические исследования, особенно те, в которых использовались культуральные среды с дефицитом фолиевой кислоты и тимидина, выявили ломкий сайт в семьях с Х-сцепленной умственной отсталостью; впоследствии эти семьи были диагносцированы как несущие синдром ломкой Х-хромосомы (Sutherland, 1977; Richards et al., 1981). Мужчины с этим синдромом имеют умственную отсталость от умеренной до тяжелой, макроорхидизм, аномалии соединительных тканей, такие как сверхрастяжимость суставов, и большие уши (рис. 23.6) (Hagerman et al., 1984). Ген, отвечающий за синдром ломкой Х-хромосомы,— это ген FMR1, который кодирует белок FMRR Наиболее обычный механизм мутации — это экспансия нестабильного некодирующего повтора CGG (Warren and Sherman, 2001). Нормальные аллели содержат 6—60 повторов, премутационные — 60—200, а полная мутация содержит более 200 повторов. Увеличение количества повторов на 5’UTR гена FMR1 представляет собой превосходный пример генетического расстройства, опосредованного изменением структуры хроматина в cis-конфигурации. Рис. 23.6. Пример генетичесского нарушения, влияющего на хроматин в trans-конфигурации.
Фотография пациента с синдромом ломкой Х-хромосомы, который, помимо умственной отсталости, обладает типичными признаками, а именно выдающимся лбом и большими ушами. Фотография любезно предоставлена доктором Стивеном Уорреном (Dr. Stephen Т. Warren)
Рис. 23.6. Пример генетичесского нарушения, влияющего на хроматин в trans-конфигурации.
Фотография пациента с синдромом ломкой Х-хромосомы, который, помимо умственной отсталости, обладает типичными признаками, а именно выдающимся лбом и большими ушами. Фотография любезно предоставлена доктором Стивеном Уорреном (Dr. Stephen Т. Warren)
Островок CpG в 5’-регуляторном участке FMR1 становится в случае полной мутации аберрантно метилированным после экспансии повторов (Verkerk et al., 1991). Пониженное ацетилирование гистонов на 5’ конце было установлено в клетках пациентов с ломкой Х-хромосомой при сравнении со здоровыми контрольными пациентами (Coffee et al., 1999). В свою очередь, измененные паттерны метилирования ДНК и ацетилирования гистонов приводят к потере экспрессии FMR1, и, соответственно, к потере функции белка FMRP у пациентов с синдромом ломкой Х-хромосомы. Таким образом, эти пациенты имеют первичную генетическую мутацию и вторичную эпигенетическую мутацию. Интересный эпигенетический механизм был предложен для объяснения того, как повтор CGG в гене FMR1 метилируется и впоследствии сайленсируется. Тот факт, что премутационный повтор CGG формирует одиночную и стабильную шпилечную структуру (Handa et al., 2003), наряду с данными о том, что повторы rCGG могут расщепляться Dicer, обусловил возможность того, что обнаружившие экспансию повторы CGG (которые в период раннего развития не метилированы) могут транскрибироваться и что получающаяся в результате РНК образует шпильку, которая может расщепляться Dicer для образования малых некодирующих РНК. Эти молекулы малых РНК связываются с РНК-индуцированным инициатором транскрипционного сайленсинга генов (RITS) и рекрутируют de novo метилтрансферазы ДНК и (или) метилтрансферазы гистонов к 5'UTR гена FMR1, что приводит к полному метилированию повтора CGG и транскрипционной репрессии FMRluo мере развития (Jin et al., 2004а). FMRP — это селективный РНК-связывающий белок, который содержит два домена КН и бокс RGG. Он связывается с полисомами РНК-зависимым способом посредством информационных рибонуклеопротеиновых частиц и предположительно участвует в супрессирующей трансляции как in vitro, так и in vivo (Laggerbauer et al., 2001; Li et al., 2001). Локализация белка FMRP совместно с и PH К и полирибосомами в дендритных шипиках (dendritic spines) свидетельствует о его роли в регуляции локального белкового синтеза в ответ на стимуляцию синапса (Feng et al., 1997; Weiler and Greenough, 1999; Brown et al., 2001; Darnell et al., 2001, 2005). Были идентифицированы предполагаемые мишени FMRP, которые играют роль в развитии синапса и которые могли бы частично объяснить возникновение фенотипов, связанных с нарушением развития нервной системы (Brown et al., 2001; Darnell et al., 2001). Некоторые исследования позволяют предположить, что основной механизм, с помощью которого FMRP регулирует трансляцию — это PH К-интерференция (RNAi). Гомолог ломкой Х-хромосомы у дрозофилы (Dfmrl) связывается с Argonaute (ARG02) и с комплексом РНК-индуцированного сайленсинга (RISC), a FMRP млекопитающих взаимодействует с EIF2C2 и связывается с активностью Dicer (Caudy et al., 2002; Ishizuka et al., 2002; Jin et al., 2004b). Наиболее вероятный механизм, предполагаемый для роли FMRP как супрессора трансляции, состоит в том, что FMRP связывается со специфическими иРНК-лигандами, рекрутирует RISC вместе с miRNAs и облегчает узнавание между miRNAs и иРНК-лигандами (Jin et al., 2004а). У носителей предмутации ломкой Х-хромосомы (60— 200 повторов) развивается отчетливый нейродегенеративный синдром, характеризующийся тремором и атаксией (Hagerman and Hagerman, 2004). Интересно, что эти предмутации могут индуцировать патогенез на уровне РНК, поскольку присутствуют РНК и белок гена FMR. Исследования на модельных животных предполагают, что РНК, кодируемая повторами CGG, присоединяется к некоторым клеточным белкам, изменяет их функцию, вызывая их накопление (Jin et al., 2003; Willemsen et al., 2003).
Плече-лопаточно-лицевая миопатия
Плече-лопаточно-лицевая миопатия (FSHD; OMIM 158900) — это аутосомная доминантная мышечная дистрофия, характеризующаяся прогрессирующим разрушением мускулов лица, предплечья и плеча. Более тяжелые случаи характеризуются потерей слуха, и очень небольшая доля детей, имеющих тяжелую форму заболевания, страдают умственной отсталостью и припадками (Mathews, 2003). Основной локус для FSHD (FSHD1) картируется в субтеломерном участке хромосомы 4q35 рядом с D4Z4 — низкокопийном повторе, который содержит совокупность единиц, обогащенных GC и имеющих длину 3.3 т.о. Эта повторяющаяся совокупность полиморфна и содержит 11—150 единиц на нормальных хромосомах, тогда как на FSHD хромосомах данная совокупность находится в диапазоне 1—10 единиц. (Wijmenga et al., 1992; van Deutekom et al., 1993). Второй вариабильный саттелитный повтор — последовательность ((3-68 п.о. Sau3A) дистальнее D4Z4 — оказывается, принимает участие в развитии FSHD. Вариант 4qA в ?-саттелитном повторе, наряду с сокращением повтора D4Z4 необходим для проявления FSHD (Lemmers et al., 2002). Пока не вполне понятно, как именно сокращение D4Z4 вместе с вариантом 4qA (?-саттелит) вызывет болезнь. Участок 4q35, содержащий D4Z4, имеет сходство с другими субтеломерами и проявляет черты, типичные для гетерохроматиновых участков (Flint etal., 1997; Tupler and Gabellini, 2004). Исследования in vitro и in vivo выявили в D4Z4 последовательность 27 п.о., которая связывается с комплексом, называемым «D4Z4-реапрессирующий комплекс» (DRC), который включает в себя транскрипционный репрессор Ying Yangl (YY1), бокс 2 группы высокой подвижности (HMGB2) и нуклеолин (Gabellini et al., 2002). Бикмор и ван дер Маарель, а также Габеллини с коллегами предположили, что сокращение повторов вызывает менее репрессивное состояние хроматина, что приводит к усиленной транскрипции генов 4q35-qter (Bickmore and van der Maarel, 2003; Tupler and Gabellini, 2004). Обнаружение повышенной экспрессии трех генов — FRGlw 2 (участок FSHD, гены I и 2) и переносчик нуклеотида аденина 1 (ANT1) — в мышцах пациентов с FSHD по сравнению с нормальной мускулатурой, согласуется с этой гипотезой (Gabellini et al., 2002). Остается еще выяснить, являются ли изменения в экспрессии этих генов прямым или косвенным следствием сокращений D4Z4 и влияет ли разрегулировка дополнительных генов на фенотип, связанный с заболеванием.Эпимутации и заболевания человека
У двух индивидуумов, страдавших множественными раковыми заболеваниями, были обнаружены эпимутации в гене MLH1 (ген, исправляющий неправильно спаренные основания в ДНК — DNA mismatch repair gene) (Suter et al., 2004). Во всех нормальных тканях, полученных от этих двух пациентов, было выявлено аномальное метилирование промоторного участка гена MLH. Делеция MLH1 или утрата гетерозиготности по этому гену в ткани опухоли вела к полной утрате белка MLH1. Оба эти пациента страдали раком толстой и прямой кишки, один из них имел рак двенадцатиперстной кишки, а у другой развились рак эндометрия и молочной железы, а также меланома. Степень участия эпимутаций в заболеваниях человека прояснится лишь тогда, когда исследователи начнут систематические поиски таких мутаций.3.4. Взаимодействие эпигенетики и окружающей среды
Данные, полученные на человеке и модельных животных, свидетельствуют, что факторы окружающей среды могут влиять на эпигенетические метки, и, в результате, на функцию гена. Тот факт, что однояйцевые близнецы имеют сходные эпигенотипы в течение первых лет жизни, но демонстрируют существенные различия по содержанию и распределению 5-метилцитозинов и ацетилированных гистонов, является хорошим доказательством того, что эпигенотип метастабилен и проявляет вариабельность во времени (Fraga et al., 2005). Вероятно, многие факторы окружающей среды и стохастические события могут способствовать изменчивости эпигенома (рис. 23.7) (Anway et al., 2005), но потенциальными ключевыми игроками выступают диета и ранний опыт.Диета и эпигенотипы при старении и болезнях
Несколько сообщений указывают на то, что существует зависящее от возраста уменьшение глобального метилирования ДНК, тогда как одновременно может иметь место сайт-специфическое гиперметилирование (Hoal-van Helden and van Helden, 1989; Cooney, 1993; Rampersaud et al., 2000). Притом, что имеется большой массив данных, связывающих изменения в метилировании ДНК с риском возниковения или развития раковых заболеваний (Mays-Hoopes, 1989; Issa et al., 1994), такие эпигенетические изменения могут вносить свой вклад в возрастание риска раковых заболеваний, связанное с возрастом. Роль диеты как фактора, участвующего в контроле статуса глобального метилирования, лучше всего проиллюстрировано на взрослых пациентах мужского пола, страдающих уремией и подвергнутых гемодиализу. Наличие у таких пациентов гипергомоцистинемии предполагает низкое содержание метионина, возможно, преимущественно из-за истощения фолатов. У этих мужчин имело место редуцированное общее и локус-специфическое метилирование ДНК, которое изменялось на противоположное после назначения высоких доз фолиевой кислоты (Ingrosso et al., 2003). Из-за того, что некоторые нейропсихиатрические характеристики, происходящие вследствие недостатка фолатов и витамина В12, перекрываются со свойствами, наблюдаемыми при спорадических нейропсихиатрических нарушениях, было высказано предположение, что последние могут быть вызваны изменениями в паттернах метилирования в центральной нервной системе (Reynolds et al., 1984). Низкие уровни содержания SAM были обнаружены при фолат-зависимой депрессии; более того, добавление SAM помогает как дополнительная терапия при некоторых формах депрессии (Bottiglieri et al., 1994). Наконец, хотя и непонятно, каким образом прием повышенного количества фолиевой кислоты беременными женщинами уменьшает риск дефектов нервной трубки плода, соблазнительно было бы предположить какое-то эпигенетически опосредованное влияние на метилирование ДНК или гистонов. Обнаружение того, что у мышей agouti viable yellow обогащение диеты самок фолиевой кислотой, В12 и бетаином изменяет эпигенотип и фенотип потомства, по-видимому, является первым из множества примеров, которые еще предстоит обнаружить у людей и других млекопитающих (Wolff et al., 1998; Waterland and Jirtle, 2003).Ранний опыт и эпигенотипы
Наилучший пример того, как ранний опыт и материнское поведение могут изменить эпигенотип млекопитающего, пока описан только у крыс. Частое облизывание крысами своих детенышей и груминг изменяют статус метилирования ДНК в промоторном участке гена рецептора глюкокортикоидов (GR) в гиппокампе крысят. У крысят, которых часто вылизывали и подвергали груммингу, имеет место пониженное метилирование ДНК и повышенное ацетилирование гистонов в промоторе GR по сравнению с крысятами, выращенными крысами, которые их редко вылизывали (Weaver et al., 2004). Повышенные уровни содержания GR у крысят, в свою очередь, влияют на регуляцию у них уровня гормона стресса и на их реакцию на стресс в течение всей жизни (Liu et al., 1997; Weaver et al., 2004). Хотя такие данные для человека пока отсутствуют, они безусловно поднимают вопрос относительно роли раннего опыта в модулировании эпигенотипов и риске психиатрических расстройств у людей. Рис. 23.7. Эпигенотип, наряду с генотипом и факторами окружающей среды, играет критическую роль в определении фенотипов
Известные эпигенетические факторы, влияющие на экспрессию генов и стабильность генома, включают метилирование ДНК. комплексы ремоделинга хроматина, ковалентные модификации гистонов, наличие вариантов гистонов или некодирующих ре гуляторных РНК (ncRNA)
Рис. 23.7. Эпигенотип, наряду с генотипом и факторами окружающей среды, играет критическую роль в определении фенотипов
Известные эпигенетические факторы, влияющие на экспрессию генов и стабильность генома, включают метилирование ДНК. комплексы ремоделинга хроматина, ковалентные модификации гистонов, наличие вариантов гистонов или некодирующих ре гуляторных РНК (ncRNA)
4. Глядя в будущее
Мы ожидаем, что в следующем десятилетии мутации, изменяющие эпигенотип, все больше и больше будут признаваться мутационными механизмами, вызывающими ряд нарушений у человека. Традиционно, идентификация генов, вызывающих заболевания, была сфокусирована на таких расстройствах, при которых семейные случаи или случаи у пациентов с хромосомными аномалиями облегчали позиционное клонирование (positional cloning) гена, ответственного за данное расстройство. Мы оказываемся перед вызовом, когда пытаемся обнаружить мутационную основу для некоторых наиболее обычных и разрушительных расстройств, таких как шизофрения, аутизм и нарушения настроения. Семейные случаи не являются такими уж обычными, очень вероятна генетическая гетерогенность, и последнее, но не менее важное, это то, что генетические данные — особенно частота дискордантности у однояйцевых близнецов — не всегда согласуются с моделью простого менделевского наследования Эти данные, вместе с сильным влиянием факторов окружающей среды на пенетрантность некоторых из этих расстройств, подчеркивают важность изучения эпигеномов при такого рода заболеваниях. Даже такие моногенные расстройства, как синдром Ангелмана, синдром Беквита-Видеманна. синдром Сильвера-Рассела, могут быть вызваны либо геномными мутациями, либо мутациями, которые влияют на эпигенотип и могут быть как унаследованными, так и возникающими de novo Такие молекулярные вариации безусловно будут вскрыты для остальных нарушений у человека. Более того, есть основания предполагать, что эпигенетические мутации, которые будут влиять на транскрипцию, сплайсинг РНК или модификации белков, могут вызывать болезни, поскольку существуют данные, показывающие, что уровни содержания нескольких белков, участвующих в эпигенетической регуляции, строго контролируются и что нарушения этих уровней либо из-за мутаций типа утраты функции, либо из-за дупликаций вызывают расстройства у человека.Благодарности
Мы благодарим Д-ра Тимоти Бестора, Д-ра Роберта Роллинза и Д-ра Дебору Буркхис за микрофотографию хромосом пациента с ICF синдромом, Д-ра Даниеля Дрисколла за фотографию пациента с синдромом Прадера-Вилли, Д-ра Карлоса Басино за изображение пациента с синдромом Ангелмана. Д-ра Даниеля Глейза за фотографию пациента с синдромом Ретга и Д-ра Стивена Уоррена за фотографию пациента с синдромом ломкой Х-хромосомы. Мы благодарны коллегам из лаборатории Зогби (Zoghbi) за прочтение данной главы и сделанные великолепные предложения. Мы также благодарим бывших и ныне работающих сотрудников лаборатории, которые участвовали в нашей работе над синдромом Ретга, синдромом Прадера-Вилли и синдромом Ангелмана. И последняя по списку, но не последняя по значению, благодарность нашим пациентам с синдромом Ретга, унипарентной дисомией по 7 хромосоме, синдромом Прадера-Вилли, синдромом Ангелмана и аутизмом, и их семьям за то, что они помогли нам прояснить роль эпигенетики в заболеваниях человека. Наша работа была поддержана грантами Национальных институтов здоровья (NIH) (5 Р01 HD040301-05; 5 Р30 HD024064-17; 5 Р01 HD37283); Международной ассоциацией синдрома Ретга; Фондом исследования синдрома Ретга; организацией «Исцели аутизм сейчас»; Фондом Симонса, March of Dimes (12-FY03-43); и Центром Ретга, клиникой «Синяя птица». H.Y.Z. является исследователем в the Howard Hughes Medical Institute. Мы сожалеем, что из-за ограниченности места мы вынуждены были убрать многие важные и значимые ссылки.Литература
Alarcon J.M., Malleret G., Touzani K., Vronskaya S., Ishii S., Kan-del E.R., and Barco A., 2004. Chromatin acetylation, memory, and LTP are impaired in CBP+/- mice: A model for the cognitive deficit in Rubinstein-Taybi syndrome and its amelioration. Neuron 42: 947-959. Amir R.E., Van den Veyver L.B., Wan M., Tran C.Q., Francke U., and Zoghbi H.Y., 1999. Rett syndrome is caused by mutations in X-linked MECP2, encoding methyl-CpG-binding protein 2. Nat. Genet. 23: 185-188. Anway M.D., Cupp A.S., Uzumcu M., and Skinner M.K., 2005. Epigenetic transgenerational actions of endocrine disrupters and male fertility. Science 308: 1466-1469. Anas J., Alberts A.S.. Brindle P., Claret EX.. Smeal T., Karin M.. Feramisco J., and Montminy M., 1994. Activation of cAMP and mitogen responsive genes relies on a common nuclear factor Nature 370: 226-229. Am P.H., Williams C.A., Zori R.T., Driscoll D.J., and Rosenblatt D.S., 1998. Methylenetetrahydrofolate reductase deficiency in a patient with phenotypic findings of Angelman syndrome. Am. J. Med. Genet. 77: 198-200. Bachman K.E., Rountree M.R., and Baylin S.B., 2001 Dnmt3a and Dnmt3b are transcriptional repressors that exhibit unique localization properties to heterochromatin. J. Biol. Chem. 276: 32282-32287. Bastepe M., Frohlich L.E, Hendy G.N., Indridason O.S., Josse R.G., Koshiyama H., Korkko J., Nakamoto J.M., Rosenbloom A.L., Slyper A.H., et al., 2003. Autosomal dominant pseudohypoparathyroidism type lb is associated with a heterozygous microdeletion that likely disrupts a putative imprinting control element of GNAS. J. Clin. Invest. 112: 1255-1263. Bembe N.G., Mangelsdorf M., Jagla M., Vanderluit J., Garrick D., Gibbons R.J., Higgs D.R., Slack R.S., and Picketts D.J., 2005. The chro-matin-remodeling protein ATRX is critical for neuronal survival during corticogenesis. J.Clin. Invest. 115: 258-267. Bickmore W.A. and van der Maarel S.M., 2003. Perturbations of chromatin structure in human genetic disease: Recent advances. Hum. Mol. Genet. 12: R207-R213. Boerkoel C.E, Takashima H., John J., Yan J., Stankiewicz P., Rosen-barker L., Andre J.L., Bogdanovic R., Burguet A., Cockfield S., et al., 2002. Mutant chromatin remodeling protein SMAR-CAL1 causes Schimke immuno-osseous dysplasia. Nat. Genet. 30: 215-220. Bottiglieri T., Hyland K., and Reynolds E.H., 1994. The clinical potential of ademethionine (S-adenosylmethionine) in neurological disorders. Drugs 48: 137-152. Botto L.D. and Yang Q., 2000. 5,10-Methylenetetrahydrofolate reductase gene variants and congenital anomalies: A HuGE review. Am. J. Epidemiol. 151: 862-877. Brattstrom L., Wilcken D.E., Ohrvik J., and Brudin L., 1998. Common methylenetetrahydrofolate reductase gene mutation leads to hyperhomocysteinemia but not to vascular disease: The result of a meta-analysis. Circulation 98: 2520-2526. Brown V., Jin P., Ceman S., Darnell J.C., O’Donnell W.T., Tenen-baum S.A., Jin X., Feng Y., Wilkinson K.D., Keene J.D., et al., 2001. Microarray identification of FMRP-associated brain mRNAs and altered mRNA translational profiles in fragile X syndrome. Cell 107: 477-487. Carney R.M., Wolpert CM., Ravan S.A., Shahbazian M., Ashley-Koch A., Cuccaro M.L., Vance J.M., and Pericak-Vance M.A., 2003. Identification of MeCP2 mutations in a series of females with autistic disorder. Pediatr. Neurol. 28: 205-211. Caspary T., Cleary M.A., Perlman E.J., Zhang P., Elledge S.J., and Tilgh-man S.M., 1999. Oppositely imprinted genes p57Kip2 and Igf2 interact in a mouse model for Beckwith-Wiedemann syndrome. Genes Dev. 13: 3115-3124. Caudy A.A., Myers M., Hannon G.J., and Hammond S.M., 2002. Fragile X-related protein and VIG associate with the RNA interference machinery. Genes Dev. 16: 2491-2496. Chen J., Giovannucci E.L., and Hunter D.J., 1999. MTHFR polymorphism, methyl-replete diets and the risk of colorectal carcinoma and adenoma among U.S. men and women: An example of gene-environment interactions in colorectal tumorigenesis. J.Nutr. 129: S560-S564. Chen W.G., Chang Q., Lin Y., MeissnerA., West A. E., Griffith E.C., Jaenisch R., and Greenberg M.E., 2003. Derepression of BDNF transcription involves calcium-dependent phosphorylation of MeCP2. Science 302: 885-889. Chen Z., Karaplis A.C., Ackerman S.L., Pogribny LP, Melnyk S., Lussier-Cacan S., Chen M.F., Pai A., John S.W., Smith R.S., et al., 2001. Mice deficient in methylenetetrahydrofolate reductase exhibit hyperhomocysteinemia and decreased methylation capacity, with neuropathology and aortic lipid deposition. Hum. Mol. Genet. 10: 433-443. Chrivia J.C., Kwok R.P., Lamb N., Hagiwara M., Montminy M.R., and Goodman R.H., 1993. Phosphorylated CREB binds specifically to the nuclear protein CBP. Nature 365: 855-859. Coffee B., Zhang E, Warren S.T., and Reines D., 1999. Acetylated histones are associated with FMR1 in normal but not fragile X-syndrome cells (erratum Nat. Genet. 22: 209 [1999]). Nat. Genet. 22: 98-101 Collins A.L., Levenson J.M., Vilaythong A.P., Richman R.D., Armstrong L., Noebels J.L., Sweatt J.D.. andZoghbi H.Y., 2004. Mild overexpression of MeCP2 causes a progressive neurological disorder in mice. Hum. Mol. Genet. 13: 2679-2689. Cooney C.A., 1993. Are somatic cells inherently deficient in methylation metabolism? A proposed mechanism for DNA methylation loss, senescence and aging. Growth Dev. Aging 57: 261-273. CooperW.N., LuhanaA., EvansG.A., RazaH., Haire A.C., Gmndy R., Bowdin S.C., Riccio A., Sebastio G., Bliek J., et al., 2005. Molecular subtypes and phenotypic expression of Beckwith-Wiedemann syndrome. Eur. J. Hum. Genet. 13: 1025-1032. Couvert P., Bienvenu T., AquavivaC., Poirier K., Moraine C., Gen-drot C., Verloes A., Andres C., Le Fevre A.C., Souville I., et al.. 2001. MECP2 is highly mutated in X-linked mental retardation. Hum. Mol. Genet. 10: 941-946. Cox G.F., Burger J., Lip V., Mau U.A., Sperling K., Wu B.L., and Horsthemke B., 2002. Intracytoplasmic sperm injection may increase the risk of imprinting defects. Am. J. Hum. Genet. 71: 162-164 Curtin P., Pirastu M., Kan Y.W., Gobert-Jones J.A., Stephens A.D., and Lehmann H., 1985. A distant gene deletion affects p-globin gene function in an atypical y (^-thalassemia. J.Clin. Invest. 76: 1554-1558. Darnell J.C., Jensen K.B., Jin P., Brown V., Warren S.T., and Darnell R.B., 2001. Fragile X mental retardation protein targets G quartet mRNAs important for neuronal function. Cell 107: 489-499. Darnell J.C., Fraser C.E., Mostovetsky O., Stefani G., Jones T.A., Eddy S.R., and Darnell R.B., 2005. Kissing complex RNAs mediate interaction between the Fragile-X mental retardation protein KH2 domain and brain polyribosomes. Genes Dev., 19: 903-918. DeBaun M.R., Niemitz E.L., and Feinberg A.P., 2003. Association of in vitro fertilization with Beckwith-Wiedemann syndrome and epigenetic alterations of LIT1 and HI9. Am. J. Hum. Genet. 72: 156-160. Dennis C., 2003. Epigenetics and disease: Altered states. Nature 421: 686-688. Ding E, Prints Y., Dhar M.S., Johnson D.K., Gamacho-Montero C., Nicholls R.D., and Francke U., 2005. Lack of Pwcr1/MBII-85 snoRNA is critical for neonatal lethality in Prader-Wlli syndrome mouse models. Mamm. Genome 16: 424-431. Driscoll M.C., Dobkin C.S., and Alter B.P., 1989. ???-thalassemia due to a de novo mutation deleting the 5’ p-globin gene activation-region hypersensitive sites. Proc. Natl. Acad. Sci. 86: 7470-7474. Eggermann T, Wollmann H.A., Kuner R., Eggermann K., Enders H., Kaiser P., and Ranke M.B., 1997. Molecular studies in 37 Silver-Russell syndrome patients: Frequency and etiology of uniparental disomy. Hum. Genet. 100: 415-419. Ehrlich M., 2003. The ICF syndrome, a DNAmethyltransferase 3B deficiency and immunodeficiency disease. Clin. Immunol 109: 17-28. Ehrlich M., Buchanan K.L., Tsien F., Jiang G., Sun B., Uicker W., Weemaes C.M., Smeets D., Sperling K., Belohradsky B.H., et al., 2001. DNA methyltransferase 3B mutations linked to the ICF syndrome cause dysregulation of lymphogenesis genes. Hum. Mol. Genet. 10: 2917-2931. Engel E., 1980. A new genetic concept: Uniparental disomy and its potential effect, isodisomy. Am. J. Med. Genet. 6: 137-143. Fattal-Valevski A., Bassan H., Korman S.H., Lerman-Sagie T., Gutman A., and Harel S., 2000. Methylenetetrahydrofolate reductase deficiency: Importance of early diagnosis./. Child Neurol. 15: 539-543. Feng Y., Absher D., Eberhart D.E., Brown V., Maker H.E., and Warren S.T., 1997. FMRP associates with polyribosomes as an mRNP, and the I304N mutation of severe fragile X syndrome abolishes this association. Mol Cell 1: 109-118. Flint J., Thomas K., Micklem G., Raynham H., Clark K., Doggett N.A., King A., and Higgs D.R., 1997. The relationship between chromosome structure and function at a human telomeric region. Nat. Genet. 15: 252-257. Forrester W.C., Epner E., Driscoll M.C., Enver T., Brice M., Papa-yannopoulouT., andGroudine M., 1990. A deletion of the human beta-globin locus activation region causes a major alteration in chromatin structure and replication across the entire beta-globin locus. Genes Dev. 4: 1637-1649. Fraga M.E., Ballestar E., Paz M.E., Ropero S., Setien E., Ball-estar M.L., Heine-Suner D., Cigudosa J.C., Urioste M., Benitez J., et al., 2005. Epigenetic differences arise during the lifetime of monozygotic twins. Proc. Natl. Acad. Sci. 102: 10604-10609. Gabellini D., Green M.R., and Tupler R., 2002. Inappropriate gene activation in FSHD: A repressor complex binds a chromosomal repeat deleted in dystrophic muscle. Cell 110: 339-348. Gibbons R.J., Picketts D.J., Villard L., and Higgs D.R., 1995. Mutations in a putative global transcriptional regulator cause X-linked mental retardation with alpha-thalassemia (ATR-X syndrome). Cell 80: 837-845. Gibbons R.J., Pellagatti A., Garrick D., Wood W.G., Malik N., Ayyub H., Langford C., Boultwood J.. Wainscoat J.S., and Higgs D.R., 2003. Identification of acquired somatic mutations in the gene encoding chromatin-remodeling factor ATRX in the a-thalassemia myelodysplasia syndrome (ATMDS). Nat. Genet. 34: 446-449. Gicquel C., Rossignol S., Cabrol S., Houang M., Steunou V., Barbu V., Danton R., Thibaud N., Le Merrer M., Burglen L., et al., 2005. Epimutation of the telomeric imprinting center region on chromosome llpl5 in Silver-Russell syndrome. Nat. Genet. 37: 1003-1007. Gowher H. and Jeltsch A., 2002. Molecular enzymology of the catalytic domains of the Dnmt3a and Dnmt3b DNA methyl-transferases. J. Biol. Chem. 277: 20409-20414. Goyette P., Sumner J.S., Milos R., Duncan A.M., Rosenblatt D.S., Matthews R.G., and Rozen R., 1994. Human methylenetetrahydrofolate reductase: Isolation of cDNA, mapping and mutation identification. Nat. Genet. 7: 195-200. Grosveld E., 1999. Activation by locus control regions? Curr. Opin. Genet. Dev. 9: 152-157. Hagberg B.. Aicardi J., Dias K., and Ramos O., 1983. A progressive syndrome of autism, dementia, ataxia, and loss of purposeful hand use in girls: Rett’s syndrome: Report of 35 cases. Ann. Neurol. 14: 471-479. Hagerman P.J. and Hagerman R.J., 2004. The fragile-X premutation: A maturing perspective. Am. J. Hum. Genet. 74: 805-816. Hagerman R.J., Van Housen K., Smith A.C., and McGavran L., 1984. Consideration of connective tissue dysfunction in the fragile X syndrome. Am. J. Med. Genet. 17: 111-121. Handa V., Saha T., and Usdin K., 2003. The fragile X syndrome repeats form RNA hairpins that do not activate the interferon-inducible protein kinase, PKR, but are cut by Dicer. Nucleic Acids Res. 31: 6243-6248. Hansen R.S., Wijmenga C., Luo P., Stanek A.M., Canfield T.K., Weemaes CM., and Gartler S.M., 1999. The DNMT3B DNA methyltransferase gene is mutated in the ICF immunodeficiency syndrome. Proc. Natl. Acad. Sci. 96: 14412-14417. Harikrishnan K.N., Chow M.Z., Baker E.K., Pal S., Bassal S., Bra-sacchio D., Wang L.. Craig J.M., Jones PL., Sif S., and El-Osta A., 2005. Brahma links the SWI/SNF chromatin-remodeling complex with MeCP2-dependent transcriptional silencing. Nat. Genet. 37: 254-264. Hark A.T., Schoenherr C.J., Katz D.J., Ingram R.S., Levorse J.M., andTilghman S.M., 2000. CTCF mediates methylation-sensitive enhancer-blocking activity at the H19/Igf2 locus. Nature 405: 486-489. Harrison C.J., Jack E.M., Allen T.D., and Harris R., 1983. The fragile X: A scanning electron microscope study. /. Med. Genet., 20: 280-285. Hasegawa T., Hara M., Ando M., Osawa M., Fukuyama Y., Taka-hashi M., and Yamada K., 1984. Cytogenetic studies of familial Prader-Willi syndrome. Hum. Genet. 65: 325-330. Hayward B.E., Kamiya M., Strain L., Moran V., Campbell R., Hayashizaki Y, and Bonthron D.T., 1998. The human GNAS1 gene is imprinted and encodes distinct paternally and biallelically expressed G proteins. Proc. Natl. Acad. Sci. 95: 10038-10043. Henry I., Bonaiti-Pellie C., Chehensse V., Beldjord C, Schwartz C, Utermann G., and Junien C., 1991. Uniparental paternal disomy in a genetic cancer-predisposing syndrome. Nature 351: 665-667. Hoal-van Helden E.G. and van Helden P.D., 1989. Age-related methylation changes in DNA may reflect the proliferative pc -tential of organs. Mutat. Res. 219: 263-266. Horike S., Cai S., Miyano M., Cheng J.F., and Kohwi-ShigematsuT., 2005. Loss of silent-chromatin looping and impaired imprinting of DLX5 in Rett syndrome. Nat. Genet. 37: 31-40. Hubbard VS., Davis P.B., di Sant’Agnese PA., Gorden P., and Schwartz R.H., 1980. Isolated growth hormone deficiency and cystic fibrosis: A report of two cases. Am. J. Dis. Chdd 134: 317-319. Ingrosso D., Cimmino A., Pema A.F., Masella L., De Santo N.G., De Bonis M.L., Vacca M., D’Esposito M., D’Urso M., Galletti P., and Zappia V., 2003. Folate treatment and unbalanced methylation and changes of allelic expression induced by hyperhomo-cysteinaemia in patients with uraemia. Lancet 361: 1693-1699. Ishizuka A., Siomi M.C., and Siomi H., 2002. A Drosophila fragile X protein interacts with components of RNAi and ribosomal proteins. Genes Dev. 16: 2497-2508. Issa J.P., Ottaviano Y.L., Celano P., Hamilton S.R., Davidson N.E., and Baylin S.B., 1994. Methylation of the oestrogen receptor CpG island links ageing and neoplasia in human colon. Nat. Genet. 7: 536-540. Jeanpierre M., Turleau C., Aurias A., Prieur M., Ledeist E., Fischer A., and Viegas-Pequignot E., 1993. An embryonic-like methylation pattern of classical satellite DNA is observed in ICF syndrome. Hum. Mol. Genet. 2: 731-735. Jiang Y.H., Armstrong D., Albrecht U., Atkins C.M., Noebels J.L., Eichele C., Sweatt J. D., and Beaudet A. L., 1998. Mutation of the Angelman ubiquitin ligase in mice causes increased cytoplasmic p53 and deficits of contextual learning and long-term potentiation (see comments). Neuron 21: 799-811. Jin P., Alisch R.S., and Warren S.T., 2004a. RNA and microRNAs in fragile X mental retardation. Nat. Cell Biol. 6: 1048-1053. Jin P., Zamescu D.C., Zhang E., Pearson C.E., Lucchesi J.C., Moses K., and Warren S.T., 2003. RNA-mediated neurodegeneration caused by the fragile X premutation rCGG repeats in Drosophila. Neuron 39: 739-747. Jin P., Zamescu D.C, Ceman S., Nakamoto M., Mowrey J., Jongens T.A., Nelson D.L., Moses K., and Warren S.T., 2004b. Biochemical and genetic interaction between the fragile X mental retardation protein and the micro RNA pathway. Nat. Neurosci. 7: 113-117. Joyce J.A., Lam W.K., Catchpoole D.J., Jenks P., Reik W, Maher E.R., and Schofield P.N., 1997. Imprinting of IGF2 and H19: Lack of reciprocity in sporadic Beckwith-Wiedemann syndrome. Hum. Mol. Genet. 6: 1543-1548. Kaufmann W.E., Jarrar M.H., Wang J.S., Lee Y.J., Reddy S., Bibat G., and Naidu S., 2005. Histone modifications in Rett syndrome lymphocytes: A preliminary evaluation. Brain Dev. 27: 331-339. Kioussis D., Vanin E., deLange T., Flavell R.A., and Grosveld E.G., 1983. Beta-globin gene inactivation by DNA translocation in gamma beta-thalassaemia. Nature 306: 662-666. Kishi N. and Macklis J.D., 2004. MECP2 is progressively expressed in post-migratory neurons and is involved in neuronal maturation rather than cell fate decisions. Mol. Cell. Neurosci. 27: 306-321. KishinoT., Lalande M., andWagstaffJ., 1997. UBE3A/E6-APmutations cause Angelman syndrome. Nat. Genet. 15: 70-73. Kondo T., Bobek M.P., Kuick R., Lamb B., Zhu X., Narayan A., Bourc’his D., Viegas-Pequignot E., Ehrlich M., and Hanash S.M., 2000. Whole-genome methylation scan in ICF syndrome: Hypomethylation of non-satellite DNA repeats D4Z4 and NBL2. Hum. Mol. Genet. 9: 597-604. Korenke G.C., Fuchs S., Krasemann E., Doerr H.G., Wilichowski E., Hunneman D.H., and Hanefeld F., 1996. Cerebral adreno-leukodystrophy (ALD) in only one of monozygotic twins with an identical ALD genotype. Ann. Neurol. 40: 254-257. Kwok R.P., Lundblad J.R., Chrivia J.C., Richards J.P., Bachinger H.P., Brennan R.G., Roberts S.G., Green M.R., and Goodman R.H., 1994. Nuclear protein GBP is a coactivator for the transcription factor CREB. Nature 370: 223-226. Laggerbauer B.. Ostareck D., Keidel E.M.. Ostareck-Lederer A., and Fischer U., 2001. Evidence that fragile X mental retardation protein is a negative regulator of translation. Hum. Mol. Genet. 10: 329-338. Ledbetter D.H., Riccardi V.M., Airhart S.D., Strobel R.J., Keenan B.S., and Crawford J. D., 1981. Deletions of chromosome 15 as a cause of the Prader-Willi syndrome. N. Engl. J. Med. 304: 325-329. Lee M.P., DeBaun M.R., Mitsuya K., Galonek H.L., Brandenburg S., Oshimura M., and Feinberg A.P., 1999. Loss of imprinting of a paternally expressed transcript, with antisense orientation to KVLQT1, occurs frequently in Beckwith-Wiedemann syndrome and is independent of insulin-like growth factor II imprinting. Proc. Natl. Acad. Sci. 96: 5203-5208. Lemmers R.J., de Kievit P, Sandkuijl L., Padberg G.W., van Ommen G.J., Frants R.R., and van der Maarel S.M., 2002. Facioscapulohumeral muscular dystrophy is uniquely associated with one of the two variants of the 4q subtelomere. Nat. Genet. 32: 235-236. Lewis J.D., Meehan R.R., Henzel W.J., Maurer-Fogy I., Jeppesen P., Klein F., and Bird A., 1992. Purification, sequence, and cellular localization of a novel chromosomal protein that binds to methylated DNA. Cell 69: 905-914. Li Z., Zhang Y., Ku L., Wilkinson K.D., Warren S.T., and Feng Y., 2001. The fragile X mental retardation protein inhibits translation via interacting with mRNA. Nucleic Acids Res. 29: 2276-2283. Liu D., Diorio J., Tannenbaum B., Caldji C., Francis D., Freedman A., Sharma S., Pearson D., Plotsky P.M., and Meaney M.J., 1997. Maternal care, hippocampal glucocorticoid receptors, and hypothalamic-pituitary-adrenal responses to stress Science 277: 1659-1662. Lubs H.A., 1969. A marker X chromosome. Am. J. Hum. Genet. 21: 231-244. Ludwig M., Katalinic A., Gross S., Sutcliffe A., Varon R., and Horst-hemke B., 2005. Increased prevalence of imprinting defects in patients with Angelman syndrome bom to subfertile couples. J. Med. Genet. 42: 289-291. Ma J., Stampfer M.J., Giovannucci E., Artigas C, Hunter D.J., Fuchs C, Willett W.C., Selhub J., Hennekens C.H., and Rozen R.. 1997. Methylenetetrahydrofolate reductase polymorphism, dietary interactions, and risk of colorectal cancer. Cancer Res. 57: 1098-1102. Magenis R.E., Brown M.G., Lacy D.A., Budden S., and LaFranchi S., 1987. Is Angelman syndrome an alternate result of del( 15) (qllql3)?Am/. Med. Genet. 28: 829-838. Martin J. and Bell J., 1943. A pedigree of mental defect showing sex-linkage. Arch. Neurol. Psychiat. 6: 154-157. Martinowich K., Hattori D., Wu F.L., Fouse S., He E., Hu Y., Fan G., and Sun Y.E., 2003. DNA methylation-related chromatin remodeling in activity-dependent Bdnf gene regulation. Science 302: 890-893. Mathews K.D., 2003. Muscular dystrophy overview. Genetics and diagnosis. Neurol Clin. 21: 795-816 Matsuura T., Sutcliffe J.S., Fang P., Galjaard R.J., Jiang Y.H., Benton C.S., Rommens J.M., and Beaudet A.L., 1997. De novo truncating mutations in E6-AP ubiquitin-protein ligase gene (UBE3A) in Angelman syndrome. Nat. Genet. 15: 74-77. Mayr B. and Montminy M., 2001. Transcriptional regulation by the phosphoiylation-dependent factor CREB. Nat. Rev. Mol. Cell. Biol. 2: 599-609. Mays- Hoopes L.L., 1989. Age-related changes in DNA methylation: Do they represent continued developmental changes? Int. Rev. Cytol. 114: 181-220. McDowell T.L., Gibbons R.J., Sutherland F.L, O’Rourke D.M., Bickmore W.A., Pombo A., Turley H., Gatter K., Picketts D.J., Buckle V.J., et al., 1999. Localization of a putative transcriptional regulator (ATRX) at pericentromericheterochromatin and the short arms of acrocentric chromosomes. Proc. Natl. Acad. Sci. 96: 13983-13988. Meguro M., Mitsuya K., Nomura N., Kohda M., KashiwagiA., Nishigaki R., Yoshioka H., Nakao M., Oishi M., and Oshimura M., 2001. Large-scale evaluation of imprinting status in the Prader-Willi syndrome region: An imprinted direct repeat cluster resembling small nucleolar RNA genes. Hum. Mol. Genet. 10: 383-394. Meins M., Lehmann J., Gerresheim F., Herchenbach J., Hagedom M., Hameister K., and Epplen J.T., 2005. Submicroscopic duplication in Xq28 causes increased expression of the MECP2 gene in a boy with severe mental retardation and features of Rett syndrome. J. Med. Genet. 42: e12. Meloni I., Bruttini M., Longo I., Mari E., Rizzolio F. D’Adamo P.. Den-vriendt K., Fryns J.P., Toniolo D., and Renieri A., 2000. A mutation in the Rett syndrome gene, MECP2, causes X-linked mental retardation and progressive spasticity in males. Am. J. Hum. Genet. 67: 982-985. Mullaney B.C., Johnston M.V., and Blue M.E., 2004. Developmental expression of methyl-CpG binding protein 2 is dynamically regulated in the rodent brain. Neuroscience 123: 939-949. Murata T., Kurokawa R., Krones A., Tatsumi K., Ishii M., Taki T., Masuno M., Ohashi H, Yanagisawa M., Rosenfeld M.G.. et al., 2001. Defect of histone acetyltransferase activity of the nuclear transcriptional coactivator CBP in Rubinstein-Taybi syndrome Hum. Mol. Genet. 10: 1071-1076. Nan X., Campoy F.J., and Bird A., 1997. MeCP2 is a transcriptional repressor with abundant binding sites in genomic chromatin. Cell 88: 471-481. Neul J.L. and Zoghbi H.Y., 2004. Rett syndrome: A prototypical neurodevelopmental disorder. Neuroscientist 10: 118-128. Nicholls R.D., Knoll J.H.M., Butler M.G., Karam S., and Lalande M., 1989. Genetic imprinting suggested by maternal heterodisomy in nondeletion Prader-Willi syndrome. Nature 342: 281-285. Nuber U.A., Kriaucionis S., RoloffT.C., Guy J., Selfridge J., Stein-hoff G, Schulz R., Lipkowitz B., Ropers H.H., Holmes M.C., and Bird A., 2005. Up-regulation of glucocorticoid-regulated genes in a mouse model of Rett syndrome. Hum. Mol. Genet. 14: 2247-2256. Ogryzko V.V., Schiltz R.L., Russanova V., Howard B.H., and Naka-tani Y., 1996. The transcriptional coactivators p300 and CBP are histone acetyltransferases. Cell 87: 953-959. Ohta T., Gray T.A., Rogan P.K., Buiting I.C., Gabriel J.M., Saitoh S., Muralidhar B., Bilienska B., Krajewska-Walasek M., Driscoll D.J., et al., 1999. Imprinting-mutation mechanisms in Prader-Willi syndrome. Am. J. Hum. Genet. 64: 397-413. Okano M., Bell D.W., Haber D.A., and Li E., 1999. DNA meth-yltransferases Dnmt3a and Dnmt3b are essential for de novo methylation and mammalian development. Cell 99: 247-257. Orstavik K.H., Eiklid K., van der Hagen C.B., Spetalen S., Kierulf K., Skjeldal O., and Buiting K., 2003. Another case of imprinting defect in a girl with Angelman syndrome who was conceived by intracytoplasmic semen injection. Am. J. Hum. Genet. 72: 218-219. Petrij E., Giles R.H., Dauwerse H.G., Sans J.J., Hennekam R.C., Masuno M., Tommerup N., van Ommen G J., Goodman R.H., Peters D.J., et al., 1995. Rubinstein-Taybi syndrome caused by mutations in the transcriptional co-activator CBP. Nature 376: 348-351. Petroms A., 2004. The origin of schizophrenia: Genetic thesis, epigenetic antithesis, and resolving synthesis. Biol. Psychiatry 55: 965-970. Picketts D.J., Higgs D.R., Bachoo S., Blake D.J., Quarrell O.W., and Gibbons R.J., 1996. ATRX encodes a novel member of the SNF2 family of proteins: Mutations point to a common mechanism underlying the ATR-X syndrome. Hum. Mol. Genet. 5: 1899-1907. Pieretti M., Zhang E., Fu Y.-H., Warren S.T., Oostra B.A., Caskey C.T., and Nelson D. L., 1991. Absence of expression of the FMR-1 gene in fragile X syndrome. Cell 66: 817-822. Ping A.J., Reeve A.E., Law D.J., Young M.R., Boehnke M., and Feinberg A.P., 1989. Genetic linkage of Beckwith-Wiedemann syndrome to 1 lpl5. Am. J. Hum. Genet. 44: 720-773. Prawitt D., Enklaar T., Gartner-Rupprecht B., Spangenberg C., Oswald M., Lausch E., Schmidfke P., Reutzel D., Fees S., Lucito R., et al., 2005. Microdeletion of target sites for insulator protein CTCF in a chromosome 1 lpl5 imprinting center in Beckwith-Wiedemann syndrome and Wilms’ tumor. Proc. Natl. Acad. Sci. 102: 4085-4090. Rampersaud G.C., Kauwell G.P., Hutson A.D.. Cerda J.J., and Bailey L.B., 2000. Genomic DNA methylation decreases in response to moderate folate depletion in elderly women. Am. J. Clin.Nutr. 72: 998-1003. Reik W., 1989. Genomic imprinting and genetic disorders in man. Trends Genet. 5: 331-336. Reynolds E.H., Carney M.W., and Toone B.K., 1984. Methylation and mood. Lancet 2: 196-198. Richards B.W., Sylvester P.E., and BrookerC., 1981. Fragile X-linked mental retardation: The Martin-Bell syndrome. J. Merit. Defic. Res. 25: 253-256. Roelfsema J.H., White S.J., Ariyurek Y., Bartholdi D., Niedrist D., Papadia E., Bacino C.A., den Dunnen J.T., van Ommen G.J., Breuning M.H., et al., 2005. Genetic heterogeneity in Rubinstein-Taybi syndrome: Mutations in both the CBP and EP300 genes cause disease. Am. J. Hum. Genet. 76: 572-580. Rougeulle C., Cardoso C., Fontes M., Colleaux L., and Lalande M., 1998. An imprinted antisense RNA overlaps UBE3A and a second maternally expressed transcript. Mat Genet., 19: 15-16. Rozen R., 1996. Molecular genetics of methylenetetrahydrofolate reductase deficiency. /. Inherit. Metab. Dis., 19: 589-594. Runte M., Varon R., Horn D., Horsthemke B., and Buiting K., 2005. Exclusion of the C/D box snoRNA gene cluster HBII-52 from a major role in Prader-Willi syndrome. Hum. Genet. 116: 228-230. Schimke R.N., Horton W.A., and King C.R., 1971. Chondroitin-6-sulphaturia, defective cellular immunity, and nephrotic syndrome. Lancet 1: 1088-1089. Schule B., Albalwi M., Northrop E., Francis D.L., Rowell M., Slater H.R., Gardner R.J., and Francke U., 2005. Molecular breakpoint cloning and gene expression studies of a novel translocation t(4; 15)(q27 ;ql 1.2) associated with Prader-Willi syndrome. BMC Med. Genet. 6: 18. Schwahn B. and Rozen R., 2001. Polymorphisms in the methylenetetrahydrofolate reductase gene: Clinical consequences. Am. J. Pharmacogenomics 1. 189-201. Shahbazian M.D., Antalffy B., Armstrong D.L., and Zoghbi H.Y., 2002a. Insight into Rett syndrome: MeCP2 levels display tissue- and cell-specific differences and correlate with neuronal maturation. Hum. Mol. Genet. 11: 115-124. Shahbazian M., Young J., Yuva-Paylor L., Spencer C., Antalffy B., Noebels J., Armstrong D., Paylor R., and Zoghbi H., 2002b. Mice with truncated MeCP2 recapitulate many Rett syndrome features and display hyperacetylation of histone H3. Neuron 35: 243-254. Smeets D.F., Moog U., Weemaes C.M.. Vaes-Peeters G., Merkx G.F., Niehof J.P., and Hamers G., 1994. ICF syndrome: A new case and review of the literature. Hum. Genet. 94: 240-246. Smeets D.F., Hamel B.C., Nelen M.R., Smeets H.J., Bollen J.H., Smits A.P., Ropers H.H., and van Oost B.A., 1992. Prader-Willi syndrome and Angelman syndrome in cousins from a family with a translocation between chromosomes 6 and 15. A. Engl. J. Med. 326: 807-811. Smilinich N.J., Day CD., Fitzpatrick G.V., Caldwell G.M., Lossie A.C., Cooper P.R., Smallwood A.C., Joyce J.A., Schofield P.N., Reik W., et al., 1999. A maternally methylated CpG island in KvLQTl is associated with an antisense paternal transcript and loss of imprinting in Beckwith-Wedemann syndrome. Proc. Natl. Acad. Sci. 96: 8064-8069. Spence J.E., Perciaccante R.G., Greig G.M., Willard H.F., Ledbetter D.H., Hejtmancik J.F., Pollack M.S., O’Brien W.E., and Beaudet A.L., 1988. Uniparental disomy as a mechanism for human genetic disease. Am. J. Hum. Genet. 42: 217-226. Spranger J., Hinkel G.K., Stoss H.. Thoenes W., Wargowski D., and Zepp E., 1991. Schimke immuno-osseous dysplasia: A newly recognized multisystem disease./. Pediatr. 119: 64-72. Sun F.L., Dean W.L., Kelsey G., Allen N.D., and Reik W., 1997. Transactivation of Igf2 in a mouse model of Beckwith-Wiedemann syndrome. Nature 389: 809-815. Suter C.M., Martin D.L., and Ward R.L., 2004. Germline epimuta-tion of MLH1 in individuals with multiple cancers. Nat. Genet. 36: 497-501. Sutherland G.R., 1977. Fragile sites on human chromosomes: Demonstration of their dependence on the type of tissue culture medium. Science, 197: 265-266. Taha D., Boerkoel C.F., Balfe J.W., Khalifah M., Sloan E.A., Barbar M., Haider A., and Kanaan H., 2004. Fatal lymphoproliferative disorder in a child with Schimke immuno-osseous dysplasia. Am. J. Med. Genet. A 131: 194-199. Tommerup N., van der Hagen C.B., and Heiberg A., 1992. Tentative assignment of a locus for Rubinstein-Taybi syndrome to 16pl 3.3 by a de novo reciprocal translocation, t(7; 16)(q34;pl3.3). Am. J. Med. Genet. 44: 237-241 Tsai T.E., Jiang Y.H.. Bressler J., Armstrong D.. and Beaudet A.L., 1999. Paternal deletion from Snrpn to Ube3a in the mouse causes hypotonia, growth retardation and partial lethality and provides evidence for a gene contributing to Prader-Willi syndrome. Hum. Mol. Genet. 8: 1357-1364. Tuck-Muller C.M., Narayan A., Tsien E., Smeets D.F., Sawyer J., Fiala E.S., Sohn O.S., and Ehrlich M., 2000. DNAhypomethyla-tion and unusual chromosome instability in cell lines from ICF syndrome patients. Cytogenet. Cell Genet. 89: 121-128. Tupler R. and Gabellini D.. 2004. Molecular basis of facioscapulohumeral muscular dystrophy. Cell. Mol. Life Sci. 61: 557-566. van Deutekom J.C, Wijmenga C., van Tienhoven E.A., Gruter A.M., Hewitt J.E., Padberg G.W., van Ommen G.J., Hofker M.H., and Frants R.R., 1993. FSHD associated DNA rearrangements are due to deletions of integral copies of a 3.2 kb tandemly repeated unit. Hum. Mol. Genet. 2: 2037-2042. Van Esch H., Bauters M., Ignatius J., Jansen M., Raynaud M., Hollanders K., Lugtenberg D., Bienvenu T., Jensen L.R., Gecz J., et al., 2005. Duplication of the MECP2 region is a frequent cause of severe mental retardation and progressive neurological symptoms in males. Am. J. Hum. Genet. 77: 442-453. VerkerkA. J.M.H., PierettiM., Sutcliffe J. S., FuY-H., KuhlD.RA., Pizutti A., Reiner O., Richards S., Victoria M.E, Zhang R., et al., 1991. Identification of a gene (FMR-1) containing a CGG repeat coincident with a breakpoint cluster region exhibiting length variation in fragile X syndrome. Cell 65: 905-914. Villard L., Gecz J., Mattel J.F., Fontes M., Saugier-Veber P., Mun-nich A., and Lyonnet S., 1996. XNP mutation in a large family with Juberg-Marsidi syndrome. Nat. Genet. 12: 359-360. Wan M., Zhao K., Lee S.S., and Francke U., 2001. A/FCP2 truncating mutations cause histone H4 hyperacetylation in Rett syndrome. Hum. Mol. Genet 10: 1085-1092. Wan M., Lee S.S., Zhang X., Houwink-Manville I., Song H.R., Amir R.E., Budden S., Naidu S., Pereira J.L., Lo I.F., et al., 1999. Rett syndrome and beyond: Recurrent spontaneous and familial MECP2 mutations at CpG hotspots. Am. J. Hum. Genet. 65: 1520-1529. Warren S.T. and Sherman S.L., 2001. The fragile X syndrome. In The metabolic and molecular bases of inherited disease, 8th edition (ed. C.R. Scriver et al.), vol. 1, pp. 1257-1289. McGraw-Hill, New York. Waterland R.A. and Jirtle R.L., 2003. Transposable elements: Targets for early nutritional effects on epigenetic gene regulation. Mol. Cell. Biol. 23: 5293-5300. Weatherall D.J., Clegg M.B., Higgs D.R., and Wood W.G., 2001. The hemoglobinopathies. In The metabolic & molecular bases of inherited disease, 8th edition (ed. C.R. Scriver et al.), pp. 4571-4636. McGraw-Hill, New York. Weaver I.C., CervoniN., Champagne F.A., D’Alessio A.C., Sharma S., Seckl J.R., Dymov S., Szyf M., and Meaney M.J., 2004. Epigenetic programming by maternal behavior. Nat. Neurosci. 7: 847-854. Weiler I.J. and Greenough W.T., 1999. Synaptic synthesis of the Fragile X protein: Possible involvement in synapse maturation and elimination. Am. J. Med. Genet. 83: 248-252. Weksberg R., Smith A.C., Squire J., and Sadowski P., 2003. Beckwith-Wiedemann syndrome demonstrates a role for epigenetic control of normal development. Hum. Mol. Genet. 12: R61-R68 Weksberg R., Nishikawa J., Caluseriu O., Fei Y.L., Shuman C., Wei C., Steele L., Cameron J., Smith A., Ambus I., et al., 2001. Tumor development in the Beckwith-Wiedemann syndrome is associated with a variety of constitutional molecular 1 lpl5 alterations including imprinting defects of KCNQIOTI. Hum. Mol. Genet. 10: 2989-3000. Weksberg R., Teshima I., Williams B.R., Greenberg C.R., Pueschel S.M., Chemos J.E., Fowlow S.B., Hoyme E., Anderson I.J., Whiteman D.A., et al., 1993. Molecular characterization of cytogenetic alterations associated with the Beckwith-Wiedemann syndrome (BWS) phenotype refines the localization and suggests the gene for BWS is imprinted. Hum. Mol. Genet. 2: 549-556. Wijmenga C., Hewitt J.E., Sandkuijl L.A., Clark L.N., Wnght T.J., Dauwerse H.G., Gruter A.M., Hofker M.H., Moerer P., Williamson R., et al., 1992. Chromosome 4q DNA rearrangements associated with facioscapulohumeral muscular dystrophy. Nat. Genet. 2: 26-30. Willemsen R., Hoogeveen-Westerveld M., Reis S., Holstege J., Severij-nen L.A., Nieuwenhuizen I.M.. Schrier M., Van Unen L., Tassone E., Hoogeveen A.T., et al., 2003. The FMR1 CGG repeat mouse displays ubiquitin-positive intranuclear neuronal inclusions; implications for the cerebellar tremor/ataxia syndrome. Hum. Mol. Genet. 12: 949-959. Wolff G.L., Kodell R.L., Moore S.R., and Cooney C.A., 1998. Maternal epigenetics and methyl supplements affect agouti gene expression in A?? mice. Faseb J. 12: 949-957. Xu G.L., Bestor T.H., Bourc’his D., Hsieh C.L., Tommerup N, Bugge M.. Hulten M.. QuX., Russo J.J.. and Viegas-Pequignot E., 1999. Chromosome instability and immunodeficiency syndrome caused by mutations in a DNA methyltransferase gene. Nature 402: 187-191. Yntema H.G., Poppelaars F.A., Derksen E., Oudakker A.R., van Roos-malen T, Jacobs A., Obbema H., Brunner H.G., Hamel B.C., and van Bokhoven H., 2002. Expanding phenotype of XNP mutations: Mild to moderate mental retardation. Am. J. Med. Genet. 110: 243-247. Young J.I.. Hong E.P., Castle J., Crespo-Barreto J.. Bowman A.B., Rose M.F., Kang D., Richman R., Johnson J.M., Berget S., and Zoghbi H.Y., 2005. Inaugural article: Regulation of RNA splicing by the methylation-dependent transcriptional repressor methyl-CpG binding protein 2. Proc. Natl. Acad. Sci. 102: 17551-17558. Zeev B.B., Yaron Y, Schanen N.C., Wolf H., Brandt N., Ginot N., Shomrat R., and Orr-Urtreger A., 2002. Rett syndrome: Clinical manifestations in males with MECP2 mutations. J. Child Neurol. 17: 20-24.Глава 24. Эпигенетические детерминанты при раковых заболеваниях
 Stephen В. Baylin1 и Peter A. Jones2
1Cancer Biology Program, The Sidney Kimmel Cancer Center; Johns Hopkins Medical Institutions, Baltimore, Maryland 21231
2Department of Urology Biochemistry and Molecular Biology, USC/Norris Comprehensive Cancer Center, Keck School of Medicine, University of Southern California, Los Angeles, California 90089-9181
Stephen В. Baylin1 и Peter A. Jones2
1Cancer Biology Program, The Sidney Kimmel Cancer Center; Johns Hopkins Medical Institutions, Baltimore, Maryland 21231
2Department of Urology Biochemistry and Molecular Biology, USC/Norris Comprehensive Cancer Center, Keck School of Medicine, University of Southern California, Los Angeles, California 90089-9181
Общее резюме
Рак вызывается наследуемым нарушением регуляции генов, которые определяют, когда клетки делятся, погибают и перемещаются из одной части тела в другую. В процессае канцерогенеза гены могут становиться активированными таким образом, что усиливают пролиферацию клеток или предотвращают клеточную гибель, или, наоборот, гены могут инактивироваться так, что они не могут более сдерживать эти процессы. Первый класс генов называется «онкогены», а второй — гены-суппрессоры опухолей («tumor suppressor genes»). Между этими двумя классами генов существует взаимодействие, которое и приводит к образованию раковой опухоли. Гены могут инактивироваться как минимум тремя способами, включающими в себя (1) возможную мутацию гена, делающую его неспособным выполнять свою функцию, (2) полную утрату гена, что, таким образом приводит к неспособности его нормально работать и (3) ген. который не мутировал и не был утрачен, может быть наследственно выключен вследствие эпигенетических изменений. Такой эпигенетический сайленсинг может включать в себя модификации гистонов, связывание белков-репрессоров и неправильное метилирование остатков цитозина (С) в СрС-мотивах, которые находятся внутри контрольных участков, управляющих экспрессией генов. В данной главе делается акцент на на этом третьем пути. Основные молекулярные механизмы, отвечающие за поддержание «молчащего» состояния, довольно хорошо понятны, что и представлено в этой книге. Далее, мы также знаем, что эпигенетический сайленсинг имеет важное значение для профилактики, диагностики и терапии раковых заболеваний. В нашем распоряжении сейчас имеются лекарства, одобренные американской FDA, которые могут ревертировать эпигенетические изменения и восстановить генную активность в раковых клетках. Поскольку изменения в метилировании ДНК можно анализировать с высокой степенью чувствительности, многие стратегии в ранней диагностике раковых заболеваний базируются на выявлении изменений в метилировании ДНК. Поэтому возможности эпигенетики в исследованиях, диагностике, профилактике и лечении рака у человека, являются совершенно исключительными.1. Биологическая основа раковых заболеваний
В конечном счете, рак является заболеванием экспрессии генов, при котором нарушается нормальная работа сложных сетей, управляющих гомеостазом у многоклеточных организмов, что позволяет клеткам расти вне связи с нуждами организма как целого. Большие успехи были достигнуты в описании той подгруппы клеточных контрольных путей, которые нарушаются при раке у человека (табл. 24.1). Тот факт, что почти при всех раковых заболеваниях, наследуемым нарушениям подвержено это ограниченное число клеточных контрольных путей, и является ключевой идеей, которая продвинула данную область исследований (Hanahan and Weinberg, 2000). Основное внимание до последних нескольких лет было сосредоточено на генетических основах раковых заболеваний, в частности, на мутационной активации онкогенов или инактивации генов-супрессоров опухолей. Однако увеличивающийся массив данных, появившихся с середины 1990-х годов, показывает, что наследуемые изменения, регулируемые эпигенетическими модификациями, также могут играть критическую роль в эволюции раковых заболеваний всех типов у человека (рис. 24.1) (Jones and Laird, 1999; Jones and Baylin, 2002; Herman and Baylin, 2003). Эти данные, в частности паттерны метилирования ДНК и хроматина, которые при раке фундаментально изменяются, привели к новым возможностям в понимании, диагностике, лечении и профилактике раковых заболеваний. Генетические и эпигенетические аномалии могут вызывать наследуемые нарушения путей обеспечения гомеостаза при помощи двух различных механизмов. Может иметь место либо активация онкогенов, в основном, через активацию точечных мутаций, либо могут быть инактивированы гены-супрессоры опухолей (Jones and Laird, 1999; Hanahan and Weinberg, 2000; Jones and Baylin, 2002; Herman and Baylin, 2003). Например, при раковых заболеваниях человека часто обнаруживаются мутации в сигнальном гене (онкогене), таком как RAS, которые усиливают активность генного продукта в стимуляции роста. Эти мутации часто являются доминантными и стимулируют возникновение онкологических заболеваний. С другой стороны, генетические мутации и эпигенетический сайленсинг генов-супрессоров опухолей, часто являются рецессивными, требующими разрушительных событий в обеих аллельных копиях гена для полной экспрессии трансформированного фенотипа. Идея о том, что в малигнизированной клеточной линии должны быть выведены из строя обе копии гена-супрессора опухолей была предложена Кнудсоном (Knudson, 2001) и широко принята. Сейчас понятно, что три класса «ударов» могут действовать в различных комбинациях, вызывая полную потерю активности генов-супрессоров опухолей Прямые мутации в кодирующей последовательности, потеря частей или целых копий генов, или эпигенетический сайленсинг могут взаимодействовать друг с другом, что может приводить ключевые контрольные гены в нерабочее состояние (рис. 24.2).Табл. 24.1. Ключевые клеточные пути, которые нарушаются генетическими и эпигенетическими механизмами при раковых заболеваниях человека

 Рис. 24.1. Эпигенетические изменения, связанные с метилированием ДНК, могут приводить к раковым заболеваниям при помощи различных механизмов
Утрата метилирования по цитозину в ДНК (гипо) приводит к нестабильности генома. Локальное гиперметилирование в промоторе гена (гипер) вызывает наследуемый сайленсинг и, следовательно, инактивацию генов-супрессоров опухоли. Кроме того, метилированные сайты CpG представляют собой горячие точки для мутаций типа транзиций С>Т, вызванных спонтанным гидролитическим дезаминированием. Метилирование сайтов CpG также повышает связывание некоторых химических канцерогенов с ДНК и повышает частоту мутаций, индуцированных УФ-излучением
Рис. 24.1. Эпигенетические изменения, связанные с метилированием ДНК, могут приводить к раковым заболеваниям при помощи различных механизмов
Утрата метилирования по цитозину в ДНК (гипо) приводит к нестабильности генома. Локальное гиперметилирование в промоторе гена (гипер) вызывает наследуемый сайленсинг и, следовательно, инактивацию генов-супрессоров опухоли. Кроме того, метилированные сайты CpG представляют собой горячие точки для мутаций типа транзиций С>Т, вызванных спонтанным гидролитическим дезаминированием. Метилирование сайтов CpG также повышает связывание некоторых химических канцерогенов с ДНК и повышает частоту мутаций, индуцированных УФ-излучением
2. Значение хроматина для раковых заболеваний
Несмотря на важнейшие достижения в понимании ключевых молекулярных повреждений путей клеточного контроля, способствующих возникновению раковых заболеваний, остается истиной то, что микроскопическое исследование цитологом-патологом структуры ядра по-прежнему является золотым стандартом в диагностике раковых заболеваний. Человеческий глаз может точно разглядеть изменения в архитектонике ядра, которая, в основном, отражает состояние конфигурации хроматина, и определенно диагносцировать раковый фенотип в одиночной клетке. В качестве признаков патологи в первую очередь используют величину ядра, его очертания, конденсированную ядерную мембрану, отчетливые ядрышки, плотный «гиперхроматиновый» хроматин и высокие значения ядерно-плазменного отношения. Эти структурные характеристики, которые видны под микроскопом (рис. 24.3), по-видимому, коррелируют с глубокими изменениями функций хроматина и получающимися в результате этого изменениями состояний экспрессии генов и (или) стабильности хромосом. Установление связи между изменениями, наблюдаемыми на микроскопическом уровне, с молекулярными метками, обсуждаемыми повсюду в этой книге, остается одной из главных проблем в онкологических исследованиях. В этой главе мы рассматриваем эпигенетические метки, типичным примером которых являются изменения в метилировании цитозина ДНК, метилирование в динуклеотидах CpG и модификации гистонов, которые в раковых клетках распределены аномально. Их все чаще связывают с наследуемыми событиями, которые затрагивают стабильность и функционирование генома, и, таким образом, вносят весьма существенный вклад в злокачественный фенотип. Известны несколько примеров роли хроматин модифицирующей активности при раковых заболеваниях у человека (Wolffe, 2001). Например, и острая миелоидная лейкемия (AML), и острая промиелоцитная лейкемия (PML) вызываются хромосомными транслокациями. которые изменяют использование диацетилаз гистонов (HDACs). При PML ген PML объединяется с рецептором ретиноидной кислоты (RAR). Этот рецептор рекрутирует активность HDAC и метилирование ДНК и вызывает состояние транскрипционного сайленсинга, что было показано с помощью экспериментальных промоторных конструктов. Эти данные предполагают, что такое «нацеливание» изменения хроматина может потенциально приводить к сайленсингу гена-супрессора опухоли, который участвует в блокировке клеточной дифференциации (Di Croce et al., 2002). При AML, ДНК-связывающий домен транскрипционного фактора AML-1 объединен с белком, который называется ЕТО и который взаимодействует с HDAC. Репрессия клеточной дифференцировки неправильно нацеленной HDAC способствует абберантной репрессии гена и, в конечном счете, лейкемии (Amann et al., 2001). Это всего два примера прямого включения модификаций хроматина в онкогенный фенотип. Однако становится ясно, что модификации хроматина могут прямо и косвенно изменять паттерны метилирования цитозина — эпигенетического изменения ДНК, которое может либо инициировать, либо «запереть» сайленсинг ключевых генов, что ведет к наследуемым нарушениям важнейших клеточных путей. Рис. 24.2. Как метилирование ДНК может участвовать в инактивации генов-супрессоров опухоли
Две активные аллели гена-супрессора опухоли показаны как два синих прямоугольника в верхней части рисунка Первый шаг инактивации гена показан как локализованная мутация (слева) или генный сайленсинг за счет метилирования ДНК (справа). Следующий «удар» показан или как потеря гетерозиготности (LOH), или как транскрипционный сайленсинг в результате дополнительных эпигенетических событий. В этом случае метилирование ДНК может играть роль одного из путей, что согласуется с гипотезой Кнудсона
Рис. 24.2. Как метилирование ДНК может участвовать в инактивации генов-супрессоров опухоли
Две активные аллели гена-супрессора опухоли показаны как два синих прямоугольника в верхней части рисунка Первый шаг инактивации гена показан как локализованная мутация (слева) или генный сайленсинг за счет метилирования ДНК (справа). Следующий «удар» показан или как потеря гетерозиготности (LOH), или как транскрипционный сайленсинг в результате дополнительных эпигенетических событий. В этом случае метилирование ДНК может играть роль одного из путей, что согласуется с гипотезой Кнудсона
3. Роль метилирования ДНК при раковых заболеваниях
Первое открытие того, что ДНК кроме четырех оснований, содержит 5-метилцитозин, непосредственно включенный в ДНК, вскоре привело к предположению, что изменения в метилировании ДНК могут играть роль в онкогенезе (табл. 24.2). За последние 40 лет было проведено много исследований, которые показывали различия в паттернах распределения 5-метилцитозина ДНК человека между раковыми и нормальными клетками. Среди них есть как минимум три основных способа, с помощью которых метилирование CpG может участвовать в онкогенном фенотипе. Они включают в себя гипометилирование ракового генома, локальное гиперметилирование промоторов генов-супрессоров опухоли и прямой мутагенез (рис. 24.1) (Jones and Laird, 1999; Jones and Baylin, 2002; Herman and Baylin, 2003). Хотя каждое из этих отклонений само по себе могло бы способствовать возникновению раковых заболеваний у человека, может быть, особенно важно то, что они все имеют место одновременно, показывая, таким образом, что нарушения гомеостаза эпигенетических механизмов — это главные причины, вызывающие рак у людей. Наиболее известное и раньше других установленное изменение в паттернах метилирования ДНК у раковых клеток — это общее уменьшение данной модификации, приводящее к нестабильности генома (дополнительное обсуждение см. в главе 18). Хорошо известно, что это является ключевым признаком рака у человека (Fein-berg and Vogelstein, 1983; Feinberg et al., 1988; Jones and Laird, 1999; Jones and Baylin, 2002; Herman and Baylin, 2003). В более поздний период времени возрастающий объем данных показал, что аномальное метилирование островков CpG в 5’-районах генов, относящихся к раковым заболеваниям, является составной частью их транскрипционного сайленсинга, обеспечивая альтернативный механизм мутаций для инактивации генов с функциями подавления опухоли (Jones and Laird, 1999; Jones and Baylin, 2002; Herman and Baylin, 2003). Наконец, в дополнении к вышеописанной роли метилирования цитозина в дестабилизации генома и генном сайленсинге, 5-метилцитозин сам по себе является высоко нестабильным и, поэтому, мутабельным основанием. Это напрямую может вносить свой вклад в развитие раковых заболеваний, вызывая мутации типа транзиций, при которых meCpG превращается в TpG (Rideout et al., 1990). Тот факт, что эти модификации столь распространены при раковых заболеваниях, и, как сейчас известно, приводят напрямую к канцерогенезу, также создает новые возможности терапевтической реверсии, направленной на эпигенетические изменения (Egger et al., 2004). Рис. 24.3. Структурные изменения хроматина в раковых клетках
Эти две микрофотографии сделаны у пациента со сквамозноклеточной карциномой кожи. На левой части показаны нормальные эпидермальные клетки, расположенные в одном миллиметре от прилегающей опухоли и показанные при том же увеличении на правой части рисунка Хроматин, окрашенный пурпурным цветом, благодаря его сродству к гематоксилину, оказывается гораздо более грубым и гранулярным в раковых клетках, чем в нормальном эпидермисе. Такие различия в окраске хроматина используются патологами в качестве диа гностических критериев раковых заболеваний
Рис. 24.3. Структурные изменения хроматина в раковых клетках
Эти две микрофотографии сделаны у пациента со сквамозноклеточной карциномой кожи. На левой части показаны нормальные эпидермальные клетки, расположенные в одном миллиметре от прилегающей опухоли и показанные при том же увеличении на правой части рисунка Хроматин, окрашенный пурпурным цветом, благодаря его сродству к гематоксилину, оказывается гораздо более грубым и гранулярным в раковых клетках, чем в нормальном эпидермисе. Такие различия в окраске хроматина используются патологами в качестве диа гностических критериев раковых заболеваний
Таким образом, в настоящее время признается, что критическую роль в канцерогенезе человека играет метилирование цитозина в ДНК. Почти все гены человека содержат остатки метилированного цитозина в своих кодирующих областях, для которых в течение некоторого времени известно непропорциональное участие в образовании болезнетворных мутаций. Метилирование 5 углерода в цитозиновом кольце повышает частоту гидролитического дезаминирования этого основания в двунитевой ДНК. Однако продуктом дезаминирования 5-метилцитозина является в тимин, а не урацил (см. рис. 3.12). Механизмы репарации ДНК впоследствии менее эффективны при восстановлении неправильных сочетаний оснований в ДНК, вызванных дезаминированием. Известно, что метилированные сайты CpG производят более 1/3 всех мутаций типа транзиций, возникающих в зародышевой линии человека (Rideout et al., 1990). Это также справедливо для генов, вызывающих рак, таких как р53 (Rideout et al., 1990). Более удивительным является наблюдение, что этот механизм также принимает существенное участие в образовании инактивирующих мутаций в генах-супрессорах опухоли в соматических тканях. Например, более 50% всех мутаций р53, которые приобретаются при спорадических раковых заболеваниях толстой и прямой кишки, имеют место в сайтах метилирования цитозина (Greenblatt et al., 1994). Таким образом, модификация ДНК ДНК-метилтрансферазами (DNMTs) существенно повышает риск получения рака с помощью такого эндогенного механизма. Было также показано, что метилирование цитозиновых остатков поддерживает образование канцерогенных аддуктов присоединения между ДНК и канцерогенами, такими как бензопирен из сигаретного дыма. В этом случае, метилирование цитозинового остатка повышает образование канцерогенных аддуктов между соседним гуаниновым остатком и бензопирендиолэпоксидом, приводящее к повышению вероятности мутаций в сайтах CpG в легких курильщиков (Greenblatt et al., 1994; Pfeifer et al., 2000). Интересно, что метилирование может также изменять частоту мутаций в гене р53 в коже, экспонированной солнечному свету (Greenblatt et al., 1994; Pfeifer et al., 2000). Это происходит из-за того, что метиловая группа смещает спектр поглощения цитозина в диапазон падающего солнечного света, тем самым повышая образование пиримидиновых димеров в ДНК клеток кожи. Таким образом, эта эпигенетическая модификация ДНК не только повышает спонтанный мутагенез, но также может влиять на то, как ДНК взаимодействует с канцерогенами и ультрафиолетом (Pfeifer et al., 2000). Гипометилирование ДНК, которое было давно отмечено в опухолях животных и человека (табл. 24.2), влияет на стабильность хромосом и повышает шанс анеуплоидии. Геномная нестабильность — это признак ракового заболевания, и повышенная ломкость хромосом, вызываемая гипометилированием саттелитных и других последовательностей, может, по-видимому, приводить к образованию раковых заболеваний путем уменьшения стабильности генома (Narayan et al., 1998; Gaudet et al., 2003). Конкретные механизмы, с помощью которых достигается эта нестабильность, все еще не полностью поняты, но они легко могут быть результатом измененных взаимодействий ДНК и белков, вызванных гипометилированием.
Таблица 24.2. Временная шкала, проясняющая роль метилирования ДНК при раковых заболеваниях
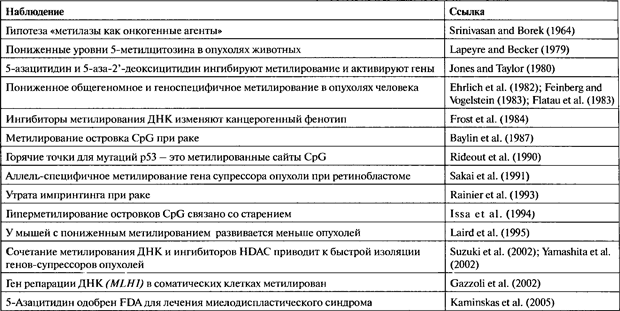
4. Гиперметилированные промоторы генов при раковых заболеваниях
4.1. Гены, участвующие в процессе
Наиболее понятный механизм, при помощи которого метилирование ДНК приводит к раковым заболеваниям, это локальное гиперметилирование промоторов генов-супрессоров опухоли. Конкретные механизмы, при помощи которых осуществляется это гиперметилирование, детально обсуждаются ниже. Однако ясно, что это важнейший путь, приводящий к наследуемому сайленсингу генов, которые подавляют развитие рака (Jones and Laird, 1999; Jones and Baylin, 2002; Herman and Baylin, 2003). Обычно, гиперметилирование ДНК осуществляется в участках, обогащенных CpG, или в или CpG-островках, которые локализованы внутри и вокруг транскрипционного стартового сайта аномально «молчащих» генов при раковых заболеваниях. Важно знать, что метилирование цитозина в CpG-островках поблизости от местоположения стартового сайта гена особенно критично, так как эта же самая модификация ДНК, имеющая место внутри генов, обычно не коррелирует с транскрипционным статусом (Jones, 1999). Перечень связанных с раком генов, на которые влияет упомянутое выше нарушение транскрипции, неуклонно растет. Как было описано ранее, сюда включаются гены в любых положениях на хромосомах (Jones and Baylin, 2002). Действительно, данное эпигенетическое изменение может сейчас численно превосходить те гены, которые часто мутируют в опухолях человека. Как было упомянуто ранее (табл. 24.1), потеря функции гена-супрессора опухоли как результат вызывающего сайленсинг данного гена метилирования CpG, по существу, затрагивает все известные пути. Чтобы понять значение генов для процесса канцерогенеза и сформулировать проблему в этой области на будущее, гены, по-видимому, могут быть разделены на три группы. Первая группа содержит те гены, которые участвуют в определении гиперметилирования промотора и сайленсинга генов, как одного из важных механизмов потери функции гена-супрессора опухоли при раковых заболеваниях (табл. 24.3). Эти гены уже были распознаны как классические гены-супрессоры опухоли, которые при мутации в зародышевой линии семьи вызывают наследуемые формы рака (Jones and Laird, 1999; Jones and Baylin, 2002; Herman and Baylin, 2003). Они также часто мутируют при спорадических формах рака, но в таких опухолях они нередко могут быть гиперметилированы по одной или обеим аллелям (Jones and Laird, 1999; Jones and Baylin, 2002; Herman and Baylin, 2003). Кроме того, для этих генов гиперметилирование промотора может иногда составлять «второй удар» (по гипотезе Кнудсона) в связи с тем, что они ассоциированы с потерей функции второй копии этого гена при семейных опухолях, где «первым ударом» является мутация в зародышевой линии (Grady et al., 2000; Esteller et al., 2001b). В некоторых случаях было показано, что индуцированная 5-азацитидином реактивация этих генов в культуре опухолевых клеток восстанавливает ключевую функцию гена-супрессора опухоли, утраченную в процессе роста опухоли. Таким примером является функция коррекции неправильного спаривания оснований ДНК в клетках рака толстой кишки, где имеет место сайленсинг гена MLH1 (Herman et al., 1998). Вторая группа эпигенетически сайленсированных генов — это те гены, которые, благодаря их функции, ранее были идентифицированы как кандидатуры на роль генов-супрессоров опухоли, но для них не было показана сколько-нибудь существенная частота инактивации за счет мутаций. Эти гены могут рассматриваться как потенциальные супресоры, потому что они находятся в таких позициях на хромосомах, которые при раковых заболеваниях часто подвергаются делениям (табл. 24.3). Примерами являются RASFF1A и FHIT на хромосоме Зр при раке легких и опухолях других типов (Dammann et al., 2000; Burbee et al., 2001). Остальные гены — это те, про которые известно, что они кодируют белки, содействующие функциям, существенным для предотвращения роста опухоли, такие как ген проапоптоза, DAP-киназы (Katzenellenbogen et al., 1999). Эти гены бросают вызов всей области эпигенетики рака, поскольку, несмотря на то, что при опухолях в них обнаружено частое гиперметилирование промотора должно быть специально доказано (поскольку многие из этих генов часто, если не всегда, мутируют) каким именно образом эти гены участвуют в генезе опухоли. Мы вернемся к этому вопросу в дальнейшем.Таблица 24.3. Классы гиперметилированных генов
 Третья группа генов идентифицируется по стратегиям, применяемым для случайной идентификации аберрантно сайленсированных генов, ассоциированных с гиперметилированием промотора (Suzuki et al., 2002; Yamashita et al., 2002; Ushijima, 2005). По сравнению с генами из второй группы, трудно поместить их в функциональный контекст развития рака, поскольку их функции могут быть совершенно неизвестны.
Третья группа генов идентифицируется по стратегиям, применяемым для случайной идентификации аберрантно сайленсированных генов, ассоциированных с гиперметилированием промотора (Suzuki et al., 2002; Yamashita et al., 2002; Ushijima, 2005). По сравнению с генами из второй группы, трудно поместить их в функциональный контекст развития рака, поскольку их функции могут быть совершенно неизвестны.
4.2. Поиск новых генов, эпигенетически сайленсированных при раке
Чаще всего используемый подход при идентификации новых генов, эпигенетически сайленсированных при раке, заключается в том, чтобы рассматривать в качестве кандидата любой потенциальный ген-супрессор опухоли, если мутации не обнаружены, или если экспрессия гена в изучаемых опухолях низкая, или вообще отсутствует. Другой используемый подход — это применить технику случайного скриннинга раковых геномов на гиперметилированные гены (Toyota et al., 1999; Suzuki et al., 2002; Yamashita et al., 2002; Ushijima, 2005). Этот путь предоставляет огромные возможности для обогащения наших знаний в области биологии рака, но также вызывает много проблем. Как недавно было сказано в обзоре (Ushijima, 2005), каждый подход имеет свои сильные и слабые стороны. Несколько подходов зависят от первого этапа, когда ДНК переваривается одним или несколькими рестрикционными ферментами, которые дифференциально расщепляют сайты CpG, в зависимости от того, метилированы ли они. Затем, чтобы определить потенциально гиперметилированные гены, продукты анализируют при помощи двухмерного электрофореза (Restriction Landmark Genomic Sequencing, RLGS), случайно амплифицируют, применяя случайные праймеры, или технику вычитания, чтобы дифференцировать метилированные последовательности нуклеотидов нормальной ДНК и ДНК из опухоли. Эти методы способны идентифицировать большое количество гиперметилированных генов, и каждый из них добавляет новые сведения относительно важных потенциальных кандидатов на роль генов-супрессоров опухоли. Однако идентифицированные последовательности нуклеотидов могут быть либо связаны, либо на связаны с островками CpG, которые стратегически расположены так, чтобы участвовать в сайленсинге генов. Повторяющиеся последовательности, которые часто бывают высокометилированными, иногда включены в конечные продукты. В результате, эффективность идентификации гиперметилированных генов-супрессоров опухоли часто бывает не очень высока и затруднительна в масштабах целого генома. Другие подходы связаны с опознаванием на микрочипах нуклеотидных последовательностей содержащихся в геноме островков CpG (С.М. Chen et al., 2003), поскольку они часто связаны со стартовыми сайтами гена, и с зондированием чипов с помощью геномной ДНК, которая была переварена чувствительными к метилированию ферментами, либо с помощью кДНК, с учетом статуса экспресии генов. Этот подход обладает мощным потенциалом для идентификации гиперметилированных супрессоров опухоли, но он ограничен числом возможных островков CpG, которые могут быть чипированы. Еще один подход состоит в том, чтобы обрабатывать культуры опухолевых клеток агентами, которые вызывают деметилирование ДНК, такими как 5-азацитидин или 5-аза-2’-деоксицитидин, и проводить гибридизацию РНК до и после обработки препаратами на генных микрочипах для выявления ап-регурированных генов (Suzuki et al., 2002; Yamashita et al., 2002). Этот подход потенциально может идентифицировать все гиперметилированные гены в культурах клеток всех типов человеческого рака. Однако изменения в генах, вызванные другими причинами, нежели деметилируюшая активность используемых препаратов, может понизить эффективность идентификации гиперметилированных генов. Меньше всего осознается тот факт, что самый низкий уровень экспрессии разыскиваемых генов, как до, так и после обработки препаратами резко ставит под вопрос чувствительность большинства генов микрочипов, заметно снижая эффективность данного подхода (Suzuki et al., 2002). Применение метода вычитания после обработки препаратами для обогащения генными транскриптами, содержание которых повышено, может повысить чувствительность подхода, основанного на генных микрочипах (Suzuki et al., 2002), но он должен быть адаптирован таким образом, чтобы удовлетворять требованиям флуоресцентного мечения зондов для микрочипов, что легко позволит покрыть весь геном Одновременное применение препаратов, модифицирующих изменения хроматина, которые действуют совместно с метилированием промотора ДНК, например, такими как ингибиторы HDAC, может помочь в подходах, основанных на генных микрочипах. Данный маневр помогает более специфично идентифицировать разыскиваемые гены, принимая во внимание ту роль, которую изменения хроматина играют в сайленсировании гиперметилированных генов, что детально обсуждается в последующем разделе. Этот последний подход позволил недавно идентифицировать важные гены, сайленсированнные при раке толстой кишки (Suzuki et al., 2002).4.3. Определение функциональной важности генов, гиперметилированных при раковых заболеваниях
Стремительность, с которой стали обнаруживаться гиперметилированные гены при раке, представляет собой исследовательскую проблему, вызывающую опасения. Частое гиперметилирование промотора данного гена не гарантирует само по себе функционального значения для сайленсинга сопутствующего гена, что обычно бывает при потере функции, обусловленной генетической мутацией. Это имеет место особенно в том случае, когда гиперметилированный ген не является известным классическим супрессором опухоли и когда нет свидетельста тому, что этот ген также может часто мутировать при различных видах рака. Итак, обязательно, чтобы рассматриваемый ген изучался таким образом, чтобы важность потери функции определялась и с точки зрения процессов, контролируемых кодируемым белком, и с точки зрения последствий этого для развития опухоли. Есть несколько возрастающих по значению стадий таких исследований, очерченных в табл. 24.4; целью этих исследований является строгое документирование роли в образовании раковых заболеваний. Первая, это, конечно, документирование гиперметилирования и его последствий для состояния экспрессии гена, включая способность гена подвергаться реэкспрессии при деметилировании промотора. Вторая — наличие гиперметилирования и сайленсинга данного гена должны быть хорошо установлены как в первичных пробах из опухолей, так и в культуре опухолевых клеток. Третья, как объясняется ниже, часто необходимо знать, в какой точке развития опухоли осуществляется сайленсинг гена (рис. 24.4). Четвертая — следует напрямую оценить, насколько канцерогенной является потеря функции гена. Можно начать с рутинного изучения культур клеток через оценку влияния восстановления гена на свойства клеток, такие как индукция апоптоза, эффект клонирования на мягком агаре, и влияние на канцерогенность клеток, растущих как ксенотрансплантат (гетеротрансплантат) в безтимусовых мышах. Пятая должна быть определена функция кодируемого белка либо через предварительные сведения относительно типа белка — через распознование его предполагаемых функций исходя из природы его структуры, или через изучение биологических свойств белка на моделях культур клеток. В конечном счете, однако, должен быть сделан шестой шаг, который может часто включать в себя трангенные нокаутные подходы, чтобы установить роль гена как гена-супрессора опухоли и чтобы понять, каковы функции кодируемых белков в развитии, обновлении клеток у взрослого организма и т.д. Изучение нокаутных мышей оказались чрезвычайно полезными для подтверждения функции HIC-1 как гена-супрессора опухоли, после того как он был идентифицирован посредством отбора тех участков генома раковых клеток, которые утратили гетерозиготность (W.Y. Chen et al., 2003, 2004). Эти сомнения и особенно шестой этап, показывают, насколько важно обнаружить гены, эпигенетически сайленсированные при раке, но создают широкий фронт работы, который следует рассмотреть исследователям в этой области.Таблица 24.4. Этапы документирования важности гиперметилированного гена для опухолеобразования
1. Обосновать метилирование промотора островка CpG и скоррелировать с транскрипционным сайленсингом гена и способностью отменять сайленсинг деметилирующими препаратами в культуре клеток 2. Обосновать корреляцию гиперметилирования промотора со специфичностью к этому изменению в раковых клетках (культура клеток и первичные опухоли) против аналогов среди нормальных клеток и случаев изменения гиперметилирования в первичных опухолях 3. Обосновать положение измененного метилирования для развития опухоли рака данного типа 4. Обосновать потенциальное значение генного сайленсинга при опухолеобразовании при помощи изучения реинсерции генов в культуре клеток и влияния на клонирование на мягком агаре, при росте опухолевых клеток в голых мышиных эксплантах и т.п. 5. Установить функцию белка, кодируемого сайленсным геном — либо через известные свойства либо путем тестирования активности узнаваемых белковых мотивов в культуре и т.п. 6. Обосновать супрессорную активность и функцию гена при обновлении клетки и т.п., особенно для совершенно неизвестных генов, посредством изучения нокаутных мышей.5. Эпигенетический сайленсинг генов и его роль в эволюции рака - значение для ранних стадий развития опухоли
Согласно классическому взгляду на развитие рака, сформулированному Фогелыитейном и его коллегами (Kinzler and Vogelstein, 1997), серия генетических изменений стимулирует продвижение от ранних предмалигнизованных стадий через появление инвазивного рака к началу метастазирующей стадии заболевания (рис. 24.4). Это развитие у разных опухолей не обязательно всегда осуществляется именно в таком порядке Мы знаем, что на всем протяжении такого хода событий, также имеют место эпигенетические изменения: наблюдается раннее появление как широко распространенных утрат нормального метилирования ДНК, так и его более локального прироста в промоторах генов, которые мы обсуждаем. Таким образом, имеется потенциальная возможность для взаимодействия эпигенетических и генетических событий, чтобы направлять последовательные клеточные аномалии на всем протяжении неопластической прогрессии. В соответствии с этим сценарием, данные, касающиеся двух эпигенетических аспектов — потери импринтинга (LOI — loss of imprinting) (как это обсуждалось в главе 23) и сайленсинга генов — оказываются крайне важными для ранних стадий развития рака. Рис. 24.4. Ранняя роль аномального метилирования ДНК в развитии опухоли
Описано в класической модели (Kinzler and Vogelstein, 1997) генетических изменений в процессе эволюции рака толстой кишки. Показано, что измененное метилирование ДНК имеет место очень рано (красная стрелка), как сказано в тексте, во время превращения нормального эпителия в гиперпластический. Этот факт определяет его стратегическое положение (левая нижняя черная стрелка и левый нижний прямоугольник): стволовые клетки направляются на путь аномальной клональной экспансии (рис. 24.5) при содействии ключевых генетических изменений. Эти эпигенетические аномалии также имеют смысл маркеров, как показано в нижнем левом черном прямоугольнике. Аномальное метилирование ДНК продолжает накапливаться в процессе превращения опухолей из неинвазивных в инвазивные и, наконец, метастазирующие (правая нижняя стрелка и правый прямоугольник). Это создает дополнительную основу для лечения рака и для поисков маркеров, используемых в прогнозировании заболевания
Рис. 24.4. Ранняя роль аномального метилирования ДНК в развитии опухоли
Описано в класической модели (Kinzler and Vogelstein, 1997) генетических изменений в процессе эволюции рака толстой кишки. Показано, что измененное метилирование ДНК имеет место очень рано (красная стрелка), как сказано в тексте, во время превращения нормального эпителия в гиперпластический. Этот факт определяет его стратегическое положение (левая нижняя черная стрелка и левый нижний прямоугольник): стволовые клетки направляются на путь аномальной клональной экспансии (рис. 24.5) при содействии ключевых генетических изменений. Эти эпигенетические аномалии также имеют смысл маркеров, как показано в нижнем левом черном прямоугольнике. Аномальное метилирование ДНК продолжает накапливаться в процессе превращения опухолей из неинвазивных в инвазивные и, наконец, метастазирующие (правая нижняя стрелка и правый прямоугольник). Это создает дополнительную основу для лечения рака и для поисков маркеров, используемых в прогнозировании заболевания
Потеря импринтинга включает в себя процесс, при котором «молчащая» аллель импринтированных генов активируется во время канцерогенеза таким образом, что устанавливается двуаллельная экспрессия гена и избыток продукта данного гена (Rainier et al., 1993). Наиболее изученный пример касается гена IGF2 в таких опухолях, как рак толстой кишки (Kaneda and Feinberg, 2005). В этом случае гиперметилирование промотора в импринтированном гене Н19 на краю хромосомы является результатом сложного процесса контролирования хроматина (глава 19), чтобы аномально активировать «молчащую» аллель 7GF2 (Kaneda and Feinberg, 2005). Получающяяся в результате двуаллельная экспрессия IGF2 приводит к переизбытку белка TGF2, стимулирующего рост.Экспериментальные свидетельства предполагают, что это может играть роль на очень ранних стадиях образования рака толстой кишки (Kaneda and Feinberg, 2005; Sakatani et al., 2005). И действительно, недавние исследования на мышиных моделях предполагают, что сама по себе LOI может быть достаточна, чтобы инициировать процесс опухолеобразования (Holmetal., 2005). Второй обычный неопластический переход — эпигенетический сайленсинг генов — происходит на ранних фазах неопластического развития. Это очень тесно связано с вопросами о роли клеточного стресса и экспозиции в развитии болезненных состояний. Часто оказывается, что гены, участвующие в процессе, устанавливают те стадии, на которых клетки, подвергнутые стрессу, выживают при повреждении ДНК и(или) хронических нарушениях, увеличиваются, как клон стволовых или прогениторных клеток и затем делаются предрасположенными к более поздним генетическим и эпигенетическим событиям, чтобы осуществить развитие опухоли (рис. 24.5). Первое свидетельство такого участия исходит из данных по нескольким классичесим генам-супрессорам опухоли, которые могут быть либо мутантными, либо эпигенетически сайленсированными в раковых опухолях человека. Например, эпигенетический сайленсинг гена pl6nk4aочень рано осуществляется в популяциях предмалигнизованных клеток, во время начальных изменений, которые предваряют образование опухолей, таких, например, как рак легких (Belinsky et al., 1998), а также в маленьких популяциях гиперпластических эпителиальных клеток нормальных во всем остальном молочных желез некоторых женщин (Hoist et al., 2003). В эксперименте, когда нормальные человеческие клетки эпителия молочной железы выращиваются в культуре (на пластике), этот тип сайленсинга р16 является предпосылкой для самых начальных этапов трансформации клеток (Kiyono et al., 1998; Romanov et al., 2001). Такая потеря функции гена сопровождает неспособность групп клеток молочной железы достичь точки смертности и, по мере того, как эти клетки продолжают пролиферировать, в них развиваются усиливающиеся хромосомные аномалии и экспрессия теломеразы. Второй пример касается MLHL гена, устраняющего неправильное спаривание оснований. Этот ген мутирует в зародышевой линии тех семей, члены которых предрасположены к раку толстой кишки, такого типа, при котором имеются множественные генетические изменения; это называется фенотип «микросаттелитной» нестабильности (Liuetal., 1995). Однако, 10—15% пациентов с несемейным раком толстой кишки, также имеют опухоли с таким фенотипом, и в большинстве этих раковых опухолей обнаруживается эпигенетический сайленсинг немутировавшего гена MLH1 (Herman et al., 1998; Veigl et al., 1998). В культуре клеток реэкспрессия этого «молчащего» гена MLH1 вызывает появление вновь функционального белка, который восстанавливает значительную часть поврежденной способности репарировать неправильно спаренные основания (Herman etal., 1998).
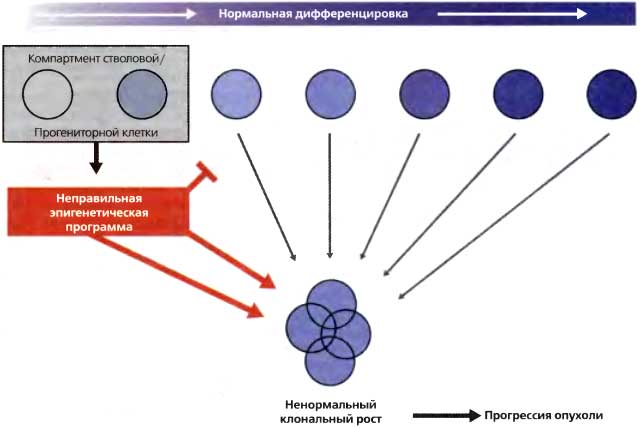 Рис. 24.5. События эпигенетического сайленсинга генов и опухолеобразование
Самые ранние этапы опухолеобразования описываются как аномальная клональная экспансия, которая разворачивается при стрессовом воздействии на клеточное обновление. Она вызывается такими факторами, как старение и хронические нарушения, связанные, например, с воспалением. Это как раз те клеточные клоны, в которых могут произойти последующие генетические и эпигенетические события, направляющие развитие опухоли. Такие аномальные эпигенетические события, как аберрантный генный сайленсинг, о котором говорится в данной главе, могли бы быть во многих случаях наиболее ранними наследуемыми причинами, вызывающими аномальную клональную экспансию из компартментов стволовых (или прогениторных) клеток в обновляющейся системе клеток взрослого организма. Сайленсинг генов включается модификациями хроматина, которые репрессируют транскрипцию, а гиперметилирование ДНК этого хроматина служит «надежным запором», чтобы стабилизировать наследуемый сай ленсинг, как сказано в тексте главы. Генный сайленсинг, в свою очередь, нарушает нормальный гомеостаз, удерживая стволовые клетки и прогениторные клетки от того, чтобы должным образом двигаться по пути дифференцировки, существующей в данной системе эпителиальных клеток (верхние клетки все более темного синего цвета) и направляя их (большие красные стрелки) к аномальной клональной экспансии
Рис. 24.5. События эпигенетического сайленсинга генов и опухолеобразование
Самые ранние этапы опухолеобразования описываются как аномальная клональная экспансия, которая разворачивается при стрессовом воздействии на клеточное обновление. Она вызывается такими факторами, как старение и хронические нарушения, связанные, например, с воспалением. Это как раз те клеточные клоны, в которых могут произойти последующие генетические и эпигенетические события, направляющие развитие опухоли. Такие аномальные эпигенетические события, как аберрантный генный сайленсинг, о котором говорится в данной главе, могли бы быть во многих случаях наиболее ранними наследуемыми причинами, вызывающими аномальную клональную экспансию из компартментов стволовых (или прогениторных) клеток в обновляющейся системе клеток взрослого организма. Сайленсинг генов включается модификациями хроматина, которые репрессируют транскрипцию, а гиперметилирование ДНК этого хроматина служит «надежным запором», чтобы стабилизировать наследуемый сай ленсинг, как сказано в тексте главы. Генный сайленсинг, в свою очередь, нарушает нормальный гомеостаз, удерживая стволовые клетки и прогениторные клетки от того, чтобы должным образом двигаться по пути дифференцировки, существующей в данной системе эпителиальных клеток (верхние клетки все более темного синего цвета) и направляя их (большие красные стрелки) к аномальной клональной экспансии
Совсем недавно было показано, что ген Chfr, регулирующий чекпойнт, который также контролирует еще один тип целостности генома, хромосомную стабильность и плоидность, мутирует в опухолях, но чаще проявляет эпигенетический сайленсинг при раке легких и других видах рака, и, что особенно важно, на ранних стадиях развития рака толстой кишки (Mizuno et al., 2002). Изучение нокаутных мышей выявило роль этого гена, как супрессора опухоли, основываясь на его функции какубиквитинлигазы ЕЗ, которая регулирует Aurora А — ген, контролирующий митоза. Эмбриональные клетки мыши характеризуются хромосомной нестабильностью и предрасположенностью к трансформации. Поскольку список гиперметилированных генов при раке расширился, ключевые события сайленсинга на ранних стадиях развития опухоли определяются теперь для возможных генов-супрессоров опухоли, у которых имеется лишь история эпигенетических изменений, но не мутаций. Например, сайленсинг гена репарации ДНК 06-MGMT происходит на ранних стадиях развития рака толстой кишки (Esteller et al., 2001а), и эта потеря функции может обусловливать возможность сохранения клетками алкилирующего повреждения по гуанозинам, и, таким образом, предрасположенность к точечным мутациям — заменам G-А. В самом деле, сайленсинг этого гена имеет место в предраковых полипах толстой кишки перед появлением высокой частоты таких мутаций как в гене р53, так и в гене RAS, на более поздних стадиях развития опухоли толстой кишки (Esteller et al., 2001а; Wolf et al., 2001). Аналогично этому, сайленсинг гена GST-Pi имеет место практически при всех предраковых повреждениях, предрасполагающих к раку простаты, подвергая клетки риску окислительного повреждения аденинов (Lee etal., 1994). Третий тип «молчащих» генов — обнаруженных методом беспорядочного скрининга раковых геномов на эпигенетически сайленсированные гены — также начинает вносить существенный вклад в наше понимание ранней роли генного сайленсинга при раке. Особенно интригующий сценарий был установлен в процессе развития рака толстой кишки: эпигенетическая потеря функции происходит в семействе генов (обнаруженных методом микрочипирования, описанного ранее — Suzuki et al., 2002), которые могут допустить раннюю аномальную активацию пути развития, всегда связанную с возникновением и дальнейшей прогрессией этого заболевания. Транскрипционный сайленсинг генов группы secreted frizzled related protein genes (SFRPs) (Suzuki et al., 2004) удаляет антагонистический сигнал к взаимодействию Wnt-лиганд с их мембранными рецепторами (Finch et al., 1997). Этот сайленсинг коррелирует с Wnt-управляемой апрегуляцией общих уровней ?-катенина в клетке, особенно благодаря повышенному присутствию и увеличенной активности в ядре этого транскрипционного фактора (Suzuki et al., 2004). Такая транскрипция — это каноническое считывание для повышенной активности Wnt-пути (Morin et al., 1997; Gregorieff and Clevers, 2005). Наиболее важным является тот факт, что сайленсинг SFRP происходит в очень ранних повреждениях, которые предрасполагают к раку толстой кишки, прежде чем происходят обычные мутации в белках Wnt-пути «вниз по течению», которые тоже приводят к активации ?-катенина в ядре (Morin et al., 1997; Gregorieff and Clevers, 2005) Таким образом, ранняя активация Wnt пути, обусловленная эпигенетическими событиями, оказывается сбалансированной, чтобы позволить раннее распространение клеток, предрасположенных к тому, чтобы и далее активировать этот путь посредством мутаций. Сохранение как эпигенетических (действующих через Wnt-управляемое увеличение клеточного ?-катенина), так и генетических (действующих через повреждение белкового комплекса, разрушающего ?-катенин. или через активирование Wnt мутаций) изменений, похоже, позволяют им дополнять друг друга при контроле развития заболевания (Suzuki et al., 2004). Еще один пример из данной группы генов — это HIC-1 (hypermethylated-in-cancer 1). который кодирует транскрипционный репрессор типа «цинкового пальца» HIC-1 был обнаружен методом случайного скрининга на гиперметилированные островки CpG в горячей точке для потери хромосомы в раковых клетках (Wales et al., 1995). Оказалось, что этот ген, который сайленсирует на ранней стадии развития рака, но не мутирует, играет роль гена-супрессора опухоли при использовании модели нокаутной мыши (WY. Chen et al., 2003, 2004). Он служит дополнением к мутациям р53 частично, через потерю функции, которая приводит к апрегуляции SIRT1 (Chen et al., 2005), ключевого белка, воспринимающего клеточный стресс, и участвующего в росте стволовых или прогениторных клеток (Howitz et al., 2003; Nemoto et al., 2004; Kuzmichev et al., 2005). Таким образом, приведенные выше данные вносят свой вклад в тематические гипотезы, представленные на рис. 24.4. Это предполагает, что некоторые из наиболее ранних наследуемых изменений в развитии опухолей могут представлять собой эпигенетические изменения, которые часто включают в себя жесткий транскрипционный сайленсинг генов, поддерживаемый метилированием промотора ДНК. Сложные задачи по дальнейшему пониманию этих сценариев целиком связаны с ключевыми задачами по изучению эпигенетических изменений при раковых заболеваниях, которые обрисованы в табл. 24.5 и более полно обсуждаются далее. Решение этих задач, в особенности для понимания роли эпигенетических изменений на самых ранних стадиях неопластического формирования, может удивительно обогатить молекулярные стратегии, имеющие целью предотвращение и раннее вмешательство при раковых заболеваниях.
Таблица 24.5. Главные задачи исследований молекулярных событий, связанные с эпигенетическим сайленсингом генов при раке
1. Выяснить связи между одновременным появлением и утратой метилирования ДНК в одних и тех же раковых клетках 2. Определить молекулярную природу границ (и то, как они изменяются при опухолеобразовании), которые отделяют области транскрипционно активных зон от транскрипционно репрессивных областей, окружающих промоторы генов и которые могут препятствовать распространению репрессивного хроматина через активную зону. Роль возможных механизмов могут играть ключевые модификации гистонов, инсуляторные белки, белки, осуществляющие ремоделинг хроматина, и т. д. 3. Определить, какова последовательность событий в эволюции генного сайленсинга при раке, по отношению к модификации гистонов, метилированию ДНК и т. д. Что идет вначале и каковы ключевые белковые комплексы (ферменты метилирования ДНК, ферменты деацетилирования и метилирования гистонов, белки, связывающиеся CpG с метилом, комплексы сайленсинга группы Polycomb и т. д.), которые нацеливают вышеупомянутые процессы, определяющие данные события 4. Какие специфические ферменты, метилирующие ДНК, требуются для инициации и(или) поддержания наиболее стабильного генного сайленсинга, и какие белковые комплексы содержат их. с учетом их взаимодействие с ключевыми компонентами гистонового кода 5. Каковы все компоненты аппарата метилирования ДНК и хроматина и какова иерархия их участия, необходимого для поддержания генного сайленсинга, и насколько обратимы их действия?6. Молекулярная анатомия эпигенетически сайленсированных раковых генов
Гены, сайленсированные в неопластических клетках, важны для понимания инициации и дальнейшего поддержания рака. Они также служат великолепными моделями для понимания того, как может инициироваться и поддерживаться сайленсинг гена, и как упакован геном млекопитающих, чтобы облегчить доступ к участкам транскрипции и репрессии транскрипции. В свою очередь, понимание функции хроматина, на которой сосредоточено основное внимание во многих главах этой книги, облегчает наше понимание того, что может служить триггером для аберрантного сайленсинга генов при раке, и того, как компоненты этого сайленсинга поддерживают сопутствующую ему транскрипционную репрессию. Работа нескольких лабораторий внесла свой вклад в текущее понимание конфигурации хроматина, который окружает гиперметилированные островки CpG в промоторах многочисленных генов, аберрантно сайленсированных в раковых клетках. Эти исследования также показали, каким образом этот хроматин отличается от хроматина, окружающего те же самые гены, когда они обнаруживают базовую экспрессию. В нормальных клетках или в раковых клетках, где гены транскрипционно не репрессированы, эти гены характеризуются наличием зоны открытого хроматина, где островки CpG в ДНК не метилированы, нуклеосомы расположены с нерегулярными промежутками, так что могут быть определены гиперчувствительные сайты, и ключевые гистоновые остатки маркированы посттрансляционны-ми модификациями, типичными для активных генов Активные ковалентные гистоновые метки включают в себя ацетилирование H3 по 9 и 14-му лизинам (H3K9ас and H3K14ас) и метилирование H3K4 (Nguyen et al., 2001; Fahmer et al., 2002). Ha 5’ и 3’ границах вышеупомянутого участка открытого хроматина обнаруживается резкий переход в структуре хроматина с характерными для транскрипционно репрессированных геномных участков чертами, фланкирующими островок CpG (рис. 24.6). В этих пограничных участках имеет место метилирование менее частых сайтов CpG и рекрутирование белков, связывающихся с метилцитозином (MBDs). и их партнеров (например, деацетилаз гистонов, или HDACs) к метилированным CpGs (глава 18) Участки вне островков CpG оказываются, таким образом, доступны для ферментов, которые катализируют метки метилирования гистонов, коррелирующие с сайленсингом гена. В результате действия всех этих факторов происходит деацетилирование ключевых гистоновых остатков и обнаруживаются репрессивные метки метилирования гистонов, связанные с транскрипционной репрессией, особенно H3K9me2 (Nguyen et al., 2001; Fahmer et al., 2002; Kondo etal., 2003). Рис. 24.6. Модель взаимоотношений между метилированием ДНК и модификациями гистонов в районе островков CpG генного промотора в нормальных и опухолевых клетках
В экспрессируемом гене показана граница (сверху), молеуклярная природа которой пока не охарактеризована и которая защищает островок CpG, окружая сайт начала транскрипции (зеленая стрелка) от метилирования ДНК. Сайты. CpG в CpG-участках, фланкирующих эту защитную зону, наоборот, имеют метилированную ДНК (розовый шестиугольник, обозначенный М) и ассоциированы с такими ключевыми метками сайленсинга, как метилирование H3K9 (красный шестиугольник, обозначенный Me). Ключевые аминокислоты «хвостов» гистонов в защищенной зоне, такие как H3K9, находятся в ацетилированом состоянии (синие флажки, обозначенные Ас) и транскрипционные факторы (желтый овал, обозначенный TF) имеют доступ к участку сайта начала транскрипции. Когда в раковой клетке тот же ген аберрантно находится в состоянии сайленсинга (внизу), островок CpG характеризуется гиперметилированием ДНК, т.к. защитные границы теперь разорваны и отсутствуют. Это метилирование поддерживается комплексами ДНК-метилтрансферазы (розовые овалы, обозначены DMMT) и белковыми комплексами, связывающимися с метилцитозином, которые содержат гистон-ацетилазы (синие овалы, обозначены HDAQ), и гистон-метилтрансферазы (красные овалы, обозначены НКМТ), которые катализируют ключевые метки метилирования при сайленсинге на аминокислотных «хвостах» гистонов (таких как H3K9). TF-комплексы более не активны (отсутствие зеленой стрелки). Отображены главные подходы проводимых в настоящее время клинических испытаний по раковой эпигенетике, которые включают либо ингибиторы метилтрансфераз ДНК для блокирования гиперметилирования ДНК, либо ингибиторы HDAC для восстановления статуса ацетилирования ключевых аминокислотных остатков гистонов Как сказано в тексте, наиболее многообещающая антираковая терапия включает комбинированное использование ингибиторов DNMT1 и HDAC
Рис. 24.6. Модель взаимоотношений между метилированием ДНК и модификациями гистонов в районе островков CpG генного промотора в нормальных и опухолевых клетках
В экспрессируемом гене показана граница (сверху), молеуклярная природа которой пока не охарактеризована и которая защищает островок CpG, окружая сайт начала транскрипции (зеленая стрелка) от метилирования ДНК. Сайты. CpG в CpG-участках, фланкирующих эту защитную зону, наоборот, имеют метилированную ДНК (розовый шестиугольник, обозначенный М) и ассоциированы с такими ключевыми метками сайленсинга, как метилирование H3K9 (красный шестиугольник, обозначенный Me). Ключевые аминокислоты «хвостов» гистонов в защищенной зоне, такие как H3K9, находятся в ацетилированом состоянии (синие флажки, обозначенные Ас) и транскрипционные факторы (желтый овал, обозначенный TF) имеют доступ к участку сайта начала транскрипции. Когда в раковой клетке тот же ген аберрантно находится в состоянии сайленсинга (внизу), островок CpG характеризуется гиперметилированием ДНК, т.к. защитные границы теперь разорваны и отсутствуют. Это метилирование поддерживается комплексами ДНК-метилтрансферазы (розовые овалы, обозначены DMMT) и белковыми комплексами, связывающимися с метилцитозином, которые содержат гистон-ацетилазы (синие овалы, обозначены HDAQ), и гистон-метилтрансферазы (красные овалы, обозначены НКМТ), которые катализируют ключевые метки метилирования при сайленсинге на аминокислотных «хвостах» гистонов (таких как H3K9). TF-комплексы более не активны (отсутствие зеленой стрелки). Отображены главные подходы проводимых в настоящее время клинических испытаний по раковой эпигенетике, которые включают либо ингибиторы метилтрансфераз ДНК для блокирования гиперметилирования ДНК, либо ингибиторы HDAC для восстановления статуса ацетилирования ключевых аминокислотных остатков гистонов Как сказано в тексте, наиболее многообещающая антираковая терапия включает комбинированное использование ингибиторов DNMT1 и HDAC
Эти соседние участки активных и репрессированных паттернов хроматина (рис. 24.6) предполагают, что промоторы активных генов, содержащие островки CpG, присущи зоне, которая «защищена», или, иными словами, не является мишенью для репрессивных меток хроматина и метилирования ДНК (Nguyen et al., 2001; Fahmer et al., 2002; Kondo et al., 2003). Неотъемлемой частью этих концепций является вероятность того, что в экспрессируемых генах молекулярные «границы» существуют на 5’ и 3’ концах промоторных островков CpG. Главная проблема — это определить точную природу этих границ. В настоящее время кандидатами на эту роль могут быть: сами модификации гистонов, которые маркируют защищенный участок промотора, транскрипционные активаторные и коактиваторные комплексы, которые прямо поддерживают активную транскрипцию, комплексы белков, которые выполняют размещение нуклеосом и(или) их движение (т.е. ремоделеры нуклеосом), которые могут маркировать гены для активной транскрипции. Эти факторы могут стимулировать доступ активирующих транскрипционных комплексов, замену классических гистонов их разновидностями, такими, как H3.3 (глава 13), который, как оказалось, поддерживает активную транскрипцию, и действие инсуляторных белковых комплексов и их узнающих последовательностей. Именно с точки зрения определения того, как один или несколько этих процессов поддерживают зоны транскрипционно пермиссивного хроматина вокруг промоторов активных генов, содержащих неметилированные по ДНК островки CpG, гены, сайленсированные при раковых заболеваниях, представляют собой великолепную модель для изучения и понимания модуляций генной экспрессии в геномах млекопитающих. Способ, которым вышеупомянутая траскрипционно активная организация хроматина промоторов, содержащих островки CpG, преобразуется в процессе развития опухоли, остается в основном неизвестным, расшифровка этого преобразования остается одной из главных проблем в области эпигенетики рака. Как было упомянуто ранее, аномально метилированные по ДНК островки CpG в промоторах генов, сопровождающиеся генным сайленсингом, часто обнаруживаются на самых ранних и предраковых стадиях развития опухоли, делая наше понимание лежащих в основе факторов потенциально очень важным для изучения биологии рака. Это также открывает новые возможности для выявления факторов риска при раке, для облегчения ранней диагностики рака и для выдвижения новых стратегий предупреждения и раннего вмешательства в канцерогенез. Какой бы конкретный механизм, из тех, что будут рассматриваться далее в этом разделе, не был задействован. конечным результатом, проявляющимся в процессе развития опухоли, является «разлад» механизмов, которые охраняют участки островков CpG в генном промоторе от «вторжения» хроматина репрессивного типа, расположенного на 5’ и 3’ границах. Результатом является превращение конфигурации промотора из транскрипционно открытой в закрытую с более плотно упакованными нуклеосомами и потерей гиперчувствительных сайтов, а также появление множественных состояний деацетилирования и метилирования гистонов, характерных для транскрипционно репрессивного хроматина (рис. 24.6). Иерархия всех этих событий, в том смысле, которое из них является наиболее значимым в поддержке этой репрессии, все еще нуждается в определении. Однако одна важная черта, которая всплывает из анализа множественных генов, состоит в том, что какой бы ни была роль компоненты ДНК-метилирования в инициации и (или) поддержании генного сайленсинга, однажды состоявшись, она играет доминирующую роль в наследуемости транскрипционно-репрессивного состояния. Соответственно, такие терапевтические приемы как ингибирование активности HDAC специфическими лекарственными препаратами, не могут индуцировать реэкспрессию раковых генов, промоторы которых содержат в себе плотно метилированнные островки CpG Однако, если сначала применяется низкая доза такого деметилирующего агента, как 5’-деоксиазацитидин (DAC), то затем ингибиторы HDAC обнаруживают при реэкспрессии «молчащих» генов эффект аддитивности и(или) синнергизма (Cameron et al., 1999; Suzuki et al., 2002). Данная парадигма в сочетании с использованием микрочипов для поиска, реэкспрессии сайленсных базально генов доказала свою ценность даже для идентификации новых эпигенетически сайленсированных генов при раке (Suzuki et al., 2002). Аналогично этому, реэкспрессия генов, следующая за назначением DAC, может привести к устранению меток сайленсирующего метилирования гистонов из промоторных участков эпигенетически сайленсированых раковых генов (Nguyen et al., 2001; Fahmer et al., 2002; Kondo et al., 2003). В этом смысле, как показано на рис. 24.6, метилирование ДНК может служить «замком», чтобы стабилизировать эпигенетический сайленсинг раковых генов и обеспечить его стабильное наследование, приводящее к потере функции генов. Еще один ключевой вопрос из области эпигенетического сайленсинга раковых генов касается того, какая из DNMT ответственна за установление и поддержание аномального метилирования ДНК промотора, которое часто сопровождает этот процесс. Современные данные позволяют предполагать, что эти этапы могут быть опосредованы каким-то другим способом, нежели это можно было бы предположить, исходя из классической роли Dnmt, установленной при исследовании развития мышей. При развитии мышей, как вытекает из исследований нокаутов трех известных биологически активных ДНК-метилтрансфераз — Dnmtl, Dnmt3a и Dnmt3b — два последних фермента отвечают за установление метилирования (метилирование ДНК de novo), тогда как Dnmtl ответственна за дальнейшее поддержание установленных паттернов (поддерживающее метилирование ДНК) (Li et al., 1992; более детально см. главу 18). Однако в культуре клеток рака толстой кишки исследования по генетическому разрушению DNMTs показывают, что поддержание большинства случаев общего метилирования ДНК, в том числе гиперметилирование промоторов и сопровождающий его сайленсинг генов, требует наличия как DNMT1, так и DNMT3b (Rhee et al., 2000, 2002). Изучение раковых клеток других типов дали более разнообразные результаты — от указания на некоторую степень партнерства этих двух ферментов в таком поддержании до описания генов, которые деметилируются и транскрипционно реактивируются при уменьшении количества одной только DNMT1 (Leu et al., 2003). Таким образом, вопрос о том, как DNMTs устанавливают и поддерживают аномальные паттерны метилирования ДНК в раковых клетках, требует того, чтобы исследования были продолжены. Особенно мы нуждаемся в прояснении того, посредством каких комплексов эти ферменты могли бы кооперироваться и с помощью каких механизмов они нацеливаются на промоторы генов. Несколько последних исследований показывают, что для такого рекрутирования ключевыми являются комплексы транскрипционной репрессии (Di Croce et al., 2002; Fuks et al., 2003: Brenner et al., 2005) Каковы бы ни были эти механизмы, следует помнить, что в эксперименте DNMTs млекопитающих обладают сложными функциями, включающими не только каталитическую активность, связанную с карбокситерминальными участками в отношении метилирования ДНК, но и активность, непосредственно связанную с транскрипционной репрессией в аминотерминальных доменах (см. рис. 18.3) (Robertson et al., 2000; Rountree et al., 2000; Fuks et al., 2001). Эти ферменты также могут связываться с ключевыми медиаторами транскрипционной репрессии, в том числе с HDAC и с белками, связывающимися с метилцитозином (MBDs), и потенциально рекрутировать их. Таким образом, роль DNMT в транскрипционном сайленсинге потенциально имеет много граней (от инициации до поддерживания), которые могут включать этапы метилирования ДНК, а могут и не включать их. Сайленсинг генов при раке поможет рассортировать эти возможности.
7. Резюме главных результатов исследований по осмыслению эпигенетического сайленсинга генов при раке
Приведенное выше обсуждение показывает, что мы узнали довольно много относительно молекулярных событий, которые лежат в основе появления метилированной ДНК промотора, а также генного сайленсинга в процессе развития опухоли, но едва ли не больше явлений еще требует прояснения. В табл. 24.5 суммированы как минимум некоторые наиболее важные вопросы, которые должны быть решены в будущих исследованиях. Во-первых, должны быть прояснены молекулярные события, определяющие одновременное появление общего гипометилирования ДНК и более локализованное гиперметилирование ДНК промотора. Эти перекрывающиеся состояния предполагают масштабные ошибки в нацеливании хроматина (мистаргетинг) в раковых клетках. Этиология этого явления должна послужить разъяснению того, как клетки млекопитающих укладывают свои геномы для создания соответствующих паттернов генной экспрессии и для поддержания целостности хромосом. Во-вторых, необходимо обрисовать детерминанты границ хроматина вокруг промоторов индивидуальных генов и их корреляцию как с нормальным, так и с аномальным состоянием транскрипции. Сами ли белки-инсуляторы, вовлеченные в защиту активных в норме генов от вторжения транскрипционно-репрессивного хроматина, и(или) модификации гистонов, устанавливают границы? Как могли бы эти детерминанты границ изменяться в процессе развития опухоли? В-третьих, каков порядок событий для появления аномального генного сайленсинга в раковых клетках? Требуется ли начальная даун-регуляция транскрипции гена? Предшествуют ли таргетному метилированию ДНК ключевые модификации хроматина, в том числе деацетилирование и метилирование гистоновых аминокислот и рекрутирование ферментов, которые служат связующим звеном в этом процессе (см. главу 10)? Если да, то каковы молекулярные взаимодействия, лежащие в основе такого таргетинга, и какую роль играют ключевые комплексы сайленсинга (такие как белки группы Polycomb, — см. главу 11), важные для нормальных и раковых стволовых клеток. В-четвертых, какие именно DNMT требуются для инициации и поддержания аномального метилирования ДНК промотора при раке, и как они взаимодействуют? Какой из компонентов хроматина, описанных выше, может взаимодействовать с этими ферментами и направлять их? Наконец, если аномальный генный сайленсинг уже установился при раке, какова точная иерархия молекулярных этапов, которые поддерживают его? Этот последний вопрос является не только ключевым фундаментальным вопросом, но и центральным в плане использования в медицине (что будет обсуждено далее) для реверсии аномального генного сайленсинга при профилактике и лечении рака.8. Выявление рака посредством метилирования ДНК
Тот факт, что локальное гиперметилирование островков CpG является таким обычным в раковых клетках, в сочетании с возможностью определять метилирование с высокой степенью чувствительности, привело к развитию нескольких подходов по определению рака с использованием жидкостей организма. Приобретенные изменения в метилировании островков CpG могут быть определены на фоне, характерном для нормальных клеток, после конверсии цитозинов в урацилы, при том, что 5-метилцитозин в ДНК, обработанной бисульфитом натрия остается интактным. Очень чувствительными являются методы ПЦР, например ПЦР, специфическая к метилированию (MSP-methylation-specific PCR), при которой праймеры сконструированы так, чтобы амплифицировать только метилированные участки. Другие методы включают способы, основанные на ПЦР в реальном времени, такие как «MethyLight», где флуоресцентный зонд, который может связываться только с метилированной ДНК, используется для выявления паттернов метилирования (как показано на левом рисунка титульной страницы, где на оси Y — гены, а на оси X — типы опухолей). Эти методики могут выявлять одну метилированную аллель на фоне примерно 1,000-10,000 аллелей. Таким образом, приобретение аномального паттерна метилирования может быть легко определено; эти подходы применимы к смесям клеток или даже к разным биологическим жидкостям, таким как плазма крови, моча или мокрота (Laird, 2003). Диагностика рака посредством идентификации измененного метилирования цитозина довольно надежная из-за свойственной ДНК стабильности, в отличие от РНК и белков. Кроме того, из-за того что измененные паттерны метилирования часто канцероспецифичны, эти методы могут быть способны отличить один тип рака от другого. Сейчас имеется целый ряд исследований, как было упомянуто выше, обеспечивающих «proof of principle» для многообещающего использования гиперметилированных последовательностей ДНК промотора как исключительно чувствительной стратегии для предсказания риска раковых заболеваний или выявления их. Окончательное доказательство того, насколько ценным этот подход окажется для клиники, дожидается более широких исследований, в которых будет дана полная оценка современных гипотез. Такие исследования безусловно будут проведены в ближайшие несколько лет.9. Эпигенетическая терапия
Наследуемая инактивация генов, имеющих отношение к раку, при помощи измененного метилирования ДНК и модификации хроматина привела к осознанию того, что сайленсированный хроматин может представлять собой жизнеспособную мишень для терапии. Таким образом, был разработан новый терапевтический поход под названием «эпигенетическая терапия», при котором лекарственные препараты, способные модифицировать хроматин или паттерны метилирования ДНК. используются либо по одному, либо в комбинации (рис. 24.7), чтобы повлиять на терапевтический результат (Egger et al., 2004). Аналоги нуклеозидов, 5-азацитидин, 5-аза-2’-дезоксицитидин, и зебуларин, являются мощными, основанными на известных механизмах (mechanism-based) ингибиторами метилирования цитозина ДНК (рис. 24.7а). Эти препараты включаются в ДНК делящихся клеток после того, как в ходе метаболизма они превращаются в соответствующие дезоксинуклеозид-трифосфаты. Будучи включены в ДНК, они взаимодействуют со всеми тремя известными метилтрансферазами ДНК и образуют ковалентные промежуточные продукты, которые в конечном счете ингибируют метилирование ДНК в последующих раундах синтеза ДНК. Механизм действия этих веществ вполне понятен и их использовали в течение некоторого времени, чтобы реактивировать «молчащие» гены в культуре ткани или в моделях с ксенотрансплантациями (xenograft). Однако недавно они нашли применение при лечении некоторых гематологических злокачественных заболеваний, в частности, миелоидного диспластического синдрома (MDS), который является предлейкемическим состоянием, возникающим, в основном, у пожилых пациентов (Lubbert, 2000; Wijermans et al., 2000; Silverman et al., 2002; Issa et al., 2004). Клинические реакции для пациентов с таким нарушением и с лейкемиями, которые могут развиться из предлейкемического состояния, становятся все более драматичными. Соответственно, лекарства на основе 5-азацитидина и 5-аза-2’-деоксицитидина (их клинические названия — Видаза (Vidaza) и Децитабин (Decitabine), соответственно) сейчас одобрены American Food and Drug Administration (FDA) для лечения пациентов с данными нарушениями. Зебуларин (Zebu-larine), который также является основанным на известных механизмах (mechanism-based) ингибитором ДНК-метилтрансфераз, находится на более ранней стадии клинической разработки. К настоящему моменту не обнаружены эффективные ингибиторы, не требующие включения в ДНК, но для клинических целей они могли бы быть более желательны, так как могли бы давать меньше побочных эффектов. Сейчас предпринимаются многочисленные попытки синтезировать и (или) обнаружить такие препараты. Хотя было показано, что Видаза и Децитабин клинически эффективны, оказалось труднее четко установить, что мишенями действия этих лекарств являются промоторы метилированных генов. Предварительные эксперименты позволили предположить, что ген-супрессор опухоли,/? 15у становится деметилированным после лечения Децитабином (Daskalakis et al., 2002); однако, остается показать, действуют ли эти препараты, индуцируя экспрессию гена, или по какому-нибудь другому механизму. Клинические испытания проходят также с использованием HDACs (рис. 24.76). Известно несколько препаратов, способных вызывать существенное ингибирование HDACs. Некоторые из них, такие как фенилбутановая кислота или вальпроевая кислота, в течение некоторого времени использовались для лечения других заболеваний (Marks et al., 2001; Richon and O’Brien, 2002). Эти препараты ингибируют все деацетилазы, и неясно, связана ли их эффективность в лечении определенных форм злокачественных заболеваний именно с ингибированием деацетилирования гистонов, а не с какой-либо другой реакцией. Более новые соединения, такие как субероиланилидгидроксамовая кислота (SAHA) и депсипептид, являются более специфичными ингибиторами гистоновых деацетилаз и показывают хорошие клинические результаты (рис. 24.8). Однако, опять же, трудно быть уверенным в том, что эти лекарства действуют на пациентов только в соответствии с теоретическими механизмами. Рис. 24/7. Структуры аналогов нуклеозидов — ингибиторов метилирования ДНК (а) и ингибиторов деацетилирования гистонов (б)
(а) Известно три нуклеозидных аналога, которые могут ингибировать метилирование ДНК после включения в ДНК 5-аза-цитидин (Видаза) и 5-аза-2’-дезоксицитидин (Децитабин) одобрены для лечения лейкемии. Зебуларин находится на более ранней стадии разработки; (б) несколько примеров многих ингибиторов гистоновых деапетилаз, некоторые из них в настоящее время находятся на стадии клинических испытаний
Рис. 24/7. Структуры аналогов нуклеозидов — ингибиторов метилирования ДНК (а) и ингибиторов деацетилирования гистонов (б)
(а) Известно три нуклеозидных аналога, которые могут ингибировать метилирование ДНК после включения в ДНК 5-аза-цитидин (Видаза) и 5-аза-2’-дезоксицитидин (Децитабин) одобрены для лечения лейкемии. Зебуларин находится на более ранней стадии разработки; (б) несколько примеров многих ингибиторов гистоновых деапетилаз, некоторые из них в настоящее время находятся на стадии клинических испытаний
Новейшие клинические испытания, основанные на взаимодействии хроматина с метилированием ДНК, обсуждавшемся в предыдущих разделах (Cameron et al., 1999; Suzuki et al., 2002), сфокусированы на комбинировании ингибиторов метилирования ДНК и ингибиторов HDACs, в попытке использовать более низкие дозы препаратов обоих классов, но получить при этом сильный синергистический эффект. Несколько интригующих клинических испытаний проводятся в настоящее время для проверки данных гипотез, однако все еще не ясно, будут ли работать эти подходы.
 Рис. 24.8. Ингибиторы деаиетилаз гистонов могут вызывать регрессию опухоли
Компьютерные томограммы (СТ) пациента с мезотелиомой (левый снимок) Перед лечением в правом легком наблюдалась большая плоская белая масса, сжимавшая аэрируемую черную часть легкого (см. стрелку). (Правый снимок) Спустя 4 месяца после лечения препаратом SAHA; наблюдается сморщивание опухоли и гораздо более расправленное правое легкое (снимки любезно предоставлены Др. Полом Марксом — Paul Marks, Memorial Sloan-Kettering Cancer Center, NY.)
Рис. 24.8. Ингибиторы деаиетилаз гистонов могут вызывать регрессию опухоли
Компьютерные томограммы (СТ) пациента с мезотелиомой (левый снимок) Перед лечением в правом легком наблюдалась большая плоская белая масса, сжимавшая аэрируемую черную часть легкого (см. стрелку). (Правый снимок) Спустя 4 месяца после лечения препаратом SAHA; наблюдается сморщивание опухоли и гораздо более расправленное правое легкое (снимки любезно предоставлены Др. Полом Марксом — Paul Marks, Memorial Sloan-Kettering Cancer Center, NY.)
Хотя метод эпигенетической терапии имеет хорошую теоретическую базу отсутствие специфичности в действии некоторых агентов дает повод для беспокойства. Например, аналоги нуклеозидов являются неспецифическими ингибиторами ДНК-метилтрансфераз и ингибируют метилирование ДНК во всем геноме. Поэтому существует возможность непреднамеренной реактивации генов в результате такой терапии, хотя это не представляется проблемой для тех пациентов с серьезными заболеваниями, которые уже были пролечены. Точно так же, есть несколько дополнительных модификаций хроматина помимо деацетилирования, такие как метилирование ключевых аминокислот гистонов, о которых говорилось в предыдущих главах, которые потенциально могут быть мишенями для терапии. Существует, следовательно, значительная заинтересованность в поиске новых мишеней для терапии с целью активировать «молчащие» гены, и в ближайшие годы ожидаются волнующие результаты на этом поприще.
Литература
Amann J.M., Nip J., Strom D.K., Lutterbach B., Harada H., Lenny N., Downing J.R., Meyers S., and Hiebert S.W., 2001. ETO, a target of t(8;21) in acute leukemia, makes distinct contacts with multiple histone deacetylases and binds mSin3A through its oligomerization domain. Mol. Cell. Biol. 21: 6470-6483. Baylin S.B., Fearon E.R., Vogelstein B., de Bustros A., Sharkis S.J., Burke P.J., Staal S.P., and Nelkin B.D., 1987. Hypermethylation of the 5' region of the calcitonin gene is a property of human lymphoid and acute myeloid malignancies. Blood 70: 412-417. Belinsky S.A., Nikula K.J., Palmisano W.A., Michels R., Saccomanno G., Gabrielson E., Baylin S.B., and Herman J.G., 1998. Aberrant methylation of pl6INK4a is an early event in lung cancer and a potential biomarker for early diagnosis. Proc. Natl. Acad. Sci. 95: 11891-11896. Brenner C., Deplus R., Didelot C., Loriot A., Vire E., De Smet C., Gutierrez A., Danovi D., Bernard D., Boon Т., et al., 2005. Мус represses transcription through recruitment of DNA methyltransferase compressor. EMBO J. 24. 336-346. Burbee D.G., Forgacs E., Zochbauer Muller S., Shivakumar L., Fong K., Gao B., Randle D., Kondo M., Virmani A., Bader S., et al., 2001. Epigenetic inactivation of RASSF1A in lung and breast cancers and malignant phenotype suppression./. Natl. Cancer Inst. 93: 691-699. Cameron E.E., Bachman K.E., Myohanen S., Herman J.G., and Baylin S.B., 1999. Synergy of demethylation and histone deacety-lase inhibition in the re-expression of genes silenced in cancer. Nat. Genet. 21: 103-107. Chen CM., ChenH.L., HsiauT.H., HsiauA.H., ShiH,, Brock G.J., Wei S.H., Caldwell C.W., Yan P.S., and Huang T.H., 2003. Methylation target array for rapid analysis of CpG island hypermethyla-tion in multiple tissue genomes. Am. J. Pathol. 163: 37-45. Chen W., Cooper T.K., Zahnow C.A., Overholtzer M., Zhao Z., Ladanyi M., Karp J.E., Gokgoz N., Wunder J.S., Andrulis I.L., et al., 2004. Epigenetic and genetic loss of Hid function accentuates the role ofp53 in tumorigenesis. Cancer Cell 6: 387—398. Chen W.Y, Wang D.H., Yen R.C., Luo J., Gu W, and Baylin S.B., 2005. Tumor suppressor HIC1 directly regulates S1RT1 to modulate p53-dependent DNA-damage responses. Cell 123: 437-448. Chen W.Y., Zeng X., Carter M.G.. Morrell C.N.. Chiu Yen R.W., Esteller M., Watkins D.N., Herman J.G., Mankowski J.L., and Baylin S.B., 2003. Heterozygous disruption of Hie /predisposes mice to a gender-dependent spectrum of malignant tumors. Nat. Genet. 33: 197-202. Dammann R., Li C., Yoon J.H., Chin P.L., Bates S., and Pfeifer G.P., 2000. Epigenetic inactivation of a RAS association domain family protein from the lung tumour suppressor locus 3p21.3. Nat. Genet. 25: 315-319. Daskalakis M., Nguyen T.T., Nguyen C., Guldbeig P., Kohler G., Wijermans P., Jones P.A., and Lubbert M., 2002. Demethylation of a hypermethylated P15/INK4B gene in patients with my-elodysplastic syndrome by 5-Aza-2’-deoxycytidine (decitabine) treatment. Blood 100: 2957-2964. Di Croce L., Raker V.A., Corsaro M., Fazi E, Fanelli M., Faretta M., Fuks E, Lo Coco E, Kouzarides T., Nervi C., et al., 2002. Methyl-transferase recruitment and DNA hypermethylation of target promoters by an oncogenic transcription factor. Science 295: 1079-1082. Egger G., Liang G., Aparicio A., and Jones P.A., 2004. Epigenetics in human disease and prospects for epigenetic therapy. Nature 429: 457-463. Ehrlich M., Gama-Sosa M.A., Huang L.H., Midgett R.M., Kuo K.C., McCune R.A., and Gehrke C., 1982. Amount and distribution of 5-methylcytosine in human DNA from different types of tissues of cells. Nucleic Acids Res. 10: 2709-2721. Esteller M., Risques R.A., Toyota M., Capella G., Moreno V., Peinado M.A., Baylin S.B., and Herman J.G., 2001a. Promoter hypermethylation of the DNA repair gene 0(6)-methylguanine-DNA methyltransferase is associated with the presence of G:C to A:T transition mutations in p53 in human colorectal tumori-genesis. Cancer Res. 61: 4689-4692. EstellerM., Fraga M.F., Guo M., Garcia-Foncillas J., HedenfalkL, Godwin A.K., Trojan J., Vaurs-Barriere C., Bignon Y.J., Ramus S., et al., 2001b. DNA methylation patterns in hereditary human cancers mimic sporadic tumorigenesis. Hum. Mol. Genet. 10: 3001-3007. Fahmer J.A., Eguchi S., Herman J.G., and Baylin S.B., 2002. Dependence of histone modifications and gene expression on DNA hypermethylation in cancer. Cancer Res. 62: 7213-7218. Feinberg A.P. and Vogelstein B., 1983. Hypomethylation distinguishes genes of some human cancers from their normal counterparts. Nature 301: 89-92. Feinberg A.P., Gehrke C.W., Kuo K.C., and Ehrlich M., 1988. Reduced genomic 5-methylcytosine content in human colonic neoplasia. Cancer Res. 48: 1159-1161. Finch P.W., He X.. Kelley M.J., Uren A.. Schaudies R.P., Popescu N.C., Rudikoff S., Aaronson S.A., Varmus H.E., and Rubin J.S., 1997. Purification and molecular cloning of a secreted, Frizzled-related antagonist of Wnt action. Proc. Natl. Acad. Sci. 94: 6770-6775. Flatau E., Bogenmann E., and Jones P.A., 1983. Variable 5-methylcy-tosine levels in human tumor cell lines and fresh pediatric tumor explants. Cancer Res. 43: 4901-4905. Frost P., Liteplo R.G., Donaghue T.P., and Kerbel R.S., 1984. Selection of strongly immunogenic “turn” variants from tumors at high frequency using 5-azacytidine. J. Exp. Med. 159: 1491-1501. Fuks E., Hurd P.J., Deplus R., and Kouzarides T., 2003. The DNA methyltransferases associate with HP1 and the SUV39H1 histone methyltransferase. Nucleic Acids Res. 31: 2305-2312. Fuks E., Burgers W.A., Godin N., Kasai M., and KouzaridesT., 2001. Dnmt3a binds deacetylases and is recruited by a sequence-specific repressor to silence transcription. EMBO J., 20: 2536-2544. Gaudet E., Hodgson J.G., Eden A., Jackson-Grusby L., Dausman J., GrayJ.W, Leonhardt H., and Jaenisch R., 2003. Induction of tumors in mice by genomic hypomethylation. Science 300: 489-492. Gazzoli I., Loda M., Garber J., Syngal S., and Kolodner R.D., 2002. A hereditary nonpolyposis colorectal carcinoma case associated with hypermethylation of the MLH1 gene in normal tissue and loss of heterozygosity of the unmethylated allele in the resulting microsatellite instability-high tumor. Cancer Res. 62: 3925-3928. Grady W.M., Wilis J., Guilford P.J., Dunbier A.K., Toro T.T., Lynch H., Wesner G., Ferguson K., Eng C, Park J.G., et al., 2000. Methylation of the CDH1 promoter as the second genetic hit in hereditary diffuse gastric cancer. Nat. Genet. 26: 16-17. Greenblatt M.S., Bennett W.P., Hollstein M., and Harris C.C., 1994. Mutations in the p53 tumor suppressor gene: Clues to cancer etiology and molecular pathogenesis. Cancer Res. 54: 4855-4878. Gregorieff A. and Clevers H., 2005. Wnt signaling in the intestinal epithelium: From endoderm to cancer. Genes Dev., 19: 877-890. Hanahan D. and Weinberg R.A., 2000. The hallmarks of cancer. Cell 100: 57-70. Herman J.G. and Baylin S.B., 2003. Gene silencing in cancer in association with promoter hypermethylation. N. Engl. J. Med. 349: 2042-2054. Herman J.G., Umar A., Polyak K., Graff J.R., Ahuja N., Issa J.P., Markowitz S., Wilson J.K., Hamilton S.R., Kinzler K.W, et al., 1998. Incidence and functional consequences of hMLHl promoter hypermethylation in colorectal carcinoma. Proc. Natl. Acad. Sci 95: 6870-6875. Holm T.M., Jackson-Grusby L., BrambrinkT., Yamada Y, Rideout W.M., III, and Jaenisch R., 2005. Global loss of imprinting leads to widespread tumorigenesis in adult mice. Cancer Cell 8: 275-285. Holst C.R., Nuovo G.J., Esteller M., Chew K., Baylin S.B., Herman J.G., and Tlsty T. D., 2003. Methylation ofplGlNK4a promoters occurs in vivo in histologically normal human mammary epithelia. Cancer Res. 63: 1596-1601. Howitz K.T., Bitterman K.J., Cohen H.Y., Lamming D.W., Lavu S., Wood J.G., Zipkin R.E., Chung P., Kisielewski A., Zhang L.L., et al., 2003. Small molecule activators of sirtuins extend Saccharomyces cerevisiae lifespan. Nature 425: 191-196. Issa J.P., Ottaviano Y.L., Celano P., Hamilton S.R., Davidson N.E., and Baylin S.B., 1994. Methylation of the oestrogen receptor CpG island links ageing and neoplasia in human colon Nat. Genet. 7: 536-540. Issa J.P., Garcia-Manero G., Giles F.J., Mannari R., Thomas D., Faderl S., Bayar E., Lyons J., Rosenfeld C.S., Cortes J., and Kantaijian H.M. 2004. Phase 1 study of low-dose prolonged exposure schedules of the hypomethylating agent 5-aza-2’-deoxycytidine (decitabine) in hematopoietic malignancies. Blood 103: 1635-1640. Jones P.A., 1999. The DNA methylation paradox. Trends Genet. 15: 34-37. Jones PA. and Baylin S.B., 2002. The fundamental role of epigenetic events in cancer. Nat. Rev. Genet. 3: 415-428. Jones P.A. and Laird P.W, 1999. Cancer epigenetics comes of age. Nat. Genet. 21: 163-167. Jones P.A. and Taylor S.M., 1980. Cellular differentiation, cytidine analogs and DNA methylation. Cell, 20: 85-93. Kaminskas E., Farrell A., Abraham S., Baird A., Hsieh L.S., Lee S.-L., Leighton J.K., Patel H., Rahman A., Sridhara R., et al., 2005. Approval summary: Azacitidine for treatment of myelodysplastic syndrome subtypes. Clin. Cancer Res. 11: 3604-3608. Kaneda A. and Feinberg A.P., 2005. Loss of imprinting of IGF2: A common epigenetic modifier of intestinal tumor risk. Cancer Res. 65: 11236-11240. Katzenellenbogen R.A., Baylin S.B., and Herman J.G., 1999. Hypermethylation of the DAP-kinase CpG island is a common alteration in B-cell malignancies. Blood 93: 4347-4353. Kinzler K.W. and Vogelstein B., 1997. Cancer-susceptibility genes. Gatekeepers and caretakers. Nature 386: 761-763. Kiyono T, Foster S.A., Koop J.I., McDougall J.K., Galloway D.A., and Klingelhutz A.J., 1998. Both Rb/pl6INK4a inactivation and telomerase activity are required to immortalize human epithelial cells. Nature 396: 84-88. Knudson A.G., 2001. Two genetic hits (more or less) to cancer. Nat. Rev. Cancer 1: 157-162. Kondo Y., Shen L., and Issa J.R, 2003. Critical role ofhistone methylation in tumor suppressor gene silencing in colorectal cancer. Mol Cell. Biol. 23: 206-215. Kuzmichev A., Margueron R., Vaquero A., PreissnerT.S., Scher M., KirmizisA., OuyangX., BrockdorffN., Abate-ShenC., Famham P., and Reinberg D., 2005. Composition and histone substrates of polycomb repressive group complexes change during cellular differentiation. Proc. Natl. Acad. Sci. 102: 1859-1864. Laird P.W., 2003. The power and the promise of DNA methylation markers. Nat. Rev. Cancer 3: 253-266. Laird P.W., Jackson-Grusby L., Fazeli A., Dickinson S.L., Jung W.E., Li E., Weinberg R.A., and Jaenisch R., 1995. Suppression of intestinal neoplasia by DNA hypomethylation. Cell 81: 197-205. Lapeyre J.N. and Becker F.F., 1979. 5-Methylcytosine content of nuclear DNA during chemical hepatocarcinogenesis and in carcinomas which result. Biochem. Biophys. Res. Commun. 87: 698-705. Lee W.H., Morton R.A., Epstein J.I., Brooks J.D., Campbell P.A., Bova G.S., Hsieh W.S., Isaacs W.B., and Nelson W.G., 1994. Cytidine methylation of regulatory sequences near the xu-class glutathione S-transferase gene accompanies human prostatic carcinogenesis. Proc. Natl. Acad. Sci. 91: 11733-11737. Leu Y.W., Rahmatpanah F., Shi H., Wei S.H., Liu J.C., Yan P.S., and Huang T.H., 2003. Double RNA interference of DNMT3band DNMT1 enhances DNA demethylation and gene reactivation. Cancer Res. 63: 6110-6115. Li E., Bestor T.H., and Jaenisch R., 1992. Targeted mutation of the DNA methyltransferase gene results in embryonic lethality. Cell 69: 915-926. Liu B., Nicolaides N.C., Markowitz S., Willson J.K., Parsons R.E., Jen J., Papadopolous N., Peltomaki P., de la Chapelle A., Hamilton S.R., et al., 1995. Mismatch repair gene defects in sporadic colorectal cancers with microsatellite instability. Nat. Genet. 9: 48-55. Lubbert M., 2000. DNA methylation inhibitors in the treatment of leukemias, myelodysplastic syndromes and hemoglobinopathies: Clinical results and possible mechanisms of action. Curr. Top. Microbiol. Immunol. 249: 135-164. Marks P., Rifkind R.A., Richon V.M., Breslow R., Miller T., and Kelly W.K., 2001. Histone deacetylases and cancer: Causes and therapies. Nat. Rev. Cancer 1: 194-202. Mizuno K., Osada H., Konishi H., Tatematsu Y., Yatabe Y., Mitsu-domi T., Fujii Y., and Takahashi T., 2002. Aberrant hypermethylation of the CHFR prophase checkpoint gene in human lung cancers. Oncogene 21: 2328-2333. Morin P.J., Sparks A.B., KorinekV., Barker N., Clevers H., Vogelstein B., and Kinzler K.W., 1997. Activation of p-catenin-Tcf signaling in colon cancer by mutations in p-catenin or APC Science 275: 1787-1790. Narayan A., Ji W., Zhang X.Y., Marrogi A., Graff J.R., Baylin S.B., and Ehrlich M., 1998. Hypomethylation of pericentromeric DNA in breast adenocarcinomas. Int. J. Cancer 77: 833-838. Nemoto S., Fergusson M.M., and Finkel T., 2004. Nutrient availability regulates SIRT1 through a forkhead-dependent pathway. Science 306: 2105-2108. Nguyen C.T., Gonzales F.A., and Jones P.A., 2001. Altered chromatin structure associated with methylation-induced gene silencing in cancer cells: Correlation of accessibility, methylation, MeCP2 binding and acetylation Nucleic Acids Res. 29: 4598-4606. Pfeifer G.P., Tang M., and Denissenko M.F., 2000. Mutation hotspots and DNA methylation. Curr. Top. Microbiol. Immunol. 249: 1-19. Rainier S., Johnson L.A., Dobry C.J., Ping A.J., Grundy P.E., and Feinberg A.P., 1993. Relaxation of imprinted genes in human cancer. Nature 362: 747-749. Rhee I., Bachman K.E., Park B.H., Jair K.W., Yen R.W., Schuebel K.E., Cui H., Feinberg A.P., Lengauer C., Kinzler K.W., et al., 2002. DNMT1 and DNMT3b cooperate to silence genes in human cancer cells. Nature 416: 552-556. Rhee I., Jair K.W., Yen R.W., Lengauer C., Herman J.G., Kinzler K.W., Vogelstein B., Baylin S.B., and Schuebel K.E., 2000. CpG methylation is mamtained in human cancer cells lacking DNMT1. Nature 404: 1003-1007. Richon V.M. and O’Brien J.P., 2002. Histone deacetylase inhibitors: A new class of potential therapeutic agents for cancer treatment. Clin. Cancer Res. 8: 662-664. Rideout W.M., III, Coetzee G.A., Olumi A.F., and Jones P.A., 1990. 5-Methylcytosine as an endogenous mutagen in the human LDL receptor and p53 genes. Science 249: 1288-1290. Robertson K.D., Ait-Si-Ali S., Yokochi T., Wade P.A., Jones P.L., and Wolffe A.P., 2000. DNMT1 forms a complex with Rb, E2F1 and HDAC1 and represses transcription from E2F-responsive promoters. Nat. Genet. 25: 338-342. Romanov S.R., Kozakiewicz B.K., Hoist C.R., Stampfer M.R., Haupt L.M., and Tlsty T.D., 2001. Normal human mammary epithelial cells spontaneously escape senescence and acquire genomic changes. Nature 409: 633-637. Rountree M.R., Bachman K.E., and Baylin S.B., 2000. DNMT1 binds HDAC2 and a new co-repressor, DMAP1, to form a complex at replication foci. Nat. Genet. 25: 269-277. Sakai T., Toguchida J., Ohtani N., Yandell D.W., Rapaport J.M., and Dryja T.P., 1991. Allele-specific hypermethylation of the retinoblastoma tumor-suppressor gene. Am. J. Hum. Genet. 48: 880-888. Sakatani T., Kaneda A., Iacobuzio-Donahue C.A., Carter M.G., de Boom Witzel S., Okano H., Ko M.S., Ohlsson R., Longo D.L., and Feinberg A.P., 2005. Loss of imprinting of Igf2 alters intestinal maturation and tumorigenesis in mice. Science 307: 1976-1978. Silverman L.R., Demakos E.P., Peterson B.L., Komblith A.B., Holland J.C., Odchimar-Reissig R., Stone R.M., Nelson D., Powell B.L., DeCastro CM., et al., 2002. Randomized controlled trial of azacitidine in patients with the myelodysplastic syndrome: A study of the cancer and leukemia group B. J. Clin. Oncol., 20: 2429-2440. Srinivasan P.R. and Borek E., 1964. Enzymatic alteration of nucleic acid structure. Science 145: 548-553. Suzuki H., Gabrielson E., Chen W., Anbazhagan R., van Engeland M., Weijenberg M.P, Herman J.G., and Baylin S.B., 2002. A genomic screen for genes upregulated by demethylation and histone deacetylase inhibition in human colorectal cancer. Nat. Genet. 31: 141-149. Suzuki H., Watkins D.N., Jair K.W., Schuebel K.E., Markowitz S.D., Chen W.D., Pretlow T.P., Yang B., Akiyama Y., Van Engeland M., et al., 2004. Epigenetic inactivation of SFRP genes allows constitutive WNT signaling in colorectal cancer. Nat. Genet. 36: 417-422. Toyota M., Ho C., Ahuja N., Jair K.W, Li Q., Ohe-Toyota M., Baylin S.B., and Issa J.P., 1999. Identification of differentially methylated sequences in colorectal cancer by methylated CpG island amplification. Cancer Res. 59: 2307-2312. Ushijima T., 2005. Detection and interpretation of altered methylation patterns in cancer cells. Nat. Rev. Cancer 5: 223-231. Veigl M.L., Kasturi L., Olechnowicz J., MaA.H., LutterbaughJ.D., Periyasamy S., Li G.M., Drummond J., Modnch P.L., Sedwick W.D., and Markowitz S.D., 1998. Biallelic inactivation ofhMLHl by epigenetic gene silencing, a novel mechanism causing human MSI cancers. Proc. Natl. Acad. Sci. 95: 8698-8702. Wales M.M., Biel M.A., el Deiry W., Nelkin B.D., Issa J.P., Cavenee W.K., Kuerbitz S.J., and Baylin S.B., 1995. p53 activates expression of HIC-1, a new candidate tumour suppressor gene on 17pl3.3. Nat. Med. 1: 570-577. Wijermans P., Lubbert M., Verhoef G., Bosly A., Ravoet C, Andre M., and Ferrant A., 2000. Low-dose 5-aza-2’-deoxycytidine, a DNA hypomethylating agent, for the treatment of high-risk myelodys-plastic syndrome: A multicenter phase II study in elderly patients. J. Clin. Oncol. 18: 956-962. Wolf P., Hu Y.C., Doffek K., Sidransky D., and Ahrendt S.A., 2001. 06-methylguanine-DNA methyltransferase promoter hypermethylation shifts the p53 mutational spectrum in non-small cell lung cancer. Cancer Res. 61: 8113-8117. Wolffe A.P., 2001. Chromatin remodeling: Why it is important in cancer. Oncogene, 20: 2988-2990. Yamashita K., Upadhyay S., Osada M., Hoque M.O., Xiao Y., Mori M., Sato R., Meltzer S.J., and Sidransky D., 2002. Pharmacologic unmasking of epigenetically silenced tumor suppressor genes in esophageal squamous cell carcinoma. Cancer Cell 2: 485-495.Приложение 1. WWW-ресурсы
Web-сайты, имеющие отношение к хроматину и эпигенетике
Chromatin Structure and Function ? Страница ресурсов по хроматину Джима Боуна http://www.chromatin.us Epigenome Network of Excellence ? Web-сайт Европейской междисциплинарной сети исследований по эпигенетике http://www.epigenome-noe.net HEP ? Исследовательский консорциум по проекту «Эпигеном человека» http://www.epigenome.org/ ENCODE ? Энциклопедия элементов ДНК: идентификация функциональных элементов у человека http://www.genome.gov/12513456 ChromDB ? База данных по хроматину растений http://www.chromdb.org/Ресурсы по гистонам
The NHGRI histone database ? Содержит информацию по последовательностям гистонов http://research.nhgn.nih.gov/histones/ Abeam histone page ? Содержит загрузки карт модификаций гистонов http://www.abcam.com/chromatin Histone.com page (Upstate) ? Карта модификаций гистонов, созданная Upstate http://www.histone.com/modification_map.htmБелки хроматина
NPD-Nuclear Protein Database ? Коллекция известных белков позвоночных, локализованных в ядре http://npd.hgu.mrc.ас.uk/index.html Chromatin proteins ? Линк с исследованиями on the NPD site ограниченными семействами белков хроматина http://www.epigenome-noe.net/researchtools/structure.php Flybase chromatin page ? Покрывает Polycomb, trithorax и другие белки хроматина у Drosophila http://flybase.bio.indiana.edw'allied-data/lkinteractive-fly/aignfam/polycomb.htmМетилирование ДНК
MethDB ? База данных по метилированию ДНК человека http://www.methdb.de/ DNA methylation society ? Web-сайт, посвященный аспектам биологического метилирования http://www.dnamethsoc.com/ CpG island searcher ? Алгоритм поиска последовательности островков CpG http://www.uscnorris.com/cpgislands2/cpg.aspxИмпринтинг
Mouse genomic imprinting ? Хромосомные карты мыши, показывающие известные импринтированные районы http://www.mgu.har.mrc.ас.ик/research/imprinting/ Gene Imprint ? Информационные ресурсы WWW по геномному импринтингу http://www.geneimprint.com/index.html Impnnted Gene Catalogue ? База данных по импринтированным генам http://igc.otago.ac.nz/home.html Candidate imprinted transcripts ? Ресурс предсказанного импринтированного транскриптома человека и мыши http://fantom2.gsc.riken.go.jp/imprinting/ (продолжение на следующей странице)RNA
NONCODE ? База данных, посвященных некодирующим РНК http://www.bioinfo.org.cn/NONCODE RNAdb ? База данных по некодирующим РНК млекопитающих http://research.imb.uq.edu.au/madb Micro RNAdb ? База данных по микроРНК эукариот http://166.111.30.65/micromadb/ miRBase ? Ресурс данных по микроРНК http://microma.sanger.ас.uk/ NARNA ? Платформа для поиска природных антисмысловых транскриптов http://www.nama.ncl.ас.uk/ ASRP ? Ресурс данных по малым siPHK и miPHK Arabidopsis thaliana http://asrp.cgrb.oregonstate.edu/ Коммерческие сайты ресурсов по эпигенетике Abeam ? Поставщики антител к гистонам http://www.abeam.сот/ Upstate ? Поставщики антител к гистонам http://www.upstatebiotech.сот/ Epigenomics ? Диагностический скрининг метилирования ДНК http://www.epigenomics.com/Ресурсы и базы данных по геномам организмов
Все эукариоты
NCBI ? Портал к сайтам по множественному геномному анализу и ссылкам http://www.ncbi.nlm.nih.gov ENSEMBL ? Браузер по эукариотическим геномам http://www.ensembl.org UCSC Genome Bioinformatics ? Портал геномных последовательностей и ресурсов http://genome.ucsc.edu EBI ? Портал к различным ресурсам по компьютерному анализу генома и протеома http://www.ebi.ac.uk/services Sanger Institute ? Портал к ресурсам по последовательностям, биоинформатике и протеомике http://www.sanger.ac.uk/ BCM Search Launcher ? Портал для поиска последовательностей и средств анализа http://searchlauncher.bcm.tmc.edu/docs/sl_links.html zPicture ? Средства сравнительного анализа последовательностей http://zpicture.dcode.org iHOP ? Информация с гиперссылками по ресурсам белок — белок http://www.ihop-net.org/UniPub/iHOP/ Repeat Masker ? Алгоритм повторящихся последовательностей для идентификации повторяющихся последовательностей ДНК http://repeatmasker.org Primer 3 ? Базирующаяся на Web программа конструирования праймеров http://frodo.wi.mit.edu/cgi-bin/primer3/primer3.cgiОтдельные организмы
S. cerevisiae — SGD — база данных по геному Saccharomyces http://www.yeastgenome.org — ENSEMBL ? портал анализа генома S. cerevisiae http://www.ensembl.org/Saccharomyces_cerevisiae/index.html S. pombe — Портал к сайтам по геномным последовательностям, родственным S. pombe, и по их анализу http://www.sanger.ac.uk/Projects/S_pombe/ T. thermophda — TGD — база данных по геному Tetrahymena http://www.ciliate.org/ — Проект по секвенированию макронуклеарного генома Tetrahymena http://www.genome.gov/12512294 A. thaliana — TAIR — ресурс информации по Arabidopsis GRAMENE — сравнительная геномика трав http://www.arabidopsis.org http://www.gramene.org/ — Ресурс по геному риса http://www.tigr.org/tdb/e2kl/osa1/ C. elegans — Портал к ресурсам по C. elegans http://www.wormbase.org/ — ENSEMBL — портал по анализу генома C. elegans http://www.ensembl.org/Caenorhabditis_elegans/index.html — Портал к сайтам по геномным последовательностям, родственным С elegans, и их анализу http://www.sanger.ac.uk/Projects/C_elegans/ Drosophila — База данных по геномуDrosophila http://www.flybase.net — ENSEMBL-портал геномного анализа!), melanogaster http://www.ensembl.org/Drosophila_ X. laevis — Информационная база данных http://www.xenbase.org/ Мышь — Информатика генома мыши http://www.informatics.jax.org — Ресурс по штаммам мышей http://jaxmice.jax.org/index.html — Проект Бейлора по геному мыши http://www.mouse-genome. bcm.tmc.edu/ — ENSEMBL — pecypc по мыши http://www.ensembl.org/Mus_musculus/index html Человек — Портал ресурсов по геному человека http://www.ncbi.nlm.nih.gov/genome/guide_human/ — ENSEMBL — портал ресурсов по геному человека http://www.ensembl.org/Homosapiens/index.html — GDB — база данных по геному человека http://www.gdb.orgПриложение 2. Модификации гистонов и литература
Гистон Н2А
Сайт | Модель | Энзим | Функция | Ссылка K5ac | Hs, Sc | Tip60, p300/CBP, Hat1 | Активация транскрипции | Yamamoto and Horikoshi, 1997; Kimura and Horikoshi, 1998; Verreault etal., 1998 K9bio | — | HCS-биотинидаза | Зависимая от ацетилирования и метилирования. Участвует в клеточной пролиферации, сайленсинге генов и в клеточном ответе на повреждение ДНК | Stanley et al., 2001; Kothapalli et al., 2005b; Chew et al., 2006 K7ac | Sc | Hat1 Esa1 | Активация транскрипции | Suka et al., 2001 K13bio | — | HCS-биотинидаза | Зависимая от ацетилирования и метилирования. Участвует в клеточной пролиферации, сайленсинге генов и клеточном ответе на повреждение ДНК | Stanley et al., 2001; Kothapalli et al., 2005b; Chew et al., 2006 K119ub1 | Dm. Hs | dRing, RING IB | Polycomb-сайленсинг, Реакция на УФ-повреждение | Wang et al., 2004; Kapetanaki et al., 2006 S121ph | Sc | Mec1 PIKK | Ответ на повреждение ДНК. | Теломерный сайленсинг | Wyatt et al., 2003; Harvey et al., 2005 T125ph | Sc | Mec1 PIKK | Ответ на повреждение ДНК. Теломерный сайленсинг | Wyatt et al., 2003 K126bio | Hs | HCS биотинидаза | Зависимая от ацетилирования и метилирования. Участвует в клеточной пролиферации, сайленсинге генов и клеточном ответе на повреждение ДНК | Stanley et al., 2001; Kothapalli et al., 2005b, Chew et al., 2006 K126su | Sc | Репрессия транскрипцииБлокирует ацетилирование и убиквитинирование гистонов | Nathan et al., 2006 K127bio | Hs | HCS-биотинидаза | Зависимая от ацетилирования и метилирования. Участвует в клеточной пролиферации, сайленсинге генов и клеточном ответе на повреждение ДНК | Stanley et al., 2001; Kothapalli et al., 2005b; Chew et al., 2006 S128ph | Sc | Mec1 PIKK | Ответ на повреждение ДНК. Теломерный сайленсинг | Downs et al., 2000; Redon et al., 2003; Wyatt et al., 2003; Downs et al., 2004 K130bio | Hs | HCS-биотинидаза | Зависимая от ацетилирования и метилирования. Участвует в клеточной пролиферации, сайленсинге генов и клеточном ответе на повреждение ДНК | Stanley et al., 2001; Kothapalli et al., 2005b; Chew et al., 2006 Дополнительные модификации Н2А: S1ph, К4ас, K13me, K15ас, K21ас, K36ас, K74me, K75me, R77me, K95me, T120ph, карбонилирование Н2А (Pantazis and Bonner, 1981; Song et al., 2003; Alhara et al., 2004).Гистон Н2В
Сайт | Модель | Энзим | Функция | Ссылка К5ас | Hs | — | Активация транскрипции | Puerta et al., 1995; Galasinski et al., 2002 S10ph | Sc | Ste20 | Апоптоз | Ahn et al., 2005 S14ph | Hs, Mm | Mst1/krs2 киназа | Апоптоз. Соматическая гипермутация и рекомбинация с переключением классов | Ajiro, 2000; Cheung et al., 2003; Odegard et al., 2005 K16su | Sc | — | Репрессия генов | Nathan et al., 2006 K17su | Sc | — | Репрессия генов | Nathan et al., 2006 S33ph | Dm | CTK | Активация транскрипции | Maile et al., 2004 K120ub | Hs | — | Прогрессия по клеточному циклу в сочетании с SAGA для транскрипционной активации посредством метилирования H3, мейоз | Robzyk et al., 2000; Sun and Allis, 2002; Kao et al., 2004 K123ub | Sc | Rad6(E2)Brel(E3)-ub1 | Теломерный сайленсинг путем снижения метилирования гистонов по H3K4 и H3K79 | Emre et al., 2005 Дополнительные модификации Н2В: E2am, K5me, K6su, K7su, K11ac, K12ас, K15ас, K16ас, K20ас, K23me, K24ас, S32ph, K43me, K85ас, R99me, K108ас, K116ас, Kарбонилирование Н2В, биотинилирование Н2В (Rouleau et al., 2004).Гистон Н3
Сайт | Модель | Энзим | Функция | Ссылка R2me | Hs Mm | CARM1-me2a | Экспрессия генов | Chen et al., 1999; Schurter et al., 2001 T3ph | Hs At | Haspin | Центромерная функция митотического веретена | Polioudaki et al., 2004; Dai et al., 2005 K4me | Sc | Setl-me3 | Сайленсинг rDNA, теломерный сайленсинг. Активация транскрипции | Briggs et al., 2001; Roguev et al., 2001; Nagy et al., 2002; Bryk et al., 2002; Bernstein et al., 2002; Santos-Rosa et al., 2002 K4me | Tt | ? | Активация транскрипции | Strahl et al. 1999 K4me | Hs | SET7/Set9-me1 | Активация транскрипции | H. Wang et al., 2001a; Nishioka et al., 2002a; Wilson et al., 2002; Zegerman et al., 2002 K4me | Ds Hs | MLLMLL2-me3 MLL3 | Активация Trithorax | Milne et al., 2002; Nakamura et al., 2002 K4me | Ds Hs | Ash1-me2 | Активация Trithorax | Beisel et al., 2002; Sanchez-Eisner et al., 2006 K4me | Hs | SMYD3-me3 | Активация транскрипции | Hamamoto et al., 2004 K9ac | Mm Sc | Meisetz-me3SAGA | Прогрессия мейотической профазы. Активация транскрипции | Hayashi et al., 2005 Grant et al., 1999 K9ac | Hs | SRC1 | Коактиватор ядерного рецептора | Spencer et al. 1997; Schubeler et al., 2000: Vaquero et al., 2004 K9ac | Dm | Активация транскрипции | Nowak et al., 2000 K9me | Mm, Hs | G9a-me1, me2 | Активация транскрипции. Импринтинг | Tachibana et al., 2001, 2002; Ogawa et al., 2002; Xin et al., 2003 K9me | Dm | Su(var)3-9-me2 | Доминантный модификатор PEV | Czermin et al., 2001; Schotta et al., 2002; Ebert et al., 2004 K9me | Mm | Suv39h1-me3 Suv39h2-me3 | Перипентрический гетерохроматин | O’Carroll et al., 2000; Rea et al., 2000; Lachner et al., 2001; Peters et al., 2001 K9me | Hs | SUV39H1-me3 | Rb-опосредованный сайленсинг | Nielsen et al., 2001; Vandel et al., 2001 K9me | Sp | Clr4-me1, me2 | Сайленсинг центромеры и типа спаривания | Bannister et al., 2001; Nakayama et al., 2001 K9me | Nc | Dim5-me3 | Метилирование ДНК | Tamaru and Selker, 2001 K9me | At | KRYPTONITE-me2 | Метилирование ДНК | Jackson et al., 2002, 2004 K9me | Hs | EuHMTase 1-me1, me2 | Репрессия транскрипции | Ogawa et al., 2002; Tachibana et al., 2005 K9me | Hs, Mm | ESET-me2, me3 | Репрессия транскрипции | Schultz et al., 2002; Yang et al., 2002; Dodge et al., 2004; Wang et al., 2004 K9me | Dm, Hs | Ash1-me2 | Активация Trithorax | Beisel et al., 2002 K9me | Hs | R1Z1-me2 | Супрессия опухоли и ответ на женские половые гормоны | Kim et al., 2003; Carling et al., 2004 S10ph | Sc | Snf1 | Активация транскрипции | Lo et al., 2001 S10ph | Dm | |il-1 | Транскрипционная ап-регуляция мужской Х-хромосомы | Jin et al., 1999; Y. Wang et al., 2001 S10ph | Hs | Rsk2 | Активация транскрипции немедленных ранних генов (в сочетании с ацетилированием H3K14) | Sassone-Corsi et al., 1999; Thomson et al. 1999; S10ph | Hs | Msk1 | Активация транскрипции немедленных ранних генов (в сочетании с ацетилированием H3K14) | Cheung et al., 2000; S10ph | Hs | Msk2 | Активация транскрипции немедленных ранних генов (в сочетании с ацетилированием H3K14) | Clayton et al. 2000 S10ph | Hs | IKKa | Транскрипционная ап-регуляция | Anest et al., 2003; Yamamoto et al, 2003 S10ph | Sc, Ce | Ipl1/AuroraB | Конденсация митотических хромосом | Hendzel et al., 1997; Wei et al.. 1999: Hsu et al., 2000 S10ph | An | NIMA | Конденсация митотических хромосом | De Souza et al., 2000 S10ph | Hs, Ce | Fyn kinase | UVB-индуцированный МАР-киназный путь | He et al., 2005 T11ph | Hs | Dlk/ZIP | Митоз-специфичное фосфорилирование | Preussetal., 2003 K14ac | Sc, Tt, Mm | Gcn5 | Активация транскрипции | Brownell et al., 1996; Kuo et al., 1996 K14ac | Hs, Dm TAF„230 TAF„250 | Активация транскрипции | Mizzen et al., 1996 K14ac | Hs | p300 | Активация транскрипции | Schiltz et al., 1999 K14ac | Hs | PCAF | Активация транскрипции | Schiltz et al., 1999 K14ac | Mm | SRC1 | Коактиватор ядерного рецептора | Spencer et al., 1997 R17me | Hs, Mm | CARM1 | Активация транскрипции (в сочетании с ацетилированием H3K18/23) | Chen et al., 1999; Schurter et al., 2001; Bauer et al., 2002; Daujat et al., 2002 K18ac | Sc | SAGA Ada Активация транскрипции | Grant etal., 1999 K18ac | Hs | p300 | Активация транскрипции | Schiltz etal., 1999 K18ac | Hs | СВР | Активация транскрипции (в сочетании с метилированием H3R17) | Daujat et al., 2002 K23ac | Sc | SAGA | Активация транскрипции | Grant etal., 1999 K23ac | Hs | СВР | Активация транскрипции (в сочетании с метилированием H3R17) | Daujat et al., 2002 R26me | Hs | CARM1 | Сайт метилирования in vitro | Chen et al., 1999; Schurter et al., 2001 K27me | Hs, Dm | E(z)/EZH2-me3 | Polycomb-репрессия Инактивация Х-хромосомы ранних В-клеток | Cao et al., 2002; Czermin et al., 2002; Kuzmichev et al., 2002; Muller et al., 2002; Su et al., 2003 S28ph | Hs | Aurora-В | Конденсация митотических хромосом | Goto et al., 1999, 2002 S28ph | Hs | MSK1 | UVB-индуцированное фосфорилирование | Zhong et al., 2001 K36me | Sc | Set2-me2 | Репрессия генов | Strahl et al., 2002; Kizer et al., 2005 K36me | Nc | Set2-me2 | Активация транскрипции | Adhvaryu et al., 2005 K36me | Sp | Set2-me2 | Элонгация транскрипции | Morris et al., 2005 K79me | Sc. Hs | Dot! /DOT! L-me2 | Теломерный сайленсинг, пахитенный checkpoint | Feng et al., 2002; Lacoste et al., 2002; Ng et al., 2002; van Leeuwen et al., 2002 Дополнительные модификации H3: K14me, K23me, K27ас, T32ph, K37me, K56me, K64me, K115ас, K118ас, K118me, K122ас, R128me (Hyland et al., 2005).Гистон Н4
Сайт | Модель | Энзим | Функция | Ссылка S1ph | Hs, Sc | Casein kinase II | Реакция на повреждение ДНК | Ruiz-Carrillo et al., 1975; Cheung et al., 2005; van Attikum and Gasser, 2005 R3me | Hs, Sc | PRMT1 | Активация транскрипции | H. Wang et al., 2001 a,b K5ac | It, Dm, Hs | Hatl | Откладка гистонов | Sobeletal., 1995; Parthunetal., 1996; Taplicket al., 1998; Turner, 2000; Kruhlak et al., 2001 K5ac | Sc | Esa1/NluA4 | Прогрессия по клеточному циклу | Smith etal., 1998; Allard etal., 1999; Clarke et al., 1999; Bird et al., 2002; Miranda et al., 2006 K5ac | Hs, Mm | ATF2 | Сиквенс-специфичный TF | Kawasaki et al., 2000a K5ac | Hs p300 | Активация транскрипции | Turner and Fellows, 1989; Schiltz et al., 1999 K8ac | Hs, Mm | Y-ATF2 | Исключен из Xi. Сиквенс-специфичный транскрипционный фактор | Jeppesenetal., 1993: Choyetal., 2001; Kruhlak et al., 2001; Kawasaki et al., 2000b K5ac | Hs | PCAF/p300 | Активация транскрипции | Turner and Fellows, 1989; Schiltz et al., 1999 К12ас | Sc, Hs | Hatl | Исключен из Xi. Откладка гистонов | Turner and Fellows, 1989; Jeppesenetal., 1993; Kleffetal., 1995; Sobeletal., 1995; Parthunetal., 1996; Chang et al., 1997; Kruhlak et al., 2001 К12ас | Sc | NuA4 | Прогрессия в митозе и в мейозе | Choy et al., 2001 K12bio | Hs | HCS Биотинидаза | Уменьшение реакции на двунитевые разрывы ДНК. Влияние на пролиферацию клеток | Stanley et al., 2001; Kothapalli et al., 2005a,b К16ас | Mm | ? | Исключен из Xi. Зависимое от клеточного цикла ацетилирование | Ieppesen et al., 1993; Taplick et al., 1998 К16ас | Dm | MOF | Транскрипционная ап-регуляция мужской Х-хромосомы | Akhtar and Becker, 2000; Hsu et al., 2000 К16ас | Hs, Mm | ATF2 | Сиквенс-специфичный транскрипционный фактор | Turner and Fellows, 1989; Kawasaki et al., 2000a; Turner, 2000; Kruhlak et al., 2001; Vacquero et al., 2004 K20me | Mm, Dm | Suv4-20hl-me2, me3 Suv4-20h2-me2, me3 | Сайленсинг генов | Schotta et al., 2004 K20me | Hs, Dm | Pr-SET7/Set8-me1 | Транскрипционный сайленсинг, митотическая конденсация | Fang et al., 2002; Nishioka et al., 2002b; Rice et al., 2002 K20me | Dm | Ash1-me2 | Trithorax-активация в сочетании с метилированием H3K4 и H3K9 | Beisei et al., 2002 K59me | Sc | Формирование «молчащего» хроматина | Zhang et al., 2003 K59me | Su Hs | SUMO-1 SUMO-3 | Репрессия транскрипции | Shiio and Eisenman, 2003 Дополнительные модификации Н4: K12me, S47ph, K31ubl, К59me, К77ас, К79ас, К79me, K91ub1, R92me (Hyland et al., 2005).Гистон Н1
Сайт | Модель | Энзим | Функция | Ссылка E2ar1 | Rn | PARP-1 | Участие в нейротрофной активности | Ogata et al., 1980; Visochek et al., 2005 T10ph | Hs | — | Митоз-специфичная транскрипционная активация Н1b | Chadee et al., 1995; Garcia et al., 2004; Sarg et al., 2006 E14ar1 | Rn | PARP-1 | Участие в нейротрофной активности Ogata et al., 1980; Visochek et al., 2005 S17ph | Hs | — | Интерфаза-специфичная транскрипционная активация Н1b Garcia et al., 2004; Chadee et al., 1995; Sarg et al., 2006 K26me | Hs | EZH2-me2 | Опосредует связывание НР1 Kuzmichev et al., 2004; Daujat et al., 2005 S27ph | Hs | — | Блокирует связывание НР1 | Garcia et al., 2004; Daujat et al., 2005 T137ph | Hs | — | Митоз-специфичная транскрипционная активация H1b | Chadee et al., 1995; Garcia et al., 2004; Sarg et al., 2006 T154ph | Hs | — | Митоз-специфичная транскрипционная активация H1b | Chadee et al., 1995; Garcia et al., 2004; Sarg et al., 2006 S172ph | Hs | — | Интерфаза-специфичная транскрипционная активация H1b | Chadee et al., 1995; Garcia et al., 2004; Sarg et al., 2006 S188ph | Hs | — | Интерфаза-специфичная транскрипционная активация H1b | Chadee et al., 1995; Garcia et al., 2004; Sarg et al., 2006 K213arl | Rn | PARP-1 | Участие в нейротрофной активности | Ogata et al., 1980; Visochek et al, 2005 Дополнительные модификации Н1: К26ас, E114arn, убиквитинирование Н1, карбонилирование HI (Pham and Sauer, 2000: Rouleau et al., 2004).Гистон H2AX
Сайт | Модель | Энзим | Функция | Ссылка S139ph | Hs, Sc, Dm. XI | ATM DNA-PK | Репарация ДНК. Связана с М-фазой. Известна также как ?Н2АХ | Rogakou et al., 1998,1999; Burma et al., 2001 ; Stiff et al., 2004; Ichijima et al., 2005; Mukheijee et al., 2006 Дополнительные модификации H2AX: T136ph.Гистон macroH2A
Сайт | Модель | Энзим | Функция | Ссылка K17me | Hs | — | — | Chu et al., 2006 K115ub1 | Hs | — | — | Ogawa et al., 2005; Chu et al., 2006 K122me | Hs | — | — | Chu et al., 2006 T128ph | Hs | — | — | Chu et al., 2006 K238me | Hs | — | — | Chu et al., 2006Гистон H3.3
Сайт | Модель | Энзим | Функция | Ссылка K4me | Dm | me1, me2, me3 | Активация транскрипции | McKittrick et al., 2004 K9me | Dm | me1, me2 | Репрессия транскрипции | McKittnck et al., 2004 K9ac | Dm, Hs | — | Активация транскрипции | McKittrick et al., 2004; Hake and Allis, 2006 K14me | Dm | me1, me2 | McKittrick et al., 2004 K14ac | Dm, Hs | — | Активация транскрипции | McKittrick et al., 2004; Hake and Allis, 2006 K18aс | Hs | — | Активация транскрипции | Hake and Allis, 2006 K23ac | Hs | — | Активация транскрипции | Hake and Allis, 2006 K27me | Dm | me1, me2, me3 | Репрессия транскрипции | McKittrick et al., 2004 K36me | Dm, Hs | me1, me2, me3 | Активация транскрипции | McKittrick et al., 2004; Hake and Allis, 2006 K37me | Dm | me1, me2 | — | McKittrick et al., 2004 K79me | Dm, Hs | me1, me2 | Активация транскрипции | McKittrick et al., 2004; Hake and Allis, 2006 S31ph | Млекопитающие | — | Митоз-специфичное фосфорилирование | Hake et al., 2005CEN-H3/ CENP-A
Сайт | Модель | Энзим | Функция | Ссылка S7ph | Hs | — | Митоз | Zeitlin et al., 2001 Дополнительные модификации CENP-A: S17ph.Сокращения для модельных организмов:
(An) Aspergillus nidulans, (At) Arabidopsis thaliana, (Ce) Caenorhabditis elegans, (Dm) Drosophila melanogaster, (Hs) Homo sapiens, (Mm) Mus musculus, (Nc) Neurospora crassa, (Rn) Rattus norvegicus, (Sc) Saccharomyces cerevisiae, (Sp) Schizosaccharomyces pombe, (Tt) Tetrahymena thermophila, (Xl) Xenopus laevis. Модификации гистонов — по номенклатуре, предложенной Тернером (Turner, 2005). В таблицах перечисляются все известные модификации гистонов и известные энзимы с первичными ссылками (до мая, 2006 г.). Дополнительные модификации с пока еще неизвестными функциями перечислены под таблицами. Эти модификации взяты из разных источников: обзорных статей, информации от Abeam Cambridge, UK и Upstate Charlottesville, USA, а также из неопубликованных данных лаборатории Рейнберга (Reinberg). Эта таблица была составлена на основе оригинального варианта, взятого из (Lachner et al., 2003) и значительно расширенного Roopsha Sengupta и Mario Richter (Лаборатория Jenuwein, IMP Vienna). Д-р Patrick Trojer (Лаборатория Reinberg, HHMI, New Jersey) проверил содержимое таблиц. Эта таблица была проверена и дополнена информацией, предоставленной д-ром Steven Gray (Dept, of Clinical Medicine, Institute of Molecular Medicine, St. James Hospital, Dublin).ЛИТЕРАТУРА
Adhvaryu K.K., Morris S.A., Strahl B.D., and Selker E.U., 2005. Methylation of histone H3 lysine 36 is required for normal development in Neurospora crassa. Eukaryot. Cell 4: 1455-1464. Ahn S.H., Cheung W.L., Hsu J.Y., Diaz R.L., Smith M.M., and Allis C.D., 2005. Sterile, 20 kinase phosphorylates histone H2B at serine 10 during hydrogen peroxide-induced apoptosis in S. cerevisiae. Cell 120: 25-36. Aihara H., Nakagawa T., Yasui K., Ohta T., Hirose S., Dhomae N., Takio K., Kaneko M., Takeshima Y., Muramatsu M., and Ito T., 2004. Nucleosomal histone kinase-1 phosphorylates H2A Thr 119 during mitosis in the early Drosophila embryo. Genes Dev. 18: 877-888. Ajiro K., 2000. Histone H2B phosphorylation in mammalian apop-totic cells. An association with DNA fragmentation. J. Biol. Chem. 275: 439-443. Akhtar A., and Becker P.B., 2000. Activation of transcription through histone H4 acetylation by MOF, an acetyltransferase essential for dosage compensation in Drosophila. Mol. Cell 5: 367-375. Allard S., Utley R.T., Savard J., Clarke A., Grant P., Brandi C.J., Pillus L., Workman J.L., and Cote J., 1999. NuA4, an essential transcription adaptor/histone H4 acetyltransferase complex containing Esalp and the ATM-related cofactor Tralp. EMBO J. 18: 5108-5119. Anest V., Hanson J.L., Cogswell P.C, Steinbrecher K.A., Strahl B.D., and Baldwin A.S., 2003. A nucleosomal function for IkB kinase-a in NF-KB-dependent gene expression. Nature 423: 659-663. Bannister A.J., Zegerman P., Partridge J.E., Miska E.A., Thomas J.O., Allshire R.C., and Kouzarides T., 2001. Selective recognition of methylated lysine 9 on histone H3 by the HP1 chromo domain. Nature 410: 120-124. Bauer U.M., Daujat S., Nielsen S.J., Nightingale K., and Kouzarides T., 2002. Methylation at arginine 17 of histone H3 is linked to gene activation. EMBO Rep. 3: 39-44. Beisel C, Imhof A., Greene J., Kremmer E., and Sauer F., 2002. Histone methylation by the Drosophila epigenetic transcriptional regulator Ash 1. Nature 419: 857-862. Berger S.L., 2002. Histone modifications in transcriptional regulation. Curr. Opin. Genet. Dev. 12: 142-148. Bernstein B.E., Humphrey E.X., Erlich R.L., Schneider R., Bouman P., Liu J.S., Kouzarides T., and Schreiber S.L., 2002. Methylation of histone H3 Lys 4 in coding regions of active genes. Proc. Natl. Acad. Sci. 99: 8695-8700. Bird A.W., Yu D.Y., Pray-Grant M.G., Qiu Q., Harmon K.E., Me-gee P.C., Grant P.A., Smith M.M., and Christman M.F., 2002. Acetylation of histone H4 by Esal is required for DNA double-strand break repair. Nature 419: 411-415. Briggs S.D., Bryk M., Strahl B.D., Cheung W.L., Davie J.K., Dent S.Y., Winston E, and Allis C.D., 2001. Histone H3 lysine 4 methylation is mediated by Setl and required for cell growth and rDNA silencing in Saccharomyces cerevisiae. Genes Dev. 15: 3286-3295. Bryk M., Briggs S.D., Strahl B.D., Curcio M.J., Allis C.D., and Winston E., 2002. Evidence that Setl, a factor required for methylation of histone H3, regulates rDNA silencing in S. cerevisiae by a Sir2-independent mechanism. Curr. Biol. 12: 165-170. Brownell J.E., Zhou J., RanalliT., Kobayashi R., Edmondson D.G., Roth S. Y., and Allis C.D., 1996. Tetrahymena histone acetyltransferase A: A homolog to yeast Gcn5p linking histone acetylation to gene activation. Cell 84: 843-851. Burma S., Chen B.P., Murphy M., Kurimasa A., and Chen D.J., 2001. ATM phosphorylates histone H2AX in response to DNA double-strand breaks. J. Biol. Chem. 276: 42462-42467. Cao R., Wang L., Wang H., Xia L., Erdjument-Bromage H., Tempst P., Jones R.S., and Zhang Y., 2002. Role of histone H3 lysine 27 methylation in Polycomb-group silencing. Science 298: 1039-1043. Carling T., Kim K.C., Yang X.H., Gu J., Zhang X.K., and Huang S., 2004. A histone methyltransferase is required for maximal response to female sex hormones. Mol. Cell. Biol. 24: 7032-7042. Chadee D.N., Taylor W.R., Hurta R.A., Allis C.D., Wright J.A., and Davie J.R., 1995. Increased phosphorylation of histone HI in mouse fibroblasts transformed with oncogenes or constitutively active mitogen-activated protein kinase kinase. J. Biol. Chem. 270: 20098-20105. Chang L., Loranger S.S., Mizzen C., Ernst S.G., Allis C.D., and Annunziato A.T., 1997. Histones in transit: Cytosolic histone complexes and diacetylation of H4 during nucleosome assembly in human cells. Biochemistry 36: 469-480. Chen D., Ma H., Hong H., Koh S.S., Huang S.M., Schurter B.T., Aswad D.W., and Stallcup M.R., 1999. Regulation of transcription by a protein methyltransferase. Science 284: 2174-2177. Cheung R, Tanner K.G., Cheung W.L., Sassone-Corsi P., Denu J.M., and Allis C.D., 2000. Synergistic coupling of histone H3 phosphorylation and acetylation in response to epidermal growth factor stimulation. Mol. Cell 5: 905-915. Cheung W.L., Turner F.B., Krishnamoorthy T., Wolner B., Ahn S.H., Foley M., Dorsey J.A., Peterson C.L., Berger S.L., and Allis C.D., 2005. Phosphorylation of histone H4 serine 1 during DNA damage requires casein kinase II in S. cerevisiae. Curr. Biol. 15: 656-660. Cheung W.L., Ajiro K., Samejima K., Kloc M., Cheung P., Mizzen C.A., Beeser A., Etkin L.D., Chemoff J., Eamshaw W.C., and Allis C.D., 2003. Apoptotic phosphorylation of histone H2B is mediated by mammalian sterile twenty kinase. Cell 113: 507-517. Chew Y.C., Camporeale G., Kothapalli N., Sarath G., andZempleni J., 2006. Lysine residues in N -terminal and C-terminal regions of human histone H2A are targets for biotinylation by biotinidase. J. Nutr. Biochem. 17: 225-233. Choy J.S., Tobe B.T., Huh J.H., and Kron S.J., 2001. Yng2p-depen-dent NuA4 histone H4 acetylation activity is required for mitotic and meiotic progression. J. Biol. Chem. 276: 43653-43662. Chu F., Nusinow D.A., Chalkley R.J., Plath K., Panning B., and Burlingame A.L., 2006. Mapping post-translational modifications of the histone variant MacroH2Al using tandem mass spectrometry. Mol. Cell. Proteomics 5: 194-203. Clarke A.S., Lowell I.E., Jacobson S.J., and Pillus L., 1999. Esalp is an essential histone acetyltransferase required for cell cycle progression. Mol. Cell. Biol., 19: 2515-2526. Clayton A.L., Rose S., Barratt M.J., and Mahadevan L.C., 2000. Phosphoacetylation of histone H3 on c-fos- and c-jun-associated nucleosomes upon gene activation. EMBO J., 19: 3714-3726. Coffee B., Zhang E., Warren S.T., and Reines D., 1999. Acetylated histones are associated with FMR1 in normal but not fragile X-syndrome cells. Nat. Genet. 22: 98-101. Czermin B., Melfi R., McCabe D., Seitz V., Imhof A., and Pirrotta V., 2002. Drosophila enhancer of Zeste/ESC complexes have a histone H3 methyltransferase activity that marks chromosomal Polycomb sites. Cell 111: 185-196. Czermin B., Schotta C., Hulsmann B.B., Brehm A., Becker P.B., Reuter C., and Imhof A., 2001. Physical and functional association of SU(VAR)3-9 and HDAC1 in Drosophila. EMBO Rep. 2: 915-919. Dai J., Sultan S., Taylor S.S., and Higgins J.M., 2005. The kinase haspin is required for mitotic histone H3 Thr 3 phosphorylation and normal metaphase chromosome alignment. Genes Dev., 19: 472-488. Daujat S., Zeissler U., Waldmann T., Happel N., and Schneider R., 2005. HP1 binds specifically to Lys26-methylated histone HI.4, whereas simultaneous Ser27 phosphoiylation blocks HP1 binding. J. Biol. Chem. 280: 38090-38095. Daujat S., Bauer U.M., Shah V., Turner B., Berger S., and Kouzarides T., 2002. Crosstalk between CARM1 methylation and CBP acetylation on histone H3. Curr. Biol. 12: 2090-2097. De SouzaC.P., Osmani A.H., Wu L.P., Spotts J.L., and Osmani S.A., 2000. Mitotic histone H3 phosphorylation by the NIMA kinase in Aspergillus nidulans. Cell 102: 293-302. Dodge J.E., Kang Y.K., Beppu H.. Lei H., and Li E., 2004. Histone H3-K9 methyltransferase ESET is essential for early development. Mol. Cell. Biol. 24: 2478-2486. Downs J.A., Lowndes N.F., and Jackson S.P., 2000. A role for Sac-charomyces cerevisiae histone H2A in DNA repair. Nature 408: 1001-1004. Downs J.A., Allard S., Jobin-Robitaille O., Javaheri A., Auger A., Bouchard N., Kron S.J., Jackson S.P., and Cote J., 2004. Binding of chromatin-modifying activities to phosphorylated histone H2A at DNA damage sites. Mol. Cell 16: 979-990. Ebert A., Schotta G., Lein S., Kubicek S., Krauss V., Jenuwein T., and Reuter G., 2004. Su(var) genes regulate the balance between euchromatin and heterochromatin in Drosophila. Genes Dev. 18: 2973-2983. Emre N.C., Ingvarsdottir K., Wyce A., Wood A., Krogan N.J., Henry K.W., Li K., Marmorstein R., Greenblatt J.F., Shilatifard A., and Berger S.L., 2005. Maintenance of low histone ubiquitylation by UbplO correlates with telomere-proximal Sir2 association and gene silencing. Mol. Cell 17: 585-594. Fang J., Feng Q., Ketel C.S., Wang H., Cao R., Xia L., Erdjument-Bromage H., Tempst P., Simon J.A., and Zhang Y., 2002. Purification and functional characterization of SET8, a nucleosomal histone H4-lysine, 20-specific methyltransferase. Curr. Biol. 12: 1086-1099. Feng Q., Wang H., Ng H.H., Erdjument-Bromage H., Tempst P., Struhl K., and Zhang Y., 2002. Methylation of H3-lysine 79 is mediated by a new family of HMTases without a SET domain. Curr. Biol. 12: 1052-1058. Galasinski S.C., Louie D.E., Gloor K.K., Resing K.A., and Ahn N.G., 2002. Global regulation of post-translational modifications on core histones. J. Biol. Chem. 211: 2579-2588. Garcia B.A., Busby S.A., Barber C.M., Shabanowitz J., Allis C.D., and Hunt D.E., 2004. Characterization of phosphorylation sites on histone H1 isoforms by tandem mass spectrometry. J. Proteome Res. 3: 1219-1227. Goto H., Yasui Y., Nigg E.A., and lnagaki M., 2002. Aurora-B phosphorylates Histone H3 at serine28 with regard to the mitotic chromosome condensation. Genes Cells 1: 11-17. Goto H., Tomono Y., Ajiro K., Kosako H., Fujita M., Sakurai M., Okawa K., Iwamatsu A., Okigaki T., Takahashi T, and lnagaki M., 1999. Identification of a novel phosphorylation site on histone H3 coupled with mitotic chromosome condensation. J. Biol. Chem. 274: 25543-25549 Grant P.A., Eberharter A., John S., Cook R.G., Turner B.M., and Workman J.L., 1999. Expanded lysine acetylation specificity of Gcn5 in native complexes. J. Biol. Chem. 274: 5895-5900. Hake S.B. and Allis C.D., 2006. Histone H3 variants and their potential role in indexing mammalian genomes: The “H3 barcode hypothesis”. Proc. Natl. Acad. Sci. 103: 6428-6435. Hake S.B., Garcia B.A., Kauer M., Baker S.P., Shabanowitz J., Hunt D.F., and Allis C.D., 2005. Serine 31 phosphorylation of histone variant H3.3 is specific to regions bordering centromeres in metaphase chromosomes. Proc. Natl. Acad. Sci. 102: 6344-6349. Hamamoto R., Furukawa Y., Morita M., Iimura Y., Silva F.P., Li M., Yagyu R., and Nakamura Y., 2004. SMYD3 encodes a histone methyltransferase involved in the proliferation of cancer cells. Nat. Cell Biol. 6: 731-740. Harvey A.C., Jackson S.P., and Downs J.A., 2005. Saccharomyces cerevisiae histone H2A Seri22 facilitates DNA repair. Genetics 170: 543-553. Hayashi K., Yoshida K., and Matsui Y., 2005. A histone H3 methyltransferase controls epigenetic events required for meiotic prophase. Nature 438: 374-378. He Z., ChoY.Y., Ma W.Y., Choi H.S., Bode A.M., and DongZ., 2005. Regulation of ultraviolet B-induced phosphorylation of histone H3 at serine 10 by Fyn kinase. J. Biol. Chem. 280: 2446-2454. Hendzel M.J., Wei Y., Mancini M.A., Van Hooser A., Ranalli T., Brinkley B.R., Bazett-Jones D.P., and Allis C.D., 1997. Mitosis-specific phosphorylation of histone H3 initiates primarily within pericentromeric heterochromatin during G2 and spreads in an ordered fashion coincident with mitotic chromosome condensation. Chromosoma 106: 348-360. Hsu J.Y., Sun Z.W., Li X., Reuben M., Tatchell K., Bishop D.K., Grushcow J.M., Brame C.J., Caldwell J.A., Hunt D.E, et al., 2000. Mitotic phosphorylation of histone H3 is governed by Ipll/aurora kinase and Glc7/PPI phosphatase in budding yeast and nematodes. Cell 102: 279-291. Hyland E.M., Cosgrove M.S., Molina H., Wang D., Pandey A., Cot-tee R.J., and Boeke J.D., 2005. Insights into the role of histone H3 and histone H4 core modifiable residues in Saccharomyces cerevisiae. Mol. Cell. Biol. 25: 10060-10070. Ichijima Y., Sakasai R., Okita N., Asahina K., Mizutani S., and Te-raoka H., 2005. Phosphoiylation of histone H2AXat M phase in human cells without DNA damage response. Biochem. Biophys. Res. Commun. 336: 807-812. Jackson J.P., Lindroth A.M., Cao X., and Jacobsen S.E., 2002. Control of CpNpG DNA methylation by the KRYPTON ITE histone H3 methyltransferase. Nature 416: 556-560. Jackson J.P., Johnson L., JasencakovaZ., ZhangX., PerezBurgos L., Singh P.B., Cheng X., Schubert I., Jenuwein T., and Jacobsen S.E., 2004. Dimethylation of histone H3 lysine 9 is a critical mark for DNA methylation and gene silencing in Arabidopsis thaliana. Chromsoma 112: 308-315. Jeppesen P. and Turner B.M., 1993. The inactive X chromosome in female mammals is distinguished by a lack of histone H4 acetylation, a cytogenetic marker for gene expression Cell 74: 281-289. Jin Y., Wang Y., Walker D.L., Dong H., Conley C., Johansen J., and Johansen K.M., 1999. JIL-1: A novel chromosomal tandem kinase implicated in transcriptional regulation in Drosophila. Mol. Cell 4: 129-135. Kao C.F., Hillyer C., Tsukuda T., Henry K., Berger S., and Osley M. A., 2004. Rad6 plays a role in transcriptional activation through ubiquitylation of histone H2B. Genes Dev. 18: 184-195. Kapetanaki M.G., Guerrero-Santoro J., Bisi D.C., Hsieh C.L., Rapic-Otrin V., and Levine A.S., 2006. The DDB1-CUL4AD-DB2 ubiquitin ligase is deficient in xeroderma pigmentosum group E and targets histone H2A at UV-damaged DNA sites. Proc. Natl. Acad. Sci. 103: 2588-2593. Kawasaki H., Taira K., and Yokoyama K., 2000. Histone acetyltransferase (HAT) activity of ATF-2 is necessary for the CRE-dependent transcription. Nucleic Acids Symp. Ser., 2000: 259-260. Kawasaki H., Schiltz L., Chiu R., Itakura K., Taira K., Nakatani Y., and Yokoyama K.K., 2000. ATF-2 has intrinsic histone acetyltransferase activity which is modulated by phosphorylation. Nature 405: 195-200. Kim K.C., Geng L., and Huang S., 2003. Inactivation of a histone methyltransferase by mutations in human cancers. Cancer Res. 63: 7619-7623. Kimura A. and Horikoshi M., 1998. Tip60 acetylates six lysines of a specific class in core histones in vitro. Genes Cells 3: 789-800. KizerK.O., Phatnani H.P., ShibataY., Hall H., GreenleafAL., and Strahl B.D., 2005. A novel domain in Set2 mediates RNA polymerase II interaction and couples histone H3 K36 methylation with transcript elongation. Mol. Cell. Biol. 25: 3305-3316. Kleff S., Andrulis E.D., Anderson C.W., and Stemglanz R., 1995. Identification of a gene encoding a yeast histone H4 acetyltransferase. J. Biol. Chem. 270: 24674-24677. Kothapalli N., Sarath G., and Zempleni J., 2005a. Biotinylation of K12 in histone H4 decreases in response to DNA double-strand breaks in human JAr choriocarcinoma cells. J. Nutr. 135: 2337-2342. Kothapalli N., Camporeale G., Kueh A., Chew Y.C., Oommen A.M., Griffin J.B., and Zempleni J., 2005b. Biological functions of biotinylated histones. J. Nutr. Biochem. 16: 446-448. Kruhlak M.J., Hendzel M.J., Fischle W., Bertos N.R., Hameed S., Yang X.J., Verdin E., and Bazett-Jones D.P., 2001. Regulation of global acetylation in mitosis through loss of histone acetyl-transferases and deacetylases from chromatin. J. Biol Chem. 276: 38307-38319. Kuo M.H., Brownell I.E., Sobel R.E., RanalliT.A., Cook R.G., Edmondson D.G., Roth S.Y., and Allis C.D., 1996. Transcription-linked acetylation by Gcn5p of histones H3 and H4 at specific lysines Nature 383: 269-272. Kuzmichev A., Jenuwein T., Tempst P., and Reinberg D., 2004. Different EZH2-containing complexes target methylation of histone HI or nucleosomal histone H3. Mol. Cell 14: 183-193. Kuzmichev A., Nishioka K., Erdjument-Bromage H., Tempst P., and Reinberg D., 2002. Histone methyltransferase activity associated with a human multiprotein complex containing the Enhancer of Zeste protein. Genes Dev. 16: 2893-2905. Lachner M., O’Carroll D., Rea S., Mechtler K., and Jenuwein T., 2001 Methylation of histone H3 lysine 9 creates a binding site for HP1 proteins. Nature 410: 116-120. Lacoste N., Utley R.T., Hunter J.M., Poirier G.G., and Cote J., 2002. Disrupter of telomeric silencing-1 is a chromatin-specific histone H3 methyltransferase./. Biol. Chem. 277: 30421-30424. Lo W.S., Duggan L., Emre N.C, Belotserkovskya R., Lane W.S., Shiekhattar R., and Berger S.L., 2001. Snfl — A histone kinase that works in concert with the histone acetyltransferase Gcn5 to regulate transcription. Science 293: 1142-1146. Maile T., Kwoczynski S., Katzenberger R.J., Wassarman D.A., and Sauer F., 2004. TAF1 activates transcription by phosphorylation of serine 33 in histone H2B. Science 304: 1010-1014. McKittrick E., Gafken P.R., Ahmad K., and HenikoffS., 2004. Histone H3.3 is enriched in covalent modifications associated with active chromatin. Proc. Natl. Acad. Sci. 101: 1525-1530. Milne T.A., Briggs S.D., Brock H.W., Martin M.E., Gibbs D., Allis C.D., and Hess J.L., 2002. MLL targets SET domain methyltransferase activity to Hox gene promoters. Mol. Cell 10: 1107-1117 Miranda T.B., Sayegh J., Frankel A., Katz J.E., Miranda M., and Clarke S., 2006. Yeast Hsl7 (histone synthetic lethal 7) catalyses the in vitro formation of co-NG-monomethylarginine in calf thymus histone H2A. Biochem. J. 395: 563-570. Mizzen C.A., Yang X.J., Kokubo T., Brownell J.E., Bannister A.J., Owen-Hughes T.. Workman J.. Wang L., Berger S.L., Kouzarides T., et al., 1996. The TAFn250 subunit of TFIID has histone acetyltransferase activity. Cell 87: 1261-1270. Morris S.A., Shibata Y., Noma K., Tsukamoto Y., Warren E., Temple B., Grewal S.L, and Strahl B.D., 2005. Histone H3 K36 methylation is associated with transcription elongation in Schizosac-charomyces pombe. Eukaryot. Cell 4: 1446-1454. Mukheijee B., Kessinger C., Kobayashi J., Chen B.P., Chen D.J., Chatteijee A, and Burma S., 2006. DNA-PK phosphorylates histone H2AX during apoptotic DNA fragmentation in mammalian cells. DNA Repair 5: 575-590. Muller J., Hart CM., Francis N.J., Vargas M.L., Sengupta A., Wild B., Miller E.L., O’Connor M.B., Kingston R.E., and Simon J.A., 2002. Histone methyltransferase activity of a Drosophila Polycomb group repressor complex. Cell 111: 197-208. Nagy P.L., Griesenbeck J., Komberg R.D., and Cleary M.L., 2002. A trithorax-group complex purified from Saccharomyces cerevisiae is required for methylation of histone H3. Proc. Natl. Acad. Sci. 99: 90-94. Nakamura T., Mori T., Tada S., Krajewski W., Rozovskaia T., Wassell R., Dubois G., Mazo A., Croce C.M., and Canaani E., 2002. ALL-1 is a histone methyltransferase that assembles a supercomplex of proteins involved in transcriptional regulation. Mol. Cell 10: 1119-1128. Nakayama J., Rice J.C., Strahl B.D., Allis C.D., and Grewal S.L, 2001. Role of histone H3 lysine 9 methylation in epigenetic control of heterochromatin assembly. Science 292: 110—113. Nathan D., Ingvarsdottir K., Sterner D.E., Bylebyl G.R., Dok-manovic M., Dorsey J.A., Whelan K.A., Krsmanovic M., Lane W.S., Meluh P.B., et al., 2006. Histone sumoylation is a negative regulator in Saccharomyces cerevisiae and shows dynamic interplay with positive-acting histone modifications. Genes Dev., 20: 966-976. Ng H.H., Xu R.M., Zhang Y., and Struhl K., 2002. Ubiquitination of histone H2B by Rad6 is required for efficient Dot 1 -mediated methylation of histone H3 lysine 79. J. Biol. Chem. 277: 34655-34657. Nielsen S.J., Schneider R., Bauer U.M., Bannister A.J., Morrison A., O’Carroll D., Firestein R., Cleary M., Jenuwein T., Herrera R.E., and Kouzarides T., 2001. Rb targets histone H3 methylation and HP1 to promoters. Nature 412: 561-565. Nishioka K., Chuikov S., Sarma K., Erdjument-Bromage H., Allis C.D., Tempst P., and Reinberg D., 2002a. Set9, a novel histone H3 methyltransferase that facilitates transcription by precluding histone tail modifications required for heterochromatin formation. Genes Dev. 16: 479-489. Nishioka K., Rice J.C., Sarma K., Erdjument-Bromage H, Werner J., Wang Y., Chuikov S., Valenzuela P., Tempst P., Steward R., et al., 2002. PR-Set7 is a nucleosome-specific methyltransferase that modifies lysine, 20 of histone H4 and is associated with silent chromatin. Mol. Cell 9: 1201-1213. Nowak S.J. and Corces V.G., 2000. Phosphorylation of histone H3 correlates with transcriptionally active loci. Genes Dev. 14: 3003-3013. O’Carroll D., Scherthan H., Peters A.H., Opravil S., Haynes A. R., Laible G., Rea S., Schmid M., Lebersorger A., Jerratsch M., et al., 2000. Isolation and characterization of Suv39h2, a second histone H3 methyltransferase gene that displays testis-specific expression. Mol. Cell. Biol., 20: 9423-9433 Odegard V.H., Kim S.T., Anderson S.M., Shlomchik M.J., and Schatz D.G., 2005. Histone modifications associated with somatic hypermutation. Immunity 23: 101-110. Ogata N., Ueda K., Kagamiyama H., and Hayaishi O., 1980. ADP-ribosylation of histone H1. Identification of glutamic acid residues 2, 14, and the COOH-terminal lysine residue as modification sites. J. Biol. Chem. 255: 7616-7620. Ogawa H., Ishiguro K., Gaubatz S., Livingston D.M., andNakatani Y., 2002. A complex with chromatin modifiers that occupies E2F-and Myc-responsive genes in G0 cells. Science 296: 1132-1136. Ogawa Y., Ono T., Wakata Y.. Okawa K.. Tagami H.. and Shibahara K.I., 2005. Histone variant macroH2Al.2 is mono-ubiquitinated at its histone domain. Biochem. Biophys. Res. Commun. 336: 204-209. Pantazis P. and Bonner W.M., 1981. Quantitative determination of histone modification. H2A acetylation and phosphoiylation. J. Biol. Chem. 256: 4669-4675. Parthun M.R., Widom J., and Gottschling D.E., 1996. The major cytoplasmic histone acetyltransferase in yeast: Links to chromatin replication and histone metabolism. Cell 87: 85-94. Peters A.H., O’Carroll D., Scherthan H., Mechtler K., Sauer S., Schofer C, Weipoltshammer K., Pagani M., Lachner M., Kohlmaier A., et al., 2001. Loss of the Suv39h histone methyl-transferases impairs mammalian heterochromatin and genome stability. Cell 107: 323-337. Pham A.D. and Sauer F., 2000. Ubiquitin-activating/conjugating activity of TAFn250, a mediator of activation of gene expression in Drosophila. Science 289: 2357-2360. Polioudaki H., Markaki Y.. Kourmouli N., Dialynas G., Theodoro-poulos P.A., Singh P.B., and Georgatos S.D., 2004. Mitotic phosphorylation of histone H3 at threonine 3. FEES Lett. 560: 39-44. Preuss U., Landsberg G., and Scheidtmann K.H., 2003. Novel mitosis-specific phosphorylation of histone H3 atThrl 1 mediated by Dlk/ZIP kinase Nucleic Acids Res. 31: 878-885. Puerta C., Hernandez F., Lopez-Alarcon L., and Palacian E., 1995. Acetylation of histone H2A.H2B dimers facilitates transcription. Biochem. Biophys. Res. Cotnmun. 210: 409-416. Rea S., Eisenhaber F., O’Carroll D., Strahl B.D., Sun Z.W., Schmid M., Opravil S., Mechtler K., Ponting C.P., Allis C.D., and Jenuwein T., 2000. Regulation of chromatin structure by site-specific histone H3 methyltransferases. Nature 406: 593-599. Redon C., Pilch D.R., Rogakou E.P., Orr A.H., Lowndes N.F., and Bonner W.M., 2003. Yeast histone 2A serine 129 is essential for the efficient repair of checkpoint-blind DNA damage. EMBO Rep. A: 678-684. Rice J.C., Nishioka K., Sarma K., Steward R., Reinberg D., and Allis C.D., 2002. Mitotic-specific methylation of histone H4 Lys, 20 follows increased PR-Set7 expression and its localization to mitotic chromosomes. Genes Dev. 16: 2225-2230. Robzyk K., Recht ]., and Osley M.A., 2000. Rad6-dependent ubiquitina-tion of histone H2B in yeast. Science 287: 501-504. Rogakou E.P., Boon C., Redon C., and Bonner W.M., 1999. Megabase chromatin domains involved in DNA double-strand breaks in vivo. J. Cell Biol. 146: 905-916. Rogakou E.R, Pilch D.R., Orr A.H., Ivanova VS., and Bonner W.M., 1998. DNA double-stranded breaks induce histone H2AX phosphorylation on serine 139. J. Biol. Chem. 273: 5858-5868. Roguev A., Schaft D., Shevchenko A., Pijnappel W.W., Wilm M., Aasland R., and Stewart A.F., 2001. The Saccharomyces cerevisiae Setl complex includes an Ash2 homologue and methylates histone 3 lysine 4. EMBO J., 20: 7137-7148. Rouleau M., Aubin R.A., and Poirier G.G., 2004. Poly(ADP-ribosyl) ated chromatin domains: Access granted. J. Cell Sci. 117: 815-825. Ruiz-Carrillo A., Wangh L.J., and Allfrey V.G., 1975. Processing of newly synthesized histone molecules. Science, 190: 117-128. Sanchez-Eisner T., Gou D., Kremmer E., and Sauer F., 2006. Noncoding RNAs of trithorax response elements recruit Drosophila Ashl to Ultrabithorax. Science 311: 1118-1123. Santos-Rosa H., Schneider R., Bannister A. J., SherriffJ., Bernstein B.E., Emre N.C., Schreiber S.L., Mellor J., and Kouzarides T., 2002. Active genes are tri-methylated at K4 of histone H3. Nature 419: 407-411. Sarg B., Helliger W., Talasz H., Forg B., and Lindner H.H., 2006. Histone HI phosphorylation occurs site-specifically during interphase and mitosis: Identification of a novel phosphorylation site on histone HI. /. Biol. Chem. 281: 6573-6580 Sassone-Corsi P., Mizzen C.A., Cheung P., Crosio C, Monaco L., Jacquot S., Hanauer A., and Allis C.D., 1999. Requirement of Rsk-2 for epidermal growth factor-activated phosphorylation of histone H3. Science 285: 886-891. Schiltz R.L., Mizzen C.A., Vassilev A., Cook R.G., Allis C.D., and Nakatani Y., 1999. Overlapping but distinct patterns of histone acetylation by the human coactivators p300 and PCAF within nucleosomal substrates. J. Biol. Chem. 274: 1189-1192. Schotta G., Ebert A., Krauss V., Fischer A., Hoffmann J., Rea S., Jenuwein T., Dorn R., and Reuter G., 2002. Central role of Drosophila SU(VAR)3-9 in histone H3-K9 methylation and heterochromatic gene silencing. EMBO J. 21: 1121-1131. Schotta G., Lachner M., Sarma K., Ebert A., Sengupta R., Reuter G., Reinberg D.. and Jenuwein T., 2004. A silencing pathway to induce H3-K9 and H4-K20 trimethylation at constitutive heterochromatin. Genes Dev. 18: 1251-1262. Schubeler D., Francastel C., Cimbora D.M., Reik A., Martin D.I., and Groudine M., 2000. Nuclear localization and histone acetylation: A pathway for chromatin opening and transcriptional activation of the human p-globin locus. Genes Dev. 14: 940-950. Schultz D.C., Ayyanathan K., Negorev D., Maul G.G., and Rauscher F.J., III., 2002. SETDB1: A novel KAP-1-associated histone H3, lysine 9-specific methyltransferase that contributes to HP1-mediated silencing of euchromatic genes by KRAB zinc-finger proteins. Genes Dev. 16: 919-932. Schurter B.T., Koh S.S., Chen D., Bunick G.J., Harp J.M., Hanson B.L., Henschen-Edman A., Mackay D.R., Stallcup M.R., and Aswad D.W., 2001. Methylation of histone H3 by coactivator-associated arginine methyltransferase 1. Biochemistry 40: 5747-5756. Shiio Y. and Eisenman R.N., 2003. Histone sumoylation is associated with transcriptional repression. Proc. Natl. Acad. Sci. 100: 13225-13230. Smith E.R., Eisen A., GuW, Sattah M., Pannuti A., Zhou J., Cook R.G., Lucchesi J.C., and Allis C.D., 1998. ESA1 is a histone acetyltransferase that is essential for growth in yeast. Proc. Natl. Acad. Sci. 95: 3561-3565. Sobel R.E., Cook R.G., Perry C.A., Annunziato A.T., and Allis C.D., 1995. Conservation of deposition-related acetylation sites in newly synthesized histones H3 and H4. Proc. Natl. Acad. Sci. 92: 1237-1241. Song O.K., Wang X., Waterborg J.H., and Stemglanz R., 2003. An Na-acetyltransferase responsible for acetylation of the N-terminal residues of histones H4 and H2A. J. Biol. Chem. 278: 38109-38112. Spencer T.E., Jenster G., Burcin M.M., Allis C.D., Zhou J., Mizzen C.A., McKenna N.J., Onate S.A., Tsai S.Y., Tsai M.J., and O’Malley B.W., 1997. Steroid receptor coactivator-1 is a histone acetyltransferase. Nature 389: 194-198. Stanley J.S., Griffin J.B., and Zempleni J., 2001. Biotinylation of histones in human cells. Effects of cell proliferation. Eur. J. Biochem. 268: 5424-5429. Stiff T., O’Driscoll M., Rief N., Iwabuchi K., Lobrich M., and Jeggo P.A., 2004. ATM and DNA-PK function redundantly to phosphorylate H2AX after exposure to ionizing radiation. Cancer Res. 64: 2390-2396. Strahl B.D., Ohba R., Cook R.G., and Allis C.D., 1999. Methylation of histone H3 at lysine 4 is highly conserved and correlates with transcriptionally active nuclei in Tetrahymena. Proc. Natl. Acad. Sci. 96: 14967-14972. Strahl B.D., Briggs S.D., Brame C.J., Caldwell J.A., Koh S.S., Ma H., Cook R.G., Shabanowitz J., Hunt D.E, Stallcup M.R., and Allis C.D., 2001.Methylation ofhistone H4 at arginine 3 occurs in vivo and is mediated by the nuclear receptor coactivator PRMT1. Curr. Biol. 11: 996-1000. Strahl B.D.. Grant P.A., Briggs S.D., Sun Z.W., Bone J.R., Caldwell J.A., Mollah S., Cook R.G., Shabanowitz J., Hunt D.E, and Allis C.D. 2002. Set2 is a nucleosomal histone H3-selective methyltransferase that mediates transcriptional repression. Mol. Cell. Biol. 22: 1298-1306. Su I.H., Basavaraj A., KrutchinskyA.N., HobertO., Ullrich A., Chait B.T., and Tarakhovsky A., 2003. Ezh2 controls B cell development through histone H3 methylation and Igh rearrangement. Nat. Immunol. 4: 124-131. SukaN., SukaY., CarmenAA, Wu J., andGrunstein M., 2001. Highly specific antibodies determine histone acetylation site usage in yeast heterochromatin and euchromatin. Mol. Cell 8: 473-479. SunX.J., Wei J., WuX.Y., Hu M., Wang L., Wang H.H., Zhang Q.H., Chen S.J., Huang Q.H., and Chen Z., 2005. Identification and characterization of a novel human histone H3 lysine 36-specific methyltransferase. J. Biol. Chem. 280: 35261-35271. Sun Z.W. and Allis C.D., 2002. Ubiquitination ofhistone H2B regulates H3 methylation and gene silencing in yeast. Nature 418: 104-108. Sung Y.J. and Ambron R.T., 2004. PolyADP-ribose polymerase-1 (PARP-1) and the evolution of learning and memory. Bioessays 26: 1268-1271. Swerdlow P.S., Schuster T., and Finley D., 1990. A conserved sequence in histone H2A which is a ubiquitination site in higher eucaryotes is not required for growth in Saccharomyces cerevisiae. Mol. Cell. Biol. 10: 4905-4911 Tachibana M., Sugimoto K., Fukushima T., and Shinkai Y., 2001. Set domain-containing protein, G9a, is a novel lysine-preferring mammalian histone methyltransferase with hyperactivity and specific selectivity to lysines 9 and 27 ofhistone H3. /. Biol. Chem. 216: 25309-25317. Tachibana M., Ueda J., Fukuda M., TakedaN., Ohta T., Iwanari H., Sakihama T., Kodama T., Hamakubo T., and Shinkai Y., 2005. Histone methyltransferases G9a and GLP form heteromeric complexes and are both crucial for methylation of euchromatin at H3-K9. Genes Dev., 19: 815-826. Tachibana M., Sugimoto K., Nozaki M.. Ueda J., Ohta T.. Ohki M., Fukuda M., Takeda N., Niida H., Kato H., and Shinkai Y., 2002. G9a histone methyltransferase plays a dominant role in euchromatic histone H3 lysine 9 methylation and is essential for early embryo-genesis. Genes Dev. 16: 1779-1791. Takechi S. and Nakayama T., 1999. Sas3 is a histone acetyltransferase and requires a zinc finger motif. Biochem. Biophys. Res. Commun. 266: 405-410. Tamaru H. and Selker E.U., 2001. A histone H3 methyltransferase controls DNA methylation in Neurospora crassa. Nature 414: 277-283. Taplick J., Kurtev V., Lagger G., and Seiser C., 1998. Histone H4 acetylation during interleukin-2 stimulation of mouse T cells. FEBS Lett. 436: 349-352. Thomson S., Clayton A.L., Hazzalin C.A., Rose S., Barratt M.J., and Mahadevan L.C., 1999. The nucleosomal response associated with immediate-early gene induction is mediated via alternative MAP kinase cascades: MSK1 as a potential histone H3/HMG-14 kinase. EMBO J. 18: 4779-4793. Turner B.M., 2000. Histone acetylation and an epigenetic code. Bioessays 22: 836-845. Turner B.M.2005. Reading signals on the nucleosome with a new nomenclature for modified histones. Nat. Struct. Mol. Biol. 12: 110-112. Turner B.M. and Fellows G., 1989. Specific antibodies reveal ordered and cell-cycle-related use of histone-H4 acetylation sites in mammalian cells. Eur. J. Biochem. 179: 131-139. van Attikum H. and Gasser S.M., 2005. The histone code at DNA breaks: A guide to repair? Nat. Rev. Mol. Cell Biol. 6: 757-765. van Leeuwen F, Gafken P.R., and Gottschling D.E., 2002. Dotlp modulates silencing in yeast by methylation of the nucleosome core. Cell 109: 745-756. Vandel L., Nicolas E., Vaute O., Ferreira R., Ait-Si-Ali S., and Trouche D., 2001. Transcriptional repression by the retinoblastoma protein through the recruitment of a histone methyltransferase. Mol. Cell. Biol. 21: 6484-6494. Vaquero A., Scher M., Lee D., Erdjument-Bromage H., Tempst P., and Reinberg D., 2004. Human SirTl interacts with histone HI and promotes formation of facultative heterochromatin. Mol. Cell 16: 93-105. Verreault A., Kaufman P.D., Kobayashi R., and Stillman B., 1998. Nucleosomal DNA regulates the core-histone-binding subunit of the human Hatl acetyltransferase. Curr. Biol. 8: 96-108. Visochek L., Steingart R.A., Vulih-Shultzman I., Klein R., Priel E., Gozes I., and Cohen-Armon M., 2005. PolyADP-ribosylation is involved in neurotrophic activity. J. Neurosci. 25:7420-7428. Wang H., Cao R., Xia L., Erdjument-Bromage H., Borchers C., Tempst P., and Zhang Y., 2001a. Purification and functional characterization of a histone H3-lysine 4-specific methyltransferase. Mol. Cell 8: 1207-1217. Wang H., Wang L., Erdjument-Bromage H., Vidal M., Tempst P., Jones R.S., and Zhang Y., 2004. Role ofhistone H2A ubiquitination in Polycomb silencing. Nature 431: 873-878. Wang H., An W., Cao R., Xia L., Erdjument-Bromage H., Chatton B., Tempst P., Roeder R.G., and Zhang Y., 2003. mAM facilitates conversion by ESET of dimethyl to trimethyl lysine 9 ofhistone H3 to cause transcriptional repression. Mol. Cell 12: 475-487. Wang H., Huang Z.Q., Xia L., Feng Q., Erdjument-Bromage H., Strahl B.D., Briggs S.D., Allis C.D., Wong J., Tempst P., and Zhang Y., 2001b. Methylation ofhistone H4 at arginine 3 facilitating transcriptional activation by nuclear hormone receptor Science 293: 853-857. Wang Y., Zhang W., Jin Y, Johansen J., and Johansen K.M., 2001. The JIL-1 tandem kinase mediates histone H3 phosphorylation and is required for maintenance of chromatin structure in Drosophila. Cell 105: 433-443. Wei Y., Yu L., Bowen J., Gorovsky M.A., and Allis C.D., 1999. Phosphorylation of histone H3 is required for proper chromosome condensation and segregation. Cell 97: 99-109. Wilson J.R., Jing C, Walker P.A., Martin S.R., Howell S.A., Blackburn G.M., Gamblin S.J., and Xiao B., 2002. Crystal structure and functional analysis of the histone methyltransferase SET7/9. Cell 111: 105-115. Wyatt H.R., Liaw H., Green G.R., and Lustig A.J.. 2003. Multiple roles for Saccharomyces cerevisiae histone H2A in telomere position effect, Spt phenotypes and double-strand-break repair. Genetics 164: 47-64. Xin Z., Tachibana M., Guggian M., Heard E., Shinkai Y, and Wag-staff J., 2003. Role ofhistone methyltransferase G9a in CpG methylation of the Prader-Willi syndrome imprinting center. J. Biol. Chem. 278: 14996-15000. Yamamoto T. and Horikoshi M., 1997. Novel substrate specificity of the histone acetyltransferase activity of HIV-1-Tat interactive protein Tip60. J. Biol. Chem. 272: 30595-30598. Yamamoto Y., Verma U.N., Prajapati S., Kwak Y.T., and Gaynor R.B., 2003. Histone H3 phosphorylation by IKK-alpha is critical for cytokine-induced gene expression. Nature 423: 655-659. Yang L., Xia L., Wu D.Y., Wang H., Chansky H.A., Schubach W.H., Hickstein D.D., and Zhang Y., 2002. Molecular cloning of ESET, a novel histone H3-specific methyltransferase that interacts with ERG transcription factor. Oncogene 21. 148-152. Zegerman P., Canas B., Pappin D., and KouzaridesT., 2002. Histone H3 lysine 4 methylation disrupts binding of nucleosome remodeling and deacetylase (NuRD) repressor complex. J. Biol. Chem. 217: 11621-11624. Zeitlin S.G., Barber C.M., Allis C.D., and Sullivan K.E, 2001. Differential regulation of CENP-A and histone H3 phosphorylation in G2/M./. Cell Sci. 114: 653-661. Zhang L., Eugeni E.E., Parthun M.R., and Freitas M.A., 2003. Identification of novel histone post-translational modifications by peptide mass fingerprinting. Chromosoma 112: 77-86. Zhong S., Jansen C, She Q.B., Goto H., lnagaki M., Bode A.M., Ma W.Y., and Dong Z., 2001. Ultraviolet B-induced phosphorylation ofhistone H3 at serine 28 is mediated by MSK1. J. Biol. Chem. 276: 33213-33219.Обзоры
Bannister A. J. and Kouzarides T., 2005. Reversing histone methylation. Nature 436: 1103-1106. Berger S.L., 2002. Histone modifications in transcriptional regulation. Curr. Opin. Genet. Dev. 12: 42-148. Davie J.R. and Spencer V.A., 2001. Signal transduction pathways and the modification of chromatin structure. Prog. Nucleic Acid Res. Mol. Biol. 65: 299-340. Cosgrove M.S., Boeke J.D., and Wolberger C., 2004. Regulated nucleosome mobility and the histone code. Nat. Struct. Mol. Biol. 11: 1037-1043. Dobosy J.R. and Selker E.U., 2001. Emerging connections between DNA methylation and histone acetylation. Cell. Mol. Life Sci. 58: 721-727. Dunleavy E., Pidoux A., and Allshire R., 2005. Centromeric chromatin makes its mark. Trends Biochem. Sci. 30: 172-175. Elgin S.C and Grewal S.L, 2003. Heterochromatin: Silence is golden. Curr. Biol. 13: R895-R898. Emre N.C. and Berger S.L., 2004. Histone H2B ubiquitylation and deubiquitylation in genomic regulation. Cold Spring Harbor Symp. Quant. Biol. 69: 289-299. Esteller M., 2006. Epigenetics provides a new generation of oncogenes and tumour-suppressor genes. Br. J. Cancer 94: 179-183. Feinberg A. P. and Tycko B., 2004. The history of cancer epigenetics. Nat. Rev. Cancer 4: 143-153. Fischer A., Hofmann I., Naumann K., and Reuter G., 2006. Heterochromatin proteins and the control of heterochromatic gene silencing in Arabidopsis. J. Plant Physiol. 163: 358-368. Fischle W., Wang Y., and Allis C.D., 2003. Binary switches and modification cassettes in histone biology and beyond. Nature 425: 475-479. Fischle W., Wang Y., and Allis C.D., 2003. Histone and chromatin cross-talk. Curr. Opin. Cell. Biol. 15: 172-183. Grewal S.L and Elgin S.C., 2002. Heterochromatin: New possibilities for the inheritance of structure. Curr. Opin. Genet. Dev. 12: 178-187. Grunstein M., 1997. Histone acetylation in chromatin structure and transcription. Nature 389: 349-352. Grunstein M., 1997. Molecular model for telomeric heterochromatin in yeast. Curr. Opin. Cell Biol. 9: 383-387. Grunstein M., 1998. Yeast heterochromatin: Regulation of its assembly and inheritance by histones. Cell 93: 325-328. Henikoff S. and Ahmad K., 2005. Assembly of variant histones into chromatin. Annu. Rev. Cell Dev. Biol. 21: 133-153. Hild M. and Paro R., 2003. Anti-silencing from the core: A histone H2A variant protects euchromatin. Nat. Cell Biol. 5: 278-280. Jenuwein T and Allis C.D., 2001. Translating the histone code. Science 293: 1074-1080. Kimmins S. and Sassone-Corsi P., 2005. Chromatin remodelling and epigenetic features of germ cells. Nature 434: 583-589. Kurdistani S.K. and Grunstein M., 2003. Histone acetylation and deacetylation in yeast. Nat. Rev. Mol. Cell Biol. 4: 276-284. Lachner M., O’Sullivan R.J., and Jenuwein T., 2003. An epigenetic road map for histone lysine methylation. J. Cell Sci. 116: 2117-2124. Luger K. and Richmond T.J., 1998. The histone tails of the nucleosome. Curr. Opin. Genet. Dev. 8: 140-146. Mellone B.G. and Allshire R.C., 2003. Stretching it: Putting the CEN (P-A) in centromere. Curr. Opin. Genet. Dev. 13: 191-198. Millar C.B., Kurdistani, S.K. and Grunstein M., 2004. Acetylation of yeast histone H4 lysine 16: A switch for protein interactions in heterochromatin and euchromatin. Cold Spring Harbor Symp. Quant. Biol. 69: 193-200. Nightingale K.P., O’Neill L.P., and Turner B.M., 2006. Histone modifications: Signalling receptors and potential elements of a heritable epigenetic code. Curr. Opin. Genet. Dev. 16: 125-136. Peterson CL. and Laniel M.A., 2004. Histones and histone modifications. Curr. Biol. 14: R546-551. Reinberg D., Chuikov S., Famham P., Karachentsev D., Kirmizis A., Kuzmichev A., Margueron R. Nishioka K., PreissnerT.S., Sarma K., et al., 2004. Steps toward understanding the inheritance of repressive methyl-lysine marks in histones. Cold Spring Harbor Symp. Quant. Biol. 69: 171-182. Sarma K. and Reinberg D., 2005. Histone variants meet their match. Nat Rev. Mol. Cell Biol. 6: 139-149. Spencer V.A. and Davie J.R., 2000. Signal transduction pathways and chromatin structure in cancer cells. J. Cell. Biochem. Suppl. 35: 27-35. Stemglanz R., 1996. Histone acetylation: Agateway to transcriptional activation. Trends Biochem. Sci. 21: 357-358. Turner B.M., 2000. Histone acetylation and an epigenetic code. Bioessays 22: 836-845. van Attikum H. and Gasser S.M., 2005. The histone code at DNA breaks: A guide to repair? Nat. Rev. Mol. Cell Biol. 6: 757-765. Vaughn M.W., Tanurdzic M., and Martienssen R., 2005. Replication, repair, and reactivation. Dev. Cell 9: 724-725. Wade P.A. and Wolffe A.P., 1997. Histone acetyltransferases in control. Curr. Biol. 1: R82-R84. Wade P.A., Pruss D., and Wolffe A.P., 1997. Histone acetylation: Chromatin in action. Trends Biochem. Sci. 22: 128-132. Zilberman D. and Henikoff S., 2005. Epigenetic inheritance in Arabidopsis: Selective silence. Curr. Opin. Genet. Dev. 15: 557-562.Алфавитный указатель
4-Фенилбутират (РВА), 460 5-Аза-2’-дезоксицитидин, 459-460 5-Азацитидин, 459-460 Abfl, 76, 81 Absent Small или Homeiotic (ASH) — семейство, 179, 223, 232, 235-236, 240-242 ACF, компенсация дозы и, 309 Ade2 как репортерный ген у дрожжей, 72-73 Adeb, 109-110 Air ген, 358, 360-361,363 Alcohol dehydrogenase (Adh) трансгены, 99 am гены, RIP и 120 ANT. См. Измененная Ядерная Пересадка (ANT); комплекс Аntennapedia (ANT-С) Antennapedia (ANT-С) комплекс, 231 Arabidopsis — Arabidopsis RNAiy, 156-157, 162-165 — веб-сайты с информацией о, 466 — как модельный организм, 35-37 — клеточная пролиферация и, 224 — компоненты эпигенетической регуляции у, 171-177 — организация генома, 54 — формирование гетерохроматина, 101-102 Argonaute белки, 121, 145, 149, 154-156, 162-164, 282, 295, 377 Argonaute-подобные белки, 121, 123, 145, 149,155-156, 163-164, 282,295 Arp. См. Белок 4, родственный актину ASH семейство. См. Absent Small или Homeotic Asm-1, 122-123,282 ATRX ген, 434 Aubergine, 100 BCR, 393, 397 Bithorax комплекс (BX-C), 231 Blimp1, 372-374, 398-400 Bmi1, 223-225 Brahma, 49, 233, 243 BRG1, 235-236 BRM. См. Brahma Brown доминантный (bwD), 98 В-клетки, 388-392, 398-401 c-Kit рецептор (CD117) 390 C. elegans — MES-модификаторы гистонов у, 296-298 — MSUD у, 296 — PcG-гены у, 215 — PRC2 и, 214-215 — RNAi и, 164 — X -хромосомная регуляция у 292, 294-298 — анатомия, 289 — веб-сайты с информацией о, 467 — гетерохроматиновые метки на единственной Х-хромосоме, 294-295 — детерминация пола у, 287-288 з — ародышевых клеток спецификация у, 294, 373-374 — импринтинг Х-хромосомы сперматозоида у, 298-299 — компенсации дозы комплекс у, 288, 290-293 — неклеточно-автономный сайленсинг и транзитивность, у 184 — оценка отношения Х:А у, 290-291 — половых хромосом дисбаланс у, 288 — сайленсинг у, 283 — центромеры структура и функция у, 271 CAF. См. Фактора Сборки Хроматина комплекс CARM 1, 201 Cd79a, клетки 391 CDKN1C, Беквита-Видеманна синдром и, 428, 430-431 Cdx2, 379 CenH-район. См. CENP-A CENP-A — RNAi и, 157 — общий обзор, 247-248 — поддержание, 114 — сайленсинг и, 115 — центромерный хроматин, 252-253, 272-275 — цетромеры дробянковых дрожжей и, 113-116 — эволюция центромеры и, 276-277 CHD белки, 197, 239 Chfr, 454 Chp1,109-110, 112, 114, 156,158-161 Chp2, 109-110 CHRAC, 309 Chromoshadow-домены, 93, 199, 305 Cidl2, 112, 114, 159-160 cis-модификаций паттерны — H2AZ и, 258 — MSL комплекс и, 308 — болезни и, 426, 435-437 — геномный импринтинг и, 353-355, 363-364 — посттрансляционная модификация гистонов и, 204 CKcnplot1, 360 CLF. См. Курчавый лист Clr4 — siRNA продукция и, 113 — гетерохроматина формирование, 110-114, 156-162 — рекрутирование энзимов, модифицирующих хроматин, 161-162 CMT3, 178 CpG динуклеотиды — CpG-островки, раковые заболевания, 448-449, 451-452, 456-457 — МеСР2 и, 342-343, 432-433 — веб-сайты с информацией о, 465 — геномный импринтинг и, 362 — гиперметилирование, 449 — метилирование ДНК и, 51, 326, 334-338, 361,425 — модификации гистонов и, 455 — раковые заболевания и, 447 — у растений, 169 CPSF-A. См. Фактор-А специфичности расщепления-полиаденилирования CREBBP, 432 CTCF, 340-341, 362-363 Cul4, 160 D. Melanogaster, спецификация зародышевых клеток у 373-374 D1, 101 d48, клеточная линия, 141-142, 147 DDM1. См. Сниженное метилирование ДНК 1 DDP1, 101 Demeter (DME), 174, 178, 181, 188, 378 Dicer — MSUD и, 123 — RNAi-опосредованный сайленсинг у растений и, 182-187 — scnRNA модель и, 147 — siRNAsH, 112, 158-161 — модификации гетерохроматина и, 161-162 — подавление и, 121 — сперматогенез и, 377 Dicer-подобные (DCL) белки, 182-183 DIM-2, 120-123 DIM-5, 121-122 Dlk1 кластер, 357-359 DMRs, 357-359 Dnmts. См. Метилтрансферазы ДНК (DNMTs) Docking-домены, 258 DOT1, 198,267, 297 DPY белки 290 dRingl (dRingl/SCE) белки, 219-220 DRM. См. Метилтрансферазы с перестроенными доменами Drosha, 185 Drosophila — kismet (kis) и, 239-240 — MSUD отсутствие у, 283 — PcG гены у, 55, 216, 218, 220 — polyhomeotic (ph) дупликация у, 220 — PRC1 «нацеливание» у, 220-222 — RNAi и, 164 — веб-сайты с информацией о, 467 — гетерохроматину, 93, 100-101, 278-279 — дисфункция половой хромосомы у, 283 — как модельный организм, 36-37 — кариотип, 303 клеточная память и, 211 — компенсация дозы у, 288, 302-311 — метилирование и, 51 — модификации гистонов, сайленсинг и, 95-96 — мозаичные фенотипы у, 88-90 — «нацеливание» формирования гетерохроматина, 97-100 — неоцентромеры у, 272 — организация генома, 55 — процесс сегрегации у, 279 — сайленсинг и, 95-96, 101-102 — утрата отцовской хромосомы у, 281 — фактор нарушения сегрегации, 280-281 — хромосомные белки и модификаторы у, 90-93, 96-97, 268 — центромерный хроматин и, 274 dsRNA. См. Двухнитевая РНК dsx гены, 306-307 DTip60, 259 E(var) (Enhancer of variegation), 90-92 E(Z) семейство. См. Энхансера zeste (E(Z)) семейство E(Z)-ESC комплекс, 296-297. См. также PRC2 Е2А, 391-392 ЕЗ убиквитинлигаза, 429, 454 EBF1, 390-392 EMF. См. Эмбриональный Цветок (EMF) ENCODE, 465 Enx1, 223, 325 ERC, 84 ESC. См. Сверхчисленные половые гребешки (ESC) Eversporting displacements (Хромосомные перестройки, обусловливающие мозаичное проявление признака), 14, 27. См. также Мозаицизм, обусловленный эффектом положения EZH2, 200, 224, 325, 388, 394 Ezh2/Enxl. 325 FACT. См. Облегчение транскрипции хроматина Female-sterile homeotic (fsh) ген, 232 Flamenco, 164 Flt3, 390 FMRP белок, 436-437 FOX-1, 290 FR901, 228 460 Fragilis, 373 FWA., 164 G9a, 400 GAGA фактор, 243 GASC1. См. jumonji-деметилаза гистонов (JHDM1) Gnas семейство, 357-359, 428, 431 GNAT семейство, 194 Groucho семейство, 399-400 Gtl2,360 HI, 260, 472 H19 ген, 352-353, 360, 362-363, 428, 430-431 H2A — дефектный по тельцу Бара (H2ABbd), 248, 259 — определение, 248 — откладка и замещение, 258-259 Н2АХ, 255-257, 267, 472 H2AZ 248, 257-259 — локализация, 250 — макро, 259, 323 — формирование вариантов, 248 Н2В 258-259, 469 H3, 196, 247-248, 251-254, 273-275, 469-471 H3.3, 248, 254-255, 275 H3.Зрепрограммирование сперматозоидов, 378 H3K27, метилирование — MES белки и, 296-298 — PRC «нацеливание» и, 221 — V(D)J рекомбинация и, 394 — Х-инактивация и, 325-327 — гетерохроматиновый сайленсинг и, 95-96 — общий обзор, 200 — развитие примордиальных зародышевых клеток и, 375 H3K36, 197-198, 297 H3K4, 196-197, 325-326 H3K79, 198, 267 H3K9 siRNAs и, 154 su(var) и, 95-96 — в единственных Х-хромосомах самцов C. elegans, 294-295 — метилирование ДНК и, 339-340 — «нацеливание» на гетерохроматин и, 87 — общий обзор, 198-200 — развитие примордиальных зародышевых клеток и, 375 — распределение репрессированной ДНК, 138 — сайленсинг и, 95-96. 101-102, 109-111, 145-146 — сперматогенез и, 376 — у растений, 179 — центромерный хроматин и, 274 Н4 — KYP/SUVH4, 180 — MSL комплекс и, 304 — SIR комплексы и, 79-80 — общий обзор, 200 — таблица, включая ссылки, 471 — формирование вариантов и, 248 Нах гены развитие примордиальных зародышевых клеток и, 373 HBRM, 237 HDAC. См. Деацетилазы гистонов (HDACs) HDOT1L, 198 her-1 ген, 291-293 HIC-1, 455 HIRA. См.Регулятор гистонов А HKMTs. См. Метилтрансферазы лизинов гистонов (HKMTs) HML, 74-75 HMR, 74-75 НО эндонуклеаза, 74-77 НОАР (HP1/ORC ассоциированный белок). 269 Homeless, 99-100 HOTHEAD ген, 21 Нох гены — PcG белки и 212-213 — PcG сайленсинг и 219 — PREs и 220 — Sex combs reduced (Scr) и 234 — клеточная память и 211, 231 — регуляция у Drosophila 231-233 НР1. См. Белок гетерохроматина 1 HpaII крошечные фрагменты, 336-337, 340 НРone, 121 Hrr1, 112, 114, 159-160 hSET, 241 HU белки, 248 IAP ретротранспозон, 375, 377 ICE, 358-359, 361-363 ICF синдром. См. Иммунодефицитная Центромерная Нестабильность IFNB1, 399 IGF2 — Беквита-Видеманна синдром и, 428, 430-431 — геномный импринтинг и, 352-353, 357-359, 362-363 — рак толстой кишки и, 453 IgH, 393 Ikaros-ассоциация, 398 IL-7, рецептор 390 In(l)wm4, 91. См. также white ген INI1, раковые заболевания и, 235 INO80-C, 259 ISWI комплексы, 239, 309-310, 415. См. также Brahma семейство; SNF2H семейство JIL1 киназа, 97-98, 102, 305 Jumonji-деметилаза гистонов (JHDM1), 47, 200 К79 метилирование, общий обзор, 198 KCNQ, 357-359, 430 killer штаммы, 133 Kismet (kis), 234-235, 239-240 KTO белок, 242 KYP/SUVH4, 180 Light, 98 Like heterochromatin protein (LHP1), 182 Linaria vulgaris, 170 LSD1 аминоксидаза, 97 LSD1. См. Лизин-специфичная деметилаза LSH2, 340 mb-1 ген, 392 MBD белки. См. Метил-CpG-связывающиеся белки МеСР2, 342-343, 432-434 Medea (МЕА), 178, 180-181, 215, 217, 223-224 Medea/Fertilization independent seed formation (MEA/FIS1), 180 MEIDOS, 216 Meisetz, 376 MES белки, 215, 296-298 MIP. См. miRNAs, премейотически индуцированные метилированием Miwi-подобные белки, 377 MIX-1 белки, 290 MLE, 304-306, 308 MLH1 ген, 437, 450, 453-454 MLL, 233, 235, 241 MNa3a. См. Микрококковая нуклеаза MOF, 304-306, 308 Morpheus-молекула (MOM), 181, 187 MS-275, 460 MSCI, 318 MSP, 459 MSUD. См. Мейотический сайленсинг неспаренной ДНК mtF гены, 143-144 MYST семейство, 194 n-1 правило, 316, 319-320 Nanog, 375, 379-380 Nasonia vitripennis, 281 ncRNA-опосредованного сайленсинга модель, 362-364 Ndj1, 269 Necdin, 429 NESP55, 431 Neurospora crassa — MSUD y, 117, 122-124, 282-283 — RIP и, 119 120, 123-124 — жизненный цикл, 116-117 — изображения, 118, 124 — как инструмент, 107 — как модельный организм, 36-37 — метилирование у, 117-119 — общий обзор, 116-117 — подавление у, 121-122 — сайленсинг у, 282-283 NONCODE веб-сайт, 360, 466 NotchL 391 Nowal, 146 NT-ES, 418-421 NuA4/Tip60, 259 NuRD, 343 NURF, 309, 429 NVP-LAQ824, 460 Oct4, 379-380, 416 Oenothera blandina, 101 OSA, 239 P53BP1, 198 p55, 214 PADI4, 202, 378 PAF комплекс, 198 PAI2, 162 Paramecia, 36, 130-132. См. также Инфузории Parp, 380 Pasha, 185 Pax5, 390-392, 396, 400-401 PcG белки. См. Polycomb белки PGC-клетки, развитие примордиальных зародышевых клеток и, 372-375 Ph 1 локус, 280 PHERES 1, 216 Pickle (PKL), 181 Piwi, 100, 154-156, 160, 164 PML-лейкемия, 56 Pol IV. См. РНК-полимераза IV Polar granule component (pgc) ген, 374 Polycomb (PcG) белки — CpG метилирования и, 339-340 — HP1 и, 98 — Х-инактивация и 58, 325-326 — генетическая идентификация, 212-214 — геномный импринтинг и, 362 — клеточная память и, 56, 212, 230 — метилтрансферазы гистонов растений и, 180 — метки сайленсинга хроматина и, 214-219 — модификация хроматина у животных и, 164-165 — общий обзор, 54, 219 — поддержание транскрипционного сайленсинга и, 219-223 — развитие млекопитающих и, 223-226 — функция, 55-57 хроматин растений и, 180-181 — эпигенетическая регуляция у Arabidopsis и, 176 Polycomb репрессивные комплексы (PRCs) — H3K27 метилирование и, 200 — Х-инактивация и, 57, 223 — клеточная память и, 211 — компоненты, 219-220 — компоненты и эволюционный консерватизм, 214-216 — модификация хроматина, 218 — «нацеливание» на сайленсированные гены, 220-222 — предотвращение наследуемой репрессии, 222-223 — репрессивные функции и, 222 — транскрипционная репрессия и, 231 — у растений, 180 — функция в развитии, 218-219 Polycomb элементы ответа — GAGA фактор и, 243 — H3K27 метилирование и, 200 — антисайленсинг и, 223 — клеточная память и, 211 Polycomb-подобный (PCL) белок 215 — PRC1 «нацеливание» и, 220-222 — транскрипционная репрессия и, 232 PRC2. См. Пререпликационный комплекс 2 Prdm1, 398-399 Priming, линия, 391 PRMTs. См. Метилтрансферазы аргининов белков PSR хромосома, 281-282 PTGS. См. Посттранскрипционный сайленсинг генов Pws кластер, 357-359 RAG, 393, 420-421 RanGAP ген, 281 Rapl. См. Репрессор-активаторный белок I (Rapl) RC гистоны, 250-251 RdDM. См. РНК-направляемое метилирование ДНК rDNA, 84, 266, 278-279 rDNA кольца, 84 RDRP. См. РНК-зависимая РНК-полимераза Replication processivity clamp (PCNA), 250 Rid ген, 120 Rikl, 160 Ring-белки, 213. 219-220, 242. 325 RIR См. Индуцируемая повторами точечная мутация RISC. См. РНК-индуцируемый сайленсирующий комплекс RITS. См. РНК-индуцируемый эффектор транскрипционного сайленсинга RITS и сборка гетерохроматина и, 158-160 — сайленсинг и, 46 — сайленсинг у S. pombe и, 112, 115-116 — сайленсинг у инфузорий и, 139, 147 — сайленсинг у растений и, 182-187 — сборка «молчащего» хроматина и, 112 — сперматогенез и, 376 RNAi, 269. См. также Меиотический сайленсинг неспаренной ДНК (MSUD); Посттранскрипционный сайленсинг генов; Подавление — Arabidopsis и, 162-164 — Chpl и, 109 — Drosophila и, 99 — dsRNA и siRNA и, 158-161 — НР1 локализация и, 121 — N. crassa и S. pombe и, 107 — ncRNAs и, 358-359 — PTGS у растений vs., 177 — геномные перестройки и, 139 — доказательства роли в сайленсинге, 156 — ломкой Х-хромосомы синдром и, 437 — метилирование ДНК млекопитающих и, 339-340 — модели распознавания и, 160-161 — модификация хроматина и, 113, 162-164 — общий обзор, 52-53, 153-154 — развитие многоклеточных и, 36 — рекрутирование хроматин-модифицирующих энзимов, 161-162 — сборка гетерохроматина и, 87-88, 102, 153-165 — структура хроматина и, 156-158 — у инфузорий, 130, 139, 147 Rolled, 93 roXRNAs, 48-49 Rsp, 281 RTT. См. Ретта синдрома R-делеционные элементы, 143-144 Saccharomyces cerevisiae — trans-взаимодействие у, 81-82 — trxG белки и, 236 — ацетилирование гистонов и, 80 — веб-сайты с информацией о, 466 — выпетливание теломер и, 80-81 — генетические инструменты, 72-73 — гетерохроматин, 74-78 — деацетилирование гистонов и, 78-79 — жизненный цикл, 73-74 — идентичность центромеры и, 275 — как модельный организм, 36-37 — наследование эпигенетических состояний у, 82-83 — нестабильность рДНК-повторов у, 84 — общий обзор, 71-72 — описание, 72-73 — организация генома, 54 — репрессия и, 79-80 — сайленсинг у vs. у S. pombe, 107-108 — структура и функция центромеры у, 270-271 — тайминг репликации. 266 Sad-1 (Супрессор доминирования аска) ген, 123-124, 282 SAGA, 49, 257 Sallimus (sis) ген, 242 Sas2, 80, 303-304 Sccl, 83 Schizosaccharomyces pombe — RNAi y, 112-114 — Sir2 белок и, 75 — веб-сайты с информацией о, 466 — гетерохроматин и RNAi и, 156-158 — гетерохроматиновая организация хромосому, 156-158 — идентичность центромер и, 271 — как модельный организм, 36-37 — кинетохоры и, 271 — общий обзор, 107-108 — организация генома, 54 — сайленсинг генов и, 52 — сайленсинг хроматина у, 108 — сборка «молчащего» хроматина и, 111-113 — состав центромер, 113-115 — супрессия эпигенетического мозаицизма, 62 — транскрипция центромерных повторов у, 113 — эпигенетическая наследственность центромерного состояния у, 114-115 SCID-мыши, 420 Scmx ген, 328 scnRNA модель, 52, 147 SCNT. См. Терапевтическое клонирование SDC белки, 288, 290 sea-1, 290 SEP-домены. См. S-аденозил-метионин (SAM) SET-домены — trxG белки и, 236 — модификации гистонов и, 179-180, 196,241 — развитие зародышевых клеток и, 376 — ремолелинг хроматина и, 216 — формирование плазматических клеток и, 400 Sex combs reduced (Scr), 232, 234 SEX-1,290 SFRPs, 455 SIR белки. См. Белки-регуляторы «молчащей» информации siRNAs — dicer-подобные (DCL) белки и, 184 — RITS и, 158-160 scnRNAsvs, 145 — генерация, 158-159, 161-162 — подавление и, 121 — сборка гетерохроматина и, 159 SKD белок, 242 SLC22A1L, 430 SMARCAL1, 435 SMYD3, 197 SNF2, 49, 204, 340 snoRNAs, 360, 428-429 SNURF-SNRPN, 429 Sonic hedgehog (Shh), 225 Sox2, 379-380 Splayed (SPD), 181 SPM-домены, 14. См. также S-аденозил-метионин (SAM) SRY ген. 315 Stella, 99, 372-375 Su(var) гены — Drosophila и, 90-93 — H3K9 метилирование и, 95-96 — компенсация дозы и, 309 — метки сайленсинга хроматина и, 214 — репрограммирование сперматозоидов и, 378 — сперматогенез и, 376 — эффект положения мозаичного типа, 37 SubTOBv, 260 SUPERMAN, 36, 162, 186 SUVH белки, 101, 180, 199-200 SWI/ISWI энзимы. См. Brahma-семейство SWI2/SNF2, репрессия хроматина и, 235-236, 239 Swi6, 110-112, 114, 156-161 Switch2/Sucrose Non-Fermentable2 (SWI2/SNF2) — H2AZ и, 257, 260 МеСР2 и, 433 — метилирование ДНК и, 340 — метилирование и, 49 — модификации гетерохроматина и, 163 — ремоделинг хроматина и, 181 — структура нуклеосом и, 204 SWR1-C, 259 SXL, 306-307 S-аденозил-метионин (SAM), 179, 215, 220, 445, 448 S-фаза митоза, 83, 266-267 Т. themiophila, веб-сайты с информацией о, 466 “ТА” внутренние элиминируемые сегменты (IES), 137 ta-siPHK, 185 TCRp, 393 Tetrahymena, 36, 52, 131-132. См. также Инфузории TGS. См. Транскрипционный сайленсинг генов (TGS) Tip60, 259, 305 Toll-подобные рецепторы, 51 Tonalli (Тпа) ген, 2452 tra гены, 306-307 Trans-sensing, 282 trans-эффекты, 41, 191-192, 258, 426, 431-435 Trithorax (trxG) белки — PcG белка рекрутирование и, 220 — SET-домены в, 236 — идентификация, 232-235 — как активаторы или антирепрессоры, 243 — клеточная память и, 54, 56, 211-212, 231 — метилтрансферазы гистонов и, 179 — модификации гистонов и, 242 — общий обзор, 55-57,231-236,242-244 — транскрипция и, 235-236, 243 — функциональные взаимодействия между, 242 — хроматин и, 236-242 Tsix ген, 317, 319, 321-322 Twi1 ген, 145-146, 156 U7 малый ядерный рибосомный комплекс, 250 Ube3aas, 360 Ura3, 72-73 V(D)J рекомбинация, 390, 393-394 Variable Surface antigen Genes (VSG). 16 VRN-комплекс, 180, 214-219 white ген, 71, 88-89, 98-99 Winged helix домены, 000 wm4, См. white ген Wnt путь, 455 Х-инактивации центр (XIC), 57, 317, 325, 327 Х-инактивация, 57, 223, 314, 317-322 — H2A варианты и, 259-260 — PcG репрессия и, 224 — болезни и, 434 — воспроизведение и поддержание у млекопитающих, 317-322 — идентификация у млекопитающих, 316 — импринтированная, 317-319, 321-322 — инициация у млекопитающих. 317-322 — исторические симпозиумы и, 16 — клонирование и, 417 — общий обзор, 28, 57-58, 314, 317 — определение, 287-288 — переключаемые режимы у млекопитающих, 322 — поддержание, 371 — реактивация и репрограммирование и, 328-330, 337, 375, 380 — регуляция у млекопитающих, 318-322 — случайная vs. импринтированная, 317-322 — у C. elegans, 294-299 — факультативный гетерохроматин и 57-58 Х:А отношение 290-291, 306-307 Х-реактивация, 328-330 Х-сигнальные элементы (XSEs), 290-291, 299 Х-элементы. 81 ХВР1, 399 Хее, 321 Xenopus, веб-сайты с информацией о, 478. См. также Амфибии Xist ген — геномный импринтинг и, 364 — исторические симпозиумы и, 16 — плюрипотентные эмбриональные стволовые клетки и, 380 — регуляция у млекопитающих, 322-323 — эмбриональные стволовые клетки и, 319 ХО эмбрионы, 320 XOL-1, 288, 290-291 Хр импринты, 298-299, 316 Yellow ген. 91 YKu, 76, 78, 80 Y-хромосомы, 90, 315 Y’-элементы, 81 —-— район, 119А
Автогамия, 131-133, 141-143 Автономно Реплицирующиеся Последовательности (ARS), 266 Автономный путь, 216 Адаптивная эволюция, 253 Адренолейкодистрофия, сцепленная с Х-хромосомой, 425 Активный хроматин, 46, 135-136, 254-255 Аллельное исключение, 396-398 Альтернативные перестройки, 141 Амфибии, 406, 409-410, 414-416 Ангельмана синдром, 427-430 Ангиогенез, 446 Анеуплоидия, определение, 264 Аномалии, клонирование животных и, 410-411 Аномальная хромосома 10 (Ab10), 282 Антигенная специфичность, 387 Антирепрессоры, 243 Антисайленсинг, 222-223 Антисмысловая транскрипция, 340, 395 Антител разнообразие — гены рецепторов антигенов, 389-390 — метилирование и, 51 — развитие лимфоцитов и, 392-398 — рекомбинация и, 389-390, 392-395 — соматические клетки и, 28 — эпигенетика и, 30 Апоптоз, 267, 446 Аскоспоры, 116 АТФ-hook белок D1, 101 АТФ-зависимые комплексы ремоделинга, 42, 49, 233, 237-240, 309 Аутизм, 432 Аутосомные гены, 290-293, 306-307 Аутосомные сигнальные элементы (ASEs), оценка отношения Х:А и, 290-293 Ахиазматическая сегрегация, 278-279 Ацетилирование PRC2 и, 218 — trxG белки и, 240-241 — V(D)J рекомбинация, 394 — активный хроматин и, 46 — варианты гистонов и, 135-136 — гистоны и, 28, 40 — ломкой Х-хромосомы синдром и, 436-437 — распространение комплекса SIR и, 80 — регулирование транскрипции [этой модификацией], 192-193 — репарация ДНК и, 267 — репрограммирование сперматозоидов и, 378 — транскрипциям 193-195 Ацетилтрансферазы гистонов (HATs) — компенсация дозы и, 304 — модификации гистонов и, 46 — очистка, 36 — Рубинштейна-Тайби синдром и, 432 — у инфузорий, 135-136 — экспрессия генов и, 28-29, 80, 194Б
База данных по хроматину растений, 172-175 Барра тельца — Н2А и, 248,259 — Х-инактивация и, 57, 314, 316 Беквита-Видеманна синдром, 440-442 Белки Группы Высокой Подвижности (HMG), 259 Белок 1 гетерохроматина (НР1) — H2AZ и, 258 — H3K9 метилирование и, 198-200 PcG и, 55 RNAi и, 121 — su(var) и, 37, 91-93, 101, 199, 309, 378 — сайленсинг и, 181-182, 222 — функция, 96 Белок 4, — родственный актину (Агр4), 259 Бидл и Тэйтум (Beadle, Tatum), 116 Бисульфитная модификация, 338 Бластоцисты, ES- и TC-cells, 380 Близнецы, изменчивость у, 35 Блокирующего фактора модель, Х-инактивация и, 320 Болезни. См. также конкретные болезни — внешняя среда и, 438-439 — геномный импринтинг и, 357, 427-439 — исследования болезней человека, 426-427 — клонирование и, 410-411 — метилирование и, 51, 344 — общий обзор роли эпигенетики в, 426-427 — структура хроматина в cis-конфигурации и, 435-437 — структура хроматина в trans-конфигурации и, 431-435 Большая бороздка, 340 Бромодомены, 42, 195, 239В
Важное значение эпигенетики, 34 Важный (I) сайленсер, 77-78 Вальпроевая кислота, 459 Варианты гистонов. См. также конкретные варианты — CENP-Аи, 275 Х-инактивация и, 317, 323-325 — геномный импринтинг и, 354 — общий обзор, 49-50, 247-248 — определение, 34 — репрограммирование сперматозоидов и, 377-378 — роли для, 135 — транскрипционные состояния, 204 — центромеры и, 252-254 — энзимы для, 18, 21, 48, 158 Веб-сайты, 358, 360, 465-467 Видаза [ингибитор метилирования ДНК], 459 Видообразование, MSUDh, 122-123 Вилки, репликация ДНК и, 266 Вироиды, 186 Внутренние элиминируемые сегменты segments siRNAsH, 145 — ингибирование элиминации, 143-144 — материнская наследственность и, 143 — перестройки у инфузорий, 136 — распределение гетерохроматина и, 136-137 — транскрипция и, 52 — элиминация чужеродных последовательностей, 142-143 Внутренняя клеточная масса (ICM), 318, 371-372, 379-380 Выбор, случайная Х-инактивация и, 319-321 Выпетливание, теломера, 80-81Г
Гаметические импринты, 353, 357-359 Гаметогенез, 376-377, 416 Геликазы, 100, 112, 121, 159, 164, 237, 304-305, 308 Гематопоэтическая система. См. Лимфоциты Гематопоэтические стволовые клетки (HSC), 225 Гемиметилированная ДНК, 51 Ген А, 140-141,437 Генетика, эпигенетика vs., 27, 34-35 Геномный импринтинг — ncRNAs и, 359-360 — PRC2 и, 223 — Х-хромосомы сперматозоида у С elegans, 298-299 — Ангельмана синдром и, 427-430 — Беквита-Видеманна синдром и, 428,430-431 — болезни и, 426 — веб-сайты с информацией о, 465 — исторические симпозиумы и, 18 — исторический обзор 16, 350-353 — как cis-действующая регуляторная система, 353-355, 363 — как модель эпигенетической регуляции у млекопитающих, 364-365 — как моноаллельный сайленсинг, 58 — компоненты у растений, 181 — метилирование ДНК и, 354, 360-362 — определение, 349, 369 — Прадера-Вилли синдром и, 427-430 — псевдогипопаратиреоидизм и, 428, 431 — Сильвера-Рассела синдром и, 428, 431 — утрата, 60-61, 452 — функция гена и, 356 — функция у млекопитающих, 355-357 — элементы контроля импринтов и, 357-359 — эмбрионального и неонатального роста контроль, 355 Гены рецепторов антигенов, 389-390, 392-395 Гены-супрессоры опухоли, 446-447 Гептобластома, 430 Гермафродиты, 131, 213, 287-299 Гетерогаметный пол, определение, 315 Гетерозиготность, утрата, 452 Гетерокариотическая фаза, 116, 122 Гетероталличные штаммы дрожжей, 74 Гетерохроматин. См. также «Молчащий» хроматин — H2AZ и, 257-258 — H3K9 метилирование и, 87 — RITS и RNAi и, 158-160 — RNAi и, 52-53, 153-165 — Х-инактивация и, 319, 322-325 — белки, ассоциированные с, 93-94 — в неоцентромерах человека, 252 — изменчивость у, 100-101 — исторические симпозиумы и, 17 — конститутивный, 40. 44. 57-58, 323-325 — мейотический дрейф и, 280-282 — метилирование и, 51 — «нацеливание», 99-100 — определение, 34, 40, 71 — перестройки генома и, 139-140 — перинуклеарное прикрепление, 81-82 — репрессия активности генов и, 75-77 — сборка, 77-78 — сегрегация хромосом и, 113 — спаривание и, 277-280 — типы спаривания дрожжей и, 75-77 — упаковка, 88-89 — факультативный, 40, 57-58, 323-325, 327 — центромеры дрожжей и, 109-111 — эухроматин vs., 44-46, 97, 100, 177 Гиббереллины, 216 Гипергомоцистеинемия, 435, 438 Гиперметилирование, 61, 254, 449-452 Гипермутация, 51 Гипометилирование, 60, 435, 449 Гипопаратиреоидизм, 431 Гипотеза гистонового кода — trxG белки и, 242 — ассоциированные с гетерохроматином белки и, 254 — вариации в, 101-102 — общий обзор, 19-20, 46-47, 205, 425 разнообразие рецепторов антигенов и, 394 Гистоны — CENP-A и, 272-274 — RAG2 и, 392, 395 — ацетилирование и, 28 — варианты у инфузории, 135 — веб-сайты с информацией о, 465 — исторические симпозиумы и, 17 — линкер, 260, 376 метилирование, 19-20 — обзор модификаций, 46-48 — общий обзор, 191-192 — поддерживающее метилирование и, 120-121 — разнообразие у, 247-248 структура, 49-50 — функция, 248 — хромосомная организация и, 34 — эволюция, 259-260 Гликозилазы, 178-179, 181, 188, 341, 343, 378 Голокинетические хромосомы, 252 Голоцентрические хромосомы,265, 277 Гомеологичное спаривание, 280 Гомеотические гены, 233. См. также Trithorax (trxG) белки Гомеотические трансформации, 212-213 Гомогаметичный пол, определение, 315 Гомологичная рекомбинация, 72, 355 Гомология, 139-141, 143-144 Гомоталлические штаммы дрожжей, 74 Граничные элементы, 17, 19. 80-81Д
Дарвиновская теория эволюции, 25 Двухнитевая РНК (dsRNA). См. также RNAi RNAi-опосредованный сайленсинг у растений и, 182-187 — геномный импринтинг и, 363 — образование разрывов. 267 — сайленсинг у инфузорий, 139 — синтез, 159-160 Деацетилазы гистонов (HDACs) — МеСР2 и, 432-433 — NuRD и, 343 PRC2 и, 215 — Sir2 семейство, 75-76, 79-80 — ингибиторы, 459-460 — исторические симпозиумы и, 19 — лейкемии и, 447 — модификации гистонов и, 46 — раковые заболевания и, 61, 345, 456-458 Дупликация, 120, 123-124, 220. См. также Точечная мутация, индуцированная повторамиЗ
Зависимый от гомологии сайленсинг 139 Задних Половых Гребешков (PSC) белки, 215, 219-220 Запрограммированная элиминация ДНК, 36 Зародышевые клетки. См. также Примордиальные зародышевые клетки — Х-реактивация у, 329 — механизмы, регулирующие спецификацию, 372-377 — наследование перестроек ресничек и, 140-144 — плюрипотентность и, 379-381 — развитие, 369-374 — тотипотентность и, 54 Защитные механизмы, 50, 146-148 Зебуларин, 459-460 Зигзаг-модели организации хроматина, 43 Зиготы, 370И
Избыточность, элементы сайленсера и, 78 Измененная Ядерная Пересадка (ANT), 421 Имагинальные диски, 212 Иммуноглобулины, 388, 395-398 Иммунодефицитная Центромерная Нестабильность (ICF), 336, 432, 434-435 Иммуноотторжение, 420 Иммунопреципитация, 22, 79-80. 95, 138,145, 193 Импринтинг. См. Геномный импринтинг Импринтинг хромосомный. См. Импринтинг геномный Импринтированная Х-инактивация, 317-319, 321-322 Инвазивные элементы, 53 Ингибиторы, 60-61, 459-461 Индуцированная повторами точечная мутация (RIP) — MSUD и, 122-123 RNAi и, 156 — исторические симпозиумы и, 16 — как модель, 36 — метилирование и, 50 — у Neurospora crassa, 117, 119-120, 123-124 Индуцированный антигеном рецептора сигналинг, 398 Индуцированный вирусом сайленсинг генов (VIGS), 177, 183 Индуцированный повторами сайленсинг генов (RIGS), 101 Индуцируемая активацией дезаминаза (AID), 51, 388, 398 Инсулятора модель, 362-363 Инфузории — RNAi у. 145, 147 — активный vs. «молчащий» хроматин у, 135-136 — жизненный цикл, 132 — зависимый от гомологии сайленсинг у, 139 — как модельный организм, 27, 36 — коньюгация и, 131-132 — общий обзор, 130 — патгернинг кортикальный у 133-134 — перестройки у, 138-139 — поддержание двух геномов, 131 — системы защиты генома у, 146-148 — цитоплазматическая наследственность у, 27, 132-133, 142-143 История эпигенетических исследований — генетика и развитие и, 27 — геномный импринтинг и, 350-353 — гиперметилирование и, 449-450 — ДНК соматических клеток и, 28 — Колд Спринг Харбор и, 14-19 — метилирование и, 28, 448-450 — механистическая — взаимосвязанность и, 30-31 — общий обзор, 26 — трансплантация ядер и, 406 — хроматин и, 28-30К
Канцерогены, метилирование цитозина и, 449 Кариогамия, 107, 116-118, 120, 131-132 Кариотип Drosophila, 303 Киназы — JIL1 киназа, 97-98, 102, 305 — модификации гистонов, 47 — фосфоинозитол 3-киназа-подобных киназ семейство, 255 Кинетохоры — CenH3 и, 252-253 — CENP-Аи, 273-275 — идентичность центромер и, 275 — сайленсинг и, 108-111, 113-114 — формирование и функция, 271-272 — функция, 269 — хромосомная наследственность и, 264 — центромеры дробянковых дрожжей и, 108-109 Клетки крови, PcG-репрессия и, 223 Клеточная память — Нох-гены и, 211, 231 — PcG и trxG и, 55-57 — метилирование ДНК и, 334-335, 343 — общий обзор, 211-212, 230-232 — повторяющиеся элементы и, 54 — трансплантация ядер и, 417-418 Клеточные судьбы. См. Соматическое репрограммирование Клеточный цикл, 49, 82, 221, 412 Клонирование. См. Трансплантация ядер; Репродуктивное клонирование Клоны, 35, 409, 414 417 Кнудсона (Knudson) двухударная теория, 60 Ковалентная модификация. 34, 241-242, 244 Когезины, 83, 114-115, 165, 256-257 Коллохоры, 278-279 Кольца повторов экстрахромосомной рДНК (ERC), 84 Коммитирование линий, 390-392 Компактизация, эволюция гистонов и, 259-260 Компартментализация у инфузорий. 130 Компенсация, 419. См. также Компенсация дозы Компенсация дозы — клонирование и, 417 — механизмы 58 — определение 287 — у C. elegans 288, 290-293 — у Drosophila 302-311 — у млекопитающих 288, 313-330 Комплекс компенсации дозы (DCC), 288, 290-293 Конденсация, 33, 76-77, 294, 298-300 Конденсины, их сходство с DCC, 288, 290 Конститутивный гетерохроматин, 40, 44, 57-58, 323-325 Контролирующие элементы, 14 Контрольная Точка Сборки Веретена (SAC), 269 Коньюгация, 131-132 Координация, ремоделин хроматина и, 49 Корепрессоры, 342 Короткие интерферирующие РНК (siRNA), 52, 112-114, 139 Кортикальный паттернинг, 133-134 Косупрессия, 121, 177. Си. также Посттранскриппионный сайленсинг генов Кошки, клонирование, 35 Крючки аскогенных гиф, Кукуруза, 280, 282 Курчавый лист (CLF), 180, 213, 215-216 Кэпирование, 80Л
Лейкемия, 56, 235, 413, 447-448, 459 Лизин-специфичная деметилаза (LSD1), 47, 180, 200 Лизины. См. также Метилтрансферазы лизинов гистонов (HKMTs) — ацетилирование, 194 — деметилирование, 200 — метилирование, 47, 180, 200 Лимфомагенез, 223 Лимфоциты — ICF синдром и, 434 — В-клеток дифференцировка и, 398-401 — клонирование мышей из, 412-413 — коммитирование линий в, 390-392 — плюрипотентность и, 390 — разнообразие рецепторов антигенов и, 392-398 Линкерные гистоны, 251, 260, 376 Локализация, экспрессия генов и, 20 Ломкой Х-хромосомы синдром, 426, 436-437М
МакКлинток (McClintock), Барбара, 268 МакроН2А, 259, 323, 472 Макронуклеусы — активный vs. «молчащий» хроматин и, 135-135 — деление у инфузорий, 140-144 — индукция специфических делеций у инфузорий, 140-141 — определение, 130 — перестройки у инфузорий и, 131 — «спасение» наследуемых делеций в, 142-143 — фрагментация хромосом и, 138 М-делеционные элементы, 143-144 Медицина, трансплантация ядер и, 413-414 Межгенные повторы. См. Неточные делеции Мейоз — гетерохроматин и, 280-282 — зародышевых клеток эпигенетические механизмы и, 376 — процесс, 264-265, 288, 290 — хромосомная наследственность и, 264-265 Мейотический дрейф, 277-278, 280-282 Мейотический сайленсинг неспаренной ДНК (MSUD) — RNAi и, 156 — у C. elegans, 296 — у Drosophila, 283 у Neurospora crassa, 117, 122-124, 282-283 — у мышей, 283 Меллер (Muller, H.J.), 303 Менделевская наследственность, 34-35, 133, 187 Метил-CpG-связывающиеся белки — 5-метилцитозин, 448-449 — метилирование и, 51, 178-179, 341 -342 — репарация ДНК и, 343 — репликация ДНК и, 341-342 — Ретта синдром и, 342-343, 432-434 — сводка функций, 342 — транскрипционный контроль и, 343 — функция, 334 Метилентетрагидрофолат редуктазы недостаточность, 435 Метилирование. См. также Метилирование ДНК — — В-клеток развитие и, 392-395 — MSUD и, 122-123 — PRC2 и, 218 — RIP и, 119-120 — trxG белки и, 242 — Х-инактивация и, 318, 325 — аномальное у клонированных эмбрионов, 416 — аргининов, 47, 201-202 — болезни и, 435 — в трофоэктодермальных клетках, 380 — гетерохроматиновый сайленсинг у Drosophila и, 95-96 — гипотеза гистонового кода и, 19 — исторические симпозиумы, 15-17 — история эпигенетики и, 28 — кластеры импринтированных генов и, 359-360 — контроль у Neurospora, 120-121 — модификации гетерохроматина, 163 — модификации гистонов и, 40, 47, 135 — «молчащий» хроматин и, 254 — наследуемость, 334 — неопластическая трансформация и, 60-61 — общий обзор, 50-51, 196-202 — определение, 34 — отсутствие у S. pombe и, 108 — поддержание, 118, 120, 178, 335, 361 — распределение репрессированной ДНК и, 138 — регуляторы у растений, 53, 177-178 — репарация ДНК и, 267 — репликация ДНК и, 30 — сайленсинг растений и, 53 — сайты в гистоновых «хвостах», 41 — транскрипционный контроль и, 236 — у Neurospora crassa, 117-119 — функция, 34 — эпигенетическая регуляция у Arabidopsis к, 174 Метилирование denovo, 177-178, 186-187, 335-337 Метилирование ДНК — CpG-островки и, 455-456 — N. crassa и, 107 — siRNAs и, 154 — Х-инактивация и, 325 — аллельное исключение, 396-398 — болезни и, 424-426, 430-431 — в ICM клетках, 379 — в эмбриональных стволовых клетках, 380 — веб-сайты с информацией о, 465 — внешняя среда и, 345, 438-439 — геномный импринтинг и, 354, 360-362 — ингибиторы, 459-460 — картирование, 338 — клеточная память и, 334-335 — мутации и, 343-344 — происхождение паттернов, 335-340 — развитие примордиальных зародышевых клеток и, 375 — раковые заболевания и, 446, 448-449, 452, 459 — регуляция экспрессии генов, 340-343 — репрограммирование и, 378-379 — у млекопитающих, 334 — у растений, 170 — хромосомная стабильность и, 344 Метилирование, индуцированное премейотически (MIP) 120, 156 Метилтрансфераз (МЕТ1) семейство. 178 Метилтрансферазы. См. также ДНК-метилтрансферазы (DNMTs); Метилтрансферазы лизинов гистонов (HKMTs) — de novo, 335-336 — Х-инактивация, 325 — болезни и, 435 — метилирование аргининов и, 47, 201-202 — модификации гетерохроматина и, 162-164 — модификации гистонов и, 121-122, 235, 388 — поддержание у млекопитающих, 335 — РНК и, 51-53, 177-178, 186-187 — у растений, 177-179 Метилтрансферазы аргининов белков (PRMTs) 47, 61, 201-202 Метилтрансферазы ДНК (DNMTs) — H3K9 метилирование и, 198-200 — ICF синдром и, 434 — RIP и, 119-120 — геномный импринтинг и, 361, 377 — гомология у 118 — защита CpG-островков и, 339 — ингибирование, 459 — исключение из ядра, 378-379 — метилирование и, 50 — млекопитающих, 335 — подавленней, 121-122 — полуметилированная ДНК и, 335 — развитие примордиальных зародышевых клеток и, 375 — раковые заболевания и, 61, 449, 459 — у Drosophila, 97 Метилтрансферазы лизинов гистонов (HKMTs) — В-клетки и, 398-399 — CpG метилирование и, 339 — Drosophila и, 37 Ezh2 и, 200, 224, 325, 388, 394 — MLL как, 233, 235 — SET домены и, 236 — SUVH белки и, 101 — trxG белки и, 235 — варианты гистонов инфузорий и, 135 — компенсация дозы и, 310 — метилирование ДНК у N. crassa и, 121 — модификации гистонов и, 47 — развитие примордиальных зародышевых клеток и, 373 — раковые заболевания и, 61, 388 — репарация ДНК и, 267 — РНК-полимераза II и, 198 — сайленсинг и, 95-96 — у растений, 179 — формирование гетерохроматина и, 109-110 Метилтрансферазы с перестроенными доменами (DRM), 178, 186 Методы лечения, эпигенетические, 459-461 Миелоидные клетки, 390, 459 Миелоидный диспластический синдром, 459 Микроиньекция, 408 Микрококковая нуклеаза, 89-90, 110 Микронуклеусы, 130-132, 135-138, 140-141 МикроРНК, 377 Микрочипы, 338, 451 Минус (-) тип спаривания, 108 Митоз, 264-265, 273-276 Митотическая контрольная точка. См. Контрольная точка сборки веретена (SAC) Млекопитающие — trxG белки у, 235-236 — веб-сайты с информацией о, 467 — геномный импринтинг у, 349-365 — изменения, ассоциированные с репрограммированием ядер у, 416-417 — компенсация дозы у, 288, 313-330 — организация генома, 54 — получение из терминально-дифференцированных клеток, 411-414 — процедуры пересадки ядер для, 406-409 — репрограммирование у, 369, 371 — фенотипы клонированных. 410-411 — формирование неоцентромер у, 272 Модели распознавания, RNAi и, 160-161 Модельные системы, 36-38, 170-171 Модификации, 60-61, 317. См. также Модификация гистонов; Конкретные процессы Модификация гистонов В-клетки, 398-399 — CpG-островки и, 455-456 — PcG и trxG и, 54-57, 231-232 — RAG2 и, 395 — Х-инактивация и, 296-298, 325-327 — геномный импринтинг и, 353-354, 362 — конститутивный vs. факультативный гетерохроматин, 323-325 — ломкой Х-хромосомы синдром и, 436-437 — общий обзор, 36, 46-48, 192 — репрограммирование — сперматозоидов и, 377-378 — сайленсинг у C. elegans и, 296-98 — сайленсинг у Drosophila и, 95-96 — сайленсинг у S. pombe и, 108 — сайты для, 41 — сокращение локуса и, 395-396 — сперматогенез и, 298 т — аблица, включая ссылки, 468-473 — темы в, 203-205 — транскрипционные факторы и, 388 — утрата отцовской хромосомы и, 281-282 — центромерный хроматин и, 274-275 — энзимы для модификации у растений, 178 — эпигенетическая регуляция у Arabidopsis и, 174 Мозаицизм, обусловленный эффектом положения (PEV) — Drosophila и, 27, 37 ТРЕ и, 269 — исторические симпозиумы и, 14-15 — общий обзор, 90-91, 101 — определение, 88 — супрессия, 269 — Х-инактивация и, 88 — хромосомные белки, 90-91, 97-98 «Молчащие» кассеты, типы спаривания и, 75-77 — исторические симпозиумы и, 15 Мутагенез, 173, 176, 344 Мухи-сциариды, 281 Мыши — Blimp 1 и, 372-374 — MSUD у, 283 — PcG гены у, 220 — Х-инактивация у, 317-318, 329 — веб-сайты с информацией о, 467 — геномный импринтинг и, 350-351, 356 — исследования раковых заболеваний и, 452 — как модельный организм, 37 — организация генома, 54 — получениемоноклональных из зрелых клеток, 412-413 — ранняя детерминация зародышевых клеток у, 372 — регуляция функции теломер у, 269-270 — сайленсинг у, 283 — со «шпилечными» хвостами, 350-351Н
Нанохромосомы, 138 Наследственность, 34, 82-83, 133-134, 187-188. См. также Цитоплазматическая наследственность Негенетические различия, примеры, 35 Независимая от репликации (RI) сборка нуклеосом, 250-251 Независимый от оплодотворения эндосперм (fie), 215 Нейральные стволовые клетки (NSC). 225 Нейроны, 30, 412-413, 434-435 Нейротрофный фактор из мозга (Bdnf), 343 Неклеточно-автономный сайленсинг 184 Некодирующие РНК — siRNAsH, 112 — Х-инактивация и, 317 — болезни и, 430 — геномный импринтинг и, 359-362 — гетерохроматинизация и, 53 — компенсация дозы и, 307-309 — сперматогенез и, 377 — функция, 34, 425-426 Неопластическая трансформация, 35, 60-61, 224, 452-453. См. также Раковые заболевания Неоцентромеры, 272, 276-277 Неслучайная Х-инактивация, 324, См. также Импринтированная Х-инактивация Неспаренная ДНК, 282-283 Неточные делеции, 137-138 Нокауты, 37, 124, 135, 270, 379-380 Нуклеазы, 71, 74, 89-90, 110 Нуклеосомы — CENP-A и, 274-275 — H3K36 метилирование и, 197-198 — trxG белки и, 240-241 — архей vs. эукариот, 248-250 — ацетилирование и, 194 — исторические симпозиумы и, 15 — определение, 39 — ремоделинг хроматина, 49 — структура, 40О
Облегчение транскрипции хроматина (FACT), 49, 204 Оболочки ядра, 81-82 Обонятельные нейроны, 30, 412-413 Общие миелоидные прогениторы (CMPs), 390 Овцы, клонирование, 407-408 Ограничение по калориям, 84 Однонуклеотидные полиморфизмы (SNPs), 353 Однородительская дисомия, 424, 427-428 Окно возможностей, 329 Онкогенез, 18, 60-61, 235. См. также Раковые заболевания Ооциты — IАР ретротранспозон у 377 — асимметричное распределение и, 377 — деметилазы ДНК и, 417 — млекопитающих, 369-370 — процедуры ядерных пересадок и, 406-407, 417-418 Оплодотворение, 131-132, 170, 378 Опухоли, 35, 60-61, 224, 362, 452-455. См. также Раковые заболевания Организация генома — веб-сайты с информацией, 466-467 — гетерохроматин и, 45 сравнение, 54 — эпигенетический контроль и, 62 Остановки, Х-инактивация и, 327 Острая миелоидная лейкемия, 447 Острая промиелоцитарная лейкемия. 56, 447 Осы, утрата отцовских хромосом у, 281-282 Отбор, 34, 315, 321П
Память, 20. См. также Клеточная память Парамутация, 14, 30, 35, 177, 187 Паратиреоидизм, 431 Партеногенез, 355-356, 369 Первичная неслучайная Х-инактивация, 321, 324 Перекрестное оплодотворение, 131 Перемещаемые элементы. См. также Ретротранспозоны — N. crassa и, 116 — P-элементы как, 89 RIP и, 123-124 — RNAi у растений и, 186 — геномные перестройки и, 139-140 — геномы млекопитающих и, 53-54 — исторические симпозиумы, 21, 27 — метилирование ДНК и, 50 — модификации гетерохроматина и, 164 — «нацеливание» формирования гетерохроматина и, 99-100 — неопластическая трансформация и, 59-60 — растения и, 36, 184 — ремоделинг хроматина и, 163, 364 — сайленсинг и, 53 Перестройки, 133, 138-139, 272 Перицентромерные фокусы, 56 Петунии, 153, 156, 173, 177 Пиримидиновые димеры, 267 Плазма, Blimp 1 и, 372-374 Плазматические клетки, 398-400 Плазмодесмы, 172 Пластичность, 54, 56, 59, 400-401 Плейогомеотические (РНО) белки, 220 Плече-лопаточно-лицевая миопатия, 436-437 Плюрипотентность — лимфоциты и, 390 — определение, 369 — развитие лимфоцитов и, 390 — развитие примордиальных зародышевых клеток и, 372-374 — развитие стволовых клеток и, 379-382 — репрограммирование и, 58-59, 381-382 сперматогенез и, 376 Плюрипотентные стволовые клетки, 379-382 Плюс (+) тип спаривания, 108 Повторяющиеся элементы, 54, 108-109, 111-112, 137 Подавление, 116, 121-122 Подвижные генетические элементы. См. Перемещающиеся элементы Поддержания минихромосом (МСМ) белки, 266 Поддерживающее метилирование, 120, 178, 335, 361 Подобные плейогомеотическим (PHOL) белки, 220 Полигомеотические (PH) белки, 219 Полимеразы, 186. См. также конкретные PH К-полимеразы Полиплоидия, 170, 172 Политенные хромосомы, 35 Полицентричные хромосомы, определение, 265 Половое воспроизведение, преимущества, 314-315 Половые тельца, 257 Посттранскриппионный сайленсинг генов (PTGS). См. также RNAi — Drosophila и, 99 — RNAi-опосредованный сайленсинг у растений и, 182-183 — деградация РНК и, 52 — дробянковые дрожжи и, 113 — как эквивалент RNAi у растений, 177 — общий обзор, 153 Посттрансляционные модификации — ацетилирование, деацетилирование и, 193-195 — гистоны и, 192-193 — деиминирование, 47, 202, 379-380 — метилирование и, 196-202 — темы в, 203-205 — убиквитинирование, сумоилирование и, 202-203 — фосфорилирование и, 195 Почкующиеся дрожжи. 74-77. См. также Saccharomyces cerevisiae Прадера-Вилли синдром, 427-430 Пре-BCR, 397 Превращение пола, 281-282 Пререпликационный комплекс 2 (PRC2) — Х-инактивация и, 325, 327 — геномный импринтинг и, 223 — деацетилазы гистонов (HDACs) и, 215 — развитие растений и, 217 — ремоделинг хроматина и, 218 — ретинобластомы (Rb) белки и, 224-225 Преформизм, 369, 372 Примордиальные зародышевые клетки — Blimp 1 и, 372-374, 398-400 — Х-реактивация, 329 — детерминация, 372 — плюрипотентные, 369, 374-375 — плюрипотентные клеточные линии из, 380-381 — развитие, 372-374 Прионы, 19, 21, 31, 34 Проблемы исследований, 64-65 Прогениторы Гранулярных Нейронов Мозжечка (CGNPs), 225 Прогерия, 56 Продолжительность жизни. См. Старение Происхождение распознающих комплексов (ORC), 75-76, 78, 80, 266, 269 Пролиферация, 55, 223-225 Промоторы, CpG-островки и, 339 Протоперитеции, 116 Процесс репликации ДНК — MBD1 и, 341-342 — варианты гистонов и, 49 — контроль, 266-267 — метилирование и, 30 — откладка гистонов и, 250-251 — ретротранспозоны и, 268 — у растений, 182 Псевдоаутосомный район. 317 Псевдогипопаратиреоидизм, 428, 431 Псевдокинетохоры, 282 Психические болезни, внешняя среда и, 425 Пузырьки, 266 ПЦР, 338, 459Р
Рабдомиосаркома, 430 РазвитиеВ-клеток, 390-392 PcG-репрессия и, 218-219, 223-226 история эпигенетики и, 27 метилирование ДНК и, 337-338 органа из одной клетки, 388-390 регуляция X-инактивации у млекопитающих и, 317 репрограммирование и, 417 Размеры геномов, 54 Разнообразие. См. Разнообразие антител Раковые заболевания — CpG-островков метилирования, 339 — H3K27 метилирование и, 200 — MLH1 ген и, 437, 450, 453-454 — PRC комплексы и, 57, 219-223 — trxG гены и, 223, 235 — гиперметилирование и, 61, 449-452 — деметилазы и, 200 — исторические симпозиумы и, 18 — метилирование ДНК и, 334, 344. — 448-449, 459 — метилтрансферазы и, 61, 388, 449, 459 — обзор, 60-61 — причины их, 446-447 — сайленсинг и, 452-458 — темы исследований, 458 — трансплантация ядер и, 413-414 — хроматин и, 447-448 — эпигенетические методы лечения, 459-461 Распространение гетерохроматина, 79-80, 88-89, 96-97 Распространения и отступления модель, 327 Растана модель блокирующего фактора, 320-321 Растения. См. также Arabidopsis RNAi-опосредованного сайленсинга пути, 182-187 — выгоды от использования для исследований, 170-177 — геномный импринтинг и, 350 — жизненный цикл, 172 — как модельные организмы, 36 — молекулярные компоненты хроматина у, 177-182 — не-РНК эпигенетическая регуляция, 187 — участие PRC2s в развитии, 217 — эволюция центромер у, 276 — эпигенетическая регуляция у, 170 Реверсия, 20 Регулятор гистонов A (HIRA), 275, 378 Регуляторы «Молчащей» Информации (SIR) — белки ацетилирование гистонов и, 80 — ацетилирование, деацетилирование и, 79-80, 195, 198 — гетерохроматиновая репрессия и, 75-77 — деацетилирование гистонов и, 78-79 — заякоривание гетерохроматина и, 83 — исторические симпозиумы и, 17-19 — как пример, 36 — «молчащий» хроматин и, 78 — репрессия и, 75, 77-80 — старение и, 83-84 — структура семейства, 75-76 — теломерный эффект положения (ТРЕ) и, 79 — ядерная локализация, 81-82 Рекомбинация, 72, 355, 388, 382-395 Релокализация, генов иммуноглобулинов, 395 Ремоделинг хроматина — В-клетки и, 398-399 — PRC2 и, 218 trxG — белки и, 236-240 — Xist и, 57 — АТФ-зависимые комплексы, 42, 49, 233, 237-240, 309 — белки ремоделинга хроматина у растений, 181 — болезни и, 34 — варианты гистонов и, 49-50 — исторические симпозиумы и, 29 — компенсация дозы и, 303-306 — метилирование ДНК и, 340 — неопластическая трансформация и, 59-60 — определение, 34 — перемещающиеся элементы и, 364 — разнообразие рецепторов антигенов и, 392-395 — транскрипционный контроль и, 204 — факторы ремоделинга и, 49 — эпигенетическая регуляция у Arabidopsis и, 174-175 Ремоделинга хроматина комплексы, 49-50 Репарация ДНК — Н2АХи, 255-257 — MBD4 и, 343-344 — раковые заболевания и, 446 — структура хроматина и, 267-268 Репликационного Белка А комплекс, 181 Репликация. См. Процесс репликации ДНК Репортерные гены, дрожжи и, 72-73, 75 Репрессия. См. также Polycomb репрессивные комплексы — В-клеток развитие и, 392, 399 — Вс16 и Blimp1 и, 399-400 — LSD1 и, 200 — SIR-белка концентрация и, 79-80 — trxG белки и, 243 — выпетливание теломер и, 80-81 — гетерохроматина, 75-77 — консерватизм, 374-375 — метилирование ДНК и, 340-344 — метилирование и, 199-200 — модификации гистонов и, 192 — сумоилирование и, 202-203 — типы спаривания дрожжей и, 75-77 Репрессор сайленсинга (ROS1), 178 Репрессор-активатор-белок 1 (Rapl), 77-80 Репрограммирование. См. также Трансплантация ядер в клонах, 409, 416 — общий обзор, 58-59 — от зиготы до бластоцисты, 379 — плюрипотентность и, 58-59, 375-376, 381-382 — после оплодотворения, 378 — потенциал для тотипотентности и, 412 — состояние дифференцировки донорской клетки и, 411-413 — стабильность Х-инактивации, 328-329 — стволовых клеток, 381-382 — тотипотентность и плюрипотентность, 369 — у амфибий, 414-416 — у млекопитающих, 416-417 Репродуктивное клонирование, 418-421 Рестрикционные энзимы, 338 Ресурсы и базы данных по геномам организмов, 466-467 Ретинобластомные (Rb) белки, 224-225 Ретродифференцировка, 411 Ретротранспозоны, 44. 94, 271, 385, 387 Ретта синдром, 334, 342-343, 432-434 Рецепторы ростового фактора, 235 РНК-зависимая РНК-полимераза (RDRP), 52, 123, 155, 162, 282, 295 РНК-зависимый сайленсинг у C. elegans, 283 РНК-индуцируемый сайленсирующий комплекс (RISC), 154, 183, 185 РНК-индуцируемый эффектор транскрипционного сайленсинга (RITS), 110, 112, 114, 154, 158-161, 199, 437 PHК - метилтрансферазы, 51 РНК-направляемое метилирование ДНК(RdDM), 52-53, 183, 186-187 РНК-направляемое РНК-полимеразный комплекс (RDRC), 114, 159-161 РНК-нокдаун. См. Посттранскрипционный сайленсинг РНК-полимераза, 162-163, 165, 175 РНК-полимераза II — H3K36 метилирование и, 197-198 — H3K4 метилирование и, 196-197 — HKMTs и, 198 PcG белки и, 243 — факторы, влияющие на элонгацию, 204 — центромерные повторы и, 113 РНК-полимераза IV, 53, 186-187 Родительские геномы, 338 Родительский импринтинг. См. Импринтинг Родительского конфликта теория, 181, 356 Рост, регуляция геномным импринтингом, 355 Ростовые сигналы, раковые заболевания и, 446 Рубинштейна-Тайби синдром, 432
С
Сайленсерные элементы, 75-77 Сайленсинг генов. См. Сайленсинг Сайленсинг у инфузорий и источники 154 Сайленсинг у инфузорий и теломеры и 52 Сайленсинг у инфузорий и 139 Сайленсинг. См. также Компенсация дозы; Посттранскрипционный сайленсинг; RNAi; Транскрипционный сайленсинг генов (TGS); Индуцируемый вирусом сайленсинг генов; Х-инактивация — PcG и trxG и, 55, 57, 223 — PRC1 и, 223 RNAi и, 36, 52-53, 139 — Х-инактивация как, 314 — Х-хромосом у C. elegans, 289, 296-298 — аккумуляция в Xi, 326 — белки кинетохорных доменов и, 110-111 — в центромерах дробянковых дрожжей, 108 — геномный импринтинг и, 353-365 — гетерохроматин и, 40, 88-90 — движение экспрессируемых генов и, 44 — зависимый от гомологии у инфузорий, 139 — избыточность и, 329 — исторические симпозиумы и, 17 — компенсация дозы и, 287-288 — ломкой Х-хромосомы синдром и, 436-437 — мейотический посредством неспаренной ДНК (MSUD), 122-123 — метилирование ДНК и, 340-344 — метилирование и, 51-52 — механизмы, 115-116, 177 — модификации гистонов и, 95-96 — наследование измененного — расположения ресничек у, 27, 133-134 — неклеточно-автономный, 184 — паттерны в теломерах, 80 — посредством неспаренной ДНК во время мейоза, 282-283 — раковые заболевания, 452-458 — растения и, 53 — субнуклеарная релокализапия и, 395 — температура и, 90 — транскрипция неспаренной ДНК и, 282-283 — у S. pombe, 108 — формирование субкомпартментов и, 83 — хромосомные белки и, 90-93 — центромерные внешние повторы и, 111-112 — эпигенетика и, 31 Сателлитная ДНК, ICF синдром и, 434-435 Сверхчисленные половые гребешки (ESC), 215, 296-297 Сдержек и противовесов механизм, 329 Сегрегация — CenH3 и, 252-253 — H2AZ и, 258 — ахиазматическая, 278-280 — в мейотическом процессе, 278-281 — гетерохроматиновое спаривание и, 270-281 — нормальная, 265 — результаты аномальной, 264 — у Drosophila, 279-281 — утрата гетерохроматина, 115, 156 Серотипы, 133 Сигналинг, лимфопоэз и, 400-403 Сигнатуры, модификации гистонов и, 46 Силвера-Рассела синдром, 428, 431 Синаптонемные комплексы, 277-278 Сканирования генома модель. См. scnRNA модель Сканирования транскриптома модель, 147-148 Случайная Х-инактивация, 319-321 Сниженное метилирование ДНК 1 (DDM1), 161-162, 179, 348 События мозаичной экспрессии. См. Мозаицизм, обусловленный эффектом положения Сокращение локуса, 395-396 Соленоидные модели организации хроматина, 43 Сомаклональная изменчивость, растения и, 172, 188 Соматическая гипермутация, метилирование и, 51 Соматические DMRs, геномный импринтинг и, 361 Соматические клетки, 27-28, 141-144, 405-409 Соматическое репрограммирование. См. Репрограммирование Соннеборн (Sonnebom, Т.М.), 131-132 Состояние покоя, репрограммирование и, 58-59 Сперматогенез — Н2АХ и, 257 — IAP ретротранспозон в, 378 — Х-инактивация и, 319-320 — геномный импринтинг и, 354 — гетерохроматиновые сайты спаривания и, 278-279 — гиперконденсация во время, 298 — замещение гистонов и, 260 — эпигенетическая модификация во время, 376-377 Специфичных для мужского пола летальных (MSL) генов комплекс, 303-309 Спиротрихи, 138 Споруляция, 74 Старение, 56, 83-84, 362, 438 Стволовые клетки, 54-55, 225-226, 379-382. См. также Эмбриональные стволовые клетки « Стебель-петля»-связывающийся белок (SLBP), 250 Стихотрихи, 137 Структурная наследственность. 133-134 Субероиланилид-гидроксамовая кислота (SAHA), 460 Субтрактивные методы, 451 Судьбы. См. Соматическое репрограммирование Сумоилирование, 192, 202-203, 354 Сумчатые, 51, 276, 316-318, 328, 355-356 Супрессорные гены, раковые заболевания и, 449-450 Сцепленная с Х-хромосомой адренолейкодистрофия, 425 Сцепленная с Х-хромосомой задержка умственного развития, 434 Сцепленные с Х-хромосомой гены, возможные способы уравнивания для, 316-317. См. также Компенсация дозыТ
Талассемии, 421, 432, 434-436 Теломера-ассоциированные последовательности (TAS), 99, 112, 268 Теломеразы, 78, 268 Теломерный эффект положения, 72, 93, 269 Теломеры — Drosophila и, 99 — siRNAs и, 53 — trans-взаимодействие, 81-82 — выпетливание, 80-81 — исторические симпозиумы и, 17 — контроль структуры и функции, 268-269 — репрессия и, 82 — сборка, 78 — функция, 44 — хромосомная наследственность и, 266 Температура, сайленсинг и, 90 Терапевтическое клонирование, 418-421 Терапия с использованием трансплантации ядер, 418-421 Терминальный цветок 2 (TFL2), 182 Тесты с иммунопреципитацией хроматина (ChIP), 17, 20, 48, 193, 197, 199, 201 Типы спаривания (МАТ). См. также Коньюгация — N. crassa, 116 — RNAi и, 158 — S. pombe и, 108 — инфузории, 133, 143 — переключение, 36, 74-75 — эпигенетический контроль репрессии, 75-77 Титин, 242 Т-клеток развитие, 388 Токсины, Caedibacter, 133 Токсины, P. aurelia, 133 Толстой кишки рак, 451, 453-455 Тотипотентность, 54, 369, 412 Точные делеции, 137 Транзитивность, 184 Транс-активные siPHK (ta-siRNAs), 186 Трансгеном индуцируемый сайленсинг, 139-140 Трансдетерминация. 212 Транскрипционная интерференция, 364 Транскрипционная память. См. Клеточная память Транскрипционного фактора (TF) размещение, 46 Транскрипционные факторы — Rapl, 77-80 — SWI/SNF-комплексы как, 239-240 — trithorax (trxG) белки как, 243 — trxG белки как, 243 — варианты гистонов у инфузорий, 135 — интерференция метилирования ДНК с, 340-341 — лимфопоэз и, 389, 390-392 — модификации гистонов и, 192 — роль в эпигенетическом контроле. 390-392 Транскрипционный контроль, 257-258, 343 Транскрипционный сайленсинг генов (TGS). См. также ДНК и метилирование гистонов — Alcohol dehydrogenase (Adh) трансгены и, 99 — PcG-комплексы и, 219-223 RNAi и, 112 — RNAi-опосредованный сайленсинг у растений и, 182-183 — Х-инактивация, 323-324 — гетерохроматин и, 52 — общий обзор, 153-154 Транскрипция — Вс16 и Blimp 1 и, 398 — PRC1 и, 219 — SWI/SNF-комплексы и, 236-239 — trithorax (trxG) белки и, 242 — trxG белки и, 235-236 — аберрантная активация, 224-225 — ацетилирование и деацетилирование и, 193-195 — внутренний элиминируемый сегмент (IES) и, 53 — выравнивание генных продуктов и, 302, 305-306 — зависимая от метилирования репрессия, 343 — изменения в структуре хроматина и, 204-205 — изменения у с репрограммированием, 414-417 — метилирование ДНК и, 340 — механизм, 302 — модификации гистонов и, 40 — регуляция гистонами и ацетилированием, 193-195 — сайленсинг и, 52-53 — эухроматин и, 45 Транслокации, 327-328, 350-351, 447 Трансплантация ядер — геномный импринтинг и, 352 — изменения, ассоциированные с, 414-417 — медицинские следствия, 418-421 — процедуры для, 406-409 — раковые заболевания и, 413-414 — соматическое репрограммирование и, 58-59 — фенотипы клонированных животных и, 409-414 — эпигенетическая память и, 417-418 Трансформирующая ДНК, 121 -122 Трихлоростатин A (TSA), 113, 115, 121, 325, 328-329 Трихогины, 116 тРНК, 109 Трофобласта защиты теория. 356 Трофэктодермы (ТЕ) слои, 371-372, 379-380 Т-хелперные клетки, 338, 343 Тэйтум и Бидл (Tatum, Beadle), 116У
Убиквигин ЕЗ лигаза (UBE3A), 429, 454 Убиквитинирование — Х-инактивация и, 324-325, 328 — общий обзор, 192, 202-203 — репарация ДНК, 267, 446 — сайты в гистоновых «хвостах», 41 Уилмса опухоли, 430. См. также Прадера-Вилли синдром Упаковка, 248 Урацил-ДНК-гликозилазы, 343 Уремия, 438 Утрата гетерозиготности, 452 Утрата импринтинга (LOI), 60, 452 Утрата октамера, 204Ф
Фактора Сборки Хроматина (CAF) комплекс, 83, 181, 250-251, 275, 378 Фактор-A специфичности расщепления-полиаденилирования (CPSF-A), 162 Факторы связывания, защита CpG-островков и, 339 Факультативный гетерохроматин, 40, 57-58, 323-325, 327 Фибробласты, 407, 411 Фолат, 435, 438 Фосфатазы (РРТазы), 42, 97 Фосфоинозитол 3-киназа-подобных киназ семейство, 255 Фосфорилирование, 40, 195-196, 255-257 Фотопериода путь, 216 Фотопериод-независимое раннее цветение (PIE), 181 Фрагментация. См. Фрагментация хромосом Фрагментация хромосом, 138X
Хиазматическая сегрегация, 278 Химеры, растения и, 172 «Храповик Меллера», 315 Хроматин. См. также «Молчащий» хроматин — ICF синдром и, 434-435 — PcG и trxG и, 55-57 — Т-клеточные рецепторы (TCR) и 388 — trxG белки и, 236-242 — Х-инактивация и, 322-325 — Xist ген и, 322 — АТФ-зависимые комплексы ремоделинга и, 235 — болезни и, 426 в центромерах, 272-275 — веб-сайты с информацией о, 465 — влияние RNAi на структуру, 158-165 — влияние структуры на транскрипцию, 204-205 — ДНК vs., 40 — изменения при репрограммировании, 415 — история эпигенетики и, 14, 18, 34 — как матрица, 39-40 — клеточная память и, 63-65 — ломкой Х-хромосомы синдром и, 426, 436-437 — метилирование ДНК и, 339-340 — модификации гистонов, 49-50, 192 — молекулярные компоненты у растений, 177-182 — недостаточность по метилентетра-гидрофолатредуктазе и, 435 — общий обзор, 34, 38, 192 определение, 191 — организация, 39-44 плече-лопаточно-лицевая миопатия, 437 — раковые заболевания и, 447-448 — Ретта синдром и, 432-434 — Рубинштейна-Тайби синдром и, 432 — талассемии и, 435-436 функция, 34 — Шимке спондилоэпифизарная дисплазия и, 435 — эпимутации и, 437 — эухроматин vs. гетерохроматин и, 44-46 Хроматоидные тельца, 377 Хромодомены — H2AZ и, 258 — H3K36 метилирование и, 197-198 — ORF «нацеливание» и, 195 — PcG и trxG и, 55, 218, 220 — компенсация дозы и, 304-305 Хромометилазы, 178 Хромосомных разрывов последовательности (CBS), 137-138 Хромосомы. См. также Сегрегация аномальная, 264 — изменения при репрограммировании, 415 — метилирование, 51 — метилирование ДНК, 343-344 — механизм наследования, 264-266 — «нацеливание» компенсации дозы», 307-309 — обзор организации, 35 организация, 314 — перестройки, 272 — полиплоидия и, 170 — политения, 35 — последовательности вздутий, 282 — разрывы хромосом и болезни, 434-435 — распределение trxG белков, 239 — родительская утрата, 281-282 — родительское происхождение и, 16 — стабильность, 344 — фрагментация у инфузории, 138-139 — эволюция Y-хромосомы, 315 — элементы, необходимые для наследования, 264-266Ц
Цветение, яровизация и, 216-217 Центромерные внешние повторы, сайленсинг и, 111-112 Центромеры H3-варианты и, 252-254 — ахиазматическая сегрегация и, 278-280 — регуляция идентичности, 276 — состав у дробянковых дрожжей, 113-115 — структура, функция и воспроизведение. 275-276 — функция, 44 — хроматина состав в, 272-275 — хромосомная наследственность, 265 — эволюция, 276-277 — эукариотная структура и функция, 270-271 Цикл «разрыв-слияние-мостик», 268 Цитозин — дезаминирование, 51, 388, 398 — метилирование и, 51, 177-178, 334-335 — раковые заболевания и, 448-449, 459 — Цитоплазматическая наследственность — scnRNA модель и, 147 — менделевская наследственность vs., 133 — перестройки ресничек, 142-143 — серотипов, 133 — сканирования транскриптома модель и, 147-148 — следствия, 144 — у инфузорий, 132-133, 142-143 Цитоплазматические мостики. См. Плазмадесмы Цитруллин, 202Ч
Человеческие искусственные хромосомы (HACs), 271 Членистоногие, геномный импринтинг и, 350 Чужеродные последовательности, элиминация, 142-143Ш
Шапероны, 83, 378 Шимке спондилоэпифизарная дисплазия и, 432, 435 «Шму» (Schmoos) [форма клеток у дрожжей], 73 «Шпилечная» РНК, 159Э
Эволюционно консервативные хромосомные сегменты (ECCS). 254. См. также Адаптивная эволюция Экспрессия — PcG-гена сверхэкспрессия и, 224 — ацетилтрансферазы гистонов (HATs) и, 29 — в В-клетках и плазматических клетках, 400-401 — геномный импринтинг и, 349-350 — импринтированных генов, 223-224 — клонирование и, 417 — контроль в лимфоцитах, 392 — локализация и, 20 — программы развития и, 377-379 — регуляция метилированием ДНК, 340-343 — регуляция Х-хромосом, 290 — эмбриональной эктодермы (Eed), 223 Экстраклеточный сигналинг, 390 Эксцизии. См. Внутренние элиминируемые сегменты Элементы контроля импринтов, 357-359 Элементы повторов, 81 Элонгация, PcG-сайленсинг и, 58 Эмбриогенез, 58, 322 Эмбриональные зародышевые клетки, плюрипотентные, 369 Эмбриональные стволовые клетки генерирование, 379-380 — использование в терапии, 418, 420 — метилирование de novo и, 335 — от ядерных пересадок (NT-ES), 418-421 — плюрипотентные, 369, 376, 379-382 — соматическое репрограммирование и, 58-59 — терапевтическое клонирование и, 418-421 Эмбриональный Цветок (EMF), 180, 216 Эмбрионы, 355-356, 406-407, 418 Эндонуклеазы, переключение типа спаривания и, 74-75 Энзимы, 18, 21, 29, 40, 46-48. См. также конкретные энзимы Энхансеры — zeste (E(Z)) семейство, 96, 179-180, 214, 224, 296-297 — аллельное исключение, 397 — мозаичности (E(var)), 90-92 — сайленсинг у C. elegans и, 296-297 Эпиаллели, 36, 177 Эпигенез, 369, 372 Эпигенетика, определение, 13, 27, 34, 38-39 Эпигенетическая память. См. Клеточная память Эпигенетические импринты, определение, 298, 299 Эпигенетические методы терапии, для раковых заболеваний, 459-461 Эпигенетические состояния, определение, 38 Эпигенетический код, 38 Эпигенетический контроль, 62-64, 75-77 Эпигенетический ландшафт, развитие, 39 Эпигеномы, определение, 424 Эпимутации, болезни человека и, 437 Эписостояния, TSA-индуцированный сайленсинг и, 113 Эпифенотипы, 35 Эритроидные клетки, CMPs и, 390 Эссенциальный (Е) сайленсер, 77-78 Эстрогенный сигналинг, метилирование аргининов и, 201 Эухроматин — H3K27 метилирование и, 200 — H3K4 метилирование и, 196-197 — H3K9 метилирование и, 198-200 — гетерохроматин vs., 44-46, 97, 100, 177 — «молчащий» хроматин и, 57 — определение, 34, 40, 71Я
Ядерная организация, общий обзор, 20-21 Ядерная эквивалентность, 405 Ядерный диморфизм, 36, 131, 135-136 Ядрышковое доминирование, 177 Яйцеклетки, 377, 407, 417-418 Яровизация (VRN), 180, 188, 214, 216-217Брно-номенклатура для модификаций гистонов
 a Использование строчных букв для обозначения модификаций помогает отличать их как от аминокислот (идентифицируемых по их однобуквенным кодовым обозначениям), так и от гистонов (таких, например, как Н2А), для которых всегда используются прописные буквы.
b Номенклатурное обозначение начинается (слева направо) с гистона, затем пишется остаток, затем — модификация. В тех случаях, где модифицированный остаток не известен или не важен, модификация должна следовать за гистоном, например: Н4ас и Н2Ваг1. Множественные модификации можно обозначать, просто расширяя список (например, H3K4me 3K9ac S10ph ...) по мере необходимости. Поскольку каждый отдельный модифицированный остаток начинается с прописной буквы, обозначающей аминокислоту, и поскольку сами модификации все обозначаются строчными буквами, нет необходимости в использовании запятых или точек, чтобы разделять отдельные модифицированные остатки в «слове», обозначающем комбинацию остатков; в этом случае остаток следует вставлять без добавлений (например, H3K9S10ph, чтобы указать H3, не модифицированный по Lys-9 и фосфорилированный по Ser-10).
c Полиубиквитилированные гистоны обозначаются ubn.
d В настоящее время гипотетично.
С изменениями и с любезного разрешения из: Turner В.М., Nat. Struct. Mol. Biol. 12: 110-112. (2005).
a Использование строчных букв для обозначения модификаций помогает отличать их как от аминокислот (идентифицируемых по их однобуквенным кодовым обозначениям), так и от гистонов (таких, например, как Н2А), для которых всегда используются прописные буквы.
b Номенклатурное обозначение начинается (слева направо) с гистона, затем пишется остаток, затем — модификация. В тех случаях, где модифицированный остаток не известен или не важен, модификация должна следовать за гистоном, например: Н4ас и Н2Ваг1. Множественные модификации можно обозначать, просто расширяя список (например, H3K4me 3K9ac S10ph ...) по мере необходимости. Поскольку каждый отдельный модифицированный остаток начинается с прописной буквы, обозначающей аминокислоту, и поскольку сами модификации все обозначаются строчными буквами, нет необходимости в использовании запятых или точек, чтобы разделять отдельные модифицированные остатки в «слове», обозначающем комбинацию остатков; в этом случае остаток следует вставлять без добавлений (например, H3K9S10ph, чтобы указать H3, не модифицированный по Lys-9 и фосфорилированный по Ser-10).
c Полиубиквитилированные гистоны обозначаются ubn.
d В настоящее время гипотетично.
С изменениями и с любезного разрешения из: Turner В.М., Nat. Struct. Mol. Biol. 12: 110-112. (2005).
Эпигенетические механизмы, действующие у разных модельных организмов
 Сокращение: (Hs) — Homo sapiens.
a Эпигенетическая особенность считается имеющейся на основе гомологии последовательностей, но не функциональных данных.
б Имеются данные, что метилирование H3K9 обнаруживается в районах активного хроматина; однако функциональное значение этого не известно.
в Триметилирование H4K20 у S. cerevisiae отсутствует, тогда как у многоклеточных организмов имеются все три состояния метилирования H4K20.
г У Drosophila уровни метилирования ДНК очень низкие.
д Мутантный Dnmt2.
е Dnmt2 (Рр) и MBD-доменные белки (Се, Cb, Рр).
ж Dnmt2 и MBD-доменные белки (Dm).
з Хромосомный или геномный, а не ген-специфичный.
Сокращение: (Hs) — Homo sapiens.
a Эпигенетическая особенность считается имеющейся на основе гомологии последовательностей, но не функциональных данных.
б Имеются данные, что метилирование H3K9 обнаруживается в районах активного хроматина; однако функциональное значение этого не известно.
в Триметилирование H4K20 у S. cerevisiae отсутствует, тогда как у многоклеточных организмов имеются все три состояния метилирования H4K20.
г У Drosophila уровни метилирования ДНК очень низкие.
д Мутантный Dnmt2.
е Dnmt2 (Рр) и MBD-доменные белки (Се, Cb, Рр).
ж Dnmt2 и MBD-доменные белки (Dm).
з Хромосомный или геномный, а не ген-специфичный.

Последние комментарии
2 часов 39 минут назад
6 часов 47 минут назад
7 часов 4 минут назад
7 часов 25 минут назад
10 часов 7 минут назад
17 часов 30 минут назад